Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 3, стр. 188-196
Образование нейтрофильных внеклеточных ловушек в цельной крови под действием липопротеинов низкой плотности, модифицированных в условиях, моделирующих галогенирующий и карбонильный стресс
Л. Ю. Басырева a, Е. В. Михальчик a, А. К. Тихазе b, С. А. Гусев a, В. З. Ланкин b, О. М. Панасенко a, *
a Федеральный научно-клинический центр физико-химической медицины
Федерального медико-биологического агентства
119435 Москва, Россия
b Национальный медицинский исследовательский центр кардиологии Минздрава РФ
121552 Москва, Россия
* E-mail: o-panas@mail.ru
Поступила в редакцию 11.04.2019
После доработки 06.07.2019
Принята к публикации 07.07.2019
Аннотация
Исследовано влияние модифицированных под действием активных форм галогенов (HOCl, HOBr) или активных форм карбонилов (глиоксаль, метилглиоксаль) липопротеинов низкой плотности (ЛНП) крови человека на нетоз. Показано, что 2-х часовая инкубация крови с ЛНП, модифицированными активными формами галогенов, вызывала зарегистрированный в мазках крови достоверный прирост количества нейтрофильных внеклеточных ловушек (НВЛ), свидетельствуя об индукции нетоза. ЛНП, модифицированные карбонильными соединениями (глиоксалем или метилглиоксалем), в аналогичных условиях нетоз не вызывали. Анализ мазков крови показал, что количество нейтрофилов, а также их морфология не изменялись после инкубации крови с нативными ЛНП, а также с ЛНП, модифицированными указанными выше соединениями. Добавление в кровь ЛНП, модифицированных как под действием активных форм галогенов, так и карбонилов, не приводило к достоверному усилению хемилюминесценции в присутствии люминола. Если на фоне действия модифицированных ЛНП в инкубационную среду добавляли форбол-12-миристат-13-ацетат, то в ответ на него хемилюминесцентный сигнал увеличивался, но это увеличение достоверно не отличалось от контроля (на фоне нативных ЛНП). При менее продолжительной инкубации (инкубация ЛНП с кровью в течение 30 мин) ни нативные, ни модифицированные ЛНП нетоз не вызывали. Таким образом, нетоз, индуцированный под действием ЛНП, модифицированных активными формами галогенов, по всей видимости, является медленным, кислороднезависимым, не сопровождающимся гибелью нейтрофилов процессом. Увеличение НВЛ в крови в результате развития галогенирующего стресса повышает вероятность образования микротромбов и нарушения микроциркуляции.
ВВЕДЕНИЕ
Около 15 лет назад был описан новый механизм бактерицидного действия нейтрофилов, получивший название нетоз и заключающийся в том, что нейтрофилы после активации выбрасывают во внеклеточное пространство сетеподобные структуры на основе ДНК, в которые встроены гистоны, а также белки гранулярного аппарата нейтрофилов: миелопероксидаза (МПО), эластаза, лактоферрин и др. [1]. Эти структуры получили название “нейтрофильные внеклеточные ловушки” (НВЛ). Первоначально их образование связывали с внеклеточной гибелью патогенов, т.е. с антимикробной защитой организма. Однако последующие исследования выявили их провоспалительный потенциал и причастность к развитию целого ряда воспалительных заболеваний, таких как сепсис, васкулит, туберкулез и др. [2].
Липопротеины низкой плотности (ЛНП) плазмы крови человека, подвергнутые модификации в результате развития окислительного [3], карбонильного [4], галогенирующего [5] стресса, являются независимым фактором риска различных острых и хронических воспалительных заболеваний, в частности атеросклероза и сахарного диабета [6]. При развитии атеросклероза помимо поражения стенок магистральных сосудов развиваются патологические процессы с нарушением микроциркуляции [7]. Очевидно, что подобные события могут запускать образование локальных дефектов в различных органах и тканях, однако механизмы, благодаря которым модифицированные ЛНП вовлечены в повреждение микрососудов, поняты далеко не полностью [8, 9]. Если нетоз развивается в сосудистом русле и НВЛ оказываются в крови, то они могут повреждать эндотелий сосудов, захватывать тромбоциты, тем самым служить основой для формирования тромбов и блокировать кровоток в микрососудах [10–13].
Недавно было показано, что модифицированные в условиях моделирования окислительного стресса ЛНП (окЛНП) не только активируют нейтрофилы, что проявляется в усилении клетками продукции активных форм кислорода, их дегрануляции, но и стимулируют нетоз. Ингибитор МПО, гидразид 4-аминобензойной кислоты, снижал дегрануляцию и высвобождение НВЛ нейтрофилами, активированными под действием окЛНП. Это значит, что МПО выполняет роль важного медиатора при окЛНП-индуцированном нетозе [14].
Бактерицидная роль МПО обусловлена способностью этого фермента катализировать образование активных форм галогенов (HOCl, HOBr и др.), которые, будучи высоко реакционными соединениями, убивают патогены (бактерии, вирусы, грибы) [15]. В то же время действие этих низкомолекулярных соединений неспецифично. При чрезмерной их продукции нейтрофилами они могут повреждать биологически важные молекулы организма-хозяина (нуклеиновые кислоты, белки, липиды, антиоксиданты и др.), вызывая галогенирующий стресс [5, 16]. При этом модификации подвергаются и ЛНП. Ранее мы показали, что МПО сайт-специфично связывается с ЛНП и, продолжая функционировать, повреждает их поверхность посредством образования активных форм галогенов. Модифицированные таким образом ЛНП активируют нейтрофилы, вызывая кислородный взрыв (продукцию активных форм кислорода) и дегрануляцию, что способствует дополнительному высвобождению из клеток МПО, усугубляет развитие галогенирующего стресса и замыкает порочный круг МПО-индуцированной модификации ЛНП [17–19].
Известно, что ряд заболеваний сопровождается накоплением в крови карбонильных соединений, способных модифицировать функциональные группы биологически важных молекул, в результате чего развивается карбонильный стресс [4]. Так, при автоокислении глюкозы у больных сахарным диабетом накапливаются такие альдегиды, как глиоксаль, метилглиоксаль, 3-дезоксиглюкозон. Реагируя с аминогруппами белка, они образуют внутри и межмолекулярные сшивки типа оснований Шиффа. Модифицированные такими карбонильными соединениями ЛНП эффективно поглощаются моноцитами-макрофагами, способствуя накоплению внутриклеточного холестерина, развитию атеросклероза [4], что может приводить к нарушению микроциркуляции.
До сих пор в научной литературе отсутствуют сведения о том, способны ли ЛНП, модифицированные в условиях галогенирующего или карбонильного стресса, влиять на нетоз аналогично тому, как это наблюдали ранее для окЛНП [14]. В настоящей работе мы исследовали влияние ЛНП, модифицированных активными формами галогенов (HOCl и HOBr) и карбонильными соединениями (глиоксалем и метилглиоксалем), на образование НВЛ. Поскольку функциональная активность изолированных нейтрофилов существенно отличается от их активности в цельной крови [20], мы проводили исследование нетоза в крови.
МАТЕРИАЛЫ И МЕТОДЫ
Все соли, используемые в работе для приготовления буферных растворов, а также гипохлорит натрия (NaOCl), глиоксаль, метилглиоксаль, форбол-12-миристат-13-ацетат (ФMA), люминол (5-амино-2,3-дигидро-1,4-фталазиндион), NaBr, EDTA, среда Кребса–Рингера были получены от фирмы Sigma-Aldrich (США). В работе использовали красители эозин-метиленовый синий по Май-Грюнвальду и азур-эозин по Романовскому фирмы ЭКОлаб (Россия).
Концентрацию NaOCl определяли по поглощению OClˉ при 290 нм и рН 12, считая молярный коэффициент поглощения ε290 = 350 М–1 см–1 [21]. Гипобромит натрия (NaOBr) получали путем смешивания равных объемов 1 мМ водных растворов NaOCl и NaBr в течение 1 мин [22]. Принимая во внимание, что рК HOCl и HOBr составляет соответственно около 7.5 [21] и 8.7 [23] и при физиологических значениях рН часть кислот находится в молекулярной форме, а остальная часть – в виде аниона, далее под HOCl и HOBr мы будем понимать смеси HOCl/OClˉ и HOBr/OBrˉ, присутствующие в исследуемой среде.
ЛНП выделяли из плазмы донорской крови методом препаративного ультрацентрифугирования в градиенте плотности растворов NaBr [24]. Выделенные ЛНП диализовали против 10 мМ фосфатного буфера, содержащего 145 мМ NaCl (pH 7.4), в течение 15 ч при 4°С, сразу подвергали модификации и использовали в эксперименте.
Галогенирующий стресс моделировали путем инкубации ЛНП в присутствии HOCl или HOBr так, чтобы на одну частицу ЛНП приходилось 400 молекул окислителя. Для этого смешивали равные объемы 1.6 мМ HOCl (или HOBr) и 2 мг/мл ЛНП, что составляет ~4 мкМ по белку из расчета, что на одну частицу ЛНП приходится одна молекула аполипопротеина В-100 с молекулярной массой 512 кДа. Инкубацию проводили при 37°С в течение 30 мин в 10 мМ фосфатном буфере, содержащем 145 мМ NaCl (рН 7.4).
Карбонильный стресс моделировали, инкубируя ЛНП в присутствии природных дикарбонилов: глиоксаля или метилглиоксаля. Для этого ЛНП инкубировали в PBS, рН 7.4 (из расчета 1 мкмоль дикарбонила на 100 мкг белка ЛНП) в течение 3 ч при 37°С. После завершения карбонильной модификации ЛНП диализовали против 2000 объемов того же буфера (PBS, рН 7.4) при 4°С в течение 18 ч. Концентрацию белка в ЛНП определяли по методу Лоури.
Образование НВЛ регистрировали в мазках цельной донорской крови, полученной в клинике ФНКЦ ФХМ ФМБА России в соответствии с требованиями этического комитета. Капиллярная кровь (из пальца) разводилась 3% водным раствором EDTA в соотношении 4 : 1 (по объему), 20 мкл такой крови для изготовления мазков и 20 мкл для анализа в камере Горяева помещали в пробирку (объемом 500 мкл), закрепляли в программируемом ротаторе-миксере Multi Bio Rs-24 (Biosan, Латвия) для предотвращения оседания клеток. Ротатор-миксер осуществлял возвратно-поступательные движения на угол 90° за 5 с с паузой между движениями 5 с. Инкубацию проводили при температуре 37°С. Через 1 ч после начала инкубации в каждый образец добавляли по 5 мкл модифицированных ЛНП. Конечная концентрация ЛНП в образцах составляла 200 мкг/мл (по белку). В контрольные образцы добавляли либо 5 мкл нативных ЛНП с конечной концентрацией 200 мкг/мл (по белку), либо 5 мкл 10 мМ фосфатного буфера, содержащего 145 мМ NaCl (рН 7.4). Сразу после взятия крови, а также через 30 мин и 2 ч после начала инкубации в образцах определяли количество лейкоцитов в камере Горяева. Затем изготавливали стандартизированные мазки крови, фиксировали их по Май-Грюнвальду, окрашивали азур-эозином по Романовскому и на микроскопе Motic B3 (Motic, Hong Kong) проводили подсчет количества лейкоцитов и НВЛ [25]. Количественный анализ содержания НВЛ в 1 мкл крови проводился следующим образом. В средней части мазков крови подсчитывали общее число лейкоцитов и НВЛ. Зная количество лейкоцитов в 1 мкл крови, определенное в камере Горяева, рассчитывали количество НВЛ в 1 мкл крови.
Активацию нейтрофилов в цельной крови оценивали методом хемилюминесценции, как описано ранее [25]. Образцы крови для этих измерений готовили, как указано выше. В кровь добавляли нативные или модифицированные ЛНП (200 мкг/мл по белку), инкубировали 10–30 мин, разбавляли в 25 раз раствором Кребса–Рингера и вносили в кювету хемилюминометра (Lum-1200, ООО “ДИСофт”, Россия), содержащую люминол (200 мкМ). Измерение проводили в кинетическом режиме при 37°С и постоянном перемешивании в течение 10 мин, после этого добавляли ФМА до конечной концентрации 100 нМ, регистрируя интенсивность максимального сигнала хемилюминесценции в вольтах (В).
Статистическую обработку результатов проводили с использованием пакета программ STATISTICA 6.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Классический процесс формирования НВЛ (“суицидальный” нетоз), запускаемый бактериями, грибами или прямым действием ФМА на протеинкиназу С, является активным кислород-зависимым процессом, который развивается в течение нескольких часов и запускается при активации NADPH-оксидазы, что вызывает генерирование активных форм кислорода [26]. Ранее нами было показано, что если в эксперименте ex vivo цельная кровь инкубируется с ФМА (100 нM), то в течение 2–3 ч появляются морфологические признаки активации нейтрофилов, регистрируется уменьшение их количества и увеличение числа НВЛ. При этом в крови регистрируется интенсивная люминол-зависимая хемилюминесценция [25]. Описанные процессы находятся в хорошем соответствии с развитием событий при “суицидальном” нетозе [1, 26].
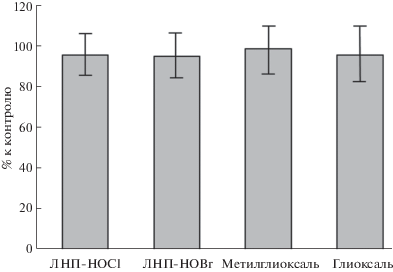
В настоящей работе мы оценили количество НВЛ, которое образуется через 2 ч после добавления модифицированных различным способом ЛНП в цельную кровь. Визуальный анализ мазков крови показал, что морфология нейтрофилов не менялась при инкубации в течение 2 ч с ЛНП, модифицированными как активными формами галогенов, так и активными формами карбонилов. Кроме того, не было замечено существенных различий в форме и размерах НВЛ до и после действия модифицированных ЛНП. В качестве примера на рис. 1 приведены типичные НВЛ до и после добавления в кровь ЛНП, модифицированных под действием HOCl (ЛНП-HOCl). В контрольных экспериментах было показано, что нативные ЛНП не вызывали прироста НВЛ в крови по сравнению с исходными значениями до инкубации с ЛНП. Результаты количественного анализа НВЛ представлены на рис. 2. Видно, что концентрация НВЛ в крови через 2 ч достоверно увеличивалась только после добавления в нее ЛНП, модифицированных под действием HOCl или HOBr (ЛНП-HOBr). Концентрация НВЛ после добавления в кровь ЛНП, модифицированных альдегидами (глиоксалем, метилглиоксалем), не изменялась. При этом, как видно из рис. 3, количество нейтрофилов в крови после инкубации со всеми типами модифицированных ЛНП достоверно не отличалось от контроля. Это говорит об отсутствии заметной гибели клеток при нетозе.
Рис. 1.
Типичные примеры НВЛ на мазках крови до (а, в) и после (б, г) ее инкубации при комнатной температуре в течение 2 ч с ЛНП, модифицированными под действием HOCl. Окраска по Романовскому. Длина маркера на фотографиях составляет 20 мкм.
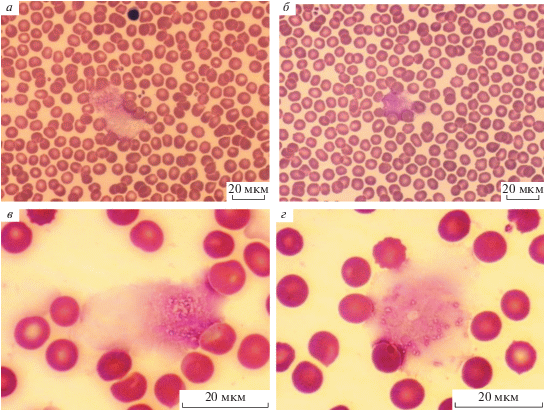
Рис. 2.
Изменение концентрации НВЛ в крови после инкубации в течение 2 ч с модифицированными ЛНП в процентах к контролю (нативные ЛНП).
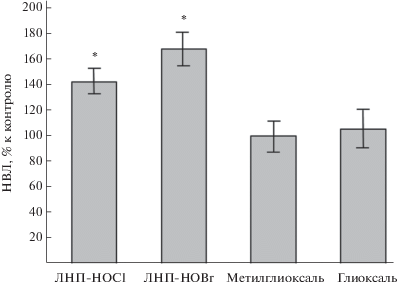
Рис. 3.
Количество нейтрофилов в крови после инкубации в течение 2 ч с модифицированными ЛНП в процентах к контролю (нативные ЛНП).
Активацию нейтрофилов в цельной крови после добавления к ней ЛНП оценивали методом хемилюминесценции в присутствии люминола. Оказалось, что добавление в кровь ЛНП, модифицированных как под действием активных форм галогенов, так и альдегидов, не приводило к достоверному усилению хемилюминесценции. Результаты экспериментов приведены в табл. 1. Если на фоне действия модифицированных ЛНП в инкубационную среду добавляли активатор (ФМА, 100 нM), то в ответ на него хемилюминесцентный сигнал увеличивался, но это увеличение достоверно не отличалось от контроля (нативные ЛНП). Полученные результаты свидетельствуют о том, что модифицированные ЛНП сами по себе не активируют NADPH-оксидазу нейтрофилов в цельной крови. Обнаружение хемилюминесцентного ответа нейтрофилов на ФМА демонстрирует нормальное функциональное состояние клеток. Отсутствие разницы в интенсивности хемилюминесценции нейтрофилов в составе крови в ответ на последующее добавление активатора говорит о том, что ЛНП, модифицированные как под действием активных форм галогенов, так и альдегидов, не обладают праймирующим действием в отношении NADPH-оксидазы нейтрофилов.
Таблица 1.
Интенсивность сигнала хемилюминесценции крови в присутствии люминола после добавления в нее нативных или модифицированных ЛНП (ХЛ1) и последующего ответа на ФМА (ХЛ2)
| ЛНП | ХЛ1, В | ХЛ2, В |
|---|---|---|
| ЛНП (контроль) | 1.7 ± 1.2 | 5.6 ± 0.4 |
| ЛНП-HOCl | 0.9 ± 0.4 | 5.6 ± 0.8 |
| ЛНП-HOBr | 1.0 ± 0.4 | 6.0 ± 2.3 |
| ЛНП + метилглиоксаль | 1.2 ± 0.5 | 4.2 ± 1.8 |
| ЛНП + глиоксаль | 1.6 ± 0.3 | 8.1 ± 1.3 |
Таким образом, по сравнению с описанным нами ранее процессом формирования НВЛ в крови при действии ФМА [25] образование НВЛ после инкубации с ЛНП, модифицированными активными формами галогенов, характеризуется отсутствием изменений морфологии и количества нейтрофилов, а также ЛНП-индуцированной люминол-зависимой хемилюминисценции. Это дает основание предполагать, что механизм образования НВЛ при действии на нейтрофилы ЛНП-HOCl или ЛНП-HOBr отличается от индуцированного ФМА “суицидального” нетоза отсутствием заметной активации нейтрофилов и их гибели.
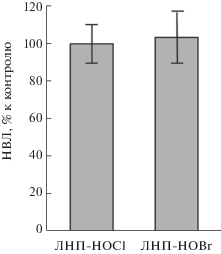
Ранее в ряде работ было показано, что в ответ на действие некоторых бактерий на нейтрофилы наблюдается особый тип образования НВЛ, получивший название “витального” нетоза. При реализации этого процесса НВЛ начинают формироваться очень быстро (уже через 5–10 мин), более того, образование НВЛ не зависит от активности NADPH-оксидазы, генерации активных форм кислорода и не заканчивается гибелью клетки [26]. Учитывая это, мы оценили изменение концентрации НВЛ через 30 мин после начала действия ЛНП, модифицированных активными формами галогенов. За это время “суицидальный” нетоз не успевает развиться, а “витальный” уже должен себя проявить. Результаты исследования приведены на рис. 4. Оказалось, что за 30 мин инкубации цельной крови с ЛНП-HOCl или ЛНП-HOBr не происходило достоверного изменения количества НВЛ в мазках. Мы также не наблюдали активации люминол-зависимой хемилюминесценции в крови в указанных условиях.
Рис. 4.
Количество НВЛ в мазках крови после инкубации в течение 30 мин с ЛНП-HOCl и ЛНП-HOBr в процентах к контролю (нативные ЛНП).
Полученные данные позволяют высказать несколько предположений. Ранее нами [27] и другими исследователями [28] отмечалось, что ЛНП-HOCl активируют изолированные из крови нейтрофилы. В частности, они усиливают как люминол-, так и люцигенин-зависимую хемилюминесценцию клеток, увеличивают продукцию ими активных форм кислорода, дегрануляцию и адгезию нейтрофилов к эндотелию. Тем не менее, функциональный ответ на различные воздействия в отношении нейтрофилов, изолированных из крови, и в составе цельной крови существенно отличается [20]. Оценка способности выделенных нейтрофилов генерировать НВЛ in vitro мало соотносится с реальными событиями в крови, поскольку при выделении нейтрофилов часть клеток теряется, удаляются белки и клетки, несущие на поверхности паттерн сиаловых кислот, тормозящий активацию нейтрофилов [20]. Все это затрудняет оценку значимости получаемых в экспериментах данных для рассмотрения вопросов, связанных с механизмами нарушения микроциркуляции. Таким образом, становится понятно, что особый интерес представляют прямые методы регистрации и расчетов количества НВЛ. Именно поэтому мы в своей работе проводили количественный анализ НВЛ на мазках крови. Достоинство этого подхода заключаются в том, что помимо прямой регистрации количества НВЛ в цельной крови он может быть легко реализован в клинических условиях. Следует отметить, однако, что в крови присутствуют клетки, различные белки и низкомолекулярные соединения, способные тушить индуцированную хемилюминесценцию. Возможно, именно по этой причине нам не удалось зарегистрировать активацию хемилюминесценции нейтрофилов в цельной крови в ответ на добавление модифицированных ЛНП (табл. 1).
Вторая причина может быть связана с гетерогенностью популяции нейтрофилов [29]. Если в образование НВЛ при действии модифицированных активными формами галогенов ЛНП вовлекается лишь небольшое количество клеток, то для статистически достоверной регистрации изменения количества нейтрофилов и хемилюминесцентного ответа на ФМА чувствительности использованных методов может оказаться недостаточно. Наконец, нельзя исключить, что при действии ЛНП, модифицированных в условиях галогенирующего стресса, развивается ранее не описанный вариант медленного кислород-независимого нетоза. Проведенное исследование показало, что появление модифицированных активными формами галогенов ЛНП в крови способно активировать нетоз. Таким образом, увеличение НВЛ в крови в результате развития галогенирующего стресса повышает вероятность образования микротромбов, что может приводить к блокированию кровотока по микрососудам и нарушению микроциркуляции.
Работа поддержана грантом РФФИ 17-04-00530.
Список литературы
Brinkmann V., Reichard U., Goosmann C., Fauler B., Uhlemann Y., Weiss D.S., Weinrauch Y., Zychlinsky A. 2004. Neutrophil extracellular traps kill bacteria. Science. 303, 1532–1535.
Короткина О.Л., Генералов И.И. 2012. Нейтрофильные внеклеточные ловушки: механизмы образования, функции. Иммунология, аллергология, инфектология. 4, 23–32.
Heinecke J.W. 2003. Oxidative stress: new approaches to diagnosis and prognosis in atherosclerosis. Am. J. Cardiol. 91 (3A), 12A–16A.
Ланкин В.З., Тихазе А.К., Капелько В.И., Шепелькова Г.С., Шумаев К.Б., Панасенко О.М., Коновалова Г.Г., Беленков Ю.Н. 2007. Механизмы окислительной модификации липопротеидов низкой плотности при окислительном и карбонильном стрессе. Биохимия. 72, 1330–1341.
Панасенко О.М., Сергиенко В.И. 2010. Галогенирующий стресс и его биомаркеры. Вестник Российской АМН. (1), 27–39.
Lankin V.Z., Tikhaze A.K. 2017. Role of oxidative stress in the genesis of atherosclerosis and diabetes mellitus: a personal look back on 50 years of research. Curr. Aging Sci. 10 (1), 18–25.
Лопухин Ю.М., Арчаков А.И., Владимиров Ю.А., Коган Э.М. 1983. Холестериноз. М.: Медицина. 352 с.
Liao L., Granger D.N. 1996. Role of mast cells in oxidized low-density lipoprotein-induced microvascular dysfunction. Am. J. Physiol. 271 (5), H1795–H1800.
Lubrano V., Balzan S. 2016. Roles of LOX-1 in microvascular dysfunction. Microvascular Research. 105, 132–140.
Handono K., Sidarta Y.O., Pradana B.A., Nugroho R.A., Hartono I.A., Kalim H., Endharti A.T. 2014. Vitamin D prevents endothelial damage induced by increased neutrophil extracellular traps formation in patients with systemic lupus erythematosus. Acta Med. Indones. 46 (3), 189–198.
Fadini G.P., Menegazzo L., Scattolini V., Gintoli M., Albiero M., Avogaro A. 2016. A perspective on NETosis in diabetes and cardiometabolic disorders. Nutr. Metab. Cardiovasc. Dis. 26 (1), 1–8.
Thålin C., Demers M., Blomgren B., Wong S.L, von Arbin M., von Heijne A., Laska A.C., Wallén H., Wagner D.D., Aspberg S. 2016. NETosis promotes cancer-associated arterial microthrombosis presenting as ischemic stroke with troponin elevation. Thromb. Res. 139, 56–64.
de Bont C.M., Boelens W.C., Pruijn G.J.M. 2019. NETosis, complement, and coagulation: a triangular relationship. Cell Mol. Immunol. 16 (1), 19–27.
Awasthi D., Nagarkoti S., Kumar A., Dubey M., Singh A.K., Pathak P., Chandra T., Barthwal M.K., Dikshit M. 2016. Oxidized LDL induced extracellular trap formation in human neutrophils via TLR-PKC-IRAK-MAPK and NADPH-oxidase activation. Free Radic. Biol. Med. 93, 190–203.
Klebanoff S.J. 2005. Myeloperoxidase: friend and foe. J. Leukoc. Biol. 77, 598–625.
Панасенко О.М., Горудко И.В., Соколов А.В. 2013. Хлорноватистая кислота как предшественник свободных радикалов в живых системах. Успехи биол. химии. 53, 195–244.
Sokolov A.V., Ageeva K.V., Cherkalina O.S., Pulina M.O., Zakharova E.T., Prozorovskii V.N., Aksenov D.V., Vasilyev V.B., Panasenko O.M. 2010. Identification and properties of complexes formed by myeloperoxidase with lipoproteins and ceruloplasmin. Chem. Phys. Lipids. 163, 347–355.
Sokolov A.V., Chekanov A.V., Kostevich V.A., Aksenov D.V., Vasilyev V.B., Panasenko O.M. 2011. Revealing binding sites for myeloperoxidase on the surface of human low density lipoproteins. Chem. Phys. Lipids. 164, 49–53.
Sokolov A.V., Kostevich V.A., Runova O.L., Gorudko I.V., Vasilyev V.B., Cherenkevich S.N., Panasenko O.M. 2014. Proatherogenic modification of LDL by surface-bound myeloperoxidase. Chem. Phys. Lipids. 180, 72–80.
Lizcano A., Secundino I., Döhrmann S., Corriden R., Rohena C., Diaz S., Ghosh P., Deng L., Nizet V., Varki A. 2017. Erythrocyte sialoglycoproteins engage Siglec-9 on neutrophils to suppress activation. Blood. 129 (23), 3100–3110.
Morris J.C. 1966. The acid ionization constant of HOCl from 5° to 35°. J. Phys. Chem. 70, 3798–3805.
Margerum D.W., Kumar K. 1987. Kinetics and mechanism of general – acid – assisted of bromide by hypochlorite and hypochlorous acid. Inorg. Chem. 26, 2706–2711.
Gazda M., Margeum D.W. 1994. Reactions of monochloramine with Br2, ${\text{Br}}_{3}^{ - }$, HOBr, and ${\text{OBr}}_{2}^{ - }$: Formation of bromochloramines. Inorg. Chem. 33, 118–123.
Lindgren F.T. 1975. Preparative ultracentrifugal laboratory procedures and suggestions for lipoprotein analysis. In: Analysis of lipids and lipoproteins. Ed. Perkins E.G. Champaign (Ill.): Amer. Oil Chemists Society, p. 204–224.
Basyreva L.Y., Brodsky I.B., Gusev A.A., Zhapparova O.N., Mikhalchik E.V., Gusev S.A., Shor D.B., Dahan S., Blank M., Shoenfeld Y. 2016. The effect of Intravenous Immunoglobulin (IVIG) on \textit{ex vivo} activation of human leukocytes. Hum. Antibodies. 24 (3-4), 39–44.
Yipp B.G., Kubes P. 2013. NETosis: How vital is it? Blood. 122 (16), 2784–2794.
Панасенко О.М., Михальчик Е.В., Горудко И.В., Григорьева Д.В., Соколов А.В., Костевич В.А., Васильев В.Б., Черенкевич С.Н. 2016. Влияние антиоксидантов и скавенджеров гипогалоидных кислот на активацию нейтрофилов липопротеинами низкой плотности, модифицированными гипохлоритом. Биофизика. 61 (3), 500–509.
Kopprasch S., Leonhardt W., Pietzsch J., Kühne H. 1998. Hypochlorite-modified low-density lipoprotein stimulates human polymorphonuclear leukocytes for enhanced production of reactive oxygen metabolites, enzyme secretion, and adhesion to endothelial cells. Atherosclerosis. 136, 315–324.
Mortaz E., Alipoor S.D., Adcock I.M., Mumby S., Koenderman L. 2018. Update on neutrophil function in severe inflammation. Front. Immunol. 9, 2171. https://doi.org/0.3389/fimmu.2018.02171
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


