Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 3, стр. 208-214
NPY-рецепторы участвуют в изменении электрической активности рабочих кардиомиоцитов правого предсердия и желудочка новорожденных крысят
Н. Г. Искаков a, А. А. Зверев a, *, Т. А. Аникина a, Е. Н. Зверева a, А. В. Крылова a, Т. Л. Зефиров a
a Казанский федеральный университет
420008 Казань, Россия
* E-mail: Alekcei5@rambler.ru
Поступила в редакцию 22.04.2019
После доработки 15.07.2019
Принята к публикации 16.07.2019
Аннотация
Исследовали влияние нейропептида Y в концентрации 10–10–10–6 М на параметры электрической активности кардиомиоцитов правого предсердия и правого желудочка крыс 7-суточного возраста. Установлено влияние нейропептида Y на длительность фазы реполяризации потенциала действия. Нейропептид Y в концентрации 10–8 и 10–7 М уменьшал длительность фазы реполяризации у 7-суточных крыс и не изменял мембранный потенциал и длительность фазы деполяризации у новорожденных крысят.
ВВЕДЕНИЕ
Нейропептид Y (NPY) представляет собой пептид из 36 аминокислот, выделенный из головного мозга свиньи, который синтезируется и высвобождается из симпатических нервов и мозгового вещества надпочечников [1–3]. NPY был идентифицирован в тканях многих видов животных [4]. Нейропептид Y является высококонсервативным пептидом: его аминокислотная последовательность не имеет видовой специфичности и на 90% идентична у разных представителей позвоночных животных.
NPY является ко-трансмиттером в симпатическом отделе вегетативной нервной системы. NPY может содержаться в пресинаптических везикулах симпатических терминалей совместно с норадреналинном и АТP. Показано, что при одновременном высвобождении с норадреналином (НА) и ATP составляющая вазоконстрикторного эффекта активации симпатических терминалей, обусловленная NPY, развивается с наибольшим латентным периодом. Сначала наблюдается краткосрочный эффект ATP, затем НА и только в конце – эффект пептида. Вследствие невозможности обратного захвата, медленной диффузии и протеолитической деградации, время жизни NPY после высвобождения из везикул гораздо больше, чем для непептидных нейромедиаторов [5, 6].
Мишенью NPY являются мембранные рецепторы, сопряженные с Gαi- и Gαq-белками. Было выявлено 5 рецепторов: у млекопитающих – это Y1, Y2, Y4, Y5, Y6, при этом Y6 нефункционален у крыс и человека. Активация Y2-рецепторов вызывает ингибирование аденилатциклазы (АЦ) и снижение внутриклеточного cAMP, а активация Y1- и Y5-рецепторов увеличивает уровень цитозольного Ca2+ посредством активации фосфолипазы С [7]. У крыс действие NPY на периферические органы-мишени реализуются преимущественно через постсинаптические Y1-, Y5-рецепторы, а также Y2-рецепторы, расположенные как на пре-, так и на постсинаптической мембране. Следовательно, Y1-, Y2- и Y5-рецепторы являются тремя основными подтипами рецепторов NPY, которые опосредуют биологические функции нейропептида у человека и крысы. Известно, что экспрессия Y1-, Y2-, Y5-рецепторов меняется в раннем постнатальном онтогенезе. Экспрессия Y1- и Y2-типа увеличивается с 20 дня постнатального онтогенеза, а 5 тип присутствует в миокарде предсердий и желудочков с момента рождения [8].
NPY участвует в различных физиологических функциях, включая регуляцию настроения, аппетита, сердечно-сосудистого и иммунного гомеостаза, ангиогенеза, ремоделирования сердца, моторики желудочно-кишечного тракта и симпатической передачи [9]. Установлено, что нейропептид Y необходим для формирования зрелого типа ионного тока Ca2+-ток L-типа в кардиомиоцитах мыши в ходе постнатального развития [10]. В сердце наиболее известным источником NPY являются постганглионарные симпатические волокна, большинство из которых происходят из нейронов, расположенных в звездчатом ганглии [8, 11].
NPY играет важную роль и в патофизиологии ряда сердечно-сосудистых заболеваний. У людей и животных повышение уровня NPY в плазме наблюдалось при нескольких стрессовых состояниях, включая физические нагрузки, гипоксию, воздействие холода, повреждение тканей и ишемию [12]. Кроме того, повышение содержания NPY в плазме крови наблюдается при патологических состояниях, сопряженных с повышением тонуса симпатического отдела вегетативной нервной системы, таких как гипертония, гипертрофия левого желудочка и сердечная недостаточность [13, 14]. Известно, что у 7-суточных крысят симпатическая иннервация сердца еще не сформирована [15], поэтому представляется интересным, изучение роли NPY в деятельности сердца в условиях незрелости симпатических регуляторных влияний на сердце. Литературные данные указывают на возможное терапевтическое использование препаратов содержащих NPY в новых методах лечения сердечно-сосудистых заболеваний.
Целью этой работы было изучение роли нейропептида Y в регуляции электрической активности миокарда правого предсердия и желудочка крыс в раннем постнатальном онтогенезе.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на 7-суточных белых беспородных лабораторных крысах от родительских животных стока Wistar из питомника лабораторных животных “Пущино” (n = 32). Данный возраст относится к неонатальному периоду развития, который характеризуется незрелостью морфо-функциональных симпатических влияний на сердце [15]. В качестве наркоза использовали 25% раствор уретана из расчета 1.2 г/кг массы животного, который вводился внутрибрюшинно [16], вскрывали грудную клетку, сердце быстро извлекали и помещали в чашку Петри с оксигенизированным раствором Тироде. Сердца препарировали и изготавливали многоклеточный препарат с ушком правого предсердия, поперечным гребешком и фрагментами верхней и нижней полой вен. В другой серии экспериментов использовали препарат правого желудочка, который состоял только из миокарда правого желудочка. Препарат помещали в камеру, куда подавался термостатируемый раствор (37 ± 1°С): 129 ммоль/л NaCl, 4 ммоль/л КСl, 1.2 ммоль/л СаС12, 0.5 ммоль/л MgSO4, 20.9 ммоль/л NaH2PO4, 20 ммоль/л NaHCO3, 5 ммоль/л глюкозы, (95% О2 и 5% СО2). Буфер Trizma использовали после оксигенации раствора для поддержания рН в пределах 7.3–7.4 (Sigma-Aldrich, США).
Электрическую активность кардиомиоцитов изучали с использованием внутриклеточного микроэлектродного отведения на препарате правого предсердия с сохраненным синусным узлом и спонтанной активностью. А также на препарате правого предсердия при навязанном ритме c частотой 5 Гц и правого желудочка с частотой 3 Гц, длительностью стимуляция 5 мс и амплитудой 5–10 В. Внешнее раздражение осуществляли через платиновые электроды. Приготовленный препарат помещался в экспериментальную камеру объемом 3 мл, куда подавался раствор Тироде (37°С) со скоростью 10 мл/мин. После стабилизации амплитудно-временны́х параметров потенциала действия (ПД) подавался раствор нейропептида Y в течение 20 мин. Сначала подавался раствор в наименьшей концентрации, затем производили отмывку препарата раствором Тироде и ожидали восстановление параметров ПД и подавали большую концентрацию. На одном препарате изучали эффект NPY в трех последовательно возрастающих концентрациях. Все растворы готовились в день эксперимента. Регистрацию электрической активности кардиомиоцитов при действии NPY проводили в диапазоне концентраций 10–10–10–6 M.
Мембранный потенциал (МП) и потенциал действия регистрировали с использованием стеклянных микроэлектродов (диаметр кончика < 1 мкм, сопротивление 30–80 МОм), которые изготавливались в день эксперимента на горизонтальном пуллере Р-1000 (Sutter Instruments). Сигналы усиливали с помощью усилителя, затем анализировали параметры ПД при помощи аналогово-цифрового преобразователя Е14-140 (L-Card). Полученные записи электрической активности миокарда анализировали в оригинальной программе Elph 3.0. Обработка включала определение величины МП, амплитуды ПД, длительности фазы деполяризации ПД, длительности фазы реполяризации ПД на уровне 20, 50 и 90% спада ПД (ДПД20, ДПД50, ДПД90). Более детально ознакомиться с методикой вычисления вышеуказанных параметров можно в статье Зверев А.А. и др. [17]. Параметры ПД регистрировали на 7-й и 15-й мин после аппликации NPY. В экспериментах использовали химические реактивы и вещество NPY фирмы Sigma-Aldrich.
Все результаты в тексте и на рисунках представлены как среднее ± ошибка среднего для n экспериментов. Полученные результаты обрабатывали в программе PowerGraph Professional 3.3 (Disoft). Проверку выборки на нормальное распределение проводили во всех сериях экспериментов. Статистическую значимость эффектов различных концентраций нейропептида Y по сравнению с контролем выявляли с помощью парного t-критерия Стьюдента после применения ANOVA. Результаты считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
У 7-суточных животных NPY в концентрации 10–10 и 10–6 М не вызывал достоверных изменений в значении МП и параметров ПД животных при спонтанной активности препарата правого предсердия. Частота спонтанной активности также достоверно не изменяется (n = 11).
При навязанном ритме NPY в концентрации 10–10, 10–9 и 10–6 М не вызывал достоверных изменений значений МП и параметров ПД кардиомиоцитов предсердий и желудочков (n = 10).
NPY в концентрации 10–8 М в предсердиях не изменял мембранный потенциал (с 82.8 ± 1.3 до 83.03 ± 1.3 мВ), амплитуду и длительность фазы деполяризации ПД, однако значительно укорачивал фазу реполяризации ПД. К 7 мин действия NPY ДПД20 уменьшилась c 6.4 ± 0.03 до 4.6 ± 0.1 мс (p < 0.05), ДПД50 – с 11.4 ± 0.6 до 7.7 ± 0.1 мс (p < 0.05), ДПД90 с 43.5 ± 1.43 до 28.0 ± 0.6 мс (p < 0.05, n = 9), т.е. на 28, 33 и 35% соответственно (рис. 1, табл. 1).
Рис. 1.
Влияние NPY (10–8 М) на ПД кардиомиоцитов правого предсердия 7-суточных крыс (навязанный ритм). а – Оригинальная запись: 1 – контроль (без воздействия NPY), 2 – NPY (7 мин); б – изменения длительности фазы реполяризации (* – p < 0.05).
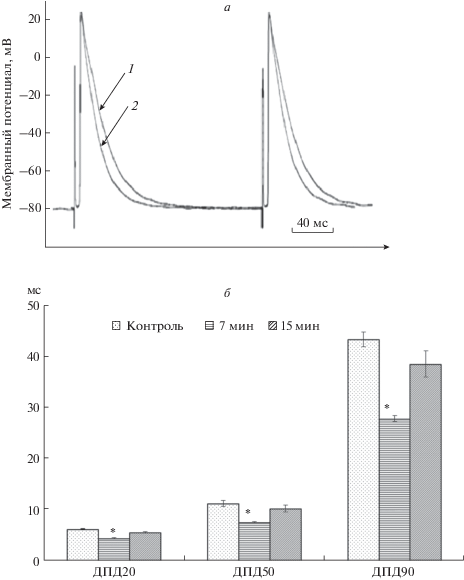
Таблица 1.
Влияние NPY (10–8, 10–7 М) на ПД кардиомиоцитов правого предсердия и желудочков 7-суточных крыс
| NPY, М | Время, мин | МП, мВ | Амплитуда ПД, мВ | ДПД20 | ДПД50 | ДПД90 | n |
|---|---|---|---|---|---|---|---|
| мс | |||||||
| Предсердие | |||||||
| 10–8 | 0 | 82.8 ± 1.3 | 89.2 ± 1.5 | 6.4 ± 0.03 | 11.4 ± 0.6 | 43.5 ± 1.43 | 9 |
| 7 | 82.1 ± 1.2 | 89.7 ± 1.6 | 4.6 ± 0.1* | 7.7 ± 0.1* | 28.0 ± 0.6* | ||
| 15 | 83.03 ± 1.3 | 89.2 ± 1.6 | 5.7 ± 0.1* | 10.4 ± 0.7* | 38.7 ± 2.6* | ||
| 10–7 | 0 | 82.8 ± 1.5 | 86.4 ± 1.0 | 6.3 ± 0.2 | 12.5 ± 0.8 | 46.5 ± 1.9 | 9 |
| 7 | 82.9 ± 1.4 | 92.0 ± 0.8 | 5.7 ± 0.2* | 10.4 ± 0.5* | 42.3 ± 1.5* | ||
| 15 | 83.0 ± 1.2 | 87.1 ± 1.4 | 6.2 ± 0.4 | 12.1 ± 1.3 | 42.5 ± 1.4* | ||
| Желудочек | |||||||
| 10–8 | 0 | 81.6 ± 1.9 | 91.2 ± 2.4 | 96.4 ± 2.3 | 159.6 ± 4.4 | 251.9 ± 6.2 | 7 |
| 7 | 82.3 ± 2.1 | 91.6 ± 3.2 | 95.3 ± 2.8 | 150.7 ± 4.1 | 215.9 ± 6.1* | ||
| 15 | 84.2 ± 2.3 | 95.4 ± 2.9 | 96.5 ± 2.5 | 157.3 ± 4.9 | 246.9 ± 7.2 | ||
| 10–7 | 0 | 81.9 ± 2.3 | 92.6 ± 3.9 | 97.4 ± 2.6 | 158.8 ± 4.1 | 249.6 ± 7.1 | 7 |
| 7 | 82.3 ± 3.1 | 93.6 ± 4.1 | 95.5 ± 3.1 | 135.9 ± 5.1* | 211.9 ± 5.4* | ||
| 15 | 84.2 ± 2.3 | 92.7 ± 6.3 | 97.1 ± 2.9 | 149.8 ± 4.8 | 243.7 ± 7.9 | ||
Через 15 мин наблюдается тенденция к восстановлению длительности фазы реполяризации, однако полного восстановления данного параметра ПД не наблюдается. ДПД20 к 15 мин аппликации NPY составляет 5.7 ± 0.1 мс (p < 0.05), ДПД50 10.4 ± 0.7 мс (p < 0.05), ДПД90 38.7 ± 2.6 мс (p < 0.05, n = 9), т.е. уменьшение составляет на 12, 10 и 11% соответственно относительно исходных значений.
NPY в концентрации 10–7 М не изменял мембранный потенциал (с 82.8 ± 1.5 до 83.0 ± 1.2 мВ) и длительность фазы деполяризации. К 7 мин действия наблюдается увеличение амплитуды ПД с 86.4 ± 1.0 до 92.0 ± 0.8 мВ, что составляет 6%. ДПД20 уменьшилась c 6.3 ± 0.2 до 5.7 ± 0.2 мс (p < 0.05), ДПД50 с 12.5 ± 0.8 до 10.4 ± 0.5 мс (p < < 0.05), ДПД90 с 46.5 ± 1.9 до 42.3 ± 1.5 мс (p < < 0.05, n = 9), т.е. на 9, 17 и 9% соответственно. К 15 мин наблюдается восстановление значений ДПД20 и ДПД50 до исходных значений при продолжающемся действии NPY. В то же время полного восстановления ДПД90 не происходит, и ДПД90 составляет 42.5 ± 1.4 мс (p < 0.05, n = 9).
Аппликация NPY на препараты желудочков в концентрации 10–8 М не приводила к изменению мембранного потенциала (с 81.6 ± 1.9 и 84.2 ± 2.3 мВ), амплитуды и длительности фазы деполяризации ПД, незначительно укорачивая фазу реполяризации ПД. К 7 мин действия NPY ДПД20 уменьшается с 96.4 ± 2.3 до 95.3 ± 2.8 мс, ДПД50 – с 159.6 ± 4.4 до 150.7 ± 4.1 мс, ДПД90 с 251.9 ± 6.2 до 215.9 ± 6.1 мс (p < 0.05, n = 7), т.е. на 1, 6 и 14% соответственно (рис. 2, табл. 1).
Рис. 2.
Влияние NPY (10–7 М) на ПД кардиомиоцитов правого желудочка 7-суточных крыс (навязанный ритм). а – Оригинальная запись: 1 – контроль (без воздействия NPY), 2 – NPY (7 мин); б – значения параметров ПД при действии NPY в % от контроля (* – р < 0.05).
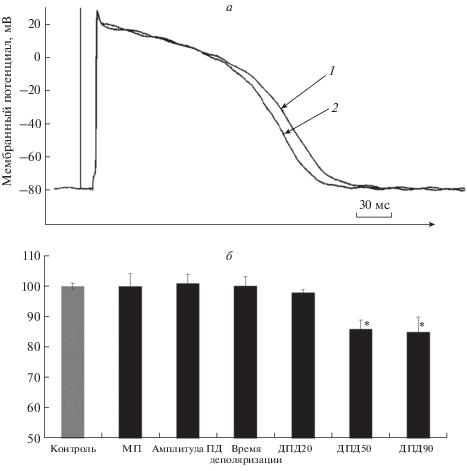
NPY в концентрации 10–7 М не изменял мембранный потенциал (с 81.9 ± 2.3 и 82.6 ± 2.6 мВ), амплитуду и длительность фазы деполяризации ПД кардиомиоцитов желудочков, незначительно укорачивая фазу реполяризации ПД. К 7 мин ДПД20 уменьшилась с 97.4 ± 2.6 до 95.5 ± 3.1 мс, ДПД50 с 158.8 ± 4.1 до 135.9 ± 5.1 мс (р < 0.05), ДПД90 с 249.6 ± 7.1 до 211.9 ± 5.4 мс (p < 0.05), т.е. на 2, 14 и 15% соответственно.
Уменьшение длительности ПД в ответ на аппликацию NPY у 7-суточных животных является кратковременным. К 15 мин наблюдается тенденция к восстановлению длительности фазы реполяризации.
ОБСУЖДЕНИЕ
Известно, что длительность фазы реполяризации потенциала действия в кардиомиоцитах определяется выходящими калиевыми токами: IKur (сверхбыстрый выходящий ток задержанного выпрямления), Ito1,2 (транзиторный выходящий ток), IKr и IKs (быстрый и медленный компоненты токов задержанного выпрямления), IK1 (ток аномального выпрямления) и некоторыми другими. Токи задержанного выпрямления протекают через потенциал чувствительные калиевые каналы. Длительность фазы реполяризации потенциала действия в основном определяется током IKr [18].
Отсутствие эффекта NPY концентрации 10–6 М возможно связанно с тем, что NPY является неселективным агонистом и может активировать разные типы рецепторов, которые сопряжены с разными G-белками: Gi, Gs, Gq. Возможно, происходит нивелирование противоположных эффектов NPY.
Активация Y1-рецепторов активирует Gq сигнальный каскад, который высвобождает Ca2+ из саркоплазматического ретикулума через инозитолтрифосфат (IP3). Повышение внутриклеточного Ca2+ активирует Ca2+/кальмодулин-зависимую киназу (CaMK) и протеинкиназу C (PKC), что приводит к усилению К+-тока. Активация PKC дополнительно усиливается с помощью диацилглицерина (DAG), образующегося после расщепления фосфатидилинозитол-4,5-бисфосфата (PIP2) с помощью фосфолипазы С (PLC) [19]. Известно, что нейропептид Y может уменьшать транзиторный выходящий калиевый ток через ингибирующий G-белок, при активации Y2-рецепторов [10, 19].
Возможной причиной различия эффектов NPY в желудочковом и предсердном миокарде является разное исходное соотношение различных К+-токов в предсердиях и желудочках. В желудочковом миокарде преобладает ток Ito, а в предсердном – IKs. Именно эти токи определяют длительность фазы реполяризации [20].
Таким образом, нейропептид Y вызывает изменения паттерна электрической активности миокарда предсердий и желудочков. Полученные нами данные об уменьшении длительности ПД, по всей видимости, связаны с изменениями плотности и кинетики К+-каналов, что ведет к увеличению суммарного К+-тока. Физиологическая роль NPY в сердце заключается в уменьшении длительности ПД за счет укорочения фазы реполяризации, что приводит к увеличению продолжительности общей паузы. В итоге NPY проявляет кардитропный эффект у новорожденных крысят, несмотря на незрелость симпатической иннервации.
Работа выполнена в рамках реализации программы повышения конкурентоспособности Казанского федерального университета и при поддержке РФФИ по теме № 18-34-00567 “Влияние нейропептида Y на деятельность сердца крыс в раннем постнатальном онтогенезе”.
Список литературы
Tatemoto K., Carlquist M., Mutt V. 1982. Neuropeptide Y – a novel brain peptide with structural similarities to peptide YY and pancreatic polypeptide. Nature. 296 (5858), 659–660.
Pedrazzini T., Pralong F., Grouzmann E. 2003. Neuropeptide Y: The universal soldier. Cell. Mol. Life Sci. 60 (2), 350–377.
Zukowska Z., Pons J., Lee E.W., Li L. 2003. Neuropeptide Y: A new mediator linking sympathetic nerves, blood vessels and immune system? Can. J. Physiol. Pharmacol. 81 (2), 89–94.
Blomqvist A., Lundell M., Larhammar D. 1990. Strong evolutionary conservation of neuropeptide Y between mammals, chicken, goldfish and horned shark. Ann. N. Y. Acid. Sci. 611 (1), 378–378.
Morris J.L., Gibbins I.L., Kadowitz P.J., Herzog H., Kreulen D.L., Toda N., Claing A. 1995. Roles of peptides and other substances in co-transmission from vascular autonomic and sensory neurons. Can. J. Physiol. Pharmacol. 73 (5), 521–532.
Burnstock G. 2009. Autonomic neurotransmission: 60 years since Sir Henry Dale. Annu Rev. Pharmacol. Toxicol. 49, 1–30.
McDermott B.J., Bell D. 2007. NPY and cardiac diseases Curr. Top. Med. Chem. 7(17), 1692–1703.
Masliukov P.M, Moiseev K., Emanuilov A.I., Anikina T.A., Zverev A.A., Nozdrachev A.D. 2016. Development of neuropeptide Y-mediated heart innervation in rats. Neuropeptides. 55 (2), 47–54.
Michel M.C., Beck-Sickinger A., Cox H., Doods H.N., Herzog H., Larhammar D., Quirion R., Schwartz T., Westfall T. 1998. XVI. International union of pharmacology recommendations for the nomenclature of neuropeptide Y peptide YY, and pancreatic polypeptide receptors. Pharmacol. Rev. 50 (1), 143–150.
Protas L., Barbuti A., Qu J., Rybin V.O., Palmiter R.D., Steinberg S.F., Robinson R.B. 2003. Neuropeptide Y is an essential in vivo developmental regulator of cardiac ICa, L. Circ. Res. 93 (10), 972–979.
Richardson R.J., Grkovic I., Allen A.M., Anderson C.R. 2006. Separate neurochemical classes of sympathetic postganglionic neurons project to the left ventricle of the rat heart. Cell Tissue Res. 324 (1), 9–16.
Pernow J., Öhlén A., Hökfelt T., Nilsson O., Lundberg J.M. 1987. Neuropeptide Y: presence in perivascular noradrenergic neurons and vasoconstrictor effects on skeletal muscle blood vessels in experimental animals and man. Regul. Pept. 19 (5), 313–324.
Zukowska-Grojec Z., Shen G.H., Capraro P.A., Vaz C.A. 1991. Cardiovascular, Neuropeptide Y and adrenergic responses in stress are sexually differentiated. Physiol. Behav. 49 (4), 771–777.
Dvorakova M.C., Kruzliak P., Rabkin S.W. 2014. Role of neuropeptides in cardiomyopathies. Peptides. 61, 1–6.
Sitdikov F.G., Anikina T.A., Zverev A.A., Bilalova G.A., Khamzina E.I. 2008. Purinergic regulation of rat heart function in ontogeny. Russian Journal of Developmental Biology. 39 (5), 269–274.
Смирнов В.М. 1995. Симпатическая нервная система не участвует в развитии ваготомической тахикардии. Бюл. экспер. биол. и мед. 120 (8), 125–128.
Zverev A.A., Anikina T.A., Iskakov N.G., Zefirov A.L., Zefirov T.L. 2018. Effect of neuropeptide Y on action potential generation in working cardiomyocytes of ther atrium in rat heart. Bull. of Exp. Biol. and Med. 165 (5), 610–612.
Virág L., Iost N., Opincariu M., Szolnoky J., Szécsi J., Bogáts G., Szenohradszky P., Varró A., Papp J.G. 2001. The slow component of the delayed rectifier potassium current in undiseased human ventricular myocytes. Cardiovasc. Res. 49 (4), 790–797.
Tan C.M.J., Green P., Tapoulal N., Lewandowski A.J., Leeson P., Herring N. 2018. The role of neuropeptide Y in cardiovascular health and disease. Front. Physiol. 9, 1–13.
Кодиров С.А. Журавлев В.Л., Сафонова Т.А., Мельников К.Н., Вислобоков А.И. 2004. Ионные каналы в кардиомиоцитах млекопитающих. Обзоры по клинической фармакологии и лекарственной терапии. 3 (4), 27–41.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


