Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 3, стр. 215-223
Особенности состава нейтральных липидов эмбриогенных и неэмбриогенных клеточных линий Larix sibirica Ledeb.
Н. В. Семёнова a, *, В. Н. Шмаков a, М. Э. Пак b, И. Н. Третьякова b, Ю. М. Константинов a, Л. В. Дударева a
a Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, Россия
b Институт леса им. В.Н. Сукачева СО РАН
660036 Красноярск, Академгородок, Россия
* E-mail: tashasemyonova@mail.ru
Поступила в редакцию 19.05.2019
После доработки 12.07.2019
Принята к публикации 08.08.2019
Аннотация
Хроматографическими и масс-спектрометрическими методами выявлены существенные различия состава и содержания нейтральных липидов (НЛ) в тканях эмбриогенных и неэмбриогенных клеточных линий лиственницы сибирской (Larix sibirica Ledeb.). Установлено, что доминирующими липидами двух типов линий являются глицериды. При этом триглицериды (ТГ) и 1,2-диглицериды (1,2-ДГ) заметно активнее (в 1.5–3 раза) накапливались в эмбриогенных клеточных линиях, что, вероятно, связано с необходимостью их вовлечения в процессы дифференциации тканей. Показано, что для эмбриогенных линий характерно высокое относительное содержание свободных жирных кислот (СЖК). При этом содержание эфиров стеринов у эмбриогенных линий в 1.5–3 раза меньше, чем у неэмбриногенных. Обнаруженные различия в соотношении стеринов и их эфиров объясняются активацией стеринов из инертной формы для участия в процессах эмбриогенеза на стадии формирования зародышей.
ВВЕДЕНИЕ
В настоящее время эффективным способом сохранения редких генотипов растений с уникальными признаками является их клональное размножение путем соматического эмбриогенеза и органогенеза [1, 2]. Однако для большинства видов хвойных биотехнология получения соматических зародышей остается трудновыполнимой задачей. Эти трудности вызваны как видовыми особенностями, так и недостатком сведений об условиях и механизмах индукции соматического эмбриогенеза у голосеменных растений [3]. Состав липидов и жирных кислот как основных структурных компонентов растительных мембран так же изменяется в зависимости от физиологического состояния клеток и тканей [4, 5]. Степень этого варьирования определяется генотипом и зависит от факторов среды [6, 7].
Известно, что нейтральные липиды (НЛ) и жирные кислоты играют важную роль в росте и развитии растений как in vivo, так и in vitro в качестве энергетического и субстратного резерва [8–10]. НЛ, в частности, триглицериды (ТГ), эфиры стеринов (ЭС) и воски, не имеют по определению заряженных групп и поэтому не могут интегрироваться в бислойные мембраны в значительных количествах. Поэтому ТГ и ЭС обычно выполняют роль депо для хранения стеринов, жирных кислот и диглицеридов (ДГ). Наиболее доступными запасными источниками энергии являются глицериды, обеспечивающие обменные процессы в растительных организмах. Так, ТГ представляют собой эффективную форму накопления углерода и энергии у 80% видов растений. Количество ТГ и их жирнокислотный состав играют важную роль в жизнедеятельности растительного организма в целом [9, 11]. В то же время физиологическая роль глицеридов не ограничивается функцией резерва энергии. Запасы этих веществ могут служить источником структурных элементов глицерина, жирных кислот, являющихся исходными продуктами при биосинтезе различных соединений [12, 13]. Еще один тип НЛ – воски, по своей химической природе являются сложными эфирами высших жирных кислот и высших одноатомных спиртов жирного (реже ароматического) ряда. Это твердые соединения с ярко выраженными гидрофобными свойствами. Природные воски содержат некоторое количество СЖК и высокомолекулярных спиртов. Они также являются запасными липидами, гидролиз которых высвобождает жирные кислоты и может приводить к образованию длинноцепочечных спиртов [14]. У некоторых растений и у бактерий воски используются в качестве энергетического запаса, кроме того у растений воски обеспечивают гидрофобное покрытие тканей для минимизации обезвоживания поверхностей. Жирные кислоты, находящиеся в составе НЛ, могут быть использованы для производства энергии путем β-окисления или служить субстратами для реакций ацилирования, например, для синтеза фосфолипидов. ДГ служат субстратом для синтеза фосфатидилэтаноламинов и фосфатидилхолинов по пути Кеннеди [15], а также действуют как вторичные мессенджеры трансдукции сигнала при связывании с протеинкиназами [14, 16]. Изучение качественного состава НЛ, в связи с их участием в клеточном росте и развитии in vitro, представляет большой интерес, в том числе и потому, что они играют важную роль в процессах развития и последующего прорастания эмбрионов. Например, показано, что дефицит липидов в соматических эмбрионах приводит к нарушению их нормального развития и прорастания [8, 17].
Стерины являются жизненно важными компонентами мембран и играют не только структурную, но и регуляторную роль в клеточных процессах. Они задействованы в упорядочивании жирнокислотных цепей в мембране, что может влиять на ее проницаемость для воды и ионов, а также на активность мембраносвязанных белков [18]. Например, они регулируют активность Na+/К+-ATP-азы в клеточных мембранах. Показано, что доминирующий в растениях β-ситостерин и другие стерины играют ключевую роль в клеточной дифференциации и пролиферации [19, 20]. Кроме того, стерины могут быть вовлечены в процессы адаптации растительных мембран к изменениям температуры. Таким образом, полученные к настоящему времени данные свидетельствуют о том, что стерины служат сигнальными и/или регуляторными молекулами, вовлеченными в процессы роста и развития растения [18]. Тем не менее, вплоть до последнего времени отсутствуют какие-либо сведения о количестве и составе НЛ в клеточных линиях с разным эмбриогенным потенциалом. Очевидно, что такая информация представляется важной с точки зрения развития подходов и методов клонального размножения хвойных с использованием культуры клеток in vitro. В связи с этим целью настоящей работы было проведение сравнительного анализа содержания НЛ в эмбриогенных и неэмбриогенных клеточных линиях лиственницы сибирской (Larix sibirica Ledeb.).
МАТЕРИАЛЫ И МЕТОДЫ
В качестве материала для индукции соматического эмбриогенеза были взяты изолированные зиготические зародыши на стадии инициации семядолей из семян, собранных у 34 деревьев лиственницы сибирской (Larix sibirica Ledeb.) в возрасте 40–60 лет, произрастающих на территории дендрария Института леса СО РАН (г. Красноярск) и в Хакасии, координаты места сбора – 54°38′58″ северной широты 89°26′28″ восточной долготы (июль 2007–июль 2011 гг.). Семена опытных деревьев очищали от покровных чешуй, поверхностно стерилизовали 5% спиртовым раствором йода в течение 3 мин. После 3-кратной промывки в стерильной дистиллированной воде мегагаметофиты обрабатывали 3% перекисью водорода в течение 5–10 мин. Зародыши извлекали из мегагаметофитов в стерильных условиях, помещали на увлажненную фильтровальную бумагу в чашках Петри и затем переносили на агаризованную питательную среду АИ [3]. В качестве регуляторов роста использовали 2,4-дихлорфеноксиуксусную кислоту (2,4-Д, 2 мг/л) и 6-бензиламинопурин (БАП, 1 мг/л). Для образования эмбриональной массы (ЭМ) в базовой среде уменьшали концентрацию цитокинина (до 0.5 мг/л). ЭМ инкубировали в темноте при 24 ± 1°С с циклом субкультивирования 28 дней. Полученные в результате индукции клеточные линии лиственницы отличались между собой по пролиферативной активности, по количеству незрелых соматических зародышей внутри эмбриональной массы, а также по возможности получения регенерантов [2, 3]. Следует отметить что наибольшее число полноценных регенерантов было получено в линии Кл4, у которой 83.3% соматических зародышей формировались без отклонений фенотипа [21]. Для изучения состава и содержания нейтральных липидов каллусов лиственницы сибирской использовали эмбриогенные Кл2, Кл6, Кл4, Кл10 (зародыши вызревают, получены регенеранты) долгоживущие клеточные линии, на стадии пролиферации эмбрионально-суспензорной массы и неэмбриогенные линии Кл31, Кл23 (не образуют регенеранты). Для экстракции липидов навеску растительного материала (0.5 г) фиксировали в жидком азоте, добавляли 0.001% ионол и растирали до получения гомогенной массы [22]. Затем добавляли 10 мл смеси хлороформ : метанол (2 : 1 v/v) тщательно перемешивали и оставляли на 30 мин до полной диффузии липидов в растворитель. Количественно переносили раствор в делительную воронку через фильтр, трижды промывая ступку и фильтр смесью растворителей. Для лучшего расслаивания добавляли воду. Для анализа суммарных липидов отделяли нижнюю хлороформную фракцию. Хлороформ (ос. ч., стабилизированный 0.005 мас.% амилена) из липидного экстракта удаляли под вакуумом с помощью роторного испарителя RVO-64 (Чехия).
Метиловые эфиры жирных кислот (МЭЖК) из экстракта получали по методу [23]. Для контроля экстрагируемости липидов (в %) использовали нонадекановую кислоту (С19:0), добавляя ее известное количество на этапе гомогенизации. Дополнительную очистку МЭЖК проводили методом ТСХ на пластинках Sorbfil ПТСХ-АФ-В (Россия) в камере с бензолом в качестве подвижной фазы (Rf = 0.71–0.73). Для визуализации зоны МЭЖК край пластинки опрыскивали 10% раствором H2SO4 в этаноле и нагревали в сушильном шкафу при 100°С. Зону МЭЖК удаляли с пластинки шпателем и элюировали с силикагеля хлороформом.
Анализ МЭЖК проводили методом газожидкостной хроматографии с использованием хромато-масс-спектрометра 5973/6890N MSD/DS Agilent Technologies (США). Детектор – квадрупольный масс-спектрометр, способ ионизации – электронный удар, энергия ионизации 70 эВ, для анализа использовали режим регистрации полного ионного тока. Для разделения использовали капиллярную колонку HP-INNOWAX (30 м × × 250 мкм × 0.50 мкм) со стационарной фазой полиэтиленгликоль. Газ-носитель: гелий, скорость потока газа 1 мл/мин. Температура испарителя 250°С, источника ионов 230°C, детектора 150°С, температура линии, соединяющей хроматограф с масс-спектрометром, 280°С. Диапазон сканирования 41–450 а.e.м. Объем вводимой пробы – 1 мкл, делитель потока 5 : 1. Разделение смеси МЭЖК выполняли в изотермическом режиме при 200°С. Для идентификации ЖК использовали библиотеку масс-спектров NIST 08, архив масс-спектров МЭЖК В. Кристи [24]. Относительное содержание ЖК определяли методом внутренней нормализации – в весовых процентах от общего их содержания в исследуемом образце, с учетом коэффициента отклика ЖК. Абсолютное содержание суммарных МЭЖК определяли с использованием внутреннего стандарта – нонадекановая кислота (С19:0).
Нейтральные липиды получали методом колоночной хроматографии, путем деления суммарных липидов на нейтральные, глико- и фосфолипиды [25]. Сорбент Silicagel L 100/160 для хроматографии (Чехия). Абсолютное содержание как отдельных фракций липидов, так и суммарных липидов определяли взвешиванием с помощью электронных весов GR-120 (A&N Company Ltd., Япония), образец высушивали до постоянного веса.
Состав нейтральных липидов анализировали методом одномерной тонкослойной хроматографии на высокоэффективных пластинках Sorbfil ПТСХ-АФ-В (Россия) (сорбент силикагель СТХ-1ВЭ, зернение 8–12 мкм, толщина слоя 80–100 мкм) в системе для НЛ : гексан : диэтиловый эфир : уксусная кислота (80 : 20 : 1 v/v/v) [26]. Для визуализации зон отдельных типов липидов хроматограммы опрыскивали 10% серной кислотой в этаноле с последующим нагреванием при 180° до проявления пятен. Идентификацию отдельных фракций НЛ проводили с использованием соответствующих стандартов (“Supelco”, США), значений Rf из литературных источников [25]. Количественное определение НЛ проводили методом денситометрии (сканер Hewlett-Packard, США), при помощи программного обеспечения Scion Image (Scion Corporation, США).
Абсолютное содержание отдельных НЛ (PГНЛ) рассчитывали исходя из их общего веса НЛ (мг/г сух. веса) (PНЛ) в образце и процентного содержания каждой группы НЛ (CГНЛ% отн.) по формуле:
Статистическая обработка. В таблицах представлены среднеарифметические значения трех-четырех независимых биологических экспериментов и их стандартное отклонение. Статистическую обработку данных проводили с помощью Microsoft Office Excel 2010. Статистическую значимость различий сравниваемых средних значений оценивали с помощью критерия Манна–Уитни (p < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты анализа содержания отдельных групп липидов в эмбриогенных и неэмбриогенных клеточных линиях лиственницы сибирской приведены в табл. 1. Можно видеть, что абсолютное содержание липидов в эмбриогенных линиях было достоверно выше, чем в неэмбриогенных. Такая же тенденция сохраняется и для абсолютного содержания НЛ для отдельных клеточных линий (17.9–24.6 мг/г сухого веса для эмбриогенных линий и 12.7–13.1 мг/г сухого веса для неэмбриогенных линий).
Таблица 1.
Содержание отдельных групп липидов в эмбриогенных и неэмбриогенных каллусах лиственницы сибирской (мг/г сухого веса клеточной линии)
| Липиды | Кл6(э) | Кл2(э) | Кл4(э) | Кл10(э) | Кл23(нэ) | Кл31(нэ) |
|---|---|---|---|---|---|---|
| НЛ | 20.0 ± 4.9 | 24.5 ± 4.8 | 17.9 ± 3.3 | 18.0 ± 2.6 | 12.7 ± 0.6 | 13.1 ± 0.5 |
| ГЛ | 25.7 ± 4.3 | 19.9 ± 4.4 | 19.2 ± 4.5 | 19.2 ± 3.6 | 17.4 ± 3.9 | 20.6 ± 0.4 |
| ФЛ | 9.5 ± 2.2 | 5.5 ± 1.9 | 6.5 ± 1.1 | 8.3 ± 2.4 | 5.7 ± 1.6 | 5.2 ± 0.2 |
| Сумма ОЛ | 55.2 ± 4.5 | 49.9 ± 2.1 | 43.6 ± 3.3 | 45.5 ± 4.2 | 35.8 ± 2.7 | 38.9 ± 0.6 |
Ранее в нашей работе было установлено, что между эмбриогенными и неэмбриогенными клеточными линиями лиственницы сибирской имеются существенные различия по жирнокислотному составу суммарных липидов, в первую очередь, по содержанию олеиновой кислоты. Показано, что содержание олеиновой кислоты коррелирует с потенциалом эмбриогенности клеточных линий [4]. Для выявления преимущественной локализации олеиновой кислоты в разных группах липидов при соматическом эмбриогенезе нами был определен жирнокислотный состав трех таких групп: нейтральных, глико- и фосфолипидов (рис. 1). В результате установлено, что во всех этих группах в отношении содержания олеиновой кислоты прослеживается та же тенденция, что и в суммарных липидах – значительно более высокое содержание олеиновой кислоты в линиях с высоким эмбриогенным потенциалом. При этом среди эмбриогенных клеточных линий имеются достоверные различия в содержании олеиновой кислоты в различных группах липидов. Так в Кл6 большее количество олеиновой кислоты содержится в нейтральных липидах, Кл2 – глико- и фосфолипидах, Кл4 – гликолипидах, Кл10 – фосфолипидах. Возможно, это связано с различиями между клеточными линиями в возрасте культуры (3–6 лет) (табл. 2 ), жизнеспособности, пролиферативной активности, в количестве соматических зародышей [21].
Рис. 1.
Содержание олеиновой кислоты в разных липидных группах при соматическом эмбриогенезе. НЛ – нейтральные липиды, ГЛ – гликолипиды, ФЛ – фосфолипиды, э – эмбриогеннные линии, нэ – неэмбриогенные линии.
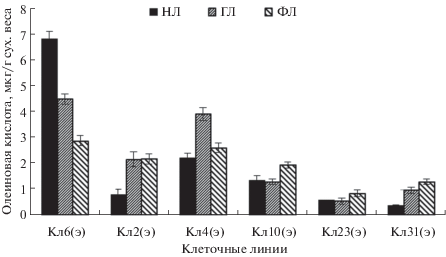
Таблица 2.
Коллекция клеточных линий, полученных в разные годы от дерева генотипа-донора А4 лиственницы сибирской [21]
| Клеточная линия | Созревание соматических зародышей | Продолжительность культивирования к моменту анализа (2015 г.), лет |
|---|---|---|
| Кл2 | + | 6 |
| Кл6 | + | 4 |
| Кл4 | + | 6 |
| Кл10 | + | 3 |
| Кл23 | – | 3 |
| Кл31 | – | 3 |
Среди НЛ клеточных линий с разным эмбриогенным потенциалом идентифицированы следующие типы липидов: моноглицериды (МГ), 1,2-ДГ, 1,3-ДГ, ТГ, стерины и их эфиры, СЖК, метиловые эфиры жирных кислот (МЭЖК) и воски (табл. 3).
Таблица 3.
Состав нейтральных липидов эмбриогенных (э) и неэмбриогенных (нэ) клеточных линий Larix sibirica Ledeb. (мкг/мг общих липидов)
| НЛ | Кл2(э) | Кл6(э) | Кл4(э) | Кл10(э) | Кл23(нэ) | Кл31(нэ) |
|---|---|---|---|---|---|---|
| МГ | 15.6 ± 1.5 | 15.5 ± 2.5 | 14.4 ± 3.1 | 12.5 ± 2.0 | 21.8 ± 0.1 | 20.4 ± 3.3 |
| ДГ-1,2 | 53.4 ± 2.6 | 27.8 ± 3.4 | 35.2 ± 4.4 | 28.6 ± 3.4 | 19.8 ± 1.5 | 18.9 ± 0.5 |
| Стерины | 78.5 ± 4.5 | 58.8 ± 4.0 | 62.9 ± 2.5 | 57.0 ± 2.3 | 58.5 ± 0.9 | 59.9 ± 10.4 |
| ДГ-1,3 | 25.0 ± 2.3 | 22.2 ± 0.8 | 20.8 ± 3.6 | 21.3 ± 2.5 | 16.3 ± 0.5 | 17.3 ± 4.2 |
| СЖК | 116.2 ± 5.1 | 77.4 ± 11.0 | 77.5 ± 6.9 | 79.3 ± 8.5 | 44.6 ± 1.0 | 43.7 ± 12.3 |
| ТГ | 72.2 ± 1.9 | 45.1 ± 7.9 | 56.4 ± 6.4 | 54.8 ± 6.6 | 27.0 ± 0.9 | 25.4 ± 4.3 |
| МЭЖК | 30.8 ± 1.9 | 25.6 ± 3.9 | 19.3 ± 7.4 | 19.5 ± 5.1 | 29.9 ± 1.7 | 24.6 ± 1.7 |
| Эфиры стеринов | 30.3 ± 2.9 | 16.9 ± 0.4 | 30.9 ± 7.2 | 28.2 ± 3.8 | 47.5 ± 1.6 | 42.7 ± 3.7 |
| Воски | 63.8 ± 2.8 | 55.0 ± 2.6 | 64.5 ± 16.0 | 51.5 ± 8.1 | 82.6 ± 6.2 | 70.2 ± 5.0 |
| Сумма НЛ | 492.0 ± 7.8 | 362.0 ± 2.1 | 410.0 ± 9.7 | 402.5 ± 6.6 | 335.0 ± 1.7 | 338.0 ± 4.8 |
Примечание. НЛ – нейтральные липиды, МГ – моноглицериды, ДГ – диглицериды, СЖК – свободные жирные кислоты, ТГ – триглицериды, МЭЖК – метиловые эфиры жирных кислот, э – эмбриогеннные линии, нэ – неэмбриогенные линии. В таблице приведены средние арифметические величины трех–четырех повторностей и их стандартные отклонения. Статистическую значимость различий сравниваемых средних значений оценивали с помощью критерия Манна–Уитни (p < 0.05).
Эмбриогенные линии достоверно отличались от неэмбриогенных высоким содержанием СЖК, 1,2-ДГ, ТГ. Для неэмбриогенных клеточных линий отмечено большее содержание МГ, эфиров стеринов и восков.
Наши эксперименты показали, что для эмбриогенных клеточных линий содержание СЖК было выше как минимум в 2 раза по сравнению с неэмбриогенными (табл. 3) и, в целом, было довольно высоким. Обычно количество СЖК в высших растениях невелико, они редко аккумулируются в здоровых тканях. Исключение составляют некоторые водные растения. Так, авторами работы [27] показано, что в тканях водных растений относительное содержание СЖК варьировало от 6.8% (Potamogeton pectinatus) до 37.9% (Spirodela polyrhiza). В работе [11], посвященной СЖК каллусов льна обыкновенного, отмечено высокое содержание СЖК – 146 мкг/мг общих липидов. Для неэмбриогенных каллусов эта величина была ниже на 10%. В работе [28] авторами показано, что каллусы плодов яблони (Malus sylvestris) содержали 6.5% СЖК, что в пересчете на абсолютный вес составило 32.6 мкг/мг общих липидов. По-видимому, заметные количества СЖК нередко встречаются в липидах клеточных культур растений. СЖК являются промежуточными веществами в синтезе других метаболитов. Являясь жирорастворимыми анионами, они способны увеличивать протонную проводимость [29]. Возможно, эти или другие функции СЖК могут быть востребованы в процессах морфогенеза в культуре растительной ткани.
Для всех клеточных линий основную долю НЛ составляли глицериды (29.1–33.8% от общих липидов для эмбриогенных клеточных линий, 23.9–24.3% (от общих липидов для неэмбриогенных клеточных линий), присутствовавшие в форме моно-, ди- и триглицеридов. Известно, что глицериды, в особенности ТГ, в жизнедеятельности растений играют особую роль, поскольку бедны кислородом, но богаты углеродом. Выигрыш энергии при их катаболизме существенно выше по сравнению с распадом углеводов и белков даже с учетом больших размеров этих молекул [30, 31]. При анализе эмбриогенных каллусов Picea glauca отмечено активное накопление ТГ при культивировании [32]. Авторы утверждают, что накопление ТГ играет существенную роль для развития каллусной культуры. В процессе культивирования ТГ также обогащаются специфическими жирными кислотами, например, имеются сведения о наличии кислот с углеродной длиной цепи 20–22 атомов, а также о наличии таксолеиновой кислоты ∆5-серии [32], характерной для хвойных и некоторых других эволюционно древних таксонов [33]. В другой работе, посвященной эмбриогенным каллусам Pinus taeda, также сообщается об увеличении содержания ТГ в процессе поддержания каллусной культуры клеток. Данные по содержанию ТГ в эмбриогенных линиях, полученные нами, хорошо согласуются с данными, полученными для каллусов Pinus taeda на ранних стадиях культивирования (в пересчете на сухой вес клеточной линии 1.0–3.6 мкг/мг в нашем эксперименте, а у P. taeda – 2.5 мкг/мг) [34]. Известно, что ТГ являются запасными липидами, которые легко могут быть вовлечены в катаболизм для получения энергии, необходимой клетке для роста и развития, а также для участия жирных кислот в клеточной сигнализации и синтезе фосфолипидов [7, 14]. Из полученных нами результатов (табл. 3) можно видеть, что для эмбриогенных клеточных линий характерно высокое содержание ТГ по сравнению с неэмбриогенными. Эта тенденция сохраняется и для 1,2-ДГ (табл. 3). При этом неэмбриогенные линии отличались достоверно более высоким содержанием МГ. Такое распределение содержания глицеридов, по-видимому, подтверждает важную роль ТГ и ДГ в процессе эмбриогенеза. Известно, что 1,3-ДГ накапливаются в клетке, выполняя запасающую функцию, в то время как 1,2-ДГ действуют как вторичные мессенджеры в клеточных процессах, являясь промежуточными звеньями в биосинтезе и катаболизме ТГ, в биосинтезе некоторых фосфолипидов – фосфатидилхолинов, фосфатидилэтаноламинов, фосфатидилсеринов. ДГ быстро накапливаются в мембранах, где они связываются с помощью сильных гидрофобных взаимодействий с определенными белками, вызывая тем самым изменения физических свойств бислоя [16, 35]. В работе [12] показано, что для меристем почек лиственницы сибирской содержание 1,2-ДГ было в 2 и более раз выше, чем содержание 1,3-ДГ в теплые месяцы (май, август). Авторы связывают это с тем что, весной идет активное накопление 1,2-ДГ в связи с их последующим участием в синтезе фосфолипидов, в то время как в холодные месяцы (октябрь–февраль) идет накопление 1,3-ДГ для сохранения необходимой клетке энергии. В работе [36], описывающей биосинтез липидов как in vivo, так и in vitro для семян рыжика посевного (Camelina sativa), также показано высокое содержание 1,2-ДГ по сравнению с 1,3-ДГ для каллусов Camelina sativa на стадии развития эмбрионов. Более высокое содержание 1,2-ДГ по сравнению с содержанием 1,3-ДГ, вероятно, характерно для эмбриогенных клеточных линий из-за их более высокой потребности в этом соединении для активных процессов роста, развития и последующего формирования растений-регенерантов.
В нашей работе содержание восков для клеточных линий с разным эмбриогенным потенциалом (способности клеточной культуры образовывать соматические эмбриоиды) достоверно не различалось: для неэмбриогенных линий – 82.6 ± 6.2 и 70.0 ± 5.0 мкг/мг общих липидов (Кл23 и Кл31 соответственно) и для эмбриогенных линий содержание восков составило 51.5 ± 8.1 (Кл10), 64.5 ± 16.0 (Кл4), 63.8 ± 2.8 (Кл2), 55.0 ± 2.6 (Кл6) мкг/мг общих липидов. Содержание эфиров жирных кислот колебалось от 19.3 до 30.8 мкг/мг общих липидов.
Как уже упоминалось, стерины играют не только структурную, но и регуляторную роль в клеточных процессах. Известно, например, что β-ситостерин и стигмастерин играют ключевую роль в клеточной дифференциации и пролиферации. Известно также, что кампестерин является предшественником брассиностеринов, которые, в свою очередь, активно участвуют в регуляции роста и развития растений [18].
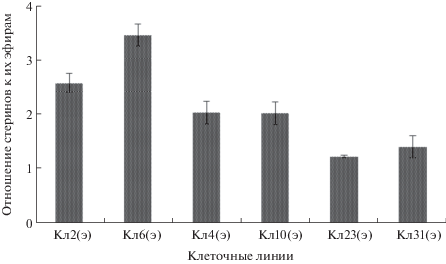
Известно об активном участии стеринов в формировании мембран и в морфогенетических процессах [18]. Нами установлено, что содержание стеринов в клеточных линиях в пересчете на сухой вес клеточной линии колебалось от 2.1 мг/г сухого веса (Кл23) до 3.9 мг/г сухого веса (Кл2). В наших экспериментах показано, что наряду со свободными стеринами в исследуемых клеточных линиях обнаружены заметные количества эфиров стеринов (табл. 3). Авторами работы [37] обнаружено, что в каллусной культуре лиственницы японской (Larix kaempferi) содержание стеринов составило от 1.0 до 2.5 мг/г сухого веса, что, в целом, согласуется с нашими данными. Для эмбриогенных линий льна обыкновенного установлено, что содержание стеринов было 1.45 мг/г сухого веса [38], а для каллусов цикория (Cichorium intybus) содержание стеринов составило 0.42 мг/г сухого веса [39], т.е. заметно ниже, чем для клеточных линий лиственницы. Возможно, высокое содержание стеринов в клеточных линиях является видовой особенностью лиственницы сибирской. Из табл. 3 видно, что содержание стеринов не имело существенных различий между линиями с разным эмбриогенным потенциалом. При этом содержание эфиров стеринов у эмбриогенных клеточных линий было почти в 1.5–2 раза ниже, чем у неэмбриогенных. Согласно нашим и литературным данным, эфиры стеринов содержатся в клетках растений в гораздо меньших объемах, чем свободные стерины [18]. Предполагается, что эфиры стеринов служат инертной формой хранения стеринов [14, 40]. Для количественной оценки конвертации стеринов из связанной формы в свободную нами было рассчитано отношение количества стеринов к количеству эфиров стеринов для эмбриогенных и неэмбриогенных клеточных линий (рис. 2). Из представленных результатов видно, что для неэмбриогенных линий этот показатель ниже в 1.5–3 раза по сравнению с таковым для эмбриогенных клеточных линий.
Из полученных нами данных (табл. 3) видно, что, хотя ТГ и ЭС обычно служат депо для хранения стеринов, жирных кислот и ДГ, для эмбриогенных линий содержание ТГ больше, а ЭС меньше, чем для неэмбриогенных. Вероятно, для более поздних стадий развития каллусов необходимо высокое содержание ТГ, в частности, для регенерации из каллуса целого растения, как предполагают авторы [34]. Свободные стерины в процессе созревания соматических зародышей активно участвуют в формировании мембран, и поэтому накопления их эфиров не происходит. Напротив, конвертация свободных стеринов в их эфиры является результатом прекращения деления клеток, и именно тогда избыточные стерины этерифицируются [41]. Авторами работы [42] показано, что в процессе субкультивирования Artemisia absinthium содержание эфиров стеринов снижается с 6.1 до 4.3% от общих липидов, а соотношение стеринов к их эфирам возрастает с 3.0 до 5.4, в то время как содержание ТГ остается практически неизменным. Мы полагаем, что для изучаемой стадии развития эмбриогенных клеточных линий лиственницы сибирской характерен большой расход свободных стеринов и, следовательно, высвобождение их из связанной формы. В этот же период происходит накопление ТГ, необходимых на более поздних стадиях культивирования.
Анализ полученных результатов показывает, что содержание и качественный состав липидов культуры in vitro закономерно различается между клеточными линиями с разным эмбриогенным потенциалом. Более высокое содержание ТГ и 1,2-ДГ у эмбриогенных клеточных линий по сравнению с неэмбриогенными является вполне ожидаемым – ТГ являются запасными липидами, необходимыми в процессах эмбриогенеза для получения энергии, необходимой клетке для роста и развития, а также для участия жирных кислот в составе ТГ в клеточной сигнализации. Действующие как вторичные мессенджеры в клеточных процессах 1,2-ДГ участвуют также в биосинтезе наиболее распространенных форм фосфолипидов, являясь необходимыми для формирования мембран клеток и клеточных органелл. Обнаруженные различия в соотношении стеринов и их эфиров указывают на то, что, по-видимому, в эмбриогенных клеточных линиях лиственницы стерины активно вовлекаются в процессы эмбриогенеза. В целом, представленные результаты свидетельствуют об активном участии НЛ, в первую очередь ТГ, 1,2-ДГ и стеринов, в процессах эмбриогенеза в тканях лиственницы сибирской in vitro. Полученные в настоящей работе результаты имеют также очевидное прикладное значение, поскольку НЛ, участвуя в клеточном росте и развитии in vitro, играют важную роль в процессах развития и последующего прорастания эмбрионов. Отметим, что выявленные нами особенности состава нейтральных липидов эмбриогенных клеточных линий Larix sibirica Ledeb. могут быть использованы в дальнейшем при скрининге клеточных линий с целью отбора материала для клонального размножения хвойных в культуре in vitro.
Работа выполнена с использованием оборудования ЦКП “Биоаналитика” СИФИБР СО РАН.
Список литературы
Calney J., Pullman G.S. 2007. Cellular and molecular biology of coniferon biogenesis. New Phytologist. 176, 511–536.
Третьякова И.Н., Барсукова А.В. 2012. Соматический эмбриогенез в культуре in vitro трех видов лиственницы. Онтогенез. 43 (6), 1–11.
Третьякова И.Н. 2013. Эмбриогенные клеточные линии и соматический эмбриогенез в культуре in vitro у лиственницы сибирской. ДАН. 450 (1), 122–125.
Макаренко С.П., Шмаков В.Н., Дударева Л.В., Столбикова А.В., Семёнова Н.В., Третьякова И.Н., Константинов Ю.М. 2016. Жирнокислотный состав суммарных липидов эмбриогенных и неэмбриогенных каллусных линий лиственницы. Физиология растений. 63 (2), 267–274.
Okazaki Y., Saito K. 2014. Roles of lipids as signaling molecules and mitigators during stress response in plants. Plant J. 79 (4), 584–596.
Лось Д.А. 2001. Структура, регуляция экспрессии и функционирование десатураз жирных кислот. Успехи биол. химии. 41, 163–198.
Ширшова Т.И., Матистов Н.В., Саакян Н.Ж., Петросян М.Т., Попов Ю.Г., Володин В.В. 2012. Содержание нейтральных липидов и жирных кислот в листьях интактных растений и каллусных культурах Ajuga chia и A. genevensis (Lamiaceae). Раст. ресурсы. 3, 389–395.
Feirer R.P., Conkey J.H., Verhagen S.A. 1989. Triglycerides in embryogenic conifer calli: A comparison with zygotic embryos. Plant cell Rep. 8, 207–209.
Chapman K.D., Dyer J.M., Mullen R.T. 2012. Biogenesis and functions of lipid droplets in plants. J. Lipid Res. 53 (2), 215–226.
Jacomini D., Sinzker R.C., Mangolin C.A., Grande P.A., Nocchi S.R., Nakamura C.V., Olivera A.J.B., Correia Goncalves R.A. 2015. Lipid profile and antiproliferative activity of callus cultures of Cereus peruvianus Mill. Ind. Crops Prod. 69, 408–414.
Cunha C.A., Fernandes-Ferreira M. 2003. Ontogenic variations in free and esterified fatty acids during somatic embryogenesis of flax (Linum usitatissimum L.). Plant Sci. 164, 863–872.
Алаудинова Е.В., Миронов П.В. 2009. Особенности обмена глицеридов меристем почек Larix sibirica Ledeb. Хвойные бореальной зоны. 26 (2), 291–293.
Suzuki M., Shinohara Y., Ohsaki Y., Fujimoto T. 2011. Lipid droplets: Size matters. Microscopy. 60 (1), S101–S116.
Athenstaedt K., Daum G. 2006. The life cycle of neutral lipids: Synthesis, storage and degradation. Cell. Mol. Life Sci. 63, 1355–1369.
Gibellini F., Smith T.K. 2010. The Kennedy pathway – de novo synthesis of phosphatidylethanolamine and phosphatidylcholine. IUBMB Life. 62 (6), 414–428.
Almena M., Merida I. 2011. Shaping up the membrane: Diacylglycerol coordinates spatial orientation of signaling. Trends Biochem. Sci. 36 (1), 593–603.
Murphy D.J. 2011. The dynamic roles of intracellular lipid droplets: From archaea to mammals. Protoplasma. 249 (3), 541–585.
Валитова Ю.Н., Сулкарнаева А.Г., Минибаева Ф.В. 2016. Растительные стерины: многообразие, биосинтез, физиологические функции. Биохимия. 81 (8), 1050–1068.
Diener C.A., Li H., Zhou W., Whoriskey J.W., Nes D.W., Fink. G.R. 2000. Sterol methyltransferase 1 controls the level of cholesterol in plants. Plant cell. 12, 853–870.
Carland F.M., Fujioka Sh., Takatsuto S., Yoshida Sh., Nelson T. 2002. The identification of CVP1 reveals a role for sterols in vascular patterning. Plant Cell. 14, 2045–2058.
Пак М.Э., Иваницкая А.С., Двойнина Л.М., Третьякова И.Н. 2016. Эмбриогенный потенциал длительно пролиферирующих клеточных линий Larix sibirica in vitro. Сибир. лесной журн. 1, 27–38.
Folch J., Lees M., Sloane Stanley G.H. 1957. A simple method for the isolation and purification of total lipids from animal tissues. J. Biol. Chem. 226 (1), 497–509.
Christie W.W. 1993. Preparation of ester derivatives of fatty acids for chromatographic analysis. In: Advances in Lipid Methodology. Ed. Christie W.W. Dundee: Two Oily Press, p. 69–111.
Christie W.W. Архив масс-спектров метиловых эфиров ЖК. https://www.lipidhome.co.uk/ms/ methesters/me-arch/index.htm.
Kates M. 1986. Techniques of lipidology: Isolation, analysis and identification of lipids. 2nd ed. Amsterdam–NY–Oxford: Elsevier. 464 p.
Malins D.C., Mangold H.K. 1960. Analysis of complex lipid mixtures by thin-layer chromatography and complementary methods. JAOCS. 37 (11), 576–578.
Розенцвет О.А., Саксонов С.В., Козлов В.Г., Конева Н.В. 2000. Эколого-биохимический подход к изучению липидов высших водных растений. Изв. Самарского научного центра РАН. 2 (2), 358–366.
Prabha T.N., Raina P.L., Patwardhan M.V. 1988. Lipid profile of cultured cells of apple (Malus sylvestris) and apple tissue. J. Biosciences. 13 (1), 33–38.
Severin F.F., Severina I.I., Antonenko Yu.N., Rokitskaya T.I., Cherepanov D.A., Mokhova E.N., Vyssokikh M.Yu., Pustovidko A.V., Markova O.V., Yaguzhinsky L.S., Korshunova G.A., Sumbatyan N.V., Skulachev M.V., Skulachev V.P. 2010. Penetrating cation/fatty acid anion pair as a mitochondria targeted protonophore. PNAS. 107 (2), 663–668.
Алаудинова Е.В., Поваляева В.А., Миронов П.В. 2010. Липиды меристем лесообразующих хвойных пород центральной сибири в условиях низкотемпературной адаптации. 3. Особенности обмена нейтральных липидов меристем почек Larix sibirica Ledeb., Picea obovata L. и Pinus sylvestris L. Химия растит. сырья. 1, 67–74.
Grigova M., Kubes M., Drazna N., Rezanka T., Lupavska H. 2007. Storage lipid dynamics in somatic embryos of Norway spruce (Picea abies): Histochemical and quantitative analyses. Tree Physiology. 27, 1533–1540.
Attree S.M., Pomeroy M.K. Fowke L.C. 1992. Manipulation of conditions for the culture of somatic embryos of white spruce for improved triacylglycerol biosynthesis and desiccation tolerance. Planta. 187, 395–404.
Wolff R.L., Comps B., Deluc L.G., Marpeau A.M. 1998. Fatty acids of the seeds from pine species of the Ponderosa-Banksiana and Halepensis sections. The peculiar taxonomic position of Pinus pinaster. JAOCS. 75 (1), 45–50.
Brownfield D.L., Todd C.D., Stone S.L., Deyholos M.K., Gifford D.J. 2007. Patterns of storage protein and triacylglycerol accumulation during loblolly pine somatic embryo maturation. Plant Cell, Tissue and Organ Culture. 88 (2), 217–223.
Gomez-Fernandez J.C., Corbalan-Garcia S. 2007. Diacylglycerols, multivalent membrane modulators. Chem. Phys. Lipids. 148, 1–25.
Pollard M., Martin T.M., Shachar-Hill Ya. 2015. Lipid analysis of developing Camelina sativa seeds and cultured embryos. Phytochemistry. 118, 23–32.
Sato M., Saito N., Seki K., Nishikoori M., Tokuji Yo., Ohnishi M. 2007. Effect of exogenous mevalonic acid on sterol lipid classes in Larix kaempferi callus. J. Oleo Sci. 56 (1), 25–28.
Cunha A., Fernandes Ferreira M. 1997. Differences in free sterols content and composition associated with somatic embryogenesis, shoot organogenesis and calli growth of flax. Plant Sci. 124, 97–105.
Meena A., Renu S. 2014. Phytochemical screening of sterols extracted from Cichorium intybus in vivo and in vitro. J. Pharm. Pharm. Sci. 3 (2), 1349–1360.
Banas A., Carlsson A.S., Huang B., Lenman M., Banas W., Lee M., Noiriel A., Benveniste P., Schaller H., Bouvier-Nave P., Stymne S. 2005. Cellular sterol ester synthesis in plant is performed by an enzyme (Phospholipid: sterol acylttransferase) different from the yeast and mammalian acyl-CoA: sterol acyltransferases. J. Biol. Chem. 280 (41), 34 626–34 634.
Bailey R.B., Parks L.W. 1975. Yeast sterol esters and their relationship to the growth of yeast. J. Bacteriol. 124 (2), 606–612.
Radwan S.S., Spenser F., Mangold H.K. 1975. Lipids in plant tissue cultures IV. The characteristic patterns of lipid classes in callus cultures and suspension cultures. Chem. Phys. Lipids. 14, 72–80.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии