Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 3, стр. 224-234
Влияние тебуконазола и тебуконазол-содержащего препарата “Бункер” на функционирование митохондрий озимой пшеницы
Т. П. Побежимова a, А. В. Корсукова a, *, О. А. Боровик a, Н. С. Забанова a, b, Н. В. Дорофеев a, О. И. Грабельных a, b, В. К. Войников a
a Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, Россия
b Иркутский государственный университет
664033 Иркутск, Россия
* E-mail: avkorsukova@gmail.com
Поступила в редакцию 27.05.2019
После доработки 07.07.2019
Принята к публикации 13.08.2019
Аннотация
В работе изучено функционирование митохондрий из побегов незакаленных и закаленных (2°С, 7 сут) этиолированных проростков озимой пшеницы (Triticum aestivum L., сорт Иркутская), выращенных из семян, обработанных тебуконазол-содержащим протравителем “Бункер” (1.5 мкл/г семян), и проростков, выращенных на растворе тебуконазола (1 мМ). Показано, что в контрольных температурных условиях (24°С) тебуконазол снижает скорость окисления малата, ингибируя цитохромный путь (ЦП) дыхания, в то время как препарат “Бункер” неспецифически ингибирует скорость переноса электронов по электронтранспортной цепи (ЭТЦ) и блокирует как ЦП, так и альтернативный (АП) пути дыхания. При холодовом закаливании тебуконазол вызывает усиление окислительной активности митохондрий, увеличивая потенциальную (максимально возможную) активность АП, главным образом, при окислении малата, а препарат “Бункер” снижает скорость окисления NADH, ингибируя ЦП. Сделано предположение, что влияние промышленного препарата “Бункер” на дыхание растений опосредовано не только входящим в состав тебуконазолом, но и вспомогательными соединениями.
ВВЕДЕНИЕ
Изменяющиеся условия внешней среды оказывают существенное влияние на клеточный метаболизм растений, при этом клеточное дыхание представляет собой важное звено в механизмах устойчивости к действию экстремальных факторов, в том числе к неблагоприятным низким температурам. Процесс окислительного фосфорилирования, локализованный в митохондриях, является конечным этапом клеточного дыхания, от эффективности функционирования которого зависит адаптация растений к низкой температуре. Переход растений в состояние покоя и формирование устойчивости к неблагоприятным низким температурам сопровождается ингибированием процессов дыхания [1, 2]. Митохондрии участвуют в механизмах адаптации растений, при этом в развитие холодо- и морозоустойчивости вовлечены митохондриальные энергорассеивающие системы, в том числе цианидрезистентная альтернативная оксидаза (АО) [3, 4]. Активация АО происходит не только при действии низких температур на растения, но и в ответ на действие других неблагоприятных факторов абиотической и биотической природы [5, 6]. Возможная функциональная роль АО при низкой температуре состоит в регуляции образования активных форм кислорода (АФК), термогенезе, поддержании дыхания в условиях ограничения активности цитохромоксидазы, регуляции соотношения NAD(P)H/NAD(P)+ и др. [5–9].
Известно, что фунгициды, в том числе триазольной природы, являются ингибиторами митохондриального дыхания, и их действие направлено на комплекс I ЭТЦ митохондрий [10]. Ранее нами было показано, что применяемые в сельском хозяйстве протравители семян триазольной природы вызывают у растений эффект, сходный с холодовым закаливанием. Так, обработка семян тебуконазол-содержащим протравителем “Бункер” сопровождалась снижением ростовых процессов [11], увеличением содержания сахаров [12], синтезом дегидринов [11], повышением ненасыщенности жирных кислот [13, 14] у проростков злаков. Эти физиологические и биохимические изменения приводили к повышению холодо- и морозоустойчивости злаков [11–14]. Можно предположить, что в механизмах повышения устойчивости растений к низкой температуре под действием тебуконазол-содержащего протравителя, участвуют митохондрии, а тебуконазол, входя в состав протравителя, влияет на их функциональную активность и активность альтернативной оксидазы.
В связи с этим цель работы – исследовать влияние тебуконазола и тебуконазол-содержащего протравителя на функционирование митохондрий озимой пшеницы в контрольных условиях и при холодовом закаливании и определить возможные изменения потенциальной (максимально возможной) активности альтернативной оксидазы в этих условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Подготовка растительного материала. В экспериментах использовали побеги 3-суточных этиолированных проростков озимой пшеницы (Triticum aestivum L., сорт Иркутская), выращенных при 24°С из семян, обработанных тебуконазол-содержащим препаратом “Бункер” (содержание тебуконазола в препарате 60 г/л), или выращенных на растворе тебуконазола (1-(4-хлорфенил)-4,4-диметил-3-(1H-1,2,4-триазол-1-илметил)-3-пентанол), и проростки этих вариантов после закаливания при 2°С в течение 7 сут. Подготовку растительного материала проводили следующим образом: семена промывали мыльным раствором, замачивали на 20–25 мин в 0.1% растворе перманганата калия и затем тщательно отмывали и просушивали. Обработку семян водным раствором препарата “Бункер” в дозе 1.5 мкл препарата на грамм семян проводили непосредственно перед их проращиванием. Необработанные и обработанные протравителем семена проращивали в течение 3 сут на влажной фильтровальной бумаге на воде в темноте при 24°С в инкубаторе MIR-154 “Sanyo” (Япония). На вторые сутки роста воду из одной части кювет с проростками из необработанных протравителем семян заменяли 1 мМ раствором тебуконазола и продолжали выращивать проростки еще в течение суток (до трехсуточного возраста) в темноте при 24°С. Затем раствор сливали, проростки промывали водой и использовали в эксперименте или подвергали закаливанию. Холодовое закаливание трехсуточных этиолированных проростков трех вариантов (проростки из необработанных протравителем семян, проростки из семян, обработанных препаратом “Бункер”, и проростки, выращенные на растворе тебуконазола) проводили при 2°С в течение 7 сут в камере тепла/холода MKT-240 “Binder” (Германия) в темноте в кюветах на влажной фильтровальной бумаге. Всего было исследовано 6 вариантов проростков: Контроль – контрольные проростки (24°С, 3 сут); Тебуконазол – проростки, обработанные 1 мМ тебуконазолом (24°С, 3 сут); Препарат “Бункер” – проростки из семян, обработанных 1.5 мкл/г “Бункером” (24°С, 3 сут); Холодовое закаливание – закаленные при +2°С (7 сут) проростки варианта Контроль; Тебуконазол + + Холодовое закаливание – закаленные при +2°С (7 сут) проростки варианта Тебуконазол; Препарат “Бункер” + Холодовое закаливание – закаленные при +2°С (7 сут) проростки варианта Препарат “Бункер”.
Выделение митохондрий. Митохондрии выделяли из побегов озимой пшеницы всех вариантов проростков с помощью дифференциального центрифугирования по методике, опубликованной ранее [15], используя среду гомогенизации, содержащую 300 мМ сахарозы, 40 мM MOPS-КОН (рН 7.36), 10 мМ KCl, 2 мМ EDTA, 1 мM MgCl2, 0.5% цистеина, 0.1% бычьего сывороточного альбумина – BSA. Гомогенат центрифугировали при 4°С в течение 4 мин при 5000 g, полученный супернатант центрифугировали 3 мин при 15 000 g для осаждения митохондрий. Осажденные митохондрии промывали средой выделения без цистеина, повторно осаждали при 15 000 g в течение 3 мин ресуспендировали в среде того же состава до концентрации белка 10–12 мг/мл и хранили на льду.
Полярографический анализ. Скорость дыхания митохондрий определяли кислородным электродом Кларка, используя полярограф Oxytherm system “Hansatech Inst.” (Англия) в ячейке объемом 1.4 мл. Реакционная среда содержала 300 мМ сахарозы, 18 мМ КН2РО4 (рН 7.36), 1 мМ МgСl2, 5 мМ EDTA. Анализ активности митохондрий проводили с субстратами, при окислении которых в транспорте электронов участвовали отдельные, заранее известные комплексы ЭТЦ. Были использованы следующие субстраты: 10 мМ малат + 10 мМ глутамат (транспорт электронов начинается с комплекса I ЭТЦ); 8 мМ сукцинат + + 5 мМ глутамат (транспорт электронов начинается с комплекса II ЭТЦ); 1 мМ NADH (поток электронов проходит по участку ЭТЦ “внешняя” NADH-дегидрогеназа – комплекс III – убихинон – комплекс IV) и 2 мМ аскорбат + 0.2 мМ тетраметил-п-фенилендиамин (TMPD) – аскорбат в присутствии TMPD является эффективным искусственным донором электронов, которые через цитохром с подаются в комплекс IV, минуя другие комплексы [16]. При использовании в качестве субстратов окисления сукцината и NADH транспорт электронов в комплексе I блокировали добавлением в реакционную среду 3 мкМ ротенона. При окислении NADH из состава среды инкубации исключали EDTA и для активации “внешней” ротенон-нечувствительной NADH-дегидрогеназы включали 0.06 мМ CaCl2 [17]. Максимальную скорость окисления субстратов измеряли в присутствии 50–200 мкМ ADP.
На основе полярограмм рассчитывали скорость поглощения кислорода в метаболическом состоянии 3 (V3, скорость фосфорилирующего дыхания), скорость поглощения кислорода в метаболическом состоянии 4 (V4, скорость нефосфорилирующего дыхания), коэффициент дыхательного контроля по Чансу–Вильямсу (КДК = = V3/V4) и отношение ADP/О [18]. Концентрацию митохондриального белка определяли по методу [19]. Для ингибирования цитохромного пути (ЦП) использовали 0.4 мМ KCN (ингибитор цитохром c оксидазы), для ингибирования альтернативного пути (АП) – 1 мМ бензгидроксамовую кислоту (BHAM, ингибитор альтернативной цианидрезистентной оксидазы), которые добавляли в фосфорилирующем состоянии (V3). Активность ЦП рассчитывали, как дыхание, ингибируемое KCN, а активность АП, связанного с функционированием альтернативной оксидазы (АО), как дыхание, ингибируемое BHAM в присутствии KCN (цианидрезистентное дыхание, чувствительное к BHAM, или потенциальная (максимально возможная) активность АП). За 100% принимали скорость поглощения кислорода митохондриями в состоянии 3 до добавления ингибиторов (отдельно для каждого субстрата окисления).
Статистический анализ. Статистическую обработку данных осуществляли с помощью программного пакета SigmaPlot 12.5. Эксперименты проводили не менее чем в 3-кратной повторности. Данные диаграмм и таблиц представлены в виде среднего арифметического (M) и стандартного отклонения (± S.D.) или в виде медианы (Me) и интерквартильной широты [25%; 75% процентиль]. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. В случае нормального распределения для доказательства наличия значимых различий между средними значениями применяли однофакторный дисперсионный анализ с последующим множественным сравнением средних по методу LSD Фишера (данные представлены на рисунке в виде M ± S.D. и в табл. 1 и 2 применительно к активности ЦП и АП в виде М). Для доказательства наличия значимых различий при распределении отличном от нормального использовали H-критерий Краскела–Уоллиса (данные представлены в табл. 1 и 2 (V3, V4, КДК, ADP/O) в виде Me [25%; 75%]). Различия между экспериментальными данными считали статистически значимыми при p ≤ 0.05.
Таблица 1.
Влияние тебуконазола и тебуконазол-содержащего препарата “Бункер” на скорость окисления различных субстратов в метаболических состояниях 3 (V3) и 4 (V4), коэффициент ДК (КДК) и отношение ADP/О и активность цитохромного (ЦП) и альтернативного (АП) путей в митохондриях из побегов этиолированных проростков озимой пшеницы, выращенных при 24°С
| Субстрат окисления |
V3 | V4 | КДК | ADP/O | Активность пути, % | |
|---|---|---|---|---|---|---|
| нмоль О2/мин/мг белка | ЦП | АП | ||||
| Контроль | ||||||
| Малат | 56.46 [53.08; 60.03] |
18.96 [17.11; 22.00] |
3.12 [2.40; 3.41] |
2.79 [2.51; 3.01] |
69 | 31 |
| Сукцинат | 67.89 [65.50; 71.39] |
35.47 [31.59; 38.30] |
2.03 [1.71; 2.14] |
1.98 [1.73; 2.11] |
82 | 18 |
| NADH | 75.0 [73.9; 80.3] |
68.21 [62.63; 72.89] |
1.13 [1.07; 1.18] |
0.77 [0.50; 0.93] |
89 | 11 |
| Аскорбат | 90.2 [87.5; 92.6] |
70.81 [63.76; 72.05] |
1.31 [1.26; 1.39] |
0.83 [0.76; 0.95] |
100 | 0 |
| Тебуконазол | ||||||
| Малат | 34.61* [32.15; 37.62] |
18.23* [15.26; 19.85] |
1.92* [1.73; 2.07] |
2.64 [2.48; 2.85] |
37* | 31 |
| Сукцинат | 54.91 [47.31; 65.56] |
30.74 [27.66; 34.39] |
1.81 [1.67; 1.93] |
1.62 [1.46; 1.79] |
67* | 23* |
| NADH | 73.31 [66.68; 81.90] |
52.56 [45.02; 67.91] |
1.40 [1.20; 1.51] |
0.81 [0.79; 0.87] |
78* | 12 |
| Аскорбат | 85.08 [81.63; 92.40] |
67.98 [57.31; 70.14] |
1.32 [1.20; 1.49] |
0.79 [0.76; 1.21] |
100 | 0 |
| Препарат “Бункер” | ||||||
| Малат | 40.36* [35.40; 42.43] |
14.65* [13.93; 15.95] |
2.74* [2.16; 2.94] |
2.84 [2.68; 3.15] |
62 | 19 |
| Сукцинат | 48.76* [43.96; 49.82] |
22.16* [17.05; 25.2] |
2.20* [1.86; 2.74] |
2.01 [1.61; 2.10] |
50* | 10* |
| NADH | 49.19* [48.06; 53.46] |
43.80* [42.00; 46.04] |
1.14 [1.12; 1.16] |
0.85 [0.47; 0.96] |
59* | 5* |
| Аскорбат | 50.28* [43.94; 53.28] |
40.20* [35.20; 44.28] |
1.25 [1.14; 1.32] |
1.05 [0.93; 1.18] |
57* | 0 |
Примечание. Контроль – митохондрии, изолированные из побегов 3-суточных проростков, выращенных из необработанных семян при 24°С; Тебуконазол – митохондрии, изолированные из побегов 3-суточных проростков, выращенных при 24°С в течение 2 сут в отсутствие обработок и 1 сут на растворе 1 мМ тебуконазола; Препарат “Бункер” – митохондрии, изолированные из побегов 3-суточных проростков, выращенных из семян, обработанных препаратом “Бункер” (1.5 мкл/г семян) при 24°С. За 100% при расчете активности АП и ЦП принята скорость поглощения кислорода митохондриями варианта Контроль в состоянии 3 до добавления ингибиторов отдельно для каждого субстрата окисления. * – указаны обнаруженные статистически значимые различия (p ≤ 0.05, n = 4) с вариантом Контроль при использовании определенного субстрата.
Таблица 2.
Влияние тебуконазола и тебуконазол-содержащего препарата “Бункер” на скорость окисления различных субстратов в метаболических состояниях 3 (V3) и 4 (V4), коэффициент ДК (КДК), отношение ADP/О и активность цитохромного (ЦП) и альтернативного (АП) путей в митохондриях из побегов закаленных (+2°С, 7 сут) этиолированных проростков озимой пшеницы
| Субстрат окисления |
V3 | V4 | КДК | ADP/O | Активность пути, % | |
|---|---|---|---|---|---|---|
| нмоль О2/мин/мг белка | ЦП | АП | ||||
| Холодовое закаливание | ||||||
| Малат | 35.82 [33.18; 40.21] |
12.58 [11.41; 16.11] |
2.59 [2.41; 3.10] |
2.56 [2.34; 2.60] |
64 | 36 |
| Сукцинат | 46.01 [44.17; 48.21] |
26.86 [25.00; 29.06] |
1.72 [1.61; 1.86] |
1.71 [1.20; 2.11] |
79 | 21 |
| NADH | 60.16 [49.11; 62.66] |
48.78 [42.79; 53.67] |
1.15 [1.12; 1.18] |
0.94 [0.75; 0.99] |
96 | 4 |
| Аскорбат | 57.34 [55.81; 64.97] |
43.69 [39.62; 54.00] |
1.29 [1.18; 1.45] |
0.95 [0.87; 1.23] |
100 | 0 |
| Тебуконазол + Холодовое закаливание | ||||||
| Малат | 41.66 [36.98; 43.68] |
14.77 [14.03; 15.53] |
2.78 [2.61; 2.96] |
2.77 [2.50; 2.94] |
67 | 49* |
| Сукцинат | 49.16 [46.14; 52.87] |
28.60 [27.36; 29.53] |
1.73 [1.66; 1.80] |
1.77 [1.69; 2.09] |
81 | 28* |
| NADH | 63.18 [56.74; 68.88] |
53.45 [46.94; 60.70] |
1.17 [1.14; 1.21] |
1.11 [0.97; 1.27] |
108* | 9* |
| Аскорбат | 66.59 [56.03; 70.97] |
56.45 [41.95; 58.91] |
1.25 [1.15; 1.39] |
0.96 [0.84; 1.18] |
100 | 0 |
| Препарат “Бункер” + Холодовое закаливание | ||||||
| Малат | 35.22 [30.94; 42.74] |
15.68 [13.28; 17.47] |
2.69 [1.90; 2.79] |
2.53 [2.35; 3.20] |
66 | 35 |
| Сукцинат | 41.24 [38.72; 55.05] |
24.58 [24.08; 25.13] |
1.71 [1.57; 2.20] |
1.79 [1.36; 1.90] |
75 | 20 |
| NADH | 44.89* [38.84; 50.63] |
37.01* [34.58; 44.12] |
1.17 [1.09; 1.20] |
1.27 [0.91; 1.39] |
86* | 6 |
| Аскорбат | 63.58 [50.74; 69.71] |
45.99 [37.36; 54.94] |
1.31 [1.21; 1.51] |
0.81 [0.62; 1.05] |
101 | 0 |
Примечание: Холодовое закаливание – митохондрии, изолированные из побегов 3-суточных проростков, выращенных при 24°С в течение 2 сут и закаленных при 2°С (в течение 7 сут); Тебуконазол + Холодовое закаливание – митохондрии, изолированные из побегов 3-суточных проростков, выращенных при 24°С в течение 2 сут в отсутствие обработок и 1 сут на растворе 1 мМ тебуконазола и закаленных при 2°С (в течение 7 сут); Препарат “Бункер” + Холодовое закаливание – митохондрии, изолированные из побегов 3-суточных проростков, выращенных из семян, обработанных препаратом “Бункер” (1.5 мкл/г семян) и закаленных при 2°С (в течение 7 сут). За 100% при расчете активности АП и ЦП принята скорость поглощения кислорода митохондриями варианта Холодовое закаливание в состоянии 3 до добавления ингибиторов отдельно для каждого субстрата окисления. * Указаны обнаруженные статистически значимые различия (p ≤ 0.05, n = 4) с вариантом Холодовое закаливание при использовании определенного субстрата.
В работе были использованы следующие реактивы: ADP (натриевая соль), ATP (натриевая соль), глутамат (натриевая соль), KCN, ротенон (Sigma, Германия); MOPS (AppliChem, Германия); NADH (динатриевая соль), цистеин (ICN Biomedicals, Inc., США); BHAM, малат (натриевая соль), тебуконазол (Tebuconazol PESTANAL), TMPD (дигидрохлорид) (Sigma-Aldrich, Германия); BSA (MP Biomedicals Inc., Франция); сукцинат (натриевая соль) (Fluka, Япония); препарат “Бункер” (Август, Россия); EDTA (динатриевая соль) (Amresco, США). Остальные реактивы были отечественного производства квалификации ч. д. а. и х. ч.
РЕЗУЛЬТАТЫ
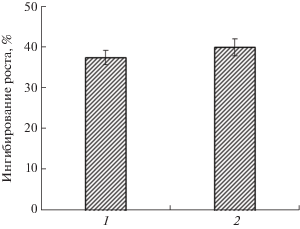
В работе использовали препарат “Бункер” – системный фунгицид (водно-суспензионный концентрат) для протравливания семян профилактического и лечебного действия, а также синтетический тебуконазол (Tebuconazol PESTANAL). Доза препарата “Бункер” (1.5 мкл/г семян) была подобрана в ходе лабораторных исследований по изменению ростовых параметров колеоптилей проростков озимой пшеницы [11]. Концентрация тебуконазола также подбиралась экспериментально: так, тебуконазол в концентрации 1 мМ вызывал ингибирование длины колеоптилей, статистически значимо не отличающееся от ингибирования, которое оказывал препарат “Бункер” в концентрации 1.5 мкл/г семян (рис. 1).
Рис. 1.
Влияние тебуконазола (1) и тебуконазол-содержащего препарата “Бункер” (2) на рост колеоптилей озимой пшеницы. n = 3–4, M ± S.D.
В настоящей работе анализировали последействие тебуконазол-содержащего препарата “Бункер” и тебуконазола на функционирование дыхательной цепи митохондрий озимой пшеницы у проростков, выращенных при 24°С и прошедших холодовое закаливание.
Как известно, ЭТЦ растительных митохондрий содержит четыре классических комплекса – комплекс I (NADH-убихинон оксидоредуктаза), комплекс II (сукцинат-убихинон оксидоредуктаза), комплекс III (убихинол-цитохром с оксидоредуктаза) и комплекс IV (цитохром с оксидаза), а также альтернативные ферменты – ротенон-нечувствительные NAD(P)H-дегидрогеназы (NAD(P)H-ДГ II типа) и цианидрезистентную АО [20]. Используя различные субстраты цикла трикарбоновых кислот и ингибиторы транспорта электронов, можно оценить работу ЭТЦ митохондрий и ее отдельных комплексов.
Свежевыделенные из побегов контрольных проростков митохондрии озимой пшеницы были энергетически активными, с хорошей степенью сопряжения процессов окисления и фосфорилирования (табл. 1). Об эффективности окислительного фосфорилирования в митохондриях свидетельствует то, что значения отношения ADP/О при окислении митохондриями малата и сукцината были близкими к теоретическим (около 3 для малата, 2 для сукцината). Высокая скорость окисления экзогенного NADH указывает на функционирование в митохондриях озимой пшеницы “внешней” NADH-дегидрогеназы. Поток электронов через комплекс IV ЭТЦ (при окислении аскорбата + TMPD) был сопряжен с фосфорилированием (табл. 1).
Обработка проростков тебуконазолом приводила к существенному ингибированию скорости фосфорилирующего дыхания в изолированных из них митохондриях при окислении малата и незначительному снижению скорости нефосфорилирующего дыхания, в результате этого КДК понижался (табл. 1). Значимого влияния обработки на отношение ADP/О при этом не наблюдали. При использовании в качестве субстратов окисления сукцината, NADH и аскорбата + TMPD статистически значимого снижения скоростей поглощения кислорода и изменений в значениях КДК и ADP/О у митохондрий этого варианта не происходило.
В митохондриях, изолированных из побегов проростков, выращенных из семян, обработанных тебуконазол-содержащим препаратом “Бункер”, также наблюдалось значительное снижение скорости фосфорилирующего дыхания при окислении малата (табл. 1). Однако, в отличие от действия тебуконазола, наряду с ингибированием скорости фосфорилирующего дыхания, происходило значимое снижение и скорости нефосфорилирующего дыхания митохондрий, что не сопровождалось таким сильным снижением КДК, как в митохондриях из обработанных тебуконазолом проростков. При окислении митохондриями других используемых субстратов (сукцината, NADH, аскорбата + TMPD) наблюдали ингибирование скоростей фосфорилирующего и нефосфорилирующего дыхания, при этом снижения КДК не наблюдали (табл. 1).
Поскольку тебуконазол и протравитель “Бункер” оказывали влияние на окислительную активность митохондрий озимой пшеницы, было изучено изменение активности ЦП и АП дыхания в митохондриях после обработки данными препаратами. Анализ проводили с помощью последовательного добавления к митохондриям ингибиторов цитохромного (KCN) и альтернативного (BHAM) путей транспорта электронов. Потенциальная активность альтернативного пути в митохондриях, изолированных из контрольных проростков, составляла 31% при окислении малата, 18% при окислении сукцината, 11% при окислении NADH (табл. 1). Более высокая активность АП при окислении митохондриями малата и сукцината ранее наблюдалась и в других работах [4], и было предположено, что это связано с тем, что при окислении малата или сукцината образуется пируват, который, как известно, является активатором АО [21, 22].
Тебуконазол не оказывал влияния на потенциальную активность АП в митохондриях озимой пшеницы, но при этом значительно снижалось цианидчувствительное дыхание при окислении митохондриями малата. Следует отметить, что на фоне сниженного дыхания по цитохромному пути доля АП в дыхании митохондрий возросла более чем в 1.4 раза. В то же время тебуконазол оказывал лишь незначительное влияние на активность ЦП в митохондриях при окислении ими сукцината и NADH, а на потенциальную активность АП не оказывал никакого влияния (табл. 1). При окислении митохондриями аскорбата + + TMPD значимых различий в активности ЦП между контрольными проростками и проростками, обработанными 1 мМ тебуконазолом, не обнаружено.
Обработка семян препаратом “Бункер” снижала как активность цитохромного, так и альтернативного путей дыхания независимо от используемого субстрата окисления (табл. 1). Из полученных данных следует, что тебуконазол ингибирует транспорт электронов через комплекс I ЭТЦ, при этом на фоне ингибирования цитохромного пути доля АП в общем дыхании митохондрий возрастает. В свою очередь, препарат “Бункер” в отличие от тебуконазола ингибирует перенос электронов как по ЦП, так и по АП.
Озимые злаки в природных условиях до перезимовки проходят осеннее закаливание, в результате чего возрастает их холодо- и морозоустойчивость. В связи с этим в следующей части работы представлен анализ действия тебуконазола и тебуконазол-содержащего протравителя на функционирование митохондрий, изолированных из побегов проростков озимой пшеницы, прошедших закаливание.
Холодовое закаливание контрольных проростков озимой пшеницы сопровождалось снижением скоростей как фосфорилирующего, так и нефосфорилирующего дыхания в изолированных из них митохондриях независимо от используемых субстратов окисления (табл. 1, 2). При этом снижение скоростей дыхания (более экономное поглощение кислорода при низкой температуре) не приводило к существенному изменению эффективности окислительного фосфорилирования – наблюдалось только незначительное снижение величин КДК и/или ADP/О при окислении малата и сукцината (табл. 1, 2). Изменения в окислительной активности митохондрий при закаливании проростков были связаны с некоторым повышением потенциальной активности АП при окислении малата и сукцината (табл. 1, 2).
В отличие от контрольных проростков в ответ на холодовую обработку проростков озимой пшеницы, предварительно обработанных тебуконазолом, снижения скорости фосфорилирующего дыхания (V3) в изолированных из них митохондриях при окислении малата не наблюдали, наоборот, она увеличивалась (табл. 2). В этих условиях на фоне сниженной скорости нефосфорилирующего дыхания происходило увеличение значения КДК (примерно на 45%). При окислении других субстратов повышения степени сопряжения окислительного фосфорилирования в митохондриях не детектировали. В сравнении с митохондриями закаленных необработанных проростков для митохондрий из проростков, обработанных перед закаливанием тебуконазолом, было характерно некоторое повышение скоростей дыхания, особенно при окислении малата и аскорбата. При этом увеличение скоростей дыхания митохондрий значимо не отразилось на значениях КДК и ADP/О. По сравнению с необработанными проростками в закаленных проростках, обработанных тебуконазолом, активность АП была больше. При окислении митохондриями малата и сукцината активность ЦП не изменялась, а при окислении NADH увеличивалась (табл. 2).
Митохондрии, выделенные из закаленных проростков озимой пшеницы, выращенных из обработанных препаратом “Бункер” семян, имели более низкие скорости дыхания, чем до закаливания проростков, за исключением дыхания на аскорбате + TMPD (табл. 1, 2). Сопряженность процессов окисления и фосфорилирования в митохондриях почти не изменялась независимо от субстрата. Следует заметить, что скорость окисления NADH митохондриями из закаленных проростков, выращенных из семян, обработанных препаратом “Бункер”, была гораздо ниже, чем в митохондриях из закаленных необработанных проростков, в то время как скорости окисления малата, сукцината и аскорбата были сходными (табл. 2). Это можно объяснить ингибированием активности внешней ротенон-нечувствительной NADH-дегидрогеназы компонентами препарата “Бункер” как в контрольных условиях (табл. 1), так и при действии низкой температуры (табл. 2). Других значительных изменений в параметрах окислительного фосфорилирования митохондрий озимой пшеницы, изолированных из закаленных проростков, выращенных из семян, обработанных препаратом “Бункер”, не было выявлено. Нами также обнаружено, что окислительная активность митохондрий данного варианта опыта была ниже, чем в митохондриях из закаленных проростков озимой пшеницы, предварительно обработанных тебуконазолом (табл. 2). При оценке активности ЦП и АП при закаливании установлено, что, в отличие от действия тебуконазола, обработка препаратом “Бункер” не вызывала изменений в потоке электронов по цитохромному и альтернативному путям, за исключением ингибирования ЦП при окислении NADH (табл. 2).
ОБСУЖДЕНИЕ
Известно, что многие пестициды помимо своего основного целевого воздействия оказывают на растения дополнительные побочные эффекты. Это выражается не только в различной степени фитотоксических проявлений, но и в стимулирующих и рострегулирующих воздействий. Знание о направленности и силе этих воздействий позволит более грамотно применять химические средства защиты растений, получая дополнительный положительный эффект и позволит избежать отрицательного действия препарата. В настоящей работе исследовано влияние тебуконазола и тебуконазол-содержащего протравителя на функционирование митохондрий озимой пшеницы в контрольных условиях и при холодовом закаливании и определены возможные изменения потенциальной (максимально возможной) активности альтернативной оксидазы в этих условиях.
Показано, что обработка проростков озимой пшеницы тебуконазолом, как и обработка семян тебуконазол-содержащим препаратом “Бункер”, эффективно ингибировала скорость фосфорилирующего дыхания у митохондрий при окислении ими малата (табл. 1). В связи с этим можно говорить о том, что последействие тебуконазола в митохондриях направлено в большей мере на транспорт электронов через комплекс I ЭТЦ. На это также указывают данные об отсутствии ингибирующего действия тебуконазола на окисление митохондриями сукцината и NADH. Полученные результаты согласуются с имеющимися в литературе данными о влиянии системных фунгицидов (витавакса, плантвакса и байлетона – производное 1,2,4-триазола) на дыхание корней проростков пшеницы [10]. Как было показано авторами, фунгициды оказывают ингибирующий эффект на дыхание корней, связанный с их влиянием на ЭТЦ митохондрий, при этом не затрагивается гликолиз и цикл Кребса. Действие фунгицидов было аналогично действию ротенона (ингибитору комплекса I ЭТЦ) – как и в случае с ротеноном, ингибирование снималось витамином К3, что позволило авторам предположить, что фунгициды действуют на комплекс I ЭТЦ митохондрий растений. Анализ полученных нами результатов позволяет полагать, что присутствие тебуконазола как действующего вещества в составе протравителя “Бункер” обуславливает его ингибирующее действие на скорость дыхания митохондрий озимой пшеницы при транспорте электронов через комплекс I ЭТЦ (субстрат окисления малат). В то же время в отличие от действия тебуконазола препарат “Бункер”, ингибируя окисление митохондриями таких субстратов, как сукцинат, NADH и аскорбат, оказывал влияние и на транспорт электронов через комплексы II, III и IV ЭТЦ растительных митохондрий. По-видимому, неспецифическое действие препарата “Бункер” на скорость поглощения кислорода митохондриями связано с влиянием вспомогательных соединений, присутствующих в составе препарата.
В природных условиях озимые злаки до перезимовки проходят осеннее закаливание, что позволяет им переживать неблагоприятные условия зимнего периода [1, 2]. Полученные в настоящей работе результаты показали, что после холодового закаливания проростков озимой пшеницы у изолированных из этих проростков митохондрий происходило снижение скоростей как фосфорилирующего, так и нефосфорилирующего дыхания независимо от используемых субстратов окисления. Такие изменения в окислительной активности митохондрий после действия низких температур на проростки озимой пшеницы ранее были отмечены другими авторами [23, 24]. Однако митохондрии озимой пшеницы из закаленных при низкой положительной температуре проростков оставались энергетически активными, что является необходимым условием эффективного закаливания и позволяет обеспечивать клетку энергией для синтеза стрессовых белков и других защитных макромолекул. У пшеницы идентифицированы два гена, кодирующих AO, – AOX1a и AOX1c, содержание транскриптов которых возрастает при закаливании к холоду [25]. Нами ранее было показано, что в начальный период холодового закаливания этиолированных проростков озимой пшеницы одновременно с индукцией экспрессии гена AOX1c происходит усиление экспрессии генов ATP6 и NAD7, продукты которых играют ведущую роль при функционировании ATP-синтазы и комплекса I ЭТЦ, соответственно [4]. Такой скоординированный характер экспрессии данных генов предполагает, что функционирование АО при окислении малата митохондриями в условиях холодового закаливания, по-видимому, позволяет поддерживать Δψ на внутренней митохондриальной мембране за счет пункта сопряжения в комплексе I ЭТЦ, на что указывали в своих работах и другие авторы [26, 27].
Что касается функционирования митохондрий, изолированных из закаленных проростков, обработанных тебуконазолом, то более высокие скорости окисления субстратов и увеличение активности АП дыхания (табл. 2) свидетельствуют о возможной защитной роли тебуконазола в механизмах устойчивости растительной клетки к низкой температуре, связанной с поддержанием синтеза ATP для обеспечения синтетических процессов в клетке при закаливании. В то же время окислительная активность митохондрий, выделенных из закаленных проростков озимой пшеницы, выращенных из обработанных препаратом “Бункер” семян, была ниже, чем до закаливания проростков, и ниже активности митохондрий из закаленных проростков озимой пшеницы, предварительно обработанных тебуконазолом (табл. 2).
Таким образом, тебуконазол и тебуконазол-содержащий препарат “Бункер” оказывают влияние на функционирование митохондрий озимой пшеницы как при обычной температуре выращивания, так и при закаливании, но их действие различно. Тебуконазол и тебуконазол-содержащий препарат “Бункер” оказывают различное влияние не только на окислительную активность митохондрий, но и на изменение потока электронов по цитохромному и альтернативному путям транспорта. Их действие на скорость окисления субстратов митохондриями зависит от температуры, при которой росли проростки. Учитывая, что препарат “Бункер” и тебуконазол оказывают ростингибирующее действие на проростки озимой пшеницы (рис. 1) и при этом митохондрии, изолированные из таких проростков, выращенных в контрольных условиях, обладают сниженным дыханием, можно полагать, что такое изменение носит адаптивный характер и направлено на снижение расходования субстратов дыхания и повышение холодоустойчивости. При этом транспорт электронов по альтернативному пути через АО под действием тебуконазола не ингибируется, что может быть важным для предотвращения развития окислительного стресса в митохондриях при низкой температуре [3, 28]. При холодовом закаливании реализуется другой механизм действия тебуконазола, направленный на поддержание скоростей дыхания митохондрий на более высоком уровне за счет активации АО, функциями которой в период низкотемпературной адаптации может быть поддержание синтеза ATP для обеспечения синтетических процессов в клетке, а также предотвращение развития окислительного стресса. Так, у митохондрий холодозакаленных проростков, предварительно обработанных тебуконазолом, активность АП была выше, чем у митохондрий из закаленных необработанных проростков и выращенных из семян, обработанных препаратом “Бункер”. Кроме того, при окислении NADH у митохондрий этого варианта проростков цианидчувствительное дыхание увеличилось. Эти изменения значимо увеличили суммарное дыхание (сумму ЦП и АП) в митохондриях из проростков, обработанных тебуконазолом до закаливания, при окислении малата, сукцината и NADH (табл. 2). В отличие от этого у митохондрий, изолированных из закаленных проростков, выращенных из семян, обработанных препаратом “Бункер”, сумма активностей ЦП и АП была равна 100% при окислении малата и сукцината, а при окислении NADH эта сумма была меньше 100%. По-видимому, это связано с тем, что в ответ на закаливание у митохондрий этого варианта скорости окисления снизились до скоростей дыхания митохондрий необработанных закаленных проростков, при этом активность ЦП дыхания была такой же, как у этих проростков (за исключением NADH). Эти результаты свидетельствуют, что процесс холодового закаливания у проростков озимой пшеницы, выращенных из обработанных препаратом “Бункер” семян, прошел успешно, и, как ранее нами было уже показано, морозоустойчивость таких проростков выше по сравнению с необработанными [11].
На основании полученных данных можно заключить, что тебуконазол, изменяя окислительную активность митохондрий и активность альтернативного пути дыхания, запускает механизм повышения устойчивости растений к низкой температуре. В составе протравителя “Бункер” действие тебуконазола, обусловленное его влиянием на транспорт электронов через комплекс I ЭТЦ, сохраняется, однако к нему добавляется неспецифическое ингибирующее действие на скорость поглощения кислорода митохондриями вспомогательных соединений, присутствующих в препарате, – загустителей, красителей, прилипателя и др. Какие из этих компонентов влияют на транспорт электронов в ЭТЦ митохондрий растений, еще предстоит выяснить.
Работа выполнена с использованием коллекций ЦКП “Биоресурсный центр” и оборудования ЦКП “Биоаналитика” Сибирского института физиологии и биохимии растений СО РАН (г. Иркутск).
Список литературы
Трунова Т.И. 2007. Растение и низкотемпературный стресс. М.: Наука. 54 с.
Титов Ф.Ф., Таланова В.В. 2011. Локальное действие высоких и низких температур на растения. Петрозаводск: Карельский научный центр РАН. 166 с.
Грабельных О.И., Побежимова Т.П., Павловская Н.С., Королева Н.А., Боровик О.А., Любушкина И.В., Войников В.К. 2011. Антиоксидантная функция альтернативной оксидазы в митохондриях озимой пшеницы при холодовом закаливании. Биол. мембраны. 28 (4), 274–283.
Грабельных О.И., Боровик О.А., Таусон Е.Л., Побежимова Т.П., Катышев А.И., Павловская Н.С., Королева Н.А., Любушкина И.В., Башмаков В.Ю., Попов В.Н., Боровский Г.Б., Войников В.К. 2014. Митохондриальные энергорассеивающие системы (альтернативная оксидаза, разобщающие белки и “внешняя” NADH-дегидрогеназа) вовлечены в развитие морозоустойчивости проростков озимой пшеницы. Биохимия. 79 (6), 645–660.
Vanlerberghe G.C. 2013. Alternative oxidase: A mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abiotic and biotic stress in plants. Int. J. Mol. Sci. 14, 6805–6847.
Del-Saz N.F., Ribas-Carbo M., McDonald A.E., Lambers H., Fernie A.R., Florez-Sarasa I. 2018. An in vivo perspective of the role(s) of the alternative oxidase pathway. Trends Plant Sci. 23 (3), 206–219.
Finnegan P.M., Soole K.L., Umbach A. 2004. Alternative mitochondrial electron transport proteins in the higher plants. In: Plant mitochondria: from genome to function. Eds Day D.A., Millar A.H., Whelan J. Dordrecht: Kluwer Academic Publishers, p. 163–230.
Грабельных О.И. 2005. Энергетические функции растительных митохондрий в стрессовых условиях. Журн. стресс-физиол. и биохим. 1 (1), 37–54.
Lambers H., Robinson A., Ribas-Carbo M. 2005. Regulation of respiration in vivo. In: Plant respiration: from cell to ecosystem. Eds Lambers H., Ribas-Carbo M. Hamburg: Springer, p. 1–15.
Сафина-Осташевская Г.Ф., Гордон Л.Х. 1984. Действие фунгицидов на дыхательный газообмен корней пшеницы. Физиол. растений. 31 (5), 896–901.
Korsukova A.V., Borovik O.A., Grabelnych O.I., Voini-kov V.K. 2015. The tebuconazole-based protectant of seeds “Bunker” induces the synthesis of dehydrins during cold hardening and increases the frost resistance of wheat seedlings. J. Stress Physiol. Biochem. 11 (4), 118–127.
Корсукова А.В., Грабельных О.И., Боровик О.А., Дорофеев Н.В., Побежимова Т.П., Войников В.К. 2016. Влияние обработки семян тебуконазолом на содержание сахаров и морозоустойчивость проростков озимых пшеницы и ржи. Агрохимия. 7, 52–58.
Korsukova A.V., Gornostai T.G., Grabelnych O.I., Dorofeev N.V., Pobezhimova T.P., Sokolova N.A., Dudareva L.V., Voinikov V.K. 2016. Tebuconazole regulates fatty acid composition of etiolated winter wheat seedlings. J. Stress Physiol. Biochem. 12 (2), 72–79.
Корсукова А.В., Горностай Т.Г., Грабельных О.И., Дорофеев Н.В., Побежимова Т.П., Дударева Л.В., Войников В.К. 2018. Жирнокислотный состав проростков озимых и яровых злаков после обработки семян тебуконазол-содержащим препаратом бункер. Агрохимия. 11, 70–76.
Побежимова Т.П., Колесниченко А.В., Грабельных О.И. 2004. Методы изучения митохондрий растений. Полярография и электрофорез. М.: ООО “НПК Промэкобезопасность”, 98 с.
Grabelnych O.I., Pobezhimova T.P., Kolesnichenko A.V., Voinikov V.K. 2001. Complex I of in winter wheat mitochondria respiratory chain is the most sensitive to uncoupling action of plant stress related uncoupling protein CSP 310. J. Thermal Biol. 26 (1), 47–53.
Møller I.M., Johnston S.P., Palmer J.M. 1981. A specific role for Ca2+ in the oxidation of exogenous NADH by Jerusalem-artichoke (Helianthus tuberosus) mitochondria. Biochem. J. 194 (2), 487–495.
Estabrook R.W. 1967. Mitochondrial respiratory control and the polarographic measurement of ADP : O ratio. Methods in Enzymology. 10, 41–47.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. 1951. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193 (1), 265–275.
Møller I.M. 2007. Mitochondrial electron transport and oxidative stress. Plant Mitochondria. Annual Plant Reviews. 31, 185–211.
Millar A.H., Wiskich J.T., Whelan J., Day D.A. 1993. Organic acid activation of the alternative oxidase of plant mitochondria. FEBS Lett. 329, 259–262.
Day D.A., Millar A.H., Wiskich J.T., Whelan J. 1994. Regulation of alternative oxidase activity by pyruvate in soybean mitochondria. Plant Physiol. 106, 1421–1427.
Нарийчук Ф.Д., Бабенко В.И. 1981. Изменение функциональной активности митохондрий проростков озимой пшеницы в процессе закаливания. Физиол. и биохим. культ. растений. 13 (6), 582–586.
Хохлова Л.П., Кучеренкова Н.Н., Абдрахимова Й.Р. 1993. Сезонные изменения митохондрий у закаленных и незакаленных к холоду растений озимой пшеницы. Физиол. растений. 40 (4), 607–612.
Mizuno N., Sugie A., Kobayashi F., Takumi S. 2008. Mitochondrial alternative pathway is associated with development of freezing tolerance in common wheat. Plant Physiol. 165, 462–467.
Pastore D., Trono D., Laus M.N., Di Fonzo N., Passarella S. 2001. Alternative oxidase in durum wheat mitochondria. Activation by pyruvate, hydroxypyruvate and glyoxylate and physiological role. Plant Cell Physiol. 42, 1373–1382.
Абдрахимова Й.Р., Андреев И.М., Шугаев А.Г. 2011. Участие диссипативных систем в контроле энергетической эффективности дыхания в митохондриях этиолированных проростков озимой пшеницы. Физиол. растений. 58, 509–517.
Sugie A., Naydenov N., Mizuno N., Nakamura C., Takumi S. 2006. Overexpression of wheat alternative oxidase gene Waox1a alters respiration capacity and response to reactive oxygen species under low temperature in transgenic Arabidopsis. Gen. Genet. Syst. 81, 349–354.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


