Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 4, стр. 282-286
Анализ секреции афферентного нейротрансмиттера АТР вкусовыми клетками типа III
А. П. Черкашин a, О. А. Рогачевская a, *
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Пущино, Россия
* E-mail: o.rogachevskaja@gmail.com
Поступила в редакцию 02.12.2019
После доработки 23.12.2019
Принята к публикации 09.01.2020
Аннотация
В периферической вкусовой системе вкусовые рецепторные клетки, локализованные во вкусовой почке, выполняют функцию хемосенсоров, детектирующих вкусовые вещества в ротовой полости. Вкусовая трансдукция завершается выбросом афферентного нейромедиатора, стимулирующего окончания вкусового нерва, что является первым этапом передачи сенсорной информации в соответствующие зоны коры головного мозга. Ряд фактов, установленных с использованием генетически модифицированных животных, свидетельствует о том, что пуринергическая сигнализация во вкусовой почке играет ключевую роль в афферентной нейропередаче вкусовой информации. В прямых экспериментах было показано, что вкусовые клетки типа II, специализированные на детекции горьких и сладких стимулов и аминокислот, секретируют АТР в качестве афферентного нейротрансмиттера. Вопрос о том, участвует ли АТР напрямую в афферентной нейропередаче в клетках типа III, которая протекает по механизму экзоцитоза, остается открытым и, в частности, сводится к прямой демонстрации секреции АТР этими клетками. В данной работе изучалась стимул-зависимая секреция АТР клетками типа III с использованием конфокальной микроскопии и флуоресцентного красителя куинакрина, который специфически окрашивает АТР-содержащие везикулы в цитоплазме клеток. Оказалось, что в ответ на деполяризацию клеток типа III наблюдалось уменьшение числа везикуло-подобных структур, содержащих куинакрин, которое происходило, скорее всего, за счет слияния АТР-содержащих везикул с плазмалеммой. Мы рассматриваем это явление как свидетельство того, что деполяризация клеток типа III инициирует экзоцитоз АТР, что подтверждает его действие в качестве афферентного нейротрансмиттера в этих вкусовых клетках.
ВВЕДЕНИЕ
Популяция клеток вкусовой почки гетерогенна и включает три типа (тип I–тип III) вкусовых клеток. Примерно половину популяции клеток вкусовой почки составляют вкусовые клетки типа I, которые выполняют преимущественно поддерживающую функцию [1]. Вкусовые клетки типа II являются основными хемосенсорными клетками вкусовой почки, которые специализируются на распознавании горьких и сладких стимулов и стимулов категории умами (аминокислоты, рибонуклеотиды, пептиды). Они составляют 30–40% вкусовых клеток во вкусовой почке. Вкусовые клетки типа III, насчитывающие 10–15% от общего количества клеток в почке, детектируют кислые и некоторые соленые стимулы [1]. Клетки типа III – единственные из клеток вкусовой почки образуют классические химические синапсы с окончаниями афферентного вкусового нерва. В пресинаптической части вкусовых клеток типа III содержатся везикулы с нейромедиатором серотонином, секреция которого регулируется входом Са2+ через потенциал-зависимые Са2+-каналы. Некоторое время это служило основанием рассматривать их в качестве истинно рецепторных, а после идентификации хемосенсорной функции вкусовых клеток типа II клеткам типа III приписывалась также функция сигнального элемента, обеспечивающего интегрирование сенсорной информации от клеток типа II и ее передачу к вкусовому нерву [2].
Вкусовые клетки детектируют вкусовые молекулы во вкусовой поре и обеспечивают кодирование сенсорной информации в форме стимул-зависимого выброса афферентного нейротрансмиттера, стимулирующего вкусовой нерв. На роль такого нейротрансмиттера предлагался серотонин, поскольку методами цитохимии только во вкусовых клетках типа III были идентифицированы пресинаптические везикулы, содержащие серотонин [3]. В настоящее время серотонину отводится вторичная роль, в частности роль сигнальной молекулы, участвующей в межклеточных коммуникациях во вкусовой почке, которая обеспечивает первичную обработку вкусовой информации [1]. Роль основного нейромедиатора, обеспечивающего трансдукцию вкусовых стимулов всех модальностей к настоящему моменту целиком отдана АТР. Эта точка зрения основана прежде всего на том, что генетически модифицированные животные, у которых инактивированы гены ионотропных Р2Х2 и Р2Х3 пуринорецепторов, функционирующих в форме Р2Х2/Р2Х3 олигомера на окончаниях вкусового нерва, полностью теряют чувствительность к вкусовым стимулам [4]. В случае вкусовых клеток типа II стимул-зависимая секреция АТР хорошо изучена методом АТР-биосенсора, и показано, что для этого используется не канонический Са2+-зависимый экзоцитозный механизм, а АТР-проницаемые ионные каналы [1, 5, 6]. Роль пуринергической сигнальной системы в трансдукции кислых и соленых стимулов менее изучена. В частности, остается открытым вопрос о том, могут ли вкусовые клетки типа III, которые являются хемосенсорами кислых стимулов и, по-видимому, некоторых соленых [1], содержать в пресинаптических везикулах АТР и секретировать его в ответ на вкусовую стимуляцию.
В качестве первичного медиатора в межклеточных коммуникациях, паракринных и аутокринных регуляциях АТР используется практически во всех тканях организма [7]. При этом АТР секретируется клетками как при участии везикулярного механизма, так и через АТР-проницаемые ионные каналы [7–11]. Для анализа секреции АТР одиночными клетками и тканями используется ряд методов, включая метод клеток АТР-сенсоров, люциферин-люциферазный метод, а также окрашивание АТР-содержащих везикул специфическими красителями, такими как куинакрин (quinacrine), BODIPY-ATP, MANT-ATP [9].
В представленной работе мы пытались зарегистрировать в режиме реального времени стимул-индуцируемую секрецию АТР одиночными вкусовыми клетками типа III.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение вкусовых почек и клеток проводилось по стандартной методике [5] из языка мышей. Смесь ферментов (0.9 мг/мл коллагеназы B, 1.2 мг/мл диспазы II, 0.2 мг/мл эластазы, 0.5 мг/мл ингибитора трипсина) инъецировалась под эпителий изолированного языка. Затем язык инкубировался 25 мин в бескальциевом растворе, содержащем (мМ): 120 NaCl, 20 KCl, 0.7 СаCl2, 1.1 MgCl2, 1 EGTA, 1 EDTA, 10 HEPES, 10 глюкозы, pH 7.4. Отделенный обработанный языковый эпителий содержался в физиологическом растворе, содержащем (мМ): 130 NaCl, 10 NaHCO3, 5 KCl, 1 MgCl2, 1 CaCl2, 10 HEPES, 10 глюкозы, pH 7.4. Вкусовые почки и клетки вытягивали из вкусовой ткани стеклянной пипеткой с диаметром кончика 70–90 мкм и помещали в экспериментальную камеру с физиологическим раствором.
Конфокальные изображения были получены с помощью конфокального микроскопа Leica TCS SP5 и объектива 63× с масляной иммерсией Plan Apochromat HCX PL APO Lambda Blue 63× 1.4 Oil UV (Leica, Германия). Возбуждение куинакрина осуществлялось при 488 нм, эмиссия регистрировалась в области 505–555 нм. Изображения регистрировались с использованием программы Leica Application Suite Advanced Fluorescence (LAS AF) ver. 2.6.4.8702 (Leica). Опыты проводили при комнатной температуре 22–24°C. Соли и реагенты приобретались в Sigma-Aldrich, США.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее нами было показано, что вкусовые клетки типа III, которые в отличие от остальных типов вкусовых клеток обладают потенциал-зависимыми Ca2+-каналами, генерируют специфические Са2+-сигналы в ответ на деполяризацию, вызванную заменой в экстраклеточном растворе 140 мМ NaCl на 40–70 мM KCl + 100–70 мM NaCl [12, 13]. Таким образом, стимуляция гетерогенной популяции клеток диссоциированных вкусовых почек внеклеточным раствором с высоким содержанием KCl позволяет неинвазивно идентифицировать вкусовые клетки типа III по характерному Са2+-ответу. Поскольку его уровень обычно достаточен, чтобы вызывать секрецию серотонина клетками типа III [14], то можно думать, что деполяризация, вызванная KCl, также должна инициировать экзоцитоз АТР-содержащих везикул в этих клетках.
В ряде экспериментов мы пытались зарегистрировать в режиме реального времени стимул-индуцируемую секрецию АТР одиночными вкусовыми клетками типа III, используя метод АТР-биосенсора. Однако нам не удалось достоверно зарегистрировать от клеток-сенсоров оптические сигналы, которые можно было бы интерпретировать как ассоциирующиеся с секрецией АТР и, таким образом, продемонстрировать выброс АТР одиночными вкусовыми клетками типа III. Деполяризация клеток типа III, по-видимому, инициировала локальный экзоцитоз слишком небольшого количества АТР-содержащих везикул. В качестве альтернативы мы загружали в изолированные вкусовые клетки куинакрин, который использовался для визуализации везикулярного высвобождения АТР в эпителиальных и других клетках [9–11]. Этот подход основан на том, что куинакрин, являющийся флуоресцентным производным акридина, эффективно связывает АТР в кислой среде. Поэтому в клетке этот краситель преимущественно окрашивает АТР-содержащие везикулы, имеющие низкий внутривезикулярный уровень рН, что дает возможность их визуализации с помощью микроскопии высокого разрешения.
С использованием конфокальной микроскопии мы попытались зарегистрировать выброс АТР из вкусовых клеток типа III в ответ на стимуляцию 70 мМ KCl. Обычно препарат диссоциированных вкусовых почек из желобоватого сосочка содержал одиночные вкусовые клетки и вкусовые клетки в составе клеточных ассоциатов. После окрашивания куинакрином (5 мкM в течение 15 мин) в клеточном препарате наблюдались отдельные клетки, содержащие флуоресцирующие гранулы (рис. 1а–1г), которые можно идентифицировать как АТР-содержащие везикулы [9]. Известно, что только вкусовые клетки типа III содержат синаптические везикулы [1], тогда как вкусовые клетки типа II не используют везикулярный механизм для выброса АТР [6]. Анализ конфокальных изображений показал, что АТР-содержащие везикулы наблюдались в 10–18% клеток, что соответствует процентному содержанию клеток типа III во вкусовых почках. Для минимизации выгорания куинакрина использовалось лазерное возбуждение наименьшей интенсивности, что позволяло в контроле регистрировать флуоресценцию гранул примерно на одном уровне в течение 15 мин (рис. 1е). Стимуляция клеток аппликацией 70 мМ KCl приводила к постепенному снижению числа флуоресцирующих везикул (рис. 1б) и в конечном итоге к их полному исчезновению. Учитывая относительную стабильность флуоресценции везикул в контроле, уменьшение их числа в ответ на 70 мМ KCl можно рассматривать как следствие экзоцитоза окрашенных АТР-содержащих везикул, вызванного активацией потенциал-зависимых Са2+-каналов. В качестве возможного контроля мы исследовали кинетику изменения флуоресценции куинакрин-нагруженых везикул в присутствии 50 мкМ Cd2+. Известно, что этот катион блокирует Са2+-каналы, в том числе потенциал-зависимые Са2+-каналы вкусовых клеток [12]. Поэтому можно было ожидать, что Cd2+ ингибирует KCl-индуцируемый экзоцитоз, а значит, и падение числа флуоресцирующих везикул во вкусовых клетках типа III. Добавление 50 мкМ Cd2+ во внеклеточную среду, в которой инкубировались вкусовые клетки, не влияло на число и интенсивность флуоресценции куинакрин-положительных везикул (рис. 1в). Хотя последующая стимуляция клеток 70 мМ KCl приводила к некоторой потере флуоресцирующих везикул, в присутствии 50 мкМ Cd2+ фракция таких везикул была существенно меньше (рис. 1г) по сравнению с экспериментом, проводившимся в отсутствие этого блокатора (рис. 1б, 1е). На рис. 1д представлена запись интегрального флуоресцентного сигнала в режиме реального времени от отдельной вкусовой клетки, которая также демонстрирует различие по величине сигналов в присутствии и в отсутствие ионов Cd2+. Это указывает на то, что способность KCl уменьшать число АТР-содержащих везикул сильно зависит от активности потенциал-зависимых Са2+-каналов.
Рис. 1.
Регистрация флуоресценции вкусовых клеток, загруженных куинакрином. а – Клетки в начальный момент регистрации (соответствует столбику 1 в е), б – клетки через 30 с после добавления KCl (столбик 3 в е), в – клетки в начальный момент регистрации в присутствии Cd2+, г – клетки в присутствии Cd2+ через 30 с после добавления KCl (столбик 4 в е). Все фотографии представлены в одном масштабе (указано на г, правая панель) в проходящем (левые панели) и флуоресцентном (правые панели) свете. д – Изменение интегральной флуоресценции куинакрина во вкусовой клетке при деполяризующей стимуляции KCl в присутствии и в отсутствие ионов Cd2+ – блокатора Са2+-каналов. Время и продолжительность аппликаций указаны над экспериментальной кривой. е – Относительное число флуоресцирующих везикул в клетке: 1 – в начальный момент регистрации; 2 – после 15 мин инкубации в контроле; 3 – через 30 с после добавления KCl; 4 – в присутствии 50 мкМ Cd2+ через 30 с после добавления KCl. Подсчет куинакрин-положительных везикул проводился в каждой флуоресцирующей клетке на конфокальном изображении препарата (3–5 клеток), количество везикул в начальный момент времени принято за 100%. Данные представлены как среднее ± ± стандартное отклонение при 10 независимых экспериментах.
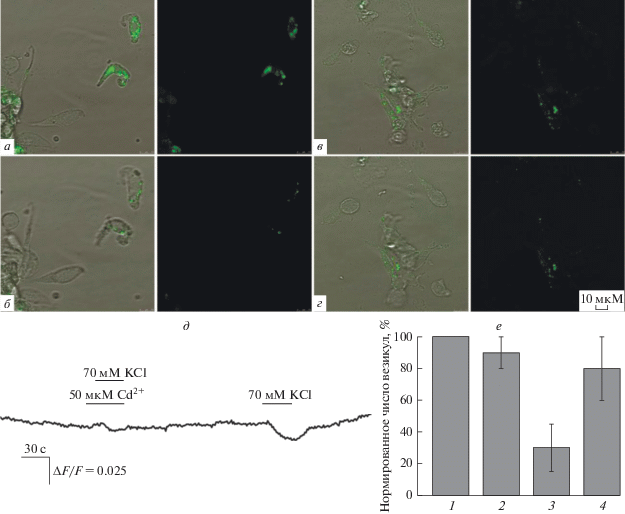
Таким образом, в своей совокупности полученные нами данные свидетельствуют о том, что деполяризация и ассоциированный с нею потенциал-зависимый вход наружного Са2+ действительно может инициировать экзоцитоз АТР-содержащих везикул во вкусовых клетках типа III. Следовательно, в цитоплазме вкусовых клеток типа III имеются не только серотонин-содержащие везикулы [3], но и пул АТР-содержащих везикул, который может использоваться этими клетками для трансдукции вкусовых сигналов. Это полностью согласуется с данными, полученными на нокаутных животных [4], и свидетельствует о ключевой роли АТР как нейротрансмиттера в периферической вкусовой системе.
Работа выполнена при поддержке РФФИ № 17-04-01941 и 20-04-01035 (рук. О.А. Рогачевская).
Список литературы
Roper S.D., Chaudhari N. 2017.Taste buds: Cells, signals and synapses. 2017. Nat. Rev. Neurosci. 18 (8), 485–497.
Huang Y.-J., Maruyama Y., Dvoryanchikov G., Pereira E., Chaudhari N., Roper S.D. 2007. The role of pannexin 1 hemichannels in ATP release and cell-cell communication in mouse taste buds. Proc. Natl. Acad. Sci. USA. 104, 6436–6441.
Nagai T., Kim D.J., Delay R.J., Roper S.D. 1996. Neuromodulation of transduction and signal processing in the end organs of taste. Chem. Senses. 21, 353–365.
Finger E.T., Danilova V., Barrows J., Bartel D.L., Vigers A.J., Stone L., Hellekant G., Kinnamon S.C. 2005. ATP signaling is crucial for communication from taste buds to gustatory nerves. Science. 310, 1495–1499.
Romanov R.A., Rogachevskaja O.A., Bystrova M.F., Jeang P., Margolskee R.F., Kolesnikov S.S. 2007. Afferent neurotransmission mediated by hemichannels in mammalian taste cells. EMBO J. 26 (3), 657–667.
Romanov R.A., Lasher R.S., High B., Savidge L.E., Lawson A., Rogachevskaja O.A., Zhao H., Rogachevsky V.V., Bystrova M.F., Churbanov G.D., Adameyko I., Harkany T., Yang R., Grahame J.K., Marambaud P., Kinnamon J.C., Kolesnikov S.S., Finger T.E. 2018. Chemical synapses without synaptic vesicles: Purinergic neurotransmission through a CALHM1 channel-mitochondrial signaling complex. Sci. Signal. 11 (529), eaao1815.
Verkhratsky A., Burnstock G. 2014. Biology of purinergic signalling: Its ancient evolutionary roots, its omnipresence and its multiple functional significance. BioEssays. 36 (7), 697–705.
Lazarowski E.R. 2012. Vesicular and conductive mechanisms of nucleotide release. Purinerg. Sign. 8, 359–373.
Rajendran M., Dane E., Conley J., Tantama M. 2016. Imaging adenosine triphosphate (ATP). Biol. Bull. 231 (1), 73–84.
Praetorius H.A., Leipziger J. ATP release from non-excitable cells. 2009. Purinergic Signal. 5 (4), 433–446.
Ho T., Jobling A.I., Greferath U., Chuang T., Ramesh A., Fletcher E.L., Vessey K.A. 2015. Vesicular expression and release of ATP from dopaminergic neurons of the mouse retina and midbrain. Front. Cell Neurosci. 9, 389.
Romanov R.A., Kolesnikov S.S. 2006. Electrophysiologically identified subpopulations of taste bud cells. Neurosci. Lett. 395, 249–254.
Bystrova M.F., Romanov R.A., Rogachevskaja O.A., Churbanov G.D., Kolesnikov S.S. 2010. Functional expression of the extracellular Ca2+-sensing receptor in mouse taste cells. J. Cell Sci. 123, 972–982.
Huang Y.-J., Maruyama Y., Lu K.-S., Pereira E., Plonsky I., Baur J.E., Wu D., Roper S.D. 2005. Mouse taste buds use serotonin as a neurotransmitter. J. Neurosci. 25, 843–847.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


