Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 4, стр. 287-298
Динамика формирования комплексов цитохрома c с анионными липидами и механизм реакций образования липидных радикалов, катализируемых этими комплексами
Г. К. Владимиров a, b, *, А. М. Нестерова a, b, А. А. Левкина a, c, А. Н. Осипов c, Ю. О. Теселкин c, М. В. Ковальчук a, d, Ю. А. Владимиров a, b, e
a Институт кристаллографии им. А.В. Шубникова
ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Россия
b Институт регенеративной медицины, Первый Московский государственный медицинский университет
имени И.М. Сеченова Министерства здравоохранения Российской Федерации
(Сеченовский университет)
119991 Москва, Россия
c Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
Министерства здравоохранения Российской Федерации
117997 Москва, Россия
d Национальный исследовательский центр “Курчатовский институт”
123182 Москва, Россия
e Московский государственный университет имени М.В. Ломоносова
119991 Москва, Россия
* E-mail: ura-vladimirov@yandex.ru
Поступила в редакцию 18.07.2019
После доработки 21.01.2020
Принята к публикации 24.01.2020
Аннотация
В настоящей работе методом измерения кинетики хемилюминесценции в присутствии активатора свечения – изохинолизинового кумарина 334 – было показано, что при взаимодействии с биологическими мембранами комплекс цитохрома с с тетраолеоил-кардиолипином (Цит-ТОКЛ) способен катализировать реакции, в которых образуются липидные радикалы. Эффект Цит-ТОКЛ был изучен на митохондриях, которые были выделены из печени самцов крыс линии Wistar и самцов беспородных мышей, и эритроцитах, выделенных из крови самцов крыс линии Wistar. Было показано, что комплекс цитохрома c с фосфатидной кислотой обладает аналогичным пероксидазным действием. Комплекс Цит-ТОКЛ при взаимодействии с интактными митохондриями проявлял в несколько раз более слабое пероксидазное действие, чем при его воздействии на поврежденные митохондрии. Таким образом, наносферы Цит-ТОКЛ, несмотря на их гидрофобную поверхность, плохо проникают через цитоплазматическую и митохондриальные мембраны. Соответственно, обнаруженное ранее цитотоксическое действие Цит-ТОКЛ на раковые клетки направлено, вероятнее всего, на цитоплазматическую мембрану, а не на внутренние мембраны митохондрий.
ВВЕДЕНИЕ
Внешним сигналом для индукции апоптоза служат факторы, действующие на рецепторы, встроенные в цитоплазматическую мембрану и запускающие каскад реакций внутри клетки, который заключается в активации ряда протеиназ, называемых каспазами. Ключевую роль в развитии апоптоза у эукариот, в том числе в организме человека, в большинстве случаев играют митохондрии. В клетках высших организмов апоптоз обычно развивается в результате нарушения барьерных свойств мембран митохондрий, внутренней и наружной [1–3]. В результате резкого увеличения проницаемости наружной митохондриальной мембраны [4–6] из межмембранного пространства митохондрий в цитоплазму выходят белки, включая цитохром с (ЦитС), что приводит к активации каспазы-9 и гибели клетки (апоптозу) [7, 8] вследствие активации протеиназ и эндонуклеаз, разрушающих клетку изнутри. Современные методы геномики и протеомики позволили выяснить множество важных и интересных особенностей сложнейшего механизма апоптоза, в реализацию и управление которым вовлечено множество регуляторных белков [9–11]. Но при всем этом долго оставались нерасшифрованными механизмы двух ключевых событий при апоптозе: механизмы нарушения проницаемости митохондриальных мембран (приводящего, помимо выхода ЦитС в цитоплазму [8, 12], к выключению биоэнергетических функций митохондрий [13]) и механизмы появления фосфатидилсерина на поверхности клеток – сигнала “съешь меня” для фагоцитов [14]. Решающую роль сыграли работы, показавшие участие перекисного окисления липидов как в митохондриальном пути апоптоза, так и в появлении сигнала для макрофагов на внешней поверхности цитоплазматической мембраны [15, 16]. Было сделано предположение, что в обоих случаях катализатором липидной пероксидации могут служить комплексы ЦитС с анионными липидами: с фосфатидилсерином в цитоплазматической мембране и с кардиолипином во внутренней мембране митохондрий [17]. В 2005 году Каган и сотр. показали, что для развития апоптоза в клетках необходима пероксидация липидов митохондрий, которая предшествовала выходу ЦитС и активации каспаз и которая подавлялась в отсутствие ЦитС или кардиолипина в клетках [18].
Первые исследования строения комплекса ЦитС с кардиолипином начались задолго до того, как стала известна его роль в апоптозе [19–23]. Наибольшей популярностью до сих пор пользуется представление о “мембранно-связанном ЦитС”. Согласно данной теории, первоначальное прикрепление ЦитС к поверхности липидного слоя мембраны, содержащей кардиолипин, обусловлено электростатическим притяжением, обратимо и не приводит к серьезному изменению конформации белка. Затем белок прочно привязывается к липидному слою гидрофобными взаимодействиями, вероятно, в результате проникновения одной [24] или двух [25] жирнокислотных цепей кардиолипина в толщу глобулы ЦитС. В результате ЦитС частично разворачивается и приобретает пероксидазную активность, которая отсутствует в водном растворе [14, 17, 18, 26, 27]. Измерения флуоресценции ЦитС, меченного в различных участках полипептидной цепи производными флуоресцеина, позволили сделать вывод о том, что при взаимодействии с липидным слоем, содержащим кардиолипин, происходят значительные изменения конформации ЦитС, приводящие к распластыванию макромолекулы на поверхности мембраны [28, 29]. Молекулярная динамика процесса связывания ЦитС с липидным бислоем, содержащим кардиолипин, была рассчитана в работе группы Кагана, причем, согласно данным этих авторов, ЦитС в конечном итоге также оказывался распластанным на поверхности мембраны [30]. В наших исследованиях были, однако, получены совершенно иные данные о структуре комплекса Цит-КЛ.
Было обнаружено, что при смешивании водного раствора ЦитС с раствором кардиолипина выпадает осадок комплекса с молярным соотношением липид/белок, равным 35–38 в нейтральной среде [31, 32] и приблизительно 13 при pH < < 5.5 [32]. Методом малоуглового рассеяния рентгеновских лучей было показано, что осадок состоит из шариков диаметром 11.2 нм [31]. Было сделано предположение, что комплекс ЦитС с кардиолипином (Цит-КЛ) представляет собой наносферу диаметром 11–12 нм, в центре которой расположен ЦитС, а снаружи – плотно сжатый монослой кардиолипина, расположенный заряженными головками внутрь и гидрофобными хвостами наружу [31]. Несмотря на гидрофобную поверхность, наносферы растворимы в водных растворах в концентрации 32 ± 4 мкМ при нейтральных pH и 28 ± 4 мкМ в кислой среде [33]. В концентрациях порядка 10 мкМ комплекс Цит-КЛ обладает пероксидазной и липопероксидазной активностью, которая проявляется в образовании свободных радикалов субстратов окисления в присутствии H2O2 или органических гидропероксидов [34–36]. Было выдвинуто предположение, что в митохондриях и других клеточных мембранах комплекс Цит-КЛ может внедряться в гидрофобный липидный бислой мембраны и осуществлять там липидную пероксидацию, которая приводит к апоптозу [32].
С помощью методики, близкой к процедуре выделения липидов по Фолчу [37], нам удалось приготовить раствор комплекса Цит-КЛ в гидрофобных растворителях (хлороформе и гексане) [38] и показать, что комплекс способен катализировать образование радикалов органического субстрата и полиненасыщенных липидов в гидрофобном окружении в присутствии H2O2. При изучении Цит-КЛ, растворенного в неполярном растворителе [39], размеры наносфер комплекса оказались такими же, как и в кристаллическом осадке [31], а молярное соотношение липид/белок – таким же, как и в водном растворе Цит-КЛ [32]. В связи с этим в недавней работе было сделано предположение о том, что и в кристаллическом осадке, и в растворах как в водной, так и в гидрофобной средах частицы Цит-КЛ имеют одно и то же строение [40]. Механизм пероксидазного действия комплекса во всех изученных системах изучался с помощью измерения кинетики хемилюминесценции (ХЛ), активированной изохинолизиновыми кумаринами [41] в сочетании с математическим моделированием кинетики реакций [42]. Примечательно то, что механизм оказался аналогичным механизму пероксидазного цикла, известному для пероксидаз растений и животных [43–45].
Появление раковой опухоли в организме животных и человека связано, как известно, с образованием мутантных клеток, не откликающихся на проапоптотические сигналы [46]. Поэтому противораковое действие практически всех существующих физических и химических агентов направлено на активацию апоптоза и других видов программируемой смерти в этих клетках [46–48]. Совместно с группой Торчилина (Бостон, США) мы исследовали действие комплекса Цит-КЛ на раковые клетки в культуре и показали, что Цит-КЛ в молярных концентрациях ниже или равных действующим концентрациям наиболее активных противораковых препаратов вызывал экстернализацию фосфатидилсерина и гибель клеток [49]. Поскольку чувствительными к данному препарату оказались как нативные, так и резистентные к другим противораковым препаратам раковые клетки, был сделан вывод, что комплексы цитохрома c с кардиолипином, т.е. природных компонентов наших клеток, и аналоги таких комплексов могут стать основой для эффективных противораковых препаратов принципиально нового типа, к которым не вырабатывается резистентность. При этом не до конца остается выясненной возможность проникновения комплекса Цит-КЛ через мембранные структуры клетки.
Задачей настоящей работы было изучение действия комплексов цитохрома c с анионными липидами – Цит-ТОКЛ и Цит-ФК – на цитоплазматическую и митохондриальные мембраны и выяснение механизма реакций образования липидных радикалов, катализируемых этими комплексами.
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты. Использовали реактивы фирмы Sigma-Aldrich (США): HEPES, тетраолеоил-кардиолипин (1',3'-бис[1,2-диолеоил-sn-глицеро-3-фосфо]-глицерин), диолеоил-фосфатидная кислота (1,2-ди(цис-9-октадеценоил)-sn-глицерин-3-фосфат натриевая соль), цитохром с, кумарин 334 (10-ацетил-2,3,6,7-тетрагидро-1Н,5Н,11H-(1)бензопирано(6,7,8-ij)хинолизин-11-он), EGTA, делипидированный бычий сывороточный альбумин; фирмы MP Biomedicals (Германия): сахароза, маннитол; а также: Na2HPO4 (ч.д.а., Реахим, Россия); раствор пероксида водорода (30%, Fluka, США); раствор Хенкса (ООО “ПанЭко”, Россия); физиологический раствор NaCl (0.9%, ООО “Мосфарм”, Россия).
Экспериментальные животные. Митохондрии выделяли из печени самцов крыс (Wistar, 250 ± ± 50 г) или самцов беспородных мышей (25 ± 5 г). Эритроциты получали из крови самцов крыс (Wistar, 250 ± 50 г). При работе с животными соблюдали регламент, установленный Приказом Минздрава СССР от 12.08.1977 г. № 755. Животных содержали в условиях вивария, по 6 особей в стандартных клетках Т4 с регулируемым освещением (12 ч – ночь, 12 ч – день), со свободным доступом к кормам и воде.
Выделение митохондрий и получение поврежденных митохондрий. Выделение митохондрий проводили согласно методике, описанной в статье [50] с небольшими модификациями. Все манипуляции проводили при температуре 0–4°C на льду. Образец печени массой от 1 до 4 г промывали в среде для выделения (10 мМ HEPES, 70 мМ сахароза, 1 мМ EGTA, 200 мМ маннитол, рН 7.4) и взвешивали в охлажденной чашке Петри. Ткань измельчали ножницами на крупные кусочки. Части образца гомогенизировали с помощью охлажденного стеклянного гомогенизатора с добавлением от 5 до 10 мл среды для выделения, содержащей 1 мг/мл делипидированного бычьего сывороточного альбумина. Равные объемы полученной суспензии переносили в две пробирки и центрифугировали 5 мин при 600 g, 2°C. Надосадочную жидкость центрифугировали еще 5 мин при тех же условиях, после чего осадок отбрасывали, а надосадочную жидкость центрифугировали 10 мин при 11 000 g, 2°C. Осадок ресуспендировали в среде для выделения до исходного объема пробы и снова центрифугировали 10 мин при 11 000 g, 2°C, после чего полученный осадок ресуспендировали в определенном объеме среды выделения и помещали в холодильник при 4°C.
Для получения поврежденных митохондрий (митохондриальных теней) полученную суспензию митохондрий замораживали при –20°С, а затем размораживали и хранили при температуре 0–4°С, после чего подвергали нескольким циклам осаждения-ресуспендирования.
Концентрацию белка в полученных митохондриях определяли биуретовым методом с помощью Total Protein reagent (Sigma-Aldrich, США).
Выделение эритроцитов и получение теней эритроцитов. Эритроциты получали центрифугированием (5 мин, 3000 g, 4°С) с последующим удалением надосадочного слоя плазмы. Клетки промывали не менее 3 раз путем смешивания с охлажденным физиологическим раствором (NaCl, 0.9%) в соотношении 1 : 1, аккуратного ресуспендирования и последующего центрифугирования при тех же условиях.
Безглобулиновые эритроцитарные мембраны (тени эритроцитов) получали по методу, описанному в работе [51]. Для этого к полученному по описанной выше методике осадку эритроцитов добавляли гипотонический раствор Na2HPO4 (10 мМ, рН 7.4, 4°С). По окончании гемолиза (через 30 мин) тени многократно отмывали путем центрифугирования (15 мин, 20 000 g, 4°C) до тех пор, пока количество гемоглобина в надосадочной жидкости не оставалось постоянным. Содержание гемоглобина контролировали путем регистрации соответствующих спектров поглощения супернатантов. В осадке оставалось небольшое количество так называемого мембранно-связанного гемоглобина, который обладал пероксидазной активностью – в соответствии с полученными ранее данными [52].
Регистрация спектров поглощения. Спектры поглощения регистрировали в кварцевых кюветах (l = 1.00 см) на спектрофотометре Specord 200 (Analytik Jena, Германия).
Регистрация кинетики хемилюминесценции. Регистрацию ХЛ осуществляли на одноканальном хемилюминометре Lum-5773 (ДИСофт, Россия) с программным обеспечением PowerGraph Professional 3.3. В качестве активатора ХЛ, сопровождающей образование липопероксильных радикалов (LOO·), использовали кумарин 334 (С-334) [53].
Схема регистрации ХЛ была следующей. Сначала регистрировали фоновый уровень ХЛ (рис. 1, нулевой момент времени). Далее в кювету, не прерывая процесса записи аналитического сигнала, помещали смесь, содержащую суспензию исследуемого объекта (интактных митохондрий, поврежденных митохондрий или теней эритроцитов) и метанольного раствора С-334 для определения базового уровня ХЛ (рис. 1, добавка 1). После этого добавляли смесь водного раствора ЦитС и метанольного раствора кардиолипина (рис. 1, добавка 2). Затем в систему для устранения действия каталазы вводили NaN3 (рис. 1, добавка 3). Запуск реакции окисления липидов осуществляли добавлением H2O2 (рис. 1, добавки 4 и 5). Интенсивность ХЛ в каждый момент времени отражала стационарную концентрацию LOO· и тем самым – скорость липопероксидазной реакции.
Рис. 1.
Образование липопероксильных радикалов при добавлении комплекса Цит-ТОКЛ к интактным и поврежденным митохондриям. Слева (а–в) – интактные митохондрии. Справа (г–е) – поврежденные митохондрии. Митохондрии были получены из печени самцов крыс (Wistar). Добавки были сделаны в моменты, указанные цифрами: 1 – митохондрии + С-334; 2 – Цит-ТОКЛ (а, г), только ТОКЛ (б, д) или только ЦитС (в, е); 3 – NaN3; 4 – 10 мкл 5 мМ H2O2; 5 – 100 мкл 5 мМ H2O2. Контроль – реакционная смесь, содержащая все вышеперечисленные компоненты, кроме ЦитС и ТОКЛ. Конечные концентрации: ЦитС – 22.5 мкМ, ТОКЛ – 750 мкМ, С-334 – 25 мкМ, NaN3 – 100 мкМ, H2O2 – 45 мкМ (добавка 4) и 500 мкМ (добавка 5).
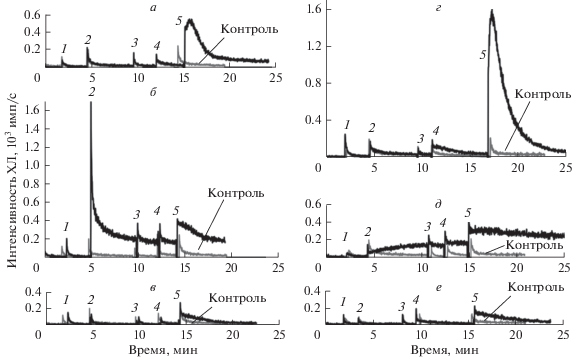
Все концентрации компонентов исследуемых систем были подобраны исходя из литературных и ранее полученных нами данных. Концентрации ЦитС и ТОКЛ были подобраны в опытах по цитотоксическому действию Цит-ТОКЛ на раковые клетки [49]. Использованная концентрация NaN3 резко уменьшала активность каталазы, но не вызывала ингибирование пероксидазной активности самого ЦитС. В работе [14], а позднее и в работе [54] было показано, что малое количество H2O2 не вызывает пероксидацию липидов в присутствии комплекса Цит-КЛ. Это связано с тем, что при добавлении небольшого количества H2O2 к комплексу Цит-КЛ пероксид водорода сначала тратится на окисление тиоловых групп ЦитС и перевод гемового железа в составе ЦитС из двухвалентного состояния в трехвалентное.
Все эксперименты были поставлены таким образом, что сначала изучали полную систему, а затем регистрировали контроли, которые выполняли методом последовательного исключения каждого из компонентов системы. На рисунках представлены данные типичных экспериментов.
Статистический анализ данных. Статистическую обработку проводили с помощью программного пакета GraphPad Prism 6 (GraphPad Software Inc, США). Для количественной оценки наблюдаемого эффекта определяли максимум вспышки ХЛ после добавления реагента. Полученные данные сравнивали с уровнем свечения в контрольном опыте, когда не добавляли ни ЦитС, ни ТОКЛ. Все эксперименты повторяли минимум 4 раза. Данные представлены в виде среднее ± стандартное отклонение. Достоверные различия между группами определяли с помощью критерия Манна–Уитни. Различия при p < 0.05 считались статистически значимыми.
РЕЗУЛЬТАТЫ
Образование липидных радикалов в интактных и поврежденных митохондриях. Взаимодействие двух радикалов LOO· сопровождается ХЛ [55], которая может быть обнаружена в присутствии С-334, физического активатора ХЛ [41], и может быть мерой ферментативной активности комплекса Цит-КЛ. В недавней работе [39] методом активированной ХЛ было показано, что комплекс Цит-КЛ в гидрофобном окружении может катализировать образование LOO·, которые могут образовываться в двух типах реакций: 1) разложение предсуществующих в системе гидропероксидов липидов (LOOH) с образованием липоксильного радикала (LO·) и последующим образованием LOOH в процессе цепного окисления (квазилипоксигеназная реакция), 2) перекисное окисление липидов в присутствии H2O2 (липопероксидазная реакция). Ранее аналогичным методом было показано, что комплекс Цит-КЛ обладает как квазилипоксигеназной, так и липопероксидазной активностью также и в водных растворах [49].
По такой же схеме мы изучили механизм образования липидных радикалов, катализируемого Цит-КЛ при добавлении H2O2 к интактным митохондриям и теням митохондрий.
Рисунок 1 показывает, что при добавлении H2O2 в концентрации 500 мкМ к интактным митохондриям, выделенным из печени крыс (кривые а–в), и теням митохондрий (кривые г–е) наблюдаются вспышки ХЛ (кривая а, добавка 5 – 0.55 ± 0.06 × 103 имп/с и кривая г, добавка 5 – 1.5 ± 0.2 × 103 имп/с), которые можно объяснить образованием LOO· в ходе пероксидации липидов. При добавлении низкой концентрации (45 мкМ) H2O2 эффект был очень мал (кривая г, добавка 4 – 0.19 ± 0.01 × 103 имп/с) или вообще отсутствовал (кривая а, добавка 4). Эти эффекты не наблюдались, если к митохондриям не добавляли NaN3, который ингибирует содержащуюся в образцах каталазу (данные не приведены).
Стоит обратить внимание на то, что присутствие отдельно взятого ЦитС (а не комплекса Цит-ТОКЛ) оказывало хотя и очень небольшое, но все же достоверное образование LOO• в реакции липопероксидации (кривая в, добавка 5 – 0.26 ± 0.02 × 103 имп/с и кривая е, добавка 5 – 0.22 ± 0.01 × 103 имп/с). Еще более заметное образование LOO· имело место при добавлении H2O2 (добавки 5) в образцах, соответствующих кривым б (0.38 ± 0.03 × 103 имп/с) и д (0.33 ± 0.04 × 103 имп/с), когда к митохондриям добавляли только ТОКЛ (в количествах таких же, как и в полной системе). По-видимому, комплексы Цит-AЛ формировались в обоих случаях за счет некоторого количества свободных анионных липидов и ЦитС, содержавшихся в суспензиях митохондрий. Эти данные согласуются с данными нашей предыдущей работы, где было показано, что цитотоксическое действие на раковые клетки в культуре оказывает не только комплекс Цит-КЛ, но и отдельно взятый кардиолипин и, в значительно меньшей степени, отдельно взятый ЦитС [49]. Липопероксидазная активность Цит-ТОКЛ была в несколько раз выше, чем пероксидазный эффект отдельно взятых ЦитС и кардиолипина.
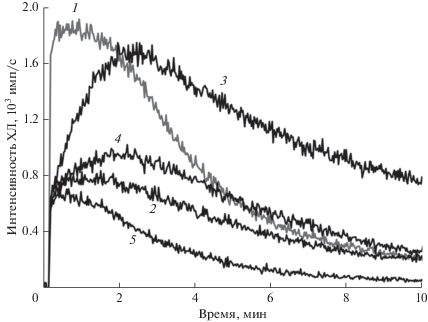
Похожие результаты были получены при исследовании митохондрий из печени мышей (рис. 2). Наибольшей липопероксидазной активностью обладал комплекс Цит-ТОКЛ (кривая 1), сам по себе ТОКЛ проявлял значительно меньшую активность (3), что особенно заметно по начальной скорости нарастания концентрации LOO· (интенсивности ХЛ, рис. 2, кривые 1 и 3). Еще меньший эффект оказывал отдельно взятый ЦитС (рис. 2, кривые 3 и 4). Если рассматривать только активированную ХЛ, что можно сделать путем вычитания фона собственной ХЛ системы – системы без С-334 (разность кривых 1–5, 3–5 и 4–5 на рис. 2), то становится понятно, что и в данном случае (так же, как и на рис.1) комплекс Цит-ТОКЛ проявляет в несколько раз большую липопероксидазную активность, чем составляющие его компоненты, взятые по отдельности.
Рис. 2.
С-334-активированная ХЛ в поврежденных митохондриях при липопероксидазной реакции, катализируемой комплексом Цит-ТОКЛ. Митохондрии были получены из печени самцов беспородных мышей. Состав реакционных смесей: тени митохондрий + 1 – ЦитС, ТОКЛ, С-334, NaN3, 100 мкл 5 мМ H2O2; 2 – ЦитС, ТОКЛ, С-334, NaN3, 50 мкл 5 мМ H2O2; 3 – ТОКЛ, С-334, NaN3, 100 мкл 5 мМ H2O2; 4 – ЦитС, С-334, NaN3, 100 мкл 5 мМ H2O2; 5 – ЦитС, ТОКЛ, NaN3, 100 мкл 5 мМ H2O2. Конечные концентрации: ЦитС – 18 мкМ, ТОКЛ – 682 мкМ, С-334 – 23 мкМ, NaN3 – 91 мкМ, H2O2 – 227 мкМ (2) и 455 мкМ (1, 3–4).
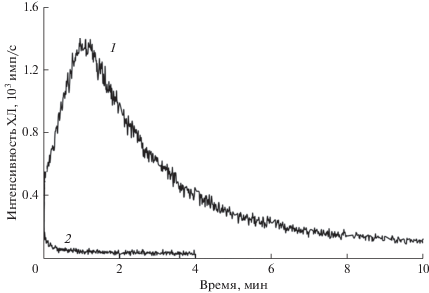
Сравнение липопероксидазного действия комплекса Цит-ТОКЛ на интактные и поврежденные митохондрии. На рис. 1 хорошо видно, что скорость образования LOO· при добавлении H2O2 в присутствии Цит-ТОКЛ к полученным из печени крыс митохондриям, мембраны которых повреждены (рис. 1г, кривая 5), существенно выше, чем при добавлении к интактным митохондриям (рис. 1а, кривая 5). На рис. 3 приведены результаты измерений, проделанных с полученными из печени мышей свежевыделенными митохондриями и поврежденными мембранами митохондрий. Очевидно, что комплекс Цит-ТОКЛ почти не действует на неповрежденные митохондрии, тогда как в результате повреждения наружной мембраны при замораживании/оттаивании добавление Цит-ТОКЛ в присутствии H2O2 приводит к весьма интенсивной липопероксидации. По-видимому, Цит-ТОКЛ действует на внутренние мембраны митохондрий и не проникает через неповрежденную наружную мембрану.
Рис. 3.
Сравнение кинетики образования липопероксильных радикалов в липопероксидазной реакции, катализируемой комплексом Цит-ТОКЛ при его добавлении к интактным (2) и к поврежденным (1) митохондриям. Митохондрии были получены из печени самцов беспородных мышей. Конечные концентрации: ЦитС – 18 мкМ, ТОКЛ – 682 мкМ, С-334 – 23 мкМ, NaN3 – 91 мкМ, H2O2 – 455 мкМ.
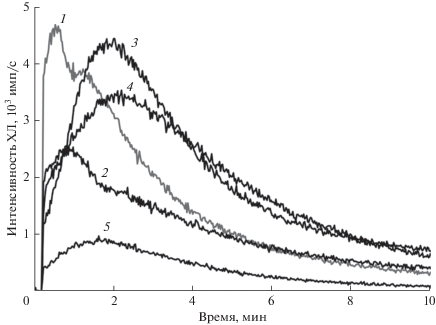
Липопероксидазное действие комплекса Цит-ФК на поврежденные митохондрии. На том же объекте, как и на рис. 2 (поврежденные митохондрии из печени мыши), мы провели эксперименты, где к суспензии поврежденных митохондрий добавляли не Цит-ТОКЛ, а смесь ЦитС с другим анионным липидом – диолеоил-фосфатидной кислотой (ФК) (рис. 4). Добавление к поврежденным мембранам митохондрий комплекса Цит-ФК приводило к появлению двухфазной ХЛ (кривая 1), являющейся суперпозицией двух процессов. Максимум ХЛ на 0.8 мин отражает образование LOO· под действием комплекса Цит-ФК. Второй максимум (на 1.8–2 мин) характеризует саму систему: первый максимум отсутствует в системе без С-334 (кривая 5), а отсутствие в исследуемой системе комплекса Цит-ФК приводит к появлению только второго максимума (кривые 3, 4). Анализ полученных данных (рис. 4) позволяет сделать вывод о том, что этот комплекс ЦитС с анионным липидом (Цит-АЛ) обладает способностью образовывать липидные радикалы в липопероксидазной реакции, причем именно комплекс Цит-ФК, а не сам по себе ЦитС обладает пероксидазной активностью.
Рис. 4.
Образование липопероксильных радикалов в поврежденных митохондриях при липопероксидазной реакции, катализируемой комплексом Цит-ФК. Митохондрии были получены из печени самцов беспородных мышей. Состав реакционных смесей: тени митохондрий + 1 – ЦитС, ФК, С-334, NaN3, 100 мкл 5 мМ H2O2.; 2 – ЦитС, ФК, С-334, NaN3, 50 мкл 5 мМ H2O2; 3 – ФК, С-334, NaN3, 100 мкл 5 мМ H2O2; 4 – ЦитС, С-334, NaN3, 100 мкл 5 мМ H2O2; 5 – ЦитС, ФК, NaN3, 100 мкл 5 мМ H2O2. Конечные концентрации: ЦитС – 18 мкМ, ФК – 682 мкМ, С-334 – 23 мкМ, NaN3 – 91 мкМ, H2O2 – 227 мкМ (2) и 455 мкМ (1, 3–4).
Образование липидных радикалов при действии Цит-ТОКЛ на тени эритроцитов. Эритроцит – клетка в организме человека, в которой отсутствуют митохондрии. Но липидная пероксидация может происходить и в другой мембранной структуре – цитоплазматической мембране. Метод изучения квазилипоксигеназного и липопероксидазного действия Цит-ТОКЛ на эритроцитарную мембрану был аналогичен использованному в опытах с интактными и поврежденными митохондриями (рис. 1). Данные, полученные в опытах с суспензией теней эритроцитов, показаны на рис. 5.
Рис. 5.
Образование липопероксильных радикалов при действии комплекса Цит-ТОКЛ на тени эритроцитов. Эритроциты были получены из крови самцов крыс (Wistar). Состав реакционных смесей: тени эритроцитов + 1 – ЦитС, ТОКЛ, C-334, H2O2; 2 – ТОКЛ, C-334, H2O2; 3 – ЦитС, C-334, H2O2; 4 –ЦитС, ТОКЛ, H2O2. В суспензии эритроцитов с С-334 (1–3) или без него (4) были внесены добавки в моменты, указанные стрелками: 2-я мин – Цит-ТОКЛ (или отдельно взятые ЦитС/ТОКЛ), 5-я мин – NaN3, 8-я мин – H2O2. Конечные концентрации компонентов системы: ЦитС – 18 мкМ, ТОКЛ – 682 мкМ, С-334 – 23 мкМ, NaN3 – 91 мкМ, H2O2 – 455 мкМ.
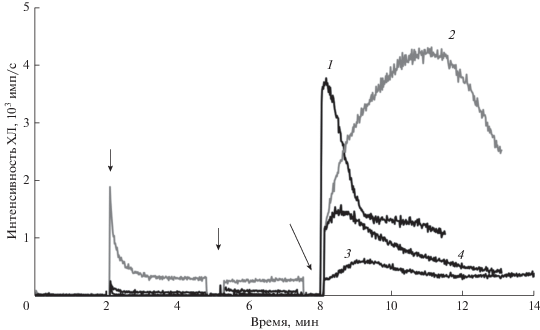
Оказалось, что тени эритроцитов сами по себе обладают липопероксидазной активностью: добавление H2O2 приводило к развитию ХЛ в присутствии C-334 (рис. 5, кривая 2). Добавленный извне комплекс Цит-ТОКЛ сам по себе вспышку не вызывал (добавка на 2-й мин, кривая 1), что говорит об отсутствии LOOH в образцах. Введение H2O2 в систему приводило к появлению довольно интенсивной, но кратковременной вспышки ХЛ (рис. 5, кривая 1), что свидетельствует о липопероксидазной активности Цит-ТОКЛ по отношению к липидам в эритроцитарных мембранах. Однако обращает на себя внимание ее кратковременность. На рис. 5 (кривая 1) видно, что за первой короткой вспышкой следует более медленная и продолжительная вспышка, которая накладывается на предыдущую и которая, вероятно, обусловлена липидной пероксидацией, катализируемой мембранно-связанным гемоглобином. Амплитуда этой медленной вспышки в 3 раза меньше в полной системе, чем в образце, где отсутствовал ЦитС (кривая 2), вероятно, из-за конкуренции гемоглобина и ЦитС за H2O2, но также, возможно, из-за антиоксидантной активности апоцитохрома с, описанной для интактного ЦитС с неокисленными тиоловыми группами [56].
Таким образом, благодаря использованию такого объекта, как тени эритроцитов, мы показали, что под действием комплекса Цит-ТОКЛ в цитоплазматической мембране протекают реакции образования липидных радикалов, сопровождающиеся ХЛ с высокой интенсивностью свечения и кинетикой, аналогичной кинетике ХЛ при реакциях, катализируемых Цит-ТОКЛ во всех изученных нами ранее системах. При этом в тенях эритроцитов также наблюдается ХЛ, предположительно связанная с реакциями, катализируемыми небольшим количеством гемоглобина, оставшегося после осаждения мембран. Эта люминесценция постепенно исчезает по мере вымывания гемоглобина из теней эритроцитов (данные не приведены).
ОБСУЖДЕНИЕ
Таким образом, в настоящем исследовании было показано, что Цит-ТОКЛ, способный катализировать реакции липидной пероксидации как в водных растворах, так и в гидрофобных растворителях, может также катализировать образование липидных радикалов в липопероксидазном цикле при действии на митохондриальные (рис. 1–3) и цитоплазматическую мембраны (рис. 5). Комплекс ЦитС с другим анионным фосфолипидом – фосфатидной кислотой – также проявлял липопероксидазные свойства при воздействии на мембраны митохондрий (рис. 4). Такие свойства данных наноструктур могут обеспечить возможность использовать эти комплексы в качестве индукторов апоптоза с целью борьбы с раковыми заболеваниями. В нашей предыдущей работе [49] было показано, что Цит-ТОКЛ обладает цитотоксическим и апоптогенным действием. На этом основании было сделано предположение, что наносферы этого комплекса способны проникать через липидный бислой биологических мембран, включая цитоплазматическую мембрану и наружную мембрану митохондрий, вызывая тем самым развитие апоптотического каскада. Такая возможность косвенно подтверждалась результатами работ других авторов о действии ЦитС на мембраны, содержащие кардиолипин, в опытах с гигантскими липосомами и искусственными липидными мембранами [57]. Однако позднее в опытах на модельных бислойных мембранах было показано, что ЦитС проходит через липидный бислой только после его липидной пероксидации [58]. Данные нашей работы тоже опровергают предположение о проницаемости биологических мембран для гидрофобных шариков Цит-КЛ. Действительно, если сравнить вспышку ХЛ в суспензии интактных митохондрий (рис. 1, кривая а, добавка 5) и в суспензии поврежденных митохондрий (рис. 1, кривая г, добавка 5), то можно увидеть, что в поврежденных митохондриях вспышка ХЛ имеет приблизительно в 16 раз большую интенсивность, чем в интактных (в пересчете на количество белка, которого в поврежденных митохондриях было обнаружено приблизительно в 6 раз меньше, чем в интактных). Данные рис. 3 согласуются с данными рис. 1 и однозначно показывают, что в интактных митохондриях липидная пероксидация под действием Цит-ТОКЛ и H2O2 практически не происходит, тогда как в поврежденных митохондриях она резко выражена. Наблюдаемый эффект можно объяснить тем, что комплекс Цит-КЛ не может окислить внутренние мембраны митохондрий, если наружные мембраны сохранили свою целостность, так как комплекс не проникает через мембраны. В настоящей работе мы получили данные, указывающие на то, что цитотоксическое действие комплекса Цит-ТОКЛ, добавляемого к раковым клеткам, не опосредовано действием на митохондрии, а связано непосредственно с липидной пероксидацией цитоплазматической мембраны. Именно такую пероксидацию липидов мы и наблюдали в настоящем исследовании при воздействии комплекса Цит-ТОКЛ на тени эритроцитов (рис. 5), которые, как известно, состоят преимущественно из цитоплазматической мембраны.
Работа выполнена при финансовой поддержке РНФ (грант № 17-74-10 248).
Список литературы
Skulachev V.P. 1996. Why are mitochondria involved in apoptosis? Permeability transition pores and apoptosis as selective mechanisms to eliminate superoxide-producing mitochondria and cell. FEBS Lett. 397 (1), 7–10.
Skulachev V.P. 2000. Mitochondria in the programmed death phenomena; a principle of biology: “It is better to die than to be wrong”. IUBMB Life. 49 (5), 365–373.
Vladimirov Y.A. 2002. The loss of barrier properties by inner and outer mitochondrial membranes, necrosis and apoptosis. Biol. Membrany. 19, 356–377.
Hunter D.R., Haworth R.A. 1979. The Ca2+-induced membrane transition in mitochondria. I. The protective mechanisms. Arch. Biochem. Biophys. 195 (2), 453–459.
Hunter D.R., Haworth R.A. 1979. The Ca2+-induced membrane transition in mitochondria. III. Transitional Ca2+ release. Arch Biochem. Biophys. 195 (2), 468–477.
Korkina L.G., Sorokovoy V.I., Vladimirov Y.A. 1973. Accumulation of Ca2+ in mitochondrial membranes and Ca2+-induced membrane damage studied with chlorotetracycline as a fluorescent probe. Studia Biophysica. 3, 177–192.
Brustugun O.T., Fladmark K., Døskeland S., Orrenius S., Zhivotovsky B. 1998. Apoptosis induced by microinjection of cytochrome C is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5 (8), 660–668.
Zhivotovsky B., Orrenius S., Brustugun O.T., Doskeland S.O. 1998. Injected cytochrome c induces apoptosis. Nature. 391 (6666), 449–450.
Green D.R., Llambi F. 2015. Cell Death Signaling. Cold Spring Harb. Perspect. Biol. 7 (12), a006080.
Green D.R. 2011. Means to an end: Apoptosis and other cell death mechanisms. Cold Spring Harbor Laboratory Press. 220p.
Green D.R., Kroemer G. 2004. The pathophysiology of mitochondrial cell death. Science. 305 (5684), 626–629.
Brustugun O.T., Fladmark K.E., Doskeland S.O., Orrenius S., Zhivotovsky B. 1998. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5 (8), 660–668.
Kroemer G., Reed J.C. 2000. Mitochondrial control of cell death. Nat. Med. 6 (5), 513–519.
Belikova N.A., Vladimirov Y.A., Osipov A.N., Kapralov A.A., Tyurin V.A., Potapovich M.V., Basova L.V., Peterson J., Kurnikov I.V., Kagan V.E. 2006. Peroxidase activity and structural transitions of cytochrome c bound to cardiolipin-containing membranes. Biochemistry. 45 (15), 4998–5009.
Kagan V.E., Gleiss B., Tyurina Y.Y., Tyurin V.A., Elenstrom-Magnusson C., Liu S.X., Serinkan F.B., Arroyo A., Chandra J., Orrenius S., Fadeel B. 2002. A role for oxidative stress in apoptosis: Oxidation and externalization of phosphatidylserine is required for macrophage clearance of cells undergoing Fas-mediated apoptosis. J. Immunol. 169 (1), 487–499.
Kagan V.E., Borisenko G.G., Serinkan B.F., Tyurina Y.Y., Tyurin V.A., Jiang J., Liu S.X., Shvedova A.A., Fabisiak J.P., Uthaisang W., Fadeel B. 2003. Appetizing rancidity of apoptotic cells for macrophages: Oxidation, externalization, and recognition of phosphatidylserine. Am. J. Physiol. Lung Cell Mol. Physiol. 285 (1), L1–17.
Kagan V.E., Borisenko G.G., Tyurina Y.Y., Tyurin V.A., Jiang J., Potapovich A.I., Kini V., Amoscato A.A., Fujii Y. 2004. Oxidative lipidomics of apoptosis: Redox catalytic interactions of cytochrome c with cardiolipin and phosphatidylserine. Free Radic. Biol. Med. 37 (12), 1963–1985.
Kagan V.E., Tyurin V.A., Jiang J., Tyurina Y.Y., Ritov V.B., Amoscato A.A., Osipov A.N., Belikova N.A., Kapralov A.A., Kini V. 2005. Cytochrome c acts as a cardiolipin oxygenase required for release of proapoptotic factors. Nat. Chem. Biol. 1 (4), 223–232.
Kimelberg H.K., Papahadjopoulos D. 1971. Interactions of basic proteins with phospholipid membranes. Binding and changes in the sodium permeability of phosphatidylserine vesicles. J. Biol. Chem. 246 (4), 1142–1148.
Brown L.R., Wuthrich K. 1977. A spin label study of lipid oxidation catalyzed by heme proteins. Biochim. Biophys. Acta. 464 (2), 356–369.
Brown L.R., Wuthrich K. 1977. NMR and ESR studies of the interactions of cytochrome c with mixed cardiolipin-phosphatidylcholine vesicles. Biochim. Biophys. Acta. 468 (3), 389–410.
Quinn P.J., Dawson R.M. 1969. Interactions of cytochrome c and [14C]-carboxymethylated cytochrome c with monolayers of phosphatidylcholine, phosphatidic acid and cardiolipin. Biochem. J. 115 (1), 65–75.
Rytomaa M., Kinnunen P.K. 1994. Evidence for two distinct acidic phospholipid-binding sites in cytochrome c. J. Biol. Chem. 269 (3), 1770–1774.
Rytomaa M., Kinnunen P.K. 1995. Reversibility of the binding of cytochrome c to liposomes. Implications for lipid-protein interactions. J. Biol. Chem. 270 (7), 3197–3202.
Sinibaldi F., Howes B.D., Piro M.C., Polticelli F., Bombelli C., Ferri T., Coletta M., Smulevich G., Santucci R. 2010. Extended cardiolipin anchorage to cytochrome c: A model for protein-mitochondrial membrane binding. J. Biol. Inorg. Chem. 15 (5), 689–700.
Vladimirov Y.A., Proskurnina E.V., Izmailov D.Y., Novikov A.A., Brusnichkin A.V., Osipov A.N., Kagan V.E. 2006. Mechanism of activation of cytochrome C pero-xidase activity by cardiolipin. Biochemistry (Mosc.). 71 (9), 989–997.
Vladimirov Y.A., Proskurnina E.V., Izmajlov D.Y. 2011. Kinetic chemiluminescence as a method for study of free radical reactions. Biophysics (Mosc.). 56 (6), 1055–1062.
Muenzner J., Pletneva E.V. 2014. Structural transformations of cytochrome c upon interaction with cardiolipin. Chem. Phys. Lipids. 179, 57–63.
Muenzner J., Toffey J.R., Hong Y., Pletneva E.V. 2013. Becoming a peroxidase: Cardiolipin-induced unfolding of cytochrome c. J. Phys. Chem. B. 117 (42), 12878–12886.
Mohammadyani D., Yanamala N., Samhan-Arias A.K., Kapralov A.A., Stepanov G., Nuar N., Planas-Iglesias J., Sanghera N., Kagan V.E., Klein-Seetharaman J. 2018. Structural characterization of cardiolipin-driven activation of cytochrome c into a peroxidase and membrane perturbation. Biochim. Biophys. Acta Biomembr. 1860 (5), 1057–1068.
Vladimirov Y.A., Nol’ Y.T., Volkov V.V. 2011. Protein–lipid nanoparticles that determine whether cells will live or die. Crystallography Reports. 56 (4), 553–559.
Vladimirov Y.A., Proskurnina E.V., Alekseev A.V. 2013. Molecular mechanisms of apoptosis. Structure of cytochrome c-cardiolipin complex. Biochemistry (Mosc.). 78 (10), 1086–1097.
Проскурнина Е.В., Проскурнин М.А., Алексеев А.В., Галимова В.Р., Владимиров Ю.А. 2018. Определение состава комплекса цитохрома c с кардиолипином при помощи спектрофотометрии и термолинзовой спектрометрии. Технологии живых систем. 3, 27–32.
Demin E.M., Proskurnina E.V., Vladimirov Y.A. 2008. Antioxidant effects of dihydroquercetin and rutin in peroxidase reactions catalyzed by cytochrome c. Moscow University Chemistry Bulletin. 63 (5), 297–302.
Proskurnina E.V., Alekseev A.V., Demin E.M., Izmailov D.Y., Vladimirov Y.A. 2013. Cyt-CL complex: Peroxidase activity and role in lipid peroxidation. FEBS J. 280 (Special issue: SI Supplement: 1), 264.
Vladimirov Y.A., Demin E.M., Proskurnina E.V., Osipov A.N. 2009. Lipoperoxide radical production during oxidation of cardiolipin in the complex with cytochrome c. Biochemistry (Mosc.). Supplement Series A: Membrane and Cell Biology. 3 (4), 479–489.
Folch J., Lees M., Sloane Stanley G.H. 1957. A simple method for the isolation and purification of total lipides from animal tissues. J. Biol. Chem. 226 (1), 497–509.
Vikulina A.S., Alekseev A.V., Proskurnina E.V., Vladimirov Y.A. 2015. The complexs of cytochrome c with cardiolipin in non-polar environment. Biochemistry (Mosc.). 80 (10), 1298–1302.
Vladimirov G.K., Vikulina A.S., Volodkin D.V., Vladimirov Y.A. 2018. Structure of the complex of cytochrome C with cardiolipin in non-polar environment. Chem. Phys. Lipids. 214, 35–45
Vladimirov G.K., Remenshchikov V.E., Nesterova A.M., Volkov V.V., Vladimirov Y.A. 2019. Comparison of the size and properties of the cytochrome c/cardiolipin nanospheres in a sediment and non-polar medium. Biochemistry (Mosc.). 84 (8), 923–930.
Vladimirov Y.A., Sharov V.S., Driomina E.S., Reznitchenko A.V., Gashev S.B. 1995. Coumarin derivatives enhance the chemiluminescence accompanying lipid peroxidation. Free Radic. Biol. Med. 18 (4), 739–745.
Kapralov A.A., Yanamala N., Tyurina Y.Y., Castro L., Samhan-Arias A., Vladimirov Y.A., Maeda A., Weitz A.A., Peterson J., Mylnikov D., Demicheli V., Tortora V., Klein-Seetharaman J., Radi R., Kagan V.E. 2011. Topography of tyrosine residues and their involvement in peroxidation of polyunsaturated cardiolipin in cytochrome c/cardiolipin peroxidase complexes. Biochim. Biophys. Acta. 1808 (9), 2147–2155.
Chance B. 1949. The properties of the enzyme-substrate compounds of horse-radish and lacto-peroxidase. Science. 109 (2826), 204–208.
Chance B., Higgins J. 1952. Peroxidase kinetics in coupled oxidation; an experimental and theoretical study. Arch. Biochem. Biophys. 41 (2), 432–441.
Furtmuller P.G., Jantschko W., Zederbauer M., Jako-pitsch C., Arnhold J., Obinger C. 2004. Kinetics of interconversion of redox intermediates of lactoperoxidase, eosinophil peroxidase and myeloperoxidase. Jpn. J. Infect. Dis. 57 (5), S30–S31.
Hannun Y.A. 1997. Apoptosis and the dilemma of cancer chemotherapy. Blood. 89 (6), 1845–1853.
Ghobrial I.M., Witzig T.E., Adjei A.A. 2005. Targeting apoptosis pathways in cancer therapy. CA Cancer J. Clin. 55 (3), 178–194.
Lopez J., Tait S. 2015. Mitochondrial apoptosis: Killing cancer using the enemy within. Br. J. Cancer. 112 (6), 957–962.
Vladimirov Y.A., Sarisozen C., Vladimirov G.K., Filipczak N., Polimova A.M., Torchilin V.P. 2017. The cytotoxic action of cytochrome C/cardiolipin nanocomplex (Cyt-CL) on cancer cells in culture. Pharm. Res. 34 (6), 1264–1275.
Storrie B., Madden E.A. 1990. Isolation of subcellular organelles. Methods Enzymol. 182, 203–225.
Dodge J.T., Mitchell C., Hanahan D.J. 1963. The preparation and chemical characteristics of hemoglobin-free ghosts of human erythrocytes. Arch. Biochem. Biophys. 100, 119–130.
Созарукова М.М. 2017. Нейтрофилы и эритроциты как источники свободных радикалов в крови и сывороточный альбумин как мишень их действия. Дис. канд. биол. наук. М.: РНИМУ.
Vladimirov Y.A., Arroyo A., Taylor J.M., Tyurina Y.Y., Matsura T., Tyurin V.A., Kagan V.E. 2000. Quinolizin-coumarins as physical enhancers of chemiluminescence during lipid peroxidation in live HL-60 cells. Arch. Biochem. Biophys. 384 (1), 154–162.
Kagan V.E., Bayir H.A., Belikova N.A., Kapralov O., Tyurina Y.Y., Tyurin V.A., Jiang J., Stoyanovsky D.A., Wipf P., Kochanek P.M., Greenberger J.S., Pitt B., Shvedova A.A., Borisenko G. 2009. Cytochrome c/cardiolipin relations in mitochondria: A kiss of death. Free Radic. Biol. Med. 46 (11), 1439–1453.
Vladimirov Y.A. 1996. Intrinsic (low-level) chemiluminescence. In: Free radicals. A practical approach. Eds Punchard N.A. Oxford, New York, Tokyo: Oxford University Press, p. 65–82.
Gryzunov Y.A., Arroyo A., Vigne J.L., Zhao Q., Tyurin V.A., Hubel C.A., Gandley R.E., Vladimirov Y.A., Taylor R.N., Kagan V.E. 2003. Binding of fatty acids facilitates oxidation of cysteine-34 and converts copper-albumin complexes from antioxidants to prooxidants. Arch. Biochem. Biophys. 413 (1), 53–66.
Bergstrom C.L., Beales P.A., Lv Y., Vanderlick T.K., Groves J.T. 2013. Cytochrome c causes pore formation in cardiolipin-containing membranes. Proc. Natl. Acad. Sci. USA. 110 (16), 6269–6274.
Firsov A.M., Kotova E.A., Korepanova E.A., Osipov A.N., Antonenko Y.N. 2015. Peroxidative permeabilization of liposomes induced by cytochrome c/cardiolipin complex. Biochim. Biophys. Acta. 1848 (3), 767 774.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


