Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 5, стр. 350-360
Влияние ионных токов плазматической мембраны на флуоресценцию хлорофилла и тушение возбужденных состояний в хлоропластах Сhara
А. А. Булычев a, *, Н. А. Крупенина a, А. А. Черкашин a
a Московский государственный университет им. М.В. Ломоносова, биологический факультет
119991 Москва, Россия
* E-mail: bulychev@biophys.msu.ru
Поступила в редакцию 02.04.2020
После доработки 23.04.2020
Принята к публикации 24.04.2020
Аннотация
Гигантские клетки Characeae, находясь на свету, сочетают возбудимость с неравномерным распределением фотосинтеза и трансмембранных потоков Н+. Возбуждение плазмалеммы в этих условиях вызывает переходную диссипацию наружных щелочных и кислых зон, а также подавление фотосинтеза в области щелочных зон. После генерации потенциала действия такие клетки проходят через стадию гиперполяризации, которая достигает максимума в течение 1 мин и продолжается до 15 мин. Чтобы исключить участие спонтанных изменений потенциала покоя в ответных реакциях хлоропластов на возбуждение плазмалеммы, в данной работе прослежены изменения флуоресценции хлорофилла, вызываемые короткой деполяризацией в режиме фиксации напряжения. Показано, что для снижения максимальной флуоресценции $F_{m}^{'}$ и фотосинтетической активности после надпороговой деполяризации необходимо не только развитие входящего Са2+- и Cl–-токов, но и стационарное поступление в цитоплазму Н+ (выведение ОН–) до момента приложения электрического стимула. Выявлены различия в амплитуде ионных токов, вызываемых короткой деполяризацией плазмалеммы на свету и в темноте в области наружных щелочных и кислых зон. Результаты согласуются с представлениями о том, что интенсивное поступление Н+ из наружной среды в клетку на свету приводит к понижению рН цитоплазмы. Различия ионных токов в разных частях клетки могут частично определяться наличием множественных инвагинаций плазмалеммы – харасом, специфично локализованных в кислых зонах, а также резкими локальными сдвигами наружного рН в кислых зонах при перфорации клеточной стенки измерительным микроэлектродом.
ВВЕДЕНИЕ
Метаболические процессы, протекающие в разных структурах растительной клетки, тесно сопряжены. Освещенные хлоропласты экспортируют в цитозоль избыток восстановленных продуктов, которые используются в дыхательной цепи митохондрий, а также служат субстратом для NADPH-оксидазы плазматической мембраны. Митохондрии обеспечивают необходимой энергией ионные насосы плазмалеммы, непрерывное движение цитоплазмы и разнообразные реакции биосинтеза. Потенциалозависимые и Са2+-управляемые ионные каналы наружной мембраны и тонопласта участвуют во внутриклеточной регуляции и сигнализации. Запуск фотосинтеза у ряда растений вызывает возникновение потенциала действия, который развивается сходным образом на непрерывном свету и в темноте после короткого освещения [1, 2]. Передача сигналов происходит как от тилакоидных мембран к плазмалемме, так и в обратном направлении – от клеточной мембраны к хлоропластам. Например, инициация потенциала действия в клетках харовой водоросли и ловчих листьях насекомоядного растения Dionaea muscipula вызывает временное торможение фотосинтеза [3–5].
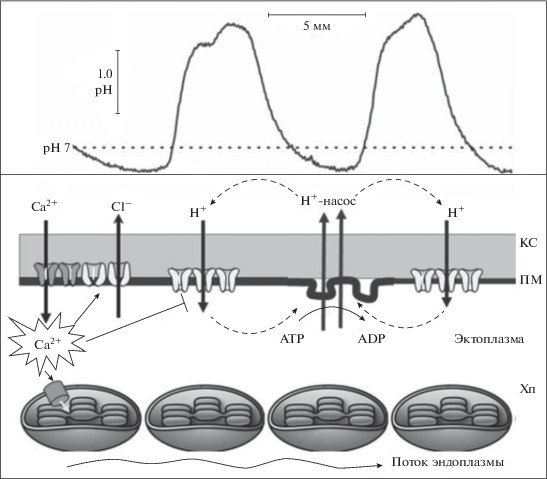
Влияние потенциала действия на фотосинтетическую активность хлоропластов Chara проявлялось особенно сильно в участках клетки с высокой пассивной проводимостью для Н+ или ОН–, формирующих внеклеточные щелочные зоны. При этом оно было слабо выражено в участках с высокой активностью Н+-насоса плазмалеммы, где возникают наружные кислые зоны [6, 7]. Сведения об участии Са2+-токов в возбуждении растительных клеток [8, 9], о влиянии Са2+ на фотосинтез [10, 11], а также о подавлении трансмембранных потоков Н+ после генерации потенциала действия [12, 13] указывают на ключевую роль Ca2+ и H+ в трансформации электрического сигнала плазмалеммы, приводящего к нарушению фотосинтетического потока электронов в хлоропластах. Ионы Ca2+ влияют на активность ферментов цикла Кальвина, что сказывается на скорости линейного и циклического потока электронов. Повышение концентрации протонов в тилакоидах и образование трансмембранного градиента рН между люменом и стромой лежит в основе нефотохимического тушения флуоресценции хлорофилла как защитной реакции от избыточного освещения [14]. На рис. 1 схематично показаны потоки H+ через плазмалемму Chara, отвечающие за неоднородный профиль рН на поверхности клетки, а также трансмембранные потоки Са2+ и Cl–, вызываемые деполяризацией плазмалеммы. Повышение уровня Са2+ в цитоплазме активирует Сl– каналы плазмалеммы, блокирует проводимость Н+/ОН–-каналов и временно останавливает течение цитоплазмы.
Рис. 1.
Схематическое изображение сегмента интернодальной клетки Chara и ионных потоков в покое и при возбуждении. Клеточная стенка (КС) создает механическую опору, противодействующую большому перепаду давления. Между плазматической мембраной (ПМ) и слоем хлоропластов (Хп) расположена неподвижная эктоплазма, внутренняя сторона слоя хлоропластов омывается непрерывным потоком эндоплазмы. Текущая цитоплазма отделена от центральной вакуоли тонопластом. На верхней диаграмме показан фрагмент продольного профиля рН у поверхности освещенной клетки. Схема внизу соответствует профилю рН и отражает локализацию наружных кислых и щелочных зон в участках ПМ с активностью Н+-насоса и с пассивным проведением Н+, а также круговые электрические токи. Складки ПМ обозначают обогащенные Н+-АТР-азой органеллы – харасомы, наиболее многочисленные в области наружных кислых зон. Возбуждение вызывает поступление Са2+ в клетку по потенциал-зависимым каналам ПМ, что повышает уровень [Ca2+] в цитоплазме до 10–40 мкМ и инактивирует Н+-проводимость ПМ. Возрастание уровня [Ca2+] в цитозоле активирует также выход Cl– из клетки по Са2+-зависимым Cl–-каналам ПМ (входящий Cl–-ток), а накопление Са2+ в строме Хп при участии светозависимого унипорта подавляет фиксацию СО2, что вызывает повышение градиента рН в тилакоидах и энергозависимое тушение флуоресценции хлорофилла а.
Метод фиксации напряжения служит основным инструментом для изучения ионных токов в клетках растений [9]. Принимая во внимание, что этот метод исключает спонтанные изменения мембранного потенциала, представляется важным использовать его для изучения ионных механизмов регуляции фотосинтеза в возбудимой клетке. Однако такие измерения в силу технических причин долгое время не проводили. Разработка специализированной микрофлуориметрии с модулированным освещением [15] сделала возможным совмещение электродных и флуоресцентных измерений на микроучастках растительной клетки [16].
Результаты данной работы показывают, что короткая (~0.25 с) деполяризация плазмалеммы в режиме фиксации напряжения вызывает длительные (в интервале десятков секунд) изменения фотосинтетических параметров, таких как максимальная флуоресценция хлорофилла ($F_{m}^{'}$), фактическая флуоресценция на действующем свету (F ') и квантовый выход нециклического переноса электронов (ΔF/$F_{m}^{'}$). Наряду с известными компонентами мембранного тока (Са2+- и Сl–-токи) выявлена минорная компонента входящего тока в щелочной зоне покоящейся клетки, которая исчезает на период ~10 мин после импульса деполяризации параллельно с диссипацией щелочной зоны. Формирование и поддержание щелочной зоны отражает стационарный поток Н+ из среды в цитоплазму. Показано, что короткая деполяризация плазмалеммы вызывает резкое снижение $F_{m}^{'}$ и фотосинтеза лишь при наличии входящего тока Н+. Инактивация этого тока на период 10–20 мин после надпороговой деполяризации не препятствует развитию Са2+- и Cl–-токов, однако исключает подавляющее влияние ионных токов на фотосинтез. Полученные данные говорят о совместном участии Са2+ и Н+ в механизме влияния возбудимости на фотосинтетическую активность, а также указывают на разнонаправленные сдвиги рН цитоплазмы при переходах свет–темнота в участках клетки, расположенных под щелочными и кислыми зонами.
МАТЕРИАЛЫ И МЕТОДЫ
В опытах использовали клетки междоузлий водоросли Chara corallina, росшие в аквариуме на рассеянном свету при комнатной температуре. Изолированные междоузлия помещали в искусственную прудовую воду, содержащую 0.1 мМ KCl, 1 мМ NaCl и 0.1 мМ CaCl2. В ходе опыта клетку укрепляли в прозрачной камере из оргстекла на столике инвертированного флуоресцентного микроскопа Axiovert 25-CFL (Zeiss, Германия). Использовали клетки, выдержанные после изоляции не менее суток.
Конструкция трехсекционной измерительной камеры была аналогична модели, описанной в работе [17]. Площадь боковой поверхности клетки в центральном отсеке составляла ~0.07 см2. Капиллярный микроэлектрод для измерения мембранного потенциала вводили в участок клетки, расположенный в центральном отсеке камеры. Электродом сравнения служил Ag/AgCl-электрод, соединенный с центральным отсеком камеры с помощью солевого мостика. Токовые хлорсеребряные электроды располагались в центральном и боковых отсеках камеры. Измерения переходного тока, вызванного изменением напряжения на мембране, проводили в режиме фиксации потенциала на выделенном рабочем участке клетки длиной 2.5 мм по четырехэлектродной методике [17, 18]. Для фиксации напряжения на мембране использовали специализированный усилитель Dagan 8500 (США). В качестве управляющего и регистрирующего устройства применяли АЦП PCI-6024E (National Instruments, США) в сочетании с программой WinWCP (Strathclyde Electrophysiology Software). Величины тока через анализируемый участок представлены в абсолютных значениях (мкА) без пересчета на единицу поверхности клетки. Начальный уровень фиксируемого напряжения (Vh) выбирали так, чтобы он был близок к потенциалу покоя.
Параметры флуоресценции хлорофилла in vivo определяли на микроучастках диаметром ~100 мкм методом насыщающих импульсов, используя микрофлуориметр Microscopy-PAM (Walz, Германия) с объективом ×32/0.4. Данные представлены в виде изменений максимальной флуоресценции $F_{m}^{'}$, индуцируемой насыщающими вспышками, и изменений фактической флуоресценции F ', измеряемой при общем фоновом освещении клетки. Сигнал с фотоумножителя поступал на блок управления (PAM Control Unit) и оцифровывался с помощью АЦП PCI-6024E (National Instruments).
Фоновое освещение всей клетки создавали с помощью верхнего осветителя микроскопа и свeтофильтра СЗС-22 (λ < 580 нм). Интенсивность фонового освещения ослабляли с помощью стеклянных нейтральных светофильтров. В большинстве случаев она составляла 28 мкмоль квантов м–2 с–1, так как обеспечивала наиболее сильные сдвиги флуоресценции $F_{m}^{'}$ в ответ на короткую надпороговую деполяризацию. Для индукции переходов между однородным и неоднородным распределением рН на поверхности клетки использовали повышенные интенсивности света (78 мкмоль м–2 с–1).
Значения pH на поверхности клетки (pHo) измеряли с помощью сурьмяных pH-микроэлектродов в стеклянной изоляции с диаметром кончика 5–15 мкм. Измерения pHo позволяли отличать области активного выведения Н+ (pHo 6.2–6.7) и зоны пассивного поглощения Н+ (pHo 9–9.5). Наличие щелочной зоны у поверхности клетки при нейтральном рН в объеме среды говорит о непрерывном диффузионном потоке Н+ через неперемешиваемый слой, который равен мембранному потоку Н+ или встречно направленному потоку ОН–. Генератором локальных круговых токов служат кислые зоны, обогащенные Н+-ATP-азой. Замыкаются круговые токи в области щелочных зон, обладающих высокой проводимостью для Н+ или ОН–. Хотя вопрос о природе переносимого иона в щелочных зонах – пассивное поступление в клетку Н+ или выведение из клетки ОН– – еще не решен [19], мы используем один термин “входящий поток Н+”. Способность клеток образовывать зоны с высоким и низким рН в центральном отсеке камеры предполагает протекание слабых круговых электрических токов либо в пределах изолированного участка, либо между примыкающими отсеками по водному пространству клеточных стенок. Эти слабые круговые токи, вероятно, были достаточными для образования и поддержания щелочных и кислых областей.
На рисунках показаны результаты, полученные не менее чем в трехкратном воспроизведении на разных клетках. Экспериментальные кривые с доверительными интервалами отражают усредненные данные и стандартные отклонения.
РЕЗУЛЬТАТЫ
Токи, отражающие инактивацию Н+(ОН–)-проводимости в щелочных зонах
На рис. 2 представлены записи ионного тока, вызванные короткой (240 мс) деполяризацией мембраны от –170 до +30 мВ с последующим возвратом к исходному уровню мембранного потенциала, а также вызванные деполяризацией изменения флуоресценции $F_{m}^{'}$ и F'. Измерения проводили в области наружной щелочной зоны после длительной (20 мин) экспозиции клетки в покое на сине-зеленом свету ( λ < 580 нм) (а, б), а также через 4.5 мин после надпороговой деполяризации, вызывающей снижение проводимости плазмалеммы и диссипацию щелочной зоны [20]. Характерное время развития ионных токов составляет несколько секунд (а, в), а вызванные ими изменения флуоресценции продолжаются в течение 10–20 мин после деполяризующего импульса (б, г).
Рис. 2.
Ионные токи (а, в) плазматической мембраны интернодальной клетки Chara corallina, вызванные коротким деполяризующим импульсом (+30 мВ, 240 мс), и последующие изменения фактической (F ') и максимальной ($F_{m}^{'}$) флуоресценции хлорофилла в хлоропластах под наружной щелочной зоной (б, г) в том же опыте. а, б – После 20 мин инкубации клетки в покое на свету; в, г – на свету через 4.5 мин после возбуждения деполяризующим стимулом. Протокол изменения напряжения на мембране представлен на диаграммах в верхней части рис. 2а и 2в с указанием командного потенциала для каждой ступени в милливольтах. Исходный стационарный уровень тока принят за ноль.
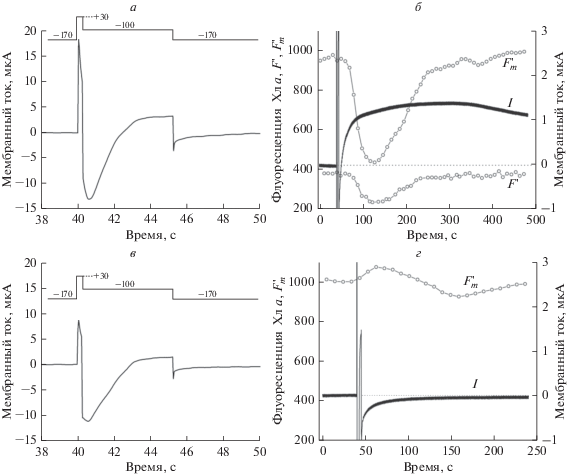
Как известно, входящий ток включает небольшую кальциевую и преобладающую хлорную составляющие [9, 17]. Амплитуды входящего тока на рис. 2а и 2в были примерно равными, т.е. слабо зависели от состояния пассивной Н+(ОН–)-проводимости мембраны. Вместе с тем амплитуда выходящего тока в момент приложения деполяризующего импульса была значительно выше при наличии щелочной зоны, чем в период инактивации пассивного потока Н+ после приложения надпорогового деполяризующего импульса (ср. рис. 2а и 2в). Ранее показано, что высокая проводимость плазмалеммы в области щелочной зоны (8.3 ± 1.1 См м–2) снижается примерно в 5 раз в течение первой минуты после генерации потенциала действия и остается почти на таком же низком уровне после 5 мин покоя [20]. Это говорит о том, что повышенная амплитуда выходящего тока на рис. 2а обусловлена высокой проводимостью мембраны при открытых Н+(ОН–)-проводящих каналах (“high pH channels” [21, 22]). Высокая проводимость плазмалеммы при щелочных рН среды свойственна клеткам междоузлий Chara [21] и Nitellopsis [22].
Исходя из этих данных, можно предполагать, что в состоянии покоя через мембрану, лежащую под щелочной зоной, протекает направленный в клетку поток Н+ или выходящий поток ОН–. Соответственно можно ожидать, что инактивация высокой проводимости после остановки этого потока вслед за надпороговой деполяризацией должна проявляться по кинетическим кривым ионных токов.
Приведенные на рис. 2а записи ионных токов представлены на рис. 2б в другом масштабе по амплитуде и времени, что позволяет выявить следовые изменения токов, происходящие после завершения ступенчатой деполяризации. Видно, что деполяризация клетки после длительного (20 мин) периода покоя вызывает развитие тока, который, по-видимому, отражает инактивацию стационарного входящего тока Н+. Характерное время нарастания этой компоненты тока (~1 мин) соответствует ранее найденному времени инактивации Н+-проводящих каналов, вызванной электрическим возбуждением клетки [20]. Амплитуда этой компоненты тока (1.4 мкА) при расчете на единичную площадь составила ~20 мкА см–2. Это значение соответствует величине входящего тока (20–60 мкА см–2) в области щелочных зон у клеток Chara, измеренной с помощью вибрирующих микроэлектродов [23]. Для обратного смещения тока к исходному уровню и восстановления щелочной зоны требовалось не менее 15–20 мин инкубации клетки на свету в состоянии покоя. Наряду с инактивацией стационарного входящего тока, деполяризующий импульс вызывал сильное тушение флуоресценции F' и $F_{m}^{'}$ (рис. 2б), а также кинетически сходное уменьшение квантового выхода переноса электронов в фотосистеме II (ФСII) с максимальным снижением параметра ΔF/$F_{m}^{'}$ от 0.6 до 0.45 (не показано).
На рис. 2в, 2г приведены ионные токи и изменения флуоресценции, происходящие на том же участке клетки в условиях, когда деполяризующий импульс был приложен через 4.5 мин после предыдущего электрического стимула. Этот период достаточен для сильного ослабления щелочной зоны. При этом проводимость мембраны опускается до уровня намного ниже нормы [20]. В этом случае отсутствовал следовой ток выходящего направления после импульса деполяризации, а индуцированное тушение флуоресценции $F_{m}^{'}$ и F ' не развивалось. Более того, импульс деполяризации индуцировал небольшое возрастание $F_{m}^{'}$, которое в стандартных условиях опыта маскируется сильным тушением $F_{m}^{'}$. Таким образом, хотя параметры входящего тока не претерпели изменений при переходе от длительного к короткому периоду покоя (рис. 2а, 2в), деполяризация плазмалеммы не индуцировала нефотохимического тушения и не снижала квантовую эффективность линейного потока электронов. Это говорит о необходимости входящего потока Н+ для эффективного влияния деполяризации плазмалеммы на фотосинтетическую активность хлоропластов.
Реакция $F_{m}^{'}$ на деполяризацию не чувствительна к стимуляции Cl–-тока
Для того чтобы выяснить роль входящего Cl–-тока в сопряжении деполяризации клетки с подавлением фотосинтеза в хлоропластах под щелочными зонами, были проведены опыты с включением в протокол изменения напряжения дополнительного гиперполяризующего импульса, который усиливал выведение Cl– по Са2+-активируемым хлорным каналам, повышая тем самым амплитуду входящего тока (рис. 3).
Рис. 3.
Повышение амплитуды входящего Cl–-тока (а, в) не оказывает заметного влияния на амплитуду индуцированного тушения $F_{m}^{'}$ (б, г). Протоколы изменения фиксируемого напряжения отражены на диаграммах в верхней части рис. 3а и 3в с указанием командного потенциала для каждой ступени в милливольтах. Трехкратное изменение амплитуды Cl–-тока при смене протокола импульсов (а, в) не сказывалось на уровне нефотохимического снижения $F_{m}^{'}$ в этом же опыте (б, г).
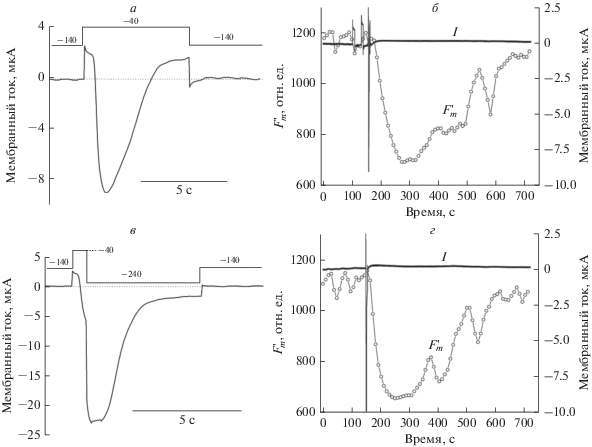
Как видно из рис. 3, кратковременная деполяризация мембраны от –140 до –40 мВ индуцирует сильное снижение флуоресценции $F_{m}^{'}$, независимо от амплитуды входящего Cl–-тока, который возрастал при дополнительной ступени гиперполяризации. На фоне сравнительно высоких концентраций Cl– в цитоплазме и вакуоли (~10 и 100 мМ соответственно [24]), относительные изменения концентрации Cl– после кратковременной деполяризации, по-видимому, невелики по сравнению с изменениями концентрации Са2+. Во всяком случае, возможные сдвиги уровня внутриклеточного Cl– не сказывались на изменениях флуоресценции хлорофилла и квантового выхода реакции ФСII.
Различия ионных токов в области щелочных и кислых зон
Известно, что проводимость Ca2+-чувствительных хлорных каналов в клетках Chara зависит от рН цитоплазмы (рНц) [25]. Физиологические различия рН цитоплазмы, вероятно, свойственны участкам клетки, осуществляющим активное выведение протонов и встречно направленное пассивное проведение Н+ [26–29]. Предполагают, что поступление Н+ в клетку понижает рНц под щелочными зонами, а выведение Н+ повышает рНц под кислыми зонами. В связи с этим мы выбирали участки клетки, формирующие наружные щелочные и кислые зоны, и измеряли вызванные деполяризацией переходные токи, отражающие преимущественно потоки Cl–.
На рис. 4 представлены ионные токи, возникающие в ответ на короткую (240 мс) деполяризацию в области наружной щелочной (а) и кислой (б) зоны. В ходе опыта клетку поочередно выдерживали 20 мин на сине-зеленом свету (λ < 580 нм, 78 мкмоль м–2 с–1) для формирования неоднородного профиля рН, а затем 20 мин в темноте для сглаживания неравномерного распределения рН, после чего переходили к новому циклу освещения и затенения.
Рис. 4.
Вызванные деполяризацией ионные токи в области наружной щелочной (а) и кислой (б) зоны клеток Chara: 1 – на свету (78 мкмоль м–2 с–1); 2 – после 20 мин инкубации клеток в темноте, вызывающей диссипацию щелочных и кислых зон. Представлены усредненные записи и стандартные отклонения среднего, полученные на разных клетках при n = 3 (а) и n = 4 (б). Диаграммы в верхней части рисунков отражают протокол изменения напряжения (в милливольтах) на плазматической мембране.
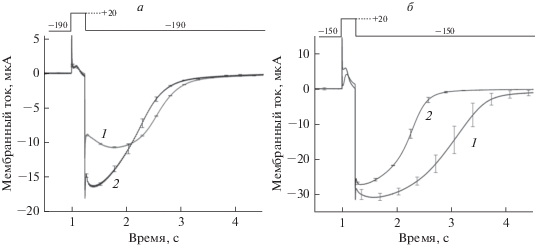
Амплитуда входящего тока в щелочной зоне на свету (рис. 4а, кривая 1) была меньше, чем в той же области после 20 мин темноты (кривая 2). Кроме того, Cl–-токи в щелочной зоне были меньше, чем пиковые значения Cl–-тока в кислой зоне той же клетки (22–25 мкА, не показано). При интерпретации результатов мы учитывали зависимость хлорных токов от рН, обнаруженную в условиях внутриклеточной перфузии [18]. По данным опытов с перфузией в условиях разрушения тонопласта, повышение внутриклеточного рН сопровождается увеличением амплитуды и сокращением длительности инактивации Cl–-тока [18]. Пониженная амплитуда Cl–-тока в щелочной зоне на свету (рис. 4а, кривая 1) согласуется с предполагаемым сдвигом рНц в сторону кислых значений вследствие интенсивного входящего потока Н+. Остановка входящего потока после помещения клетки в темноту, вероятно, повышала рНц, что приводило к возрастанию Cl–-тока (рис. 4а, кривая 2).
В кислой зоне (рис. 4б) влияние освещения и затенения клетки на Cl–-токи было существенно иным. Максимальная амплитуда Cl–-тока была отмечена на свету, а затенение клетки приводило к снижению пиковых значений тока. Амплитуды Cl–-токов в кислой зоне были, как правило, выше, чем в щелочной зоне, причем отличия проявлялись даже при измерениях на кислых и щелочных участках одной и той же клетки. Выявленные различия по амплитуде Cl–-токов на свету и в темноте согласуются с предполагаемым щелочным смещением рНц в области наружной кислой зоны. Различия по амплитуде Cl–-токов на рис. 4а и 4б также соответствуют представлениям о более низкой величине рНц под щелочными зонами по сравнению с рНц под кислыми зонами. Вместе с тем скорости инактивации Cl–-токов в разных зонах интактных освещенных клеток не проявляли заметной корреляции с их амплитудными значениями в отличие от наблюдений [18] на перфузированных клетках, лишенных тонопласта.
ОБСУЖДЕНИЕ
Изменения флуоресценции и фотосинтеза в клетках Chara после генерации потенциала действия известны уже давно [3]. Однако все измерения проводились в режиме свободного изменения мембранного потенциала клетки. Вместе с тем известно, что в случае формирования на свету неоднородного продольного профиля рН мембранный потенциал клеток претерпевает длительные изменения после однократного потенциала действия [7]. В этих условиях вслед за потенциалом действия развивалась длительная гиперполяризация с амплитудой 50–60 мВ, причем исходный уровень мембранного потенциала восстанавливался за время ~15 мин [7, 20]. Чтобы исключить влияние свободного дрейфа мембранного потенциала на активность хлоропластов, в данной работе использован метод фиксации напряжения. Результаты, представленные на рис. 2 и 3, показывают, что кратковременное деполяризующее смещение мембранного потенциала с последующим восстановлением исходного потенциала вызывает сильные изменения флуоресценции $F_{m}^{'}$ и F ' в хлоропластах, расположенных под наружными щелочными зонами. Эти изменения, равно как и снижение квантового выхода переноса электронов в ФСII (ΔF/$F_{m}^{'}$), развивались после некоторой критической деполяризации, достаточной для возникновения входящего тока (см. записи тока и $F_{m}^{'}$ на рис. 3б).
Качественное сходство изменений флуоресценции в режиме фиксации напряжения и при свободных изменениях мембранного потенциала указывает на то, что основную роль в запуске ответной реакции на электростимул играют события, развивающиеся на плазмалемме в секундном интервале времени, такие как поступление в цитоплазму Ca2+ и выход Cl– [17]. В последнее время выяснилось, что изменения концентрации Са2+ в цитоплазме фотосинтезирующих клеток Arabidopsis при различных воздействиях сопровождаются параллельными изменениями внутриклеточного рН [30], однако механизм такой взаимосвязи пока не установлен. Частично эта связь определяется тем, что Са2+ и Н+ конкурируют за общие участки связывания [31]. Взаимосвязь уровня Са2+ и рН в цитоплазме представляется важным элементом ионной регуляции фотосинтеза, поскольку энергозависимое тушение $F_{m}^{'}$ (см. рис. 2, 3) обусловлено накоплением протонов в люмене тилакоидов. Следует также учитывать, что повышение уровня Са2+ в строме хлоропластов при поступлении Са2+ из наружной среды подавляет реакции цикла Кальвина, а это повышает градиент рН на тилакоидной мембране, поскольку снижается потребление ATP в цикле фиксации СО2.
Полученные результаты (рис. 2) показывают, что входящий поток Са2+ является необходимым, но недостаточным условием для развития тушения $F_{m}^{'}$ и торможения нециклического переноса электронов. Величины Са2+- и Cl–-токов были примерно равными в состоянии с максимально активной щелочной зоной (состояние покоя на свету, рис. 2а, 2б) и в условиях ее ослабления после предшествующего деполяризующего импульса (рис. 2в, 2г). Вместе с тем сильное тушение $F_{m}^{'}$ возникало лишь при условии поддержания щелочной зоны, т.е. при наличии входящего потока Н+. Это говорит о том, что ответная реакция хлоропластов на повышение уровня Са2+ в цитоплазме зависит от величины рНц. Можно предполагать, что эта реакция выражена наиболее сильно при пониженных значениях рНц, которые обусловлены входящим потоком Н+. Следовые изменения токов, регистрируемых в интервале от 1 мин до 10–15 мин после завершения деполяризующего импульса, согласуются с данными об инактивации Н+-проводящих каналов (high pH channels) в этом диапазоне времени. Амплитуда следовых токов приближается к оценкам плотности локальных токов в области щелочных зон, выполненным другим методом [23].
В отличие от входящих потоков Са2+ и Н+, которые необходимы для нефотохимического тушения возбужденных состояний хлорофилла в ответ на деполяризацию плазмалеммы, Са2+-зависимые потоки Cl–, по-видимому, играют меньшую роль в этой регуляторной реакции фотосинтеза. Как видно из рис. 3, значительное увеличение амплитуды Cl–-тока за счет дополнительной ступени гиперполяризации не оказывало влияния на амплитуду изменений флуоресценции $F_{m}^{'}$. Наряду с этим, амплитуды Са2+-активируемого хлорного тока существенно различались в зависимости от проведения измерений в области локализации щелочной или кислой зоны (рис. 4). Эти наблюдения в основном соответствуют сведениям о зависимости хлорных токов в перфузируемых клетках от величины рН цитоплазмы [18]. Результаты этой части работы косвенно подтверждают различия рНц под щелочными и кислыми зонами освещенных клеток, а именно, пониженные значения рНц в участках клетки с преобладанием пассивного входящего потока Н+.
На кинетические кривые мембранного тока в щелочных и кислых зонах могут влиять особенности структуры этих частей междоузлий и их ответных реакций на микроукол при введении капиллярного микроэлектрода. Области, расположенные под кислыми зонами Chara, содержат большое число харасом – органелл, которые представляют собой разветвленную систему связанных с плазмалеммой канальцев [32], обогащенных содержанием Н+-ATP-азы [33]. Функция харасом, по-видимому, заключается в увеличении эффективной поверхности с активностью Н+-насоса плазмалеммы, что способствует поступлению в клетки СО2, используемого при фотосинтезе. Харасомы практически отсутствуют в частях клетки, формирующих щелочные зоны [33]. В связи с этим эффективные площади поверхности, через которые протекают ионные токи, индуцированные деполяризацией, могут не совпадать для щелочных и кислых зон. По данным работы [34], значения электрической емкости плазмалеммы в области кислых зон были в 1.44 раза выше, чем в области наружных щелочных зон. Эти различия, возможно, обусловлены неравномерным пространственным распределением харасом. Вместе с тем противоположное влияние переходов свет–темнота на ионные токи в щелочных и кислых зонах определяется не харасомами, а лабильностью зон с разными значениями рН, поскольку харасомы представляют собой стабильные структуры и сохраняются на протяжении нескольких суток после помещения клеток в темноту.
Введение стеклянного микроэлектрода в цитоплазму для измерения мембранного потенциала неизбежно сопряжено с микроповреждением клеточной стенки, которое вызывает быстрое локальное образование щелочной зоны, время жизни которой на свету достигает 40 мин [35]. В результате при измерениях мембранного потенциала и ионных токов в области кислой зоны значения наружного рН на анализируемой поверхности могут быть существенно неоднородными и варьировать от рН ~ 6.5 до 9.5–10. Однако радиус щелочной зоны в области микроперфорации не превышает обычно 100 мкм. Поэтому площадь поверхности с измененными значениями рН составляет крайне малую часть (<1%) в суммарной поверхности выбранного участка клетки и не может существенно исказить получаемые результаты. Сравнение локальных свойств (ионные токи, проводимость) в области щелочных зон, формируемых в интактной клетке на свету и после микроперфорации клеточной стенки, может служить предметом отдельного исследования.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 20-54-12015).
Список литературы
Bulychev A.A., Vredenberg W.J. 1995. Enhancement of the light-triggered electrical response in plant cells following their de-energization with uncouplers. Physiol. Plant. 94, 64–70.
Trebacz K., Sievers A. 1998. Action potentials evoked by light in traps of Dionaea muscipula Ellis. Plant Cell Physiol. 39, 369–372.
Bulychev A.A., Kamzolkina N.A. 2006. Effect of action potential on photosynthesis and spatially distributed H+ fluxes in cells and chloroplasts of Chara corallina. Russ. J. Plant Physiol. 53, 1–9.
Pavlovic A., Demko V., Hudák J. 2010. Trap closure and prey retention in Venus flytrap (Dionaea muscipula) temporarily reduces photosynthesis and stimulates respiration. Ann. Bot. 105, 37–44.
Krupenina N.A., Bulychev A.A. 2007. Action potential in a plant cell lowers the light requirement for non-photochemical energy-dependent quenching of chlorophyll fluorescence. Biochim. Biophys. Acta. 1767, 781–788.
Bulychev A.A., Kamzolkina N.A., Rubin A.B. 2005. Effect of plasmalemma electrical excitation on photosystem II activity and nonphotochemical quenching in chloroplasts of cell domains in Chara corallina. Dokl. Biochem. Biophys. 401, 127–130.
Bulychev A.A., Kamzolkina N.A. 2006. Differential effects of plasma membrane electric excitation on H+ fluxes and photosynthesis in characean cells. Bioelectrochemistry. 69, 209–215.
Williamson R.E., Ashley C.C. 1982. Free Ca2+ and cytoplasmic streaming in the alga Chara. Nature. 296, 647–651.
Berestovsky G.N., Kataev A.A. 2005. Voltage-gated calcium and Ca2+-activated chloride channels and Ca2+ transients: Voltage-clamp studies of perfused and intact cells of Chara. Eur. Biophys. J. 34, 973–986.
Stael S., Wurzinger B., Mair A., Mehlmer N., Vothknecht U.C., Teige M. 2012. Plant organellar calcium signalling: An emerging field. J. Exp. Bot. 63, 1525–1542.
Hochmal A.K., Schulze S., Trompelt K., Hippler M. 2015. Calcium-dependent regulation of photosynthesis. Biochim. Biophys. Acta. 1847, 993–1003.
Bulychev A.A., Kamzolkina N.A., Luengviriya J., Rubin A.B., Müller S.C. 2004. Effect of a single excitation stimulus on photosynthetic activity and light-dependent pH banding in Chara cells. J. Membr. Biol. 202, 11–19.
Krupenina N.A., Bulychev A.A., Roelfsema M.R.G., Schreiber U. 2008. Action potential in Chara cells intensifies spatial patterns of photosynthetic electron flow and non-photochemical quenching in parallel with inhibition of pH banding. Photochem. Photobiol. Sci. 7, 681–688.
Ruban A.V., Johnson M.P., Duffy C.D.P. 2012. The photoprotective molecular switch in the photosystem II antenna. Biochim. Biophys. Acta. 1817, 167–181.
Goh C.H., Schreiber U., Hedrich R. 1999. New approach of monitoring changes in chlorophyll a fluorescence of single guard cells and protoplasts in response to physiological stimuli. Plant, Cell Environ. 22, 1057–1070.
Bulychev A.A., Cherkashin A.A., Rubin A.B., Vredenberg W.J., Zykov V. S., Müller S.C. 2001. Comparative study on photosynthetic activity of chloroplasts in acid and alkaline zones of Chara corallina. Bioelectrochemistry. 53, 225–232.
Lunevsky V.Z., Zherelova O.M., Vostrikov I.Y., Berestovsky G.N. 1983. Excitation of Characeae cell membranes as a result of activation of calcium and chloride channels. J. Membr. Biol. 72, 43–58.
Катаев А.А. 2008. Функциональные свойства Са2+-активируемых хлорных каналов харовых водорослей. Дисс. канд. биол. наук. Пущино: Институт биофизики клетки РАН. 117 с.
Beilby M.J., Al Khazaaly S. 2009. The role of H+/OH– channels in the salt stress response of Chara australis. J. Membr. Biol. 230, 21–34.
Bulychev A.A., Krupenina N.A. 2009. Transient removal of alkaline zones after excitation of Chara cells is associated with inactivation of high conductance in the plasmalemma. Plant Signal. Behav. 4, 727–734.
Beilby M.J., Bisson M.A. 1992. Chara plasmalemma at high pH: Voltage dependence of the conductance at rest and during excitation. J. Membr. Biol. 125, 25–39.
Beilby M.J., Mimura T., Shimmen T. 1993. The proton pump, high pH channels, and excitation: Voltage clamp studies of intact and perfused cells of Nitellopsis obtusa. Protoplasma. 175, 144–152.
Lucas W.J., Nuccitelli R. 1980. HC${\text{O}}_{3}^{ - }$ and OH– transport across the plasmalemma of Chara. Planta. 150, 120–131.
Coster H.G.L. 1966. Chloride in cells of Chara australis. Aust. J. Biol. Sci. 19, 545–554.
Johannes E., Crofts A., Sanders D. 1998. Control of Cl– efflux in Chara corallina by cytosolic pH, free Ca2+, and phosphorylation indicates a role of plasma membrane anion channels in cytosolic pH regulation. Plant Physiol. 118, 173–181.
Bulychev A.A., Komarova A.V. 2014. Long-distance signal transmission and regulation of photosynthesis in characean cells. Biochemistry (Moscow). 79, 273–281.
Feijó J.A., Sainhas J., Hackett G.R, Kunkel J.G., Hepler P.K. 1999. Growing pollen tubes possess a constitutive alkaline band in the clear zone and a growth-dependent acidic tip. J. Cell Biol. 144, 483–496.
Bulychev A.A. Komarova A.V. 2017. Photoregulation of photosystem II activity mediated by cytoplasmic streaming in Chara and its relation to pH bands. Biochim. Biophys. Acta. 1858, 386–395.
Bulychev A.A., Krupenina N.A. 2019. Interchloroplast communications in Chara are suppressed under the alkaline bands and are relieved after the plasma membrane excitation. Bioelectrochemistry. 129, 62–69.
Behera S., Zhaolong X., Luoni L., Bonza M.C., Doccula F.G., De Michelis M.I., Morris R.J., Schwarzländer M., Costa A. 2018. Cellular Ca2+ signals generate defined pH signatures in plants. Plant Cell. 30, 2704–2719.
Plieth C., Sattelmacher B., Hansen U.P. 1997. Cytoplasmic Ca2+–H+-exchange buffers in green algae. Protoplasma. 198, 107–124.
Franceschi V.R., Lucas W.J. 1980. Structure and possible function(s) of charasomes; complex plasmalemma-cell wall elaborations present in some characean species. Protoplasma. 104, 253–271.
Schmölzer P.M., Höftberger M., Foissner I. 2011. Plasma membrane domains participate in pH banding of Chara internodal cells. Plant Cell Physiol. 52, 1274–1288.
Chilcott T.C., Coster H.G.L. 1999. Electrical impedance tomography study of biological processes in a single cell. Ann. N.Y. Acad. Sci. 873, 269–286.
Bulychev A.A., Alova A.V., Bibikova T.N. 2013. Strong alkalinization of Chara cell surface in the area of cell wall incision as an early event in mechanoperception. Biochim. Biophys. Acta. 1828, 2359–2369.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


