Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 6, стр. 434-441
IP3-рецептор второго типа является доминантной изоформой в клетках HEK-293
М. Ф. Быстрова a, О. А. Рогачевская a, Е. Н. Кочкина a, Е. Е. Копылова a, Н. П. Коваленко a, С. С. Колесников a, *
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290
Московская обл., Пущино, Россия
* E-mail: staskolesnikov@yahoo.com
Поступила в редакцию 20.05.2020
После доработки 13.07.2020
Принята к публикации 17.07.2020
Аннотация
Многие первичные медиаторы способны инициировать внутриклеточную Са2+-сигнализацию, стимулируя поверхностные рецепторы клеток, сопряженные с фосфоинозитидным каскадом. Ключевыми в этом процессе являются продукция вторичного медиатора IP3, катализируемая фосфолипазой С, и IP3-зависимый выброс депонированного Са2+. Регуляторная роль IP3 сводится к активации IP3-рецепторов, являющихся лиганд-управляемыми Са2+-проницаемыми каналами, функционирующими в эндоплазматическом ретикулуме и некоторых других внутриклеточных органеллах. Геномы позвоночных содержат три гена, кодирующие субъединицы IP3-рецепторов, включая IP3R1, IP3R2 и IP3R3. В разных клетках функционируют различные комбинации IP3-рецепторов, активность которых находится под контролем различных механизмов, что определяет индивидуальные особенности IP3-зависимых Са2+-сигналов и специфическую роль IP3-рецепторов в физиологии клеток данного типа. Клетки линии HEK-293 повсеместно используются как модельная гетерологическая система для экспрессии рекомбинантных белков и исследования рецепторных систем и механизмов внутриклеточной сигнализации. В этих клетках функционируют все три изоформы IP3-рецепторов. Для анализа связи активности IP3-рецепторов и различных аспектов внутриклеточной Са2+-сигнализации определенные перспективы открывает создание линий клеток, в которых подтипы IP3R-рецепторов функционируют в различных комбинациях. В данной работе в клетках HEK-293 были последовательно инактивированы гены IP3R1 и IP3R3 с использованием системы CRISPR/Cas9 и была получена моноклональная линия клеток HEK-293IP3R2++, в которой функционален только IP3R2. Сравнительный анализ внутриклеточной Са2+-сигнализации, инициируемой ацетилхолином в клетках HEK-293 и клетках HEK-293IP3R2++, свидетельствовал о том, что генетичeская инактивация генов IP3R1 и IP3R3 не привела к изменению параметров Са2+-ответов на ацетилхолин. В целом, полученные данные указывают на то, что в клетках HEK-293 ключевой вклад в генерацию Са2+-ответов на агонисты вносит IP3-рецептор второго типа.
ВВЕДЕНИЕ
Внутриклеточная Са2+-сигнализация является одним из ключевых процессов клеточной физиологии, который вовлечен в регуляцию самых разнообразных клеточных функций, включая подвижность, дифференцировку и пролиферацию, экспрессию генов, синаптическую передачу, трансэпителиальный транспорт, мышечную сократимость и апоптоз [1]. Многие рецепторы, функционирующие на клеточной поверхности, сопряжены с фосфоинозитидным каскадом и при активации агонистами способны инициировать мобилизацию внутриклеточного Са2+. Ключевым этапом в этом процессе является продукция вторичного медиатора IP3, катализируемая фосфолипазой С, и IP3-зависимый выброс депонированного Са2+ из Са2+-депо, в роли которого выступает специализированная часть эндоплазматического ретикулума (ЭР), примыкающая к плазмолемме [2, 3]. Регуляторная роль IP3 сводится к активации IP3-рецепторов, которые фактически являются лиганд-управляемыми Са2+-проницаемыми каналами, функционирующими в ЭР и некоторых других внутриклеточных органеллах [4]. Помимо IP3 цитозольный Са2+ также является ключевым регулятором IP3-рецепторов, оказывая при относительно небольших концентрациях стимулирующее воздействие и ингибируя их активность при микромолярных концентрациях [4, 5]. Связывание Ca2+ с высокоаффинным активаторным сайтом IP3-рецептора приводит к существенному росту вероятности открытого состояния этого Ca2+-канала [6], так что ионы Ca2+, высвободившиеся из Ca2+-депо через IP3-рецептор, потенцируют его активность. Эта и аналогичная положительная обратная связь в случае рианодиновых рецепторов лежат в основе Ca2+-индуцированного выброса депонированного Ca2+ (Ca2+-induced Ca2+ release, CICR) – регенеративного процесса, который детерминирует многие аспекты внутриклеточной Ca2+-сигнализации [2, 7].
Геномы позвоночных содержат три гена, которые кодируют субъединицы IP3-рецепторов, включая IP3R1, IP3R2 и IP3R3, которые способны формировать гомо- и гетеротетрамерные каналы [5], хотя ряд данных указывает на то, что доля гетеротетрамеров в клетках невелика [8]. Несмотря на высокую степень гомологии первичных последовательностей IP3R1, IP3R2 и IP3R3, они заметно отличаются по своим биофизическим свойствам и характеризуются разными регуляторными механизмами и чувствительностью к IP3 и Са2+ [4, 5]. Так, аффинности связывания IP3 описываются рядом IP3R2 > IP3R1 > IP3R3 [9]. В разных клетках IP3-рецепторы функционируют в различных комбинациях, и их индивидуальная активность находится под контролем специфических механизмов, что определяет характерные особенности IP3-зависимой Са2+-сигнализации и специфическую роль IP3-рецепторов в физиологии клеток данного типа и биологической ткани в целом [4, 5]. Так, IP3R1 играет существенную роль в Ca2+-сигнализации в ооцитах, и в его отсутствие процессы оплодотворения и развития протекают с нарушениями [10, 11]. Атаксия у млекопитающих ассоциируется с мутациями IP3R1 [12, 13]. Основной изоформой в кардиомиоцитах является IP3R2, и его аномально высокая экспрессия в этих клетках ассоциируется с сердечной гипертрофией [14]. IP3R3 играет ключевую роль во вкусовой трансдукции, и инактивация гена IP3R3 приводит к потере чувствительности к горьким и сладким стимулам и аминокислотам [15]. В ряде клеток было показано, что IP3R3 локализован в мембранных контактах эндоплазматического ретикулума и митохондрий (mitochondria-associated membranes, MAMs); такая локализация указывает на его участие в формировании митохондриального Са2+-сигнала, который может запускать апоптоз [16, 17].
Клетки линии HEK-293 повсеместно используются как модельная гетерологическая система для экспрессии рекомбинантных белков и для исследований рецепторных систем, механизмов внутриклеточной сигнализации и ионного транспорта. В этих клетках функционируют все три изоформы IP3-рецепторов [18]. Для анализа роли IP3-рецепторов в генерации различных форм Са2+-сигналов, индуцированных агонистами рецепторов, целесообразно использовать линии клеток, в которых IP3R-изоформы функционируют в различных комбинациях. В данной работе мы последовательно инактивировали гены IP3R1 и IP3R3 в клетках HEK-293, используя систему CRISPR/Cas9. В результате была получена моноклональная линия клеток, в которых функционален только IP3R2-подтип, и был проведен функциональный анализ этих генетически модифицированных клеток.
МАТЕРИАЛЫ И МЕТОДЫ
1. Редактирование генов IP3-рецепторов
1.1. Конструкция для направленного редактирования гена IP3R3. Экспрессионная кассета для внесения двухнитевого разрыва в выбранный участок гена IP3R3 сконструирована с использованием плазмиды pGuide-it-tdTomato и реагентов набора Guide-it CRISPR/Cas9 System (Takara). Для конструирования плазмиды pGuide-it-tdTomato/IP3R3 были синтезированы два взаимно-комплементарных олигонуклеотида 5'-ccggATGTCCAGCTTTCTTCACAT-3' и 5'-aaacATGTGAAGAAAGCTGGACAT-3'. Олигонуклеотиды содержали на 5'-концах адаптерные последовательности для последующего клонирования в вектор (подчеркнуты). Фосфорилирование олигонуклеотидов осуществляли с помощью Т4-полинуклеотидкиназы, из набора Anza™ T4 PNK kit (Invitrogen). Реакцию отжига фосфорилированных олигонуклеотидов проводили в буфере Annealing Buffer из набора Guide-it CRISPR/Cas9 System (Takara) в соответствии с рекомендацией производителя. Полученный дуплекс олигонуклеотидов клонировали в линеаризованную плазмиду pGuide-it Vector по липким концам адаптерных последовательностей. Лигазной смесью трансформировали компетентные клетки Stellar Competent Cells (Takara). Наличие вставки в полученных плазмидных клонах и правильность полученной конструкции подтверждались секвенированием.
1.2. Конструкция для направленного редактирования IP3R1. Для выключения гена IP3R1 использовали вектор AIO-GFP, обеспечивающий экспрессию Cas9-D10A никазы, слитой с EGFP, и двух РНК-гидов, содержащих последовательности смыслового и антисмыслового спейсеров [19]. Вектор AIO-GFP был предоставлен Steve Jackson (Addgene plasmid # 74 119; http://n2t.net/addgene:74119; RRID:Addgene_74 119). Для конструирования плазмиды AIO-GFP/IP3R1 были синтезированы две пары взаимно-комплементарных олигонуклеотидов: 5'-accgAAATGGATTTATTAGCACCT-3' и 5'- aaacAGGTGCTAATAAATCCATTT-3', соответствующие РНК-гиду со смысловым спейсером, и 5'-accgAACAAATGTCTCCAATATGT-3' и 5'-aaacACATATTGGAGACATTTGTT-3', соответствующие РНК-гиду с антисмысловым спейсером. В вектор AIO-GFP последовательно клонировали сначала антисмысловой дуплекс фосфорилированных олигонуклеотидов по сайту BbsI, затем смысловой дуплекс по сайту BsaI. Наличие вставок в векторе AIO-GFP/IP3R1 подтверждалось секвенированием.
1.3. Выявление клеточных моноклонов с биаллельными мутациями целевых генов. Геномная ДНК индивидуальных клеточных моноклонов использовалась в качестве матрицы для ПЦР-амплификации фрагмента целевого гена, предназначенного для редактирования, с праймерами AAGTCAGACTTTCCAGGTAAC и AGTGGAATAAAGGCACTCTC для IP3R1 (ожидаемый размер ампликона 769 п.н.) и с праймерами GGGATTTGCATGTGTGTGGTG и CTACTGAAGCTGGGAAGAACAGG для IP3R3 (ожидаемый размер ампликона 962 п.н.). Амплифицированный участок геномной ДНК, содержащий предполагаемую мутацию, подвергался гидролизу комплексом гидРНК/Cas9 in vitro с использованием реагентов набора Guide-it™ Indel Identification Kit (Takara). Синтез РНК-гидов методом транскрипции in vitro с помощью РНК-полимеразы фага Т7 проводили с использованием реактивов набора Guide-it sgRNA In Vitro Transcription Kit (Такара). Для получения ДНК матриц, содержащих последовательность промотора Т7 РНК-полимеразы и спейсерные последовательности, были синтезированы олигонуклеотиды CCTCTAATACGACTCACTATAGGAAATGGATTTATTAGCACCTGTTTAAGAGCTATGC для IP3R1 и CCTCTAATACGACTCACTATAGGATGTCCAGCTTTCTTCACATGTTTAAGAGCTATGC для IP3R3 (последовательности спейсеров РНК-гидов в составе олигонуклеотидов подчеркнуты). Фрагменты геномной ДНК клонов с выявленными в реакции in vitro биаллельными мутациями клонировались в вектор pJET1.2/blunt по тупым концам. Для выявления инделей 10 индивидуальных плазмидных клонов каждой клонотеки были секвенированы.
2. Обратная транскрипция с ПЦР в режиме реального времени
Уровень экспрессии генов семейства IP3R-рецепторов оценивали методом обратной транскриции с последующей ПЦР в режиме реального времени (ОТ-ПЦР-РВ). РНК из клеток НЕК-293 выделяли с помощью колонок и реагентов набора innuPREP DNA/RNA Mini Kit (Analytik Jena). Для удаления следов геномной ДНК и проведения реакции обратной транскрипции с отрицательным контролем использовали реагенты набора SuperScript™ IV VILO™ Master Mix with ezDNase™ Enzyme (Thermo Fisher Scientific). ПЦР в режиме реального времени (ПЦР-РВ) проводили с использованием прибора ДТлайт (“ДНК-Технология”, Россия) и готовой реакционной смеси Maxima SYBR Green/ROX qPCR Master Mix (Thermo Fisher Scientific). Для проведения реакции ПЦР-РВ использовались следующие ген-специфические праймеры: GTCGGAATTAAAGGATCAGATGAC и AAGTGCAAATCAGGTGCTTTC для IP3R1, AAAGACCCAACAGAATACACTG и ATTCTTCCTTTGTTCTGTCATCTG для IP3R2, GACATGCTTCATCTGTGGTC и TTTCCGCTGCTCCGTCATC для IP3R3. Специфичность амплификации оценивали с помощью кривых плавления. В качестве референсного гена использовали ген бета-актина. Уровень экспрессии генов рассчитывали согласно стандартному методу 2–ΔСt.
3. Получение моноклональных сублиний клеток НЕК-293 с модифицированным геномом
Трансфекцию клеток НЕК-293 проводили с использованием Lipofectamin 3000 (Invitrogen) в соответствии с протоколом производителя. Через 72 ч после трансфекции клетки анализировались по интенсивности флуоресценции с помощью сортера клеток FACSAria SORP (BD Biosciences). Для получения моноклонов отбирали клетки, обладающие наибольшей интенсивностью флуоресценции, переносили их по одной в лунку 96-луночного планшета, и по достижении 50–70% конфлюентности клеточные клоны переносили в лунки с большей ростовой поверхностью (последовательно в 24-, 12- и 6-луночные планшеты). После достижения монослоя в лунке 6-луночного планшета клетки использовались для генетического анализа. Клеточные моноклоны с выявленными биаллельными мутациями целевого гена культивировали в среде DMEM (Gibco) с высоким содержанием глюкозы с добавлением 10% эмбриональной бычьей сыворотки (HyClone), 100 мг/мл гентамицина (Sigma), 2 мМ глутамина (Sigma) (ростовая среда) во влажной атмосфере c 5% содержанием CO2 в воздухе при 37°C. Перед экспериментом клетки обрабатывали последовательно раствором Версена и 0.25% раствора трипсина и ресуспендировали в полной ростовой среде. По этому протоколу с использованием плазмиды AIO-GFP/IP3R1 сначала был получен клеточный моноклон с биаллельными мутациями IP3R1, который затем был трансфицирован плазмидой pGuide-it-tdTomato/IP3R3 с последующей селекцией и выявлением клеточного моноклона с биаллельными мутациями IP3R3.
4. Микрофотометрия
Для анализа функциональных последствий инактивации генов IP3-рецепторов проводился анализ агонист-зависимой Са2+-сигнализации в модифицированных клетках HEK-293. Клетки прикрепляли ко дну фотометрической камеры с помощью адгезивного материала Cell Tak и выдерживали при комнатной температуре 30 мин. Затем клетки инкубировались в присутствии проникающего агента Fluo-4 AM (4 мкМ) и детергента Pluronic (0.02%) (оба Molecular Probes, США) в течение 20–30 мин, что обеспечивало загрузку клеток Са2+-зондом Fluo-4. Внеклеточный раствор содержал (мМ): NaCl – 140, KCl – 5, CaCl2 – 2, MgSO4 – 1, HEPES – 10, глюкоза – 10. Бескальцевый раствор содержал 100 мкМ EGTA вместо 2 мМ CaCl2. Фотометрические эксперименты проводили с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss), оборудованного объективом Plan NeoFluar 20×/0.75 и цифровой ECCD камерой LucaR (Andor Technology). Флуоресценцию клеток поочередно возбуждали в диапазоне 480 ± 105 нм, эмиссию регистрировали в областях 525 ± 25 нм. Изменение концентрации Са2+ в цитоплазме оценивали по относительному изменению интенсивности флуоресценции ΔF/F0, где ΔF = F0 – F, F и F0 – текущая интенсивность эмиссии Fluo-4 и его эмиссия в начале регистрации, соответственно. Количественный фотометрический анализ изображений проводили с использованием программы Imaging Workbench 6 (INDEC, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Экспрессионный анализ
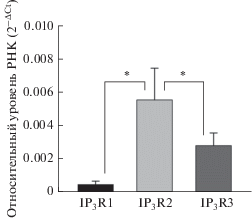
Как уже упоминалось выше, в клетках HEK-293 (human embryonic kidney) функционируют все три IP3-рецептора человека [18]. С целью оценки относительного уровня экспрессии генов IP3-рецепторов в образцах РНК, выделенной из клеток НЕК-293, проводилась ОТ-ПЦР-РВ с использованием ген-специфических праймеров. Оказалось, что на уровне клеточной популяции уровень транскриптов гена IP3R2 превышал уровень транскриптов IP3R1 и IP3R3 в среднем на порядок и вдвое, соответственно (рис. 1). Это свидетельствовало о том, что в клетках НЕК-293 IP3R2 может вносить ключевой вклад в агонист-индуцированную Са2+-сигнализацию. Поскольку до сих пор не разработаны изоформ-специфичные ингибиторы IP3-рецепторов, для выяснения их роли в клеточной физиологии мы использовали технологию геномного редактирования CRISPR/ Cas9. Учитывая данные транскриптомного анализа, показывающего повышенный уровень экспрессии IP3R2 по сравнению с двумя другими генами, нами была получена стабильная клеточная сублиния с инактивированными генами IP3R1 и IP3R3 для проведения сравнительного функционального анализа с исходными клетками HEK-293 дикого типа (wild type, WT).
Рис. 1.
Относительный уровень транскриптов генов IP3R1, IP3R2 и IP3R3 в клетках HEK-293. Данные представлены как среднее ± стандартное отклонение, полученные усреднением результатов четырех независимых экспериментов. Ген бета-актина использовался в качестве референсного. Уровень экспрессии генов рассчитывали согласно стандартному методу 2–ΔСt. Звездочками обозначены статистически значимые различия по Стьюденту (р < 0.05).
2. Получение клеточных моноклонов, экспрессирующих только IP3R2-рецептор
Стабильная клеточная линия HEK293/ΔIP3R1/ ΔIP3R3 с нокаутом генов IP3R1 и IP3R3 создавалась в два этапа. Сначала был получен клеточный моноклон HEK-293/ΔIP3R1 с биаллельными мутациями, приводящими к смещению открытой рамки считывания IP3R1 человека, затем в этом моноклоне с использованием системы CRISPR/ Cas9 был инактивирован ген IP3R3. Для редактирования IP3R1 человека мы использовали мутантный вариант Cas9-D10А с никазной активностью, применение которого способствует значительному снижению нецелевых эффектов по сравнению с действием нуклеазы Cas9. Целевое действие Cas9-D10A, приводящее к двухнитевому разрыву ДНК, обеспечивается кооперацией двух направляющих sgРНК. Экспрессионная кассета конструировалась на основе плазмиды AIO-GFP, кодирующей никазу Cas9-D10А, слитую с зеленым флуоресцентным белком, и пару направляющих sgРНК под контролем промоторов U6 [19]. Потенциальные протоспейсеры для действия CRISPR/Cas9-10А, состоящие из 20 нуклеотидов и содержащие на 3'-конце мотив –NGG, были выбраны в третьем экзоне гена IP3R1 справа от старт-кодона (рис. 2).
Рис. 2.
Положение последовательностей PAM (выделены красным) с протоспейсерами (подчеркнуты) на смысловой и антисмысловой цепях ДНК выбранного участка IP3R1.
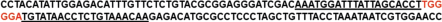
Сконструированную плазмиду AIO-GFP/IP3R1 использовали для трансфекции клеток НЕК-293 с последующей селекцией клеточных моноклонов. Из индивидуальных клеточных моноклонов была выделена геномная ДНК, которую использовали в качестве матрицы для ПЦР-амплификации с ген-специфическими праймерами, фланкирующими предположительный сайт мутации (рис. 3a).
Рис. 3.
ПЦР-амплификация фрагмента геномной ДНК, содержащей предположительный сайт мутации IP3R1, с использованием в качестве матрицы геномной ДНК индивидуальных клеточных моноклонов (a). Примеры гидролиза in vitro комплексом Cas9/sgRNA фрагментов геномной ДНК, амплифицированных из индивидуальных клеточных моноклонов 10–15 (б).
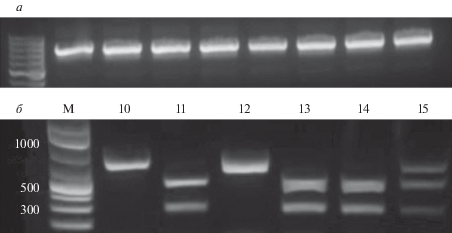
Следующим этапом работы было выявление моноклонов с моноаллельными и биаллельными мутациями, проведенное в модели in vitro с помощью комплекса Сas9-sgRNA. В этой модели для специфического гидролиза амплифицированных фрагментов геномной ДНК индивидуальных моноклонов использовался коммерчески доступный фермент нуклеаза Cas9 и синтезированная нами sgRNA. Далее для каждого индивидуального моноклона была поставлена реакция гидролиза амплифицированных с геномной ДНК фрагментов IP3R1 в системе Cas9-sgRNA in vitro. На рис. 3б показаны результаты детекции типа мутаций в шести моноклонах HEK293/ΔIP3R1. Биалелльные мутации содержат моноклоны 10 и 12, моноаллельные – 15, моноклоны 11, 13 и 14 содержат ДНК дикого типа. Генетические изменения в нокаутных сублиниях подтверждались секвенированием целевого участка IP3R1. По результатам секвенирования для дальнейшей работы был выбран клеточный моноклон cо следующими биаллельными мутациями IP3R1. Первая мутация состоит из делеции 48 пар нуклеотидов, приводящей к смещению открытой рамки считывания и изменению первичной последовательности IP3R1-рецептора после 11-й аминокислоты. Вторая мутация представляет собой делецию 35 пар нуклеотидов, приводящую к смещению открытой рамки считывания и появлению стоп-кодона после 21-й аминокислоты (рис. 4а).
Рис. 4.
Биаллельные делеции различной длины, выявленные в таргетном участке IP3R1 (а). Области PAM выделены красным, ATG-кодон и положение протоспейсеров подчеркнуты. б –Биаллельные делеции различной длины в таргетном участке IP3R3. ATG-кодон и положение протоспейсера подчеркнуты.

Для редактирования IP3R3 использовался вектор pGuide-it-tdTomato (Takara), кодирующий синтез sgRNA под управлением U6 промотора, нуклеазу Cas9 и красный флуоресцентный белок tdTomato. При конструировании плазмиды на участке вблизи старт-кодона IP3R3 в последовательности первого экзона был выявлен потенциальный протоспейсер для действия CRISPR/ Cas9, содержащий с 3′-конца мотив PAM – CGG (ATGTCCAGCTTTCTTCACATCGG). Полученной плазмидой pGuide-it-tdTomato/IP3R3, кодирующей элементы системы CRISPR/Cas9, трансфицировались клетки сублинии с нокаутированным IP3R1. Выявление мутаций IP3R3 в индивидуальных клеточных моноклонах проводили по тому же протоколу, что был использован при получении HEK293/ΔIP3R1. Был получен клеточный моноклон с биаллельными мутациями, приводящими к смещению открытой рамки считывания IP3R3 (рис. 4б). В результате первой мутации от первичной последовательности рецептора остается только 7 аминокислот, а в результате второй – только 5 аминокислот.
Таким образом, с помощью технологии CRISPR/Cas9 получена стабильная линия клеток HEK293/ΔIP3R1/ΔIP3R3 с биаллельными мутациями генов IP3R1 и IP3R3, приводящими к их инактивации, при сохранении функционального гена IP3R2. Для этой линии ниже используется термин HEK-293IP3R2++.
3. Физиологические эксперименты
Далее проводился сравнительный функциональный анализ клеток HEK-293WT и HEK-293IP3R2++ с использованием микрофотометрии (Ca2+ imaging) и Са2+-зонда Fluo-4. В типичном эксперименте в фотометрической камере находились 100–120 клеток, загруженных Fluo-4, и осуществлялся мониторинг Fluo-4-индуцированной флуоресценции каждой клетки. Функциональные последствия инактивации генов IP3R1 и IP3R3 оценивались по способности клеток отвечать на ацетилхолин (ACh), который при достаточной дозе стимулирует Са2+-сигнализацию в большинстве (70–80%) клеток HEK-293WT. Следует отметить, что Са2+-ответы клеток HEK-293WT на ACh слабо зависели от внеклеточного Са2+ и подавлялись ингибитором фосфолипазы С U73122, но не его неактивным аналогом U73343 (рис. 5а). Это свидетельствовало о незначительном вкладе никотиновых рецепторов в ACh-зависимые Са2+-сигналы, которые, очевидно, генерировались в клетках HEK-293WT за счет стимуляции мускариновых рецепторов, сопряженных G-белками с фосфоинозитидным каскадом и мобилизацией депонированного Са2+. Примечательной особенностью ответов клеток HEK-293WT на ACh было то, что кратковременные последовательные аппликации агониста в увеличивающихся дозах либо не вызывали мобилизацию внутриклеточного Са2+, либо инициировали импульсное повышение Са2+ практически до одной и той же величины при разных концентрациях выше пороговой (рис. 5б, верхняя кривая). При относительно малых концентрациях ACh генерировались гладкие одиночные Са2+ пики, в то время как при увеличении дозы клеточные ответы носили осцилляторный характер (рис. 5б, верхняя кривая). В этом отношении генетически модифицированные клетки HEK-293IP3R2++ фактически не отличались от клеток HEK-293WT (рис. 5б, нижняя кривая). Такой характер ответов “все или ничего” на AСh и их рандаун (rundown), наблюдавшийся при длительных регистрациях у некоторых клеток, делали невозможным анализ дозозависимости величины ответов. Хотя частота осцилляций и глубина модуляции Са2+-ответов в определенной степени зависели от концентрации ACh (рис. 5б), разброс этих параметров от клетки к клетке был слишком велик, чтобы использовать их в качестве параметров, характеризующих клеточную популяцию.
Рис. 5.
Ca2+-ответы клеток на ACh. а – Мониторинг внутриклеточного Са2+ в клетках HEK-293WT (n = 53), содержащих Fluo-4 (репрезентативный эксперимент; n = 53), в контроле, при удалении внеклеточного Ca2+ и в присутствии ингибитора фосфолипазы С U73122. б – Ответы клетки HEK-293WT (верхняя кривая) и HEK-293IP3R2++ (нижняя кривая) на ACh, апплицированный в разных дозах, как указано. в – Фракция клеток, генерирующих Са2+-ответы на ACh при данной концентрации, для популяции HEK-293WT (⚪) и HEK-293IP3R2++ (⚫). Моменты и продолжительность аппликаций веществ обозначены горизонтальными линиями выше экспериментальных кривых. Относительную флуоресценцию Са2+-индикаторов оценивали как ΔF/F0, где ΔF = F – F0, F – текущая интенсивность флуоресценции, F0 – средняя интенсивность флуоресценции в начальный момент регистрации.

В силу сказанного выше мы охарактеризовали количественно дозозависимость клеточных ответов, используя популяционный параметр – фракцию клеток в популяции, способных генерировать Са2+-ответ на ACh при данной концентрации. Клетки HEK-293WT стимулировались ACh в диапазоне концентраций 125 нМ – 5 мкМ, где 125 нМ – это примерно пороговая концентрация для самых чувствительных клеток. Для клеток HEK-293IP3R2++ использовалась область 125 нМ – 1 мкМ. В общей сложности мы проанализировали восемь клеточных популяций HEK-293WT и изучили Са2+-ответы 917 клеток. Для каждой популяции определялась фракция клеток, способных отвечать на агонист, концентрация которого варьировалась, и затем определялась средняя величина и стандартное отклонение по восьми популяциям. Соответствующая усредненная дозозависимость представлена на рис. 5в, светлые кружочки. Аналогичные эксперименты были проведены с клетками HEK-293IP3R2++, в которых были изучены 296 клеток в четырех популяциях. Полученная для этих клеток дозозависимость представлена черными кружочками на рис. 5в. Оказалось, что в популяциях HEK-293WT и HEK-293IP3R2++ фракции клеток, в которых ACh вызывал детектируемую мобилизацию Са2+ при использованных дозах, были статистически неотличимы, за исключением точки 125 нМ.
Таким образом, в согласии с данными ПЦР-РВ (рис. 1), которые предполагали заметно меньший уровень экспрессии IP3R1 и IP3R3 по сравнению с IP3R2, а значит, меньшую функциональную значимость в клетках HEK-293WT, последнее прямо следовало из результатов функционального анализа клеток HEK-293IP3R2++. Оказалось, что инактивация генов IP3R1 и IP3R3 существенно не затронула Са2+-сигнализацию, по крайней мере, в части, касающейся ответов на ACh, которые у клеток HEK-293IP3R2++ по величине и кинетике были статистически неотличимы от таковых у клеток HEK-293WT. Поскольку популяционная кривая доза–ответ (рис. 5в) предполагает несколько более низкую чувствительность клеток HEK-293IP3R2++, возможно, что это является следствием инактивации IP3R1 и/или IP3R3, которые играют заметную роль в генерации Са2+-ответов клеток HEK-293WT при их стимуляции при дозах ACh, близких к пороговым.
Авторы благодарят Д.М. Поташникову за помощь в проведении работ по сортировке клеток (поддержана Программой развития МГУ). Работа поддержана Российским научным фондом (грант 18-14-00347).
Список литературы
Foskett J.K., White C., Cheung K.H., Mak D.O. 2007. Inositol trisphosphate receptor Ca2+ release channels. Physiol. Rev. 87, 593–658.
Berridge M.J. 2016. The inositol trisphosphate/calcium signaling pathway in health and disease. Physiol. Rev. 96, 1261–1296.
Thillaiappan N.B., Chakraborty P., Hasan G., Taylor C.W. 2019. IP3 receptors and Ca2+ entry. Biochim. Biophys. Acta Mol. Cell. Res. 1866 (7), 1092–1100. https://doi.org/10.1016/j.bbamcr.2018.11.007
Hamada K., Mikoshiba K. 2020. IP3 receptor plasticity underlying diverse functions. Annu. Rev. Physiol. 82, 151–176.
Prole D.L., Taylor C.W. 2019. Structure and Function of IP3 Receptors. Cold Spring. Harb. Perspect. Biol. 11(4), a035063.
Mak D.O., Foskett J.K. 2015. Inositol 1,4,5-trisphosphate receptors in the endoplasmic reticulum: A single-channel point of view. Cell Calcium. 58, 67–78.
Rios E. 2018. Calcium-induced release of calcium in muscle: 50 years of work and the emerging consensus. J. Gen. Physiol. 150, 521–537.
Chandrasekhar R., Alzayady K.J. Yule D.I. 2015. Using concatenated subunits to investigate the functional consequences of heterotetrameric inositol 1,4,5-trisphosphate receptors. Biochem. Soc. Trans. 43, 364–370.
Iwai M., Michikawa T., Bosanac I., Ikura M., Mikoshiba K. 2007. Molecular basis of the isoform-specific ligand-binding affinity of inositol 1,4,5-trisphosphate receptors. J. Biol. Chem. 282, 12755–12764.
Miyazaki S., Yuzaki M., Nakada K., Shirakawa H., Nakanishi S., Nakade S., Mikoshiba K. 1992. Block of Ca2þ wave and Ca2þ oscillation by antibody to the inositol 1,4,5-trisphosphate receptor in fertilized hamster eggs. Science. 257 (5067), 251e5.
Takei K., Shin R.M., Inoue T., Kato K., Mikoshiba K. 1998. Regulation of nerve growth mediated by inositol 1,4,5-trisphosphate receptors in growth cones. Science. 282 (5394), 1705e8.
Matsumoto M., Nakagawa T., Inoue T., Nagata E., Tanaka K., Takano H., Minowa O., Kuno J., Sakakibara S., Yamada M., Yoneshima H., Miyawaki A., Fukuuchi Y., Furuichi T., Okano H., Mikoshiba K., Noda T. 1996. Ataxia and epileptic seizures in mice lacking type 1 inositol 1,4,5-trisphosphate receptor. Nature. 379 (6561), 168e71.
Tada M., Nishizawa M., Osamu O. 2014. IP3 receptors in neurological disorders. In: Pathologies of calcium channels. Eds. Weiss N., Koschak A. Heidelberg: Springer. 731 p.
Nakayama H., Bodi I., Maillet M., DeSantiago J., Domeier T.L., Mikoshiba K., Lorenz J.N., Blatter L.A., Bers D.M., Molkentin J.D. 2010. The IP3 receptor regulates cardiac hypertrophy in response to select stimuli. Circ Res. 107 (5), 659e66.
Hisatsune C., Yasumatsu K., Takahashi-Iwanaga H., Ogawa N., Kuroda Y., Yoshida R., Ninomiya Y., Mikoshiba K. 2007. Abnormal taste perception in mice lacking the type 3 inositol 1,4,5-trisphosphate receptor. J. Biol. Chem. 282 (51), 37 225–37 231.
Mendes C.C., Gomes D.A., Thompson M., Souto N.C., Goes T.S., Goes A.M., Rodrigues M.A., Gomez M.V., Nathanson M.H., Leite M.F. 2005. The type III inositol 1,4,5-trisphosphate receptor preferentially transmits apoptotic Ca2+ signals into mitochondria. J. Biol. Chem. 280, 40 892–40 900.
Kuo I.Y., Brill A.L., Lemos F.O., Jiang J.Y., Falcone J.L., Kimmerling E.P., Cai Y., Dong K., Kaplan D.L., Wallace D.P., Hofer A.M., Ehrlich B.E. 2019. Polycystin 2 regulates mitochondrial Ca2+ signaling, bioenergetics, and dynamics through mitofusin 2, Sci. Signal. 12 (580), eaat7397.
Lock J.T., Alzayady K.J., Yule D.I., Parker I. 2018. All three IP3 receptor isoforms generate Ca2+ puffs that display similar characteristics. Sci. Signal. 11 (561), eaau0344.
Chiang T.W., le Sage C., Larrieu D., Demir M., Jackson S.P. 2016. CRISPR-Cas9(D10A) nickase-based genotypic and phenotypic screening to enhance genome editing. Sci. Rep. 6, 24 356.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


