Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 1, стр. 44-60
Везикулярные системы доставки биологически активных соединений: от липосом к керасомам
З. Г. Дениева a, *, У. А. Буданова a, Ю. Л. Себякин a
a МИРЭА – Российский технологический университет, Институт тонких химических технологий
им. М.В. Ломоносова
119571 Москва, Россия
* E-mail: zaret03@mail.ru
Поступила в редакцию 16.05.2020
После доработки 03.06.2020
Принята к публикации 04.06.2020
Аннотация
Современная фармацевтика ставит перед собой задачу создания новых лекарственных препаратов, которые будут обладать хорошей биодоступностью и биосовместимостью, высокой эффективностью и незначительным проявлением токсических эффектов. Решением такой задачи является получение наноразмерных частиц, содержащих небольшие эффективные дозы лекарственного вещества. Разнообразие подобных систем доставки позволяет создавать терапевтические комплексы с требуемыми характеристиками. Липосомы – липидные везикулы с двухслойной структурой мембраны – имеют необходимые свойства для транспортировки различных лекарственных соединений и генетического материала. Они интересны тем, что состоят из природных компонентов, которые могут минимизировать токсичность по отношению к клеткам организма. Кроме того, искусственные катионные липиды дают возможность корректировать свойства транспортной системы под определенные задачи. Для преодоления низкой стабильности – серьезного недостатка липосом, были разработаны кремнийорганические частицы – керасомы. Это наноразмерные агрегаты сферической формы, состоящие, как и липосомы, из липидного бислоя, но их поверхность модифицирована кремниевой полимерной сетью. При этом они обладают всеми достоинствами липосом. В обзоре представлены основные методы синтеза компонентов липосом и керасомообразующих липидов для создания стабильных транспортных систем. Приведены варианты структур катионных липидов и модификаций керасомообразующих липидов, а также области их применения, главным образом, трансфекция генетического материала, фотодинамическая терапия, визуализация и диагностика заболеваний при помощи магнитно-резонансной томографии, а также лечение опухолей.
ВВЕДЕНИЕ
Генная терапия является многообещающим подходом для лечения наследственных патологий, а также негенетических болезней, например, рак, сердечно-сосудистые и аутоиммунные заболевания, путем коррекции генетических дефектов или избыточной экспрессии терапевтически значимых белков [1]. Предпосылки для успешной терапии включают не только использование подходящих генов, но и безопасную и эффективную их доставку в клетки-мишени. Однако большинство лекарственных препаратов не имеют селективного действия, тем самым они губительны для здоровых клеток человека. Чтобы решить эти проблемы, разработаны системы доставки в организм терапевтических средств с использованием нанотехнологий [2]. Они позволяют не только увеличить биодоступность и активность препарата, но и дают возможность контролируемо высвобождать переносимое средство для пролонгированного действия.
Различают две основные группы генных векторов: вирусные и невирусные. Из-за серьезных побочных эффектов, вызываемых вирусными векторами, таких как иммуногенность, мутагенез и канцерогенез, невирусные векторы стали привлекать все больше внимания [3].
К невирусным векторам относятся липосомы, дендримеры, магнитные и металлические наночастицы, нанокристаллы плохо растворимых лекарств, полимерные частицы, квантовые точки и др. Различные химические модификации, например, с использованием антител или углеводов, обеспечивают адресную доставку невирусных векторов к клеткам-мишеням.
Липосомы интересны благодаря структуре их мембран, аналогичной клеточной мембране, и способности образовывать комплексы с молекулами нуклеиновых кислот. Липиды, формирующие бислойную мембрану липосом, обеспечивают инкапсулирование молекул ДНК или РНК, а также лекарственных препаратов различной природы, их внутриклеточную доставку и выход из эндосом.
На сегодняшний день препарат Onpattro является единственным одобренным для клинических испытаний средством доставки генетического материала. Он представляет собой липидный комплекс с миРНК для лечения редкого наследственного заболевания – амилоидной полинейропатии [4].
ЛИПОСОМАЛЬНЫЕ СИСТЕМЫ ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ
Трансфекция относится к невирусным методам доставки ДНК в клетки и включает физические и химические методы [5]. Физические методы основаны на непосредственном физическом проникновении генетической конструкции через клеточную мембрану. Это эффективно и может использоваться на любых типах клеток. При этом иногда нарушается целостность клеточной мембраны, что приводит к гибели клетки. Химическая доставка генов – это процесс, который основан на химических реакциях или электростатических взаимодействиях между компонентами транспортной системы и нуклеиновой кислотой. В результате взаимодействия с мембраной транспортная система вместе с переносимым материалом может поглощаться клеткой посредством эндоцитоза или слияния мембран. Стратегии доставки терапевтических молекул химическим путем высокопроизводительны и часто просты в исполнении. Наиболее широко распространена трансфекция с помощью липосом.
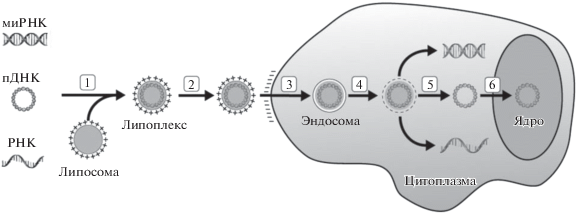
Липофекция, также известная как “трансфекция липидами” или “трансфекция на основе липосом”, использует липидный комплекс для доставки ДНК к клеткам (рис. 1).
Рис. 1.
Трансфекция эукариотических клеток (по [3]). 1 – Получают положительно заряженный комплекс трансфекции путем объединения липосомы с нуклеиновой кислотой. 2 – Комплексы добавляют к клеткам, они связываются с отрицательно заряженной клеточной мембраной посредством электростатических взаимодействий. 3 – Клетки поглощают комплексы посредством эндоцитоза в мембранные везикулы – эндосомы. 4 – Реагент для трансфекции дестабилизирует эндосомальную мембрану. 5 – Комплексы выходят из эндосом и высвобождают нуклеиновую кислоту в цитоплазму. 6 – ДНК локализуется в ядре, где происходит дальнейшая экспрессия генов.
Липосомы представляют собой сферические везикулы, состоящие из одного или нескольких липидных слоев, разделенных водной фазой [6]. Размер липосом, наиболее часто используемых для создания систем доставки, составляет от 50 до 450 нм в диаметре. Они формируются при смешивании липидов с водой, что объясняется амфифильной природой этих молекул и приводит к самопроизвольному образованию замкнутых бислойных структур. Липосомы характеризуются способностью к биодеградации, обладают низкой иммуногенностью, их мембрана может взаимодействовать с клеточной мембраной, способствуя внутриклеточной доставке содержимого везикул [7].
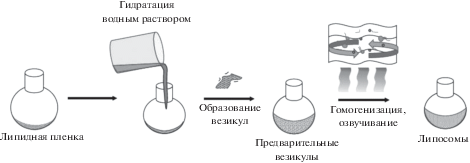
Процесс приготовления липосом отличается простотой исполнения (рис. 2). Наиболее широко распространенным методом является гидратирование тонкой липидной пленки с последующей обработкой ультразвуком для получения моноламеллярных везикул заданного размера [8].
Благодаря электростатическому взаимодействию между положительно заряженной группой в липиде и отрицательно заряженными фосфатными группами ДНК образуются комплексы липидов с нуклеиновой кислотой (липоплексы), которые могут быть использованы для трансфекции. Клетки поглощают липоплексы посредством образования в процессе эндоцитоза мембранных везикул – эндосом. Реагент для трансфекции дестабилизирует эндосомальную мембрану, комплексы покидают эндосомы и высвобождают РНК в цитоплазму, а ДНК локализуется в ядре, где происходит дальнейшая экспрессия генов [9].
Преимущество липофекции заключается в том, что она работает во многих типах клеток, включая культивируемые нейроны. Коммерчески доступные наборы позволяют проводить реакции трансфекции в течение 30 мин и анализировать экспрессию генов уже через нескольких часов. Однако применение липофекции часто ограничивается экспериментами в условиях in vitro [10].
Липосомы состоят из различных типов липидов. В основном это фосфолипиды, например фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилглицерин и фосфатидилинозитол, с насыщенными или ненасыщенными жирными цепями. Кроме того, используют сфинголипиды, например, сфингомиелин, который может дополнительно стабилизировать бислой в присутствии молекул холестерина. Однако составы на основе природных липидов обладают значительной токсичностью для клеток [11].
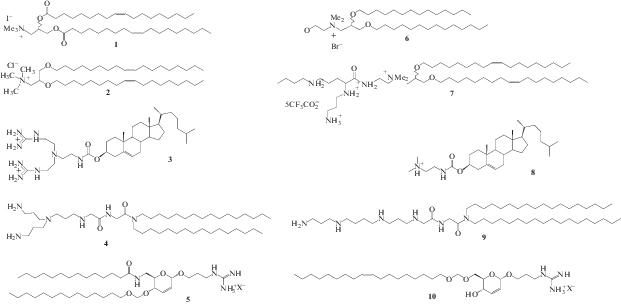
В процессе поиска менее токсичных методов доставки генетического материала появились новые химические подходы, позволяющие смягчить нежелательные цитотоксические эффекты и увеличить успех транспорта нуклеиновых кислот [12]. Эти подходы используют варьирование структур липидов, создание катионных липидов, а также керасомообразующих липидов [13, 14].
Катионные липосомы имеют ряд преимуществ. Такие частицы обладают небольшим положительным поверхностным зарядом (дзета-потенциалом), а варьирование отношения величины положительного заряда к отрицательному может влиять на эффективность конденсации липосомы и нуклеиновой кислоты, таким образом обеспечивая ее защиту от ферментативного расщепления и деградации. Положительный дзета-потенциал может направлять комплекс к отрицательно заряженной клеточной мембране, что приводит к эффективному поглощению комплекса [15]. Форма и размеры агрегатов значительно варьируются: это могут быть небольшие однослойные везикулы размером 20–200 нм, более крупные везикулы размером от 200 нм до 1 мкм, а также гигантские однослойные везикулы размером более 1 мкм [16]. Последние также могут существовать в виде многослойных везикул, состоящих из множества липидных бислоев. На размер везикул влияют физико-химические и термодинамические свойства липидов, используемых в системе.
СТРУКТУРА КАТИОННЫХ ЛИПИДОВ
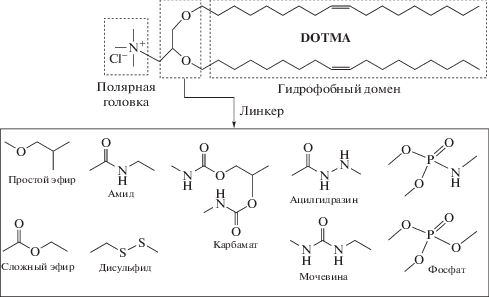
Катионные липиды (КЛ), как и природные фосфолипиды, являются амфифильными по своей природе структурами и содержат неполярную (гидрофобную) область и полярную (гидрофильную) “головку”. Кроме того, в них присутствуют соединительные звенья внутри гидрофобного/гидрофильного фрагментов – линкер [17–19] и между гидрофильными и гидрофобными доменами – спейсер [20, 21]. Положительно заряженная полярная “головка” липида взаимодействует с отрицательно заряженными биомакромолекулами и клеточными мембранами. Гидрофобные “хвосты” влияют на текучесть мембран, состояние сборки и стабильность агрегатов, а также профиль высвобождения захваченных молекул из липосомы [22].
Гидрофобные (неполярные) фрагменты амфифилов играют ключевую роль в образовании двухслойных везикул. Структурные вариации гидрофобного домена (схема 1 ), такие как число цепей, их длина, специфичность химических связей (степень ненасыщенности), ориентация углеводородных цепей [23], а также асимметрия и тип (стероиды и их производные) гидрофобного домена могут влиять на эффективность трансфекции генетического материала в клетки.
Схема 1
Для доставки плазмидной ДНК имеет важное значение наличие двух углеводородных радикалов в структуре гидрофобного блока липида. При использовании липидов, имеющих одну или три алифатические цепочки [24], эффективность трансфекции ниже, чем при наличии у липидов двух углеводородных радикалов [25, 26]. Причинами низкой эффективности трансфекции липоплексов на основе липидов с одной или тремя гидрофобными “хвостами” является склонность таких липидов к образованию мицеллярных агрегатов в водной среде, которые обладают более высокой токсичностью по сравнению с липосомальными везикулами.
Известно, что при наличии ненасыщенной связи в гидрофобном блоке эффективность трансфекции возрастает [27]. Присутствие такой связи в углеводородной цепи липида обеспечивает большую площадь поперечного сечения алифатического фрагмента, повышенную текучесть двухслойной мембраны и, следовательно, стимулирует слияние катионных липосом с клеточными мембранами и облегчает проникновение через них, что повышает эффективность трансфекции [28]. Напротив, насыщенные алкильные цепи увеличивают жесткость липидного бислоя [29, 30]. Замена двойной связи на тройную связь в алкильных цепях оказывает влияние как на структурные, так и на функциональные свойства липосом и липоплексов. Изменение положения тройной связи по направлению к концу алкильных цепей повышает стабильность липоплексов при физиологических температурах [31]. Кроме того, алкильные цепи с тройными связями обеспечивают более жесткие бислои в липосомах.
Наиболее высокая эффективность трансфекции наблюдается для липидов с более короткими алкильными цепями и обусловлена сниженной жесткостью и повышенной текучестью мембранного бислоя, что приводит к низкой температуре фазового перехода по сравнению с их более длинными аналогами. Степень эффективности трансфекции плазмидной ДНК в клетки в зависимости от длины углеводородных цепей в гидрофобном блоке липидов изменяется в ряду ди-C14:0 > ди-С18:1 > ди-C16:0 > ди-C18:0 [32, 33]. Катионные липосомы с 12 атомами углерода в алкильных цепях липидов также являются высокоэффективными в доставке плазмидной ДНК in vitro, однако они крайне нестабильны, и для формирования липоплексов требуется большое количество липидов.
В экспериментах in vitro эффективность трансфекции асимметричных липидов обычно превосходит значения их симметричных аналогов, поскольку скорость образования комплексов плазмиды и липидов с асимметрией в гидрофобном блоке выше [34, 35].
Введение в гидрофобный домен стероидных фрагментов позволяет не только повысить эффективность трансфекции, но и снизить общую цитотоксичность молекулы [36].
Линкер в катионных липидах выступает в качестве каркаса, связывающего гидрофобные фрагменты или гидрофильные “головки”. Наиболее широко используют простую или сложную эфирные связи, карбаматы, амиды, глицерин или аминокислоты (рис. 3).
Включение химических связей, подверженных внутриклеточному ферментативному расщеплению (сложноэфирная, амидная) в молекулярную структуру компонентов системы доставки снижает их цитотоксичность и повышает способность образовывать эффективные комплексы с ДНК [37]. Преимуществами сложноэфирной связи является ее чувствительность к изменениям рН в эндосомах и гидролиз под действием клеточных эстераз. Транспортные системы, способные эффективно обеспечить трансфекцию, должны не только защищать ДНК от клеточных ферментов, но и высвобождать ее внутри клетки. Внутриклеточная деградация лабильных амидных и сложноэфирных связей может приводить к разрушению комплексов и последующему высвобождению нуклеиновых кислот из липосом [38]. Простая эфирная связь в составе катионного липида позволяет достичь лучшей трансфекции, чем у соединений со сложноэфирным и уретановым линкером, однако она делает молекулу более токсичной [39, 40].
Для повышения эффективности доставки плазмидной ДНК в клетки рекомендуется использовать катионные липиды с более длинным линкером [27]. На вновь синтезированных соединениях [41] показано, что глутамат в качестве линкера проявляет большую эффективность трансфекции по сравнению с аспартатом. Наличие еще одного метиленового звена в структуре глутамат-содержащего липида может влиять на структуру/конформацию липоплексов и обеспечивать лучшее связывание с положительно заряженными группами липоплексов. Следовательно, взаимодействие между положительно заряженными и стабильными липоплексами и отрицательно заряженной поверхностью клеток будет более эффективным.
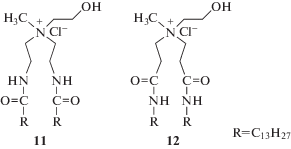
Ориентация линкера в молекуле влияет на физико-химические свойства липидов. Незначительные структурные изменения в ориентации существенно влияют на способность связывать ДНК, жесткость мембраны, способность к слиянию с клеточными мембранами, поглощение клетками и эффективность доставки генетического материала катионными липосомами [42]. Например, структурная ориентация амидного линкера оказывает влияние на совместимость с сывороткой крови и эффективность трансфекции катионных амфифилов. Так, группа исследователей [43] показала, что липоплексы липидов 11 демонстрируют значительно более высокую совместимость с сывороткой и селективность переноса генетического материала, чем липоплексы липидов 12 (схема 2 ).
Схема 2
Для спейсера между гидрофобным и гидрофильным фрагментами основными параметрами эффективности трансфекции также являются природа, длина и ориентация в молекуле. Природа спейсера может быть гидрофильной или гидрофобной, жесткой или гибкой [44]. Длина и гидрофобность влияют на морфологию агрегатов и трансфекционные свойства димерных амфифилов [45], а также размер везикул и степень гидратации [46].
Размер агрегатов увеличивается с увеличением длины спейсера. Катионные липиды с длинным спейсером (не менее 6 атомов углерода) образуют либо трубчатые, либо стержнеподобные структуры, а не обычную везикулярную структуру, тогда как липиды без него образуют неустойчивые агрегаты. Отмечается, что лучшую трансфекцию показывают липиды с 3 атомами углерода в составе спейсера. При этом не отмечается существенного влияния длины на температуру фазового перехода агрегатов [20].
Спейсер может влиять на температуру фазового перехода в зависимости от его ориентации в молекуле липида [45, 46]. В мономерной молекуле спейсер между гидрофобным и гидрофильным блоками ориентирован вертикально, поэтому он сильно влияет на расположение гидрофильной “головки”. В димерных липидах ориентация спейсера влияет на молекулярную упаковку мембранной структуры, а не на местоположение гидрофильной “головки”, так как он расположен горизонтально. Таким образом, роль спейсера в молекулярной упаковке катионных агрегатов будет различаться в зависимости от структуры липидов.
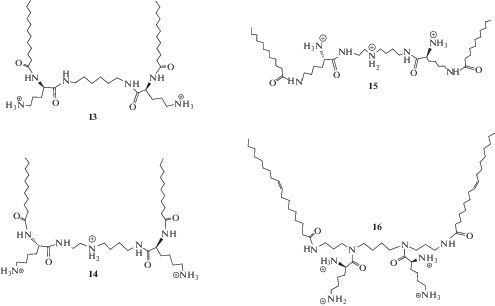
В качестве полярных гидрофильных групп перспективно использовать гидрофильные аминокислоты, например L-лизин, L-аргинин и др., поскольку мультивалентные катионные липиды обладают повышенной эффективностью трансфекции и низкой общей токсичностью по сравнению с аналогами, содержащими полиамины. В качестве противоионов к ним выступают HCl или трифторуксусная кислота (TFA). Они могут влиять на поверхностный потенциал катионных липосом: липиды с трифторацетатом обладают большим дзета-потенциалом, чем липиды, содержащие хлор в качестве противоиона [20, 47].
L-Лизин представляет большой интерес для использования в качестве компонента амфифильных соединений. Это двухосновная аминокислота с одной из самых длинных боковых цепей среди всех природных аминокислот, что может быть важным для преодоления проблем стерического характера. Из-за наличия концевой ε-аминогруппы, L-лизин классифицируют как гидрофильную основную аминокислоту. Структура L-лизина обеспечивает универсальное использование его в качестве строительного блока в синтезе катионных амфифилов: наличие трех активных центров (одной карбоксильной группы и двух α- и ε‑аминогрупп) позволяет получать молекулы с необходимыми ионными характеристиками [48, 49]. Синтезированы амфифилы [50] с различным расположением L-лизина в полярном блоке (схема 3 ).
Схема 3
Кроме того, важно, чтобы заряженные “головки” находились на определенном расстоянии друг от друга для взаимодействия с соседними фосфатными группами молекул ДНК [51]. Согласно исследованию [52], наиболее эффективным расстоянием между аминогруппами в амфифилах является 4.9 Å, которое позволяет им прочно связываться с фосфатными группами молекулы ДНК.
Липиды с L-аргинином в качестве полярной головки имеют эффективность трансфекции выше, чем их аналоги с L-лизином, благодаря наличию гуанидиновой группировки, которая обеспечивает способность прочно связываться с ДНК [47]. Гуанидиновая группировка остается протонированной в широком диапазоне рН, образует водородные связи с пуриновыми и пиримидиновыми нуклеотидами, а также играет важную роль в различных ДНК-связывающих белках, таких как гистоны и протамины. Кроме того, L-аргинин способен образовывать цвиттер-ионные водородные связи с фосфат-ионами [52–54]. Образование водородных связей между гуанидиновым фрагментом L-аргинина и фосфатами, сульфатами, карбоксильными группами компонентов клеточной мембраны может усиливать проявляемый эффект [55]. Наличие множества положительных зарядов в полярной головке липида обычно не влияет негативно на компактность и гидродинамический размер липоплексов, эффективность трансфекции и цитотоксичность катионных амфифилов, однако в некоторых случаях может вызывать трудности при проникновении через клеточную мембрану ввиду большой плотности поверхностного заряда гуанидиновой группировки [56].
Гистидин также позволяет повысить эффективность трансфекции. Среда, используемая при образовании липоплексов между катионными амфифилами, содержащими в структуре гистидин, и плазмидной ДНК, существенно влияет на эффективность трансфекции, а также на совместимость с сывороткой крови [57].
Катионные липиды с L-лизином, L-аргинином и гистидином могут формировать структуры в виде стержней, поскольку их полярные “головки” образуют однослойные везикулы [32]. Эффективность их трансфекции изменяется в ряду L-лизин > L-аргинин > гистидин. При этом катионные липиды с дипептидами в качестве полярной головки, например L-лизин-глицин, “работают” лучше, чем их аналоги с одной аминокислотой [23].
Наличие гидроксильных групп в составе полярного блока усиливает электростатическое взаимодействие плазмидной ДНК с липидами посредством водородных связей и, следовательно, улучшает сродство полученных липоплексов к клеточным мембранам [28]. Амфифилы на основе производных L-серина могут снижать цитотоксические эффекты [58]. Присутствие трех активных центров может обеспечить наличие химических связей разного типа, в результате чего открываются новые возможности для создания биологически активных молекул.
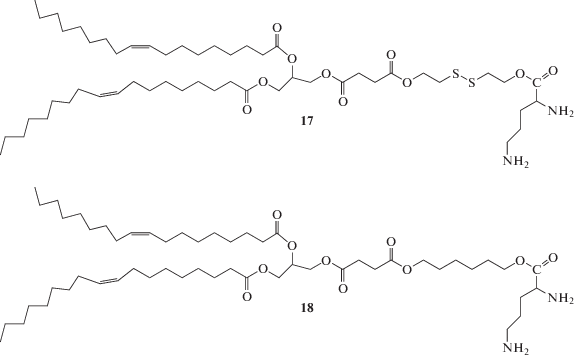
Кроме стандартных мономерных липидных молекул существуют димерные амфифилы. Перспективным материалом для дизайна димерных амфифилов является цистин, который состоит из двух остатков L-цистеина, соединенных дисульфидной связью. Дисульфидная связь является потенциально реакционноспособной группой, способной вступать в реакции обмена тиол–дисульфид, образуя свободные сульфгидрильные группы. Таким образом, соединения на основе цистина и их восстановленные аналоги являются структурами с уникальными свойствами [59].
Первым синтезированным катионным липидом, содержащим дисульфидную связь, является КЛ 17 (схема 4 ). Исследования показали, что он эффективнее высвобождает плазмидную ДНК из комплекса по сравнению с его аналогом 18, не содержащим S–S-связь, из-за дестабилизации структуры липида при низких значениях рН внутри клетки [60].
Схема 4
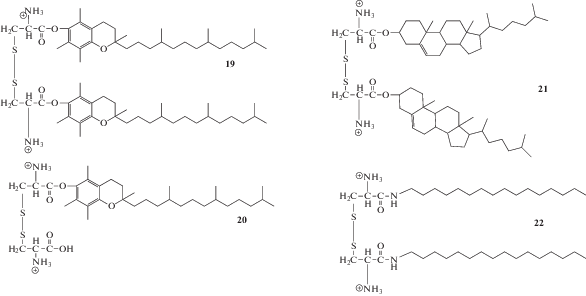
Структуры, содержащие цистин в качестве полярного домена, проявили себя как перспективные трансфицирующие агенты. Определена зависимость эффективности трансфекции от структуры гидрофобного блока липидов на основе цистина [61]. Исследование показало, что α-токоферол-содержащие липиды 19 и 20 более активные, чем амфифилы со стероидными фрагментами 21 и алифатическими цепями 22 (схема 5 ). При этом КЛ 19, несущий два гидрофобных фрагмента, эффективнее, чем его мономерный аналог 20.
Схема 5
Кроме того, созданы структуры на основе природных L-аминокислот, которые проявили антибактериальную активность [62, 63]. Это расширяет возможные области применения катионных липидов.
КЕРАСОМЫ – УСОВЕРШЕНСТВОВАННАЯ ТРАНСПОРТНАЯ СИСТЕМА
Несмотря на известные достоинства, катионные липосомы могут быть весьма токсичными для клеток. Это может приводить к изменениям в экспрессии генов даже при отсутствии какого-либо визуального эффекта на клетки. Кроме того, многие структуры подвержены деградации или агрегации в физиологических условиях. Для решения подобной проблемы были сконструированы гибридные системы кремнийорганической природы.
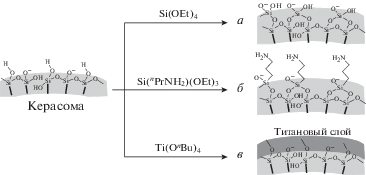
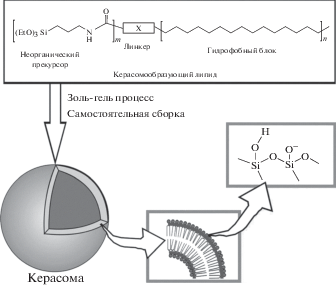
Керасомы, впервые разработанные в 1999 году [64], в настоящее время интересны в качестве нового типа транспортной системы для трансфекции, а также в терапии социально значимых заболеваний. Это искусственные биоорганические гибридные липосомы, образованные с помощью золь-гель-процесса в условиях in situ путем самосборки керасомообразующих липидов (КОЛ), содержащих силоксановую сеть на поверхности двухслойной мембраны везикул (рис. 4). Они морфологически стабильны и могут быть нагружены гидрофильными, гидрофобными или амфифильными молекулами для терапевтической доставки и биомедицинской визуализации. В общем виде структура КОЛ включает гидрофильную триэтоксисилильную головку (неорганический прекурсор), гидрофобный блок, содержащий углеводородные цепи, и соединительное звено (линкер) между ними [65–68]. При гидролизе триалкоксисилильных полярных групп образуется прочная сеть –Si–O–Si– на поверхности везикулы, которая позволяет резко увеличить устойчивость агрегатов по сравнению с липосомами. Керасомообразующие липиды синтезируются по методу блочного синтеза. Это позволяет проводить стадию присоединения кремнийсодержащего фрагмента последней, что, несомненно, важно для предотвращения возможной реакции самопроизвольной полимеризации силановых групп под воздействием различных сред.
Рис. 4.
Схематическое изображение структуры керасомы (по [14]). Неорганическим прекурсором является триэтоксисилильная головка.
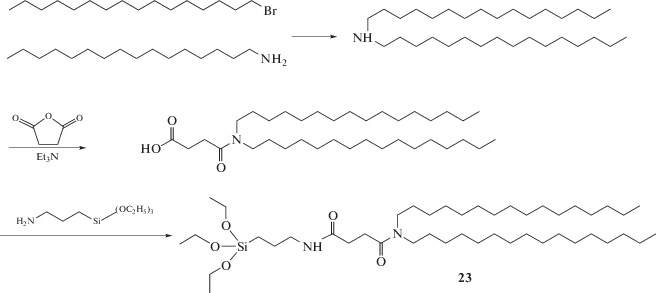
Одним из первых был получен КОЛ 23 путем простых реакций конденсации трех молекулярных блоков: дигексадециламина, янтарной кислоты и 3-амино-пропилтриэтоксисилана (схема 6 ) [68].
Схема 6
На сегодняшний день исследованы модификации поверхности керасом. Для получения уникальных везикул, которые можно применять в различных областях, кремнийсодержащую поверхность агрегатов модифицируют различным образом (рис. 5) [69]. Чаще всего такой процесс инициируется силанизацией молекулы 3-аминопропилтриэтоксисилана, после чего следует реакция образования основания Шиффа между его аминогруппой и альдегидной группой глутарового альдегида. Затем идет присоединение функциональной группировки [70]. Возможно нанесение металлических наночастиц на поверхность керасом. Нанокомпозиты с частицами золота могут служить объемными электрохимическими платформами для исследования передачи информации между клетками [71].
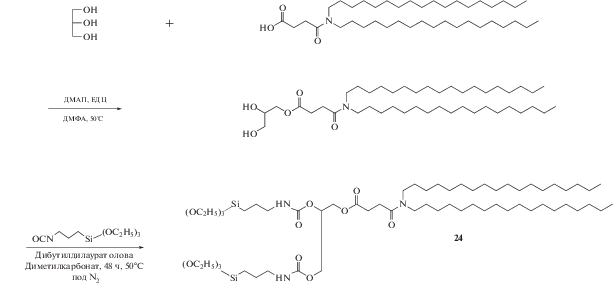
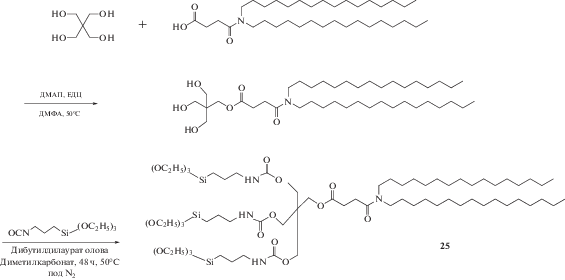
Кроме силоксановой сети проводят модификации структуры самих КОЛ. Так, для исследования влияния липидоподобной структуры на способность к загрузке лекарственного средства и механизм его высвобождения были разработаны схемы и синтезирована серия КОЛ 24 и 25, различающиеся числом триэтоксисилильных головок (схемы 7, 8 ).
Схема 7
Схема 8
Результаты экспериментов показали, что количество силоксановых групп влияет на диаметр керасом: с увеличением их количества наблюдалось уменьшение диаметра. Это может быть связано с особенностями полимеризации силоксановой сети на поверхности, поскольку, чем больше число триэтоксисилановых групп, тем выше степень полимеризации силоксановых головок, что приводит к более компактным везикулам. Исследование эффективности захвата керасомами противоопухолевого препарата доксорубицина (DOX) показало увеличение количества инкапсулированного вещества с увеличением числа кремниевых фрагментов в ряду 1 фрагмент < < 2 фрагмента < 3 фрагмента. Это объясняется электростатическим взаимодействием между положительно заряженным DOX и отрицательно заряженными керасомами, что приводит к увеличению эффективности инкапсуляции водорастворимого препарата DOX [72].
Разработаны гибридные КОЛ на основе фосфатидилхолина путем реакции конденсации алифатических производных триэтоксисилана, несущих азидную группировку, и алкин-лизолипида [73]. Образуемые молекулы триэтоксисилан-триазол-фосфатидилхолина содержат полисилоксановую сеть внутри бислойной мембраны. Благодаря такой структуре подобные керасомы могут применяться для конструирования везикулярных материалов с функционализированными оболочками.
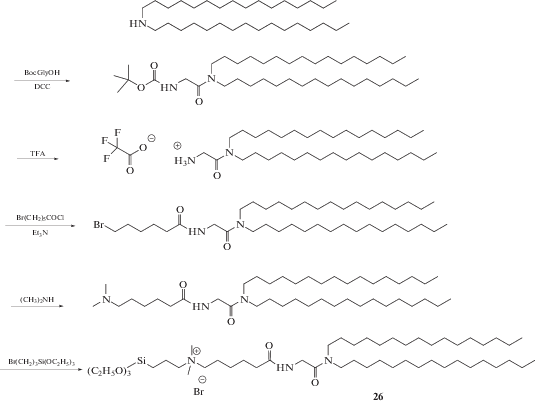
Создание положительного заряда в структуре керасомообразующего липида позволяет применять керасомы не только как часть комбинированных с липосомами систем, но и в качестве самостоятельных агентов трансфекции нуклеиновых кислот в клетки. Для этой цели был разработан КОЛ 26 (схема 9 ) [74]. Катионные керасомы успешно осуществляют трансфекцию первичных нейронов и не оказывают неблагоприятного воздействия на рост аксонов [75].
Схема 9
В последние годы были синтезированы новые керасомообразующие липиды на основе природных аминокислот [76–78]. Это позволило изучить влияние структуры соединений на биологическую активность и свойства агрегатов. Полученные данные свидетельствуют о перспективности применения природных компонентов в составе амфифилов.
При терапии опухолевых заболеваний наноносители в основном пассивно или активно накапливаются в клетках опухолей. До сих пор этот процесс не во всех случаях улучшал терапевтическую эффективность, однако важно, чтобы лекарственные молекулы аккумулировались в местах, близких к опухолям. Путем применения различных стимулов [79], например изменения pH, кванта света, магнитного поля, ультразвука [80, 81] можно обеспечить высвобождение переносимого препарата во внеклеточном пространстве или внутри опухоли.
Фотодинамическая терапия (ФДТ) является одним из неинвазивных методов лечения онкологических заболеваний, использующих активацию внешним светом определенной длины волны особых молекул – фотосенсибилизаторов, которые могут генерировать цитотоксические активные формы кислорода. Фотосенсибилизаторами являются производные порфиринов и родственные им гетероароматические структуры, чувствительные к свету. Активно исследуются производные природных хлоринов и бактериохлоринов [82]. Нетоксичная природа применяемых молекул придает им дополнительное преимущество по сравнению с химиотерапией. Однако плохая растворимость в воде и недостаточная селективность ограничивают их терапевтическое применение. Чтобы решить эту проблему, синтезированы керасомальные фотосенсибилизаторы путем конъюгации порфиринов и керасом [83]. Керасомы, обладающие легко модифицируемыми химическими свойствами, позволяют загружать фотоактивируемый блок для эффективной и безопасной ФДТ. Распределение порфиринов в липидном бислое может предотвращать их агрегацию, а химическое связывание предупреждает преждевременную утечку фотосенсибилизаторов во время циркуляции в русле крови, что значительно улучшает эффективность ФДТ. Исследования показали отличную способность порфирина продуцировать активные формы кислорода даже после конъюгирования с керасомами. Результаты in vitro отражают значительный эффект абляции опухоли при облучении светом 400–700 нм, демонстрируя возможность использовать керасомы в качестве терапевтической платформы для лечения рака [83]. Кроме того, они способны инкапсулировать молекулы лекарственного средства во внутреннюю часть, следовательно, совмещают химиотерапию и ФДТ [84].
В последние годы отмечается значительный исследовательский интерес к разработке и внедрению многофункциональных наноматериалов для одновременной визуализации и терапии [85]. Эта область развилась настолько быстро, что был введен специальный термин “тераностика” для описания двойной функциональности таких наноматериалов [86]. Магнитно-резонансная томография (МРТ) является одним из мощнейших методов диагностики социально значимых заболеваний. Высокое пространственное разрешение, неинвазивность и яркий контраст мягких тканей являются основными преимуществами МРТ по сравнению с другими методами визуализации. Использование магнитных наночастиц в качестве контрастного средства дополнительно позволяет обнаруживать опухоли на ранней стадии. Особое место в ряду магнитных наноматериалов занимают наночастицы магнетита (FeO · Fe2O3) благодаря их уникальным свойствам, например, высокой чувствительности и низкой токсичности для живых организмов. При этом привлекательна их доступность и высокая технологичность процессов получения [87]. Однако для применения магнитных частиц в медицине важную роль играет возможность создания устойчивых коллоидных растворов частиц, биосовместимость, а также возможность модифицировать их путем присоединения к частицам векторов нацеливания на клетки-мишени. Для этой цели было предложено включать наночастицы магнетита в керасомы и, таким образом, получать новую систему, обладающую комбинированными свойствами. Она является как системой доставки терапевтических препаратов в клетки, так и методом диагностики МРТ. Такие системы получили название магнитные керасомочастицы [88].
Магнитные керасомочастицы показали высокую стабильность при хранении в водной среде, пролонгированное высвобождение лекарственного препарата паклитаксела в организме, более высокую чувствительность при диагностике МРТ, а также положительные результаты при лечении лейкемии [89]. Такие показатели делают их многообещающей платформой для одновременной химио- и магнитотерапии.
Керасомальным системам доставки лекарственных веществ в процессе их конструирования можно придать специфические свойства. Например, керасомы могут быть чувствительными к рН среды. При нормальных (физиологических) условиях рН-чувствительные керасомы имеют достаточно жесткую мембрану, однако при понижении рН среды до 6.5 и ниже, что свойственно опухолевым тканям, проницаемость мембраны керасом резко увеличивается [90, 91]. Принципиальным механизмом действия таких керасом является дестабилизация структуры в кислых условиях, что, в свою очередь, приводит к высвобождению их содержимого [92]. Однако существуют некоторые ограничения для терапии. Во-первых, участки опухолей с кислым рН удалены от микроциркулирующей части сосудистого русла, так как именно там наиболее выражена гипоксия. Такая отдаленность затрудняет эффективное накопление керасом в требуемом участке опухоли. Во-вторых, поскольку значения рН в опухолевых клетках не превышают 6.5, технически сложно изготовить керасомы, которые способны эффективно реагировать на низкие уровни pH [93]. Решением данных ограничений является включение производных фосфатидилэтаноламина в состав керасом. Полярная группа фосфолипида подвергается дестабилизации в кислой среде, в результате чего слияние керасом с клеточной мембраной в опухоли протекает легче и, в конечном итоге, высвобождается содержимое транспортной системы. Кроме включения фосфолипидов в состав керасом, возможна модификация их поверхности с помощью рН-лабильных полимеров на основе производных декстрана [94]. Подобное преобразование керасом позволяет создать платформу, способную к дестабилизации в слабокислых условиях.
ЗАКЛЮЧЕНИЕ
Липосомальные транспортные системы в качестве невирусных систем доставки генетического материала и терапевтических молекул являются интересным объектом для фундаментальных исследований. Они позволяют легко транспортировать в клетки нуклеиновые кислоты в составе липоплексов за счет электростатических взаимодействий между положительными полярными группами катионных липидов и отрицательно заряженной поверхностью клеточных мембран. Однако известны недостатки катионных липосом, такие как низкая стабильность, токсичность, а также способность провоцировать сильный иммунный ответ. Тем не менее, современные исследования позволяют преодолевать подобные трудности путем введения в систему дополнительных компонентов – керасомообразующих липидов. Они дают возможность улучшить стабильность везикул в системном кровотоке и способствуют пролонгированному высвобождению полезной нагрузки из липосом в клетках. Это расширяет области применения липосомальных систем.
Таким образом, применение различных липидов позволяет создавать множество липосом для нескольких областей медицины. Невирусные системы доставки на основе гибридных липосом при правильном подборе их структурных компонентов могут стать перспективным решением ряда проблем медицины, а их дальнейшее изучение является актуальной задачей.
Работа выполнена в рамках гранта Российского фонда фундаментальных исследований (№ 19-04-00775).
Список литературы
Dickler H.B., Collier E. 1994. Gene therapy in the treatment of disease. J. Allergy and Clinical Immunology. 94 (6), 942–951.
Patra J.K., Das G., Fraceto L.F., Campos E.V.R., Rodriguez-Torres M.P., Acosta-Torres L.S., Diaz-Torres L.A., Grillo R., Swamy M.K., Sharma S., Habtemariam S., Shin H.-S. 2018. Nano based drug delivery systems: recent developments and future prospects. J. Nanobiotechnol. 16 (1), 71–104.
Yin H., Kanasty R., Eltoukhy A., Vegas A.J., Dorkin J.R., Anderson D.G. 2014. Non-viral vectors for gene-based therapy. Nat Rev Genet. 15, 541–555.
Akinc A., Maier M.A., Manoharan M., Fitzgerald K., Jayaraman M., Barros S., Ansell S., Du X., Hope M.J., Madden T.D., Mui B.L., Semple S.C., Tam Y.K., Ciufolini M., Witzigmann D., Kulkarni J.A., Meel R., Cullis P.R. 2019. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotech. 14, 1084–1087.
Carter M. 2015. Chapter 11. Gene delivery strategies. In: Guide to Research Techniques in Neuroscience. New York: Acad. Press, p. 239–252.
Alavi M., Karimi N., Safaei M. 2017. Application of various types of liposomes in drug delivery systems. Adv. Pharm. Bull. 7(1), 3–9.
Тазина Е.В., Игнатьева Е.В., Полозкова А.П., Орлова О.Л., Оборотова Н.А. 2008. Технология получения и анализ термозависимой липосомальной лекарственной формы доксорубицина. Хим.-фарм. журн. 42 (12), 30–35.
Patil Y.P., Jadhav S. 2014. Novel methods for liposome preparation. Chem. Phys. Lipids. 177, 8–18.
Dan N. 2015. Lipid-nucleic acid supramolecular complexes: Lipoplex structure and the kinetics of formation. AIMS Biophysics. 2 (2), 163–183.
Kim T.K., Eberwine J.H. 2010. Mammalian cell transfection: The present and the future. Analytical and Bioanalytical Chemistry. 397 (8), 3173–3178.
Knudsen K.B., Northeved H., Kumar P.E., Permin A., Gjetting T., Andresen T.L., Larsen S., Wegener K.M., Lykkesfeldt J., Jantzen K., Loft S., Møller P., Roursgaard M. 2015. In vivo toxicity of cationic micelles and liposomes. Nanomedicine. 11 (2), 467–477.
Akbarzadeh A., Rezaei-Sadabady R., Davaran S., Joo S. W., Zarghami N., Hanifehpour Y., Samiei M., Kouhi M., Nejati-Koshki K. 2013. Liposome: Classification, preparation, and applications. Nanoscale Research Letters. 8 (1), 102.
Shim G., Kim M.-G., Park J.Y., Oh Y.-K. 2013. Application of cationic liposomes for delivery of nucleic acids. Asian J. Pharm. Sci. 8, 72–80.
Liang X., Li X., Jing L., Xue P., Jiang L., Ren Q., Dai Z. 2013. Design and synthesis of lipidic organoalkoxysilanes for self-assembly of liposomal nanohybrid cerasomes with controlled drug release properties. Chem. Eur. J. 19 (47), 16113–16121.
Sabın J., Prieto G., Ruso J.M., Hidalgo-Álvarez R., Sarmiento F. 2006. Size and stability of liposomes: A possible role of hydration and osmotic forces. The European Phys. J. 20, 401–408.
Sandeep K., Sunilkumar K.T., Sudheer B., Mohanvarma M. 2013. Liposomal drug delivery system – A comprehensive review. Int. J. Drug Dev. Res. 5 (4), 62–75.
Ghosh Y.K., Visweswariah S.S., Bhattacharya S. 2002. Advantage of the ether linkage between the positive charge and the cholesteryl skeleton in cholesterol-based amphiphiles as vectors for gene delivery. Bioconjugate Chem. 13, 378–384.
Ghosh Y.K., Visweswariah S.S., Bhattacharya S. 2000. Nature of linkage between the cationic headgroup and cholesteryl skeleton controls gene transfection efficiency FEBS letters. 473, 341–344.
Banerjee R., Mahidhar Y.V., Chaudhuri A., Gopal V., Rao N.M. 2001. Design, synthesis, and transfection biology of novel cationic glycolipids for use in liposomal gene delivery J. Med. Chem. 44, 4176–4185.
Sarker S.R., Arai S., Murate M., Takahashi H., Takata M., Kobayashi T., Takeoka S. 2012. Evaluation of the influence of ionization states and spacers in the thermotropic phase behaviour of amino acid-based cationic lipids and the transfection efficiency of their assemblies. Int. J. Pharmaceutics. 422, 364–373.
Obata Y., Saito S., Takeda N., Takeoka S. 2009. Plasmid DNA-encapsulating liposomes: Effect of a spacer between the cationic head group and hydrophobic moieties of the lipids on gene expression efficiency. Biochim. Biophys. Acta. 1788, 1148–1158.
Loew S., Fahr A., May S. 2011. Modeling the release kinetics of poorly water-soluble drug molecules from liposomal nanocarriers. J. Drug Deliv. 376548.
Yi W.J., Zheng L.T., Su R.C., Liu Q., Zhao Z.-G. 2015. Amino acid-based cationic lipids with alpha-tocopherol hydrophobic tail for efficient gene delivery. Chem. Biol. Drug Design. 86, 1192–1202.
Zhi D., Zhang S., Wang B., Zhao Y., Yang B., Yu S. 2010. Transfection efficiency of cationic lipids with different hydrophobic domains in gene delivery. Bioconjugate Chem. 21, 563–577.
Pinnaduwage P., Schmitt L., Huang L. 1989. Use of a quaternary ammonium detergent in liposome mediated DNA transfection of mouse L-cells. Biochim. Biophys. Acta. 985, 33–37.
Cameron F.H., Moghaddam M.J., Bender V.J., Whittaker R.G., Mott M., Lockett T.J. 1999. A transfection compound series based on a versatile Tris linkage. Biochim. Biophys. Acta. 1417, 37–50.
Obika S., Yu W., Shimoyama A., Uneda T., Miyashita K., Doi T., Imanishi T. 2001. Symmetrical cationic triglycerides: An efficient synthesis and application to gene transfer. Bioorgan. Med. Chem. 9, 245–254.
Felgner J.H., Kumar R., Sridhar C.N., Wheeler C.J., Tsai Y.J., Border R., Ramsey P., Martin M., Felgner P.L. 1994. Enhanced gene delivery and mechanism studies with a novel series of cationic lipid formulations. J. Biol. Chem. 269, 2550–2561.
Lichtenberg D., Freire E., Schmidt C.F., Barenholz Y., Felgner P.L., Thompson T.E. 1981. Effect of surface curvature on stability, thermodynamic behavior, and osmotic activity of dipalmitoylphosphatidylcholine single lamellar vesicles. Biochemistry. 20, 3462–3467.
Lichtenberg D., Felgner P., Thompson T. 1982. Transition of a liquid crystalline phosphatidylcholine bilayer to the gel phase in a vesicle reduces the internal aqueous volume. Biochim. Biophys. Acta. Biomembranes. 684, 277–281.
Fletcher S., Ahmad A., Perouzel E., Heron A., Miller A.D., Jorgensen M.R. 2006. In vivo studies of dialkynoyl analogues of DOTAP demonstrate improved gene transfer efficiency of cationic liposomes in mouse lung. J. Med Chem. 49, 349–357.
Obata Y., Suzuki D., Takeoka S. 2008. Evaluation of cationic assemblies constructed with amino acid-based lipids for plasmid DNA delivery. Bioconjugate Chem. 19, 1055–1063.
Floch V., Bolc’h G. Le, Audrezet M.P., Yaouanc J.J., Clément J.C., Abbayes H., Mercier B., Abgrall J.F., Férec C. 1997. Cationic phosphonolipids as non-viral vectors for DNA transfection in hematopoietic cell lines and CD34+ cells. Blood Cell. Mol. Dis. 23, 69–87.
Nantz M.H., Dicus C.W., Hilliard B., Yellayi S., Zou S., Hecker J.G. 2010. The benefit of hydrophobic domain asymmetry on the efficacy of transfection as measured by in vivo imaging. Mol. Pharm. 7, 786–794.
Dharmalingam P., Rachamalla H.K.R., Lohchania B., Bandlamudi B., Thangavel S., Murugesan M.K., Banerjee R., Chaudhuri A., Chandrashekhar Voshavar, Marepally S. 2017. Green transfection: Cationic lipid nanocarrier system derivatized from vegetable fat, palmstearin enhances nucleic acid transfections. ACS Omega. 2, 7892–7903.
Bhattacharya S., Bajaj A. 2009. Advances in gene delivery through molecular design of cationic lipids. Chem. Commun. 31, 4632–4656.
Shi N., Pardridge W.M. 2000. Noninvasive gene targeting to the brain. Proc. Natl. Acad. Sci. USA. 97, 7567–7572.
Sarker S.R., Takeoka S. 2018. Amino acid-based liposomal assemblies: Intracellular plasmid DNA delivery nanoparticles. J. Nanomed. 2, 1008–1021.
Ghosh Y.K., Visweswariah S.S., Bhattacharya S. 2002. Advantage of the ether linkage between the positive charge and the cholesteryl skeleton in cholesterol-based amphiphiles as vectors for gene delivery. Bioconjugate Chem. 13, 378–384.
Ghosh Y.K., Visweswariah S.S., Bhattacharya S. 2000.Nature of linkage between the cationic headgroup and cholesteryl skeleton controls gene transfection efficiency. FEBS letters. 473, 341–344.
Kim H.S., Song I.H., Kim J.C., Jang D.O., Park Y.S. 2006. In vitro and in vivo gene-transferring characteristics of novel cationic lipids, DMKD (O,O'-dimyristyl-N-lysyl aspartate) and DMKE (O,O'-dimyristyl-N-lysyl glutamate). J. Contr. Release. 115, 234-241.
Rajesh M., Sen J., Srujan M., Mukherjee K., Sreedhar B., Chaudhuri A. 2007. Dramatic influence of the orientation of linker between hydrophilic and hydrophobic lipid moiety in liposomal gene delivery. J. Amer. Chem. Society. 129, 11408–11420.
Zhi D., Bai Y., Yang J., Cui S., Zhao Y., Chen H., Zhang S. 2018. A review on cationic lipids with different linkers for gene delivery. Adv. Colloid Interface Sci. 253, 117–140.
Bajaj A., Kondaiah P., Bhattacharya S. 2008. Effect of the nature of the spacer on gene transfer efficacies of novel thiocholesterol derived gemini lipids in different cell lines: A structure–activity investigation. J. Med. Chem. 51, 2533–2540.
Bhattacharya S. 1999. Vesicle formation from dimeric ion-paired amphiphiles. control over vesicular thermotropic and ion-transport properties as a function of intra-amphiphilic headgroup separation. Langmuir. 15, 3400–3410.
Bhattacharya S., Bajaj A. 2007. Membrane-forming properties of gemini lipids possessing aromatic backbone between the hydrocarbon chains and the cationic headgroup. J. Phys. Chem. B. 111, 13511–13519.
Sarker S.R., Aoshima Y., Hokama R., Inoue T., Sou K., Takeoka S. 2013. Arginine-based cationic liposomes for efficient in vitro plasmid DNA delivery with low cytotoxicity. Int. J. Nanomed. 8, 1361–1375.
Colomer A., Pinazo A., García M.T., Mitjans M., Vinardell M.P., Infante M.R., Martínez V., Pérez L. 2012. pH-Sensitive surfactants from lysine: Assessment of their cytotoxicity and environmental behavior. Langmuir. 28, 5900–5912.
Mezei A., Pérez L., Pinazo A., Comelles F., Infante M.R., Pons R. 2012. Self assembly of pH-sensitive cationic lysine based surfactants. Langmuir. 28, 16 761–16 771.
Castro M., Griffiths D., Patel A., Pattrick N., Kitson C., Ladlow M. 2004. Effect of chain length on transfection properties of spermine-based gemini surfactants. Org. Biomol. Chem. 2, 2814–2820.
Karlsson L., van Eijk M.C.P., Söderman O. 2002. Compaction of DNA by gemini surfactants: Effects of surfactant architecture. J. Colloid Interface Sci. 252, 290–296.
Wettig S.D., Badea I., Donkuru M., Verrall R.E., Foldvari M. 2007. Structural and transfection properties of amine-substituted gemini surfactant-based nanoparticles. J. Gene Med. 9, 649–658.
Vigneron J.P., Oudrhiri N., Fauquet M., Vergely L., Bradley J.C., Basseville M., Lehn P., Lehn J.M. 1996. Guanidinium-cholesterol cationic lipids: efficient vectors for the transfection of eukaryotic cells. Proc. Natl. Acad. Sci. USA. 93, 9682–9686.
Sen J., Chaudhuri A. 2005. Design, syntheses, and transfection biology of novel non-cholesterol-based guanidinylated cationic lipids. J. Med. Chem. 48, 812–820.
Nakase I., Takeuchi T., Tanaka G., Futaki S. 2008. Methodological and cellular aspects that govern the internalization mechanisms of arginine-rich cell-penetrating peptides. Adv. Drug Delivery Rev. 60, 598–607.
Лосева А.А., Буданова У.А., Себякин Ю.Л. 2019. Cинтез новых гуанидинилированных амфифилов и их аналога, содержащего пирен, для создания липосомальных транспортных систем и визуализации в клетке-мишени. Журн. орг. химии. 55 (12), 1827–1833.
Kumar V.V., Pichon C., Refregiers M., Guerin B., Midoux P., Chaudhuri A. 2003. Single histidine residue in head-group region is sufficient to impart remarkable gene transfection properties to cationic lipids: evidence for histidine-mediated membrane fusion at acidic pH. Gene Ther. 10, 1206–1215.
Cardoso A.M., Morais C.M., Cruz A.R., Silva S.G., Vale M.L., Marques E.F., Pedroso de Lima M.C., Jurado A.S. 2015. New serine-derived gemini surfactants as gene delivery systems. Eur. J. Pharm. Biopharm. 89, 347–356.
Gujrati M., Malamas A., Shin T., Jin E., Sun L., Lu Z.-R. 2014. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Mol. Pharm. 11, 2734–2744.
Tang F., Hughes J.A. 1998. Introduction of a disulfide bond into a cationic lipid enhances transgene expression of plasmid DNA. Biochem. Biophys. Res. Commun. 242, 141–145.
Kedika B., Patri S.V. 2012. synthesis and gene transfer activities of novel serum compatible reducible tocopherol-based cationic lipids. Mol. Pharm. 9, 1146–1162.
Denieva Z.G., Romanova N.A., Bodrova T.G., Budanova U.A., Sebyakin Yu.L. 2019. Synthesis of amphiphilic peptidomimetics basedon the aliphatic derivatives of natural amino acids. Moscow University Chem. Bull. 74 (6), 300–305.
Marusova (Soloveva) V.V., Zagitova R.I., Budanova U.A., Sebyakin Yu.L. 2018. Multifunctional lipoamino acid derivatives with potential biological activity. Moscow University Chem. Bull. 73 (2), 74–79.
Katagiri K., Ariga K., Kikuchi J.-I. 1999. Preparation of organic-inorganic hybrid vesicle “cerasome” derived from artificial lipid with alkoxysilyl head. Chem. Lett. 28, 661–662.
Liang X., Gao J., Jiang L., Luo J., Jing L., Li X., Jin Y., Dai Z. 2015. Nanohybrid liposomal cerasomes with good physiological stability and rapid temperature responsiveness for high intensity focused ultrasound triggered local chemotherapy of cancer. ACS Nano. 9, 1280–1293.
Zhang C.Y., Cao Z., Zhu W.J., Liu J. 2014. Highly uniform and stable cerasomal microcapsule with good biocompatibility for drug delivery. Colloids Surface B. 116, 327–333.
Kikuchi J. 2011. Cerasomes: A new family of artificial cell membranes with ceramic surface. In: Advances in Biomimetics. Ed. George A. Rijeka: InTech, p. 231–250.
Wang Y., Wang B., Song X., Wu H., Wang H., Shen H., Ma X., Tan M. 2015. Liposomal nanohybrid cerasomes for mitochondria-targeted drug delivery. J. Mat. Chem. B. 3, 7291–7299.
Katagiri K., Hamasaki R., Ariga K., Kikuchi J.-I. 2003. Preparation and surface modification of novel vesicular nano-particle “cerasome” with liposomal bilayer and silicate surface. J. Sol.-Gel. Sci. Technol. 26, 393–396.
Cheung L.S., Zheng X., Stopa A., Baygents J.C., Guzman R., Schroeder J.A., Heimark R.L., Zohar Y. 2009. Detachment of captured cancer cells under flow acceleration in a bio-functionalized microchannel. Lab. Chip. 9, 1721–1731.
Liu D., Wu Q., Zou S., Bao F., Kikuchi J.-I., Song X.-M. 2020. Surface modification of cerasomes with AuNPs@poly(ionic liquid)s for an enhanced stereo biomimetic membrane electrochemical platform. Bioelectrochem. 132, 107411.
Hashizume M., Inoue H., Katagiri K., Ikeda A., Kikuchi J.-I. 2004. Cerasome as an organic-inorganic nanohybrid: Characterization of cerasome-forming lipids having a single or a dual trialkoxysilil head. J. Sol.-Gel. Sci. Technol. 31, 99–102.
Zhang D., Culver H.R., Bowman C.N. 2019. Hybrid cerasomes composed of phosphatidylcholines and silica networks for the construction of vesicular materials with functionalized shells. ACS Applied Nano Mater. 2 (12), 7549–7558.
Katagiri K., Hashizume M., Ariga K., Terashima T., Kikuchi J.-I. 2007. Preparation and characterization of a novel organic-inorganic nanohybrid “cerasome” formed with a liposomal membrane and silicate surface. Chem. Eur. J. 13, 5272–5281.
Tahara K., Moriuchi T., Tsukui M., Hirota A., Maeno T., Toriyama M., Inagaki N., Kikuchi J.-I. 2013. Ceramic coating of liposomal gene carrier for minimizing toxicity to primary hippocampal neurons. Chem. Lett. 42, 1265–1267.
Denieva Z.G., Budanova U.A., Sebyakin Yu.L. 2019. Synthesis asymmetric lipid-like organosilanes for liposomal nanohybrid cerasomes toward potential medical applications. Mendeleev Commun. 29, 32–34.
Sarychev G.A., Mironova M.S., Budanova U.A., Sebyakin Yu.L. 2017. Design, synthesis and morphology of the organosiloxane hybrid particles based on L-aspartic acid derivatives. Mendeleev Commun. 27, 155–156.
Denieva Z.G., Budanova U.A., Sebyakin Y.L. 2019. Липосомальные гибридные кремний-органические средства доставки лекарственных препаратов. Изв. вузов. Химия и хим. технология. 62 (5), 14–23.
Karimi M., Ghasemi A., Zangabad P.S., Rahighi R., S. Basri M.M., Mirshekari H., Amiri M., Pishabad Z.S., Aslani A., Bozorgomid M., Ghosh D., Beyzavi A., Vaseghi A., Aref A.R., Haghani L., Bahrami S., Hamblin M.R. 2016. Smart micro/nanoparticles in stimulus responsive drug/gene delivery systems. Chem. Soc. Rev. 45, 1457–1501.
Xiao W., Zeng X., Lin H., Han K., Jia H.-Z., Zhang X.-Z. 2015. Dual stimuli-responsive multi-drug delivery system for the individually controlled release of anti-cancer drugs. Chem. Commun. 51, 1475–1478.
Manigandan A., Handi V., Sundaramoorthy N.S, Dhandapani R., Radhakrishnan J., Sethuraman S., Subramanian A. 2017. Responsive nanomicellar theranostic cages for metastatic breast cancer. Bioconjugate Chem. 29, 275–286.
Panchenko P.A., Grin M.A., Fedorova O.A., Zakharko M.A., Pritmov D.A., Mironov A.F., Arkhipova A.N., Fedorov Y.V., Jonusauskas G., Yakubovskaya R.I., Morozova N.B., Ignatova A.A., Feofanov A.V. 2017. A novel bacteriochlorin–styrylnaphthalimide conjugate for simultaneous photodynamic therapy and fluorescence imaging. Phys. Chem. Chem. Phys. 19, 30195–30206.
Liang X., Li X., Yue X., Dai Z. 2011. Conjugation of porphyrin to nanohybrid cerasomes for photodynamic diagnosis and therapy of cancer. Angew. Chem. Int. Ed Engl. 50, 11622–11627.
Li S., Jiang J., Zhu S., Yan Y., Huang G., He D. 2017. Progress of liposomal nanohybrid cerasomes as novel drug nanocarriers. Gen. Chem. 3 (4), 194–201.
Bhattarai P., Liang X., Xu Y., Dai Z. 2017. A novel cyanine and porphyrin based theranostic nanoagent for near-infrared fluorescence imaging guided synergistic phototherapy. J. Biomed. Nanotechnol. 13, 1468–1479.
Elzoghby A.O., Hemasa A.L., Freag M.S. 2016. Hybrid protein-inorganic nanoparticles: From tumor-targeted drug delivery to cancer imaging. J. Control. Release. 243, 303–322.
Шарапаев А.И., Мурадова А.Г., Юртов Е.В. 2012. Получение магнитных частиц на основе магнетита и фармацевтически приемлемых полимеров для МРТ-диагностики. Успехи химии и хим. технологии. 26 (7), 97–100.
Cao Z., Zhu W., Wang W., Zhang C., Xu M., Liu J., Feng S.-T., Jiang Q., Xie X. 2014. Stable cerasomes for simultaneous drug delivery and magnetic resonance imaging. Int. J. Nanomed. 9, 5103–5116.
Mo R., Sun Q., Li N., Zhang C. 2013. Intracellular delivery and antitumor effecrs of pH-sensitive liposomes based on zwitterionic oligopeptide lipids. Biomaterials. 34 (11), 2773–2786.
Xia G., An Z.Y. Wang Y., Zhao C., Li M., Li Z.; Ma J. 2013. Synthesis of a novel polymeric material folate-poly(2-ethyl-2-oxazoline)-distearoyl phosphatidyl ethanolamine tri-block polymer for dual receptor and pH-sensitive targeting liposome. Chem. Pharm. Bull. 61 (4), 390–398.
Drummond D. C., Zignani M., Leroux J. 2000. Current status of pH-sensitive liposomes in drug delivery. Prog. Lipid Res. 39 (5), 409–460.
Karanth H., Murthy R. 2007. pH-sensitive liposomes-principle and application in cancer therapy. J. Pharm. Pharmacol. 59 (4), 469–483.
Ferreira D.S., Lopes S.C., Franco M.S., Oliveira M.C. 2013. pH-sensitive liposomes for drug delivery in cancer treatment. Ther. Deliv. 4 (9), 1099–1123.
Seki K., Tirrell D.A. 1984. pH-dependent complexation of poly(acrylic acid) derivatives with phospholipid vesicle membranes. Macromolecules. 17 (9), 1692–1698.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии