Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 1, стр. 61-70
Появление признаков дифференцировки и провоспалительного фенотипа у клеток острого миелоидного лейкоза ТНР-1 при повышении их TRAIL-резистентности в агрегатах in vitro
М. И. Кобякова a, Я. В. Евстратова a, А. С. Сенотов a, А. И. Ломовский a, В. В. Минайчев a, А. И. Звягина a, М. Е. Соловьева a, И. С. Фадеева a, В. С. Акатов a, Р. С. Фадеев a, *
a Институт теоретической и экспериментальной биофизики РАН
142290 Пущино, Россия
* E-mail: fadeevrs@gmail.com
Поступила в редакцию 03.08.2020
После доработки 09.09.2020
Принята к публикации 10.09.2020
Аннотация
Ранее нами было обнаружено значительное повышение TRAIL (TNFα Related Apoptosis Inducing Ligand) резистентности клеток острого миелоидного лейкоза (ОМЛ) в многоклеточных агрегатах in vitro, моделирующих расположение лейкозных клеток в костном мозге. В представленной работе мы попытались оценить, может ли быть связано повышение резистентности клеток ОМЛ к цитотоксическому действию TRAIL в многоклеточных агрегатах in vitro с запуском механизмов, опосредованных дифференцировкой клеток или приобретением ими провоспалительного фенотипа. Было выполнено исследование фенотипа клеток ТНР-1 в агрегированной и дезагрегированной культурах в сравнении с фенотипом дезагрегированной культуры клеток ТНР-1, подвергнутой действию факторов, индуцирующих моноцитоподобную дифференцировку или провоспалительный фенотип. Установлено, что повышение TRAIL-резистентности клеток ТНР-1 в агрегированной культуре сопровождается появлением у них признаков, характерных для моноцитоподобной дифференцировки и провоспалительного фенотипа. Результаты представляют интерес для разработки подходов подавления TRAIL-резистентности клеток ОМЛ в костном мозге человека.
ВВЕДЕНИЕ
Выяснение механизмов резистентности опухолевых клеток к противоопухолевой терапии и к иммунному надзору, в частности, к известному индуктору апоптотической рецептор-опосредованной гибели опухолевых клеток, цитокину TRAIL (TNFα Related Apoptosis Inducing Ligand), является одной из центральных задач онкологии. Ранее нами было обнаружено значительное повышение TRAIL-резистентности клеток острого миелоидного лейкоза (ОМЛ) in vitro в многоклеточных агрегатах, которые моделируют расположение лейкозных клеток в костном мозге [1, 2]. Повышение TRAIL-резистентности было обнаружено также у клеток различных линий, полученных из солидных опухолей (сарком, карцином, глиом, нейробластом и т.д.), при формировании ими конфлюэнтного монослоя или клеточных сфероидов in vitro [3–7]. В связи с этим изучение механизмов повышения резистентности опухолевых клеток, в частности клеток ОМЛ, в многоклеточных агрегатах к цитотоксическому действию лиганда TRAIL представляет интерес для онкологии.
Известно, что в процессе дифференцировки клеток моноцитарного ряда наблюдается активация внутриклеточных сигнальных путей выживания [8]. Так, созревание в моноцитарном направлении у нормальных клеток может сопровождаться повышенной экспрессией антиапоптотических белков, таких как Bcl-XL, XIAP (через активацию транскрипционного фактора STAT3) [9] и/или Bcl-2 (через активацию сигнального каскада Akt/PI3K) [10]. Кроме того, в механизмах защиты моноцитов от индукции клеточной гибели могут участвовать белки теплового шока (Hsp), в частности Hsp27, Hsp70 и Hsp90 [10]. Также в наших публикациях было показано, что снижение экспрессии проапоптотических TRAIL-рецепторов и, соответственно, повышение TRAIL-устойчивости происходит на фоне дифференцировки миелоидных клеток в моноцитарно-макрофагальном направлении как при направленной дифференцировке лейкозных бластов, так и при созревании нормальных моноцитов периферической крови в макрофаги [11]. В то же время известно, что активация клеток моноцитарного ряда липополисахаридом, цитокинами TNFα, IL-1β, в ходе которой они приобретают провоспалительный фенотип, может также защищать их от гибели. Показано, что активация клеток моноцитарного ряда может сопровождаться активацией транскрипционного фактора NF-kB и, как следствие, повышенной экспрессией антиапоптотических белков семейств Bcl-2 и IAP [12, 13], а также индукцией секреции провоспалительных цитокинов, таких как TNFα, IL-1β, -6, -8, -10, -12, -15 [14], способной повысить выживаемость клеток [10]. В связи с этим возникает вопрос, может ли быть связано повышение TRAIL-резистентности клеток ОМЛ в многоклеточных агрегатах in vitro с дифференцировкой клеток или с приобретением ими провоспалительного фенотипа. В представленной работе мы попытались ответить на этот вопрос.
МАТЕРИАЛЫ И МЕТОДЫ
Клеточные культуры. В работе использовали клетки острого миелоидного лейкоза человека, линия ТНР-1, полученные из Всероссийской коллекции клеточных культур (Институт цитологии РАН, Санкт-Петербург), а также первичную культуру моноцитов периферической крови человека, полученную от здоровых доноров из ГБУЗ МО МОНИКИ им. М.Ф. Владимирского. Первичная культура моноцитов была получена из мононуклеарной фракции периферической крови с использованием набора MojoSort Human Pan Monocyte Isolation Kit (BioLegend, США) в соответствии с рекомендациями производителя. Моноциты культивировали в среде DMEM/F12 с добавлением 10% эмбриональной телячьей сыворотки (Gibco, США) 80 мкг/мл гентамицина, 24 мкг/мл флуконазола при 37°C и 5% CO2 в газовой фазе в СО2-инкубаторе в течение 24 ч. Для открепления моноцитов от поверхности культуральной посуды использовали фермент Accutase (Sigma, США). Клетки ТНР-1 культивировали в среде RPMI 1640/F12 с добавлением 20% эмбриональной телячьей сыворотки, 80 мкг/мл гентамицина, 24 мкг/мл флуконазола при 37°C и 5% CO2 в газовой фазе в СО2-инкубаторе. Клетки линии THP-1 спонтанно формировали агрегаты, состоящие из 10–50 клеток через 24 ч после посева 15 × × 103 клеток/см2.
Получение белка izTRAIL. Для получения тримерной формы белка izTRAIL синтезировали мотив изолейциновой застежки и ген izTRAIL, которые в дальнейшем клонировали в плазмидном векторе pET101 (Novagen, США). Полученным геном трансформировали штамм E. coli BL21(DE3) и методом микробного синтеза с последующей очисткой металл-аффинной хроматографии получали тримерную форму izTRAIL с молекулярной массой 80 кДа [15, 16]. Показано, что полученный рекомбинантный белок TRAIL вызывает апоптотическую гибель опухолевых клеток в культуре [16].
Активация провоспалительного фенотипа и моноцитоподобной дифференцировки у клеток ТНР-1. Для активации провоспалительного фенотипа клетки THP-1 культивировали в среде DMEM/F12 с добавлением 10% эмбриональной телячьей сыворотки в присутствии 10 мкг/мл липополисахарида (LPS) из E. coli O111:B4 (Sigma, США) в течение 24 ч. [17, 18]. Для получения моноцитоподобной дифференцировки клетки THP-1 культивировали в среде DMEM/F12 с добавлением 10% эмбриональной телячьей сыворотки в присутствии 1 мкМ ATRA (Sigma, США) в течение 96 ч [19]. Затем клетки трижды отмывали средой DMEM/F12 и использовали для экспериментов.
Формирование многоклеточных агрегатов. Для формирования многоклеточных агрегатов клетки высевали по 5 × 103 клеток в лунку в 100 мкл ростовой среды в 96-луночные планшеты, покрытые 1.5% гелем агарозы толщиной 1 мм (Panreac, Испания) и культивировали в течение 5 дней (120 ч). Формированию агрегатов способствовала U-образная форма агарозного геля на дне лунки. Через 120 ч после посева в каждой лунке наблюдали крупные одиночные агрегаты клеток. Клетки в агрегатах были слабо связаны, и стандартное пипетирование культуры позволяет получить из агрегатов суспензию живых одиночных клеток.
Анализ цитотоксического действия белка izTRAIL. Для анализа цитотоксического действия белка izTRAIL клетки из растущих культур высевали в 96-луночные плоскодонные культуральные планшеты по 5 × 103 клеток в 100 мкл ростовой среды в лунки, дно которых было покрыто слоем 1.5% агарозного геля (Panreac, Испания) толщиной 1 мм, способствующего формированию агрегатов, или без покрытия агарозным гелем. Цитотоксическое действие izTRAIL оценивали по отношению количества живых клеток в опытных и контрольных (без добавления izTRAIL) культурах через 24 ч после добавления izTRAIL. Белок izTRAIL добавляли через 24 ч после посева клеток в лунки, не покрытые агарозным гелем, или через 120 ч после посева клеток в лунки, покрытые агарозным гелем. Количество живых клеток после инкубации с izTRAIL оценивали по интенсивности восстановления резазурина (Sigma, США). Для этого к клеткам добавляли резазурин в концентрации 30 мкг/мл. Далее клетки инкубировали с красителем в течение 4 ч при 37°C и 5% CO2 в инкубаторе и измеряли интенсивность флуоресценции при длине волны возбуждения 532 нм и длине волны испускания 590 нм с использованием планшетного спектрофлуориметра Infinite F200 (Tecan, Австрия) [20].
Анализ пролиферативной активности. Для определения пролиферативной активности оценивали распределение клеточной популяции по фазам клеточного цикла, митотическую активность клеток, экспрессию ядерного антигена Ki-67. Для изучения распределения по фазам клеточного цикла, клетки отмывали в фосфатно-солевом буфере (300 g, 5 мин), фиксировали 70% этанолом (24 ч, –20°C), окрашивали йодидом пропидия. Для анализа экспрессии Кi-67 клетки окрашивали моноклональными антителами против Кi-67 человека, конъюгированными с PE (Biolegend, США). Для определения неспецифического связывания клетки окрашивали антителами контроля изотипа PE Mouse IgG1, k isotype Ctrl (Biolegend, США). Для анализа флуоресценции клеток и построения ДНК-цитограмм использовали проточный цитометр BD Accuri C6 (BD Bioscience, США). Полученные результаты обрабатывали с использованием программы ModFit LT 4.1. Митотический индекс и жизнеспособность оценивали, окрашивая суспензию клеток в культуральной среде флуоресцентными ядерными красителями Hoechst 33 342 и йодидом пропидия в концентрации 1 мкг/мл и подсчитывая число живых, погибших, а также митотических клеток с помощью флуоресцентного микроскопа DM 6000 (Leica, Германия), используя камеры Горяева [16, 21].
Иммунофенотипирование клеток. Клетки для иммунофенотипирования отмывали в буферном растворе для окрашивания клеток (Biolegend, США) при 300 g в течение 5 мин, окрашивали их, используя панель конъюгированных с FITC человеческих моноклональных антител против CD11b (Biolegend США), CD11c, CD14 и CD45 (Sigma, США), CD163 и CD68 (BD Bioscience, США), а также конъюгированных с PE моноклональных человеческих антител CD284 и HLA-DR (Biolegend США). Для определения неспецифического связывания клетки окрашивали антителами-контролями изотипов: FITC Mouse IgG1, k isotype Ctrl, PE Mouse IgG1 k isotype и PE Mouse IgG2a k isotype (Biolegend, США). Окрашивание проводили при комнатной температуре в темноте в течение 30 мин. После окрашивания клетки фиксировали 2% раствором параформальдегида (Panreac, Испания). Измерение флуоресценции выполняли с помощью проточного цитометра BD Accuri C6.
Определение гранулярности цитоплазмы. Определение гранулярности цитоплазмы клеток проводили по боковому рассеянию света (SSC) на проточном цитометре Accuri C6.
Анализ фагоцитарной активности клеток. Фагоцитарную активность клеток оценивали после 2 ч инкубации их в СО2-инкубаторе в ростовой среде с добавлением в нее 1 мг/мл pHrodo Green E. coli (Thermo Fisher Scientific, Германия). Для контроля неспецифического окрашивания клетки инкубировали с 10 мкг/мл цитохалазина D (Sigma, США) в течение 30 мин в СО2-инкубаторе, затем добавляли 1 мг/мл pHrodo Green E. coli и далее инкубировали в течение 2 ч. Измерение флуоресценции осуществляли с помощью проточного цитометра BD Accuri C6. Оценку фагоцитарной активности проводили с использованием показателей фагоцитарного числа и индекса. Фагоцитарный индекс отражает процент клеток в популяции, способных к поглощению бактерий (оценивали по числу флуоресцентных клеток в процентах относительно общего числа клеток). Фагоцитарное число – среднее число бактерий, поглощенное одним фагоцитом (оценивали по средней интенсивности флуоресценции клеток, способных к фагоцитозу) [22].
Оценка внутриклеточного содержания оксида азота (NO). Для оценки внутриклеточной продукции NO клетки инкубировали в ростовой среде в течение 40 мин после добавления в нее 5 мкМ флуоресцентного NO-зонда DAF-FM DA (Thermo Fisher Scientific, Германия). Далее клетки отмывали в ростовой среде (300 g, 5 мин) и инкубировали в ней в течение 30 мин. Все процедуры инкубации выполняли при 37°C и 5% СО2. Интенсивность флуоресценции клеток измеряли, используя проточный цитофлуориметр BD Accuri C6 [22].
Статистический анализ. Результаты представляли в виде среднего ± стандартное отклонение (M ± SD). Опыты проводили не менее чем в трех повторах (n ≥ 3). Статистическую значимость отличия определяли с помощью одностороннего ANOVA с последующим множественным сравнением Холма–Сидака, р < 0.05.
РЕЗУЛЬТАТЫ
Клетки ТНР-1 приобретают в агрегатах in vitro такую же TRAIL-резистентность, как после воздействия дифференцирующего фактора ATRA или провоспалительного стимула LPS
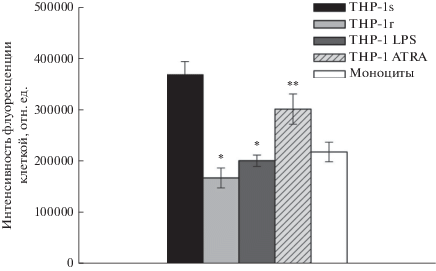
Мы сравнили TRAIL-резистентность клеток ОМЛ линии ТНР-1 в многоклеточных агрегатах (1), после индукции у этих клеток моноцитоподобной дифференцировки трансретиноевой кислотой ATRA (2), после активации в этих клетках провоспалительного фенотипа посредством LPS (3) и TRAIL-резистентность моноцитов периферической крови человека (4) (рис. 1).
Рис. 1.
Цитотоксическое действие рекомбинантного белка izTRAIL на клетки ТНР-1, культивируемые 24 ч в планшете (нет агрегата, ТНР-1s), либо 120 ч в агрегате на агарозном геле (ТНР-1r), либо предварительно обработанные ATRA (1 мкМ, 96 ч) и затем культивируемые 24 ч (нет агрегата) (ТНР-1 ATRA), либо предварительно обработанные LPS (10 мкг/мг, 24 ч) и затем культивируемые 24 ч (нет агрегата) (ТНР-1 LPS) и моноциты крови человека (нет агрегата).
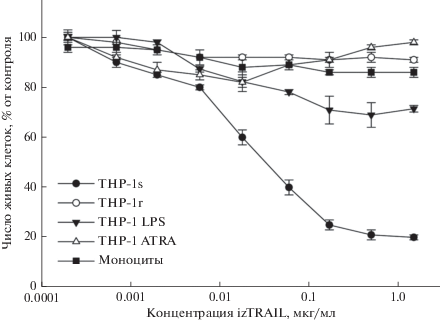
Было установлено, что как после LPS-индуцированной активации провоспалительного фенотипа у клеток ТНР-1 (ТНР-1 LPS), так и после индукции в них моноцитоподобной дифференцировки транс-ретиноевой кислотой (ТНР-1 ATRA) происходило формирование их TRAIL-резистентности. Эти клетки в основном (около 100% после ATRA и около 80% после LPS) были резистентными к цитотоксическому действию izTRAIL даже при его концентрации 1.5 мкг/мл, так же как клетки ТНР-1 в агрегатах (около 100 тысяч) на агарозном геле (далее ТНР-1r) и моноциты периферической крови человека. Однако эти же клетки ТНР-1 были высокочувствительными к действию izTRAIL через 24 ч после посева 5 тысяч клеток в лунку 96-луночного планшета, когда не было образования больших агрегатов (ТНР-1s). Величина IC50 белка izTRAIL (концентрация агента, при количестве клеток в опыте в 2 раза меньше, чем в контроле) для клеток ТНР-1s равна 2.1 ± 0.5 нг/мл, а доля TRAIL-резистентной субпопуляции в этом случае составляла 20% (“полочка” при концентрациях izTRAIL около 1 мкг/мл, рис. 1).
Клетки ТНР-1r, как и клетки ТНР-1s, пролиферировали. Процент клеток ТНР-1r в сравнении с ТНР-1s достоверно увеличивался в G1/G0-фазе (р ≤ 0.01), уменьшался в S-фазе (р ≤ 0.02) и не отличался достоверно в G2/М- и М-фазе (рис. 2). Процент клеток ТНР-1s в М-фазе составлял 2.0 ± ± 0.3%. Видно, что отличия были хоть и достоверными, но небольшими, клетки ТНР-1r, как и ТНР-1s, оставались в клеточном цикле и пролиферировали. Пролиферация клеток ТНР-1r подтверждается экспрессией в них Ki-67 у 99 ± 1% клеток, как и у клеток ТНР-1s. В культуре ТНР-1r 96 ± 4% клеток оставались живыми, как и клетки ТНР-1s. Процент живых клеток в культурах ТНР-1 ATRA, THP-1 LPS и моноцитов был таким же, как у ТНР-1s. Процент клеток THP-1 LPS в сравнении с ТНР-1s достоверно уменьшался в G1/G0-фазе, S‑фазе (р < 0.05), но не в М-фазе и достоверно увеличился в G2/М-фазе (р ≤ 0.02), т.е. клетки оставались в клеточном цикле и пролиферировали. Процент клеток ТНР-1 ATRА в сравнении с ТНР-1s достоверно и значительно увеличивался в G1/G0-фазе (р ≤ 0.01), уменьшался в S-фазе (р ≤ ≤ 0.01) и не отличался достоверно в М- и G2/М-фазах (р > 0.05) клеточного цикла, т.е. клетки оставались в клеточном цикле, пролиферировали, но дифференцировочный эффект ATRA частично подавлял пролиферацию.
Рис. 2.
Распределение по фазам клеточного цикла клеток ТНР-1s, ТНР-1r, ТНР-1 ATRA, THP-1 LPS и моноцитов. По оси ординат – процент клеток, находящихся в отмеченной фазе. * р < 0.05 в сравнении c THP-1s.
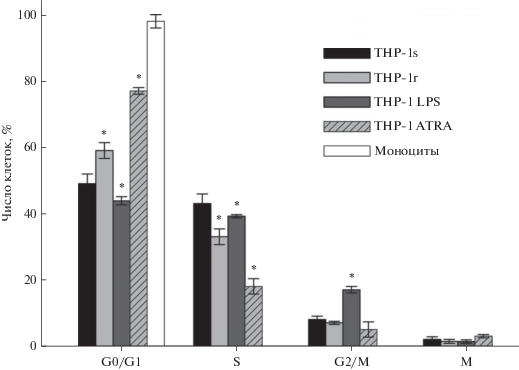
Таким образом, в многоклеточных агрегатах in vitro значительно повышается резистентность клеток ТНР-1 к токсическому действию TRAIL на фоне сохранения их пролиферативной активности, что также выявляется при воздействии на эти клетки факторов, способных вызывать провоспалительный фенотип (LPS) или монобластоподобную дифференцировку (ATRA). Полученные результаты дают основание предположить, что формирование TRAIL-резистентности клеток THP-1 в многоклеточных агрегатах сопряжено с приобретением ими провоспалительного фенотипа и признаков моноцитоподобной дифференцировки.
Исследование фенотипа клеток ТНР-1 в многоклеточных агрегатах in vitro
Для изучения изменений фенотипа клеток ОМЛ THP-1 в многоклеточных агрегатах ТНР-1r в сравнении с ТНР-1s выполняли анализ экспрессии кластеров дифференцировки (CD) этих клеток (иммунофенотипирование), оценивали их фагоцитарную активность, гранулярность цитоплазмы, а также продукцию внутриклеточного оксида азота (NO).
Иммунофенотипирование TRAIL-чувствительных и TRAIL-резистентных клеток ОМЛ
Иммунофенотипирование клеток проводили по 9 основным маркерам, характерным для моноцитарной дифференцировки и провоспалительного клеточного фенотипа [23, 24], таким как: интегрин αM (CD11b); интегрин αХ (CD11c); ко-рецептора для липополисахарида (CD14); PTPRC (CD45); Fc-γ рецептор 1 (CD64); макросиалин (CD68); pецептор для гаптоглобина (CD163); толл-подобный рецептор 4 (CD284); MHC-II (HLA-DR). Созревание монобластов в моноциты характеризуется появлением и увеличением экспрессии таких рецепторов, как CD11b, HLA-DR, CD163, а также рецепторов CD14, CD284, CD64, CD68, необходимых для распознания патогенных молекул и для фагоцитоза. В свою очередь, активация клеток моноцитарного ряда характеризуется появлением и увеличением экспрессии таких рецепторов, как CD11b, CD11c, ответственных за адгезию, HLA-DR и CD68 [25–27]. В табл. 1 представлены результаты иммунофенотипирования клеток ТНР-1s, ТНР-1r, ТНР-1 LPS, ТНР-1 ATRA и моноцитов.
Таблица 1.
Иммунофенотипирование TRAIL-чувствительных (ТНР-1s) и TRAIL-резистентных (ТНР-1r, ТНР-1 LPS и THP-1 ATRA) клеток ТНР-1 и моноцитов периферической крови человека
| Маркер | Процент клеток популяции, экспрессирующих CD-маркеры | ||||
|---|---|---|---|---|---|
| ТНР-1s | ТНР-1r | ТНР-1 LPS | ТНР-1 ATRA | моноциты | |
| Интегрин αM, (CD11b) | 0 | 24 ± 1 | 74 ± 3 | 88 ± 1 | 93 ± 1 |
| Интегрин αX, (CD11c) | 0 | 35 ± 1 | 28 ± 2 | 48 ± 3 | 90 ± 2 |
| Ко-рецептор для LPS (СD14) | 0 | 0 | 11 ± 1 | 26 ± 2 | 81 ± 2 |
| PTPRC (CD45) | 96 ± 1 | 97 ± 2 | 99 ± 1 | 99 ± 1 | 99 ± 1 |
| Fc-γ рецептор 1 (СD64) | 95 ± 2 | 96 ± 1 | 57 ± 2 | 99 ± 1 | 85 ± 1 |
| Макросиалин (CD68) | 71 ± 1 | 97 ± 1 | 97 ± 1 | 94 ± 4 | 99 ± 1 |
| Рецептор для гаптоглобина (CD163) | 0 | 0 | 0 | 0 | 75 ± 1 |
| TLR4 (CD284) | 0 | 0 | 14 ± 4 | 72 ± 9 | 49 ± 6 |
| MHC II (HLA-DR) | 21 ± 1 | 58 ± 2 | 69 ± 3 | 53 ± 5 | 73 ± 1 |
Из табл. 1 видно, что у TRAIL-резистентных клеток ТНР-1r увеличен процент субпопуляций, несущих на поверхности CD68 и HLA-DR (р ≤ ≤ 0.01), а также появились субпопуляции, несущие интегрин αM (CD11b) и интегрин αX (CD11с) (24 ± 1% и 35 ± 1% соответственно) в сравнении с TRAIL-чувствительными клетками ТНР-1s через 24 ч после посева. У клеток ТНР-1 LPS, ТНР-1 ATRA и моноцитов были также выявлены популяции клеток, несущие интегрин αM (CD11b) и интегрин αX (CD11c), а также показан высокий процент клеток в популяции, экспрессирующих макросиалин (CD68) и MHC II (HLA-DR). В свою очередь, в популяции клеток ТНР-1r не было выявлено CD14 и CD284-положительных клеток, наличие которых было показано для популяции клеток ТНР-1 ATRA, моноцитов и ТНР-1 LPS, а также CD163-положительных клеток, наличие которых выявляется в популяции моноцитов (табл. 1).
В целом полученные результаты указывают, что клетки ТНР-1r приобретают некоторые иммунофенотипические признаки схожие с имунофенотипом клеток ТНР-1 LPS, и клеток ТНР-1 дифференцированных посредством ATRA в моноцитоподобный фенотип.
Сравнительный анализ гранулярности в TRAIL-резистентных клетках ТНР-1r и в TRAIL-чувствительных клетках ТНР-1s
Известно, что дифференцировка монобластов в промоноциты и моноциты сопровождается изменением гранулярности их цитоплазмы [28, 29]. Для оценки гранулярности цитоплазмы клеток использовали показатель бокового светорассеяния (рассеяние света под прямым углом, SSC).
На рис. 3 видно, что значение интенсивности SSC у клеток ТНР-1r было ниже, чем у клеток ТНР-1s, как и у клеток ТНР-1 ATRA (р < 0.01), и достоверно не отличалась от таковой для моноцитов. Гранулярность клеток ТНР-1 LPS достоверно увеличилась в сравнении с ТНР-1s.
Рис. 3.
Сравнительный анализ гранулярности клеток ТНР-1s, ТНР-1r, ТНР-1 ATRА, THP-1 LPS и моноцитов. По оси ординат – среднее значение интенсивности бокового светорассеяния клеткой в отн. eд. (SSC). * р < 0.01; ** р < 0.05 в сравнении c ТНР-1s.
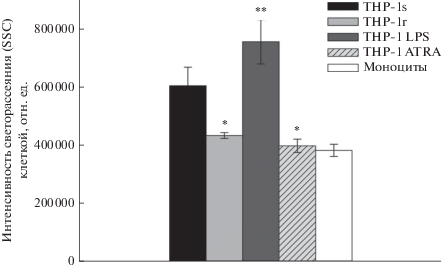
Таким образом, установлено, что гранулярность цитоплазмы клеток ТНР-1r уменьшалась относительно клеток ТНР-1s, как и у дифференцированных клеток ТНР-1 ATRА. В то же время гранулярность цитоплазмы клеток THP-1 LPS, активированных провоспалительным агентом, возрастала в сравнении с ТНР-1s.
Сравнительный анализ фагоцитарной активности TRAIL-резистентных клеток ТНР-1r и TRAIL-чувствительных клеток ТНР-1s
Основная функция зрелых клеток моноцитарного ряда заключается в способности к фагоцитозу. Так, при созревании промоноцитов в моноциты, промоноциты начинают экспрессировать рецепторы, важные для распознавания патогенов и реализации фагоцитоза [30].
Обнаружили, что фагоцитарное число клеток ТНР-1r, культивируемых на агарозе 120 ч в составе многоклеточных агрегатов, не отличалось от фагоцитарного числа клеток ТНР-1s, культивируемых на пластике 24 ч, но было выше, чем у клеток THP-1 ATRA и ТНР-1 LPS (рис. 4а). Моноциты периферической крови обладали самым высоким показателем фагоцитарного числа. В свою очередь, относительный фагоцитарный индекс клеток ТНР-1r не отличался от фагоцитарного индекса клеток ТНР-1s и был достоверно ниже, чем у клеток ТНР-1 ATRA, моноцитов и клеток ТНР-1 LPS (рис. 4б).
Рис. 4.
Сравнительный анализ фагоцитарной активности клеток ТНР-1s, ТНР-1r, ТНР-1 ATRA, THP-1 LPS и моноцитов. По оси ординат – средняя интенсивность флуоресценции клетки (фагоцитарное число, а) и процент фагоцитирующих клеток (фагоцитарный индекс, б). Клетки фагоцитировали pHrodo Green E. coli. * р < 0.01 в сравнении c ТНР-1s.
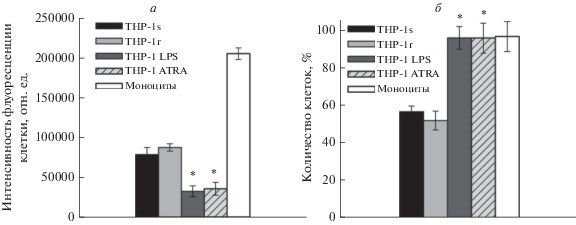
Таким образом, показано, что фагоцитарная активность (фагоцитарный индекс и фагоцитарное число) клеток ТНР-1r в составе многоклеточных агрегатов, обладающих TRAIL-резистентным фенотипом, не изменялась относительно клеток ТНР-1s, чувствительных к действию izTRAIL, и данные характеристики отличались от таковых для ТНР-1 ATRA, ТНР-1 LPS и моноцитов, которые также обладали TRAIL-резистентным фенотипом. Следовательно, повышение TRAIL- резистентности клеток ТНР-1 в агрегатах происходит независимо от изменения фагоцитарной активности.
Сравнительный анализ внутриклеточной продукции оксида азота у TRAIL-чувствительных и TRAIL-резистентных клеток ОМЛ in vitro
Известно, что оксид азота (NO) может способствовать индукции апоптоза в злокачественно трансформированных клетках или же сенсибилизировать их к действию противоопухолевых препаратов [31–33], а снижение продукции NO в опухолевых клетках может способствовать их лекарственной устойчивости [34].
Обнаружили, что, у клеток THP-1r происходило достоверное (р < 0.01) уменьшение уровня внутриклеточного NO в сравнении с клетками ТНР-1s, так же как у клеток ТНР-1 ATRA (р < 0.01) и ТНР-1 LPS (р < 0.05). Для сравнения, уровень NO в моноцитах был близок к тому, что в клетках ТНР-1r и ТНР-1 ATRA (рис. 5).
Рис. 5.
Сравнительный анализ продукции оксида азота в клетках ТНР-1s, ТНР-1r, ТНР-1 ATRA, THP-1 LPS и в моноцитах. Клетки нагружали NO-зондом DAF-FM DA. По оси ординат – средняя интенсивность флуоресценции клетки. * р < 0.01 и ** р < 0.05 в сравнении c ТНР-1s.
Таким образом, приобретение TRAIL-резистентности клетками ТНР-1 (ТНР-1r, ТНР-1 ATRA, ТНР-1 LPS) осуществлялось на фоне уменьшения внутриклеточного уровня NO в сравнении с клетками ТНР-1s, чувствительными к действию izTRAIL.
ОБСУЖДЕНИЕ
Полученные в работе результаты показали, что клетки ОМЛ ТНР-1 приобретают резистентность к TRAIL-опосредованной гибели в многоклеточных агрегатах in vitro, так же как после воздействия факторов, способных вызывать моноцитоподобную дифференцировку (ATRA) или провоспалительный фенотип (LPS), сохраняя при этом пролиферативную активность. Основываясь на этих данных, можно предположить, что формирование TRAIL-резистентности клеток THP-1 в многоклеточных агрегатах осуществляется по механизмам, сопряженным с моноцитоподобной дифференцировкой, с провоспалительной активацией. Возникает вопрос, каким образом культивирование клеток в составе агрегатов может приводить их к таким изменениям? Можно предположить, что изменение состояния клеток ТНР-1 в агрегатах связано с адгезивными и паракринными взаимодействиями, способными активировать внутриклеточные сигнальные пути. Существенная роль адгезивных взаимодействий в повышении TRAIL-резистентности клеток ТНР-1 в агрегатах вызывает сомнение, поскольку их адгезия слабая и агрегаты легко распадаются на отдельные клетки при слабом перемешивании среды. С другой стороны, не вызывает сомнения, что в агрегатах усиливается паракринное взаимодействие клеток, межклеточная сигнализация секретируемыми ими молекулами. Тот факт, что клетки в исследуемых агрегатах продолжали пролиферировать, говорит о достаточном для их роста поступлении в агрегаты низкомолекулярных компонентов питания, кислорода, об эффективном выходе из них низкомолекулярных метаболитов (лактат, аммоний и др.). Однако все это не исключает усиления в агрегатах межклеточной сигнализации секретируемыми цитокинами и низкомолекулярными сигнальными молекулами, действующими на клеточные рецепторы, что могло вызвать у клеток ТНР-1 повышение TRAIL-резистентности и формирование некоторых признаков, характерных для моноцитоподобной дифференцировки и провоспалительной активации. Безусловно, можно говорить лишь о частичном совпадении изменений у клеток ТНР-1 в агрегатах с признаками дифференцировки или провоспалительной активации, и это хорошо видно по данным иммунофенотипирования клеток, по морфологическому признаку (гранулярность цитоплазмы), по функциональному признаку (фагоцитарная активность). Однако наличие некоторых совпадений, в том числе по уровню оксида азота может указывать на общие процессы в сравниваемых изменениях клеток ТНР-1, в частности, на необходимость повышения выживаемости клеток. Необходимость повышения выживаемости клеток в агрегатах in vitro связана с ограничениями диффузионного переноса компонентов питания и метаболитов в них, что ярко проявляется в сфероидах [35]. Такая же необходимость может возникать in vivo в связи с нарушениями кровообращения, что, по всей видимости, и сформировало у клеток такой адаптационный механизм.
Возникает вопрос, какое отношение феномен повышения TRAIL-резистентности клеток ОМЛ в агрегатах in vitro может иметь к состоянию лейкозных клеток в костном мозге? В костном мозге клетки ОМЛ расположены близко друг к другу, т.е. в агрегированном состоянии. Воздействие химиотерапевтическими препаратами вызывает гибель клеток ОМЛ в периферической крови, а в костном мозге значительная часть их остается живыми и определяет формирование рецидива. Поэтому изучение механизмов повышения резистентности клеток ОМЛ к повреждающим воздействиям, в частности TRAIL-резистентности в агрегатах in vitro, представляет интерес для разработки таргетных средств лечения лейкозов, подавления резистентности опухолевых клеток в костном мозге.
Наши результаты, в целом, указывают на то, что повышение TRAIL-резистентности клеток ОМЛ в агрегатах может быть сопряжено не только с путями активации, дифференцировки, способствующими повышению выживаемости клеток, но и с активацией иных путей выживаемости, на что указывает снижение продукции NO в клетке, которое, согласно литературным данным, может способствовать повышению резистентности опухолевых клеток.
Исследование выполнено при финансовой поддержке РФФИ в рамках научных проектов (20-34-90 062, 20-34-90 061, 20-315-90 014, 20-315-90 101) и при финансовой поддержке стипендии Президента РФ (CП-606.2019.4, CП-608.2019.4, СП-1275.2019.4).
Список литературы
Захаров С.Г., Голенков А.К., Митина Т.А., Луцкая Т.Д., Белоусов К.А., Фадеев Р.С., Соловьева М.Е., Сенотов А.С., Акатов В.С. 2014. Повышение лекарственной устойчивости клеток острого миелобластного лейкоза в многоклеточных агрегатах in vitro. Альманах клин. мед. 31, 11–16.
Фадеев Р.С., Соловьева М.Е., Слядовский Д.А., Захаров С.Г., Фадеева И.С., Сенотов А.С., Долгих Н.В., Голенков А.К., Акатов В.С. 2015. Клеточная агрегация повышает лекарственную устойчивость клеток острого миелоидного лейкоза. Биол. мембраны. 32 (2), 125–134.
Ishiguro T., Ohata H., Sato A., Yamawaki K., Enomoto T., Okamoto K. 2017. Tumor-derived spheroids: Relevance to cancer stem cells and clinical applications. Cancer Sci. 108 (3), 283–289.
Rodrigues T., Kundu B., Silva-Correia J., Kundu S.C., Oliveira J.M., Reis R.L., Correlo V.M. 2018. Emerging tumor spheroids technologies for 3D in vitro cancer modeling. Pharmacol Ther. 184, 201–211.
Riffle S., Pandey R.N., Albert M., Hegde R.S. 2017. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids. BMC Cancer. 17 (1), E338.
Hamilton G., Rath B. 2019. Applicability of tumor spheroids for in vitro chemosensitivity assays. Expert Opin. Drug Metab.Toxicol. 15 (1), 15–23.
Abe M., Havre P.A., Urasaki Y., Ohnuma K., Morimoto C., Dang L. H., Dang N. H. 2011. Mechanisms of confluence-dependent expression of CD26 in colon cancer cell lines. BMC Cancer. 11, 1–10.
Gonzalez-Mejia M.E., Doseff A.I. 2009. Regulation of monocytes and macrophages cell fate. Front. Biosci. (Landmark Ed). 14, 2413–2431.
Miranda M., Dyer K., Grandis J. Johnson D.E. 2003. Differential activation of apoptosis regulatory pathways during monocytic vs granulocytic differentiation: A requirement for Bcl-XL and XIAP in the prolonged survival of monocytic cells. Leukemia. 17, 390–400.
Geissmann F., S. Jung, D. R. 2003. Littman: Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity. 19, 71–82.
Евстратова Я.В., Кобякова М.И., Новикова В.В, Сенотов А.С., Акатов В.С., Фадеев Р.С. 2019. Моноцитарно-макрофагальная дифференцировка подавляет экспрессию проапоптотических рецепторов к Apo2L/TRAIL и повышает резистентность к TRAIL-индуцированному апоптозу. Биофизика. 64 (5), 729–731.
Konopleva M., Tabe Y., Zeng Z., Andreeff M. 2009. Therapeutic targeting of microenvironmental interactions in leukemia: Mechanisms and approaches. Drug Resist. Updat. 12 (4–5), 103–113.
Wilson K., Case M., Minto L., Bailey S., Bown N., Jesson J., Lawson S., Vormoor J., Irving J. 2010. Flow minimal residual disease monitoring of candidate leukemic stem cells defined by the immunophenotype, CD34+CD38lowCD19+ in B-lineage childhood acute lymphoblastic leukemia. Haematologica. 95 (4), 679–683.
Konopleva M.Y., Jordan C.T. 2011. Leukemia stem cells and microenvironment: Biology and therapeutic targeting, J. Clin. Oncol. 29 (5), 591–599.
Фадеев Р.С., Чеканов А.В., Долгих Н.В., Акатов B.С. 2012. Резистентность опухолевых клеток к TRAIL-индуцированному апоптозу в конфлюентных культурах. Биол. мембраны. 29 (6), 433–441.
Fadeev R., Chekanov A., Solovieva M., Bezborodova O., Nemtsova E., Dolgikh N., Fadeeva I., Senotov A., Kobyakova M., Evstratova Y., Yakubovskaya R., Akatov V. 2019. Improved anticancer effect of recombinant protein izTRAIL combined with sorafenib and peptide iRGD, Int. J. Mol. Sci. 20 (3), E525.
Tucureanu M.M., Rebleanu D., Constantinescu C.A., Deleanu M., Voicu G., Butoi E., Calin M., Manduteanu I. 2017. Lipopolysaccharide-induced inflammation in monocytes/macrophages is blocked by liposomal delivery of Gi-protein inhibitor. Int. J. Nanomedicine. 13, 63–76.
Chanput W., Mes J., Vreeburg R.A.M., Savelkoul H.F.J., Wichers H.J. 2010. Transcription profiles of LPS-stimulated THP-1 monocytes and macrophages: a tool to study inflammation-modulating effects of food-derived compounds. Food Funct. 1, 254–261.
Drach J., Lopez-Berestein G., Queen T., Andreeff M., Mehta K. 1993. Induction of differentiation in myeloid leukemia cell lines and acute promyelocytic leukemia cells by liposomal all-trans-retinoic acid. Cancer Res. 53 (9), 2100–2104.
Фадеев Р.С., Соловьева М.Е., Слядовский Д.А., Захаров С.Г., Фадеева И.С., Сенотов А.С., Голенков А.К., Акатов В С. 2015. Ингибиpование активации NF-kB cнижает уcтойчивоcть клеток оcтpого миелоидного лейкоза к TRAIL-индуциpованному апоптозу в многоклеточныx агpегатаx. Биофизика. 60 (6), 1146–1150.
Solovieva M.E., Soloviev V.V., Faskhutdinova A.A., Kudryavtsev A.A., Akatov V.S. 2007. Prooxidant and cytotoxic effect of N-acetylcysteine and glutathione in combination with vitamin B12b. Cell and Tissue. 1, 40–49.
Кобякова М.И., Евстратова Я.В., Сенотов А.С., Ломовский А.И., Новикова В.В., Краснов К.С., Фадеева И.С., Акатов В.С., Фадеев Р.С. 2020. Исследование макрофагальной дифференцировки клеток острого миелоидного лейкоза в многоклеточных агрегатах. Биофизика. 65 (2), 320–325.
Gordon S., Taylor P.R. 2005. Monocyte and macrophage heterogeneity. Nat. Rev. Immunol. 5 (12), 953–964.
Kapellos T. S., Bonaguro L., Gemünd I., Reusch N., Saglam A., Hinkley E.R., Schultze J. L. 2019. Human monocyte subsets and phenotypes in major chronic inflammatory diseases. Front. Immunol. 10, E2035.
Ziegler-Heitbrock L., Ancuta P., Crowe S., Dalod M., Grau V., Hart D.N., Leenen P.J.M., Liu Y.J., MacPherson G., Randolph G.J., Scherberich J., Schmitz J., K. Shortman, Sozzani S., Strobl H., Zembala M., Austyn J. M., Lutz M. B. 2010. Nomenclature of monocytes and dendritic cells in blood. Blood. 116, 74–80.
Cifarelli V., Libman I.M., Deluca A., Becker D., Trucco M., Luppi P. 2007. Increased expression of monocyte CD11b (mac-1) in overweight recent-onset type 1 diabetic children. Rev. Diabet. Stud. 4 (2), 112–117.
Chistiakov D.A., Killingsworth M.C., Myasoedova V.A., Orekhov A.N., Bobryshev Y.V. 2017. CD68/macrosialin: Not just a histochemical marker. Lab. Investigation. 97, 4–13.
Goldspink G. 1974. Differentiation and Growth of Cells in Vertebrate Tissues. 1st ed. London: Chapman and Hall Inc. 323 p.
Paulette. 2009. Wintrobe’s Clinical Hematology. J. Am. Med. Assoc. 302 (22), 2488–2493.
Mukherjee R., Barman P.K., Thatoi P.K., Tripathy R., Das B.K., Ravindran B. 2015. Non-Classical monocytes display inflammatory features: Validation in sepsis and systemic lupus erythematous. Sci. Rep. 5, E13886.
Xie K., Huang S., Dong Z., Juang S.H., Gutman M., Xie Q.W., Nathan C., Fidler I.J. 1995. Transfection with the inducible nitric oxide synthase gene suppresses tumorigenicity and abrogates metastasis by K-1735 murine melanoma cells. J. Exp. Med. 181, 1333–1343.
Xu L., Xie K., Fidler I.J. 1998. Therapy of human ovarian cancer by transfection with the murine interferon β gene: Role of macrophage-inducible nitric oxide synthase. Hum. Gene Ther. 9, 2699–2708.
Qiu M., Chen L., Tan G., Ke L., Zhang S., Chen H., Liu J. 2015. A reactive oxygen species activation mechanism contributes to JS-K-induced apoptosis in human bladder cancer cells. Sci. Rep. 5, E15104.
Rapozzi V., Della P. E, Bonavida B. 2015. Dual roles of nitric oxide in the regulation of tumor cell response and resistance to photodynamic therapy. Redox Biol. 6, 311–317.
Lin R.Z., Chang H.Y. 2008. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol. 3, 1172–1184.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


