Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 3, стр. 187-198
Индукционные изменения флуоресценции клеток Chara, связанные с обменом метаболитов между хлоропластами и потоком цитоплазмы
А. А. Булычев *
Московский государственный университет им. М.В. Ломоносова,
биологический факультет
119991 Москва, Россия
* E-mail: bulychev@biophys.msu.ru
Поступила в редакцию 26.01.2021
После доработки 02.02.2021
Принята к публикации 03.02.2021
Аннотация
Индукционные изменения флуоресценции (Фл) хлорофилла в растениях связаны с фотосинтетическим переносом электронов, генерацией градиента протонов и образованием углеводов в цикле фиксации СО2. Реакции фотосинтеза сопровождаются также выведением фотопродуктов из освещенных хлоропластов и их переносом на дальние расстояния. Обмен метаболитов через оболочку хлоропластов осуществляют переносчики, которые активны на свету и теряют активность в темноте. Инактивация светозависимых транспортеров оболочки прерывает дальнюю передачу сигналов в клетках харовой водоросли, выявляемую по изменениям Фл в ответ на освещение удаленного участка клетки. Показано, что темновая адаптация нарушает поступление метаболитов из потока цитоплазмы в затененные хлоропласты, но оказывает сравнительно слабое влияние на экспорт метаболитов из освещенных пластид. Установлено, что индукционные кривые Фл существенно различаются при освещении или затемнении препарата за пределами фотометрируемой области. Амплитуда медленных изменений Фл при низкоинтенсивном освещении всего междоузлия Chara была значительно больше, чем при узкопольном освещении зоны измерения Фл. Результаты говорят о том, что медленное нарастание Фл в индукционный период в клетках харовых водорослей определяется не только фотосинтетической активностью исследуемого участка, но и взаимодействиями между анализируемой областью и соседними частями клетки. При остановке движения цитоплазмы под действием цитохалазина D локальное и общее освещение вызывали примерно равные индукционные изменения Фл, что говорит о разобщении дальних взаимодействий. Результаты показывают, что поток жидкости не только переносит метаболиты от освещенных к затененным частям клетки, но и облегчает экспорт фотометаболитов из хлоропластов в цитоплазму.
ВВЕДЕНИЕ
Индукционные кривые флуоресценции (Фл) хлорофилла (Хл) у фотосинтезирующих объектов (O-J-I-P-S-M-T переходы) обычно рассматривают в связи с переносом электронов, образованием электрохимического градиента протонов на тилакоидных мембранах и активностью цикла фиксации СО2 [1, 2]. Кроме того, фотосинтез включает перенос субстратов и метаболитов через мембраны оболочки хлоропластов, а также дальний транспорт ассимилятов, однако сведения о влиянии этих процессов на Фл Хл единичны [3–5]. В листьях растений быстрые стадии индукционной кривой Фл (O-J-I-P-S) малочувствительны к трансмембранному обмену метаболитов и их латеральному перемещению, поскольку оболочка пластид и межклеточные барьеры затрудняют эти процессы. Вместе с тем обмен метаболитов и их дальний перенос могут сказываться на параметрах Фл при длительном освещении (S-M-T переходы). Эти переходы развиваются в течение минут после начала освещения и регулируются как редокс состоянием хинонного акцептора QA, так и процессами нефотохимического тушения, которые включают изменения баланса энергии возбуждения, поглощаемой фотосистемами I и II [2]. В основе S-M-T переходов у высших растений, водорослей и цианобактерий, по-видимому, лежат разные процессы, которые остаются недостаточно охарактеризованными.
Стадия возрастания флуоресценции S-M у цианобактерий и водорослей Chlamydomonas в интервале от нескольких секунд до 100 с обусловлена переходами фотосинтетического аппарата из состояния 2 в состояние 1, при котором преимущественное возбуждение фотосистемы I сменяется преобладающим возбуждением фотосистемы II (ослабление тушения qT), а последующее снижение M-T в диапазоне до 1000 с отражает усиление нефотохимического тушения [6–8]. В зеленых растениях переходы S-M-T в значительной степени определяются изменениями фотохимического тушения [2].
Особый интерес в плане изучения природы медленных стадий индукционных кривых Фл представляют изолированные гигантские (размером 5–10 см) междоузлия харовых водорослей, в которых отсутствуют межклеточные барьеры, а дальние коммуникации облегчены благодаря интенсивному (со скоростью до 100 мкм с–1) круговому течению цитоплазмы. Активность хлоропластов у этих водорослей при неравномерном ступенчатом освещении может зависеть от таких процессов, как экспорт фотопродуктов в цитоплазму, их удаление из прилегающих к органеллам слоев и извлечение метаболитов из цитоплазмы в строму после их доставки от соседних частей клетки.
О наличии дальних взаимодействий и латерального переноса фотометаболитов между хлоропластами можно судить по флуоресценции Хл на ограниченных участках препарата при варьировании световых условий за пределами анализируемой площади. Например, квантовая эффективность фотосистемы II на микроучастках междоузлия Chara была существенно выше при локальном освещении анализируемой зоны, чем при общем освещении всей клетки светом той же интенсивности и того же спектрального состава [9, 10]. При этом величина нефотохимического тушения (NPQ) была ниже при освещении объекта узким световым лучом, чем при широкопольном освещении. Эти различия объясняли большей доступностью субстрата (СО2) при отсутствии существенной конкуренции между хлоропластами в узкой зоне освещения и облегченным удалением продуктов метаболизма. Дальний перенос метаболитов в междоузлиях Chara лежит в основе изменений фактического и максимального выхода Фл (F ' и $F_{{\text{m}}}^{'}$, соответственно) при освещении участков клетки, расположенных вдали (на расстояниях до 6–10 мм) от зоны измерения [11–13]. При отсутствии дальних взаимодействий параметры Фл Хл на измеряемом участке не зависят от условий освещения окружающих областей [5, 14]. Сравнение индукционных кривых Фл Хл при локальном и общем освещении представляет еще один способ оценки роли дальнего транспорта в регуляции фотосинтеза [15].
Участие потока цитоплазмы в дальних взаимодействиях можно выявить с помощью ингибиторов актина, которые замедляют и полностью останавливают течение цитоплазмы без нарушения механизма фотосинтеза [16]. В клетках Characeae тяжи актина прикреплены к внутренней поверхности одиночного слоя неподвижных хлоропластов, расположенных в периферическом слое цитоплазмы [17]. На границе между хлоропластами и эндоплазмой скорость течения достигает наибольших значений [18]. Тесный контакт хлоропластов с наиболее быстрыми струями потока обеспечивает распространение веществ из освещенных областей в затененные участки в условиях неравномерного освещения. Другим, не менее важным фактором является быстрый обмен метаболитов между стромой пластид и цитоплазмой. Такой трансмембранный обмен осуществляют светозависимые транслокаторы оболочки, главными из которых являются “малатный клапан” и переносчик триозофосфатов [19–21]. Оба переносчика отвечают за выведение избытка NADPH из стромы, поскольку при линейном потоке электронов образование NADPH превышает потребности, лимитируемые синтезом АТР. Эти транслокаторы активны на свету и постепенно (за время от десятков секунд до нескольких минут) теряют активность после перехода к темноте [22, 23]. Используя различные варианты инкубации объекта на свету и в темноте, можно оценить роль светозависимых транспортеров оболочки в дальней передаче метаболического сигнала.
Дистанционная передача восстановленных соединений (NAD(P)H, триозофосфаты) включает стадию их экспорта в зоне образования, латеральный перенос вдоль неподвижного слоя хлоропластов, поступление метаболитов из цитоплазмы в строму затененных пластид и последующие биохимические и физико-химические реакции, приводящие к восстановлению пластохинона и возрастанию флуоресценции Хл [24, 25]. В этой цепи событий транслокаторы оболочки осуществляют как экспорт метаболитов в цитоплазму (на начальном этапе), так и их перенос в обратном направлении (на конечных участках). В настоящее время отсутствуют сведения о том, совпадают или различаются стадии экспорта и импорта метаболитов по чувствительности к действию света. Для ответа на этот вопрос важно использовать локальное подведение лучей к начальному и терминальному участку цепи передачи сигнала.
В данной работе показано, что индукционные кривые Фл в клетках харовых водорослей включают медленные (в минутном диапазоне) стадии, которые чувствительны к транспорту фотометаболитов через мембраны оболочки хлоропластов и к распространению метаболитов с потоком цитоплазмы. Установлено, что выведение фотопродуктов из хлоропластов начинается сравнительно быстро после включения света, тогда как для их поступления из цитоплазмы в строму пластид необходимо длительное (>40 c) фоновое освещение. Результаты указывают на то, что стадии медленного нарастания и последующего спада (S-M-T переходы) в индукционной кривой Фл интернодальных клеток Chara сопровождаются изменениями состава цитоплазмы в связи с обменом метаболитов через мембраны оболочки хлоропластов.
МАТЕРИАЛЫ И МЕТОДЫ
Культуру Chara australis, полученную из лаборатории профессора Ilse Foissner (Salzburg University), выращивали в стеклянных сосудах при рассеянном комнатном освещении. Изолированные междоузлия главной оси (диаметр ~0.9 мм, длина 3–6 см) и боковых побегов (диаметр 0.6–0.7 мм, длина 1–1.5 см) помещали в искусственную прудовую воду, содержащую 0.1 мМ KCl, 1.0 мМ. NaCl и 0.1 мМ CaCl2. В среду добавляли NaHCO3 до рН 7.
Опыты проводили при температуре 19–23°С. Скорость течения цитоплазмы измеряли с помощью секундомера, наблюдая в микроскоп за движением отдельных частиц. Время пробега фиксированного расстояния (950 мкм) определяли последовательно для пяти частиц и находили среднее значение скорости движения. В зависимости от температуры скорость варьировала на разных клетках от 65 до 100 мкм с–1 при стандартной ошибке среднего ≤1.5 мкм с–1.
Выход флуоресценции Хл измеряли на микроучастках клеток (диаметр ~ 100 мкм) с помощью инвертированного микроскопа Axiovert-25 CFL (Zeiss, Германия) в сочетании со специализированным флуориметром Microscopy-PAM (Walz, Effeltrich, Германия). Установка для измерений описана ранее [15, 25]. Слабый модулированный измерительный свет от синего светодиода флуориметра Microscopy-PAM проходил по оптическому пути микроскопа и возбуждал Фл Хл (F '), которую регистрировали при низкоинтенсивном фоновом освещении. Сигнал от фотоумножителя обрабатывали в программе WinControl-3 (Walz), оцифровывали с интервалом ~51 мс аналого-цифровым преобразователем PCI-6024E (National Instruments, США) и записывали на компьютер.
В начале опытов интернодальную клетку выдерживали при общем фоновом освещении (ОФО). Свет от верхнего осветителя микроскопа проходил через стеклянный фильтр (СЗС-22, λ < 580 нм) и нейтральный стеклянный фильтр, который ослаблял плотность потока фотонов до ~10 мкмоль м–2 с–1. Низкая интенсивность ОФО достаточна для поддержания активности светозависимых ферментов и дальней передачи сигнала, но исключает образование энергозависимого нефотохимического тушения.
Способность клеток к дальней передаче метаболического сигнала и поступление фотометаболитов в хлоропласты-акцепторы оценивали по изменениям F ' в области измерения флуоресценции (ОИФ) после воздействия локального светового импульса (ЛСИ) на участок, отстоящий от ОИФ вверх по течению цитоплазмы на 1.5–3 мм (рис. 1). После лаг-периода, достаточного для опосредованной циклозом доставки метаболитов в ОИФ, наблюдали переходное возрастание F '. Для подведения ЛСИ использовали кварцевое оптоволокно (диаметр 400 мкм) и контролируемый компьютером светодиодный источник белого света (плотность потока фотонов ~500 мкмоль м–2 с–1).
Рис. 1.
Схема приложения локального светового импульса (ЛСИ) относительно зоны локального фонового освещения (ЛФО) и области измерения флуоресценции. Луч от оптоволокна направлен в горизонтальной плоскости, а локальное фоновое освещение – вертикально. Стрелкой показано направление течения цитоплазмы параллельно рядам неподвижных хлоропластов в плоскости измерения флуоресценции.
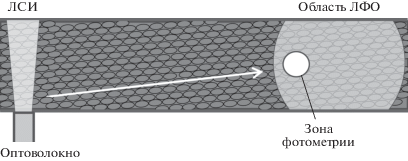
Локальное фоновое освещение (ЛФО) области измерения F ' и окрестных участков осуществляли с помощью гибкого многоволоконного световода длиной 10 см и диаметром оптического пучка 2 мм [15]. Один конец оптического кабеля проходил через светозащитный экран; на него падал свет от верхнего осветителя микроскопа. Другой конец кабеля был направлен на клетку сверху. Положение торца оптического кабеля относительно ОИФ в горизонтальной плоскости и по вертикальной оси регулировали с помощью микроманипулятора при наблюдении в микроскоп. Интенсивности лучей, падающих на исследуемую область клетки при двух конфигурациях освещения, – ЛФО и ОФО – отличались незначительно, о чем говорят близкие измеряемые значения F ' для этих экспериментальных условий.
На рис. 1 схематично показаны область подведения локального светового импульса, область измерения флуоресценции, зона воздействия ЛФО, а также направление течения цитоплазмы. Индукционные изменения флуоресценции измеряли после предварительной адаптации клетки к темноте (Т) в течение 5 мин. В различных вариантах опытов записывали индукционные изменения F ' при следующих изменениях световых условий: Т → ОФО, Т → ЛФО, а также ЛФО → ОФО.
На рисунках представлены усредненные кинетические кривые изменений F ', полученные при 3–6-кратном воспроизведении в репрезентативных опытах на отдельных клетках. В каждой серии опытов использовали не менее четырех клеток. Количество измерений (n) указано в подписях к рисункам. Отклонения от средних значений обозначают стандартные ошибки измерений.
РЕЗУЛЬТАТЫ
Лимитирующая светозависимая стадия в дальней передаче сигнала
На рис. 2 показаны изменения флуоресценции Хл, вызываемые приложением локального светового импульса к отдаленному участку клетки, в зависимости от предварительных световых условий. Кривая 1 отражает стандартную ответную реакцию F ' в условиях стационарной фоновой подсветки всей клетки. Переходное возрастание F ' обусловлено доставкой в строму восстановителей, распространяемых с потоком цитоплазмы [11]. Поступление в строму NADPH и триозофосфатов замедляет отток электронов из электрон-транспортной цепи фотосинтеза и вызывает помимо этого нефотохимическое восстановление пластохинона [25]. Оба фактора приводят к восстановлению хинонного акцептора QA и к временному возрастанию флуоресценции F '.
Рис. 2.
Изменения флуоресценции F ' в ответ на локальное приложение 30 -с импульса белого света (ЛСИ; 500 мкмоль м–2 с–1) на расстоянии 1.5 мм от зоны измерения F ' при разной предыстории освещения междоузлия. 1 – Стандартная ответная реакция F ' при стационарном фоновом освещении всей клетки (12.5 мкмоль квантов м–2 с–1); штриховые линии отмечают начало и конец ЛСИ. 2 – Отсутствие ответной реакции F ' на ЛСИ при общем фоновом освещении (ОФО) после 5-мин инкубации в темноте; регистрация F ' включена через 40 с после начала ОФО; пик F ' при t ≈ 150 c от начала записи (t ≈ 190 c от момента включения ОФО) отражает задержанный индукционный переход S-M-T, вызванный ОФО. 3 – Ответная реакция F ' на удаленное локальное освещение после 5 мин затемнения всей клетки, за исключением области измерения F ', которая оставалась на фоновом свету; начало регистрации F ' совмещено с моментом помещения клетки на фоновый свет; вторая волна изменений F ' отражает индукционный переход, вызванный общим освещением. Представлены усредненные записи для n = 6, полученные в типичном опыте на одной клетке.
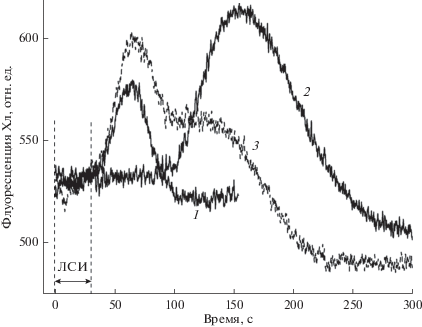
Как видно из записи 2, дистанционная передача сигнала между хлоропластами временно исчезает после предварительного выдерживания всей клетки в темноте в течение 5 мин. Об этом говорит отсутствие пика F ' в интервале времени до 100 с. Хотя клетка находилась на фоновом свету в течение 40 с от момента завершения темновой адаптации до приложения локального светового импульса, ответная реакция F ' на ЛСИ полностью отсутствовала. Изменения F ', развивающиеся в более поздний период и достигающие пика при t ≈ 150 c от начала записи (t ≈ 190 c от момента возобновления фонового освещения), отражают задержанную стадию индукционной кривой, вызванную общим освещением. Начало этой стадии совпадает с восстановлением дальней передачи сигналов. Долгая задержка S-M-T изменений F ' связана с низкой интенсивностью фонового света (12.5 мкмоль квантов м–2 с–1). Точно такой же индукционный переход можно наблюдать при включении фонового освещения без воздействия ЛСИ. Эти опыты говорят о том, что дальняя сигнализация нарушается при темновой инактивации ферментов, входящих в транспортеры оболочки. Однако из этих данных нельзя решить, нарушается ли экспорт метаболитов в зоне яркого освещения или же их поступление из цитозоля в строму в слабо освещенных участках клетки. Для ответа на этот вопрос применяли комбинированную предобработку, помещая в темноту всю клетку, за исключением небольшого участка в области измерения F '. На область измерения F ' и окрестные участки направляли узкий луч (локальное фоновое освещение), который по интенсивности и спектральному составу не отличался от общего фонового освещения.
Из записи 3 видно, что после темновой инкубации всей клетки, за исключением области измерения F ', одновременное включение локального светового импульса и общего фонового освещения вызывало ответную реакцию с двумя пиками F '. Первый пик представлял собой реакцию на ЛСИ, а второй – реакцию на ОФО. В отличие от опыта, представленного записью 2, в котором локальный импульс не вызывал сдвигов F ' даже после 40 с экспозиции всей клетки на фоновом свету, в записи 3 ответная реакция F ' возникала даже при одновременном включении локального импульса и ОФО. Амплитуда ответной реакции на ЛСИ после предобработки, поддерживающей активность светозависимых ферментов в зоне измерения, зачастую была больше, чем в контрольных условиях при стационарном ОФО. Результаты показывают, что экспорт фотометаболитов из хлоропластов-доноров при переходе темнота–свет начинается намного раньше, чем их поступление в хлоропласты-акцепторы. Длительность латентного периода на конечных участках сигнальной цепи при экспозиции хлоропластов на фоновом свету составляла не менее 40–50 с.
Латентный период фотоактивации импорта метаболитов
Различия в лаг-периодах выведения фотометаболитов из хлоропластов-доноров и их поступления в хлоропласты-акцепторы могут потенциально определяться высокой интенсивностью ЛСИ и, соответственно, низкой интенсивностью фонового освещения в зонах расположения этих органелл. В связи с этим были проведены опыты без приложения ЛСИ, в которых измеряли индукционные изменения Фл после переноса адаптированной к темноте клетки на слабый фоновый свет. Перед каждой записью хлоропласты-акцепторы переводили в состояние либо с неактивными транспортерами оболочки (после выдерживания всей клетки в темноте в течение 5 мин), либо в активное состояние (выдерживание в темноте всей клетки, за исключением области измерения Фл, которая оставалась экспонированной локально на фоновом свету). Соответствующие условия опыта обозначали для краткости Т → ОФО (переход от темноты к общему фоновому освещению) и ЛФО → ОФО (переход от локального фонового освещения зоны измерения флуоресценции к общему фоновому освещению).
На рис. 3а показаны изменения Фл Хл, вызванные переходом от темноты к ОФО после двух вариантов предварительной обработки. В первом случае (кривая 1) все междоузлие было преадаптировано к темноте в течение 5 мин. Во втором случае (кривая 2) в темноту помещали всю клетку, за исключением зоны измерения Фл, которая оставалась в зоне ЛФО. Предполагали, что первый вариант предобработки инактивировал светозависимые ферменты, ассоциированные с транслокаторами оболочки, а второй поддерживал светозависимые системы в области измерения Фл в активном функциональном состоянии.
Рис. 3.
Медленные индукционные изменения флуоресценции при неактивном и активном функциональном состоянии светозависимых ферментов в области измерения. а – Индукционные кривые флуоресценции при переходах: 1 – от темноты к общему фоновому освещению (Т → ОФО); 2 – от локального фонового освещения зоны измерения к общему фоновому освещению (ЛФО → ОФО). Момент времени t = 0 соответствует включению ОФО. Представлены усредненные кривые и стандартные ошибки для n = 4. б – Индукционные изменения Фл при локальном освещении области измерения фоновым светом (переход Т → ЛФО), n = 3.
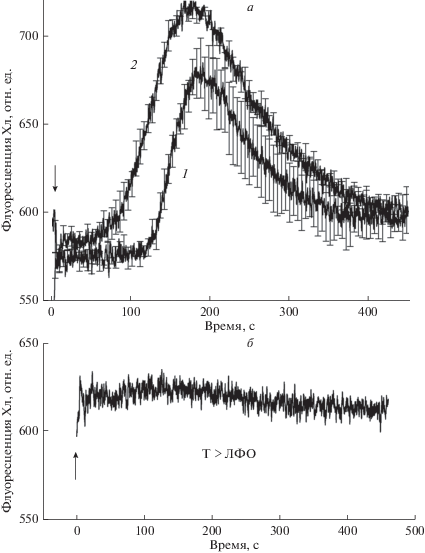
Индукционная кривая 1 на рис. 3а получена при переходе Т → ОФО; она аналогична кривой 2 на рис. 2, за исключением того, что в данных опытах отсутствовало удаленное воздействие локального импульса света. При помещении клетки на слабый фоновый свет наблюдали пик F ' при t ~ 200 c. Кривая 2 на рис. 3а, наблюдаемая при переходе ЛФО → → ОФО, имеет аналогичную форму, что может показаться неожиданным, поскольку анализируемая область при таком переходе оставалась на свету того же спектрального состава и неизменной интенсивности. Это означает, что основная часть изменений F ' при переходе ЛФО → ОФО обусловлена влиянием метаболитов, продуцируемых за пределами зоны измерения. Как видно из рис. 3б, локальное фоновое освещение области измерения после предварительной адаптации к темноте всего междоузлия (переход Т → ЛФО) вызывало лишь незначительные сдвиги флуоресценции Хл в исследуемом диапазоне.
Сходная форма кривых 1 и 2 (рис. 3а) и незначительный сдвиг Фл при локальном освещении фотометрируемого участка (рис. 3б) указывают на то, что переходные изменения F ' хлоропластов-акцепторов в области измерения Фл вызваны влиянием фотопродуктов, доставляемых с потоком жидкости от хлоропластов-доноров после перехода от темноты к общему фоновому освещению.
Пик на индукционной кривой F ' в предварительно освещенных хлоропластах (кривая 2) достигался раньше, чем в неактивных, адаптированных к темноте хлоропластах (кривая 1). Более короткий латентный период на кривой 2 и сдвиг (~50 с) между фронтами нарастания F ' на кривых 1 и 2, вероятно, обусловлены разным функциональным состоянием светозависимых переносчиков в зоне наблюдения после темновой адаптации и предварительного освещения. В случае, когда светозависимые транспортеры оболочки были активны (кривая 2), они обеспечивали быструю доставку восстановителей из потока цитоплазмы в строму пластид. Если же транслокаторы оболочки были исходно неактивны вследствие темновой адаптации, то доставка восстановителей из потока цитоплазмы начиналась позднее, после периода фотоактивации транспорта.
Слабые изменения F ' при локальном освещении области измерения флуоресценции (рис. 3б) указывают на то, что восстановительные эквиваленты не накапливаются в хлоропластах в данных условиях опыта. Их эффективное удаление из стромы обусловлено двумя факторами. С одной стороны, экспорт метаболитов не требует долгой световой экспозиции (см. описание в тексте к рис. 2), а с другой – поток цитоплазмы быстро удаляет выводимые продукты из окружения хлоропластов. Данные, представленные на рис. 3, указывают на участие светозависимых транспортеров оболочки и микрофлуидных потоков в развитии медленных изменений флуоресценции (S-M-T переходы) у харовой водоросли.
Изменения индукционной кривой флуоресценции при остановке циклоза
На рис. 4 показаны изменения Фл Хл на микроучастках междоузлия Chara, вызванные световыми воздействиями двух типов. Одно из них (кривые 1) состояло в локальном приложении 30‑секундного импульса белого света на расстоянии 1.5 мм от области измерения флуоресценции в условиях постоянного фонового освещения всей клетки. Это воздействие позволяло визуализировать передачу сигналов от хлоропластов-доноров к хлоропластам-акцепторам, находящимся на слабом фоновом свету. В параллельных опытах всю клетку освещали слабым фоновым светом после предварительной 5-минутной адаптации междоузлия к темноте и наблюдали медленные (S-M-T) индукционные изменения Фл (кривые 2). Измерения обоих типов выполняли в контрольных условиях при активном течении цитоплазмы (а), после остановки потока под действием цитохалазина D (б) и после восстановления потока, спустя 1 ч после начала отмывания клетки от цитохалазина D (в).
Рис. 4.
Цитохалазин D прерывает дальнюю передачу сигнала между пространственно удаленными хлоропластами (1) и ускоряет S-M-T переход на индукционной кривой флуоресценции (2). Кривые 1 представляют изменения F ' на слабом фоновом свету в ответ на приложение локального импульса белого света (30 с, 500 мкмоль м–2 с–1) на расстоянии 1.5 мм от зоны измерения F '; кривые 2 изображают индукционные изменения F ', вызванные переносом клетки на фоновый свет после 5 мин темновой адаптации. а – Контроль в отсутствие ингибиторов; б – при остановке течения цитоплазмы в присутствии 25 мкМ цитохалазина D; в – после восстановления циклоза в той же клетке, отмытой от ингибитора. Усредненные кинетические кривые рассчитаны для n = 3–5.
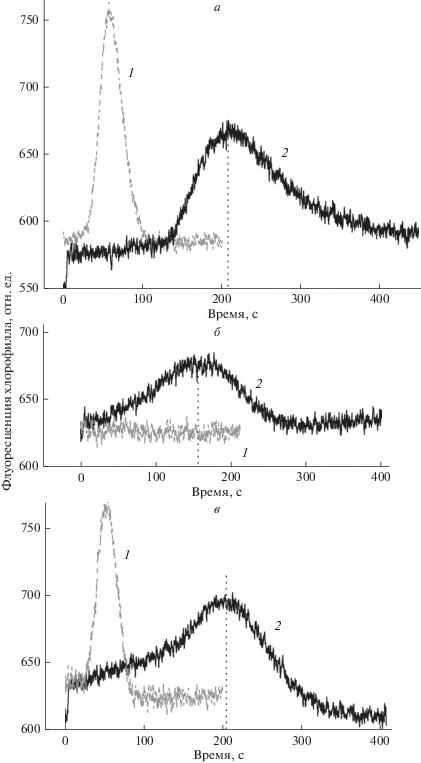
Скорость течения цитоплазмы в нативной клетке составляла 92 мкм с–1. Как видно из рис. 4а (кривая 1), приложение локального светового импульса в момент времени t = 0 вызывало переходное увеличение F ' при постоянных световых условиях в области измерения. Эти переходные изменения F ' отражают передачу метаболического сигнала и его доставку к рецепторным хлоропластам. Добавление цитохалазина D в концентрации 25 мкМ приводило в течение 5 мин к остановке течения цитоплазмы и устраняло переходные изменения F ', вызванные локальным импульсом света (рис. 4б, кривая 1). Действие цитохалазина D обратимо снималось после промывания клетки свежей средой.
Кривые 2 на рис. 4 изображают изменения Фл Хл, вызванные общим фоновым освещением адаптированного к темноте междоузлия в отсутствие и в присутствии цитохалазина D. В необработанной клетке задержанная волна F ' появлялась после периода задержки ~ 130 с, достигала пика при t ≥ 200 с и затем снижалась до исходного уровня F '. При остановленном течении цитоплазмы в присутствии цитохалазина D задержанная волна F ', индуцированная слабым фоновым освещением, развивалась после более короткого периода задержки; пик F ' и возврат к исходному уровню достигались раньше, чем в необработанной клетке. Амплитуда волны F ' была, как правило, меньше, чем в контроле.
После отмывания клетки искусственной прудовой водой в течение ≥1 ч латеральная передача метаболитов восстанавливалась (рис. 4в, кривая 1). Скорость течения возрастала до исходного значения 92 мкм с–1, а пик волны F ', вызванной слабым фоновым освещением всей клетки, смещался к исходной позиции (при t ≈ 210 с). Обратимое действие цитохалазина D на сигналы F ' двух типов говорит о том, что задержанный пик Фл Хл в период индукции фотосинтеза чувствителен к латеральной передаче фотометаболитов. При быстром течении цитоплазмы в интактной клетке поток постоянно омывает хлоропласты, что ускоряет удаление восстановительных эквивалентов из стромы пластид и замедляет развитие пика флуоресценции F '. Прекращение оттока метаболитов с поверхности пластид после остановки течения цитоплазмы замедляет экспорт восстановительных эквивалентов из хлоропластов, способствуя более быстрому накоплению восстановителей в строме за счет внутренних процессов, что отражается в ускоренном подъеме F ' в индукционный период.
Влияние локального и общего освещения на F ' при остановке циклоза
Остановка движения цитоплазмы кардинально меняла ответную реакцию F ' на локальное освещение анализируемой области (переход Т → ЛФО). Как видно из рис. 5а (кривая 1) и как показано также на рис. 3б, переход Т → ЛФО вызывал слабые изменения F ' при активном течении цитоплазмы. Вместе с тем после остановки циклоза такое же локальное освещение вызывало переходное возрастание F ' (рис. 5а, кривая 2). По-видимому, остановка течения затрудняет отток восстановительных эквивалентов из освещенных хлоропластов, приводя к их накоплению в строме и восстановлению пластохинона и хинонного акцептора QA.
Рис. 5.
Медленные индукционные изменения флуоресценции клеток Chara, вызванные локальным и общим освещением до и после остановки течения цитоплазмы под действием 25 мкМ цитохалазина D (CD). а – Индукционные изменения F ' при локальном освещении анализируемого участка после 5-мин темновой адаптации в контрольных условиях и при подавлении циклоза цитохалазином D. 1 – при переходе от темноты к локальному фоновому освещению (Т → ЛФО) в условиях быстрого течения цитоплазмы (90 мкм с–1, контроль); 2 – то же после прекращения потока в присутствии цитохалазина D. б – Изменения F ' в клетках с неподвижной цитоплазмой (в присутствии 25 мкМ цитохалазина D) при переходе от темноты к общему фоновому освещению (Т → ОФО) и при переходе от локального фонового освещения области регистрации F ' к общему освещению (ЛФО → ОФО). Усредненные кинетические кривые рассчитаны для n = 2–6.
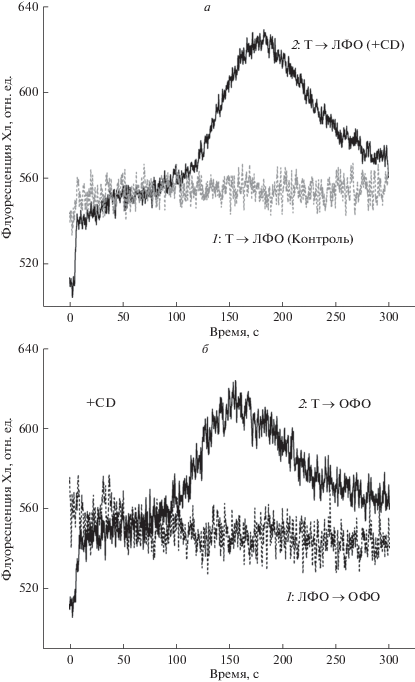
На рис. 5б показаны изменения F ', вызываемые в отсутствие циклоза при смене локального освещения анализируемого участка на общее фоновое освещение (ЛФО → ОФО, кривая 1), а также при общем освещении клетки (переход Т → ОФО, кривая 2). Из сравнения кривых 2 на рис. 5а и 5б видно, что при отсутствии движения цитоплазмы локальное и общее освещение вызывают примерно равные ответные реакции F ' с положением пика при t ≈ 160–170 c. В условиях подавления циклоза переход от локального к общему фоновому освещению (ЛФО → ОФО) не оказывал влияния на F ' (рис. 5б, кривая 1) в отличие от сильной ответной реакции F ' на аналогичное воздействие при нормальном течении цитоплазмы (рис. 3а, кривая 2). Полученные результаты существенно дополняют представления о роли движения цитоплазмы в изменениях Фл Хл при локальном и общем освещении клетки.
ОБСУЖДЕНИЕ
В индукционной кривой флуоресценции зеленых растений и водорослей выделяют быстрые и медленные стадии, причем о природе задержанного нарастания флуоресценции (S-M) известно гораздо меньше, чем о мультифазном нарастании O-J-I-P [2]. У харовых водорослей наблюдаемый пик F ' обусловлен ослаблением фотохимического тушения qP [8], а используемая низкая интенсивность света исключает развитие существенного нефотохимического тушения. Эти особенности говорят о том, что индукционные изменения Фл в минутном диапазоне у харовых водорослей возникают иначе, чем в цианобактериях и у Chlamydomonas [6–8]. Результаты данной работы показывают, что нарастание флуоресценции S-M у харовых водорослей происходит при участии дальних взаимодействий, опосредованных течением цитоплазмы. Об участии дальнего транспорта говорят сильные отличия индукционных кривых F ' при освещении клеток междоузлий узким лучом и широким световым потоком (ср. рис. 3а и 3б). Дальние взаимодействия включают перенос фотометаболитов через мембраны оболочки хлоропластов при участии активируемых светом транспортеров (рис. 3) и латеральный перенос этих метаболитов с потоком цитоплазмы (рис. 4, 5а).
Полученные результаты показывают, что переходное возрастание выхода флуоресценции F ' в минутном интервале при низкоинтенсивном освещении связано с дальним переносом фотометаболитов (восстановительные эквиваленты, триозофосфаты). Перенос метаболитов из ярко освещенной области в зону слабой фоновой подсветки проявляется в переходном возрастании F ' в связи с поступлением восстановителей в строму, которое стимулирует фотохимическое и нефотохимическое восстановление хинонного акцептора QA [25]. В случае, когда размер донорной области ограничен диаметром оптоволокна (400 мкм в данной работе), ответные изменения F ' проявляются в виде узкой полосы (рис. 4, кривые 1). В случае общего освещения клетки размер донорной области расширяется; поэтому ответная реакция F ' проявляется в виде широкой и, как правило, асимметричной полосы (рис. 3а). Форма индукционной кривой F ' должна зависеть от динамики обмена метаболитами между хлоропластами и цитозолем в период после включения света, а также от размера освещаемой площади и от расстояния, на которое перемещаются вещества в потоке цитоплазмы. Следует отметить, что латеральный перенос можно индуцировать не только интенсивным лучом, но и светом низкой интенсивности [11].
При подавлении латерального переноса веществ цитохалазином D индукционные изменения S-M-T претерпевали изменения, но не исчезали (рис. 4). В этих условиях переходы от темноты к общему и локальному фоновому освещению (Т → ОФО и Т → ЛФО) вызывали примерно равные ответные реакции F ' (рис. 5), тогда как при быстром течении цитоплазмы ответные реакции на эти воздействия существенно различались (рис. 3). Эти и другие полученные в работе данные говорят о том, что после остановки циклоза индукционные изменения S-M-T зависят от динамики содержания восстановителей (NADPH) в строме, определяемой только внутренними процессами в хлоропластах, и не включают стадии дальнего транспорта и поглощения фотометаболитов из цитоплазмы. В отличие от этого, нормальное течение цитоплазмы обеспечивает свободный отток метаболитов, препятствуя накоплению избытка NADPH в строме, что проявляется в слабых изменениях F ' при локальном освещении области измерения (рис. 3б). Можно предполагать, что в нормальных условиях переход S-M в минутном интервале в значительной степени зависит от содержания восстановителей в текущей цитоплазме.
Результаты работы выявили, что экспорт метаболитов из освещенных хлоропластов начинается сравнительно быстро, тогда как поступление фотометаболитов из цитоплазмы в строму пластид развивается лишь после долгого (~50 с) латентного периода. Представляется вероятным, что оба процесса – экспорт и импорт метаболитов – опосредованы общими транслокаторами оболочки, а различное время задержки определяется величиной и направлением градиента редокс-агентов или других участников цикла переноса. Высокое содержание NADPH в строме освещенных хлоропластов и низкое содержание восстановительных эквивалентов в цитозоле [26, 27] могут способствовать более раннему началу экспорта метаболитов. По данным [27], содержание NADPH в строме хлоропластов арабидопсиса достигает максимального уровня в течение 120–150 с освещения. Примерно такое же время характерно для достижения пика флуоресценции F ' при нарушении цитохалазином D экспорта и оттока редокс-метаболитов из освещенных хлоропластов (рис. 5). Эти данные косвенно подтверждают предположение о том, что переход S-M флуоресценции при нарушении дальних внутриклеточных связей обусловлен изменением редокс-статуса стромы. В клетках с быстрым движением цитоплазмы редокс-состояние стромы хлоропластов в значительной степени контролируется обменом метаболитов между цитозолем и стромой. Таким образом, остановка течения цитоплазмы нарушает не только стадию латерального переноса метаболитов, но и стадию экспорта метаболитов из локально освещаемых хлоропластов.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 20-54-12015).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Papageorgiou G.C., Govindjee. 2014. The non-photochemical quenching of the electronically excited state of chlorophyll a in plants: Definitions, timelines, viewpoints, open questions. In: Non-photochemical quenching and energy dissipation in plants, algae and cyanobacteria. Eds Demmig-Adams B., Garab G., Adams III W., Govindjee. Dordrecht: Springer, p. 531–550.
Stirbet A., Riznichenko G.Y., Rubin A.B., Govindjee. 2014. Modeling chlorophyll a fluorescence transient: Relation to photosynthesis, Biochemistry (Moscow). 79, 291–323.
Siebke K., Weis E. 1995. Imaging of chlorophyll-a-fluorescence in leaves: Topography of photosynthetic oscillations in leaves of Glechoma hederacea. Photosynth. Res. 45, 225–237.
Pieruschka R., Schurr U., Jensen M., Wolff W.F., Jahnke S. 2006. Lateral diffusion of CO2 from shaded to illuminated leaf parts affects photosynthesis inside homobaric leaves. New Phytol. 169, 779–788.
Pieruschka R., Chavarría-Krauser A., Schurr U., Jahnke S. 2010. Photosynthesis in lightfleck areas of homobaric and heterobaric leaves, J. Exp. Bot. 61, 1031–1039.
Kaňa R., Kotabová E., Komárek O., Šedivá B., Papageorgiou G.C., Govindjee, Prášil O. 2012. The slow S to M fluorescence rise in cyanobacteria is due to a state 2 to state 1 transition. Biochim. Biophys. Acta. 1817, 1237–1247.
Kodru S., Malavath T., Devadasu E., Nellaepalli S., Stirbet A., Subramanyam R., Govindjee. 2015. The slow S to M rise of chlorophyll a fluorescence reflects transition from state 2 to state 1 in the green alga Chlamydomonas reinhardtii. Photosynth. Res. 125, 219–231
Bernát G., Steinbach G., Kaňa R., Govindjee, Misra A.N., Prašil O. 2018. On the origin of the slow M–T chlorophyll a fluorescence decline in cyanobacteria: Interplay of short-term light-responses. Photosynth. Res. 136, 183–198.
Bulychev A., Vredenberg W. 2003. Spatio-temporal patterns of photosystem II activity and plasma-membrane proton flows in Chara corallina cells exposed to overall and local illumination. Planta. 218, 143–151.
Bulychev A.A., Dodonova S.O. 2011. Effects of cyclosis on chloroplast-cytoplasm interactions revealed with localized lighting in characean cells at rest and after electrical excitation. Biochim. Biophys. Acta. 1807, 1221–1230.
Bulychev A.A., Komarova A.V. 2015. Photoinduction of cyclosis-mediated interactions between distant chloroplasts. Biochim. Biophys. Acta. 1847, 379–389.
Komarova A.V., Sukhov V.S., Bulychev A.A. 2018. Cyclosis-mediated long distance communications of chloroplasts in giant cells of Characeae. Funct. Plant Biol. 45, 236–246.
Bulychev A.A., Foissner I. 2020. Inhibition of endosomal trafficking by brefeldin A interferes with long-distance interaction between chloroplasts and plasma membrane transporters. Physiol. Plant. 169, 122–134.
Tseng Y.C., Chu S.W. 2017. High spatio-temporal-resolution detection of chlorophyll fluorescence dynamics from a single chloroplast with confocal imaging fluorometer. Plant Methods. 13, 1–11.
Bulychev A.A. 2020. Transient depletion of transported metabolites in the streaming cytoplasm of Chara upon shading the long-distance transmission pathway. Biochim. Biophys. Acta. 1861, 148257.
Bulychev A.A., Foissner I. 2017. Pathways for external alkalinization in intact and in microwounded Chara cells are differentially sensitive to wortmannin. Plant Signal. Behav. 12, e1362518.
Foissner I., Wasteneys G.O. 2012. The characean internodal cell as a model system for studying wound healing. J. Microsc. 247, 10–22.
Goldstein R.E., Van de Meent J.W. 2015. A physical perspective on cytoplasmic streaming. Interface Focus. 5, 20150030.
Scheibe R. 2004. Malate valves to balance cellular energy supply. Physiol. Plant. 120, 21–26.
Taniguchi M., Miyake H. 2012. Redox-shuttling between chloroplast and cytosol: Integration of intra-chloroplast and extra-chloroplast metabolism. Curr. Opin. Plant Biol. 15, 252–260.
Selinski J., Scheibe R. 2019. Malate valves: Old shuttles with new perspectives. Plant Biol. 21, 21–30.
Vaseghi M.J., Chibani K., Telman W., Liebthal M.F., Gerken M., Schnitzer H., Mueller S.M., Dietz K.J. 2018. The chloroplast 2-cysteine peroxiredoxin functions as thioredoxin oxidase in redox regulation of chloroplast metabolism. Elife. 7, e38194.
Howard T.P., Metodiev M., Lloyd J.C., Raines C.A. 2008. Thioredoxin-mediated reversible dissociation of a stromal multiprotein complex in response to changes in light availability. Proc. Natl. Acad. Sci. USA. 105, 4056–4061.
Bulychev A.A., Komarova A.V. 2017. Photoregulation of photosystem II activity mediated by cytoplasmic streaming in Chara and its relation to pH bands. Biochim. Biophys. Acta. 1858, 386–395.
Bulychev A.A., Rybina A.A. 2018. Long-range interactions of Chara chloroplasts are sensitive to plasma-membrane H+ flows and comprise separate photo- and dark-operated pathways. Protoplasma. 255, 1621–1634.
Heineke D., Riens B., Grosse H., Hoferichter P., Peter U., Flügge U.I., Heldt H.W. 1991. Redox transfer across the inner chloroplast envelope membrane. Plant Physiol. 95, 1131–1137.
Lim S.L., Voon C.P., Guan X., Yang Y., Gardeström P., Lim B.L. 2020. In planta study of photosynthesis and photorespiration using NADPH and NADH/NAD+ fluorescent protein sensors. Nat. Commun. 11, 3238.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


