Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 3, стр. 199-208
Роль экстраклеточного Са2+ в регуляции распределения и конформации гемоглобина в эритроцитах
О. В. Слатинская a, Н. А. Браже a, С. Н. Орлов a, Г. В. Максимов a, b, *
a Московский государственный университет им. М.В. Ломоносова, биологический факультет
119892 Москва, Россия
b Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Россия
* E-mail: gmaksimov@mail.ru
Поступила в редакцию 18.11.2020
После доработки 11.01.2021
Принята к публикации 13.01.2021
Аннотация
Установлено, что снижение концентрации экстраклеточного Ca2+ ([Ca2+]out) увеличивает поверхностный заряд мембраны эритроцита, что сопровождается изменением конформации гема и глобина, а также перераспределением гемоглобина в клетке (снижение величины оптической разности хода луча (ОРХ) цитоплазмы и содержания примембранного гемоглобина). Установлено, что при варьировании [Ca2+]out с 10–3 до 10–6 М морфология эритроцита практически не меняется, ζ-потенциал возрастает с –15.4 ± 0.2 до –14.5 ± 0.3 мВ (при [Ca2+]out от 10–3 до 5 × 10–4 М), а величина ОРХ цитоплазмы клетки снижается. Уменьшение [Ca2+]out до 10–6 М меняет конформацию гема, а также распределение гемоглобина в эритроците: происходит снижение симметричных колебаний боковых СН-групп пиррольных полуколец и увеличение валентных колебаний винильных групп гемопорфирина и сродство гема к лигандам. При этом не меняется вероятность нахождения гема в плоской конформации, но снижается жесткость его белкового окружения. При варьировании [Ca2+]out с 10–3 до 10–4 М наблюдается изменение конформации глобина: снижение упорядоченности СН-групп аминокислот глобина, увеличение плотности упаковки глобина, а также полярности окружения глобина. При инкубации эритроцитов в среде, содержащей [Ca2+]out = 10–6 М, максимальная величина интенсивности комбинационного рассеяния (КР) гемоглобина эритроцитов (полосы КР-спектра 1375 см–1 и 1580 см–1) выявлена в центре клетки и в 2.6 раза меньше, чем у эритроцитов, инкубированных в среде, содержащей [Ca2+]out = 10–3 М.
ВВЕДЕНИЕ
Известно, что для плазматической мембраны эритроцита характерно наличие фиксированных поверхностных зарядов молекул липидов и белков, формирующих поверхностный потенциал и характер распределения ионов и молекул воды [1]. В основном поверхностный потенциал эритроцита обусловлен зарядом карбоксильных групп N-ацетилнейраминовой кислоты сфинголипида и ионизируемых групп гликофорина и снижается при воздействии на клетку нейраминидазы. С помощью спектроскопии комбинационного рассеяния (КР) установлено, что при варьировании экстраклеточного рН от 4.82 до 9.70 меняется константа диссоциации комплекса мономер/димер гемоглобина (Гб) в клетке. Предполагается, что при нейтральном экстраклеточном рН, молекулы Гб локализованы в примембранном пространстве клетки или связаны с мембраной, в то время как при низком pH значительная часть Гб локализована в центральной области клетки [2].
Известно, что изменение поверхностного заряда цитоплазматической мембраны эритроцита связано с ОН-группами тирозина ряда белков мембраны, например, белка полосы 3 (БП3) [3]. Изменение поверхностного потенциала на цитоплазматической стороне мембраны сопровождается активацией внутриклеточных фосфолипаз, что меняет упорядоченность жирнокислотных хвостов мембранных липидов, снижая долю примембранного Гб [4–6]. Важную роль в регуляции изменений заряда на цитоплазматической поверхности мембраны эритроцита выполняет внутриклеточный Са2+ ([Са2+]in). Например, повышение [Ca2+]in активирует Ca2+-зависимые K+-каналы и приводит к гиперполяризации мембраны [7]. Отметим, что из всех ионов цитоплазмы клетки (Ca2+, Mg2+, K+, Na+ и Cl–) только Ca2+ специфически связывается с клеточными белками, поскольку K+, Na+ и моновалентные анионы формируют слабые комплексы с протеинами вследствие большого радиуса и небольшого заряда.
В настоящее время активно обсуждается вопрос о роли структурных изменений цитоплазмы эритроцита (“краудинг”) в регуляции объема и гемодинамики эритроцитов в сосудах [8–13]. Известно, что морфология эритроцита зависит от Ca2+-зависимых изменений молекул спектрина и актина цитоскелета, формирующих комплекс с мембраной эритроцита. Так, α- и β-цепи тримеров спектрина способны к самопроизвольной агрегации в тетрамеры и формированию комплексов c актином, которые связываются c белком полосы 4.1 и гликофоpином с БП3 плазматической мембраны. Спектрин связывается с помощью анкиpина, контролируя таким образом как долю примембранного Гб (Гбпм), так и механические свойства мембраны эритроцита [14, 15]. Отметим, что N-конец молекулы БП3 содержит анионные центры для формирования комплексов с глицеpальдегид-6-фоcфатдегидpогеназой, альдолазой, каталазой Гбпм [15–18].
Возможно, что [Ca2+]out-зависимые изменения поверхностного заряда на внутренней поверхности мембраны эритроцита регулируют формирование комплекса БП3 и Гб и эффективность переноса кислорода, которое обусловлено деполяризацией мембраны [19]. Предполагается, что при изменении [Ca2+]out происходит формирование кластеров отрицательно заряженных остатков сиаловых кислот на поверхности мембраны эритроцита, что увеличивает количество свободных ОН-групп тирозина БП3 [3, 20].
В связи с этим цель работы заключалась в исследовании изменения морфологии, поверхностного потенциала, а также распределения и конформации гема и глобина Гб в эритроцитах при варьировании экстраклеточного Са2+.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили отмытые от форменных элементов крови эритроциты, выделенные из крови здоровых доноров (n = 10, возраст 20–40 лет). Кровь отбирали из кубитальной вены в вакуумные пробирки (Vacuette, РФ) и хранили при 4°С в течение 3 ч после забора крови. В качестве антикоагулянта использовали гепарин (20–50 ед/мл крови). Выделение эритроцитов проводили центрифугированием крови при 1500 g в течение 5 мин при 4°C (Laborfuge 400R, Thermo Scientific, США). Полученный супернатант отделяли, а осадок отмывали в физиологическом растворе Аллена, содержащем 145 мМ NaCl, 5 мМ KCl, 4 мM Na2HPO4, 1 мM NaH2PO4, 1 мМ MgSO4, 5 мМ глюкозы с добавлением СаСl2 10–6, 10–5, 10–4, 5 × 10–4 или 10–3 М (Sigma, США), рН 7.4. Выделенную суспензию эритроцитов (Ht = 40%) хранили при 4°С и использовали в эксперименте в течение 3 ч после выделения.
Выделение Гб из суспензии эритроцитов проводили следующим образом: к суспензии эритроцитов добавляли фосфатный буфер (4 мМ Na2HPO4, 1 мМ NaH2PO4, 1 мкМ СаСl2, рН 7.4) в десятикратном объеме, после чего суспензию тщательно перемешивали и центрифугировали при 6000 g в течение 10 мин при температуре 4°С. Супернатант отделяли и хранили при 4°С. Образец использовали в течение 3 ч после выделения.
Исследование конформации гема и глобина гемоглобина проводили методом спектроскопии комбинационного рассеяния. Сигнал КР цитоплазматического Гб регистрировали с помощью конфокального микроскоп-спектрометра NTEGRA-SPECTRA (NT-MDT, РФ) в диапазоне 1000–3000 см–1, с шагом измерения 0.8 см–1, регистратор – ССD-детектор с Пельтье-охлаждением до –50°C (объектив 5× с апертурой 0.15, решетка 600 штр/мм), мощность лазера на образце составила 3 мВт, длина волны возбуждения 532 нм, время регистрации одного спектра – 15 с. Измерения проводили при комнатной температуре. Для регистрации спектров КР Гб и суспензии эритроцитов образец помещали в гематокритный капилляр (Агат-Мед, РФ) и регистрировали по три спектра в разных точках капилляра. Количество повторов измерений каждой тестируемой концентрации Ca2+ – не менее 12.
Распределение амплитуды КР в клетке проводили с одиночных клеток, размещенных на покровном стекле, при помощи конфокального микроскопа-спектрометра NTEGRA-SPECTRA (NT-MDT, РФ) в диапазоне 1000–3000 см–1, с шагом измерения 0.8 см–1 (объектив 20× с апертурой 0.45, решетка 600 штр/мм), длина волны возбуждения 532 нм, время получения одного изображения – 10 мин. Количество измеренных клеток – 12. Спектры КР обрабатывали в программе Origin2017 (OriginLab Corporation, США). Обработка сигнала включала в себя вычитание базовой линии и сглаживание спектров.
Для анализа изменений конформации гема и глобина молекулы гемоглобина использовали величины соотношений интенсивностей полос спектра КР [21–24]:
I1172/I1375 – групповые колебания связей полуколец пиррола в гемопорфирине, зависит от белкового окружения глобина возле гемопорфирина (характеризует выраженность симметричных и ассиметричных колебаний пиррольных полуколец);
I1580/I1375 – вклад симметричных колебаний пиррольных колец к валентным колебаниям связей винильных групп, характеризует способность гемоглобина выделять лиганды (в том числе O2);
I1640/I1375 – вклад колебаний метиновых мостиков к симметричным колебаниям пиррольных колец, характеризует конформационные изменения гема;
I2850/I2880 – вклад симметричных колебаний по отношению к несимметричным колебаниям метиленовых групп аминокислот, характеризующий плотность упаковки белка;
I2930/I2850 – вклад колебаний симметричных концевых метиновых групп к симметричным колебаниям метиленовых групп аминокислот, характеризующий изменение полярности окружения аминокислот глобина;
I2880/I2930 – вклад колебаний водородных связей метиленовых групп аминокислот глобина, характеризующий конформационную подвижностью белка. При увеличении параметра увеличивается упорядоченность аминокислот и плотность упаковки аминокислот.
КР-спектроскопия в поляризованном свете. Для выявления изменений упорядоченности молекулярных колебаний связей гема и глобина КР регистрировали в условиях с различными положениями плоскости поляризации лазера относительно образца [25, 26]. Для этого образцы размещали на покровном стекле и регистрировали сигнал от одиночных эритроцитов (для СЭ) или от раствора Гб. Регистрацию спектров КР в поляризованном свете проводили на КР-спектрометре WITec alpha 300 (Zeiss, Германия) в диапазоне 200–3100 см–1 с шагом измерения 0.3 см–1 (объектив 20× с апертурой 0.45, решетка 1800 штр/мм), мощность лазера на образце – 7мВт, длина волны возбуждения 532 нм, время регистрации сигнала – 5 с. Поляризацию осуществляли с помощью установки поляризатора (ThorLabs, США) под углом поляризации 0 и 90 градусов в специальное отверстие. Измерения проводили при комнатной температуре. Количество повторов измерений каждой тестируемой концентрации Сa2+ – не менее 12.
Регистрация изменений ζ-потенциала. Для регистрации изменений ζ-потенциала плазматической мембраны эритроцита суспензию эритроцитов (Нt = 40%) разводили в 1000 раз в буфере Аллена с соответствующей концентрацией Са2+. Эксперимент проводили в термостатируемой кювете с золотыми электродами (Malvern, РФ) при 25°С, время адаптации образца к температуре – 100 с, количество измерений 100). Количество повторов измерений каждой тестируемой концентрации Сa2+ – не менее 12. Обработку результатов ζ-потенциала проводили с помощью программного обеспечения Malvern и MS Excel.
Изменения морфологии эритроцита и оптической разности хода (ОРХ) луча света цитоплазмы эритроцита регистрировали методом лазерной интерференционной микроскопии (ЛИМ). После 10-минутной инкубации суспензии эритроцитов (5 мкл) в 1 мл буфера с тестируемой концентрацией Ca2+ добавляли 20 мкл 25% глутарового альдегида и инкубировали в течение 60 мин при 25°C [27]. Далее пробы центрифугировали (при 5000 g в течение 3 мин), к осадку добавляли 2 мл дистиллированной воды, ресуспендировали (Vortex, BioSan, Латвия) и повторяли процедуру. Суспензию фиксированных эритроцитов наносили на предметное стекло с зеркальным покрытием и регистрировали топографию распределения величины ОРХ цитоплазмы клетки с помощью лазерного интерференционного микроскопа (ЛИМ, ВНИИОФИ, РФ) на базе микроинтерферометра Линника МИИ-4 (ЛОМО, РФ) с объективом 30× (NA = 0.65), с мощностью лазера на объекте менее 2 мВт (λ = 650 нм). Размер регистрируемого кадра составлял 195 × 145 мкм. Для анализа полученных изображений использовали ПЗС видеокамеру VS-415U (NPK Videoscan, РФ) с размером матрицы 6.5 × 4.83 мм и разрешением 782 × 582 точек. Общее время регистрации составляло 10 с. Количество измеренных клеток – не менее 180. Для восстановления фазового изображения использовали программу WinPhast (ВНИИОФИ, РФ), а для реконструкции изображений – программы FIJI (ImageJ, США) и Origin2017 (Microcal Inc., OriginLab Corporation, США) [28, 29]. Реконструкция позволяла анализировать изменения величины ОРХ цитоплазмы эритроцита (средняя фазовая высота эритроцита) и площади клетки [30–33].
Для оценки статистической значимости результатов использовали t-критерий. Результаты считали достоверно различающимися при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе исследовали изменения морфологии, состояние цитоплазмы эритроцита (ОРХ) и конформации внутриклеточного гемоглобина при варьировании экстраклеточного Ca2+ ([Са2+]out.). Установлено, что при снижении [Са2+]out с 10–3 до 10–6 М морфология эритроцита практически не меняется, но уменьшается величина ОРХ цитоплазмы эритроцита (рис. 1а, 1б, табл. 1). Исследуя характер распределения величины интенсивности КР гемоглобина в эритроците (рис. 1в, полосы КР-спектра 1375 и 1580 см–1), установлено, что при инкубации эритроцитов в среде с 10–6 М [Ca2+]out величина интенсивности КР гемоглобина эритроцитов в 2.6 раза ниже, чем у эритроцитов, инкубированных в среде с 10–3 М [Са2+]out, а максимальная величина интенсивности сигнала выявлена в области ближе к краю клетки при 10–3 М [Са2+]out и в центре клетки при с 10–6 М [Са2+]out. Итак, при уменьшении [Са2+]out, форма эритроцита практически не меняется, но наблюдается изменение локализации сигнала КР гемоглобина в клетке, что, вероятно, свидетельствует о перераспределении Гб в цитоплазме и десорбции мембраносвязанного Гб. Отметим, что при старении эритроцита также выявлено перераспределение Гб в цитоплазме: увеличение доли примембранного Гб и снижение поверхностного заряда мембраны [34]. В связи с этим исследовали изменения величины ζ-потенциала мембраны и конформации гема и глобина эритроцита при варьировании [Са2+]out. Установлено, что при уменьшении [Са2+]out с 10–3 до 10–6 М ζ-потенциал возрастает с –15.4 ± 0.2 до –14.5 ± 0.3 мВ и при более низких концентрациях не меняется (рис. 2а). Отметим, что изменения величин ζ-потенциала эритроцитов согласуются с данными литературы [35, 36].
Рис. 1.
2D-распределение и фазовый профиль величины ОРХ эритроцитов при 10–6 М [Ca2+]out (a) и 10–3 М [Ca2+]out (б). На фотографии представлено изображение эритроцита, полученное методом ЛИМ. По оси абсцисс отложена длина скан-линии. Данные представлены как величина фазового профиля, усредненная по 180 клеткам (черная линия) ± SE (SE – стандартная ошибка, серая линия). в – соотношение интенсивностей полос КР-спектра в эритроците при концентрациях при 10–6 и 10–3 М [Са2+]out. На фотографии указан срез, по которому проводили расчеты соотношений. Столбцы соответствуют величине скан-линии с шагом 0.625 нм.
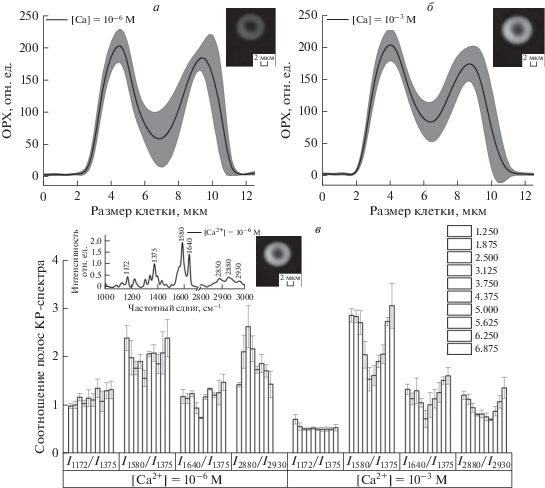
Таблица 1.
Изменения площади клетки (Sср) и распределения Гб (ОРХ) в эритроците при изменении [Са2+]out
| [Ca2+], M | Sср, мкм2 | ОРХ, нм | ОРХ/S | ОРХцентр/ОРХкрай |
|---|---|---|---|---|
| 10–6 | 45.50 ± 0.46 | 131.56 ± 0.65 | 2.92 ± 0.05 | 0.038 ± 0.016 |
| 10–5 | 44.52 ± 0.96 | 134.44 ± 0.57 | 3.30 ± 0.05 | 0.072 ± 0.027 |
| 10–4 | 44.62 ± 0.47 | 133.86 ± 0.69 | 3.12 ± 0.07 | 0.025 ± 0.026 |
| 10–3 | 44.86 ± 0.60 | 138.06 ± 0.80 | 3.13 ± 0.06 | 0.012 ± 0.007 |
Рис. 2.
а – Изменение величины ζ-потенциала мембраны эритроцита при изменении [Са2+]out; б – спектры КР эритроцитов (нормированные на полосу 1280 см–1) в области, характеризующей колебания в геме (1000–1700 см–1) и глобине (2800–3000 см–1).
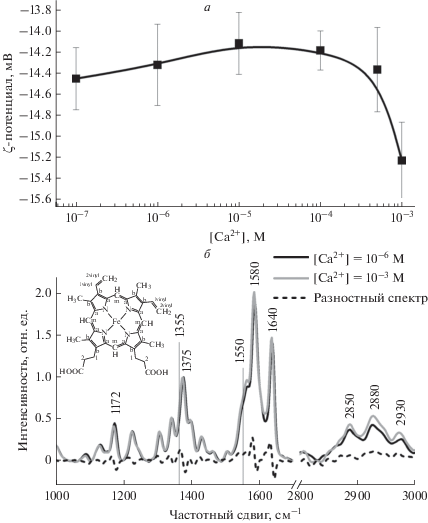
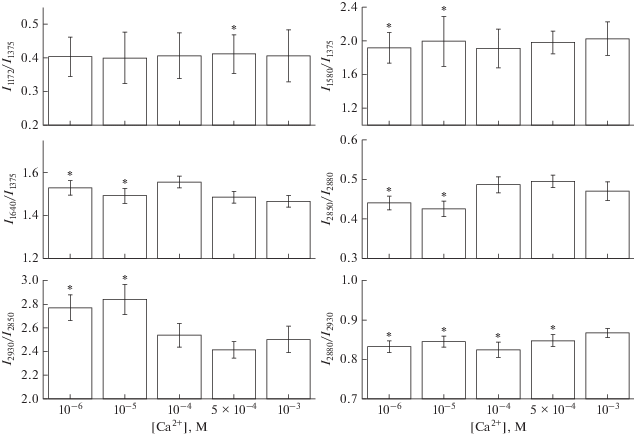
В следующей серии экспериментов при снижении [Ca2+]out с 10–3 до 10–6 М обнаружено, что изменения в КР-спектре внутриклеточного Гб наблюдаются в области 1355–1700 см–1 (рис. 2б). Установлено, что уменьшение [Ca2+]out до 10–6 М приводит к изменению конформации гема и глобина: снижение симметричных колебаний боковых СН-групп пиррольных полуколец (I1375/I1127) и увеличение вклада валентных колебаний винильных групп гемопорфирина (I1580/I1550) и сродства к лигандам (I1375/I1580). Отметим, что при этом не меняется вероятность нахождения гема в плоской конформации (I1640/I1127), но снижается жесткость его белкового окружения (I1170/I1127). При снижении [Са2+]out с 10–3 до 10–4 М происходит увеличение плотности упаковки глобина (I2850/I2880) и полярности окружения глобина (I2930/I2850), а также снижение упорядоченности СН-групп аминокислот глобина, что может быть связано с изменением поверхностного заряда мембраны и присоединением молекул Гб к мембране (I2880/I2930) (рис. 3). Отметим, что изменения в спектре КР в области валентных колебаний аминокислот 2800–3000 см–1 КР-спектра характерны только для глобина Гб, так как при данном режиме регистрации КР (возбуждение с длиной волны 532 нм) в области 2800–3100 см–1 КР от белков и липидов мембраны эритроцита не регистрируется [10, 22]. Отметим, что при снижении [Ca2+]out изменения конформации глобиновой части Гб в эритроците начинаются при [Ca2+]out 10–5 М, а изменения конформации гема – при [Ca2+]out 10–6 М (рис. 3). Вероятно, изменения конформации как гемовой, так и глобиновой части внутриклеточного Гб при снижении [Ca2+]out до 10–4 М связаны частично с изменением поверхностного заряда (ζ-потенциал) мембраны (на 6%), но в большей степени с увеличением мембранного потенциала (на 25%).
Рис. 3.
Соотношения интенсивностей полос КР-спектра гема и глобина гемоглобина, измеренные от суспензии эритроцитов. Данные представлены как среднее ± SE (* p ≤ 0.05 относительно [Ca2+]out = 10–3 М).
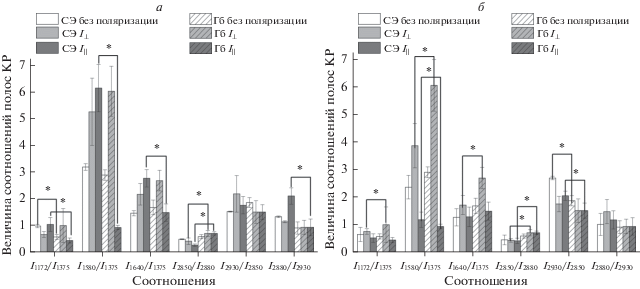
В связи с выявленным различием в распределении Гб в клетке при снижении [Ca2+]out (рис. 1) в следующей серии экспериментов с помощью КР-спектроскопии в поляризованном свете исследовали наличие упорядоченности в распределении Гб (гомогенное или негомогенное распределение Гб различных областях клетки) [37]. Установлено, что амплитуда характерных полос КР-спектра при перпендикулярной (I⊥) и параллельной поляризации (I||) различна. При снижении [Ca2+]out с 10–3 до 10–6 М изменения в спектре КР Гб в эритроците в поляризованном свете выявлены в области 1355–3000 см–1 (рис. 4). Установлено, что при [Ca2+]out = 10–3 М при регистрации КР в плоско поляризованном свете вклад симметричных колебаний боковых СН-групп пиррольных полуколец (I1375/I1127) и способность Гб выделять лиганды (отношение симметричных валентных колебаний пирролов к валентным колебаниям винильных групп) (I1375/I1580) увеличивается, а вклад валентных колебаний винильных групп гемопорфирина (I1580/I1550) и полярность окружения глобина (I2930/I2850) по сравнению с контролем уменьшается. При регистрации КР в перпендикулярно поляризованном свете уменьшение [Ca2+]out с 10–3 до 10–6 М не влияло на вклад симметричных колебаний боковых СН-групп пиррольных полуколец (I1375/I1127) и полярность окружения глобина (I2930/I2850), хотя менялся вклад валентных колебаний винильных групп гемопорфирина (I1580/I1550). Таким образом, с помощью поляризации КР, были выявлены изменения структуры молекулы (что отражается в ориентации/вкладе определенных групп) или ее олигомеризации при изменении [Ca2+]out (рис. 4).
Рис. 4.
Соотношение интенсивностей полос КР-спектра в поляризованном свете внутриклеточного Гб при [Ca2+]out = 10–6 М (а) и 10–3 М (б) и внеклеточного Гб при [Ca2+]out = 10–6 М. Данные представлены как среднее ± SE (* p ≤ 0.05 для СЭ относительно внеклеточного Гб). Скобками указаны группы сравнения.
Известно, что важнейшими компонентами внешнего монослоя мембраны эритроцитов являются незаряженный фосфотидилхолин (около 28%) и отрицательно заряженные сфинголипиды (сфингомиелин, составляющий около 26% от всех липидов) с N-ацетилнейраминовой кислотой, а также гликопротеин (гликофорин). В мембране гликофорин распределен неравномерно (локализован как на внешней, так и на внутренней поверхности плазматической мембраны) и содержит большое количество отрицательно заряженных групп сиаловой кислоты. Известно, что при старении эритроцита величина поверхностного потенциала мембраны эритроцита снижается на 7 мВ (с –30.2 до –23.2 мВ) что соответствует 2.5 × 106 электронным зарядам или 4 × 1013 кулонов на поверхности мембраны эритроцита [1, 36]. Нами установлено, что снижение [Ca2+]out увеличивает поверхностный заряд, и это сопровождается изменением конформации гема и глобина, а также его олигомеризацией (за счет снижения упорядоченности цитоплазмы и десорбции примембранного Гб). Обратимое связывание Гб с мембранами может быть адаптивной реакцией, направленной на стабилизацию липидного бислоя мембран и/или регуляцию его упруго-механических свойств, и осуществляется за счет электростатических взаимодействий Гб с БП3 [38, 39]. Известно, что NH2-терминальный участок БП3 имеет гибкий анионный сегмент и может входить в катионную центральную полость дезоксигемоглобина (дГб), которая значительно сужается при связывании O2 (это снижает сродство O2 к Гб). Предполагается, что при связывании молекулы кислорода изменения конформации гема и расположения близлежащих к гему аминокислот дГб (например, лизина) увеличивают плотность отрицательного заряда в центральной полости дГб, способствуя смещению анионного сегмента в БП3 [10].
Вероятно, снижение [Ca2+]out меняет конформацию гема и расположения близлежащих к гему аминокислот дГб (например, лизина) и локализацию анионного сегмента БП3 за счет увеличения мембранного потенциала и поверхностного заряда. Этот процесс сопровождается десорбцией мембраносвязанного оксигемоглобина (оГб), дГб и последующей олигомеризацией цитоплазматического оГб, что меняет кислородтранспортные свойства эритроцита.
Исследование выполнено при финансовой РФФИ (№ 20-34-90073, для С.О.В.) и РНФ (№ 19-79-30062, для М.Г.В. и Б.Н.А), а также Междисциплинарной научно-образовательной школы Московского университета “Молекулярные технологии живых систем и синтетическая биология”.
Список литературы
Atkins C.G., Buckley K., Blades M.W., Turner R.F. 2017. Raman spectroscopy of blood and blood components. Appl. Spectrosc. 71 (5), 767–793. https://doi.org/10.1177/0003702816686593
Wu Y., Huang Y.X., Kang L.L., Wu Z.J., Luo M. 2010. Effect of pH on molecular constitution and distribution of hemoglobin in living erythrocyte. Biopolymers: Original Research on Biomolecules. 93 (4), 348–354. https://doi.org/10.1002/bip.21348
Minetti G., Piccinini G., Balduini C., Seppi C., Bro-velli A. 1996. Tyrosine phosphorylation of band 3 protein in Ca2+/A23187-treated human erythrocytes. Biochem. J. 320 (2), 445–450. https://doi.org/10.1042/bj3200445
Friederichs E., Farley R.A., Meiselman H.J. 1992. Influence of calcium permeabilization and membrane-attached hemoglobin on erythrocyte deformability. Amer. J. Hematol. 41 (3), 170–177. https://doi.org/10.1002/ajh.2830410306
Peng, Z., Li X., Pivkin I.V., Dao M., Karniadakis G.E., Suresh S. 2013. Lipid bilayer and cytoskeletal interactions in a red blood cell. Proc. Natl. Acad. Sci. USA. 110 (33), 13356–13361.https://doi.org/10.1073/pnas.1311827110/-/DCSupplemental
Wiley J.S., McCulloch K.E. 1982. Calcium ions, drug action and the red cell membrane. Pharmac. Therap. 18 (2), 271–292. https://doi.org/10.1016/0163-7258(82)90070-5
Орлов С.Н. 2014. Котранспортеры катионов и хлора: регуляция, физиологическое значение и роль в патогенезе артериальной гипертензии. Усп. биол. химии. 54, 267–298.
Luneva O.G., Sidorenko S.V., Maksimov G.V., Grygorczyk R., Orlov S.N. 2015. Erythrocytes as regulators of blood vessel tone. Biochem. (Moscow) Suppl. Series A: Membrane and Cell Biology. 9 (3), 161–171. https://doi.org/10.1134/S1990747815040078
Sidorenko S.V., Ziganshin R.H., Luneva O.G., Deev L.I., Alekseeva N.V., Maksimov G.V., Grygorczyk R., Orlov S.N. 2018. Proteomics-based identification of hypoxia-sensitive membrane-bound proteins in rat erythrocytes. J. Proteom. 184, 25–33. https://doi.org/10.1016/j.jprot.2018.06.008
Slatinskaya O.V., Luneva O.G., Deev L.I., Orlov S.N., Maksimov G.V. 2020. Conformational changes that occur in heme and globin upon temperature variations and normobaric hypoxia. Biophys. 65 (2), 213–221. https://doi.org/10.1134/S0006350920020220
Parshina E.Y., Yusipovich A.I., Brazhe A.R., Silicheva M.A., Maksimov G.V. 2019. Heat damage of cytoskeleton in erythrocytes increases membrane roughness and cell rigidity. J. Biol. Phys. 45 (4), 367–377.https://doi.org/10.1007/s10867-019-09533-5
Klimanova E.A., Sidorenko S.V., Tverskoi A.M., Shiyan A.A., Smolyaninova L.V., Kapilevich L.V., Gusakova S.V., Maksimov G.V., Lopina O.D., Orlov S.N. 2019. Search for intracellular sensors involved in the functioning of monovalent cations as secondary messengers. Biochem. (Moscow). 84 (11), 1280–1295. https://doi.org/10.1134/S0006297919110063
Maksimov G.V., Slatinskaya O.V., Tkhor E.S., Anisimov N.A., Mamaeva S.N., Shutova V.V. 2019. The role of erythrocyte receptors in regulation of the conformation and distribution of hemoglobin. Biophys. 64 (1), 57–61. https://doi.org/10.1134/S0006350919010123
De Rosa M.C., Alinovi C.C., Galtieri A., Russo A., Giardina B. 2008. Allosteric properties of hemoglobin and the plasma membrane of the erythrocyte: New insights in gas transport and metabolic modulation. IUBMB life. 60 (2), 87–93. https://doi.org/10.1002/iub.15
Sidorenko S.V., Luneva O.G., Novozhilova T.S., Alekseeva N.V., Rodnenkov O.V., Deev L.I., Maksimov G.V., Grygorczyk R., Orlov S.N. 2018. Hemolysis and ATP release from human and rat erythrocytes under conditions of hypoxia: A comparative study. Biochem. (Moscow), Suppl. Series A: Membrane and Cell Biology. 12 (2), 114–120. https://doi.org/10.1134/S1990747818020125
Mawatari S., Murakami K. 2004. Different types of glutathionylation of hemoglobin can exist in intact erythrocytes. Arch. Biochem. Biophys. 421 (1), 108–114. https://doi.org/10.1016/j.abb.2003.10.012
Kovalenko S.S., Yusipovich A.I., Parshina E.Y., Maksimov G.V. 2015. Role of purinergic receptors of erythrocytes in the regulation of conformation and oxygen-and NO-transporting capacity of hemoglobin. Bull. Exp. Biol. Med. 159 (2), 213–216. https://doi.org/10.1007/s10517-015-2925-6
Brazhe N.A., Parshina E.Y., Khabatova V.V., Semenova A.A., Brazhe A.R., Yusipovich A.I., Sarycheva A.S., Churin A.A., Goodilin E.A., Maksimov G.V., Sosnovtseva O.V. 2013. Tuning SERS for living erythrocytes: Focus on nanoparticle size and plasmon resonance position. J. Raman Spectrosc. 44 (5), 686–694. https://doi.org/10.1002/jrs.4274
Cordero J.F., Romero P.J. 2002. Caffeine activates a mechanosensitive Ca2+ channel in human red cells. Cell Calcium. 31 (5), 189–200. https://doi.org/10.1016/S0143-4160(02)00032-5
Othmane A., Bitbol M., Snabre P., Mills P. 1990. Influence of altered phospholipid composition of the membrane outer layer on red blood cell aggregation: Relation to shape changes and glycocalyx structure. Eur. Biophys. J. 18 (2), 93–99.https://doi.org/10.1007/BF00183268
Brazhe N.A., Abdali S., Brazhe A.R., Luneva O.G., Bryzgalova N.Y., Parshina E.Y., Sosnovtseva O.V., Maksimov G.V. 2009. New insight into erythrocyte through in vivo surface-enhanced Raman spectroscopy. Biophys. J. 97 (12), 3206–3214. https://doi.org/10.1016/j.bpj.2009.09.029
Goheen S.C., Lis L.J., Kucuk O., Westerman M.P., Kauffman J.W. 1993. Compositional dependence of spectral features in the Raman spectra of erythrocyte membranes. J. Raman Spectrosc. 24 (5), 275–279. https://doi.org/10.1002/jrs.1250240503
Tiba M.H., Draucke, G.T., Barbee R.W., Terner J., Torres Filho I., Romfh P., Vakhshoori D., Ward K.R. 2014. Tissue oxygenation monitoring using resonance Raman spectroscopy during hemorrhage. J. Trauma and Acute Care Surgery. 76 (2), 402–408. https://doi.org/10.1097/TA.0000000000000088
Wood B.R., Hammer L., McNaughton D. 2005. Resonance Raman spectroscopy provides evidence of heme ordering within the functional erythrocyte. Vibration. Spectrosc. 38 (1–2), 71–78. https://doi.org/10.1016/j.vibspec.2005.02.016
Kutuzov N.P., Brazhe A.R., Maksimov G.V., Dracheva O.E., Lyaskovskiy V.L., Bulygin F.V., Rubin A.B. 2014. Orientational ordering of carotenoids in myelin membranes resolved by polarized Raman microspectroscopy. Biophys. J. 107 (4), 891–900. https://doi.org/10.1016/j.bpj.2014.07.002
Maksimov G.V., Kutuzov N.P., Shutova V.V., Orlov S.N. 2019. Microdomain organization of internodal myelin. Biochem. (Moscow), Suppl. Series A: Membrane and Cell Biology. 13 (3), 260–267. https://doi.org/10.1134/S1990747819030164
Hofmann U.G., Rotsch C., Parak W.J., Radmacher M. 1997. Investigating the cytoskeleton of chicken cardiocytes with the atomic force microscope. J. Struct. Biol. 119 (2), 84–91. https://doi.org/10.1006/jsbi.1997.3868
Bryzgalova N.Y., Brazhe N.A., Yusipovich A.I., Maksimov G.V., Rubin A.B. 2009. Role of the state of erythrocyte cytoplasm in the change of hemoglobin affinity for oxygen. Biophys. 54 (3), 308. https://doi.org/10.1134/S0006350909030075
Yusipovich A.I., Zagubizhenko M.V., Levin G.G., Platonova A., Parshina E.Y., Grygorzcyk R., Maksimov G.V., Rubin A.B., Orlov S.N. 2011. Laser interference microscopy of amphibian erythrocytes: Impact of cell volume and refractive index. J. Microscopy. 244 (3), 223–229. https://doi.org/10.1111/j.1365-2818.2011.03516.x
Левин Г.Г., Булыгин Ф.В., Вишняков Г.Н. 2005. Когерентные осцилляции состояния молекул белка в живых клетках. Цитология, 47 (4), 348–356.
Mazeron P., Muller S., El Azouzi H. 1997. Deformation of erythrocytes under shear: A small-angle light scattering study. Biorheol. 34 (2), 99–110. https://doi.org/10.3233/BIR-1997-34202
Yusipovich A.I., Bryzgalova N.Y., Parshina E.Y., Lomakin A.G., Rodnenkov O.V., Levin G.G., Maksimov G.V., Rubin A.B. 2008. Evaluation of erythrocyte shape and status by laser interference microscopy. Bull. Experim. Biol. Med. 145 (3), 382. https://doi.org/10.1007/s10517-008-0097-3
Yusipovich A.I., Novikov S.M., Kazakova T.A., Erokhova L.A., Brazhe N.A., Lazarev G.L., Maksimov G.V. 2006. Peculiarities of studying an isolated neuron by the method of laser interference microscopy. Quant. Electron. 36 (9), 874. https://doi.org/10.1134/S000368381203012X
Kang L.L., Huang Y.X., Liu W.J., Zheng X.J., Wu Z.J., Luo M. 2008. Confocal Raman microscopy on single living young and old erythrocytes. Biopolymers: Original Research on Biomolecules. 89 (11), 951–959. https://doi.org/10.1002/bip.21042
Tikhomirova I.A., Murav’ev A.V., Mikhailichenko L.A., Golubkova E.V. 2006. Correlation between electrophoretic mobility and extent of aggregation of human red blood cells. Hum. Physiol. 32 (6), 748–749. https://doi.org/10.1134/S0362119706060223
Huang Y.X., Wu Z.J., Mehrishi J., Huang B.T., Chen X.Y., Zheng X.J., Lui W.J., Luo M. 2011. Human red blood cell aging: Correlative changes in surface charge and cell properties. J. Cell. Mol. Medicine. 15 (12), 2634–2642. https://doi.org/10.1111/j.1582-4934.2011.01310.x
Spiro T.G., Strekas T.C. 1972. Resonance Raman spectra of hemoglobin and cytochrome c: Inverse polarization and vibronic scattering. Proc. Natl. Acad. Sci. USA. 69 (9), 2622–2626. https://doi.org/10.1073/pnas.69.9.2622
Shaklai N., Sharma V.S., Ranney H.M. 1981. Interaction of sickle cell hemoglobin with erythrocyte membranes. Proc. Natl. Acad. Sci. USA. 78 (1), 65–68. https://doi.org/10.1073/pnas.78.1.65
Demehin A.A., Abugo, O.O., Jayakumar R., Lakowicz J.R., Rifkind J.M. 2002. Binding of hemoglobin to red cell membranes with eosin-5-maleimide-labeled band 3: Analysis of centrifugation and fluorescence lifetime data. Biochem. 41 (27), 8630–8637. https://doi.org/10.1021/bi012007e
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


