Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 3, стр. 217-224
Влияние газотрансмиттера монооксида углерода на микрореологию и эластичность мембран эритроцитов
А. В. Муравьев a, *, И. А. Тихомирова a, С. В. Булаева a, Е. П. Петроченко a, Ю. В. Малышева a
a Ярославский государственный педагогический университет им. К.Д. Ушинского
150000 Ярославль, Россия
* E-mail: alexei.47@mail.ru
Поступила в редакцию 06.09.2020
После доработки 02.10.2020
Принята к публикации 05.10.2020
Аннотация
Доставка кислорода в тканевые микрорайоны зависит не только от сосудистых факторов, но и от самих эритроцитов – транспортеров дыхательных газов. Хотя влияние газотрансмиттеров на микрореологию клеток крови сомнений не вызывает, имеющиеся данные касаются преимущественно эффектов оксида азота (NO) на эластичность мембраны эритроцитов. Существенно меньше информации об эффектах H2S, и совсем отсутствуют данные о сигнальной роли монооксида углерода (СО) в микрореологии эритроцитов. Таким образом, целью данной работы было изучение микрореологических ответов эритроцитов на действие СО. Микрореологические характеристики эритроцитов исследовались в контроле и в присутствии донора СО CORM-3 в сочетании с рядом ингибиторов, включая ингибитор растворимой гуанилатциклазы ODQ, ингибитор NO-синтетазы L-NAME и блокатор Са2+-зависимых калиевых (KCа) каналов ТЕА. Регистрировали индекс деформируемости эритроцитов (ИУЭ) и показатели их агрегации (ПАЭ) в контроле и после инкубации с препаратами. Кроме того, использовали восстановленные тени эритроцитов, для которых оценивали изменение деформируемости под действием указанных соединений. В присутствии CORM-3 эритроциты демонстрировали увеличение ИУЭ на 9% (p < 0.01). Прирост ИУЭ теней эритроцитов под влиянием донора СО составил 10% (p < 0.01). В этих условиях ПАЭ снижался на 41% (p < 0.01). Блокирование KСа-каналов с помощью ТЕА проявлялось в существенном подавлении СО-зависимого увеличения ИУЭ и полностью устраняло влияние СО на агрегацию эритроцитов. При ингибировании NO/cGMP сигнального пути с помощью ODQ и L-NAME микрореологические эффекты CORM-3 не проявлялись. Таким образом, результаты исследования свидетельствуют о том, что СО способен положительно влиять на микрореологические характеристики эритроцитов, повышая их эластичность и деформируемость и угнетая их способность к агрегации. Регуляторные эффекты СО могут реализоваться при участии KСа-каналов и NO/cGMP сигнального каскада.
ВВЕДЕНИЕ
Наряду с оксидом азота и сульфидом водорода, монооксид углерода – еще один эндогенно генерируемый биологический газ [1]. Главный путь образования CO включает гемоксигеназу, которая вместе с NADPH-цитохром Р450–редуктазой, расщепляет гемовое кольцо в гемопротеинах на биливердин, CO и железо [2]. В последнюю декаду проведенные исследования выявили многие аспекты эндогенной продукции и физиологических функций монооксида углерода. Была показана важная роль СО в функциях иммунной, сердечно-сосудистой, дыхательной, репродуктивной, пищеварительной системах [1, 3]. В кровеносной системе эндогенно генерируемый СО может эффективно расслаблять гладкие мышцы сосудов [4–6]. Важно заметить, что для эффективной тканевой перфузии важен не только сосудистый компонент адаптации, но и оптимальная микрореология эритроцитов – транспортеров кислорода [7]. На уровне обменных капилляров, лишенных мышечных элементов и, следовательно, существенного изменения диаметра [8], деформируемость эритроцитов является критической характеристикой потока и, следовательно, определяет эффективность доставки кислорода в ткани [7–9]. Одним из важнейших факторов изменения деформируемости эритроцитов является их мембранная эластичность [10]. Газотрансмиттеры по аутокринному или паракринному механизмам могут оказывать регуляторное влияние на эти микромеханические свойства эритроцитов. Так, например, донор NO нитропруссид натрия повышал деформируемость эритроцитов и уменьшал их агрегацию [11–13]. Таким же эффектом обладает и гидросульфид натрия, донор H2S [14]. Как в случае NO, H2S выраженно ингибирует агрегацию тромбоцитов [15, 16]. Что касается СО, то практически нет данных о его влиянии на эластичность мембран эритроцитов и их микрореологию в целом. В свете вышесказанного целесообразно было исследовать влияние СО на микрореологические характеристики эритроцитов.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы цельной крови (9 мл) здоровых доноров (n = 36) получали венопункцией в вакуумные пробирки (вакутайнеры с EDTA). Проведение исследования одобрено местным этическим комитетом Ярославского государственного педагогического университета (протокол № 2 от 13.02.2020 г.). Получено информированное согласие всех субъектов в соответствии с рекомендациями Хельсинкской декларации (Хельсинкская декларация WMA об этике. Принципы медицинских исследований с участием людей, с поправками, внесенными 64-й Генеральной Ассамблеей WMA, Форталеза, Бразилия, октябрь 2013 г.). Эритроциты отделяли от плазмы центрифугированием (15 мин, 3000 об/мин), трижды отмывали в изотоническом растворе хлорида натрия и ресуспендировали в буферном растворе (138 мМ NaCl, 3 мМ KCl, 1 мМ K2SO4, 7.5 мМ Na2HPO4, 1 мМ MgSO4, 5 мМ глюкозы, pH 7.4). Поскольку эндотелиальная NO-синтаза является кальций-зависимым ферментом, то в среду инкубации эритроцитов добавляли CaCl2 до его конечной концентрации 150 мкМ. Осмолярность составляла 300 мОсм/л (определяли на осмометре Fogel ОМ-801, Германия). При исследовании агрегации эритроцитов для ее стимулирования добавляли к буферному раствору декстран-200 (10% ХАЕС-стерил, компания Fresenius Kabi, Германия) в соотношении 7 : 3 по объему. При этом осмолярность полученной смеси не изменялась. Суспензию эритроцитов делили на несколько аликвот и клетки инкубировали при 37°С в течение 30 мин с каждым из соединений:
1) донором СО – CORM-3 (15, 50 и 100 мкМ);
2) с блокатором Са2+-зависимых калиевых каналов ТЕА (50 мкМ);
3) с ингибитором растворимой гуанилатциклазы ODQ (0.5 мкМ);
4) с ингибитором NO-синтазы L-NAME (200 мкМ).
В каждом опыте в качестве контроля использовали суспензию эритроцитов, инкубируемых в течение 30 мин при 37°С в буферном растворе без добавления указанных выше препаратов. В опыте и в контроле проводилось по 20 параллельных измерений микрореологических характеристик эритроцитов и их теней. Все препараты и соединения получены от фирмы Sigma-Aldrich (США). Их растворяли согласно указаниям производителя либо в DMSO, либо в дистиллированной воде. Все эксперименты проводили в течение 4 ч после взятия крови. Тени эритроцитов готовили по методу Доджа [17]. Эритроциты разрушали осмотическим шоком. Для этого к 1 мл клеток добавляли 7 мл охлажденной дистиллированной воды (при температуре 4°С) с последующей отмывкой в фосфатном буфере. Затем концентрат теней инкубировали в фосфатном буфере с добавлением 30% декстрана-200 (соотношение буфера и декстрана 7 : 3 по объему). Суспензию восстановленных теней эритроцитов делили на несколько аликвот, добавляли соответствующие препараты и после инкубации в течение 30 мин при 37°С регистрировали их деформируемость в проточной микрокамере.
Исследование агрегации и деформируемости. Степень агрегации эритроцитов определяли с помощью агрегометра Myrenne M1 (Германия), который дает возможность получить четыре индекса агрегации при низких (3 с–1) и высоких (600 с–1) скоростях сдвига (индексы агрегации: М5, М10, М15 и М110, соответственно). Кроме того, процесс агрегации и форму клеток контролировали с помощью прямой микроскопии. Поскольку все четыре индекса агрегации, которые регистрируются агрегометром Myrenne M1, изменялись однонаправленно и примерно одинаково, то для анализа использовали только индекс М5. В тексте, на рисунках и в таблицах они обозначены как показатели агрегации эритроцитов.
Для оценки мембранной вязкоэластичности эритроцитов определяли индекс удлинения эритроцитов и их восстановленных теней в проточной микрокамере, где создавали постоянное течение суспензии эритроцитов (Hct = 0.5%). В микрокамеру подавали давление, которое создавало напряжение сдвига 0.54 Н/м2 и вытягивало клетки (или их восстановленные тени), прикрепленные ко дну камеры. Адгезия клеток происходила спонтанно. На основе измерения длины (L) и ширины (W) вытянутых потоком клеток рассчитывали показатель деформируемости эритроцитов: ИУЭ = L/W (отн. ед.) [18].
Статистическая обработка. Статистическую обработку результатов проводили с использованием программы Statistica 6.0. Проверку выборочного распределения проводили с помощью теста Шапиро–Уилка. Значимость различий определяли с помощью t-критерия Стьюдента. Гипотезу о взаимосвязи данных проверяли с помощью корреляции Спирмена. За уровень статистически значимых различий принимали изменения при p < 0.05 и p < 0.01. Данные в таблицах и тексте представлены как М ± m (среднее ± стандартная ошибка среднего).
РЕЗУЛЬТАТЫ
Изменение микрореологии эритроцитов после их инкубации с донором СО CORM-3
После инкубации эритроцитов с CORM-3 прирост ИУЭ при разных концентрациях препарата составил 6–9% (с 1.94 ± 0.03 до 2.05 ± 0.03 отн. ед. при концентрациях донора СО 15 и 100 мкМ и до 2.11 ± ± 0.02 отн. ед. при концентрации 50 мкМ; p < < 0.01). Таким образом, несколько более выраженные изменения ИУЭ были зарегистрированы при концентрации CORM-3 50 мкМ (с 1.94 ± 0.02 до 2.11 ± 0.03 отн. ед., p < 0.01; рис. 1а).
Рис. 1.
Относительные изменения деформируемости интактных эритроцитов (а) и их восстановленных теней (б) после инкубации с CORM-3 в разных концентрациях: 1 – 15, 2 – 50, 3 –100 мкМ. * – Отличие от контроля статистически значимо (p < 0.01).
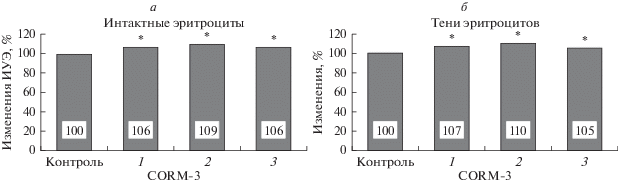
Это было подтверждено и на тенях эритроцитов (рис. 1б). При этом увеличение их деформируемости при концентрации донора СО 50 мкМ достигло 10% (с 1.84 ± 0.02 до 2.02 ± 0.03 отн. ед., p < 0.01). Важно заметить, что одним из основных факторов изменения деформируемости эритроцитов в целом является эластичность их мембран [10] (наряду с цитоплазматической вязкостью, величина которой в основном зависит от концентрации гемоглобина) [19]. Поскольку при приготовлении теней эритроцитов гемоглобин удалялся из клеток и заменялся изотоническим раствором с постоянной вязкостью, то, следовательно, изменение общей деформируемости теней зависело только от микромеханических свойств мембраны, и измеряемые величины могут характеризовать мембранную эластичность эритроцитов.
Дозозависимые изменения агрегации эритроцитов при их инкубации с CORM-3 тоже свидетельствовали о большей эффективности донора СО при его концентрации 50 мкМ (рис. 2).
Рис. 2.
Относительные (в % от контрольного значения) изменения агрегации эритроцитов после их инкубации с CORM-3 в концентрациях: 1 – 15, 2 – 50, 3 –100 мкМ. * – Отличие от контроля статистически значимо (p < 0.01).
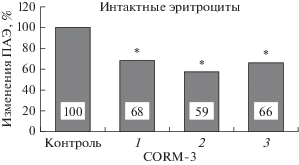
При этой концентрации снижение ПАЭ составило 41% (с 4.92 ± 0.38 отн. ед. в контроле до 2.51 ± ± 0.22 отн. ед. после инкубации с донором СО, p < < 0.01).
Изменение микрореологии эритроцитов после их инкубации с CORM-3 и ТЕА
В качестве основной молекулярной мишени для действия СО в клетках рассматривают KCa-каналы, которые блокируются ТЕА [20]. В этой серии опытов было установлено, что CORM-3 повышал ИУЭ интактных клеток на 8% (р < 0.01), а снижение агрегации составило 37% (табл. 1, р < 0.05). ТЕА (50 мкМ) уменьшал влияние CORM-3 на деформируемость эритроцитов, но не устранял его полностью (табл. 1). Однако если сравнить ответы эритроцитов на CORM-3 и на сочетание ТЕА + CORM-3, то разница в изменениях ИУЭ в первом случае составила 8% и была достоверной (р < 0.01), а во втором – 2% (р > 0.05) и статистически незначима. Что касается второй микрореологической характеристики эритроцитов, их агрегации, то ТЕА полностью устранял снижение ПАЭ, происходящее под влиянием CORM-3 (табл. 1).
Таблица 1.
Изменение микрореологических характеристик эритроцитов после их инкубации с CORM-3, блокатором кальций-зависимых калиевых каналов, ТЕА по отдельности и при их одновременном добавлении (M ± m, n = 20)
| Показатель | Контроль | CORM-3 | ТЕА | ТЕА + CORM-3 |
|---|---|---|---|---|
| ИУЭ, отн.ед. | 1.93 ± 0.01 | 2.08 ± 0.02** | 1.96 ± 0.03 | 1.97 ± 0.03 |
| ПАЭ, отн.ед. | 4.56 ± 0.18 | 2.87 ± 0.16* | 4.88 ± 0.28 | 4.65 ± 0.32 |
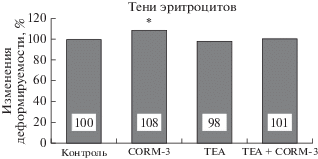
На микрореологической модели теней эритроцитов были получены данные, свидетельствующие о полном подавлении эффекта донора СО на деформируемость (рис. 3). Хотя после инкубации теней эритроцитов только с CORM-3 наблюдался достоверный, на 8% прирост деформируемости (р < 0.01). Однако если в среду инкубации теней был добавлен ТЕА, то донор СО практически не изменял мембранную эластичность и индекс деформируемости отличался от уровня контроля менее чем на 1% (1.80 ± 0.03 отн. ед. – контроль; 1.95 ± 0.03 отн. ед. – CORM-3 и 1.81 ± 0.02 отн. ед. – ТЕА + CORM-3).
Изменение микрореологии эритроцитов после их инкубации с CORM-3, ингибиторами растворимой гуанилатциклазы ODQ и NO-синтазы L-NAME
Известно, что NO- и CO-индуцированные изменения клеточных функций в основном опосредуются растворимой гуанилатциклазой и cGMP-зависимыми сигнальными/регуляторными процессами [21]. Мы проверили предположение о том, что микрореологические ответы эритроцитов могут быть связаны сигнальной системой NO-cGMP. Было найдено, что при ингибировании р-ГЦ с помощью ODQ (0.5 мкМ) практически полностью устранял эффект донора СО. Это было подтверждено на двух моделях: в опытах с деформируемостью эритроцитов и при регистрации их агрегации (табл. 2).
Таблица 2.
Изменение микрореологических характеристик эритроцитов после их инкубации с донором СО (CORM-3), ODQ по отдельности и при их одновременном добавлении (M ± m, n = 20)
| Показатель | Контроль | CORM-3 | ODQ | ODQ + CORM-3 |
|---|---|---|---|---|
| ИУЭ, отн. ед. | 2.00 ± 0.01 | 2.10 ± 0.01** | 1.96 ± 0.01 | 2.00 ± 0.02 |
| ПАЭ, отн. ед. | 4.05 ± 0.22 | 2.83 ± 0.15* | 4.12 ± 0.28 | 4.08 ± 0.32 |
Если ингибировать активность NO-синтетазы с помощью L-NAME (200 мкМ), то, как и при воздействии на р-ГЦ, полностью устраняется микрореологический эффект CORM-3 (табл. 3). Более того, под влиянием отдельно L-NAME агрегация эритроцитов даже возрастала на 16%, и добавление CORM-3 не устраняло повышения ПАЭ (табл. 3).
Таблица 3.
Изменение микрореологических характеристик эритроцитов после их инкубации с донором СО (CORM-3), L-NAME по отдельности и при их одновременном добавлении (M ± m, n = 20)
| Показатель | Контроль | CORM-3 | L-NAME | L-NAME + CORM-3 |
|---|---|---|---|---|
| ИУЭ, отн. ед. | 1.95 ± 0.03 | 2.09 ± 0.02** | 1.95 ± 0.03 | 1.96 ± 0.03 |
| ПАЭ, отн. ед. | 4.50 ± 0.34 | 3.85 ± 0.29** | 5.22 ± 0.42 | 4.91 ± 0.84 |
Необходимо заметить, что замена цитоплазмы в эритроцитах на раствор Рингера в их восстановленных тенях должна привести к удалению р-ГЦ. Однако это не изменило микрореологические ответы на CORM-3 и на одновременное воздействие ODQ + CORM-3. Так, например, добавление в среду инкубации ингибитора р-ГЦ полностью устраняло прирост деформируемости теней эритроцитов (рис. 4а).
Рис. 4.
Относительные (в % к контролю) изменения деформируемости восстановленных теней эритроцитов после их инкубации с CORM-3 и в сочетании с ODQ (а) и CORM-3 в сочетании L-NAME (L-N). * – Отличие от контроля статистически значимо (p < 0.01).
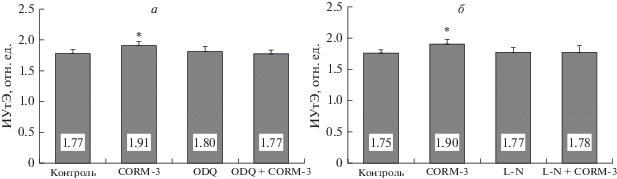
Сходный результат был получен при инкубации теней эритроцитов с L-NAME и при совместном воздействии L-NAME + CORM-3. Прирост деформируемости под влиянием CORM-3 на 9% (p < 0.01) устранялся добавлением ингибитора NOS (рис. 4б).
ОБСУЖДЕНИЕ
Донор монооксида углерода, например CORM-3, высвобождает молекулы СО, что обеспечивает доставку контролируемых количеств СО для регуляции работы биологических систем [22]. Результаты данного исследования показали, что CORM-3 заметно повышает эластичность мембран эритроцитов и их деформируемость в целом. Вместе с выраженным снижением агрегации это может существенно сказываться на перфузии тканей [7, 8]. Изменение мембранной эластичности теней эритроцитов под влиянием донора СО было достоверно большим, и разница относительно контроля составила 0.143 ± 0.01 отн. ед., тогда как у интактных клеток прирост ИУЭ был равен 0.100 ± ± 0.01 отн. ед. Это различие в 0.043 отн. ед. было статистически достоверным (р < 0.05). Разница в мембранной эластичности может быть обусловлена тем, что имеющийся в интактных эритроцитах гемоглобин связывает выделившийся из CORM-3 СО как сигнальную молекулу [23], чего не происходит в тенях клеток с удаленной цитоплазмой и гемоглобином.
В качестве одной из основных молекулярных мишеней для CO в клетках рассматривают KСа‑каналы [4]. Когда CO взаимодействует с гемом, это приводит к увеличению связывания Ca2+ с каналом, причем и CO может напрямую воздействовать на активность KCa-каналов, связываясь в нескольких центрах [20]. При блокировании этих каналов с помощью TEA происходило существенное уменьшение эффективности действия СО на деформируемость эритроцитов и их теней и полное устранение его снижающего агрегацию влияния. Важно заметить, что CO активирует KCa-каналы не только на интактных клетках, а также в изолированных фрагментах плазматической мембраны. Это происходит в условиях, когда цитозольные сигнальные белки отсутствуют, а киназы неактивны, свидетельствуя о прямом действии СО на KCa-каналы [24]. Кроме того, СО, так же как и NO, способен стимулировать р-ГЦ, тем самым повышая уровень cGMP в клетках. Это ведет, например, к вазодилатации и угнетению агрегации тромбоцитов [1, 25, 26]. Вполне вероятно, что в эритроцитах используются оба этих сигнальных пути для реализации эффектов СО.
Наряду с вышеприведенными данными об эффекте блокирования KCa-каналов, ингибирование р-ГЦ с помощью ODQ сопровождалось практически полным устранением микрореологических ответов эритроцитов и их теней на CORM-3. Анализ выраженного снижения агрегации под влиянием донора СО позволяет предполагать, что изменение этой микрореологической характеристики эритроцитов реализуется через активацию р-ГЦ с последующим снижением внутриклеточной концентрации Са2+ [1]. Известно, что поступление Са2+ в эритроциты и/или тромбоциты сопровождается выраженным приростом агрегации этих клеток [15, 27]. Тогда как блокирование его входа или связывание во вне- или внутриклеточной среде хелаторами, напротив, ингибирует агрегацию эритроцитов [28].
Интересно заметить, что и при инкубации теней эритроцитов с CORM-3 на фоне ингибитора р-ГЦ также не было выявлено прироста деформируемости. Имеются данные о том, что СО может ингибировать образование NO в клетках, и эти газотрансмиттеры могут проявлять уникальные взаимодействия [29]. Действительно, при ингибировании ключевого фермента образования оксида азота NO-синтазы с помощью L-NAME устранялись положительные микрореологические эффекты донора СО. Более того, сам ингибитор (L-NAME) заметно повышал агрегацию эритроцитов. Известно, что активация NOS связана с системой кальций-кальмодулин [30], и нарушение их взаимодействия под влиянием L-NAME может способствовать повышению концентрации свободного Са2+ в эритроцитах и, как следствие этого, – усиление агрегации [28, 31].
Таким образом, получены данные о положительном влиянии донора монооксида углерода на микрореологические свойства эритроцитов. Был выявлен умеренный, но статистически достоверный прирост мембранной эластичности, подтвержденный как в микрореологических ответах интактных эритроцитов, так и их восстановленных теней. Донор СО значительно снижал агрегацию эритроцитов. Что касается молекулярных мишеней, то результаты опытов позволяют заключить, что эффекты СО могут реализоваться как через активацию KCa-каналов, так и при участии NO/cGMP сигнального пути.
Исследование выполнено при финансовой поддержке РФФИ и БРФФИ в рамках научного проекта № 20-515-00019 Бел_а.
Список литературы
Truss N.J., Warner T.D. 2011. Gasotransmitters and platelets. Pharmacol. Ther. 132, 196–203. https://doi.org/10.1016/j.pharmthera.2011.07.001
Wang R. 1998. Resurgence of carbon monoxide: An endogenous gaseous vasorelaxing factor. Can. J. Physiol. Pharmacol. 76, 1–15. https://doi.org/10.1139/cjpp-76-1-1
Wu L., Wang R. 2005. Carbon monoxide: Endogenous production, physiological functions, and pharmacological applications. Pharmacol. Rev. 57 (4), 585–630. https://doi.org/10.1124/pr.57.4.3
Wang R., Wu L. 1997. The chemical modification of KCa channels by carbon monoxide in vascular smooth muscle cells. J. Biol. Chem. 272, 8222–8226. https://doi.org/10.1074/jbc.272.13.8222
Wang R., Wang Z.Z., Wu L. 1997. Carbon monoxide-induced vasorelaxation and the underlying mechanisms. Br. J. Pharmacol. 121, 927–934. https://doi.org/10.1038/sj.bjp.0701222
Durante W., Peyton K.J., Schafer A.I. 1999. Platelet-derived growth factor stimulates heme oxygenase-1 gene expression and carbon monoxide production in vascular smooth muscle cells. Arterioscler. Thromb. Vasc.Biol. 19, 2666–2672. https://doi.org/10.1161/01.ATV.19.11.2666
Pries A.R., Secomb T.W. 2003. Rheology of the microcirculation. Clin. Hemorheol. Microcirc. 29, 143–148.
Popel A.S., Johnson P.C. 2005. Microcirculation and hemorheology. Annu. Rev. Fluid. Mech. 37, 43–69. https://doi.org/10.1146/annurev.fluid.37.042604.133933
Guo Q., Duffy S.P., Matthews K. 2014. Microfluidic analysis of red blood cell deformability. J. Biomech. 47, 1767–1776. https://doi.org/10.1016/j.jbiomech.2014.03.038
Mohandas N., Gallagher P.G. 2008. Red cell membrane: Past, present, and future. Blood. 112, 3939–3948. https://doi.org/10.1182/blood-2008-07-161166
Uyuklu M., Meiselman H.J., Baskurt O.K. 2009. Role of hemoglobin oxygenation in the modulation of red blood cell mechanical properties by nitric oxide. Nitric Oxide. 21, 20–26. https://doi.org/10.1016/j.niox.2009.03.004
Bor-Kucukatay M., Wenby R.B., Meiselman H.J., Baskurt O.K. 2003. Effects of nitric oxide on red blood cell deformability. Am. J. Physiol. Heart Circ. Physiol. 284, 1577–1584. https://doi.org/10.1152/ajpheart.00665.2002
Mozar A., Connes P., Collins B., Hardy-Dessources M.D., Romana M., Lemonne N., Bloch W., Grau M. 2016. Red blood cell nitric oxide synthase modulates red blood cell deformability in sickle cell anemia. Clin. Hemorheol. Microcirc. 64, 47–53. https://doi.org/10.3233/CH-162042
Muravyov A.V., Antonova N., Tikhomirova I.A. 2019. Red blood cell micromechanical responses to hydrogen sulfide and nitric oxide donors: Analysis of crosstalk of two gasotransmitters (H2S and NO). Series on Biomechanics. 33, 34–40.
Gao L., Cheng C., Sparatore A., Zhang H., Wang C. 2015. Hydrogen sulfide inhibits human platelet aggregation in vitro in part by interfering gap junction channels: Effects of ACS14, a hydrogen sulfide-releasing aspirin. Heart Lung Circ. 24, 77–85. https://doi.org/10.1016/j.hlc.2014.05.019
Irwin C., Roberts W., Naseem K.M. 2009. Nitric oxide inhibits platelet adhesion to collagen through cGMP-dependent and independent mechanisms: The potential role for S-nitrosylation. Platelets. 20, 478–486. https://doi.org/10.3109/09537100903159375
Dodge J., Mitchell C., Hanahan D. 1963. The preparation and chemical characteristics of hemoglobin free ghosts of erythrocytes. Arch. Biochem. Biophys. 100, 119–130.
Artmann G.M. 1995. Microscopic photometric quantification of stiffness and relaxation time of red blood cells in a flow chamber. Biorheology. 32, 553–570. https://doi.org/10.1016/0006-355X(95)00032-5
Cokelet G.B., Meiselman H.J. 1968. Rheological comparison of hemoglobin solutions and erythrocyte suspensions. Science. 162, 275–277.
Jaggar J.H., Li A., Parfenova H., Liu J., Umstot E.S., Dopico A.M., Leffler C.W. 2005. Heme is a carbon monoxide receptor for large-conductance Ca2+-activated K+ channels. Circ Res. 97, 805–812. https://doi.org/10.1161/01.RES.0000186180.47148.7b
Morita T., Perrella M.A., Lee M.E., Kourembanas S. 1995. Smooth muscle cell derived carbon monoxide is a regulator of vascular cGMP. Proc. Natl. Acad. Sci. USA. 92, 1475–1479. https://doi.org/10.1073/pnas.92.5.1475
Soboleva T., Berreau L.M. 2019. 3-Hydroxyflavones and 3-hydroxy-4-oxoquinolines as carbon monoxide-releasing molecules. Molecules. 24, pii: E1252. https://doi.org/10.3390/molecules24071252
Furchgott R.F., Jothianandan D. 1991. Endothelium-dependent and -independent vasodilatation involving cyclic GMP: Relaxation induced by nitric oxide, carbon monoxide and light. Blood Vessels. 28, 52–61. https://doi.org/10.1159/000158843
Leffler Ch.W., Parfenova H., Jonathan H. Jaggar J.H. 2011. Carbon monoxide as an endogenous vascular modulator. Am. J. Physiol. Heart Circ. Physiol. 301, H1–H11. https://doi.org/10.1152/ajpheart.00230.2011
Durante W. 2002. Carbon monoxide and bile pigments: Surprising mediators of vascular function. Vasc. Med. 7. 195–202. https://doi.org/10.1191/1358863x02vm424ra
Bełtowski J., Jamroz A., Borkowska E. 2004. Heme oxygenase and carbon monoxide in the physiology and pathology of the cardiovascular system. Postepy Hig. Med. Dosw. (Online). 58, 83–99.
Oonishi T., Sakashita K., Uyesaka N. 1997. Regulation of red blood cell filterability by Ca2+ influx and cAMP-mediated signaling pathways. Am. J. Physiol. Cell Physiol. 273, 1828–1834
Muravyov A.V., Tikhomirova I.A. 2012. Role Ca2+ in mechanisms of the red blood cells microrheological changes. Adv. Exp. Med. Biol. 740, 1017–1038. https://doi.org/10.1007/978-94-007-2888-2_47
Johnson F.K., Teran F.J., Prieto-Carrasquero M., Johnson R.A. 2002. Vascular effects of a heme oxygenase inhibitor are enhanced in the absence of nitric oxide. Am. J. Hypertens. 15, 1074–1080. https://doi.org/10.1016/S0895-7061(02)03062-5
Kampoli A., Tousoulis D., Tentolouris C., Stefanadis Ch. 2012. Novel agents targeting nitric oxide. Curr. Vasc. Pharmacol. 10, 61–76. https://doi.org/10.2174/157016112798829805
Муравьев А.В., Михайлова С.Г., Тихомирова И.А. 2014. Роль внутриклеточных сигнальных систем в изменениях микрореологических свойств эритроцитов. Биол. мембраны. 31, 270–277. https://doi.org/10.7868/S0233475514040069
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии