Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 4, стр. 292-305
Влияние окислительного стресса на транспорт субстрата Р-гликопротеина через клеточный монослой
А. В. Щулькин a, *, Ю. В. Абаленихина a, А. А. Сеидкулиева a, И. В. Черных a, Е. Н. Якушева a
a Рязанский государственный медицинский университет
им. акад. И.П. Павлова Минздрава России
390026 Рязань, Россия
* E-mail: alekseyshulkin@rambler.ru
Поступила в редакцию 13.01.2021
После доработки 24.03.2021
Принята к публикации 24.03.2021
Аннотация
Р-гликопротеин (Pgp) – ATP-зависимый трансмембранный белок, участвующий в эффлюксе липофильных веществ. Цель работы – оценить влияние окислительного стресса на транспорт субстрата Pgp через монослой клеток линии Caco-2, гиперэкспрессирующих данный белок-транспортер. Окислительный стресс моделировали инкубированием клеток с H2O2. Воздействие H2O2 в концентрациях 10 и 50 мкМ в течение 3 ч снижало активность (но не количество) Pgp при сохранении целостности клеточного монослоя. Увеличение концентрации прооксиданта до 100 мкМ снижало количество Pgp, нарушало целостность клеточного монослоя и повышало трансцеллюлярный и парацеллюлярный транспорт фексофенадина. При длительности воздействия 24 ч H2O2 в концентрациях 0.1–1 мкМ приводил к увеличению количества Pgp, опосредованному транскрипционным фактором Nrf2, но активность белка-транспортера оставалась неизменной. При концентрации прооксиданта 10 мкМ активность Pgp снижалась и повышалась проницаемость клеточной мембраны, а при концентрациях 50−100 мкМ происходило снижение количества (100 мкМ) и активности Pgp, повышение пара- и трансцелюллярной проницаемости клеточного монослоя для субстрата белка-транспортера – фексофенадина. Таким образом, Н2О2 повышает транспорт субстрата Pgp фексофенадина через клеточный монослой за счет ингибирования активности белка-транспортера, снижения его количества, а также нарушения целостности клеточной мембраны и межклеточных контактов. Клетки могут адаптироваться к данным воздействиям, повышая количество Pgp.
ВВЕДЕНИЕ
Транспорт веществ через клеточный монослой может происходить трансцеллюлярно (через билипидную мембрану клеток) или парацеллюлярно (через межклеточные щелевые контакты). Парацеллюлярный транспорт осуществляется только пассивной диффузией по градиенту концентрации, в то время как трансцеллюлярный транспорт может происходить путем пассивной и облегченной диффузии, активным транспортом и трансцитозом [1].
Одним из самых изученных трансмембранных белков, участвующих в транспорте веществ через билипидную мембрану клеток, является P-гликопротеин (Pgp, ABCB1-белок, MDR1-белок) [2].
Pgp – это ATP-зависимый эффлюксный белок-транспортер, который относится к суперсемейству ABC-транспортеров (ATР-binding cassette). Молекула Pgp состоит из двух одинаковых частей, каждая из которых включает большой гидрофобный трансмембранный домен и консервативный цитоплазматический домен с ATP-связывающим сайтом [3].
Pgp обладает широкой субстратной специфичностью. Его субстратами являются биогенные вещества – сфинголипиды, фактор активации тромбоцитов, короткоцепочечные фосфолипиды, цитокины [4], а также липофильные лекарственные средства – противоопухолевые препараты, иммунодепрессанты, стероидные и тиреоидные гормоны, антибиотики, ингибиторы ВИЧ-протеиназы, сердечные гликозиды, антикоагулянты и др. [5].
Являясь липофильными молекулами, субстраты Pgp легко растворяются в цитоплазматической мембране. Pgp, работая как “гидрофобный пылесос”, связывает данные вещества в липидном бислое и выводит их во внеклеточную среду. То есть транспортер способен перехватывать субстраты прежде, чем они смогут войти в цитозоль. Некоторые авторы считают, что Pgp может также работать как “флоппаза”, транспортируя вещества от цитоплазматического к внеклеточному монослою билипидной мембраны [4, 6].
Активность Pgp может изменяться под воздействием ряда факторов внешней и внутренней среды (гипоксия, рН, уровень гормонов) и различных веществ. Так, индукторы (рифампицин, карбамазепин) повышают активность белка-транспортера, а ингибиторы (верапамил, амиодарон) – ее снижают [5, 7].
Окислительный стресс – патологический процесс, развивающийся в результате дисбаланса между продукцией и утилизацией активных форм кислорода, когда образующиеся свободные радикалы не успевают инактивироваться из-за повышения их продукции или из-за снижения емкости антиоксидантной системы защиты [8].
При широком спектре патологий, таких как атеросклероз, сахарный диабет, воспалительные, инфекционные заболевания, снижение кровоснабжения, а также при воздействии ряда ксенобиотиков развивается окислительный стресс [8], что, в свою очередь, может оказывать воздействие на транспорт экзогенных и эндогенных веществ через биологические барьеры, представляющие, прежде всего, монослой клеток.
В ряде исследований было показано, что окислительный стресс повышает экспрессию и активность Pgp [9, 10].
С другой стороны, в исследованиях Basuroy и соавт. показано, что при окислительном стрессе происходит повреждение межклеточных контактов и повышение парацеллюлярного транспорта веществ [11]. Кроме того, активные формы кислорода при взаимодействии с цитоплазматической мембраной клеток вызывают активацию перекисного окисления липидов (ПОЛ), что приводит к образованию пор, повреждению билипидного слоя и в конечном счете повышению проницаемости цитоплазматической мембраны и трансцеллюлярного транспорта [12].
Таким образом, при развитии окислительного стресса может происходить как снижение проницаемости субстратов Pgp через клеточный монослой за счет повышения активности белка-транспортера, так и активация транспорта вследствие усиления парацеллюлярной и трансцеллюлярной диффузии.
Кроме того, исследований, в которых бы оценивалось влияние окислительного стресса одновременно на парацеллюлярный и трансцеллюлярный транспорт с участием белков-транспортеров не проводилось, что и явилось целью настоящего исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование клеток. Исследование выполнено на линии клеток аденокарциномы ободочной кишки человека (Caco-2) (ЦКП “Коллекция культур клеток позвоночных”, Санкт-Петербург, Россия). Клетки культивировали при 37°С и 5% содержании СО2 в инкубаторе WS-189C (World Scienc, Корея) в Дульбекко модифицированной среде Игла (DMEM) с высоким содержанием глюкозы (4500 мг/л) (Sigma-Aldrich, США), с добавлением L-глутамина (4 мМ) (Sigma-Aldrich), 15% бычьей сыворотки (Sigma-Aldrich), 100 ед/мл и 100 мкг/мл пенициллина и стрептомицина (Sigma-Aldrich), соответственно. Клетки культивировали в течение 21 сут, поскольку при данном сроке происходит их спонтанная дифференцировка в энтероцитоподобные клетки, гиперэкспрессирующие Pgp [13].
Окислительный стресс моделировали добавлением в культуральную среду пероксида водорода Н2О2 (Sigma-Aldrich) в конечных концентрациях 0.1, 0.5, 1, 5, 10, 50 и 100 мкМ и инкубацией в течение 3 и 24 ч. Контрольным клеткам в эквивалентном объеме в культуральную среду добавляли воду для инъекций. Каждый эксперимент был выполнен в 3 повторах.
Для исследования цитотоксичности пероксида водорода клетки высевали в 96-луночный планшет (Сorning, США), для изучения влияния пероксида водорода на количество Pgp и транскрипционного фактора Nrf2, концентрацию продуктов ПОЛ, карбонильных производных белков, содержание тиоловых SH-групп клетки культивировали в 6-луночных планшетах (Сorning), а для оценки действия прооксиданта на проницаемость клеточного монослоя для субстрата Pgp – в специальной трансвелл-системе (12 mm Transwell with 0.4 µm Pore Polycarbonate Membrane Insert, Sterile, Corning) [14].
Цитотоксический тест (МТТ-тест). Клетки высевали в 96-луночный планшет из расчета 104 клеток на каждую лунку и культивировали в течение 21 сут, затем добавляли питательную среду с Н2О2. После окончания инкубации в каждую лунку добавляли по 20 мкл 0.5% раствора бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил тетразолия (МТТ) и инкубировали в течение 2 ч, затем раствор МТТ удаляли и добавляли 200 мкл 1% раствора диметилсульфоксида (ПанЭко, Россия) [15]. Поглощение измеряли через 10 мин при 530 нм на спектрофотометре для планшетов Stat Fax 2100 (Awareness Technology, США).
Жизнеспособность клеток Сасо-2 в присутствии пероксида водорода рассчитывали по формуле:
Получение тотальных клеточных лизатов. После окончания экспозиции с пероксидом водорода клетки снимали с лунок раствором трипсин–EDTA (0.25% трипсина и 0.2% EDTA, Sigma-Aldrich). Клетки в расчете 2 × 106 трехкратно промывали фосфатным буфером рН 7.4 (ПанЭко) и лизировали трехкратным циклом замораживания–размораживания в 200 мкл фосфатного буфера при –20°С, далее полученный лизат использовали для иммуноферментного анализа.
Клетки из расчета 1 × 106 промывали изотоническим солевым раствором (Медпро, Россия) и ресуспендировали в 150 мкл ледяного буфера для лизиса (50 мМ трис-HCl, pH 7.4, 150 мМ KCl, 0.5% тритон X-100, смесь ингибиторов протеиназ (аминоэтилбензолсульфонилфторид гидрохлорид (AEBSF) 2 мМ; апротинин 0.3 мкМ; бестатин 130 мкМ; EDTA 1 мМ; эпоксисукциниллейцингуанидинобутиламид (Е-64) 14 мкМ; лейпептин 1 мкМ (Sigma-Aldrich)), встряхивали на шейкере и инкубировали на льду в течение 10 мин. Затем центрифугировали в течение 10 мин при 5000g (СМ-50, Eppendorf, Германия). Цитоплазматическую фракцию переносили в отдельные пробирки и использовали для определения концентрации продуктов ПОЛ (малоновый диальдегид (МДА) и 4-гидроксиолефины).
Получение клеточных мембран. Полученную аналогичным образом с других лунок суспензию клеток (3 × 106) использовали для выделения клеточных мембран методом дифференциального центрифугирования [16]. Клетки осаждали при 100g в течение 10 мин и ресуспендировали в буфере для лизиса с добавлением 0.25 М сахарозы, встряхивали на шейкере, инкубировали на льду в течение 20 мин. Полученные лизаты центрифугировали 10 мин при 800 g (СМ-50, Eppendorf, Германия) для осаждения не полностью разрушенных клеток и ядер. Надосадочную жидкость центрифугировали 15 мин при 14 000 g для удаления митохондрий, а затем полученный супернатант – при 20 000 g 30 мин для осаждения лизосом. Полученную цитоплазматическую фракцию центрифугировали при 100 000 g 35 мин (Avanti JXN-3, Beckman Coulter, США) для осаждения мембран, полученный осадок ресуспендировали в 200 мкл лизирующего буфера и использовали для оценки степени окисления белков по уровню SH-групп и карбонильных производных.
Определение количества Pgp и транскрипционного фактора Nrf2 в клетках линии Сасо-2 проводили методом гетерогенного иммуноферментного анализа с использованием коммерческих наборов (Human Permeability glycoprotein ELISA kit и Human Nuclear factor erythroid 2-related factor 2 ELISA kit, Blue gene, Китай). Светопоглощение измеряли при 450 нм на спектрофотометре для планшетов Stat Fax 2100 (Awareness Technology, США).
Количество белка в пробах анализировали методом Бредфорда (Pierce Coomassie Plus (Bradford) Assay Kit, ThermoFisher, США) [17].
Анализ содержания тиоловых SH-групп проводили по методу Эллмана с 5,5'-дитиобис(2-нитро)-бензоатом (DTNB) в неденатурирующих условиях [18]. Уровень SH-групп количественно оценивали по уровню 5-тио-2-нитробензойной кислоты при 412 нм на Stat Fax 2100 (Awareness Technology, США). Концентрацию SH-групп рассчитывали исходя из коэффициента экстинкции ε412 = 13.6 мМ–1 см–1 [19], полученные результаты выражали в мкмоль/мг белка.
Определение концентрации продуктов перекисного окисления липидов. В лизате клеток с помощью коммерческого набора определяли концентрацию продуктов ПОЛ (Elabscience, Китай). Метод определения продуктов ПОЛ – МДА и 4-гидроксиолефинов (4-гидрокси-2-ноненаля и 4-гидрокси-2-гексеналя) – основан на их взаимодействии с 1-метил-2-фенилиндолом с образованием стабильного хромофора, который имеет максимум поглощения при 586 нм (Awareness Technology, США) [20]. Полученные результаты выражали в мкмоль/мг белка.
Определение концентрации карбонильных производных белков проводили с помощью коммерческого набора (Sigma-Aldrich).
Метод определения продуктов карбонильных производных белков основан на их взаимодействии с 2,4-динитрофенилгидразином с образованием 2,4-динитрофенилгидразонов [21], которые регистрировали при длине волны 375 нм (Awareness Technology, США). Концентрацию карбонильных производных белков рассчитывали исходя из коэффициента экстинкции ε375 = = 22 мМ–1 см–1 и выражали в нмоль/мг белка. Анализ выполняли на спектрофотометре для планшетов Stat Fax 2100 (Awareness Technology, США).
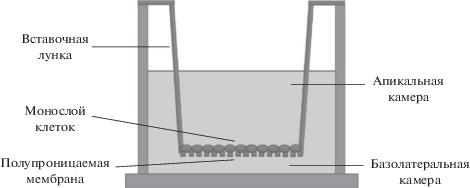
Оценка транспорта субстрата Pgp фексофенадина через монослой клеток линии Caco-2. В качестве субстрата белка-транспортера Pgp использовали фексофенадин (Sigma-Aldrich) [22]. Транспорт субстрата оценивали по его проникновению через монослой клеток линии Caco-2 в специальной трансвелл-системе (рис. 1). Трансвелл-система представлена двумя камерами: апикальной и базолатеральной. Дно апикальной камеры является полупроницаемой мембраной, на которую высевали клетки линии Caco-2 с плотностью 105/см2 и культивировали в течение 21 сут.
Рис. 1.
Структура трансвелл-системы. Трансвелл-система представлена двумя камерами: апикальной и базолатеральной. Дно апикальной камеры является полупроницаемой мембраной, на которую высеивали клетки линии Caco-2 с плотностью 105/см2.
Целостность клеточного монослоя оценивали по величине трансэпителиального сопротивления, которое определяли с помощью вольтметра Millicell ERS-2 (Millipore, США). При его значении выше 500 мОм см2 к клеткам добавляли тестируемые концентрации пероксида водорода в питательной среде. После окончания инкубации питательную среду заменяли на транспортную среду, представляющую собой раствор Хенкса (Sigma-Aldrich) с 25 мМ HEPES (Sigma-Aldrich) и 1% диметилсульфоксида (ПанЭко). Затем добавляли субстрат Pgp фексофенадин в апикальную камеру в концентрации 150 мкМ [23]. Через 1, 2 и 3 ч забирали образцы из базолатеральной камеры-реципиента для определения концентрации субстрата (a–b транспорт, обусловленный пассивной диффузией против работы транспортера).
В аналогичной трансвелл-системе оценивали транспорт фексофенадина из базолатеральной камеры в апикальную (b–a транспорт, обусловленный пассивной диффузией и работой Pgp). Для этого субстрат в той же концентрации добавляли в базолатеральную камеру, а затем через 1, 2 и 3 ч забирали образцы из апикальной камеры для определения концентрации фексофенадина.
Транспорт маркерного субстрата рассчитывали по формуле [24]:
где Рарр – коэффициент кажущейся проницаемости (apparent permeability coefficient, см/с), dQ/dt – изменение количества субстрата в камере-реципиенте за время инкубации (мкМ мл/с), A – площадь полупроницаемой мембраны лунки в трансвелл-системе (см2), C0 – начальная концентрация субстрата в камере-доноре (мкМ).Концентрации фексофенадина в транспортной среде определяли методом высокоэффективной жидкостной хроматографии с УФ-детектированием при длине волны 220 нм. Исследование выполнялось на хроматографе (Стайер, Россия) по оригинальной методике [25]. Полученную пробу транспортной среды, содержащую фексофенадин, в количестве 50 мкл, разводили в 150 мкл подвижной фазы и 100 мкл полученного раствора вводили в хроматограф.
При анализе использовали хроматографическую колонку (Phenomenex Synergi 4u Polar-RP 80A, 250 × 4.6, США) с зернением 4 мкм. Температура разделения: 45°С, скорость потока: 1 мл/мин, состав подвижной фазы: 128 мл ацетонитрила (PanReac AppliChem, Испания), 267.4 мл воды деионизированной, 6.33 мл кислоты уксусной ледяной (PanReac AppliChem), с добавлением триэтиламина (PanReac AppliChem) до pH 6.7. Время удерживания фексофенадина в данных условиях составляло 12.8 мин. Количественное определение проводили методом абсолютной калибровки по площади пиков. Аналитический диапазон методики составлял 1.2–57.4 мкМ.
Оценка плотности межклеточных контактов. Влияние H2O2 на плотность межклеточных контактов клеток оценивали по величине трансэпителиального сопротивления (TEER), которое измеряли с помощью вольтметра Millicell ERS-2 (Millipore, США). Показано, что чем выше плотность межклеточных контактов, тем выше трансэпителиальное сопротивление [26].
Измеряли данный показатель до начала инкубации монослоя клеток с пероксидом водорода и по окончании экспозиции, то есть непосредственно перед выполнением транспортных экспериментов.
Статистический анализ. Полученные результаты анализировали с помощью программ StatSoft Statistica 13.0 (США, номер лицензии JPZ811I521319AR25ACD-W) и Microsoft Excel for MAC ver. 16.24 (ID02984-001-000001). Результаты представлены в виде M ± SD. Для оценки статистической значимости различий использовали дисперсионный анализ ANOVA, попарные сравнения выполняли с помощью критерия Ньюмена–Кейлса. Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ
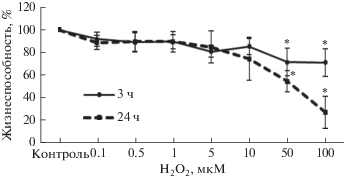
Цитотоксическое и прооксидантное действие H2O2 на клетки линии Caco-2. Цитотоксическое действие H2O2 оценивалось в ходе МТТ-теста. В контрольной группе жизнеспособность клеток составила 100% и статистически значимо не отличалась от значений в группе клеток, подвергавшихся воздействию пероксида водорода в концентрациях 0.1–10 мкМ в течение 3 и 24 ч. При инкубации клеток с H2O2 в течение 3 и 24 ч при концентрации прооксиданта 50 мкМ жизнеспособность клеток снижалась до 71.3 ± 12.1% (р = = 0.01) и 54.1 ± 9.5% (р = 0.001), а при 100 мкМ – до 70.9 ± 12.2% (р = 0.006) и 26.8 ± 14.3% (р = = 0.0003), соответственно (рис. 2).
Рис. 2.
Изменение жизнеспособности клеток линии Сасо-2 в зависимости от концентрации пероксида водорода при инкубации 3 и 24 ч, (M ± SD, n = 3). Жизнеспособность клеток оценивали с помощью МТТ-теста. * – достоверное отличие от контроля, р ≤ 0.01.
Оценку окислительного повреждения белков клеток линии Caco-2 под действием H2O2 проводили по анализу содержания SH-групп и карбонильных производных белков в мембранной фракции клеточного лизата, а повреждения липидов – по концентрации продуктов ПОЛ в тотальном лизате клеток.
Концентрация SH-групп в мембранах клеток при воздействии пероксида водорода в концентрациях 0.1−5 мкМ в течение 3 ч статистически значимо не изменялась по сравнению с показателями контроля, а в концентрациях 10 мкМ, 50 мкМ и 100 мкМ снижалась на 40.8% (р = 0.039), 56.7% (р = 0.016) и 74.2% (р = 0.007), соответственно (рис. 3).
Рис. 3.
Изменение концентрации белковых SH-групп мембран клеток линии Сасо-2 при индукции окислительного стресса пероксидом водорода в концентрациях 0.1−100 мкМ в течение 3 и 24 ч (M ± SD, n = 3). Количественное определение тиоловых SH-групп проводили фотометрическим методом. * – достоверное отличие от контроля, р < 0.05.
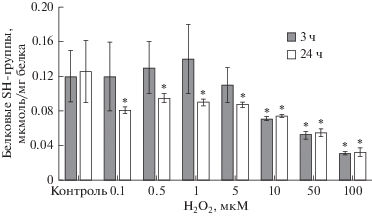
При инкубировании клеток Caco-2 с пероксидом водорода в течение 24 ч во всех тестируемых концентрациях 0.1−100 мкМ уровень белковых SH-групп мембран достоверно снижался с максимальными изменениями при концентрации 100 мкМ (на 74.4% ниже значений контроля, р = = 0.01) (рис. 3).
При воздействии Н2О2 на клетки линии Caco-2 в течение 3 ч уровень карбонильных производных белков в мембране клеток статистически значимо не изменялся в диапазоне концентраций от 0.1 до 10 мкМ и повышался в концентрации 50 мкМ на 87.3% (р = 0.005), а в концентрации 100 мкМ – на 130.4% (р = 0.001) по сравнению с показателями контроля (рис. 4).
Рис. 4.
Изменение концентрации карбонильных производных белков мембран клеток линии Сасо-2 при индукции окислительного стресса пероксидом водорода в концентрациях 0.1−100 мкМ в течение 3 и 24 ч (M ± SD, n = 3). Количественное определение карбонилированных белков проводили фотометрическим методом. * – достоверное отличие от контроля, р < 0.05.
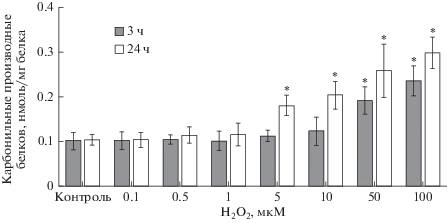
При увеличении длительности воздействия прооксиданта до 24 ч уровень карбонильных производных белков увеличивался по сравнению со значениями контроля при концентрациях пероксида водорода 5, 10, 50 и 100 мкМ на 74.8% (р = = 0.01), 97.1% (р = 0.01), 150.5% (p = 0.001) и 189.3% (р = 0.0005), соответственно (рис. 4).
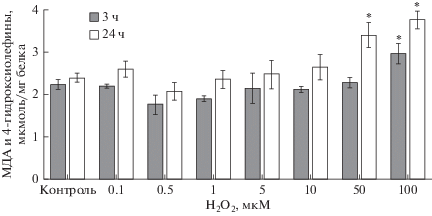
Воздействие пероксида водорода на клетки линии Caco-2 в течение 3 ч приводило к увеличению уровня продуктов ПОЛ лишь в концентрации 100 мкМ на 35.7% (р = 0.04) по сравнению с контролем. Увеличение длительности экспозиции Н2О2 до 24 ч сопровождалось повышением содержания МДА и 4-гидроксиолефинов уже при двух концентрациях прооксиданта: 50 мкМ – на 42.1% (p = 0.006) и 100 мкМ – на 57.1% (p = = 0.0007), соответственно (рис. 5).
Рис. 5.
Изменение концентрации продуктов перекисного окисления липидов (МДА и 4-гидроксиолефинов) в лизате клеток линии Сасо-2 при индукции окислительного стресса пероксидом водорода в концентрациях 0.1−100 мкМ в течение 3 и 24 ч (M ± SD, n = 3). Количественное определение продуктов ПОЛ проводили фотометрическим методом. * – достоверное отличие от контроля, р < 0.05.
Таким образом, цитотоксичными для клеток линии Caco-2 являются концентрации Н2О2 50 и 100 мкМ при длительности воздействия 3 и 24 ч. При этом окислительные изменения в белках наблюдаются и при более низких концентрациях прооксиданта (10 мкМ при инкубации 3 ч, 0.1–10 мкМ при 24-часом воздействии).
Полученные результаты согласуются с данными литературы. Так, в исследованиях на культуре клеток фибробластов установлено, что пероксид водорода в концентрации 50 мкМ запускает апоптоз, а выше 100 мкМ – некроз [27], аналогичные результаты были описаны для клеток линии 293Т (клеточная линия, полученная из эмбриональных почек человека) и клеток миокарда при сроке инкубации от 6 до 36 ч [28]. Следовательно, полученные результаты указывают, что концентрации Н2О2 0.1–10 мкМ являются физиологическими и имеют регуляторное значение.
Влияние H2O2 на количество Pgp в клетках линии Caco-2. Количество Pgp в лизате клеток линии Caco-2, оцененное методом иммуноферментного анализа, составило 118.1 ± 10.6 нг/мг белка.
Количество Рgp статистически значимо не изменялось при воздействии пероксида водорода в концентрациях 0.1−50 мкМ в течение 3 ч, однако при максимальной концентрации Н2О2 100 мкМ статистически значимо снижалось на 55.3% (p = = 0.003) по сравнению с контролем (рис. 6).
Рис. 6.
Изменение количества Рgp в лизате клеток линии Сасо-2 при индукции окислительного стресса пероксидом водорода в концентрациях 0.1−100 мкМ в течение 3 и 24 ч, (M ± SD, n = 3). Количество Pgp определяли с помощью ИФА. * – достоверное отличие от контроля, р < 0.05.
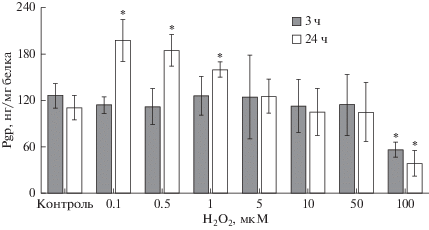
При инкубации клеток Caco-2 с пероксидом водорода в течение 24 ч количество белка-транспортера повышалось при концентрациях прооксиданта 0.1 мкМ, 0.5 мкМ и 1 мкМ на 78.9% (p = 0.01), 67.1% (p = 0.02) и 44.6% (p = 0.04), соответственно, по сравнению с контролем. В концентрациях Н2О2 5, 10 и 50 мкМ уровень Pgp не отличался от контроля (p > 0.05), а в максимальной концентрации 100 мкМ его уровень достоверно снижался на 65.1% (p = 0.02) (рис. 6).
Влияние H2O2 на количество Nrf2. Ранее нами было показано, что повышение количества Pgp при развитии окислительного стресса может быть связано с активацией транскрипционного фактора Nrf2 (Nuclear erythroid 2-related factor) [29]. Поэтому в данном исследовании также был оценен уровень Nrf2 и его взаимосвязь с количеством белка-транспортера.
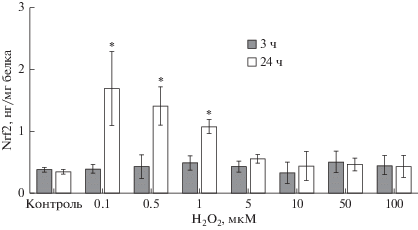
При воздействии пероксида водорода во всех протестированных концентрациях в течение 3 ч на клетки линии Сасо-2 количество транскрипционного фактора Nrf2 не изменялось (рис. 7). Увеличение срока инкубации до 24 ч способствовало повышению количества Nrf2 при концентрациях Н2О2 0.1, 0.5 и 1 мкМ на 394.1% (p = = 0.006), 311.7% (p = 0.01) и 214.7% (p = 0.03), соответственно (рис. 7).
Рис. 7.
Изменение количества Nrf2 в лизате клеток линии Сасо-2 при индукции окислительного стресса пероксидом водорода в концентрациях 0.1−100 мкМ в течение 3 и 24 ч, (M ± SD, n = 3). Количество Nrf2 определяли с помощью ИФА. * – достоверное отличие от контроля, р < 0.05.
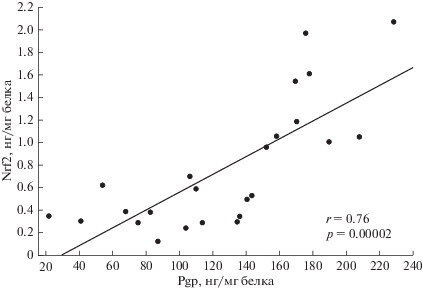
При проведении корреляционного анализа была выявлена прямая корреляционная зависимость между количеством Nrf2 и Pgp при длительности воздействия пероксида водорода 24 ч (коэффициент корреляции Пирсона r = 0.76, p = = 0.00002) (рис. 8).
Рис. 8.
Корреляционная зависимость между количеством Nrf2 (нг/мг белка) и Pgp (нг/мг белка) при индукции окислительного стресса пероксидом водорода в концентрациях 0.1–100 мкМ в течение 24 ч.
Таким образом, пероксид водорода в концентрациях 0.1–1 мкМ повышает уровень транскрипционного фактора Nrf2, который в свою очередь увеличивает количество белка-транспортера Pgp. Повышение концентрации H2O2 выше 5 мкМ нивелирует индуцирующее действие прооксиданта как на количество Nrf2, так и на уровень Pgp.
Влияние H2O2 на плотность межклеточных контактов клеток линии Caco-2. Влияние H2O2 на плотность межклеточных контактов оценивали по величине трансэпителиального сопротивления монослоя клеток. До начала экспериментов сопротивление клеточного монослоя составляло 775.3 ± 34.7 мОм см2.
При экспозиции 3 ч пероксид водорода в концентрациях 0.1−50 мкМ достоверно не влиял на значение трансэпителиального сопротивления, данный показатель достоверно не отличался от значений контроля (p > 0.05). Однако в концентрации 100 мкМ прооксидант вызывал снижение трансэпителиального сопротивления на 62.5% (p = 0.0001) (рис. 9).
Рис. 9.
Значения трансэпителиального сопротивления (TEER) монослоя клеток линии Сасо-2 (мОм см2) при воздействии пероксида водорода в диапазоне концентраций 0.1−100 мкМ в течение 3 и 24 ч, (M ± SD, n = 3). Трансэпителиальное сопротивление определяли с помощью вольтметра. * – достоверное отличие от контроля, р < 0.01.
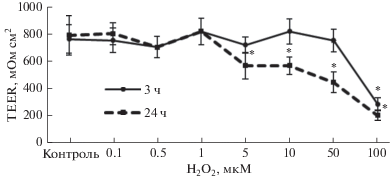
При инкубации в течение 24 ч H2O2 в концентрациях 0.1−1 мкМ достоверно не влиял на значение трансэпителиального сопротивления, а в концентрациях 5, 10, 50 и 100 мкМ вызывал снижение данного показателя на 28.4% (p = 0.008), 28.2% (p = 0.003), 43.8% (p = 0.0003) и 74.5% (p = = 0.0002), соответственно (рис. 9).
Таким образом, полученные результаты свидетельствуют о том, что плотность межклеточных контактов уменьшается при воздействии пероксида водорода в концентрации 100 мкМ при экспозиции в течение 3 ч и в концентрациях 5− 100 мкМ при 24-часовой экспозиции.
Влияние H2O2 на транспорт субстрата Pgp фексофенадина через монослой клеток линии Caco-2. Коэффициент кажущейся проницаемости Papp b–a фексофенадина, характеризующий его транспорт из базолатеральной камеры в апикальную за счет пассивной диффузии и работы Pgp, в среднем составил 3.08 × 10–6 ± 0.94 × 10–6 см/с, а коэффициент кажущейся проницаемости Papp a–b, оценивающий транспорт из апикальной камеры в базолатеральную за счет пассивной диффузии против работы Pgp, равнялся 1.13 × 10–6 ± 0.6 × × 10–6 см/с Представленные данные показывают, что транспорт, обусловленный Pgp, почти в 3 раза интенсивнее транспорта, происходящего за счет пассивной диффузии против функционирования белка-транспортера (p = 0.004) (табл. 1).
Таблица 1.
Влияние H2O2 в диапазоне концентраций 0.1−100 мкМ в течение 3 и 24 ч на транспорт субстрата Pgp (фексофенадина) через билипидную мембрану клеток Caco-2 (M ± SD, n = 3)
| Н2О2, мкМ | Papp b–a, ×10–6 см/с |
Papp a–b, ×10–6 см/с |
Papp b–a, ×10–6 см/с |
Papp a–b, ×10–6 см/с |
|---|---|---|---|---|
| 3 ч | 24 ч | |||
| Контроль | 3.09 ± 0.13 | 1.17 ± 0.15 | 3.06 ± 0.35 | 1.03 ± 0.34 |
| 0.1 | 3.08 ± 0.11 | 0.94 ± 0.16 | 2.96 ± 0.25 | 0.95 ± 0.11 |
| 0.5 | 2.90 ± 0.59 | 1.17 ± 0.03 | 3.65 ± 0.76 | 1.18 ± 0.08 |
| 1 | 2.79 ± 0.42 | 1.16 ± 0.09 | 3.59 ± 0.61 | 1.36 ± 0.43 |
| 5 | 2.52 ± 0.43 | 1.26 ± 0.06 | 2.85 ± 0.76 | 1.19 ± 0.05 |
| 10 | 1.35 ± 0.13* | 1.76 ± 0.18* | 3.82 ± 0.65 | 2.53 ± 0.39* |
| 50 | 2.52 ± 0.16* | 2.99 ± 0.65* | 5.16 ± 0.47* | 5.52 ± 0.38* |
| 100 | 4.92 ± 0.96** | 5.15 ± 1.81** | 7.81 ± 0.18* | 8.95 ± 1.05* |
Примечание. Клетки линии Сасо-2 после экспозиции с пероксидом водорода (3 и 24 ч) инкубировали в транспортной среде с добавлением фексофенадина (150 мкМ) в апикальную и базолатеральную камеры соответствующих трансвелл-систем. Забирали образцы через 1, 2 и 3 ч из противоположной камеры-реципиента: базолатеральной (a–b транспорт) и из апикальной камеры (b–a транспорт) для определения концентрации фексофенадина. Концентрацию фексофенадина в транспортной среде определяли методом высокоэффективной жидкостной хроматографии с УФ-детектированием. * − Достоверное отличие от контроля, р ≤ 0.01, ** − достоверное отличие от контроля, р < 0.05.
При воздействии пероксида водорода на клетки линии Caco-2 в течение 3 ч были получены следующие результаты: при концентрациях H2O2 0.1−5 мкМ коэффициенты кажущейся проницаемости Papp b–a фексофенадина и Papp a–b достоверно не отличались от показателей контроля. В концентрации 10 мкМ пероксид водорода вызывал снижение коэффициента кажущейся проницаемости Papp b–a на 56.3% (p = 0.0004) и повышение коэффициента кажущейся проницаемости Papp a–b на 50.4% (p = 0.01). Аналогичным образом при концентрации 50 мкМ пероксид водорода вызывал снижение коэффициента кажущейся проницаемости Papp b–a на 18.4% (p = = 0.01) и повышение коэффициента кажущейся проницаемости Papp a–b на 155.6% (p = 0.01). При этом стоит отметить, что при данных концентрациях (10 и 50 мкМ) прооксиданта значения коэффициентов кажущейся проницаемости Papp b–a и Papp a–b фексофенадина выравнивались и достоверно между собой не различались. Полученные результаты свидетельствуют о снижении активности Pgp при воздействии пероксида водорода в указанных концентрациях.
При увеличении концентрации прооксиданта до 100 мкМ происходило повышение как коэффициента кажущейся проницаемости Papp b–a на 59.2% (p = 0.03), так и коэффициента кажущейся проницаемости Papp a–b – на 340.2% (p = = 0.02). Данные показатели между собой также не различались. Выявленные изменения свидетельствуют об усилении транспорта фексофенадина через монослой клеток линии Сасо-2 как в эффлюксном направлении функционирования Pgp, так и в противоположном, то есть о повышении проницаемости клеточного монослоя.
При воздействии пероксида водорода на клетки линии Caco-2 в течение 24 ч были получены следующие результаты: H2O2 в концентрациях 0.1−5 мкМ достоверно не влиял на коэффициенты кажущейся проницаемости Papp b–a и Papp a–b фексофенадина, их значения достоверно не отличались от показателей контроля.
В концентрации 10 мкМ пероксид водорода повышал коэффициент кажущейся проницаемости Papp a–b фексофенадина на 145.6% (p = 0.04) по сравнению с контролем и не влиял на коэффициент кажущейся проницаемости Papp b–a, что свидетельствует о снижении активности Pgp и повышении проницаемости клеточного монослоя.
Увеличение концентрации H2O2 до 50 и 100 мкМ вызывало повышение коэффициента кажущейся проницаемости Papp b–a на 68.6% (p = 0.006) и 155.2% (p = 0.0003) и повышение коэффициента кажущейся проницаемости Papp a–b на 435.9% (p = 0.0003) и 768.9% (p = 0.0005), соответственно (табл. 1), что является следствием дальнейшего повышения проницаемости клеточного монослоя в обоих направлениях.
Таким образом, при воздействии Н2О2 в течение 3 ч в концентрациях выше 10 мкМ происходит снижение активности Pgp, а в концентрации 100 мкМ также повышение проницаемости клеточного монослоя в обоих направлениях для субстрата белка-транспортера, как трансцеллюлярно, так и парацеллюлярно.
Увеличение длительности экспозиции до 24 ч не только снижает активность Pgp, но и повышает проницаемость клеточного монослоя для субстрата Pgp уже с концентрации прооксиданта 10 мкМ.
ОБСУЖДЕНИЕ
Клетки линии Caco-2 представляют собой клетки аденокарциномы толстого кишечника человека. При культивировании данных клеток в течение 21 сут происходит их спонтанная дифференцировка в столбчатые поляризованные эпителиальные клетки, подобные энтероцитам тонкого кишечника [30]. Исторически клетки линии Caco-2 после их спонтанной дифференцировки используют для изучения абсорбции лекарственных веществ, а также оценки проникновения веществ через билипидную мембрану [31]. При этом особенностью образуемого монослоя клеток линии Caco-2 является то, что на нем можно изучать все виды транспорта веществ: парацелюллярный и трансцеллюлярный (пассивная диффузия, облегченная диффузия, активный транспорт, в том числе с помощью белка-транспортера Pgp), трансцитоз [32].
В настоящем исследовании в опытах in vitro оценивалось влияние окислительного стресса на транспорт субстрата белка-транспортера Pgp фексофенадина через монослой клеток линии Caco-2 после их спонтанной дифференцировки.
Окислительный стресс моделировали инкубированием клеток с H2O2 в диапазоне концентрации 0.1−100 мкМ в течение 3 и 24 ч. Показано, что H2O2 может непосредственно контактировать с цитоплазматической мембраной и межклеточными контактами и проникать внутрь клетки путем пассивной диффузии [33] или через аквапорины [34].
В ходе реакции Фентона и Габера-Вейса из пероксида водорода образуется гидропероксидный радикал ${\text{H}}{{{\text{O}}}^{\centerdot }}$, который вызывает повреждение белков, липидов и нуклеиновых кислот [35].
В ходе выполнения настоящего исследования нами было показано, что воздействие пероксида водорода в течение 3 ч на клетки линии Caco-2 в концентрациях 0.1–5 мкМ не вызывало окислительного повреждения биомакромолекул, существенно не влияло на функционирование белка-транспортера Pgp и на проницаемость клеточного монослоя для его субстрата фексофенадина. Повышение концентрации H2O2 до 10–50 мкМ сопровождалось повреждением белков, снижением активности Pgp (скорее всего вследствие окисления SH-групп в его молекуле, доля которых составляет примерно 1% [36]), при этом количество белка-транспортера не изменялось, также как сохранялась целостность клеточного монослоя. Увеличение концентрации прооксиданта до 100 мкМ приводило к усилению окислительного стресса, повреждению белков, липидов, снижению количества Pgp, его активности, повышению парацелюллярного и трансцелюллярного транспорта фексофенадина через клеточный монослой и снижению жизнеспособности клеток.
При инкубировании клеток линии Caco-2 с пероксидом водорода в течение 24 ч было показано, что H2O2 уже в концентрациях 0.1−1 мкМ снижал содержание белковых SH-групп. Однако при этом происходило повышение количества Pgp, что, видимо, предотвращало снижение активности белка-транспортера (данный показатель достоверно не отличался от контроля), несмотря на окисление SH-групп в его молекуле.
Увеличение концентрации H2O2 до 5−10 мкМ сопровождалось усилением окислительного стресса, что, видимо, приводило к снижению уровня Pgp до величин нормы и уменьшению по сравнению с контролем активности белка транспортера при концентрации прооксиданта 10 мкМ.
В концентрациях Н2О2 50−100 мкМ наблюдалось дальнейшее усиление окислительного стресса, повреждение как белков, так и липидов, снижение количества Pgp при концентрации прооксиданта 100 мкМ, его активности, повышение парацелюллярного и трансцелюллярного транспорта фексофенадина через клеточный монослой и снижение жизнеспособности клеток.
Таким образом, при воздействии H2O2 на транспорт субстрата Pgp через монослой клеток линии Caco-2 в течение 3 и 24 ч отмечалась аналогичная картина: сначала снижается транспорт фексофенадина, опосредованный Pgp, а затем при повышении концентрации прооксиданта до 50–100 мкМ нарушается целостность клеточного монослоя и растет транспорт субстрата за счет пассивной диффузии пара- и трансцеллюлярно.
Однако есть и ряд отличий. При длительности воздействия пероксида водорода 24 ч описанные выше изменения начинаются при более низких концентрациях прооксиданта. С другой стороны, при увеличении срока экспозиции до 24 ч клетки начинают адаптироваться к возникшим патологическим условиям, повышая количество белка-транспортера Pgp при концентрации H2O2 – 0.1–1 мкМ.
Полученные результаты согласуются с данными литературы. Так, в исследовании Ziemann и соавт. на культуре крысиных гепатоцитов было показано, что H2O2 в концентрации 0.5−1 мМ при инкубации в течение 72 ч вызывал повышение количества Pgp, экспрессии его гена и активности белка-транспортера [9]. В работе Felix и Barrand [10] выявлено, что H2O2 в концентрации до 500 мкМ при воздействии в течение 48 ч на первичную культуру эндотелия крыс повышал экспрессию Pgp и в меньшей степени влиял на активность белка-транспортера.
В то же время Hoshi и соавт. установлено, что обработка клеток hCMEC/D3 (модель гематоэнцефалического барьера in vitro) H2O2 в концентрации 0.5−5 мМ при экспозиции 20 мин снижал транспортную активность Pgp [37], что согласуется с нашими результатами при длительности воздействия прооксиданта 3 ч.
В отличие от ряда процитированных работ в нашем исследовании, несмотря на повышение количества Pgp при воздействии пероксида водорода в течение 24 ч, активность белка-транспортера не изменялась. Данные различия могут быть связаны с разной длительностью экспозиции, концентрацией Н2О2 и типами клеток, используемых в исследованиях, а также методиками оценки активности Pgp, учетом или не учетом вклада парацеллюлярного транспорта в перенос субстрата, что в цитируемых работах не изучалось.
В ограничении парацеллюлярного транспорта наибольшее значение имеют плотные соединения (tight junction). Три типа трансмембранных белков: окклюдин, клаудины и zonula occludens (ZO, относящиеся к семейству каркасных белков мембраносвязанных гуанилаткиназ) были идентифицированы в области плотных соединений [38]. В исследовании на клетках линии Caco-2 было показано, что окислительный стресс вызывал повышение парацеллюлярного транспорта, что было связано с нарушением плотных соединений из-за фосфорилирования тирозина окклюдина, ZO-1, E-кадгерина и бета-катенина [39], что согласуется с нашими результатами и объясняет увеличение транспорта фексофенадина через клеточный монослой в обоих направлениях при увеличении концентрации Н2О2 и времени его экспозиции.
В рамках настоящего исследования также был изучен возможный механизм увеличения количества белка-транспортера в условиях окислительного стресса. В частности, было показано, что повышение уровня Pgp прямопропорционально повышению количества транскрипционного фактора Nrf2.
Nrf2 – редокс-чувствительный транскрипционный фактор. Его экспрессия повышается при развитии окислительного стресса и направлена на защиту клетки от воздействия свободных радикалов [40]. В условиях нормы данный транскрипционный фактор находится в комплексе с белком-репрессором Keap 1, который, с одной стороны, способствует убиквитированию и протеасомной деградации Nrf2, а с другой – предотвращает его проникновение из цитоплазмы в ядро.
После активации комплекс Keap1–Nrf2 диссоциирует, и Nrf2 транслоцируется в ядро, где связывается с ARE (antioxidant-response elements) и активирует транскрипцию защитных ферментов [41].
Полученные результаты могут иметь важное практическое значение. Проникновение веществ через монослой клеток линии Caco-2 является классической модельной системой абсорбции веществ в тонком кишечнике [31, 32]. Выявленное в нашем исследовании снижение активности Pgp и повышение проницаемости монослоя клеток для субстрата белка-транспортера при воздействии пероксида водорода может свидетельствовать о повышении абсорбции веществ-субстратов белка-транспортера в тонком кишечнике при развитии заболеваний, сопровождающихся окислительным стрессом, что в свою очередь может приводить к увеличению их концентрации в плазме крови и сопровождаться развитием побочных эффектов фармакотерапии.
ЗАКЛЮЧЕНИЕ
Таким образом, нами показано, что кратковременное воздействие Н2О2 в течение 3 ч в концентрации 10–50 мкМ снижает активность (но не количество) Pgp и, соответственно, транспорт его субстрата, опосредованный данным белком-транспортером, при сохранении целостности клеточного монослоя. Увеличение концентрации прооксиданта до 100 мкМ приводит к снижению количества Pgp и нарушению целостности клеточного монослоя, что приводит к повышению трансцеллюлярного и парацеллюлярного транспорта фексофенадина.
При инкубировании клеток линии Caco-2 с пероксидом водорода в течение 24 ч в концентрациях 0.1–1 мкМ повышается количество Pgp, опосредованное транскрипционным фактором Nrf2, но активность белка-транспортера остается неизменной. В концентрации прооксиданта 10 мкМ снижается активность Pgp и повышается проницаемость клеточной мембраны, а в концентрациях 50−100 мкМ происходит снижение количества (100 мкМ) и активности Pgp и повышение пара- и трансцелюллярной проницаемости клеточного монослоя для субстрата Pgp фексофенадина.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Исследование выполнено при финансовой поддержке гранта Президента Российской Федерации для государственной поддержки молодых российских ученых – кандидатов наук МК-1856.2020.7.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Maiti S. 2017. Nanometric biopolymer devices for oral delivery of macromolecules with clinical significance. Multifunctional Systems for Combined Delivery, Biosensing and Diagnostics. 6, 109–138. https://doi.org/10.1016/B978-0-323-52725-5.00006-X
Subramanian N., Condic-Jurkic K., O’Mara M.L. 2016. Structural and dynamic perspectives on the promiscuous transport activity of P-glycoprotein. Neurochem. Int. 98, 146–152. https://doi.org/10.1016/j.neuint.2016.05.005
Esser L., Zhou F., Pluchino K.M., Shiloach J., Ma J., Tang W.K., Gutierrez C., Zhang A., Shukla S., Madigan J.P., Zhou T., Kwong P.D., Ambudkar S.V., Gottesman M.M., Xia D. 2017. Structures of the multidrug transporter P-glycoprotein reveal asymmetric ATP binding and the mechanism of polyspecificity. J. Biol. Chem. 292, 446–461. https://doi.org/10.1074/jbc.M116.755884
Якушева Е.Н., Титов Д.С., Правкин С.К. 2017. Локализация, модели функционирования и физиологические функции гликопротеина-Р. Успехи физиол. наук. 48 (4), 70–87.
Кукес В.Г., Грачев С.В., Сычев Д.А., Раменская Г.В. 2008. Метаболизм лекарственных средств. Научные основы персонализированной медицины: руководство для врачей. М.: Гэотар-Медиа, 2008. 304 с.
Aller S.G., Yu J., Ward A., Weng Y., Chittaboina S., Zhuo R., Harrell P.M., Trinh Y.T., Zhang Q., Urbatsch I.L., Chang G. 2009. Structure of P-glycoprotein reveals a molecular basis for poly-specific drug binding. Science. 323 (5922), 1718–1722. https://doi.org/10.1126/science.1168750.
Якушева Е.Н., Щулькин А.В., Попова Н.М., Черных И.В., Титов Д.С. 2014. Структура, функции гликопртеина-Р и его значение для рациональной фармакотерапии. Обзоры по клинической фармакологии и лекарственной терапии. 12 (2), 3–11.
Halliwell B., Gutteridge J.M.C. 2015. Free radicals in biology and medicine. 5th Edition. New York: Oxford University Press. 905 p. https://doi.org/10.1093/acprof:oso/9780198717478. 001.0001
Ziemann C., Bürkle A., Kahl G.F., Hirsch-Ernst K.I. 1999. Reactive oxygen species participate in mdr1b mRNA and P-glycoprotein overexpression in primary rat hepatocyte cultures. Carcinogenesis. 20 (3), 407–414. https://doi.org/10.1093/carcin/20.3.407
Felix R.A., Barrand M.A. 2002. P-glycoprotein expression in rat brain endothelial cells: evidence for regulation by transient oxidative stress. J. Neurochem. 80 (1), 64–72. https://doi.org/10.1046/j.0022-3042.2001.00660.x
Basuroy S., Sheth P., Kuppuswamy D., Balasubramanian S., Ray R.M., Rao R.K. 2003. Expression of kinase-inactive c-Src delays oxidative stress-induced disassembly and accelerates calcium-mediated reassembly of tight junctions in the Caco-2 cell monolayer. J. Biol. Chem. 278 (14), 11916–11924. https://doi.org/10.1074/jbc.M211710200
Van der Paal J., Neyts E.C., Verlackt C.C.W., Bogaerts A. 2016. Effect of lipid peroxidation on membrane permeability of cancer and normal cells subjected to oxidative stress, Chem. Sci. 7, 489–498. https://doi.org/10.1039/C5SC02311D
Hilgers A.R., Conradi R.A., Burton P.S. 1990. Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa. Pharmac. Res. 7 (9), 902–910. http://dx.doi.org/10.1023/A:1015937605100
Якушева Е.Н., Щулькин А.В., Черных И.В., Попова Н.М., Котлярова А.А., Слепнев А.А. 2019. Метод анализа принадлежности лекарственных веществ к субстратам и ингибиторам белка-транспортера гликопротеина-Р in vitro. Обзоры по клинической фармакологии и лекарственной терапии. 17 (1), 71–78. https://doi.org/10.7816/RCF17171-78
Tolosa L., Donato M.T., Gómez-Lechón M. J. 2015 general cytotoxicity assessment by means of the MTT assay. Methods Mol. Biol. 1250, 333–348. https://doi.org/10.1007/978-1-4939-2074-7_26
Wibo M. 1976. Cell Fractionation by Centrifugation Methods. In: Eukaryotic Cell Function and Growth. Eds Dumont J.E., Brown B.L., Marshall N.J. Boston: Springer, p. 1–17. https://doi.org/10.1007/978-1-4613-4322-6_1
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 7 (72), 248–254. https://doi.org/10.1006/abio.1976.9999
Boschi-Muller S., Azza S., Sanglier-Cianferani S., Talfournier F., Dorsselear A.V., Branlant G. 2000. A sulfenic acid enzyme intermediate is involved in the catalytic mechanism of peptide methionine sulfoxide reductase from Escherichia coli. J. Biol. Chem. 275, 35 908–35 913. https://doi.org/10.1074/jbc.M006137200
Ellman L.G. 1959 Tissue sulfhydryl groups. Arch. Biochem. Biophys. 82, 70–77. https://doi.org/10.1016/0003-9861(59)90090-6
Gérard-Monnier D., Erdelmeier I., Régnard K., Moze-Henry N., Yadan J.C., Chaudière J. 1998. Reactions of 1-methyl-2-phenylindole with malondialdehyde and 4-hydroxyalkenals. Analytical applications to a colorimetric assay of lipid peroxidation, Chem. Res. Toxicol. 11 (10), 1176–1183. https://doi.org/10.1021/tx9701790
Weber D., Davies M.J., Grunea T. 2015. Determination of protein carbonyls in plasma, cell extracts, tissue homogenates, isolated proteins: Focus on sample preparation and derivatization conditions. Redox Biol. 5, 367–380. https://doi.org/10.1016/j.redox.2015.06.005
Bronsky E.A., Falliers C.J., Kaiser H.B., Ahlbrandt R., Mason J.M. 1998. Effectiveness and safety of fexofenadine, a new nonsedating H1-receptor antagonist in the treatment of fall allergies. Allergy Asthma Proc. 19, 135–141. https://doi.org/10.2500/108854198778604112
Petri N., Tannergren C., Rungstad D., Lennernäs H. 2004. Transport Characteristics of Fexofenadine in the Caco-2 Cell Model. Pharmac. Res. 21 (8), 1398–1404. https://doi.org/10.1023/B:PHAM.0000036913.90332.b1
Elsby R., Surry D.D., Smith V.N., Gray A.J. 2008. Validation and application of Caco-2 assays for the in vitro evaluation of development candidate drugs as substrates or inhibitors of P-glycoprotein to support regulatory submissions, Xenobiotic, 38, 1140–1164. https://doi.org/10.1080/00498250802050880
Ерохина П.Д., Абаленихина Ю.В., Щулькин А.В., Черных И.В., Попова Н.М., Слепнев А.А., Якушева Е.Н. 2020. Изучение влияния прогестерона на активность гликопротеина-Р in vitro. Российский медико-биологический вестник им. акад. И.П. Павлова. 28 (2), 135–142. https://doi.org/10.23888/PAVLOVJ2020282135-142
Srinivasan B., Kolli A.R., Esch M.B., Abaci H.E., Shuler M.L., Hickman J.J. 2015. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107–126. https://doi.org/10.1177/2211068214561025
Hirsch I., Prell E., Weiwad M. 2014. Assessment of cell death studies by monitoring hydrogen peroxide in cell culture. Analyt. Biochem. 456 (1), 22–24. https://doi.org/10.1016/j.ab.2014.04.009
Xiang J., Wan C., Guo R., Guo D. 2016. Is hydrogen peroxide a suitable apoptosis inducer for all cell types? Biomed Res Int. Article ID 7343965. https://doi.org/10.1155/2016/7343965
Shchulkin A.V., Abalenikhina Y.V., Erokhina P.D., Chernykh I.V., Yakusheva E.N. 2021. The role of P-glycoprotein in decreasing cell membranes permeability during oxidative stress. Biochemistry (Moscow). 86 (2), 197–206. https://doi.org/10.1134/S0006297921020085
Hidalgo I.J., Raub T.J., Borchardt R.T. 1989. Characterization of the human colon carcinoma cell line (Caco-2) as a model system for intestinal epithelial permeability. Gastroenterology. 96 (3), 736–749.
Sun H., Chow E.C., Liu S., Du Y., Pang K. S. 2008. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opin. Drug Metab. Toxicol. 4 (4), 395–411. https://doi.org/10.1517/17425255.4.4.395
Shah P., Jogani V., Bagchi T., Misra A. 2006. Role of Caco-2 cell monolayers in prediction of intestinal drug absorption. Biotechnology Progress., 22 (1), 186–198. https://doi.org/ 10.1021 / bp050208u
Möller M.N., Cuevasanta E., Orrico F., Lopez A.C., Thomson L., Denicola A. 2019. Diffusion and transport of reactive species across cell membranes. Adv. Exp. Med. Biol. 1127, 3–19. https://doi.org/10.1007/978-3-030-11488-6_1
Hara-Chikuma M., Watanabe S., Satooka H. 2016. Involvement of aquaporin-3 in epidermal growth factor receptor signaling via hydrogen peroxide transport in cancer cells. Biochem. Biophys. Res. Commun. 471 (4), 603–609. https://doi.org/10.1016/j.bbrc.2016.02.010
Sies H. 2019. Oxidative stress: eustress and distress in redox homeostasis. Handbook of Stress Series. 3, 153–163. https://doi.org/10.1016/B978-0-12-813146-6.00013-8
Sim H.M., Bhatnagar J., Chufan E.E., Kapoor K., Ambudkar S.V. 2013. Share conserved walker A cysteines 431 and 1074 in human P-glycoprotein are accessible to thiol-specific agents in the apo and ADP-vanadate trapped conformations. Biochemistry. 52 (41), 7327–7338. https://doi.org/10.1021/bi4007786
Hoshi Y., Uchida Y., Tachikawa M., Ohtsuki S., Couraud P., Suzuki T., Terasaki T. 2019. Oxidative stress-induced activation of Abl and Src kinases rapidly induces P-glycoprotein internalization via phosphorylation of caveolin-1 on tyrosine-14, decreasing cortisol efflux at the blood–brain barrier. J. Cerebral Blood Flow Metabolism. 40 (2), 420–436. https://doi.org/10.1177/0271678X18822801
Kim S., Kim G.H. 2017. Roles of claudin-2, ZO-1 and occludin in leaky HK-2 cells. PLoS One. 12 (12), e0189221. https://doi.org/10.1371/journal.pone.0189221
Rao R.K., Basuroy S., Rao V.U., Karnaky K. J., Gupta A. 2002. Tyrosine phosphorylation and dissociation of occludin-ZO-1 and E-cadherin-beta-catenin complexes from the cytoskeleton by oxidative stress. Biochem. J. 368, 471–481. https://doi.org/10.1042/BJ20011804
Kang K.A., Hyun J.W. 2017. Oxidative stress, Nrf2, and epigenetic modification contribute to anticancer drug resistance. Toxicol. Res. 33, 1–5. https://doi.org/10.5487/TR.2017.33.1.001
Wen Zh., Liu W., Li X., Chen W., Liu J., Wen Zh., Liu Zh. 2019. A Protective Role of the NRF2-Keap1 Pathway in Maintaining Intestinal Barrier Function, Oxid. Med. Cell Longev. Article ID 1 759 149. https://doi.org/10.1155/2019/1759149
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


