Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 5, стр. 351-362
Флуоресцентные исследования структурно-динамических параметров мембран митохондрий печени крыс при гипотермии различной длительности
Р. А. Халилов a, С. И. Хизриева a, А. М. Джафарова a, *, В. Р. Абдуллаев a
a Дагестанский государственный университет
367000 г. Махачкала, Россия
* E-mail: albina19764@mail.ru
Поступила в редакцию 14.12.2020
После доработки 27.03.2021
Принята к публикации 29.03.2021
Аннотация
В последние годы гипотермию различной глубины и длительности все чаще используют в медицинской практике для защиты органов и тканей от повреждений, вызванных гипоксией, ишемией и реперфузией. Однако начальные этапы гипотермии индуцируют окислительный стресс, в развитии которого ключевая роль принадлежит митохондриям. Целью данной работы является исследование эффектов гипотермии различной длительности на структурно-динамические параметры митохондрий, которые определялись с помощью флуоресцентных зондов – пирена и 1-анилинонафталин-8-сульфоната (АНС). Обнаружено, что кратковременная гипотермия и ее пролонгирование увеличивают коэффициент эксимеризации пирена в аннулярных и общих липидах митохондриальных мембран, что указывает на снижении их микровязкости. При пролонгированной гипотермии увеличивается коэффициент полярности микроокружения пирена в общих липидах, в то время как в аннулярных данный показатель не претерпевает каких-либо изменений. Исследование кинетики связывания флуоресцентного зонда АНС с митохондриями печени крыс демонстрирует нелинейный характер зависимости интенсивности флуоресценции зонда от его концентрации. Это указывает на наличие в мембранах митохондрий как минимум двух гетерогенных участков связывания. Кратковременная гипотермия и ее пролонгирование снижают интенсивность флуоресценции АНС при всех исследованных концентрациях зонда. Это снижение обусловлено изменениями кинетических параметров связывания зонда с различными участками мембранных белков: для участков 1-го типа – снижением числа мест связывания зонда (N1), а для участков 2-го типа – повышением константы диссоциации зонда (Kd2). Таким образом, гипотермия индуцирует ряд существенных изменений в физическом состоянии липидной матрицы митохондриальных мембран, а также в структурной организации и локализации мембранных белков. Выраженность некоторых из этих изменений зависит от длительности воздействия низкотемпературного фактора.
ВВЕДЕНИЕ
В последние годы гипотермические состояния нашли широкое применение в медицинской практике. Многочисленные исследования демонстрируют эффективность использования гипотермии при операциях на сердце и мозге [1, 2], инсульте, инфаркте, неонатальной гипоксии [3, 4], травмах [5, 6]. Оказалось, что гипотермия способствует защите различных органов и тканей от последствий их гипоксических, ишемических и реперфузионных повреждений. Протекторный эффект гипотермии обусловлен снижением температуры тела, в результате которого снижаются скорости метаболических процессов и уменьшаются потребности тканей в кислороде и глюкозе [7]. В терапевтических целях чаще всего используют умеренную гипотермию [8]. Однако следует учесть, что сама по себе гипотермия является экстремальным состоянием для гомойотермного организма [5] и может привести к развитию ряда патологических процессов, выраженность которых может зависеть от длительности воздействия низкотемпературного фактора. В связи с этим для разработки надлежащего эффективного лечения возникает необходимость тщательного и всестороннего изучения всех изменений, которые происходят в организме на различных временных отрезках его охлаждения.
Обнаружено, что снижение температуры тела крыс до 30°С сопровождается развитием оксидативного стресса с последующей интенсификацией свободнорадикальных процессов (СРП) [9, 10]. Известно, что ключевую роль в индукции СРП играют активные формы кислорода (АФК), образующиеся в электрон-транспортной цепи (ЭТЦ) митохондрий [11]. Гипотермия может оказывать влияние на функциональную активность ферментов ЭТЦ и скорость передачи электронов во внутренней мембране митохондрий. Ранее нами было обнаружено, что умеренная гипотермия приводит к существенному повышению скорости дыхания и снижению коэффициента окислительного фосфорилирования митохондрий печени крыс. При этом наряду с изменениями респираторных характеристик [12, 13] увеличиваются уровни маркеров окислительного стресса продуктов перекисного окисления липидов (ПОЛ) и окислительной модификации белков (ОМБ) [14].
Причинами интенсификации дыхания митохондриями могут быть как структурно-конформационные перестройки дыхательных белков ЭТЦ, так и изменения проницаемости митохондриальных мембран. Возможно, что определенную роль в этих процессах играют и сами АФК, которые посредством ОМБ и ПОЛ могут стать причиной модификации структурно-динамических параметров митохондрий.
Чувствительным и информативным методом для исследования изменений физико-химических параметров биологических мембран является метод флуоресцентного зондирования. Известно, что интенсивность зондовой флуоресценции может зависеть от полярности и заряда мембран, количества гидрофобных карманов и конформации белков, мембранного потенциала, фазового состояния и вязкости липидов. Широкое применение для исследований структурно-динамических характеристик мембран нашли флуоресцентные зонды – 1-анилинонафталин-8-сульфонат (АНС) и пирен [15, 16]. АНС прежде всего реагирует на конформацию белков, их заряд и гидрофобные карманы, пирен – на вязкость липидной фазы [17–19]. Анионный зонд АНС позволяет исследовать поверхностные свойства мембраны, в то время как пирен – глубинные гидрофобные участки.
Целью данной работы явилось исследование эффектов умеренной гипотермии различной длительности на некоторые структурно-динамические параметры мембран митохондрий посредством оценки кинетики связывания флуоресцентных зондов – АНС и пирена.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Опыты выполнены на крысах-самцах Вистар 3.5-месячного возраста с массой тела 200−220 г, полученных из питомника филиала “Столбовая” ФГБУН НЦБМТ ФМБА России (Московская область, Чеховский район) и содержащихся в стандартных условиях вивария Дагестанского государственного университета. В контрольных и экспериментальных группах было использовано по 8 животных. В ходе исследования были соблюдены все нормы и правила выполнения экспериментальных работ с использованием лабораторных животных (Директива 2010/63/EU Совета Европейского Сообщества по защите животных, используемых в экспериментальных и других научных целях).
Моделирование гипотермических состояний. Гипотермию вызывали наружным охлаждением животных в плексигласовых камерах с рубашкой, через которую циркулировала холодная вода (15°С). Температуру тела крыс снижали равномерно в течение 30 мин до 30°С (кратковременная умеренная гипотермия), в течение 60 мин и 180 мин (пролонгированная умеренная гипотермия). В качестве контроля служили интактные крысы с нормальной температурой тела (37°С).
Выделение митохондрий. Выделение митохондрий из печени крыс проводили методом дифференциального центрифугирования в градиенте плотности сахарозы [20]. Крыс декапитировали. Быстро выделяли печень, промывали ледяной средой выделения (1°С) в течение 5 мин. Печень предварительно измельчали, пропускали через пресс и готовили 10% гомогенат в среде выделения, после чего центрифугировали при 1800 g 10 мин. Супернатант отделяли и центрифугировали при 15 000 g в течение 15 мин на центрифуге MR 23i (Thermo Fisher Scientific, США). Полученный дважды отмытый осадок доводили до 2 мл и суспендировали в 0.32 М сахарозе. Суспензию митохондрий наслаивали на заранее приготовленный градиент плотности сахарозы (содержащий 3.5 мл 1.1 М, 7.5 мл 0.8 М, 7.5 мл 0.5 М и 5 мл 0.3 М сахарозы) и центрифугировали в бакетном роторе SW32 Ti при 7000 g на ультрацентрифуге Optima L-90K (Beckman Coulter, США).
Митохондрии, находящиеся в слоях 0.5–0.8 М отсасывали специальным приспособлением для отбора фракций и осаждали при 15 000 g на центрифуге MR 23i (Thermo Fisher Scientific). Полученные митохондрии промывали в среде выделения и повторно центрифугировали при 15 000 g в течение 15 мин. Митохондрии ресуспендировали в среде инкубации и хранили на льду.
Все растворы сахарозы, использованные для создания градиента ее плотности в пробирке, были приготовлены на буфере 10 мМ НЕРЕS, содержащем 1 мМ EDTA (рН 7.2) и 0.1% альбумин. Состав среды выделения: 0.25 М сахароза, 5 мМ HEPES, 0.5 мМ EDTA, 0.1% BSA (pH 7.4). Среда инкубации содержала 0.32 М сахарозу, 3 мМ HEPES, 0.25 мМ EDTA, 1 мМ MgCl2, 13 мМ KCl (рН 7.4). Содержание белка в суспензии митохондрий определяли по методу Лоури [21].
Исследование структурно-динамических параметров мембран митохондрий с помощью флуоресцентных зондов. В работе использовали интактные митохондрии, суспендированные в среде инкубации. К 1 мл суспензии митохондрий добавляли 0.05 мл стокового раствора сукцината (до конечной концентрации 3 мМ), 0.05 мл раствора КН2РО4 (до конечной концентрации 1 мМ) и 0.02 мл раствора флуоресцентного зонда. Содержание белка в исследуемой пробе составляло 0.08 мг/мл. Измерения проводили на спектрофлуориметре HitachiF 7000 (Япония) при температуре 25°С. Оценка микровязкости мембран митохондрий производилась с помощью флуоресцентного зонда пирена. Микровязкость липидного слоя митохондриальных мембран оценивали при длине волны возбуждения λвозб = 337 нм, а микровязкость зон белок-липидных контактов при λвозб = 280 нм. Максимумы длин волн флуоресценции (λ эмисс) составляли для мономеров пирена – 394 нм, для эксимеров – 470 нм [15, 16].
Исследования концентрационной зависимости флуоресценции АНС, инкубированного с суспензией митохондрий, проводили в диапазоне концентраций 2.5–32.5 мкМ при температуре 25°С. Исследования проведены на спектрофлуориметре Hitachi F7000 при λвозб = 360 нм и λэмисс в диапазоне 400–550 нм. По полученным спектрам флуоресценции АНС определяли оптимум интенсивности флуоресценции зонда (Iфл). Затем строили графики зависимости оптимума интенсивности флуоресценции от концентрации зонда в пробе. Для расчета кинетических характеристик связывания зонда использовали нелинейный многомерный регрессионный анализ.
Статистическая обработка. Обработка данных производилась с помощью однофакторного дисперсионного анализа (ANOVA) с использованием пакета Statistica. Достоверность различия определяли с помощью критерия Фишера на уровне значимости p = 0.05.
РЕЗУЛЬТАТЫ
Известно, что в воде АНС имеет очень низкий квантовый выход, тогда как в комплексе с белками он многократно увеличивается [16, 18]. Связывание АНС может зависеть от локализации и структуры мембранных белков, а также их заряда. Исследование концентрационной зависимости флуоресценции АНС позволит детально изучить кинетику его взаимодействия с митохондриальными мембранами печени контрольных и гипотермированных крыс: обнаружить наличие отличающихся по своей структуре участков связывания зонда, рассчитать их количество и аффинность. В связи с этим нами была исследована зависимость интенсивности флуоресценции АНС, инкубированного с митохондриями, от его концентрации в диапазоне 2.5–30 мкМ.
Из рис. 1, где приведены соответствующие спектры флуоресценции АНС, видно, что характер спектров и положение максимума флуоресценции зависят от концентрации зонда. Особое внимание привлекает тот факт, что с повышением концентрации зонда происходит смещение максимума интенсивности флуоресценции в длинноволновую область. Так, максимум интенсивности флуоресценции при концентрации АНС 2.5 мкМ соответствует длине волны испускания 458 нм, а при 32.5 мкМ – 477 нм, таким образом, смещение в длинноволновую область составляет 19 нм. Это может быть обусловлено различиями в полярности окружения связанного с белками зонда, что свидетельствует о гетерогенности сайтов связывания АНС на белковой молекуле.
Рис. 1.
Спектры флуоресценции АНС, инкубированного с митохондриями печени контрольных крыс, при различных концентрациях зонда, мкМ: 1 – 2.5, 2 – 5, 3 – 7.5, 4 – 10, 5 – 12.5, 6 – 15, 7 – 17.5, 8 – 20, 9 – 22.5, 10 – 25, 11 – 27.5, 12 – 30, 13 – 32.5. Стрелками указаны длины волн эмиссии, при которых интенсивность флуоресценции АНС максимальна.
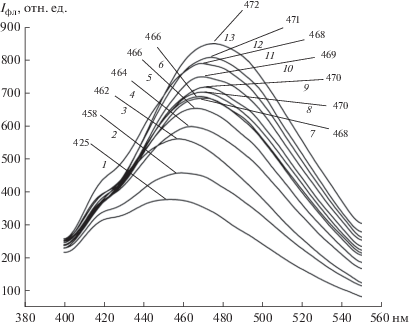
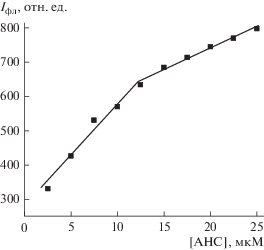
На рис. 2 представлена зависимость максимума интенсивности флуоресценции АНС от его концентрации. Оказалось, что она носит нелинейный характер и представлена двумя пересекающимися в окрестностях одной точки прямыми. Из рисунка видно, что с повышением концентрации зонда интенсивность флуоресценции его линейно увеличивается, однако в области концентраций 10–12.5 мкМ происходит изменение характера концентрационной зависимости и она становится менее выраженной.
Рис. 2.
Концентрационная зависимость интенсивности флуоресценции АНС в митохондриях печени контрольных крыс.
Исследование позволяет предположить наличие как минимум двух типов участков связывания зонда, имеющих различное сродство к АНС, одни из которых обеспечивают более полярное окружение зонда, а другие менее полярное. Это подтверждается наличием двух обособленных отрицательных пиков на графиках вторых производных спектров флуоресценции АНС (рисунок не приведен).
Для каждого линейного участка представленного графика зависимости, методом регрессионного многомерного нелинейного анализа, используя в опции “нелинейное оценивание” уравнение y = ymax × [ANS]/(Kd + [ANS]), где y – это интенсивность флуоресценции, а ymax – это максимальная интенсивность флуоресценции, Kd – константа диссоциации, были рассчитаны кинетические параметры связывания зонда – ymax и Kd; ymax – это величина, которая зависит от числа мест связывания зонда (N) и, таким образом, может опосредованно отражать это число [22].
Из табл. 1 видно, что константы диссоциации двух гетерогенных сайтов связывания АНС с митохондриями печени крыс в контроле существенно отличаются: Kd2 больше Kd1 в 2.24 раз. Соответственно отличается и кажущееся число центров связывания АНС (N1 и N2). Так, участков первого типа связывания (N1) меньше таковых второго типа (N2) на 24.43%. Данный факт, скорее всего, является следствием связывания АНС как с гидрофобными карманами белка (имеющих более высокое сродство к зонду), так и с остатками положительно заряженных аминокислот (имеющих более низкое сродство к зонду).
Таблица 1.
Кинетические параметры связывания АНС с митохондриями печени крыс в норме и при гипотермии (M ± m, n = 8)
| Серия экспериментов | N1, усл.ед. | N2, усл.ед. | Kd1, мкМ | Kd2, мкМ |
|---|---|---|---|---|
| Контроль | 827.99 ± 28.49 | 1095.72 ± 79.53 | 4.13 ± 0.31 | 9.26 ± 0.98 |
| Гипотермия 30°С, 30 мин | 671.59 ± 63.70*** | 1145.72 ± 89.58 | 4.20 ± 0.20 | 16.30 ± 1.12** |
| Гипотермия 30°С, 1 ч | 644.27 ± 55.02*** | 1143.59 ± 31.98 | 4.00 ± 0.14 | 15.32 ± 1.15** |
| Гипотермия 30°С, 3 ч | 649.22 ± 49.41*** | 1084.53 ± 59.28 | 4.30 ± 0.04 | 17.60 ± 1.24** |
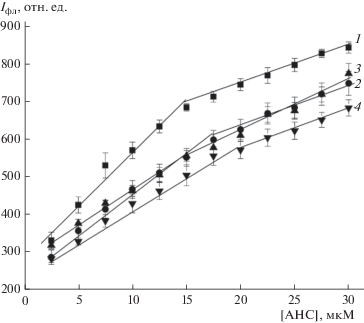
Интенсивность флуоресценции АНС и кинетика его связывания с митохондриями гипотермированных крыс претерпевает значительные изменения. Из рис. 3 видно, что при кратковременной гипотермии интенсивность флуоресценции инкубированного с митохондриями зонда значительно снижается и остается примерно на этом же уровне при гипотермии продолжительностью 60 мин. Пролонгирование гипотермии до 3 ч способствует дальнейшему снижению интенсивности флуоресценции АНС, однако это снижение по сравнению с кратковременной гипотермией не является ярко выраженным.
Рис. 3.
Зависимость интенсивности АНС в митохондриях печени крыс от концентрации зонда при умеренной гипотермии различной длительности: контроль (1), умеренная гипотермия в течение 30 (2), 60 (3) и 180 мин (4).
Анализ изменений кинетических параметров связывания АНС с митохондриями гипотермированных крыс показал, что кратковременная гипотермия приводит к снижению N1 на 18% (табл. 1). При пролонгировании гипотермических состояний до 1 и 3 ч значения N1 не претерпевают достоверных изменений относительно умеренной кратковременной гипотермии. Параметр Kd1 у гипотермированных крыс остается на уровне контрольных значений.
Из табл. 1 видно, что параметр N2 в динамике гипотермических состояний не меняется, в то время как Kd2 при кратковременной гипотермии повышается на 76%. Дальнейшее пролонгирование гипотермии до 1 и 3 ч не приводит к существенным изменениям данного параметра.
Степень погруженности и конфигурация мембранных белков могут определяться фазовым состоянием липидного матрикса. Для исследования эффектов гипотермии на структурно-динамические параметры митохондриальных мембран, связанные с состоянием их липидной фазы, был использован флуоресцентный зонд пирен.
Пирен – это гидрофобный зонд, флуоресценция которого очень чувствительна к микроокружению. Квантовый выход в воде пирена ничтожно мал, при этом он может диффундировать в гидрофобный слой мембраны, где интенсивность флуоресценции его возрастает [15, 19].
В липидном бислое мономеры пирена способны образовывать эксимерные формы, количество которых зависит от скорости латеральной диффузии зонда. Это в свою очередь определяется микровязкостью липидной матрицы. Таким образом, коэффициент эксимеризации пирена, представляющий собой отношение интенсивности флуоресценции эксимеров и мономеров пирена (FЭ/FM), является величиной обратно пропорциональной микровязкости липидов. При этом отношение F470/F395 нм при λвозб = 337 нм отражает вязкость липидных слоев мембраны клеток, а при λвозб = 280 – микровязкость липид-белковых контактов [11, 16, 23].
Кроме этого, спектральные характеристики пирена могут быть использованы для оценки полярности его окружения. Соотношение максимумов флуоресценции пирена F372/F393 при λвозб = = 337 нм характеризует изменения полярности микроокружения его мономеров в общих липидах, а при λ возб = 280 нм – в аннулярных липидах [23].
Пирен также позволяет оценить структурные перестройки мембранных белков по изменению эффективности переноса энергии электронного возбуждения с триптофановых остатков белков на флуоресцентный зонд [15–17]. Для определения степени тушения флуоресценции белков мембран митохондрий, мы измеряли интенсивность флуоресценции их при λвозб = 280 нм и λфлу = 333 нм в отсутствие пирена и после инкубации с зондом. Эффективность переноса энергии определяли по выражению: (F0 – F)/F0) × 100, где F0 – интенсивность флуоресценции суспензии мембран митохондрий в отсутствие пирена, F – интенсивность флуоресценции суспензии мембран митохондрий после инкубации с пиреном (7.76 мкМ).
Особого внимания заслуживает вопрос о том, где локализуется пирен в митохондриях: во внутренней или наружной мембране. Известно, что гидрофобный зонд пирен в мембранах преимущественно накапливается в области углеводородных хвостов фосфолипидов, где может быстро перемещаться латерально. Однако было показано, что он также способен к быстрому трансмембранному перемещению [24]. Исходя из этого, пирен может распределиться не только во внешней мембране митохондрий, но и во внутренней мембране.
Известно, что наружная мембрана митохондрий состоит из билипидного слоя и пронизывающих его белков (менее 20% по весу) при соотношении липидов и белков по массе – примерно 1 : 1. Напротив, во внутренней мембране содержание белка (транспортные белки, ферменты дыхательной цепи, а также крупные ATP-синтазные комплексы) столь высоко (около 75% по весу), что в ней местами нарушается типичное для биомембран взаимное расположение липидов и белков, причем липиды не образуют бимолекулярного слоя, локализуясь на поверхности [25].
Отсюда следует то, что латеральная диффузия зонда в липидной матрице наружной мембраны менее ограничена, и измеренный нами коэффициент эксимеризации пирена в липидной матрице, скорее всего, отражает поведение зонда в наружной мембране. В то время как особая архитектоника липидов и высокое содержание белков во внутренней мембране позволяет предположить, что большая часть липидов внутренней мембраны включена в состав аннулярных липидов, а это ограничивает свободную латеральную диффузию зонда. Следовательно, здесь преимущественно регистрируется эксимеризация пирена в аннулярных липидах, нежели в общих.
В работе Ягужинского и сотр. [26]. было отмечено, что в белках внешней мембраны митохондрий (в частности, в порине) содержится минимальное количество триптофана, но он присутствует в значительном количестве в комплексах дыхательной цепи внутренней мембраны. Авторы предположили, что с помощью данного метода представляется возможным изучить свойства именно внутренней мембраны митохондрий.
Из табл. 2 видно, что значение параметра FЭ/FМ (λвозб = 337 нм) сразу после снижения температуры тела возрастает на 24%. Пролонгирование гипотермии до 1 и 3 ч не вызывает дальнейших изменений FЭ/FМ, не считая того, что имеется небольшая тенденция к снижению FЭ/FМ относительно кратковременной гипотермии, которая не достигает уровня контрольных значений.
Таблица 2.
Структурно-динамические параметры митохондрий печени крыс в норме и при гипотермии (М ± m, n = 8)
| Серия экспериментов | FЭ/FМ (λвозб = 337) |
F370/F390 (λвозб = 337) |
FЭ/FМ (λвозб = 280) |
F370/F390 (λвозб = 280) |
(F0 – F)/F0, % |
|---|---|---|---|---|---|
| Контроль | 0.45 ± 0.026 | 1.07 ± 0.01 | 0.58 ± 0.04 | 0.96 ± 0.06 | 44.5 ± 3.7 |
| Гипотермия 30°С, сразу | 0.56 ± 0.023* | 1.1 ± 0.009 | 0.73 ± 0.029* | 0.92 ± 0.008 | 46.7 ± 3.5 |
| Гипотермия 30°С, через 1 ч | 0.54 ± 0.033* | 1.18 ± 0.04* | 0.71 ± 0.008* | 0.93 ± 0.01 | 45.6 ± 1.34 |
| Гипотермия 30°С, через 3 ч | 0.52 ± 0.02* | 1.17 ± 0.09* | 0.71 ± 0.016* | 0.94 ± 0.001 | 41.2 ± 3.72 |
На фоне снижения относительной микровязкости липидного бислоя мембран митохондрий при гипотермии наблюдается увеличение параметра FЭ/FМ (λвозб = 280 нм), которое начинается сразу после снижения температуры тела и составляет 25%. Дальнейшее пролонгирование гипотермического состояния не сопровождается изменениями FЭ/FМ (λвозб = 280), во многих случаях этот параметр возрастает всего лишь на 22.5% относительно контроля. Таким образом, сразу же после снижения температуры тела достоверно снижается микровязкость как общих липидов митохондриальной мембраны, так и аннулярных.
Параметр (F0 – F)/F0 пирена, характеризующий снижение эффективности переноса энергии электронного возбуждения с триптофановых остатков мембранных белков на пирен, при всех исследованных гипотермических состояниях не претерпевает достоверных изменений. Незначительное снижение эффективности переноса происходит при умеренной пролонгированной 3 ч гипотермии, но оно не является статистически достоверным.
Полученные результаты показывают, что в мембранах митохондрий печени крыс при всех исследованных гипотермических состояниях параметр F370/F390 (λвозб = 280 нм), характеризующий полярность микроокружения зонда в области аннулярных липидов, существенно не изменяется. При этом пролонгирование гипотермического состояния приводит к статистически достоверным изменениям параметра F370/F390 (λвозб = 337 нм), указывающего на полярность микроокружения зонда в общих липидах. Так пролонгирование гипотермии до 1 и 3 ч приводит к повышению F370/F390 (λвозб = 337 нм) на ~10%.
ОБСУЖДЕНИЕ
Особенность липидов в составе мембран – это изменение их физико-химического состояния под действием факторов внешней среды, особенно температуры. Полученные данные (микровязкость аннулярных и общих липидов, полярность микроокружения белков, тушение) указывают на изменения структурно-динамических характеристик мембран митохондрий печени крыс при гипотермии.
После понижения температуры тела повышается значение параметра FЭ/FМ (λвозб = 337 нм), что указывает на повышение текучести (или соответствующее снижение микровязкости) липидного бислоя мембран митохондрий по сравнению с нормой, поскольку степень эксимеризации пирена находится в обратной зависимости от микровязкости липидной фазы [17, 23]. При гипотермии возрастает также текучесть зон белок-липидных контактов, которые представлены аннулярными липидами, составляющими микроокружение мембранных белков, что подтверждает увеличение параметра FЭ/FМ (λвозб = 280 нм) по сравнению с контролем.
Обнаруженные изменения вязкости мембранных липидов при гипотермии указывают на существенные структурные перестройки в липидах мембран митохондрий. В первую очередь они могут быть связаны с изменениями жирнокислотного состава фосфолипидов, поскольку для оптимального функционирования наружной и внутренней мембраны митохондрий имеет большое значение регуляция фазовых состояний липидов мембран.
Так, по данным Шепелева [27], при снижении температуры тела до 27–28°С происходят изменения фосфолипидного спектра и содержания полиненасыщенных жирных кислот (ЖК) в липидах митохондрий миокарда белых крыс и собак. Вместе с тем повышение степени ненасыщенности липидов при умеренной гипотермии приводило к снижению их микровязкости и сдвигу фазового перехода в область низких температур. Автор предположил, что основная роль этих перестроек в липидах мембран митохондрий связана с повышением устойчивости животных к низкотемпературным воздействиям.
К сожалению, в современной литературе мы не обнаружили какую-либо новую информацию о влиянии гипотермии на липидный состав митохондриальных мембран гомойотермных животных. Имеются отдельные работы, в которых было показано, что умеренная гипотермия и ее пролонгирование изменяют ЖК-состав липидов синаптических и эритроцитарных мембран. Так, в работе Каландарова и соавт. [28], в которой был проведен анализ ЖК-состава суммарных фосфолипидов (ФЛ) синаптических мембран мозга крыс, показано, что при умеренной гипотермии достоверно снижается количество насыщенных ЖК (С16:0, С17:0) и моноеновых жирных кислот (С18:1, С20:1), при этом количество полиненасыщенных ЖК (С20:4, С22:4) существенно возрастает.
Вместе с тем в недавнем исследовании Раджабовой и соавт. [29] было обнаружено, что в ЖК суммарных ФЛ эритроцитарных мембран индекс ненасыщенности, а также отношения ПНЖК/НЖК и неНЖК/НЖК сразу после снижения температуры тела существенно не изменяются, но после пролонгированной гипотермии заметно снижаются. Таким образом, характер изменений ЖК состава ФЛ мембран различных биологических структур при гипотермии неоднозначен.
Следует также отметить, что проведенные ранее исследования структурно-динамических параметров эритроцитарных мембран с применением флуоресцентного зонда пирена, показали снижение микровязкости как общих, так и аннулярных липидов после 1.5 ч гипотермии [30]. Таким образом, результаты исследования микровязкости эритроцитарных мембран [30] и их ЖК-состава [29] хорошо коррелируют. Это позволяет нам предположить, что снижение вязкости липидов митохондриальных мембран тесно связано с повышением степени их ненасыщенности.
Механизмы, посредством которых может происходить изменение ЖК-состава митохондриальных мембран при гипотермии, могут быть разнообразны, учитывая что, митохондрии являются поставщиками ацетил-КоА – инициальной затравки синтеза ЖК, и участвуют в последовательной элонгации синтезированной в цитоплазме углеводородной цепочки ЖК. Вероятнее всего, в митохондриях при гипотермии происходит включение механизмов ремоделирования мембранных липидов путем деацилирования и реацилирования ФЛ.
Показано, что на начальных этапах развития гипотермия сопровождается стрессорной реакцией, при которой происходит активация гипоталамо-гипофизарно-надпочечниковой системы [31]. В результате включаются механизмы, направленные на увеличение липолиза. Было показано, что при гипотермии в крови увеличивается количество ненасыщенных ЖК [32], которые гипотетически могут использоваться для ремоделирования митохондриальной мембраны.
Известно, что изменение индекса ненасыщенности в мембранах пойкилотермных животных может происходить и с помощью ферментов – десатураз. Низкие температуры способны включать десатурацию ЖК, увеличивая тем самым индекс ненасыщенности клеточных мембран. В работе Гонзалеза и соавт. [32] было показано, что у адаптированных к холоду крыс, которым снижали температуру до 30–32°С в течение 20–25 дней и затем охлаждали до 15°С в течение 12 ч, также наблюдалось повышение активности различных десатураз печени. Причем, повышение активности ферментов коррелировало с увеличением содержания арахидоновой кислоты и снижением олеиновой кислоты в микросомах сердца и печени.
В нашем эксперименте исследуемые крысы не были адаптированы к холоду и не подвергались длительному и глубокому охлаждению. Однако все же можно выдвинуть предположение о том, что снижение микровязкости в митохондриях печени крыс при умеренной гипотермии также может быть связано с повышением активности десатураз и изменением ЖК-состава в сторону увеличения содержания ненасыщенных ЖК.
Известно, что процессы обновления ФЛ ускоряются после их окислительной модификации, в ходе которого окисленные ацильные цепи быстро удаляются из ФЛ мембран под действием кальций-зависимой фосфолипазы А2 [33]. Ранее нами было установлено, что кратковременная умеренная гипотермия стимулирует ПОЛ в митохондриях [14]. Гипотетически, интенсификация ПОЛ при гипотермии может привести к заметному увеличению параметра F370/F390, показывающего полярность микроокружения пирена в аннулярных или общих липидах. В соответствии с нашими экспериментальными данными, гипотермия увеличивает полярность ФЛ липидного бислоя, в то время как значительных изменений ее в области белок-липидных контактов не происходит. Это свидетельствует о том, что активация процессов ПОЛ при гипотермии не оказала существенного влияния на ЖК аннулярных фосфолипидов.
Снижение микровязкости липидного матрикса мембран митохондрий, возможно, является адаптивной реакцией, направленной на сохранение функциональной активности этих органелл. Ранее нами обнаружено, что кратковременная гипотермия и ее пролонгирование увеличивают интенсивность дыхания митохондрий печени крыс [12, 13]. Было предположено, что одной из причин увеличения уровней потребления кислорода митохондриями может быть снижение вязкости внутренней мембраны митохондрий, способствующее повышению подвижности в липидной матрице убихинона. Настоящее исследование позволило экспериментально подтвердить справедливость этого предположения. Гипотермия действительно приводит к снижению вязкости мембран и тем самым, возможно, способствует увеличению подвижности и активности участников ЭТЦ и позволяет сохранять энергетический потенциал митохондрий.
Изменения, происходящие в митохондриальных мембранах гомойотермных животных при низких температурах тела, могут затрагивать не только липидную матрицу. Проведенное нами исследование кинетических характеристик связывания флуоресцентного зонда АНС с мембранами митохондрий указывает на то, что при гипотермии происходят существенные изменения как в структуре, так и в локализации мембранных белков.
Результаты исследования свидетельствуют о гетерогенности сайтов связывания АНС с митохондриями. Каковы возможные причины такой гетерогенности?
Известно, что квантовый выход флуоресценции АНС зависит от полярности его окружения и увеличивается в гидрофобных средах. В соответствии с некоторыми литературными данными анионный зонд АНС чувствителен к поверхностному заряду митохондрий [34]. В работе Векшина [35] отмечается то, что митохондрии заряжены отрицательно и снаружи, и внутри (положительный заряд – в межмембранном пространстве). Гипотетически, АНС должен отталкиваться от интактных энергизованных отрицательно заряженных митохондрий, что позволяет вести регистрацию мембранного потенциала. Однако сам автор ясно указывает на то, что АНС и другие гидрофобные заряженные зонды плохо пропускаются внешней мембраной нативныx митохондрий и остаются “заякоренными” в ее наружной липидной фазе. Поэтому изменение трансмембранного потенциала на внутренней мембране, если оно будет иметь место, не сможет заметно повлиять на зондовую флуоресценцию. Экспериментально показано, что интенсивности флуоресценции АНС в интактных и разобщенных митохондриях не имеют существенных различий, что свидетельствует о низкой чувствительности флуоресцентного зонда к поверхностному заряду митохондрий [35].
По мнению других авторов, на внешней мембране митохондрий отсутствует мембранный потенциал [36], поскольку внешняя мембрана митохондрий обладает высокой степенью проницаемости, через нее свободно проходят ионы и небольшие незаряженные молекулы за счет мембранных белков, называемых поринами. Особую роль играет митохондриальный порин – потенциал-зависимый анионный канал VDAC (voltage-dependent anion channel). В зависимости от напряжения канал может быть селективен к анионам органических соединений. Следовательно, существует вероятность того, что АНС может перемещаться в межмембранное пространство через VDAC и взаимодействовать со внутренней митохондриальной мембраной, характеризующейся большим содержанием белков.
Было показано, что нафталиновое кольцо молекулы АНС может проникать в гидрофобную область мембраны и тем самым становиться менее доступным для водной среды, что увеличивает квантовый выход флуоресценции зонда [37]. Однако многие авторы предполагают, что АНС прежде всего реагирует на конформацию белков, их заряд и гидрофобные карманы [38]. Повышение интенсивности флуоресценции АНС в белках объясняется гидрофобностью сайтов связывания и ограниченной подвижностью зонда в гидрофобных карманах белка [39]. Однако, помимо гидрофобных взаимодействий с находящимися в карманах белка ароматическими радикалами аминокислот, зонд может связываться с помощью электростатических взаимодействий с периферическими аминокислотными радикалами. Эти взаимодействия формируются между отрицательно заряженной сульфоновой группой АНС и положительно заряженными аминокислотами, например, гистидином, лизином или аргинином [40].
Было обнаружено, что вклад во флуоресценцию АНС от внешних сайтов связывания гораздо меньше, чем от глубоколежащих гидрофобных сайтов [41]. Гидрофобные участки связывания создают менее полярное окружение зонду, и, возможно, имеют к АНС более высокое сродство. Поэтому они быстрее насыщаются при более низких концентрациях субстрата и характеризуются относительно низкими значениями констант диссоциации. Напротив, внешние положительно заряженные аминокислотные сайты обеспечивают более полярное окружение зонду и имеют к нему меньшее сродство.
Таким образом, кинетические особенности связывания АНС с белками достаточно хорошо описывают полученные нами экспериментальные данные, демонстрирующие нелинейный характер концентрационной зависимости флуоресценции зонда, инкубированного с митохондриями. Это позволяет утверждать, что основной вклад во флуоресценцию АНС в митохондриальных мембранах вносят белки, а не мембранный потенциал.
Результаты исследования указывают на снижение интенсивности флуоресценции АНС, инкубированного с митохондриями, гипотермированных животных. Оно может происходить либо за счет снижения абсолютного числа сайтов связывания, либо за счет снижения аффинности зонда к этим сайтам. Можно предположить, что при гипотермии количество гидрофобных карманов в белках митохондриальных мембран снижается, что приводит к падению интенсивности флуоресценции зонда. Гипотетически снижение числа гидрофобных карманов могло произойти за счет повышения степени погруженности некоторых белков в липидный матрикс. Одной из возможных причин такого явления может быть снижения вязкости бислоя. В соответствии с литературными данными микровязкость липидной матрицы оказывает влияние на интенсивность флуоресценции АНС [18].
Из приведенных выше данных по коэффициенту эксимеризации пирена в липидной фазе и в зоне липид-белковых контактов видно, что вязкость митохондриальных мембран снижается, особенно в области аннулярных липидов. Причем дальнейшее пролонгирование гипотермии не оказывает влияния на этот параметр. Такой же феномен демонстрирует и параметр N1 для АНС, в динамике пролонгирования гипотермии он не претерпевает изменений. Корреляционный анализ показал, что между коэффициентом эксимеризации пирена и N1 имеется отрицательная корреляция (r = –0.9631, p < 0.05). Нельзя исключать и возможность уменьшения числа мест связывания в результате компактизации белков митохондриальных мембран и их уплотнения, что снижает доступность зонда к гидрофобным карманам. Такая компактизация может произойти, например, вследствие окисления остатков цистеина и образования дисульфидных мостиков или же остатков тирозина с образованием битирозиновых сшивок. Возможно, что компактизация имеет отношение и к процессам митохондриального слияния в клетках. Известно, что митохондриальное слияние – это один из эволюционно консервативных процессов, необходимый для эффективной работы митохондрий в условиях стресса [42].
Исследование показало, что гипотермия не влияет на Кd1, то есть на аффинность зонда к гидрофобным сайтам и силу гидрофобных взаимодействий зонда с белком. Это свидетельствует о том, что изменения, происходящие в белках при гипотермии, не затрагивают структуру радикалов, находящихся в гидрофобных карманах белков. Скорее всего, находящиеся в углублениях белков радикалы, являются менее доступными для АФК.
Кратковременная гипотермия и ее пролонгирование не влияют на N2, которое отражает число положительно заряженных сайтов связывания с отрицательно заряженной сульфоновой группировкой зонда, однако при этом резко (почти в 2 раза) увеличивается Kd2, то есть уменьшается его аффинность к таким участкам. Такая ситуация может складываться вследствие снижения силы ионных взаимодействий зонда с радикалами положительно заряженных аминокислот.
Известно, что эти аминокислотные остатки лизина, аргинина и гистидина очень чувствительны к АФК и продуктам ПОЛ. Интенсификация СРП при кратковременной гипотермии может способствовать окислительной модификации радикалов этих аминокислотных остатков с образованием карбонильных групп. Ранее нами было показано [14], что кратковременная гипотермия увеличивает содержание карбонильных групп в митохондриальных белках. При этом пролонгирование гипотермии в течение 3 ч способствует их нормализации. В то время как в настоящем исследовании значения Kd2 для АНС при 3-часовом пролонгировании гипотермического состояния изменений не претерпевают. Достаточно слабая корреляция между интенсивностью ОМБ в митохондриальных мембранах печени крыс и кинетикой связывания АНС при гипотермии, возможно, связана с тем, что исследования содержания карбонильных групп в белках проводились на изолированных мембранах митохондрий крыс, а кинетики связывания АНС – на интактных энергизованных митохондриях. В таких митохондриях АНС, вероятнее всего, мог взаимодействовать с поверхностью наружной мембраны митохондрий. Поскольку митохондрии обладают собственной убиквитин-конъюгирующей системой [43] можно предположить, что в течение 3 ч гипотермии модифицированные посредством окисления белки внутренней мембраны митохондрий, возможно, подвергаются более интенсивной деградации и замене, чем белки наружной мембраны. Вследствие этого нормализации значений Kd2 для АНС в динамике пролонгирования гипотермии не наблюдается.
Следует отметить, что определенный вклад в снижение флуоресценции АНС при гипотермии могут внести и изменения степени погруженности нафталинового кольца зонда в липидную матрицу митохондриальной мембраны. Гипотетически это может быть обусловлено падением поверхностной гидрофобности митохондриальной мембраны вследствие накопления в ней гидрофильных продуктов ПОЛ.
Таким образом, флуоресцентное исследование структурно-динамических параметров мембран митохондрий печени крыс при гипотермии позволило выявить ряд существенных изменений в состоянии и структурной организации липидной матрицы и мембранных белков. Выраженность этих изменений зависит от длительности воздействия низкотемпературного фактора.
Полученные данные позволяют предположить, что при низких температурах тела в митохондриальных мембранах гомойотермных животных наряду с деструктивными процессами происходит развитие ряда компенсаторно-адаптивных реакций. Эти реакции связанны со снижением вязкости липидной матрицы, а также повышением конформационной подвижности мембранных белков и направлены прежде всего на сохранение функциональной активности митохондрий.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при частичной финансовой поддержке Госзадания FZNZ-2020-0002 “Разработка и оптимизация технологий получения инновационных функциональных материалов”.
Соответствие принципам этики. Все применимые международные, национальные и (или) институциональные принципы ухода и использования животных, нормы и правила выполнения экспериментальных работ с использованием лабораторных животных (Директива 2010/63/EU Совета Европейского Сообщества по защите животных, используемых в экспериментальных и других научных целях) были соблюдены.
Список литературы
Schaller B., Graf R. 2003. Hypothermia and stroke: The pathophysiological background. Review. Pathophysiology. 10, 7–35.
Wang H., Wang B., Normoyle K.P., Jackson K., Spitler K., Sharrock M.F., Miller C.M., Best C., Llano D., Du. R. 2014. Brain temperature and its fundamental properties: a review for clinical neuroscientists. Front. Neurosci. 8, 307. https://doi.org/10.3389/fnins.2014.00307
Zanelli S., Fairchild K. 2009. Physiologic and pharmacologic effects of therapeutic hypothermia for neonatal hypoxic ischemic encephalopathy. Newborn and Infant Nursing Reviews. 9 (1), 10–17.
Каленова И.Е., Шаринова И.А., Шевелев О.А., Бутров А.В. 2012. Опыт применения терапевтической гипотермии в лечении ишемического инсульта. Неврология, нейропсихиатрия, психосоматика. 2, 41–44.
Polderman K.H. 2004. Application of therapeutic hypothermia in the ICU: Opportunities and pitfalls of a promising treatment modality. Part 1: Indications and evidence. Intensive Care Med. 30 (4), 556–575.
Усенко Л.В., Царев А.В. 2009. Искусственная гипотермия в современной реаниматологии. Общая реаниматология. 5 (1), 21-23.
Alva N., Palomeque J., Carbonell T. 2013. Oxidative stress and antioxidant activity in hypothermia and rewarming: can RONS modulate the beneficial effects of therapeutic hypothermia? Oxid. Med. Cell. Longev. 2013, 957054. https://doi.org/10.1155/2013/957054
Liu L., Yenari M.A. 2007. Therapeutic hypothermia: neuroprotective mechanisms. Front. Biosci. 12, 816–825.
Аль-Рабии М.А.М., Астаева М.Д., Кличханов Н.К. 2015. Свободнорадикальные процессы в крови крыс при умеренной гипотермии разной длительности. Естественные науки. 50 (1), 35–42.
Эмирбеков Э.З., Кличханов Н.К. 2011. Свободнорадикальные процессы и состояние мембран при гипотермии. Ростов-на-Дону: ЮФУ. 200 с.
Гривенникова В.Г., Виноградов А.Д. 2013. Генерация активных форм кислорода митохондриями. Успехи биол. химии. 53, 245–296.
Халилов Р.А., Хизриева СИ., Джафарова А.М., Абдуллаев В.Р. 2019. Биоэнергетические характеристики митохондрий печени крыс при низких температурах тела. Вопр. биол., мед. и фармацевт. химии. 22 (5), 35–41.
Халилов Р.А., Хизриева С.И., Джафарова А.М., Абдуллаев В.Р. 2020. Респираторные характеристики митохондрий печени крыс зависят от длительности умеренной гипотермии. Бюлл. эксперим. биол. и мед. 169 (1), 33–38.
Халилов Р.А., Джафарова А.М., Хизриева С.И., Абдуллаев В.Р. 2019. Интенсивность свободно-радикальных процессов в митохондриях печени крыс при умеренной гипотермии различной длительности. Цитология. 91 (7), 1–12.
Владимиров Ю.А. Добрецов Г.Е. 1980. Флуоресцентные зонды в исследовании биологических мембран. М.: Наука, 308 с.
Добрецов Г.Е. 1989. Флуоресцентные зонды в исследовании клеток, мембран и липопротеинов. М.: Наука, 277 с.
Vekshin N.L. 2002. Pyrene Monomers and Excimers in Membranes. In: Photonics of Biopolymers. Biological and Medical Physics Series. Berlin, Heidelberg: Springer, p. 165–171. https://doi.org/10.1007/978-3-662-04947-1_16
Векшин Н.Л. 2008. Флуоресцентная спектроскопия биополимеров. Пущино: Фотон-век, 168 с.
Лакович Дж. 1986. Основы флуоресцентной спектроскопии. М.: Мир, 496 с.
Рыбальченко В.К., Коганов М.М. 1998. Структура и функции мембран. Киев: Выща школа. 312 с.
Lowry D.H., Rosebrough H.J., Farr A.L., Randall R.J. 1951. Protein measurement with the Folin-phenol reagent. J. Biol. Chem. 193 (1), 265–275.
Schönbrunn E., Eschenburg S., Luger K. 2000. Structural basis for the interaction of the fluorescence probe 8-anilino-1-naphthalenesulfonate (ANS) with the antibiotic target MurA. Proc. Natl. Acad. Sci. USA. 97 (12), 6345-634.
Донцов В.И. 2013. Флуоресцентные зонды в изучении внутриклеточных изменений при старении: изменения микровязкости мембран клеток. В сб.: Докл. МОИП. Секция Геронтологии. Ред. Донцов В.И. М.: МОИП, с. 73–78.
Vekshin N.L. 1987. Use of pyrene as a luminescence indicator of the viscosity of model and biological membranes. Nauchnye Doklady Vysshei shkoly. Biologicheskie Nauki. 11, 59–66.
Лукьянова Л.Д. 2019. Сигнальные механизмы гипоксии. М.: РАН, 215 с.
Ягужинский Л.С., Скоробогатова Ю.А., Нестеров С.В. 2017. Функционально значимые низкотемпературные структурные перестройки в митохондриальных мембранах теплокровных животных. Биофизика. 2 (3), 518–524.
Shepelev A.P. 1977. Relationship between the depth of acute hypothermia and the composition and phase transitions of mitochondrial lipids of dog and white rat myocardium. Biofizika. 3, 465–467.
Каландаров А.М., Раджабова З.И., Забелинский С.А., Фейзулаев Б.А., Кличханов Н.К., Чеботарева М.А., Кривченко А.И. 2018. Влияние гипотермии на фосфолипидный и жирнокислотныи состав синаптических мембран мозга крыс. Журн. эволюц. биохим. и физиол. 54 (2), 81–90.
Раджабова З.Г., Забелинскийa С.А., Чеботарева М.А., Шуколюковаa Е.П., Кличханов Н.К., Кривченковa А.И. 2020. Влияние умеренной гипотермии на фосфолипидный и жирнокислотный состав мембран эритроцитов крыс. Биол. мембраны. 37 (2), 134–148.
Кличханов Н.К., Джафарова А.М., Аль-Рабии М.А.М. 2017. Кинетические характеристики ацетилхолинэстеразы и структурно-функциональное состояние мембран эритроцитов крыс при умеренной гипотермии. Биол. мембраны. 34 (3), 201–214.
Маяхи М.Т.Д., Кличханов Н.К. 2012. Влияние даларгина на содержание гормонов гипофизарно-надпочечникового и гипофизарно-тиреоидного эндокринного комплексов в крови крыс при гипотермии. Вопросы общей биологии. Известия Самарского научного центра РАН. 14 (5), 273–277.
Gonzalez S., Nervi A.M., Peluffo R.O., Brenner R.R. 1983. Effect of environmental temperature changes on rat liver fatty acid desaturases. Lipids. 18, 7–11.
Van den Berg J.J., Op den Kamp J.A., Lubin B.H., Kuypers F.A. 1993. Conformational changes in oxidized phospholipids and their preferential hydrolysis by phospholipase A2: A monolayer study. Biochemistry. 32, 4962–4967.
Robertson E, Rottenberg H. 1983. membrane potential and surface potential in mitochondria fluorescence and binding of 1-anilinonaphthalene-sulfonate, membrane potential and surface potential in mitochondria. J. Biol. Chemistry. 258 (18), 11039–11048.
Векшин Н.Л. 2013. Об измерении трансмембранного потенциала митохондрий флуоресцентными зондами. Биофизика. 58 (6), 1074–1080.
Kühlbrandt W. 2015. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13 (1), 1–11.
Slavík J. 1982. Anilinonaphthalene sulfonate as a probe of membrane composition and function. Biochim. Biophys Acta. 694, 1–25.
Vekshin N.L. 2002. Photonics of Biopolymers. Biological and Medical Physics Series. Berlin: Springer. 229 p. https://doi.org/10.1007/978-3-662-04947-1.
Collini M., D’Alfonso L., Baldini G. 2000. New insight onb-lactoglobulin bindingsites by 1-anilinonaphthalene-8-sulfonatefluorescence decay. Protein Sci. 9, 1968–1974.
Hawe A., Sutter M., Jiskoot W. 2008. Extrinsic fluorescent dyes as tools for protein characterization. Pharmac. Res. 25 (7), 1487–1499.
Gasymov O.K., Glasgow B.J. 2007. ANS fluorescence: potential to augment the identification of the external binding sites of proteins. Biochim. Biophys. Acta. 1774 (3), 403–411.
Escobar-Henriques M., Anton F. 2013. Mechanistic perspective of mitochondrial fusion: Tubulation vs. fragmentation. Biochim. Biophys. Acta. 1833 (1), 162–175.
Adamo A.M., Pasquini L.A., Moreno M.B., Oteiza P.I., Soto E.F., Pasquini J.M. 1999. Effect of oxidant systems on the ubiquitylation of proteins in the central nervous system. J. Neurosci. Research. 55, 523–531.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


