Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 5, стр. 363-373
Морфологическая характеристика ядрышка и гетерохроматиновых агрегатов таницитов головного мозга крысы
Д. А. Суфиева a, *, И. М. Плешакова a, Д. Э. Коржевский a
a Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: dinobrione@gmail.com
Поступила в редакцию 11.03.2021
После доработки 05.04.2021
Принята к публикации 07.04.2021
Аннотация
В данной работе изучали структурно-функциональную организацию ядрышка и конститутивного гетерохроматина в различных типах таницитов в ходе постнатального развития и при старении. С помощью иммуногистохимических методов и конфокальной лазерной микроскопии впервые было описано распределение аргентофильных белков ядрышка (нуклеолина и нуклеофосмина), а также гетерохроматиновых скоплений в таницитах на различных этапах постнатального онтогенеза. Была продемонстрирована гетерогенность как в размерах ядрышек, так и в их количестве не только в различных субпопуляциях таницитов, но и в возрастном аспекте, что может свидетельствовать о разном уровне их синтетической активности и способности к пролиферации в ходе раннего развития и старения. Распределение гетерохроматиновых агрегатов различается среди субпопуляций таницитов в ходе старения: α-танициты подвержены интенсивной гетерохроматизации, в то время как β-танициты характеризуются стабильностью организации изучаемых компартментов клеточного ядра. Полученные данные существенно дополняют современное представление об организации структуры клеточного ядра таницитов в ходе нормального развития и старения, что может в последующем послужить основой для установления роли этих субъядерных структур в патологических процессах при различного рода повреждающих воздействиях.
ВВЕДЕНИЕ
Танициты, локализующиеся в области дна третьего желудочка, представляют собой особую популяцию глиальных клеток. Тела этих клеток формируют выстилку инфундибулярного углубления, а базальные отростки проникают в нервную ткань и оканчиваются на кровеносных сосудах, оплетая их своими расширенными терминалями. Отростки таницитов оплетают, в том числе, фенестрированные капилляры портальной системы гипофиза, которая локализуется в срединном возвышении. Таким образом, эти клетки задействованы в формировании ликворо-энцефалического и гематоликворного барьеров. Ранее была показана их роль в регуляции работы подлежащих ядер гипоталамуса – вентромедиального и аркуатного ядер, отвечающих за энергетический баланс организма. Кроме того, будучи производными клеток радиальной глии, танициты сохраняют не только их морфологию и ряд цитохимических характеристик, но также и способность к пролиферации и дифференцировке в нейроны и глию. Выделяют 4 типа таницитов (α1-, α2-, β1- и β2-танициты), различающихся локализацией в пределах инфундибулярного углубления, а также структурными, цитохимическими и функциональными характеристиками [1, 2]. Тем не менее, несмотря на пристальный интерес исследователей к таницитам, такая важная клеточная характеристика, как структурно-функциональная организация ядра в этих клетках, до настоящего момента остается не изученной. При исследовании организации клеточного ядра особое внимание уделяют распределению гетерохроматиновых скоплений и морфологии ядрышка, поскольку эти субъядерные структуры отражают метаболический статус клетки и чувствительны к дегенеративным изменениям.
Одним из важных маркеров, отражающих функциональное состояние клетки, является ядрышко. Поскольку основная функция этой структуры – это участие в биогенезе рибосом, то уровень белкового синтеза в клетке коррелирует с организацией ядрышка. Кроме того, было установлено, что белки ядрышка вовлечены в контроль клеточного цикла, апоптоза и старения, а дислокация этих белков из ядрышка (так называемый “нуклеолярный стресс”) может опосредовать развитие нейродегенеравтивных процессов [3–5]. Другой характеристикой, отражающей клеточную активность, является наличие гетерохроматиновых агрегатов. Гистон H4, триметилированный по лизину 20 (H4K20me3), формирует конститутивный гетерохроматин и участвует в репрессии генов в промоторных участках [6, 7]. Также H4K20me3 важен в подавлении транскрипции повторяющейся ДНК и транспозонов [8]. Было показано, что подавление экспрессии этого гистона приводит к развитию злокачественных образований [9]. Изучение возможных изменений в организации ядрышка и гетерохроматиновых агрегатов в ходе постнатального онтогенеза и при старении, поможет получить новые сведения о функциональном состоянии таницитов в ходе нормального развития.
Цель данного исследования состояла в изучении структурно-функциональной организации ядрышка и конститутивного гетерохроматина в различных типах таницитов в ходе постнатального развития и при старении.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования послужили фрагменты промежуточного мозга крыс-самцов линии Вистар пяти возрастных групп: 7, 14, 30 сутки постнатального развития (n = 3 для каждого срока), взрослые животные (4–5 мес.) (n = 6), старые животные (20–24 мес.) (n = 3). При содержании и умерщвлении животных соблюдали международные правила Хельсинской декларации о гуманном обращении с животными и “Правила проведения работ с использованием экспериментальных животных” (приказ № 755 от 12.08.1977 г. МЗ СССР). Головной мозг был фиксирован в цинк-этанол-формальдегиде [10], обезвожен и залит в парафин обычным способом. Изготавливались фронтальные срезы толщиной 5 мкм на уровне от –3.24 до –4.44 мм по отношению к брегме [11]. После стандартной процедуры депарафинирования срезы подвергали тепловому демаскированию в модифицированном цитратном буфере S1700, pH 6.1 (Dako, Дания) в течение 23 мин в пароварке. Затем были поставлены двойные иммуногистохимические реакции с использованием мышиных моноклональных антител к виментину (клон V-9, Dako) в разведении 1 : 100, кроличьих поликлональных антител к нуклеолину/белку C23 (Abcam, Великобритания) в разведении 1:200, мышиных моноклональных антител к нуклеофосмину/белку B23 (клон FC82291, Sigma-Aldrich, США) в разведении 1 : 100 и поликлональных кроличьих антител к гистону H4K20me3 (Abcam) в разведении 1 : 500. В качестве вторичных реагентов были использованы моновалентный Fab-фрагмент антикроличьего иммуноглобулина осла, конъюгированного с флуорохромом Rhodamine Red-X (RRX) в разведении 1 : 50 (Jackson ImmunoReaserch, США) и моновалентный Fab-фрагмент антимышиного иммуноглобулина осла, меченые биотином в разведении 1 : 100 (Jackson ImmunoReaserch). Затем срезы обрабатывали конъюгатом стрептавидина с флуорохромом Cy2 (Jackson ImmunoResearch) в разведении 1 : 200. Препараты заключали в водорастворимую среду Fluorescence Mounting Medium (Dako). Анализ полученных препаратов проводили при помощи конфокального лазерного микроскопа LSM 710 (Zeiss, Германия). Обработку полученных изображений и трехмерную реконструкцию объектов проводили с помощью компьютерных программ LSM Image Browser и ZEISS ZEN lite (Zeiss). Определение диаметра ядрышек и их количества осуществляли в программах ZEISS Zen lite и Fiji [12] при исследовании не менее 10 случайно выбранных клеток каждого типа таницитов для каждого срока. В тех случаях, когда ядрышек в ядре было больше одного, средний диаметр ядрышек рассчитывали для наибольшего ядрышка. Данные представлены в виде средней ± стандартная ошибка средней. Для количества ядрышек помимо абсолютных значений также рассчитывали медиану (Me). При проведении статистического анализа использовали программу Graph Pad Prism 8. Применяли непараметрический критерий Краскела–Уоллиса с дальнейшим сравнением групп с помощью апостериорного критерия Данна. Значимым считали различия групп при p < 0.05.
РЕЗУЛЬТАТЫ
При проведении двойной иммуногистохимической реакции на виментин (маркер таницитов и эпендимоцитов) и нуклеолин (маркер ядрышка) можно наблюдать, что в дорсальной области дна третьего желудочка выстилка образована кубовидными клетками – эпендимоцитами, которые затем замещаются отросчатыми клетками – таницитами (рис. 1).
Рис. 1.
Дно третьего желудочка головного мозга крысы. Взрослое животное. Двойная иммуногистохимическая реакция на виментин (зеленый) и нуклеолин (красный). Одиночный оптический срез. Масштабный отрезок равен 200 мкм. Увеличенные фрагменты: 1 – α1-танициты; 2 – α2-танициты; 3 – β1-танициты; 4 – β2-танициты. Проекция 16 (1 фрагмент), 26 (2 фрагмент), 21 (3 фрагмент) и 36 (4 фрагмент) оптических стеков. Объектив C-Apochromat 63x/1.20 W Korr M27. Водная иммерсия. Масштабный отрезок равен 5 мкм (1 фрагмент), 10 мкм (2 и 3 фрагменты) и 20 мкм (4 фрагмент). Звездочка – полость третьего желудочка.
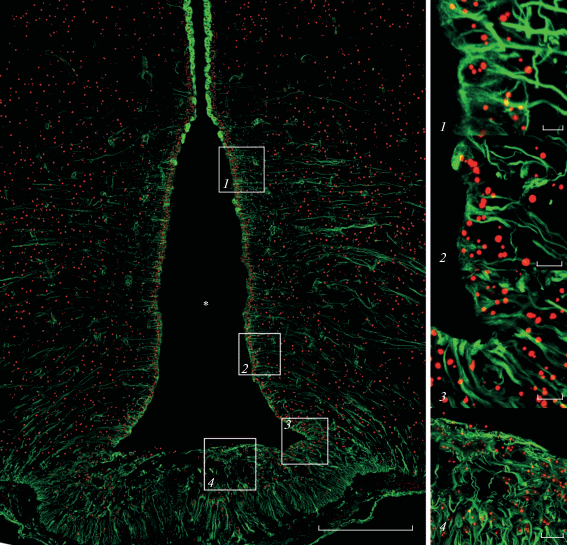
Наиболее дорсально среди таницитов расположены α1-танициты, отростки которых направлены в вентромедиальное ядро гипоталамуса (рис. 1, увеличенный фрагмент 1). У молодых и взрослых животных для этих клеток характерно присутствие от 1 до 4 ядрышек. В основном наблюдалось 1–3 ядрышка (97% случаев), и лишь в единичных клетках встречалось 4 ядрышка (3% случаев). У старых животных, как правило, число ядрышек составляло 1–2, редко 3. Более вентрально относительно α1-таницитов располагаются α2-танициты. Отростки этих клеток направлены в аркуатное ядро (рис. 1, увеличенный фрагмент 2). У 7- и 14-дневных крысят число ядрышек составляло 1–3, в то время как начиная с первого месяца постнатального развития для этих клеток характерно присутствие 1–2 ядрышек, у старых животных в подавляющем большинстве случаев наблюдалось 1 ядрышко. Латеральные области срединного возвышения выстилают β1-танициты, которые образуют многорядную структуру. Центральную область срединного возвышения занимают β2-танициты. Именно β-танициты контактируют с капиллярами фенестрированного типа. Для этих типов таницитов характерно наличие 1–2 ядрышек (рис. 1, увеличенные фрагменты 3 и 4 соответственно). Стоит отметить, что ядрышки таницитов в подавляющем большинстве случаев локализуются на периферии ядра, часто контактируя с ядерной оболочкой.
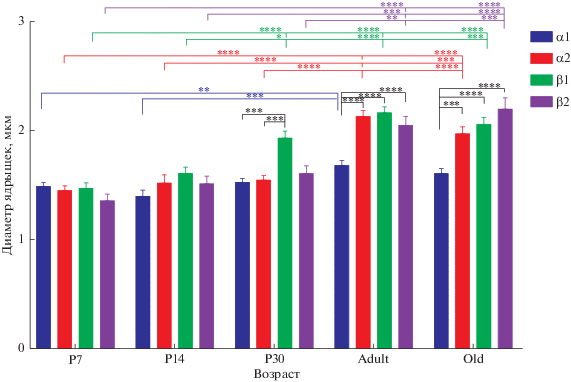
При измерении диаметра наибольшего из ядрышек было установлено, что диаметр ядрышек изменяется с возрастом (табл. 1, рис. 2). Для всех типов таницитов характерно увеличение размеров этой субъядерной структуры в раннем постнатальном развитии (статистически достоверно для 7 и 14 суток постанатального развития при сравнении с одномесячными животными для β1-таницитов и со взрослыми и старыми животными для всех типов таницитов). Максимальный размер ядрышка наблюдается у взрослых животных, в то время как при старении средний диаметр наибольшего ядрышка уменьшается. Кроме того, наблюдается вариабельность в диаметре ядрышка среди различных типов таинцитов в пределах одной возрастной группы. Так, у 30-дневных крысят диаметр ядрышек α1- и α2-таницитов статистически различался при сравнении с диаметром ядрышек β1-таницитов (p < 0.0001 для обоих типов таницитов), а также различались размеры ядрышек β1 и β2 таницитов (p = 0.0006). У взрослых и старых крыс разница наблюдалась между размерами ядрышек α1-таницитов с другими типами таницитов (α2, β1 и β2) (p < 0.0001 для всех групп сравнения, за исключением α1 и α2 у старых животных, здесь p = 0.0003). У 14-дневных крысят различались ядрышки α1 и β1 таницитов (p = 0.0071). У 7-дневных крысят статистически значимой разницы между размерами ядрышек не наблюдалось. Данные по количеству ядрышек и их размеру на разных этапах постнатального онтогенеза представлены в таблице 1.
Таблица 1.
Морфофункциональные характеристики ядрышек различных популяций таницитов в ходе постнатального онтогенеза и при старении
| Параметр | Возраст | Субпопуляция таницитов | |||
|---|---|---|---|---|---|
| α1 | α2 | β1 | β2 | ||
| Количество ядрышек | P7 | 1–4 Me = 2 |
1–3 Me = 2 |
1–3 Me = 2 |
1–2 Me = 2 |
| P14 | 1–3 Me = 2 |
1–3 Me = 2 |
1–2 Me = 2 |
1–3 Me = 1 |
|
| P30 | 1–4 Me = 2 |
1–2 Me = 2 |
1–2 Me = 1 |
1–3 Me = 1 | |
| 4–5 мес. | 1–4 Me = 2 |
1–3 Me = 2 |
1–2 Me = 1 |
1–2 Me = 1 |
|
| 20–23 мес. | 1–3 Me = 1 |
1–2 Me = 1 |
1–2 Me = 1 |
1–2 Me = 1 |
|
| Среднее значение диаметра наибольшего ядрышка ± ± ошибка среднего, мкм | P7 | 1.492 ± 0.03 | 1.473 ± 0.03 | 1.479 ± 0.04 | 1.360 ± 0.06 |
| P14 | 1.367 ± 0.05 | 1.489 ± 0.07 | 1.623 ± 0.05 | 1.513 ± 0.06 | |
| P30 | 1.528 ± 0.03 | 1.516 ± 0.04 | 1.991 ± 0.06 | 1.612 ± 0.07 | |
| 4–5 мес. | 1.679 ± 0.04 | 2.087 ± 0.05 | 2.171 ± 0.05 | 2.059 ± 0.07 | |
| 20–23 мес. | 1.611 ± 0.04 | 1.948 ± 0.06 | 2.068 ± 0.06 | 2.202 ± 0.1 | |
Рис. 2.
Возрастная динамика в размерах ядрышка различных субпопуляций таницитов. Черная линия показывает статистически значимую разницу между разными типами таницитов в пределах одного возраста. Цветные линии показывают статистически значимую разницу в диаметре ядрышек в каждой из популяций таницитов (в соответствии с легендой) между разными возрастными группами. * p < 0.05; ** p < 0.01; *** p < 0.001; **** p < 0.0001.
Для более подробного изучения структурно-функциональной организации ядрышка была поставлена двойная иммуногистохимическая реакция к аргентофильным белкам ядрышка – нуклеолину (белок C23) и нуклеофосмину (белок B23), которые опосредуют гистохимическую окраску ядрышка методом серебрения (метод Ag-NOR). Было установлено, что характер распределения этих двух белков в ядре отличается. Нуклеолин, как правило, распределен в форме тора, или двояковогнутого диска (рис. 4а), в то время как центральная часть ядрышка либо не окрашивается, либо окрашивается, но очень слабо, а также присутствует в виде отдельных скоплений в нуклеоплазме всех типов таницитов. В то время как нуклеофосмин локализуется только в ядрышках таницитов. Кроме того, характер распределения нуклеофосмина в этих субъядерных структурах сильно отличается от ядрышка к ядрышку. Как правило, белок B23 распределен в виде кольца по периферии ядрышка (рис. 3а). Реже этот белок может локализоваться в пределах ядрышка в виде двояковогнутого диска (рис. 3б), подковы (рис. 3в), отдельных глобул внутри ядрышка (рис 3г), а также распределяться в виде структуры округлой формы с поверхностной бороздой (рис. 3д, 3е). При старении характер распределения не меняется, однако центральная часть ядрышка, где нуклеолин и нуклеофосмин практически не присутствует, становится более выраженной (рис. 4а).
Рис. 3.
Характер распределения нуклеофосмина (белка B23) в ядрышках таницитов. Конфокальная лазерная микроскопия. Трехмерная реконструкция. а, б, в – α1-танициты, старые животные; г, е – β1-танициты, старые животные; д – α1-танициты, 7 сутки постнатального развития. Масштабный отрезок 2 мкм.
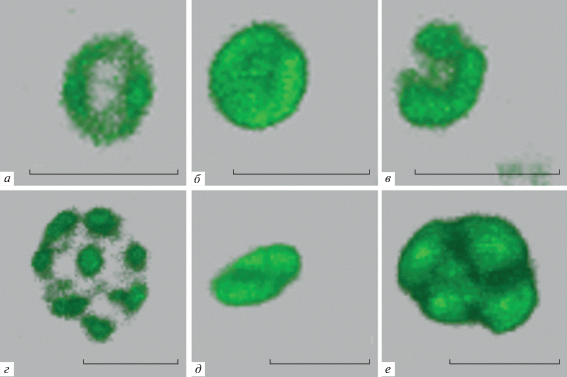
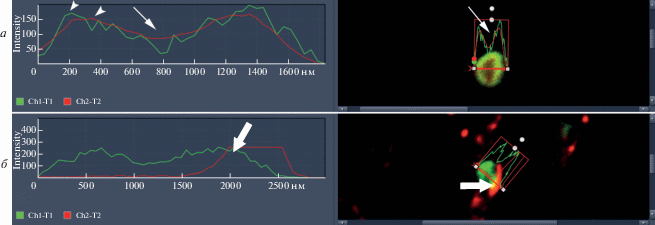
Рис. 4.
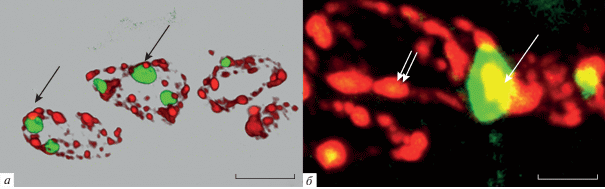
Профиль интенсивности флуоресценции исследуемых белков в ядрышке таницитов. Конфокальная лазерная микроскопия. Одиночный оптический срез. а – Распределение аргентофильных белков нуклеолина (красный цвет) и нуклеофосмин (зеленый цвет) в ядрышке таницитов у старых животных (20–24 мес). Стрелкой отмечена область наименьшей флуоресценции обоих белков. Головка стрелки указывает на пики флуоресценции зеленого и красного каналов. б – Зона колокализации H4K20me3 (красный цвет) и нуклеофосмина (зеленый цвет) в ядрышке таницитов у старых животных (20–24 мес). Область колокализации (желтый цвет) отмечена толстой стрелкой.
При изучении распределения конститутивного гетерохроматина в таницитах и его пространственных взаимоотношениях с ядрышком была поставлена двойная иммуногистохимическая реакция к H4K20me3 и нуклеофосмину. В таницитах конститутивный гетерохроматин представлен в виде отдельных скоплений округлой формы. Они локализуются преимущественно по периферии ядра, однако встречаются и диффузно распределенные глыбки небольшого размера, лежащие в центральной области ядра. Было выявлено, что характерным признаком для всех типов таницитов является увеличение размеров самих гетерохроматиновых глобул в раннем развитии. При старении в α-таницитах значительно увеличивается содержание гетерохроматина как по периферии ядер клеток, так и в центральных областях ядра, а в α1-таницитах может формировать сплошной периферический гетерохроматиновый слой (рис. 5). В β-таницитах содержание гетерохроматиновых агрегатов при старении меняется незначительно. При изучении пространственного расположения гетерохроматиновых скоплений относительно ядрышек было установлено, что в первую неделю развития и у старых животных в α1-таницитах почти все ядрышки погружены в гетерохроматин и окружены им со всех сторон (рис. 5). В α2- и β-таницитах в первую неделю развития, а также во всех типах таницитов на более поздних сроках развития наблюдается наличие околоядрышкового гетерохроматина, который примыкает к ядрышку с одной из сторон в виде небольшой глобулы (рис. 6). Полностью погруженных в гетерохроматин ядрышек на этих сроках выявлено не было. Однако у большинства ядрышек в области примыкания гетерохроматина формируется зона перекрывания (колокализации) нуклеофосмина и H4K20me3. Как правило, это зона небольшая и находится на границе соприкосновения этих двух белков (рис. 4б). В единичных случаях встречается околоядрышковый гетерохроматин, который формирует впячивание в глубь ядрышка (рис. 6).
Рис. 5.
Распределение гетерохроматиновых агрегатов в α1-таницитах. Двойная иммуногистохимическая реакция на H4K20me3 (красный цвет) и нуклеофосмин (зеленый цвет). Трехмерная реконструкция 28 (а) и 29 (б) оптических срезов (режим Transparent). Объектив alpha Plan-Apochromat 100x/1.46 Oil DIC M27 (масляная иммерсия). а – 7 сутки постнатального развития, б – старое животное (20–24 мес.). Стрелки указывают на гетерохроматиновые скопления. Звездочка – полость желудочка.
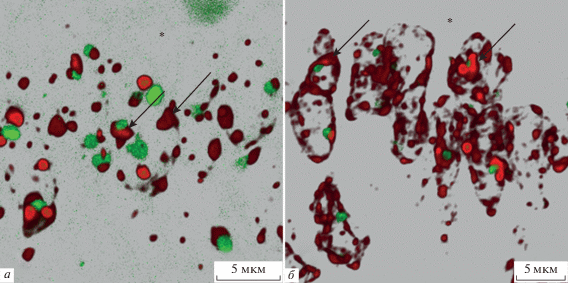
Рис. 6.
Околоядрышковый гетерохроматин в β2-таницитах. Двойная иммуногистохимическая реакция на H4K20me3 (красный цвет) и нуклеофосмин (зеленый цвет). Трехмерная реконструкция 24 оптических срезов (а – режим Transparent; б – модуль Maximum). а – Стрелки указывают на околоядрышковый гетерохроматин. Масштабный отрезок равен 5 мкм. б – Стрелкой отмечен околоядрышковый гетерохроматин, формирующий впячивание в глубь ядрышка. Двойной стрелкой отмечены гетерохроматиновые скопления на периферии ядра таницитов. Масштабный отрезок равен 2 мкм.
ОБСУЖДЕНИЕ
Исследование архитектуры клеточного ядра в настоящее время является одним из магистральных направлений современной клеточной биологии. В нейробиологических исследованиях накоплен большой массив данных об организации ядра и его компонентов нейронов различных структур головного мозга [13–15], в то время как анализу глиальных клеток, в частности таницитов, в этой области уделено незаслуженно мало внимания [16]. Кроме того, исследования, посвященные организации ядра таницитов в постнатальном развитии и при старении, ранее не проводились. В связи с этим данные, представленные в настоящем исследовании, являются актуальными как для нейробиологии, так и для клеточной биологии в целом.
В рамках представленной работы нами были изучены ядрышки различных типов таницитов в раннем постнатальном развитии и при старении. Было установлено, что в раннем развитии количество ядрышек не меняется, однако при старении наблюдается уменьшение их числа. Кроме того, с возрастом для таницитов характерно увеличение размеров этой субъядерной структуры. Полученные результаты соотносятся с литературными данными. Было показано, что ядрышковые организаторы (nucleolar organizer regions, NORs), число которых определяет максимально возможное число ядрышек в клетке, имеют тенденцию с возрастом объединяться и формировать более крупные ядрышки [17]. Также была продемонстрирована завимость размера ядрышек и синтетической активности клетки, а также числа ядрышек и степени дифференицировки клетки [18, 19]. Это может свидетельствовать, что уменьшение числа ядрышек таницитов с возрастом происходит вследствие слияния ядрышек в более крупные, а также с закономерным увеличением синтетической активности по мере становления и формирования клеток в ходе раннего постнатального развития.
Также нами была отмечена разница в организации ядрышек среди различных типов таницитов, которые, несмотря на то что являются единой популяцией клеток, все же значительно отличаются по своим функциональным и цитохимическим свойствам. Это связано с тем, что они взаимодействуют с разными структурами в медиабазальном гипоталамусе и опосредуют их функции. Начиная с 30-х суток постнатального развития, самое крупное ядрышко присутствует в β1-таницитах, в то время как размеры ядрышек других типов исследуемых клеток не различались между собой статистически значимо. У взрослых и старых животных крупные ядрышки встречаются в α2-, β1- и β2-таницитах. Это может указывать на то, что для β1-таницитов высокая синтетическая активность характерна еще в раннем постнатальном развитии, в то время как для α2- и β2-таницитов она свойственна в более поздние сроки развития. Кроме того, полученные данные позволяют выделить популяцию α1-таницитов, для которой типично наличие некрупных ядрышек, но их количество больше, чем в других типах анализируемых клеток (за исключением α2-таницитов) на протяжении всего постнатального развития. Это соответствует мнению о том, что именно этот тип таницитов осуществляет только транспортную, но не секреторную функцию. Кроме того, поскольку количество ядрышек коррелирует со степенью дифференцировки клетки, то присутствие большого числа ядрышек может указывать и на разную способность таницитов к пролиферации. Так, согласно литературным данным, в раннем постнатальном развитии все типы таницитов характеризуются способностью к пролиферации и дифференцировке в нейроны и глию, в то время как у половозрелых животных это свойство сохраняется только у α-таницитов, а β-танициты являются коммитированными нейральными прогениторными клетками [1].
В рамках представленной работы нами были изучены два основных аргентофильных белка ядрышка – нуклеолин (белок C23) и нуклеофосмин (белок B23/NPM1). Было установлено, что и для нуклеолина, и для нуклеофосмина типично распределение в виде кольца или двояковогнутого диска. Однако характер распределения этих белков в ядрышках таницитов несколько различается. Так, пик интенсивности флуоресценции этих белков не совпадает: пик интенсивности флуоресценции нуклеолина располагается ближе к центру, по сравнению с нуклеофосмином, который тяготеет к периферии ядрышка (рис. 4а). Вероятно, такое распределение связано с тем, что, хотя оба этих белка задействованы в биогенезе рибосом, они вовлечены в разные этапы сборки прорибосомных частиц. Так, нуклеолин имеет высокую аффинность к одноцепочечной рДНК, в области нетранскрибируемого спейсера рДНК, расположенного выше сайта инициации транскрипции и, как следствие, регулирует транскрипцию рРНК, а также этот белок необходим для созревания рРНК и правильной сборки рибосомных частиц, т.е. задействован в ранних этапах созревания рибосомных субъединиц [20, 22]. Нуклеофосмин регулирует поздние этапы созревания рибосомных частиц, а именно он регулирет препроцессинг рРНК, действуя как эндорибонуклеаза, осуществялет высвобождение 28S рРНК посредством связывания со вторым внутренним транскрибируемым спейсером (ITS2) пре-РНК, а также задействован в экспорте субъединиц рибосом в цитоплазму [23, 24]. Отсутствие реакции либо слабая реакция к изучаемым белкам в центральных областях ядрышка может быть связано с тем, что часто здесь может локализоваться фибриллярный центр (ФЦ), в котором изучаемые белки, как правило, отсутствуют, что особенно отчетливо видно в крупных нейронах, где описан гигантский ФЦ [25].
Известно, что белок C23 является многофункциональным белком и выявляется в ядрышке, нуклеоплазме, цитоплазме и на плазматической мембране разных клеток. Различные посттрансляционные модификации нуклеолина и осуществление челночного транспорта опосредуют его многофункциональность. Было показано, что этот белок, помимо участия в биогенезе рибосом, задействован в организации и стабильности хроматина, метаболизме ДНК и РНК, цитокинезе, пролиферации клеток и их выживании, ангиогенезе, регуляции апоптоза, реакции на стресс и процессинге микроРНК, участии в межклеточном сигналинге, а также задействован в ряде патологических процессов [20, 25, 26]. В настоящем исследовании было установлено, что в таницитах нуклеолин помимо ядрышка также локализовался в нуклеоплазме в виде диффузно распределенных глыбок, но не в цитоплазме и не на плазматической мембране клеток. Неравномерность распределения нуклеолина в пределах нуклеоплазмы может быть связана с тем, что этот белок может выступать в качестве шаперона гистонов и локально регулировать транскрипционную активность различных генов. В то время как отсутствие этого белка в цитоплазме и на плазматической мембране может быть связана либо с недостаточной чувствительностью иммуногистохимического метода для выявления небольшого содержания этого белка в этих клеточных компартментах, либо с тем, что в таницитах, этот белок преимущественно задействован в ядрышковых и ядерных процессах.
В свою очередь, нуклеофосмин выявлялся только в пределах ядрышка исследуемых клеток. Согласно литературным источникам, нуклеофосмин локализуется в ядрышке (80% от общего содержания белка) и в нуклеоплазме (20% от общего содержания белка), а также может курсировать между ядрышком, цитоплазмой и плазматической мембраной, осуществляя челночный транспорт различных белков. Существует две изоформы нуклеофосмина – B23.1 и B23.2. N-Концевой и центральный домены у этих изоформ идентичны, в то время как C-концевой домен (имеющий сигнал ядрышковой локализации, Nucleolar localisation signal, NoLS) присутствует только в изоформе B23.1. Это обуславливает преимущественную локализую изоформы B23.1 в ядрышке, а B23.2 – в нуклеоплазме [27]. В настоящем исследовании были использованы антитела, которые выявляют C-концевой участок белка B23, т.е. изоформу B23.1, что объясняет его идентификацию только в пределах ядрышка таницитов.
Распределение гетерохроматиновых агрегатов также является важной характеристикой клеточного ядра. Гетерохроматин входит в состав сразу нескольких ядерных субкомпартментов, таких как ламинассоциированные домены, теломерные и центромерные участки, околоядрышковый гетерохроматин и др. В данном исследовании было показано, что с возрастом наблюдается увеличение размеров гетерохроматиновых скоплений в ядрах α1-таницитов, при этом в β-таницитах содержание гетерохроматина меняется незначительно. В литературных источниках данные об изменении содержания конститутивного гетерохроматина при старении противоречивы. Согласно одним данным, при старении происходит значительное снижение гетерохроматизации в клетках различных типов, так называемая “модель старения с потерей гетерохроматина” (heterochromatin loss model of aging) [28, 29]. Однако в исследовании Lezhava [30] было показано, что при старении в лимфоцитах человека происходит интенсивная гетерохроматизация хромосом. Предполагается, что в данном случае возрастное (после 70 лет) накопление хромосомных аберраций и аннеуплоидий, происходит вследствие активной гетерохроматизации ДНК и невозможности физического доступа репаративных ферментов к этим участкам. Прогрессивное усиление гетерохроматинизации при старении способствует инактивации ряда ранее функционирующих “активных генов”. Это приводит к блоку определенных этапов метаболических процессов клеточных систем, которые происходят в норме, в результате чего недостаток многих специфических ферментов рано или поздно приводит к патологиям старения [30]. Вероятно, α-танициты также являются тем типом клеток, которые подвергаются гетерохроматизации при старении, что может отражаться на их функциях. В этом отношении при старении β-танициты характеризуются стабильностью организации изучаемых компартментов клеточного ядра, что, возможно, связано с их уникальной локализацией в области срединного возвышения, где располагаются капилляры фенестрированного типа (т.е. лишенные гематоэнцефалического барьера). Вероятно, это необходимо для поддержания нормального функционирования не только самих β-таницитов, но и адекватной работы гипоталамо-гипофизарной оси в целом.
При изучении пространственных взаимоотношений ядрышек и гетерохроматина было установлено, что ядрышки всех типов таницитов на всех исследованных сроках находятся в тесной ассоциации с околоядрышковым конститутивным гетерохроматином. В области их контакта формируется зона колокализации, что может свидетельствовать о структурно-функциональном взаимодействии этих двух компартментов. Известно, что нуклеофосмин имеет сайты связывания с тетрамером гистонов H3-H4 и H2A-H2B, а также линкерным гистоном H1. Связываясь с гистоном, белок B23 выступает в качестве шаперона гистонов, и принимает участие в формировании нуклеосомной частицы [31]. Ранее Lafarga и соавт. [32] в своих работах показали, что околоядрышковый гетерохроматин в ряде случаев формирует впячивание – хроматиновую ножку (chromatine pedicle), которая проходит через ПФК и касается фибриллярного центра ядрышка. Нами также было обнаружено, что в единичных клетках встречается околоядрышковый гетерохроматин, который формирует впячивание в глубь ядрышка.
Таким образом, настоящее исследование представляет собой первый сравнительно-онтогенетический анализ ядрышек и конститутивного гетерохроматина в различных типах таницитов в ходе раннего постнатального развития и при старении. В данной работе была показана гетерогенность как в размерах ядрышек, так и в их количестве не только между различными субпопуляциями таницитов, но и в возрастном аспекте, что может свидетельствовать о различном функциональном статусе этих клеток. Так, было показано увеличение размеров ядрышек и уменьшения их количества с возрастом, что, вероятно, говорит о закономерном увеличении синтетической активности по мере становления и формирования клеток в ходе раннего постнатального развития. Впервые описано распределение главных аргентофильных белков ядрышка, нуклеолина и нуклеофосмина, а также конститутивного гетерохроматина в таницитах на различных этапах развития. Было продемонстрировано, что нуклеолин и нуклеофосмин имеют различную пространственную локализацию в пределах ядрышка. Распределение гетерохроматиновых скоплений различается среди субпопуляций таницитов в ходе старения: α-танициты подвержены интенсивной гетерохроматизации, в то время как β-танициты характеризуются стабильностью организации изучаемых компартментов клеточного ядра. Полученные данные существенно дополняют современное представление об организации ядрышкового аппарата и гетерохроматина в таницитах в ходе нормального развития и старения, что создает условия для определения роли этих субъядерных структур в патологических процессах при различного рода повреждающих воздействиях.
Представленные изображения получены с помощью оборудования Центра коллективного пользования научным оборудованием “Микробиом человека” при ФГБНУ “Институт экспериментальной медицины”.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа финансировалась из средств Государственного задания ФГБНУ “Институт экспериментальной медицины”.
Соответствие принципам этики. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Prevot V., Dehouck B., Sharif A., Ciofi P., Giacobini P., Clasadonte J. 2018. The versatile tanycyte: A hypothalamic integrator of reproduction and energy metabolism. Endocr Rev. 39 (3), 333–368.
Rodríguez E., Guerra M., Peruzzo B., Blázquez J.L. 2019. Tanycytes: A rich morphological history to underpin future molecular and physiological investigations. J. Neuroendocrinol. 31 (3), e12690.
Parlato R., Kreiner G. 2013. Nucleolar activity in neurodegenerative diseases: A missing piece of the puzzle? J. Mol. Med (Berl). 91 (5), 541–547.
Parlato R., Bierhoff H. 2015. Role of nucleolar dysfunction in neurodegenerative disorders: a game of genes? AIMS Mol. Sci. 2 (3), 211–224.
Yang K., Yang J., Yi J. 2018. Nucleolar stress: Hallmarks, sensing mechanism and diseases. Cell Stress. 2 (6), 125–140.
Kourmouli N., Jeppesen P., Mahadevhaiah S., Burgoyne P., Wu R., Gilbert D.M., Bongiorni S., Prantera G., Fanti L., Pimpinelli S., Shi W., Fundele R., Singh P.B. 2004. Heterochromatin and tri-methylated lysine 20 of histone H4 in animals. J. Cell. Sci. 117 (Pt 12), 2491–501.
Wang Z., Zang C., Rosenfeld J.A., Schones D.E., Barski A., Cuddapah S., Cui K., Roh T.Y., Peng W., Zhang M.Q., Zhao K. 2008. Combinatorial patterns of histone acetylations and methylations in the human genome. Nat. Genet. 40 (7), 897–903.
Schotta G., Lachner M., Sarma K., Ebert A., Sengupta R., Reuter G., Reinberg D., Jenuwein T. 2004. A silencing pathway to induce H3-K9 and H4-K20 trimethylation at constitutive heterochromatin. Genes Dev. 18 (11), 1251–1262.
Fraga M.F., Ballestar E., Villar-Garea A., Boix-Chornet M., Espada J., Schotta G., Bonaldi T., Haydon C., Ropero S., Petrie K., Iyer N.G., Pérez-Rosado A., Calvo E., Lopez J.A., Cano A., Calasanz M.J., Colomer D., Piris M.A., Ahn N., Imhof A., Caldas C., Jenuwein T., Esteller M. 2005. Loss of acetylation at Lys16 and trimethylation at Lys20 of histone H4 is a common hallmark of human cancer. Nat. Genet. 37, 391–400.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Grigorev I.P. 2015. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde. Eur. J. Histochem. 59 (3), 2530.
Paxinos G., Watson C. 2007. The rat brain in stereotaxic coordinates. 6th edition. New York: Elsevier/Academic Press. 456 p.
Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., Preibisch S., Rueden C., Saalfeld S., Schmid B., Tinevez J.Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P., Cardona A. 2012. Fiji: An open-source platform for biological-image analysis. Nat. Meth. 9 (7), 676–682.
Berciano M.T., Villagrá N.T., Pena E., Navascués J., Casafont I., Lafarga M. 2002. Structural and functional compartmentalization of the cell nucleus in supraoptic neurons. Microsc. Res. Tech. 56 (2), 132–142.
Pleshakova I., Gusel’nikova V., Sufieva D., Korzhevskii D. 2018. The distribution of the nucleophosmin (B23) and histone H4K20me3 in the granule cells of the rat cerebellar cortex. Tsitologiya. 60, 632–638.
Cohen S., Greenberg M.E. 2008. Communication between the synapse and the nucleus in neuronal development, plasticity, and disease. Annu. Rev. Cel.l Dev. Biol. 24, 183–209.
Sufieva D.A., Kirik O.V., Korzhevskii D.E. 2018. Nucleolin and nucleoli in ependymocytes and tanycytes of the third ventricle of the rat brain. Cell Tiss. Biol. 12, 167–173.
Pena E., Berciano M.T., Fernandez R., Ojeda J.L., Lafarga M. 2001. Neuronal body size correlates with the number of nucleoli and Cajal bodies, and with the organization of the splicing machinery in rat trigeminal ganglion neurons. J. Comp. Neurol. 430 (2), 250–263.
Жарская О.О., Зацепина О.В. 2007. Динамика и механизмы реорганизации ядрышка в митозе. Цитология. 49 (5), 355–369.
Watanabe-Susaki K., Takada H., Enomoto K., Miwata K., Ishimine H., Intoh A., Ohtaka M., Nakanishi M., Sugino H., Asashima M., Kurisaki A. 2014. Biosynthesis of ribosomal RNA in nucleoli regulates pluripotency and differentiation ability of pluripotent stem cells. Stem Cells. 32 (12), 3099–3111.
Tajrishi M.M., Tuteja R., Tuteja N. 2011. Nucleolin: The most abundant multifunctional phosphoprotein of nucleolus. Commun. Integr. Biol. 4 (3), 267–275.
Feric M., Vaidya N., Harmon T.S., Mitrea D.M., Zhu L., Richardson T.M., Kriwacki R.W., Pappu R.V., Brangwynne C.P. 2016. Coexisting liquid phases underlie nucleolar subcompartments. Cell. 165 (7), 1686–1697.
Ginisty H., Sicard H., Roger B., Bouvet P. 1999. Structure and functions of nucleolin. J. Cell. Sci. 112 (Pt 6), 761–772.
Lindström M.S. 2011. NPM1/B23: A multifunctional chaperone in ribosome biogenesis and chromatin remodeling. Biochem. Res. Int. 2011, 195209.
Colombo E., Alcalay M., Pelicci P. 2011. Nucleophosmin and its complex network: A possible therapeutic target in hematological diseases. Oncogene. 30, 2595–2609.
Guselnikova V.V., Sufieva D.A., Korzhevsky D.E. 2020. Nucleophosmin, coilin, and argentophilic (AgNOR) proteins in the neurons of human substantia nigra. Cell Tiss. Biol. 14, 380–387.
Jia W., Yao Z., Zhao J., Guan Q., Gao L. 2017. New perspectives of physiological and pathological functions of nucleolin (NCL). Life Sci. 186, 1–10.
Ugrinova I., Petrova M., Chalabi-Dchar M., Bouvet P. 2018. Multifaceted nucleolin protein and its molecular partners in oncogenesis. Adv. Protein Chem. Struct. Biol. 111, 133–164.
Владимирова Н.М., Потапенко Н.А., Сурина Е.А., Вольпина О.М. 2014. Особенности структурного состояния белка В23/нуклеофозмина в клетках головного мозга. Биол. мембраны. 31 (1), 57–67.
Wang J., Jia S.T., Jia S. 2016. New insights into the regulation of heterochromatin. Trends Genet. 32 (5), 284–294.
Lee J.H., Kim E.W., Croteau D.L., Bohr V.A. 2020. Heterochromatin: An epigenetic point of view in aging. Exp. Mol. Med. 52, 1466–1474.
Lezhava T. 2001. Chromosome and aging: Genetic conception of aging. Biogerontology. 2 (4), 253–260.
Frehlick L.J., Eirín-López J.M., Ausió J. 2007. New insights into the nucleophosmin/nucleoplasmin family of nuclear chaperones. Bioessays. 29 (1), 49–59.
Lafarga M., Berciano M.T., Hervas J.P., Villegas J. 1989. Nucleolar organization in granule cell neurons of the rat cerebellum. J. Neurocytol. 18 (1), 19–26.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


