Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 6, стр. 418-426
Участие переносчика фосфата в ионофорном разобщающем действии ω-гидроксипальмитиновой кислоты в митохондриях печени
М. В. Дубинин a, *, А. А. Семенова a, О. Э. Краснощекова a, В. Н. Самарцев a
a Марийский государственный университет
424000 Йошкар-Ола, Республика Марий Эл, Россия
* E-mail: dubinin1989@gmail.com
Поступила в редакцию 09.04.2021
После доработки 13.05.2021
Принята к публикации 14.05.2021
Аннотация
В работе исследовано разобщающее влияние ω-гидроксипальмитиновой кислоты (ГПК) на митохондрии печени, энергизованные путем окисления сукцината. Показано, что ГПК более эффективно стимулирует дыхание органелл при условии их инкубации в среде, содержащей хлорид калия, что свидетельствует о способности ГПК оказывать ионофорное влияние на митохондрии, связанное с транспортом ионов калия и/или трис+ в матрикс органелл. Предположено, что в ионофорном действии ГПК может быть задействован переносчик фосфата внутренней мембраны митохондрий. Показано, что субстрат переносчика фосфата – неорганический фосфат (Pi), оказывает существенное ингибирующее влияние на ГПК-индуцированную стимуляцию дыхания митохондрий печени. Кроме того, Pi подавляет ГПК-индуцированное набухание органелл, обусловленное транспортом ионов калия и/или трис+ в матрикс органелл, а также снижает эффективность ГПК как индуктора падения трансмембранного потенциала (Δψ) митохондрий печени. Аналогичное влияние оказывают и ингибиторы переносчика фосфата – N-этилмалеимид (NEM) и иминоди(метилен)фосфонат (ИДМФ). Показано, что при стимуляции дыхания митохондрий 30 мкМ ГПК ресопрягающие эффекты Pi, NEM и ИДМФ составляют соответственно 71 ± 8.3%, 56 ± 6.1% и 34 ± 2.7%. При этом отмечено, что указанные лиганды фосфатного переносчика не влияют на протонофорную активность ГПК. Таким образом, сделан вывод о том, что переносчик фосфата митохондрий принимает участие в ионофорном действии ГПК, предположительно способствуя переносу аниона ГПК с внутреннего монослоя внутренней мембраны на ее наружный монослой.
ВВЕДЕНИЕ
Хорошо известно, что свободные монокарбоновые жирные кислоты обладают способностью переносить протоны и различные моновалентные катионы через искусственные и биологические мембраны, как предполагается, в виде комплекса аниона жирной кислоты и протона (или катиона) [1–7]. Ионы кальция или магния препятствуют быстрому перемещению молекулы жирной кислоты с одного монослоя фосфолипидной мембраны на другой и тем самым нарушают способность жирных кислот к быстрому трансмембранному переносу протонов и моновалентных катионов [1, 4].
Способность свободных жирных кислот переносить протоны через внутреннюю мембрану митохондрий связывают с “мягким” разобщением окислительного фосфорилирования, имеющим большое физиологическое значение [8, 9]. В митохондриях печени в разобщающем действии монокарбоновых жирных кислот и, в частности, пальмитиновой принимают участие белки-переносчики внутренней мембраны, осуществляющие обменный транспорт ADP на ATP (ADP/ATP-антипортер) и аспартата на глутамат (аспартат/глутаматный антипортер) [8, 10–12]. Согласно гипотезе В.П. Скулачева, эти белки содействуют переносу аниона жирной кислоты с внутреннего монослоя мембраны на наружный, где эти анионы протонируются и перемещаются в обратном направлении без участия белков по механизму флип-флоп, освобождая затем протон в матрикс [8]. Специфический ингибитор ADP/ATP-антипортера карбоксиатрактилат и субстраты аспартат/ глутаматного антипортера глутамат и аспартат в митохондриях печени подавляют разобщающее действие жирных кислот (ресопрягающий эффект) [10, 11].
Участием ADP/ATP- и аспартат/глутаматного антипортеров обусловлено около 70–80% разобщающей активности пальмитиновой и других насыщенных жирных кислот [11, 13]. Другая часть разобщающей активности этих жирных кислот (20–30%) подавляется циклоспорином А в необычной для него высокой концентрации 10 мкМ и, по-видимому, осуществляется путем переключения цитохром-bc1-комплекса дыхательной цепи на холостой режим работы в отсутствие синтеза АТР [13, 14].
В отличие от протонофорного разобщения ионофорная активность монокарбоновых жирных кислот в энергизованных митохондриях печени существенно усиливается при повышении рН и сопровождается набуханием органелл [5, 6, 15]. Было предположено, что подобное ионофорное разобщающее действие пальмитиновой кислоты обусловлено циклическим транспортом этой жирной кислоты: из межмембранного пространства в матрикс в виде нейтрального комплекса аниона с катионами K+ и трис+ и в обратном направлении в виде свободного аниона при содействии ADP/ATP-антипортера [15].
Одним из путей метаболизма монокарбоновых жирных кислот у млекопитающих и человека является их ω-окисление, происходящее, главным образом, в клетках печени и почек и приводящее к образованию соответствующих ω-гидроксикарбоновых и α,ω-дикарбоновых кислот [16–18]. Так, в процессе ω-окисления пальмитиновой кислоты образуется ω-гидроксипальмитиновая кислота (ГПК). Путь ω-окисления значительно усиливается при некоторых патологических состояниях, сопровождающихся увеличением содержания свободных монокарбоновых жирных кислот и, в частности, при такой распространенной болезни, как диабет [16, 18, 19]. При этих условиях в крови и клетках пациентов наблюдается накопление продуктов ω-окисления жирных кислот [16, 18, 19]. В клетках печени α,ω-дикарбоновые кислоты подвергаются β-окислению главным образом в пероксисомах, в результате чего образуются короткоцепочечные дикарбоновые кислоты и в конечном итоге сукцинат, эффективно окисляющийся митохондриями [19–21]. Путь ω-окисления жирных кислот рассматривается как один из “путей спасения” (rescue pathway) при различных нарушениях метаболизма, связанных с избыточным накоплением свободных жирных кислот [16, 18].
Молекула ГПК отличается от молекулы пальмитиновой кислоты только наличием гидроксильной группы на конце ацильной цепи – в ω-положении. Известно, что нейтральные молекулы ГПК и пальмитиновой кислоты, но не их анионы, способны перемещаться через фосфолипидную бислойную мембрану по механизму флип-флоп [22]. Однако в отличие от пальмитиновой кислоты, стимуляция дыхания ГПК в митохондриях печени помимо протонофорного действия в существенной степени связана с переносом ионов калия и трис+ в матрикс этих органелл [11]. Можно было бы предположить, что такое ионофорное разобщающее действие ГПК обусловлено циклическим транспортом этой жирной кислоты: из межмембранного пространства в матрикс в виде нейтрального комплекса аниона с катионами калия и трис и в обратном направлении в виде свободного аниона при содействии ADP/ATP- и аспартат/глутаматного антипортеров. Однако ни карбоксиатрактилат, ни глутамат не оказывали влияния на стимуляцию дыхания ГПК [11]. Следовательно, транспорт аниона ГПК из матрикса в межмембранное пространство осуществляется при содействии какого-либо другого белка.
Наше внимание привлек переносчик фосфата – интегральный белок внутренней мембраны митохондрий, который в процессе окислительного фосфорилирования осуществляет перенос аниона неорганического фосфата из межмембранного пространства в матрикс [9, 23, 24]. Известно, что в митохондриях фосфатный переносчик наряду с ATP-синтазой и ADP/ATP-антипортером участвует в формировании комплекса ATP-синтасомы, что способствует повышению общей эффективности окислительного фосфорилирования [23, 24]. Кроме того, в опытах на реконструированной системе со встроенным в липосомы переносчиком фосфата показана способность этого белка ускорять трансмембранный перенос протонов свободными монокарбоновыми жирными кислотами [25, 26]. В митохондриях печени переносчик фосфата, по-видимому, участвует в разобщающем действии подобных жирных кислот только совместно с ADP/ATP- и аспартат/глутаматным антипортерами, выполняя при этом лишь вспомогательную роль [27].
МАТЕРИАЛЫ И МЕТОДЫ
Выделение митохондрий печени крыс. Митохондрии из печени белых половозрелых крыс самцов (весом 210–250 г) выделяли общепринятым методом дифференциального центрифугирования с последующим освобождением от эндогенных жирных кислот с помощью бычьего сывороточного альбумина (БСА) фракции V в соответствии с описанной ранее методикой [28]. Среда выделения содержала 250 мМ сахарозы, 1 мМ EGTA, 5 мМ MOPS (рН до 7.4 доводили трис). Концентрацию белка митохондрий определяли биуретовым методом, в качестве стандарта использовали раствор БСА. Во время проведения эксперимента суспензию митохондрий (60–70 мг митохондриального белка в 1 мл) хранили на льду.
Оценка дыхания митохондрий печени крыс. Дыхание митохондрий регистрировали полярографическим методом при 25°С в термостатируемой ячейке объемом 1 мл с помощью кислородного электрода типа Кларк и установки Oxygraph Plus (Hansatech Instruments, Великобритания). Способность Pi, NEM и ИДМФ ингибировать стимулированное ГПК дыхание (ресопрягающий эффект) выражали в процентах и определяли как отношение величины ингибирования дыхания в присутствии жирной кислоты одним из этих ресопрягающих агентов к величине стимуляции дыхания этой жирной кислотой по формуле: 100 × ΔJu/(Ju – J4), где Ju и J4 – скорости дыхания (мкмоль О2/мин на 1 мг белка) соответственно в присутствии и в отсутствие ГПК, ΔJu – снижение скорости дыхания указанными агентами.
Оценка разности электрических потенциалов (Δψ) на внутренней мембране митохондрий. Разность электрических потенциалов (Δψ) на внутренней мембране митохондрий оценивали по распределению катиона тетрафенилфосфония (ТФФ+) через внутреннюю мембрану, концентрацию которого регистрировали с помощью ТФФ+-чувствительного электрода и многоканальной электрометрической системы Record 4usb в кювете объемом 1.2 мл при 25°C при постоянной аэрации и перемешивании.
В большинстве экспериментов применяли среду инкубации, содержащую 130 мМ KCl, 5 мМ янтарной кислоты, 0.5 мМ EGTA, 10 мМ MOPS (рН до 7.4 доводили трис). В некоторых экспериментах была использована сахарозная среда инкубации: 250 мМ сахарозы вместо KCl.
Оценка ионофорной и протонофорной активности ГПК. Ионофорную активность ГПК оценивали по интенсивности энергозависимого набухания митохондрий путем изменения оптической плотности суспензии митохондрий (А) при длине волны 540 нм на спектрометре Ocean Optics FLAME-T-UV-VIS (Ocean Optics Inc., США) при постоянном перемешивании и при температуре 25°С. Протонофорную активность ГПК оценивали по интенсивности набухания деэнергизованных (недышащих) митохондрий, инкубируемых в изотоническом растворе ацетата калия в присутствии валиномицина [5, 29]. Набухание митохондрий регистрировали путем изменения оптической плотности суспензии митохондрий (А) при длине волны 600 нм на спектрофотометре Ocean Optics FLAME-T-UV-VIS (Ocean Optics Inc.) в ячейке объемом 1 мл при постоянном перемешивании и температуре 25°С. В этом случае применяли среду инкубации, содержащую 145 мМ ацетата калия, 5 мМ трис, 0.2 мМ EDTA, 0.5 мкМ валиномицина и 1 мкМ ротенона (pH 7.4).
При проведении экспериментов в ячейку или в кювету сразу после митохондрий во всех случаях добавляли ротенон (1 мкМ) и, если это необходимо, ТФФ+ (1 мкМ). Все другие добавки осуществляли, как указано в таблице и на рисунках. В контрольных пробах к митохондриям добавляли растворители в том же объеме, как в добавках с исследуемыми веществами. Во всех случаях растворители не оказывали существенного влияния на исследуемые параметры митохондрий.
Статистическая обработка результатов. Данные были проанализированы с использованием программ Graph Pad Prizm 5 и Microsoft Excel и представлены как среднее ± стандартная ошибка средней (n = 3–4). Полученные данные были обработаны статистически с помощью U-критерия Манна–Уитни. Для оценки значимости различий использовался уровень вероятности p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
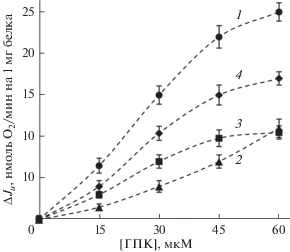
При исследовании ионофорного действия ГПК прежде всего необходимо выяснить особенности стимуляции дыхания митохондрий этой жирной кислотой при замене сахарозной среды инкубации KCl-средой, не содержащей сахарозу. Как видно из рис. 1, ГПК вплоть до ее концентрации 45 мкМ более эффективно стимулирует дыхание митохондрий печени при условии их инкубации в KCl-среде, чем в сахарозной среде. Следовательно, в KCl-среде инкубации активность ГПК как индуктора свободного дыхания может быть обусловлена энергозависимым транспортом ионов в матрикс (ионофорное действие). По этой причине во всех следующих опытах была использована KCl-среда инкубации.
Рис. 1.
Влияние ГПК на дыхание митохондрий печени, инкубируемых в KCl- (1) и сахарозной (2) средах инкубации. Условия опыта и состав среды инкубации описаны в разделе “Материалы и методы”. Концентрация митохондриального белка – 1.2 мг/мл. Приведены средние значения ± стандартная ошибка среднего (n = 4).

В следующих экспериментах было исследовано влияние лигандов переносчика фосфата – его субстрата неорганического фосфата (Pi), а также ингибиторов: N-этилмалеимида (NEM) [30, 31] и иминоди(метилен)фосфоната (ИДМФ) [25, 26] на стимуляцию дыхания митохондрий печени ГПК. Как известно, переносчик фосфата при физиологических условиях, т.е. в процессе синтеза АТР, осуществляет транспорт неорганического фосфата (Pi) совместно с Н+ (или в обмен на ОН–) [9, 23]. В том случае, если синтез АТР не происходит, переносчик фосфата катализирует электронейтральный Pi/Pi-обмен [30, 32]. Следует отметить, что Кm переносчика фосфата митохондрий печени (В изоформа) для Pi составляет 0.78 мM [32]. Следовательно, применяемая нами концентрация Pi 2 мМ существенно больше этой величины. Как видно из таблицы, наличие в среде инкубации Pi в указанной концентрации приводит к небольшой стимуляции дыхания в состоянии 4. Это может быть связано с частичным транспортом Pi совместно с Н+, что проявляется как слабое разобщающее действие Pi. При этом Pi эффективно ингибирует дыхание митохондрий, стимулированное ГПК в концентрации от 15 до 60 мкМ (табл. 1). Вместе с тем Pi не оказывает влияния на дыхание митохондрий в присутствии протонофорного разобщителя 2,4-динитрофенола (ДНФ) в концентрации 50 мкМ необходимой для проявления максимального разобщающего действия (табл. 1). Следовательно, Pi не оказывает ингибирующего влияния на транспорт электронов по дыхательной цепи. NEM в количестве 170 нмоль на 1 мг белка митохондрий полностью ингибирует транспорт Pi в митохондриях печени, по-видимому, взаимодействуя с SH-группой цистеина-41 [30, 31]. Как видно из таблицы, NEM в концентрации 240 мкМ (200 нмоль на 1 мг белка митохондрий) не влияет на дыхание митохондрий в состоянии 4, но эффективно ингибирует (на 35–40%) дыхание в присутствии ГПК. В то же время NEM в указанной концентрации не оказывает влияния на полностью разобщенное ДНФ дыхание (табл. 1).
Таблица 1.
Влияние Pi, NEM и ИДМФ на дыхание митохондрий печени в состоянии 4 и в присутствии ГПК в различной концентрации
| ГПК, мкМ | Скорость дыхания, нмоль О2/мин на 1 мг белка | |||
|---|---|---|---|---|
| контроль (n = 4) |
Pi 2 мМ (n = 3) |
NEM 240 мкМ (n = 3) |
ИДМФ 5 мМ (n = 4) |
|
| 0 | 8.6 ± 0.23 | 10.1 ± 0.23* | 8.9 ± 0.21 | 9.1 ± 0.11 |
| 15 | 15.3 ± 0.53 | 11.9 ± 0.57* | 11.7 ± 0.52* | 12.8 ± 0.29* |
| 30 | 23.9 ± 1.26 | 14.6 ± 0.52* | 15.6 ± 0.69* | 19.2 ± 0.91* |
| 45 | 30.9 ± 1.31 | 17.8 ± 0.63* | 18.2 ± 1.01* | 24.8 ± 0.54* |
| 60 | 33.3 ± 0.93 | 21.8 ± 0.41* | 19.8 ± 0.72* | 26.3 ± 0.78* |
| 60 + ДНФ 50 мкМ | 44.6 ± 1.94 | 46.5 ± 1.44 | 39.7 ± 1.54 | 40.7 ± 2.44 |
Примечание. Условия опыта и состав среды инкубации описаны в разделе “Материалы и методы”. Pi, NEM и ИДМФ были добавлены в экспериментальную ячейку до внесения ГПК. Приведены средние значения ± стандартная ошибка среднего. * Различия между опытом (присутствие модифицирующих агентов) и контролем (их отсутствие) статистически значимы, p < 0.05.
Известно, что при ингибировании транспорта Pi в митохондриях печени Кi для ИДМФ составляет 5.2 мМ [26]. Следовательно, для проявления полного ингибирующего действия концентрация ИДМФ должна составлять как минимум 15 мМ. Однако в наших экспериментах уже в концентрации 10 мМ ИДМФ более чем на 40% снижает скорость полностью разобщенного ДНФ дыхания, что свидетельствует об ингибировании транспорта электронов по дыхательной цепи (данные не приведены). Как видно из таблицы, в концентрации 5 мМ ИДМФ не влияет на дыхание митохондрий в состоянии 4, но частично на 20% ингибирует дыхание в присутствии ГПК в концентрации от 30 до 60 мкМ. При этом в указанной концентрации ИДМФ также не влияет на разобщенное ДНФ дыхание (табл. 1).
Эффективность действия ГПК как индуктора свободного дыхания в митохондриях может быть выражена количественно как величина стимуляции дыхания в состоянии 4 (ΔJ4). Это позволяет сравнить эффективность действия указанных лигандов переносчика фосфата как ингибиторов стимуляции дыхания ГПК. Как видно из рис. 2, наиболее эффективно действуют Pi и NEM, в то время как ИДМФ менее эффективен.
Рис. 2.
Зависимость величин стимуляции дыхания митохондрий печени в состоянии 4 (ΔJu, нмоль О2/мин на 1 мг белка) ГПК от концентрации этой жирной кислоты в отсутствие (1) и присутствии: 2 мМ Pi (2), 240 мкМ NЕМ (3), 5 мМ ИДМФ (4). Условия опыта и состав среды инкубации описаны в разделе “Материалы и методы”. Приведены средние значения ± стандартная ошибка среднего (n = 3).
Ранее для количественной оценки степени ингибирования карбоксиатрактилатом, глутаматом и циклоспорином А стимулированного пальмитиновой кислотой дыхания митохондрий были использованы величины их ресопрягающих эффектов [13, 27]. По аналогии с этими ресопрягающими агентами способность Pi, NEM и ИДМФ ингибировать разобщающее действие жирных кислот также была выражена количественно как ресопрягающий эффект. Так, в отсутствие влияния указанных соединений на действие ГПК их ресопрягающий эффект равен 0, при полном ингибировании – 100%. Проведенные расчеты показали, что при стимуляции дыхания митохондрий 30 мкМ ГПК ресопрягающие эффекты Pi, NEM и ИДМФ составляют соответственно 71 ± ± 8.3% (n = 3), 56 ± 6.1% (n = 3) и 34 ± 2.7% (n = 4).
Выше уже отмечалось, что стимуляция ГПК дыхания митохондрий, инкубируемых в KCl-среде, может быть обусловлена как протонофорным, так и ионофорным действием этой жирной кислоты. Эффективным методом оценки способности различных соединений транспортировать протоны через внутреннюю мембрану митохондрий является регистрация набухания деэнергизованных органелл в изотоническом растворе ацетата калия в присутствии валиномицина [5, 29]. Как видно из рис. 3, в этих условиях ГПК в концентрации 30 мкМ индуцирует набухание митохондрий печени, что свидетельствует о протонофорном действии этой жирной кислоты. Pi и NEM не влияют на набухание митохондрий в присутствии ГПК (рис. 3). Полученные результаты позволяют говорить о том, что указанные лиганды переносчика фосфата не влияют на протонофорную активность ГПК. Следовательно, эффективное ингибирование Pi и NEM стимулированного ГПК дыхания митохондрий может быть связано с подавлением ионофорного действия этой жирной кислоты.
Рис. 3.
Кинетика (а) и скорость (б) набухания митохондрий печени крысы в изотоническом растворе ацетата калия в присутствии валиномицина. На панели а цифрами обозначены кривые, полученные при добавлении различных агентов: 1 – без добавок; 2 – 30 мкМ ГПК; 3 – 2 мМ Pi + 30 мкМ ГПК; 4 – 200 мкМ NEM + 30 мкМ ГПК. Условия опыта и состав среды инкубации описаны в разделе “Материалы и методы”. Концентрация митохондриального белка в кювете – 1 мг/мл. Представлены данные типичного эксперимента, полученные на одном препарате митохондрий. Аналогичные результаты были получены еще в двух независимых экспериментах. На диаграмме б приведены средние значения ± стандартная ошибка среднего (n = 3). * – различия между контролем (без добавок) и экспериментом (с тестируемыми агентами) статистически значимы, p < 0.05.
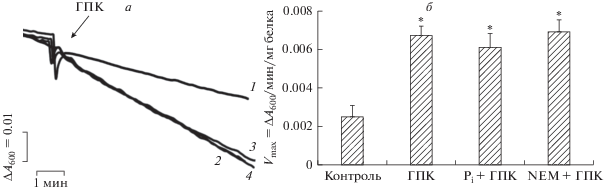
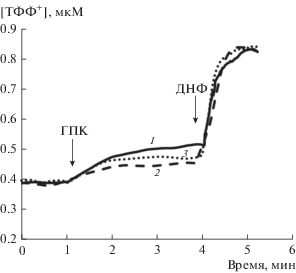
Известно, что транспорт К+ и других моновалентных катионов в матрикс энергизованных митохондрий сопровождается набуханием этих органелл [5, 6, 33–35]. Как показано на рис. 4, ГПК в концентрации 30 мкМ эффективно индуцирует снижение оптической плотности суспензии митохондрий, что свидетельствует о набухании этих органелл. Такое действие ГПК в значительной степени подавляется 2 мМ Pi (рис. 4, кривая 3). Аналогичным действием обладают и ингибиторы переносчика фосфата: NEM (рис. 4, кривая 4) и 5 мМ ИДМФ (рис. 4, кривая 5). При оценке влияния ГПК на трансмембранный потенциал митохондрий печени, инкубируемых в KCl-среде, получены схожие результаты (рис. 5). Действительно, можно видеть, что 30 мкМ ГПК вызывает частичный выход ТФФ+ из органелл, что свидетельствует о снижении мембранного потенциала митохондрий печени. При этом 2 мМ Pi и менее эффективно 200 мкМ NEM снижают такой эффект ГПК. Стоит отметить, что указанные лиганды фосфатного переносчика не влияют на снижение мембранного потенциала митохондрий, индуцированное 50 мкМ ДНФ (рис. 5).
Рис. 4.
Кинетика (а) и скорость (б) набухания митохондрий печени крысы в KCl-среде. На панели а цифрами обозначены кривые, полученные при добавлении различных агентов: 1 – без добавок; 2 – 30 мкМ ГПК; 3 – 2 мМ Pi + 30 мкМ ГПК; 4 – 200 мкМ NEM + 30 мкМ ГПК; 5 – 5 мМ ИДМФ + 30 мкМ ГПК. Условия опыта и состав среды инкубации описаны в разделе “Материалы и методы”. Концентрация митохондриального белка в кювете – 1 мг/мл. Представлены данные типичного эксперимента, полученные на одном препарате митохондрий. Аналогичные результаты были получены еще в двух независимых экспериментах. На диаграмме б приведены средние значения ± стандартная ошибка среднего (n = 3). * – статистически значимые различия между скоростью ГПК-индуцированного набухания в присутствии различных агентов или в отсутствие добавок (Б.д., p < 0.05).
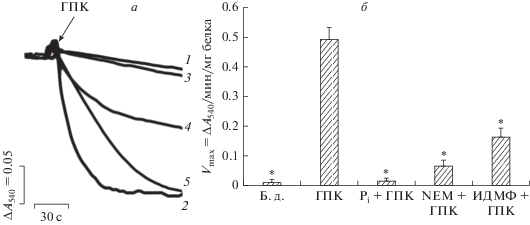
Рис. 5.
Влияние ГПК на разность электрических потенциалов (Δψ) на внутренней мембране митохондрий. Цифрами обозначены кривые, полученные при добавлении различных агентов: 1 – 30 мкМ ГПК, 2 – 2 мМ Pi + 30 мкМ ГПК, 3 – 200 мкМ NEM + 30 мкМ ГПК. Другие добавки: 50 мкМ ДНФ. Условия опыта и состав среды инкубации описаны в разделе “Материалы и методы”. Концентрация митохондриального белка в кювете – 1 мг/мл. Представлены данные типичного эксперимента, полученные на одном препарате митохондрий. Аналогичные результаты были получены еще в двух независимых экспериментах.
Таким образом, полученные результаты свидетельствуют о том, что лиганды переносчика фосфата: его субстрат Pi и ингибиторы – NEM и ИДМФ снижают активность ГПК как индуктора свободного дыхания, связанную с переносом ионов калия в матрикс митохондрий печени (ионофорное действие). Эти данные позволяют говорить о том, что переносчик фосфата в митохондриях печени принимает участие в ионофорном действии ГПК. Как уже отмечалось во введении, нейтральные молекулы ГПК и пальмитиновой кислоты, но не их анионы, способны перемещаться через фосфолипидную бислойную мембрану по механизму флип-флоп [22]. Ионофорное действие ГПК в энергизованных митохондриях печени может быть обусловлено транспортом этой жирной кислоты из межмембранного пространства в матрикс в виде нейтрального комплекса аниона с катионами К+ и (или) трис+. В этом случае можно полагать, что фосфатный переносчик способен содействовать переносу аниона ГПК с внутреннего монослоя внутренней мембраны на наружный монослой. Добавление Pi к митохондриям, вероятно, индуцирует конформационные изменения молекулы переносчика, характерные для транспорта аниона Pi совместно с протоном или для электронейтрального Pi/Pi-обмена [30, 32]. Можно полагать, что в этой конформации переносчик фосфата не способен содействовать переносу аниона ГПК с внутреннего монослоя внутренней мембраны на наружный монослой. Связывание NEM с SH-группами цистеина приводит к конформационным изменениям молекулы переносчика, при которых этот транспорт осуществляется с значительно меньшей скоростью. По-видимому, взаимодействие ИДМФ с переносчиком фосфата приводит к аналогичным изменениям транспорта аниона ГПК.
Как уже было сказано во введении, путь ω-окисления значительно усиливается при некоторых патологических состояниях, сопровождающихся увеличением содержания свободных монокарбоновых жирных кислот, и, в частности, при такой распространенной болезни, как диабет [16, 18, 19]. Подобные нарушения липидного и углеводного обменов приводят к увеличению содержания в том числе и ω-гидроксикарбоновых кислот [16, 18, 19], а также к развитию окислительного стресса [34]. Стимуляция свободного дыхания ГПК сопровождается эффективным ингибированием генерации Н2О2 в изолированных митохондриях печени [11]. Следовательно, индукцию ГПК свободного дыхания в митохондриях печени можно рассматривать как один из “путей спасения” гепатоцитов при различных патологических состояниях, сопровождающихся нарушениями метаболизма углеводов и липидов и усилением окислительного стресса, в том числе и при диабете [36]. Можно полагать, что переносчик фосфата играет существенную роль в действии ГПК как модулятора таких патологических состояний.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при финансовой поддержке РФФИ (№ 20-015-00124).
Соответствие принципам этики. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Wojtczak L. 1974. Effect of fatty acids and acyl-CoA on the permeability of mitochondrial membranes to monovalent cations. FEBS Lett. 44, 25–30.
Кочергинский Н.М., Осак И.С., Демочкин В.В., Рубайло В.Л. 1987. Физико-химический механизм ионофорной активности жирных кислот, стимулирующих трансмембранный обмен одновалентных катионов. Биол. мембраны. 4, 838–848.
Cooper C.E., Wrigglesworth J.M., Nicholls P. 1990. The mechanism of potassium movement across the liposomal membrane. Biochem. Biophys. Res. Commun. 173, 1008–1012.
Sharpe M.A., Cooper C.E., Wrigglesworth J.M. 1994. Transport of K+ and cations across phospholipid membranes by nonesterified fatty acids. J. Membr. Biol. 141, 21–28.
Schӧnfeld P., Wieckowski M.R., Wojtczak L. 2000. Long-chain fatty acid-promoted swelling of mitochondria: further evidence for the protonophoric effect of fatty acids in the inner mitochondrial membrane. FEBS Lett. 471, 108–112.
Schönfeld P., Gerke S., Bohnensack R., Wojtczak L. 2003. Stimulation potassium cycling in mitochondria by long-chain fatty acid. Biochim. Biophys. Acta. 1604, 125–133.
Severin F.F., Severina I.I., Antonenko Y.N., Rokit-skaya T.I., Cherepanov D.A., Mokhova E.N., Vyssokikh M.Y., Pustovidko A.V., Markova O.V., Yaguzhinsky L.S., Korshunova G.A., Sumbatyan N.V., Skulachev M.V., Skulachev V.P. 2010. Penetrating cation/fatty acid anion pair as a mitochondria-targeted protonophore. Proc. Natl. Acad. Sci. USA. 107, 663–668.
Skulachev V.P. 1998. Uncoupling: New approaches to an old problem of bioenergetics. Biochim. Biophys. Acta. 1363, 100–124.
Скулачев В.П., Богачев А.В., Каспаринский Ф.О. 2010. Мембранная биоэнергетика. М.: Изд-во Московского университета. 368 с.
Samartsev V.N., Smirnov A.V., Zeldi I.P., Markova O.V., Mokhova E.N., Skulachev V.P. 1997. Involved of aspartate/glutamate antiporter in fatty acid-induced uncoupling of liver mitochondria. Biochim. Biophys. Acta. 1339, 251–257.
Семенова А.А., Самарцев В.Н., Павлова С.И., Дубинин М.В. 2019. ω-Гидроксипальмитиновая и α,ω-гексадекандикарбоновая кислоты как активаторы свободного дыхания и ингибиторы генерации Н2О2 в митохондриях печени. Биол. мембраны. 36, 428–438.
Bertholet A.M., Chouchani E.T., Kazak L., Angelin A., Fedorenko A., Long J.Z., Vidoni S., Garrity R., Cho J., Terada N., Wallace D.C., Spiegelman B.M., Kirichok Y. 2019. H+ transport is an integral function of the mitochondrial ADP/ATP carrier. Nature. 7766, 515–520.
Samartsev V.N., Semenova A.A., Dubinin M.V. 2020. A comparative study of the action of protonophore uncouplers and decoupling agents as inducers of free respiration in mitochondria in states 3 and 4: theoretical and experimental approaches. Cell Biochem. Biophys. 78, 203–216.
Semenova A.A., Samartsev V.N., Dubinin M.V. 2021. The stimulation of succinate-fueled respiration of rat liver mitochondria in state 4 by α,ω-hexadecanedioic acid without induction of proton conductivity of the inner membrane. Intrinsic uncoupling of the bc1 complex. Biochimie. 181, 215–225.
Самарцев В.Н., Пайдыганов А.П., Полищук Л.С., Зелди И.П. 2004. Изучение разобщающего действия жирных кислот в митохондриях печени при различных рН среды инкубации. Биол. мембраны. 21, 39–45.
Wanders R.J., Komen J., Kemp S. 2011. Fatty acid omega-oxidation as a rescue pathway for fatty acid oxidation disorders in humans. FEBS J. 278, 182–194.
Longo N., Frigeni M., Pasquali M. 2016. Carnitine transport and fatty acid oxidation. Biochim. Biophys. Acta. 1863, 2422–2435.
Ribel-Madsen A., Ribel-Madsen R., Brøns C., Newgard C.B., Vaag A.A., Hellgren L.I. 2016. Plasma acylcarnitine profiling indicates increased fatty acid oxidation relative to tricarboxylic acid cycle capacity in young, healthy low birth weight men. Physiol. Rep. 4, e12977.
Hardwick J.P. 2008. Cytochrome P450 omega hydroxylase (CYP4) function in fatty acid metabolism and metabolic diseases. Biochem. Pharmacol. 75, 2263–2275.
Tserng K.Y., Jin S.J. 1991. Metabolic conversion of dicarboxylic acids to succinate in rat liver homogenates. A stable isotope tracer study. J. Biol. Chem. 266 (5), 2924–2929.
Westin M.A., Hunt M.C., Alexson S.E. 2005. The identification of a succinyl-CoA thioesterase suggests a novel pathway for succinate production in peroxisomes. J. Biol. Chem. 280 (46), 38125–38132.
Jezek P., Modriansky M., Garlid K.D. 1997. Inactive fatty acids are unable to flip-flop across the lipid bilayer. FEBS Lett. 408, 161–165.
Ko Y.H., Delannoy M., Hulliben J., Chiu W., Pedersen P.L. 2003. Mitochondrial ATP synthasome. Cristae-enriched membranes and a multiwell detergent screening assay yield dispersed single complexes containing the ATP and carriers for Pi and ADP/ATP. J. Biol. Chem. 278, 12305–12309.
Beutner G., Alanzalon R.E., Porter G.A. 2017. Cyclophilin D regulates the dynamic assembly of mitochondrial ATP synthase into synthasomes. Sci. Rep. 7, 14488.
Zachova M., Kramer R., Jezek P. 2000. Interaction of mitochondrial phosphate carrier with fatty acids and hydrophobic phosphate analogs. Int. J. Biochem. Cell Biol. 32, 499–508.
Engstová H., Zácková M., Růzicka M., Meinhardt A., Hanus J., Krämer R., Jezek P. 2001. Natural and azido fatty acids inhibit phosphate transport and activate fatty acid anion uniport mediated by the mitochondrial phosphate carrier. J. Biol. Chem. 276 (7), 4683–4691.
Самарцев В.Н., Кожина О.В., Марчик Е.И., Шамагулова Л.В. 2011. Участие переносчика фосфата в разобщающем действии пальмитиновой кислоты в митохондриях печени в составе комплекса с ADP/ATP- и аспартат/глутаматным антипортерами. Биол. мембраны. 28 (3), 206–214.
Dubinin M.V., Samartsev V.N., Stepanova A.E., Khoroshavina E.I., Penkov N.V., Yashin V.A., Starinets V.S., Mikheeva I.B., Gudkov S.V., Belosludtsev K.N. 2018. Membranotropic effects of ω-hydroxypalmitic acid and Ca2+ on rat liver mitochondria and lecithin liposomes. Aggregation and membrane permeabilization. J. Bioenerg. Biomembr. 50 (5), 391–401.
Popova L.B., Nosikova E.S., Kotova E.A., Tarasova E.O., Nazarov P.A., Khailova L.S., Balezina O.P., Antonenko Y.N. 2018. Protonophoric action of triclosan causes calcium efflux from mitochondria, plasma membrane depolarization and bursts of miniature end-plate potentials. Biochim. Biophys. Acta Biomembranes. 1860 (5), 1000–1007.
Ligeti E., Brandolin G., Dupont Y., Vignais P.V. 1985. Kinetic of Pi–Pi exchange in rat liver mitochondria. Rapid filtration experiments in the millisecond time range. Biochemistry. 24, 4423–4428.
Ferreira G.C., Pedersen P.L. 1993. Phosphate transport in mitochondria: past accomplishments, present problems, and future challenges. J. Bioenerg. Biomembr. 25, 483–492.
Fiermonte G., Dolce V., Palmieri F. 1998. Expression in Escherichia coli, functional characterization, and tissue distribution of isoforms A and B of the phosphate carrier from bovine mitochondria. J. Biol. Chem. 273, 22782–22787.
Bernardi P. 1999. Mitochondrial transport of cations: Channels, exchengers, and permeability transition. Physiol. Rev. 79, 1127–1155.
Миронова Г.Д., Качаева Е.В., Копылов А.Т. 2007. Митохондриальный АТФ-зависимый калиевый канал. I. Структура канала, механизмы его функционирования и регуляции. Вестник РАМН. 2, 34–43.
Szabo I., Zoratti M. 2014. Mitochondrial channels: Ion fluxes and more. Physiol. Rev. 94, 519–608.
Belosludtsev K.N., Belosludtseva N.V., Dubinin M.V. 2020. Diabetes mellitus, mitochondrial dysfunction and Ca2+-dependent permeability transition pore. Int. J. Mol. Sci. 21 (18), 6559.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


