Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 6, стр. 434-439
Роль активности киназы гликогенсинтазы 3 в регуляции митохондриального биогенеза в постуральной мышце крысы в условиях антиортостатического вывешивания
И. Д. Львова a, *, К. А. Шарло a, С. В. Рожков a, Т. М. Мирзоев a, Б. С. Шенкман a
a Государственный научный центр Российской Федерации
Институт медико-биологических проблем РАН
123007 Москва, Россия
* E-mail: irrrra1@yandex.ru
Поступила в редакцию 15.04.2021
После доработки 24.05.2021
Принята к публикации 26.05.2021
Аннотация
Функциональная разгрузка скелетных мышц наблюдается как в условиях микрогравитации у космонавтов, так и в земных условиях при постельном режиме, иммобилизации конечностей и различных опорно-двигательных нарушениях. Это состояние характеризуется полным или частичным устранением опорной афферентации, что приводит к исчезновению или значительному снижению сократительной активности постуральной камбаловидной мышцы, последующему “запуску” функциональной перестройки мышц, выражающейся в атрофии мышечных волокон, снижении уровня биогенеза митохондрий, трансформации миозинового фенотипа и, в конечном итоге, приводит к повышенной мышечной утомляемости (мышечной слабости). Киназа гликогенсинтазы 3 (GSK-3) способна регулировать как экспрессию медленной изоформы тяжелых цепей миозина, так и экспрессию ключевого фактора биогенеза митохондрий PGC1α; на основе этих данных мы предположили, что фармакологическое ингибирование GSK-3 на фоне 7 сут функциональной разгрузки (вывешивания) крыс способно предотвратить инактивацию биогенеза митохондрий в камбаловидных мышцах экспериментальных животных. Снижение экспрессии мРНК ключевого фактора биогенеза митохондрий PGC1α, наблюдаемое после 7 сут вывешивания, было предотвращено в группе с введением ингибитора GSK-3. Также было предотвращено снижение экспрессии ряда регуляторов биогенеза и функций митохондрий (TFAM, митофузинов-1 и -2, NRF-1 и NRF-2α) и содержания митохондриальной ДНК. Данные изменения в группе с ингибированием GSK-3 сопровождались частичным предотвращением снижения мРНК гена myh7b, что свидетельствует о возможной корегуляции экспрессии миозиновых генов и митохондриального биогенеза в камбаловидной мышце крысы в условиях функциональной разгрузки.
ВВЕДЕНИЕ
Функциональная разгрузка, наблюдаемая как в условиях микрогравитации при космическом полете, так и в земных условиях при моделировании микрогравитации (антиортостатическое вывешивание грызунов, модель “сухой” иммерсии с участием человека), а также при иммобилизации конечностей и постельном режиме, приводит к мышечной атрофии, снижению мышечного тонуса (атонии), снижению окислительных способностей мышц и трансформации мышечных волокон из “медленного” типа в “быстрый” [1]. В последние годы в нашей лаборатории было показано, что ингибирование киназы GSK-3 предотвращает снижение экспрессии медленной изоформы тяжелых цепей миозина (ТЦМ) в камбаловидной мышце крысы на фоне антиортостатического вывешивания [2]. Также по данным ряда работ, GSK-3 способна инактивировать экспрессию PGC1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha), ключевого регулятора митохондриального биогенеза, на фоне функциональной разгрузки и в процессе миогенеза [3, 4]. Ряд литературных данных свидетельствует о том, что экспрессия медленной изоформы ТЦМ способна регулировать экспрессию ключевого фактора митохондриального биогенеза PGC1α за счет активации сигнального пути микроРНК-208/myh7b/микроРНК-499 [5, 6]. В процессе экспрессии мРНК гена myh7, кодирующего медленную изоформу ТЦМ, также происходит экспрессия микроРНК-208b, закодированной в одном из интронов этого гена. МикроРНК-208b способна индуцировать экспрессию гена myh7b, который представляет собой древний ген одной из миозиновых изоформ, играющий в мышечных волокнах камбаловидной мышцы исключительно регуляторную роль. мРНК гена myh7b кодирует регуляторную микроРНК-499 [7]. Сверхэкспрессия микроРНК-499 в миотубах С2С12 приводит к усилению экспрессии медленной изоформы тропонина tnni1, миоглобина и PGC1α [8]. Таким образом, данная микроРНК играет важную роль в реализации окислительного фенотипа мышечного волокна. Влияние ингибирования GSK-3 на трансформацию миозинового фенотипа в условиях антиортостатического вывешивания было исследовано ранее, однако возможность предотвращения инактивации митохондриального биогенеза в условиях функциональной разгрузки путем ингибирования GSK-3 остается неисследованной. Таким образом, цель работы заключалась в исследовании влияния ингибирования GSK-3 на ряд параметров, регулирующих биогенез митохондрий и экспрессию гена myh7b в постуральной камбаловидной мышце крыс в условиях 7-суточного антиортостатического вывешивания.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения эксперимента было отобрано 24 самца крыс линии Вистар массой 200 ± 10 г и возрастом 2.5 мес. Все животные содержались при температуре 20–25°C, вода и корм грызунам давались без ограничения в соответствии с рационом для лабораторных животных. Эксперимент был проведен согласно биоэтическим правилам проведения исследований на животных и одобрен комиссией по биомедицинской этике ГНЦ РФ – ИМБП РАН (протокол № 421, 14.04.2016). Для решения поставленной задачи в эксперименте проводилось моделирование гравитационной разгрузки в течение 7 сут по методу антиортостатического вывешивания Новикова–Ильина в модификации Morey-Holton [9, 10]. В соответствии с данным методом крысы были вывешены за хвост под углом 30 градусов к полу клетки таким образом, что передние конечности крысы опирались на пол, а задние конечности не касались пола. Животные были случайным образом разделены на 3 группы по 8 особей в каждой: С – группа виварного контроля; 7HS – группа, вывешенная на протяжении 7 сут; 7HS + G – группа, вывешенная на протяжении 7 сут, которой также ежедневно вводили AR-A014418 (ингибитор GSK-3) в дозировке 4 мг на 1 кг массы тела животных. Все препараты вводили внутрибрюшинно, растворенными в 1% DMSO в физрастворе в объеме 1.5 мл. Группам C и HS ежедневно вводили 1.5 мл раствора 1% DMSO в физрастворе. После проведения эксперимента у каждого животного под авертиновым наркозом (трибромэтанол, 240 мг/кг) из обеих ног были выделены камбаловидные мышцы, взвешены на аналитических весах и немедленно заморожены в жидком азоте. Замороженный биоматериал использовали для выделения тотальной РНК и ДНК, а также тотальной белковой фракции.
Для выделения тотальной белковой фракции и последующей оценки содержания в ней GSK-3β, фосфорилированной GSK-3β (Ser 9), гликогенсинтазы (GS) и фосфорилированной GS (Ser 641) был использован набор реагентов RIPA Lysis Buffer System (Santa Cruz, США). При этом дополнительно использовались ингибиторы протеаз Complete Protease Inhibitor Coctail (Santa Cruz), 10 мкг/мл апротинина (Sigma-Aldrich, США), 10 мкг/мл леупептина (Sigma-Aldrich) 10 мкг/мл пепстатина (Sigma-Aldrich), 20 мкл Complete Mini Protease Inhibitor Cocktail (Roche, Швейцария), 40 мкл фосфоингибиторного коктейля (Santa Cruz). Содержание тотальной и фосфорилированной форм GSK-3β проводили методом электрофореза в полиакриламидном геле с последующим иммуноблоттингом, как было описано ранее [11]. Выявление целевых белков проводилось с помощью следующих первичных антител: p-GSK3β (Ser 9) (1 : 1000, #9322, Cell Signaling Technology, США), GSK-3β (1 : 1000, #12456, Cell Signaling Technology), p-glycogen synthase 1 (Ser 641) (1 : 10 000, Abcam, США), anti-glycogen synthase 1 antibody (1 : 1000, ab40867, Abcam). В качестве вторичных антител использовались биотинилированные антитела goat anti-rabbit (sc-2004, Santa Cruz) в разведении 1 : 1000.
Выделение тотальной РНК проводили с помощью набора RNeasy Micro Kit (Qiagen, США) согласно рекомендациям производителя. Для синтеза кДНК использовали набор фирмы Синтол (Россия). Анализ экспрессии генов проводили методом ОТ-ПЦР в реальном времени. Выделение ДНК проводили с использованием набора QIAamp DNA Micro Kit (Qiagen) согласно рекомендациям производителя. Содержание митохондриальной ДНК определяли с помощью ПЦР в реальном времени, в качестве праймеров к митохондриальной ДНК использовали праймеры к COX I. Список использованных в работе праймеров представлен в табл. 1. Анализ данных ПЦР проводился по методу Pfaffl с учетом эффективностей амплификации [12]. Статистическую обработку данных проводили с помощью непараметрического критерия Краскела–Уоллиса с последующим апостериорным тестом Данна. Достоверными считались различия с p < 0.05. В качестве референсного гена использовался RPL19.
Таблица 1.
Праймеры, использованные при проведении ПЦР-анализа в реальном времени
| RPL19 | 5'-GTACCCTTCCTCTTCCCTATGC-3'; 5'-CAATGCCAACTCTCGTCAACAG-3' |
| myh7b | 5'-GAGTGTGGAGCAGGTGGTATTT-3'; 5'-GGACCCCAATGAAGAACTGA-3' |
| PGC1α (PPARGC1A) |
5'-GTGCAGCCAAGACTCTGTATGG-3'; 5'-GTCCAGGTCATTCACATCAAGTTC-3' |
| TFAM1 | 5'-CGCCTGTCAGCCTTATCTGTA-3'; 5'-TGCATCTGGGTGTTTAGCTTA-3' |
| NRF1 | 5'-TTACTCTGCTGTGGCTGATGG-3'; 5'-CCTCTGATGCTTGCGTCGTCT-3' |
| NRF2α | 5'-AAGTGACGAGATGGGCCGC-3'; 5'-CGTTGTCCCCATTTTTGTG-3' |
| Митофузин-1 | 5'-CCACAGAGCTGGACATCTGG-3'; 5'-GAGAGCCGCTCATTCACCTT-3' |
| Митофузин-2 | 5'-AGTCGGTTGGAAGTCACTGT-3'; 5'-TGTACTCGGGCTGAAAGGAG-3' |
| COXI | 5'-ATTGGAGGCTTCGGGAACTG-3'; 5'-AGATAGAAGACACCCCGGCT-3' |
| Медленная изоформа тропонина (Tnni) | 5'-TCTCATCTGCACAGGAACCAAC3' 5'-TGGAGCTCTCGGCATAAGTC3' |
| Миоглобин | 5'-GTGATGGGGAGTGGCAGATG3' 5'-ACTTGACCGGGATCTTGTGC3' |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После 7 сут антиортостатического вывешивания мы обнаружили достоверное снижение уровня фосфорилирования GSK-3β по 9 остатку серина, что свидетельствует об активации данной киназы (рис. 1а) Введение ингибитора GSK-3 не повлияло на уровень фосфорилирования GSK-3β, что было ожидаемо, поскольку принцип действия AR-A014418 не предполагает влияния на посттрансляционные модификации GSK-3β [13]. AR-A014418 является высокоселективным конкурентным ингибитором GSK-3, механизм действия которого основан на препятствии связывания ATP в активном центре фермента. Действие ингибитора было подтверждено с помощью оценки фосфорилирования гликогенсинтазы (GS) – ключевого субстрата GSK-3β.
Рис. 1.
Процент фосфорилирования GSK-3β по Ser 9 (а) и GS по Ser 641 (б) в камбаловидных мышцах крыс. Данные представлены в виде среднего значения ± стандартная ошибка среднего. С – контрольная группа, 7HS – группа 7-суточного антиортостатического вывешивания, 7HS + G – группа 7-суточного антиортостатического вывешивания с введением ингибитора GSK-3. * – достоверные отличия от контрольной группы (p < 0.05).
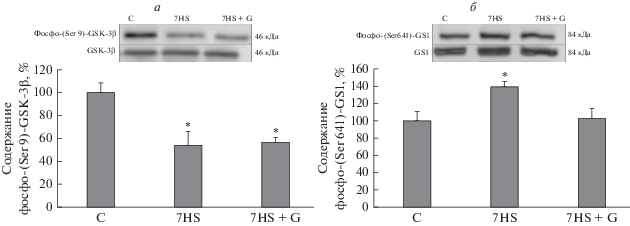
После 7 сут антиортостатического вывешивания мы обнаружили достоверное повышение уровня фосфорилирования GS-1 по 641 остатку серина (рис. 1б), что свидетельствует об активации GSK-3β. Введение ингибитора GSK-3 снизило уровень фосфорилирования GS-1 до контрольного уровня.
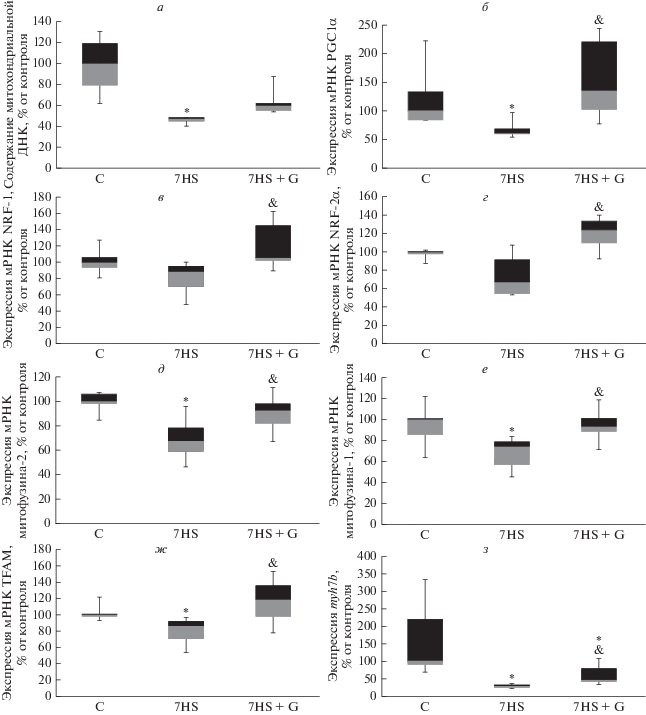
После 7 сут антиортостатического вывешивания содержание митохондриальной ДНК в камбаловидной мышце животных достоверно снизилось вдвое в сравнении с контрольной группой (рис. 2а). Эти результаты соответствуют данным о снижении количества копий митохондриальной ДНК на фоне функциональной разгрузки, полученным другими авторами, и могут считаться показателем снижения уровня биогенеза митохондрий в камбаловидных мышцах при вывешивании [4]. Также после 7 сут вывешивания мы обнаружили снижение уровня экспрессии мРНК ключевого регулятора биогенеза митохондрий PGC1α (рис. 2б), его мишени – фактора транскрипции митохондриальных генов TFAM (рис. 2ж), а также мРНК генов митофузина-1 (рис. 2е) и митофузина-2 (рис. 2д). Снижение других генов-мишеней PGC1α, NRF-1 и NRF-2α, являющихся коактиваторами транскрипции ряда генов, необходимых для биогенеза митохондрий, не было достоверным (рис. 2б–2ж). Введение ингибитора GSK-3 на фоне функциональной разгрузки привело к достоверному повышению содержания митохондриальной ДНК (рис. 2а), повышению экспрессии PGC1α (рис. 2б), митофузинов 1 (рис. 2е) и 2 (рис. 2д), а также TFAM (рис. 2ж) в сравнении со значениями в группе вывешивания с введением плацебо. Стоит отметить, что митофузины 1 и 2 принимают участие в регуляции слияния митохондрий и играют ключевую роль в адаптации мышц к упражнениям на выносливость [14]. Таким образом, GSK-3-зависимое снижение экспрессии данных белков может вносить вклад в развитие повышенной утомляемости скелетных мышц в условиях функциональной разгрузки. При этом введение ингибитора GSK-3 также привело к повышению экспрессии мРНК NRF-1 (рис. 2в) и NRF-2α (рис. 2г) в сравнении с группой вывешивания с введением плацебо. Таким образом, можно сделать вывод, что ингибирование GSK-3 приводит к предотвращению снижения биогенеза митохондрий, вероятно, посредством влияния на уровень экспрессии PGC1α. Эти результаты соответствуют данным, полученным ранее с использованием трансгенных животных [4].
Рис. 2.
Содержание митохондриальной ДНК (а), экспрессия мРНК PGC1α (б), экспрессия мРНК NRF-1 (в), экспрессия мРНК NRF-2α (г), экспрессия мРНК митофузина-2 (д), экспрессия мРНК митофузина-1 (е), экспрессия мРНК TFAM (ж), экспрессия мРНК myh7b (з) в камбаловидных мышцах крыс. Данные представлены в виде медианы, интерквартильного интервала, а также максимумов и минимумов. С – контрольная группа, 7HS – группа 7-суточного антиортостатического вывешивания, 7HS + G – группа 7-суточного антиортостатического вывешивания с введением ингибитора GSK-3. * – достоверные отличия от контрольной группы (p < 0.05), & – достоверные отличия от группы 7HS (p < 0.05).
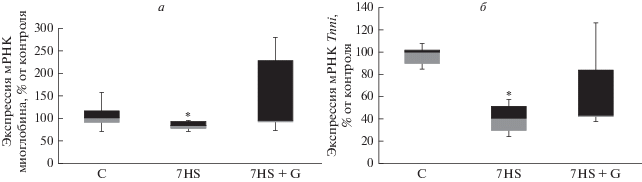
Механизмы влияния GSK-3 на экспрессию PGC1α при функциональной разгрузке остаются неизвестными. Тем не менее известно, что микроРНК-499 способна активировать экспрессию PGC1α [6, 8, 15]. Мы обнаружили, что ингибирование GSK-3 приводит к частичному предотвращению снижения предшественника микроРНК-499, мРНК гена myh7b, в камбаловидных мышцах животных из группы 7HS + G. Также после 7 сут антиортостатического вывешивания мы обнаружили снижение экспрессии мРНК миоглобина и медленной изоформы тропонина (рис. 3), при этом в группе 7HS + G снижение уровня экспрессии данных генов было лишь частично предотвращено (рис. 3). С учетом того факта, что экспрессия этих генов способна регулироваться микроРНК-499, можно предположить, что GSK-3 регулирует их экспрессию за счет влияния на myh7b/микроРНК-499. Таким образом, не исключено, что и эффект GSK-3 на экспрессию PGC1α и митохондриальный биогенез по крайней мере частично осуществляется за счет микроРНК-зависимых регуляторных механизмов.
Рис. 3.
Экспрессия мРНК гена миоглобина (а) и медленной изоформы тропонина (Tnni) (б) в камбаловидных мышцах крыс. Данные представлены в виде медианы, интерквартильного интервала, а также максимумов и минимумов. С – контрольная группа, 7HS – группа 7-суточного антиортостатического вывешивания, 7HS + G – группа 7-суточного антиортостатического вывешивания с введением ингибитора GSK-3. * – достоверные отличия от контрольной группы (p < 0.05).
С учетом того, что GSK-3 является негативным регулятором экспрессии гена медленной изоформы ТЦМ [2], можно заключить, что активация GSK-3 на фоне антиортостатического вывешивания приводит к трансформации фенотипа мышечных волокон в постуральной мышце крысы: от “медленного” (окислительного и устойчивого к утомлению) к “быстрому” (гликолитическому, менее устойчивому к утомлению).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена в рамках проекта РНФ № 17-75-20 152.
Соответствие принципам этики. В настоящей статье все эксперименты были проведены с соблюдением всех биоэтических норм и одобрены комиссией по биомедицинской этике ГНЦ РФ – ИМБП РАН (протокол № 421, 14.04.2016).
Список литературы
Shenkman B.S., Kozlovskaya I.B. 2019. Cellular responses of human postural muscle to dry immersion. Front. Physiol. 10, 1–11.
Sharlo K.A., Lomonosova Y.N., Turtikova O.V., Mitrofanova O.V., Kalamkarov G.R., Bugrova A.E., Shevchenko T.F., Shenkman B.S. 2018. The role of GSK-3β phosphorylation in the regulation of slow myosin expression in soleus muscle during functional unloading. Biochem. (Moscow) Suppl. Ser. A. Membr. Cell Biol. 12, 85–91.
Theeuwes W.F., Gosker H.R., Langen R.C.J., Pansters N.A.M., Schols A., Remels A.H.V. 2018. Inactivation of glycogen synthase kinase 3beta (GSK-3beta) enhances mitochondrial biogenesis during myogenesis. Biochim. Biophys. Acta. Mol. Basis Dis. 1864 (9 Pt B), 2913–2926.
Theeuwes W.F., Gosker H.R., Langen R.C.J., Verhees K.J.P., Pansters N.A.M., Schols A., Remels A.H.V. 2017. Inactivation of glycogen synthase kinase-3beta (GSK-3beta) enhances skeletal muscle oxidative metabolism. Biochim. Biophys. Acta. Mol. Basis Dis. 1863, 3075–3086.
Gan Z., Rumsey J., Hazen B.C., Lai L., Leone T.C., Vega R.B., Xie H., Conley K.E., Auwerx J., Smith S.R., Olson E.N, Kralli A., Kelly D.P. 2013. Nuclear receptor/microRNA circuitry links muscle fiber type to energy metabolism. J. Clin.Invest. 123, 2564–2575.
Liu J., Liang X., Zhou D., Lai L., Xiao L., Liu L., Fu T., Kong Y., Zhou Q., Vega R.B., Zhu M., Kelly D.P., Gao X., Gan Z. 2016. Coupling of mitochondrial function and skeletal muscle fiber type by a miR-499/ Fnip1/AMPK circuit. EMBO Mol. Med. 8, 1212–1228.
van Rooij E., Quiat D., Johnson B.A., Sutherland L.B., Qi X., Richardson J.A., Kelm R.J. Jr., Olson E.N. 2009. A family of microRNAs encoded by myosin genes governs myosin expression and muscle performance. Dev. Cell. 17, 662–673.
Xu M., Chen X., Chen D., Yu B., Li M., He J., Huang Z. 2018. MicroRNA-499-5p regulates skeletal myofiber specification via NFATc1/MEF2C pathway and Thrap1/MEF2C axis. Life Sci. 215, 236–245.
Ильин Е.А., Новиков В.Е. 1980. Стенд для моделирования физиологических эффектов невесомости в лабораторных условиях. Косм. биол. мед. 14 (3), 79–80.
Morey-Holton E.R., Globus R.K. 2002. Hindlimb unloading rodent model: Technical aspects. J. Appl. Physiol. 92 (4), 1367–1377.
Sharlo K.A., Paramonova I.I., Lvova I.D., Vilchin-skaya N.A., Bugrova A.E., Shevchenko T.F., Kalamkarov G.R., Shenkman B.S. 2020. NO-dependent mechanisms of myosin heavy chain transcription regulation in rat soleus muscle after 7-days hindlimb unloading. Front. Physiol. 11, 1–12.
Pfaffl M.W. 2001. A new mathematical model for relative quantification in real-time RT-PCR. Nucl. Acids Res. 29, e45.
Bhat R., Xue Y., Berg S., Hellberg S., Ormö M., Nilsson Y., Radesäter A.C., Jerning E., Markgren P.O., Borgegård T., Nylöf M, Giménez-Cassina A., Hernández F., Lucas J. J., Díaz-Nido J., Avila J. 2003. Structural insights and biological effects of glycogen synthase kinase 3-specific inhibitor AR-A014418. J. Biol. Chem. 278 (46), 45937–45945.
Bell M.B., Bush Z., McGinnis G.R., Rowe G.C. 2019. Adult skeletal muscle deletion of Mitofusin 1 and 2 impedes exercise performance and training capacity. J. Appl. Physiol. 126, 341–353.
Wang J.X., Jiao J.Q., Li Q., Long B., Wang K., Liu J.P., Li Y.R., Li P.F. 2011. miR-499 regulates mitochondrial dynamics by targeting calcineurin and dynamin-related protein-1. Nat. Med. 17, 71–78.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


