Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 6, стр. 440-449
Секреция ацетилхолина в моторных синапсах мыши. Изменение пуринергической регуляции в условиях фармакологической блокады Паннексина 1 и при его генетическом нокауте
А. С. Митева a, *, А. Е. Гайдуков a, О. П. Балезина a
a Московский государственный университет им. М.В. Ломоносова,
биологический факультет
119234 Москва, Россия
* E-mail: anka.miteva@gmail.com
Поступила в редакцию 10.04.2021
После доработки 23.05.2021
Принята к публикации 26.05.2021
Аннотация
В нервно-мышечных синапсах диафрагмы мыши сопоставляли влияние на секрецию ацетилхолина (АХ) острой блокады паннексина 1 (за счет фармакологических агентов: пробенецида, мефлохина и 10Panx1) и отсутствия его экспрессии за счет нокаута гена. Паннексины 1 образуют канал, который может пропускать в синаптическую щель ATP, влияя тем самым на нервно-мышечную передачу. Используя нервно-мышечные препараты мышей дикого типа, регистрировали миниатюрные потенциалы концевой пластинки (МПКП) и вызванные потенциалы концевой пластинки (ПКП) при воздействии различных блокаторов паннексина 1 и агониста Р2Х7-рецепторов (BzATP). Полученные результаты сопоставляли с таковыми для мышей, нокаутных по гену паннексина 1. Отсутствие экспрессии за счет генетического нокаутирования или блокирование паннексина 1 под действием пробенецида или 10Panx1 у мышей дикого типа само по себе не влияет на секрецию АХ, однако позволяет проявиться потенцирующему действию на секрецию АХ со стороны Р2Х7-рецепторов при аппликации их агониста, чего не происходит без блокады паннексина 1. При этом в обоих случаях увеличение секреции АХ осуществляется за счет увеличения размера пула синаптических везикул, готовых к выбросу. Исходя из этого, сделан вывод, что отсутствие экспрессии гена паннексина 1 за счет нокаута и острое блокирование паннексина 1 одинаково влияет на секрецию АХ через уменьшение концентрации пуринов в синаптической щели и, вероятно, механизмы этого влияния схожи. В них вовлечен паннексин 1, как важный участник пуринергической регуляции работы моторного синапса: при его блокаде существенно изменяются условия активации пресинаптических пуринорецепторов.
ВВЕДЕНИЕ
Паннексины – это белки с молекулярной массой порядка 50 кДа, способные образовывать гексамерные комплексы для осуществления трансмембранной канальной функции и проведения ATP и других метаболитов из клеток в межклеточную среду [1]. В последние годы паннексины описаны в составе мембран скелетных мышц, Шванновских клеток и, возможно, аксонов [2, 3]. Известно, что ATP, поступающая из мышцы через паннексины, способна активировать мышечные пуринорецепторы и регулировать метаболизм мышцы [3]. Однако могут ли “паннексиновые” источники пуринов, то есть поступающие в синаптическую щель посредством каналов паннексинов из мышцы, глиальных и других клеток, играть самостоятельную роль в пуринергической регуляции секреции ацетилхолина (АХ), остается не ясным. Для исследования этого вопроса используют разные процедуры острого блокирования каналов, образованных паннексинами 1, или животных с нокаутированным геном паннексина 1 [4]. Недавно мы показали, что при отсутствии экспрессии паннексина 1 за счет генетического нокаутирования у мышей наблюдаются определенные нарушения в активации пресинаптических пуринорецепторов со стороны эндогенных и экзогенных пуринов [5, 6]. Являются ли такие изменения результатом хронических перестроек системы пуринергической регуляции синапсов или они могут также проявляться и при остром выключении паннексинов и соответствующих “паннексиновых” источников эндогенных пуринов в синапсах, остается не ясным. В связи с этим целью данной работы было сравнить изменения пуринергической регуляции работы моторных синапсов мыши в условиях отсутствия экспрессии паннексина 1 за счет генетического нокаутирования и фармакологического выключения активности паннексина 1, блокируя, таким образом, этот источник эндогенных пуринов в синапсах. Для этого использовали регистрацию спонтанной и вызванной электрической активности в моторных синапсах мышей с генетическим нокаутом паннексина 1 или при остром фармакологическом блокировании паннексина 1.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Эксперименты проводили на изолированных нервно-мышечных препаратах диафрагмы (m. diaphragma–n. phrenicus) взрослых мышей дикого типа (WT) линии C57/Bl6 и мышей, нокаутных по гену паннексина 1 (Panx1–/–) обоих полов [7]. Содержание мышей соответствовало директиве 86/609/EEC по обращению человека с лабораторными животными. Всего в исследованиях было использовано 21 животное. Умерщвление животных перед электрофизиологическими экспериментами производилось посредством быстрой декапитации.
Электрофизиология. Эксперименты проводились при температуре 20–22°С. Препарат левой половины диафрагмы с диафрагмальным нервом помещали в камеру объемом 3 мл, перфузируемую оксигенированным (95% O2, 5% CO2) раствором Лайли (pH 7.2–7.4), содержащим (мМ): NaCl – 135, KCl – 4, NaH2PO4 – 0.9, CaCl2 – 2, MgCl2 – 1, NaHCO3 –16.3, глюкоза – 11 (все реактивы поставлены Sigma–Aldrich, США). Исследование спонтанной активности синапсов проводили на нерассеченном препарате. Для предотвращения сокращений мышечных волокон при регистрации вызванной стимуляцией нерва синаптической активности мышечные волокна частично рассекали, используя стандартный протокол [8]. Непосредственно после поперечного рассечения мышечных волокон нервно-мышечный препарат помещали в емкость, содержащую 150 мл раствора Лайли не менее чем на 1 ч для удаления продуктов, выделившихся из рассеченных мышечных волокон и предотвращения блокады проведения потенциала действия по нерву. Это приводило к стабилизации мембранного потенциала мышечных волокон на сниженном по сравнению с нерассеченными волокнами уровне (порядка –50 мВ), что предотвращало сокращение мышцы при стимуляции нерва. Внутриклеточную регистрацию спонтанных миниатюрных потенциалов концевой пластинки (МПКП) и вызванных стимуляцией нерва мультиквантовых потенциалов концевой пластинки (ПКП) осуществляли с помощью стеклянных микроэлектродов, заполненных 2.5 М КCl (сопротивление кончика микроэлектрода 10–20 МОм). Для регистрации вызванной ритмической активности диафрагмальный нерв стимулировали залпами сверхпороговых импульсов длительностью 0.08–0.1 мс с частотой 50 Гц в течение 1 с. Для предотвращения “утомления” синаптической передачи и возможного снижения амплитуд постсинаптических потенциалов, не связанного с действием исследуемых веществ, перерывы между стимуляциями составляли не менее 4 мин. Непосредственно перед стимуляцией нерва проводили регистрацию МПКП в течение 60–100 с (среднее значение амплитуд МПКП, зарегистрированных в этот период, использовали для вычисления квантового состава ПКП). Сигналы регистрировали при помощи усилителя Neuroprobe Amplifier Model 1600 (A-M Systems, США) и записывали их с помощью аналого-цифрового преобразователя Е-154 (L-Card, Россия) с интерфейсом PowerGraph 6.0 (ДИСофт, Россия) на жесткий диск компьютера. Программное обеспечение MiniAnalysis (Synaptosoft, США) использовали для первичного анализа данных. В контроле регистрировали МПКП и ПКП от 4 и более разных синапсов, после чего в перфузионный раствор в определенном порядке добавляли исследуемые вещества, и далее регистрировали активность разных синапсов на протяжении 40–60 мин. В каждой серии экспериментов использовали не менее трех нервно-мышечных препаратов.
Анализ данных и статистика. Оценивали мембранный потенциал, амплитуду и временнóй ход МПКП и ПКП, а также квантовый состав ПКП. Для каждого конкретного синапса регистрировали мембранный потенциал мышечного волокна. В случае регистрации МПКП у интактных мышечных волокон для нивелирования различий движущей силы потенциала на амплитуду синаптических токов стандартизировали значение амплитуд МПКП к величине МП = –70 мВ, а на рассеченном препарате аналогичным образом стандартизировали значения амплитуд МПКП и ПКП, регистрируемых в разных синапсах, к величине МП = –50 мВ. Для расчета квантового состава ПКП производили корректировку амплитуды ПКП на нелинейную суммацию [9], далее делили полученное значение на стандартизованную амплитуду МПКП. Для оценки временнóго хода ПКП вычисляли время спада их амплитуды, начиная от пика ПКП до момента уменьшения амплитуды ПКП на 90% от максимума. Для сравнения параметров секреции АХ у WT мышей и Panx1–/– мышей использовали случайную выборку из 45 синапсов в каждой группе. Сравнивали мембранный потенциал, амплитуду, квантовый состав первого ПКП в залпе, амплитуду МПКП.
Расчет размера пула везикул, готовых к выбросу (RRP) производили, исходя из предположения, что уменьшение квантового состава ПКП по ходу залпа, когда наблюдается последовательное снижение амплитуд ПКП – депрессия нервно-мышечной передачи в залпе ПКП – при высокочастотной ритмической активности происходит из-за истощения RRP, а наступающая после стадия плато отражает баланс между истощением RRP и рекрутированием в него новых везикул. Исходя из этого, для оценки RRP для каждого синапса строили график количества квантов, выбрасываемых при каждом стимуле относительно суммарного количества везикул [10, 11]. В этом случае значение RRP вычисляли как экстраполяцию линейной регрессии участка депрессии залпа на ось X [11]. Значение вероятности выброса рассчитывали, как отношение количества квантов, выделившихся во время первого ПКП, к RRP [11, 12].
Для статистического анализа использовали программу GraphPad Prism 6.0. Нормальность распределения значений параметров оценивалась с помощью теста Д’Агостино–Пирсона. Для оценки амплитуды и частоты МПКП, показателей временнóго хода ПКП в случае нормально-распределенных величин применяли t-критерий Стьюдента, в случае распределения отличающегося от нормального – критерий Манна–Уитни. Для анализа амплитуды и квантового состава ПКП применяли двухфакторный дисперсионный анализ с последующим применением апостериорного критерия Тьюки. Данные представлены в виде среднего ± стандартная ошибка среднего, уровень значимости p = 0.05 (n – количество исследованных синапсов).
Материалы. В работе использовали в качестве блокаторов паннексина 1: мефлохина гидрохлорид (ApexBio Technology, США), водорастворимую форму пробенецида натриевую соль (AAT Bioquest, США), 10Panx1 – пептидный фрагмент WRQAAFVDSY, являющийся пептидным ингибитором канала паннексина 1 (ApexBio Technology); а также BzATP (Sigma–Aldrich). Для приготовления стоковых растворов использовали деионизированную воду.
РЕЗУЛЬТАТЫ
Первая часть исследования была направлена на то, чтобы выявить возможные отличия в параметрах секреции АХ у мышей Panx1–/–, по сравнению таковыми для мышей WT. Для этого использовали анализ параметров спонтанных МПКП, а также ПКП в условиях ритмических залпов ПКП (табл. 1).
Таблица 1.
Сравнение средних значений основных анализируемых характеристик у мышей дикого типа (WT) и мышей, нокаутных по гену паннексина 1 (Panx1–/–). Каждое значение – результат усреднения показателей не менее чем 45 синапсов, случайно выбранных из разных экспериментов
| Параметр | WT | Panx1–/– |
|---|---|---|
| МП, мВ | 38.73 ± 0.81 | 37.81 ± 0.78 |
| Амплитуда МПКП, мВ | 1.09 ± 0.08 | 1.10 ± 0.07 |
| Частота МПКП, Гц | 0.86 ± 0.10 | 0.78 ± 0.12 |
| Амплитуда ПКП, мВ | 22.31 ± 1.89 | 22.84 ± 1.91 |
| Квантовый состав ПКП | 33.42 ± 1.11 | 33.71 ± 1.01 |
Оказалось, что ни один из указанных параметров МПКП и ПКП в диафрагмальных синапсах Panx1–/– мышей не отличался статистически значимо от таковых в синапсах мышей WT. Таким образом, мы подтвердили опубликованные ранее наши данные [5], указывающие на отсутствие различий в параметрах синаптической активности моторных синапсов при отсутствии экспрессии паннексина 1 из-за нокаута соответствующего гена. Однако, как показал более детальный анализ, проведенный в наших предыдущих исследованиях, несмотря на кажущуюся сохранность и неизменность характера активности синапсов у Panx1–/– мышей по сравнению с WT, на самом деле имеют место серьезные нарушения баланса пуринергических тормозных и облегчающих влияний на секрецию АХ у синапсов таких мышей [5]. У Panx1–/– мышей мы наблюдали ограничение эндогенной активации одних рецепторов (например, А1-рецепторов аденозина) [5] и облегчение активации других (например, Р2Х7-рецепторов ATP) [6]. В частности, активация пресинаптических Р2Х7-рецепторов моторных синапсов BzATP (30 мкМ), используемого в микромолярном диапазоне в нервно-мышечных синапсах и других объектах в качестве агониста P2Х7-рецепторов [6, 13–15], у Panx1–/– мышей вызывала потенцирование вызванной секреции АХ, чего не наблюдалось в синапсах WT мышей. Потенцирующее влияние на вызванный выброс АХ проявлялось в единообразном увеличении амплитуды и квантового состава первого и последующих ПКП по всему ходу ритмического залпа при активации Р2Х7-рецепторов.
Известно, что при изменении экспрессии тех или иных белков возможна функциональная перестройка регуляторных систем синапсов за счет изменения работы синаптических рецепторов или других компонентов, ответственных за показатели секреторной активности синапсов [16]. В связи с этим оставался открытым вопрос: являются ли наблюдаемые изменения пуринергической регуляции у Panx1–/– мышей результатом системных перестроек в синапсах в связи с нокаутом гена паннексина 1, либо аналогичный характер изменений пуринергической регуляции может проявляться даже при остром выключении активности паннексинов и “паннексинового” источника пуринов?
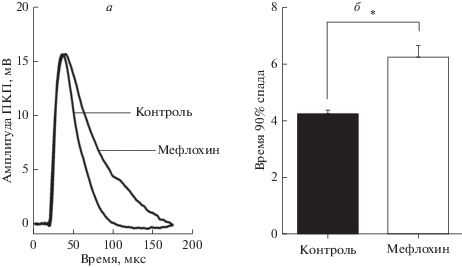
Для решения этого вопроса далее мы исследовали влияние на секрецию АХ фармакологической блокады паннексина 1. Для этого использовали три блокатора: мефлохин (10 мкМ) [17], пробенецид (1 мМ) [18] и пептидный ингибитор 10Panx1 (10 мкМ). Оказалось, что мефлохин не вызывает значимых изменений амплитуды МПКП – значение этого параметра составило 1.26 ± 0.11 мВ (n = 22) в контроле и 1.49 ± 0.07 на фоне блокатора паннексина 1 (n = 27, p > 0.05). Амплитуда и квантовый состав ПКП под действием мефлохина статистически значимо не изменялись по сравнению с контролем. Так, квантовый состав первого ПКП в контроле составил 30.55 ± 2.31 (n = 19), а при действии мефлохина – 32.08 ± 2.77 (n = 13, p > 0.05). При этом мефлохин вызывал значимое увеличение времени спада ПКП (рис. 1). Согласно исследованиям, проведенным в рамках тестирования мефлохина как потенциального лекарства от малярии, данный препарат обладает способностью ингибировать работу ацетилхолинэстеразы, что, по-видимому, приводит к пролонгированию действия АХ в синаптической щели и вызывает увеличение длительности МПКП и ПКП [19]. В связи с проявлением эффекта, вероятно не связанного с непосредственной работой паннексинов, в дальнейших исследованиях мефлохин не применяли.
Рис. 1.
Временнóй ход ПКП в контроле и на фоне 10 мкМ мефлохина: а – Оригинальные записи первого ПКП в залпе в контроле и под действием мефлохина; б – средние значения времени 90% спада первого ПКП в контроле и под действием мефлохина, *p < 0.05 по сравнению с контролем.
Аппликация пептидного ингибитора паннексина 1 10Panx1 не приводила к изменениям секреции АХ у WT мышей. Квантовый состав первого ПКП в залпе в контроле составил 26.01 ± 1.39 (n = 15), а на фоне 10Panx1 23.82 ± 2.39 (n = 13, p > > 0.05); временны́е характеристики ПКП также не изменились. Аналогичный эффект наблюдался и при применении пробенецида: значение квантового состава первого ПКП в контроле составило 31.26 ± 2.04 (n = 15), под действием пробенецида – 32.26 ± 2.15 (n = 14, p > 0.05). В отдельной серии экспериментов мы также установили, что и в синапсах Panx1–/– мышей оба вещества, блокирующих функционирование паннексинов 1, не влияли ни на квантовый состав ПКП, ни на другие параметры передачи.
Таким образом, острая фармакологическая блокада паннексина 1 при помощи пробенецида или 10Panx1 не влечет за собой изменений параметров вызванной и спонтанной секреции АХ. Такие последствия совпадают с картиной неизменных параметров спонтанной и вызванной секреции АХ, зарегистрированных и в синапсах Panx1–/– мышей. Это косвенно свидетельствует о сходстве функциональных изменений в регуляции функционирования моторных синапсов при острой блокаде паннексина 1 и при нокауте соответствующего гена, и об отсутствии радикальных перестроек в рецепторных белках или других структурах нервно-мышечных синапсов у Panx1–/– мышей по сравнению с синапсами WT мышей, подвергшихся острой фармакологической блокаде паннексинов 1.
Вместе с тем, как уже было отмечено выше, ранее мы показали, что одним из важных последствий отсутствия экспрессии паннексина 1 за счет генетического нокаутирования является частичное “растормаживание” активности Р2Х7-рецепторов и возможность наблюдать потенцирующее действие P2Х7-рецепторов на вызванную секрецию АХ при их активации экзогенным агонистом BzATP [6]. Поэтому важно было сравнить, происходит ли аналогичное растормаживание и облегчение активации Р2Х7-рецепторов, и как выглядит изменение квантового состава ПКП под действием BzATP в условиях острой блокады паннексина 1 с помощью 10Panx1 или пробенецида.
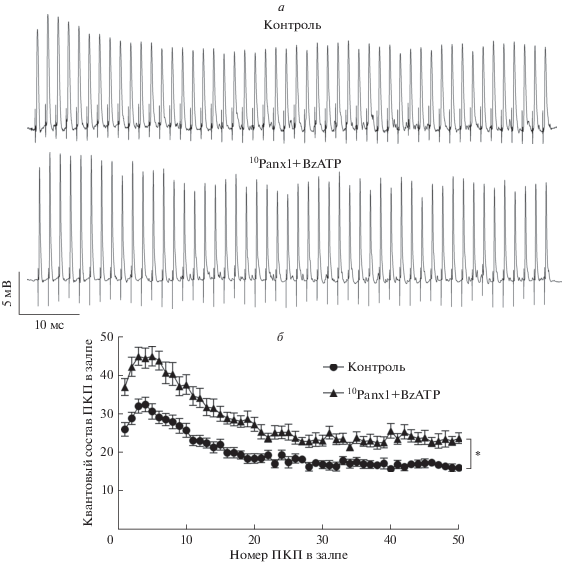
Оказалось, что пробенецид хотя сам по себе и не изменяет параметры вызванного выброса АХ, но при этом позволяет проявиться потенцирующему действию агониста P2X7-рецепторов в отношении квантового состава ПКП. Значение квантового состава ПКП значимо увеличивалось по всему ходу залпа ПКП на 30–50% под действием BzATP в присутствии пробенецида (рис. 2). Аналогичные изменения наблюдались при аппликации BzATP и на фоне другого ингибитора канала паннексина 1 – 10Panx1: в этом случае увеличение квантового состава ПКП по ходу залпа составило 25–55% (рис. 3).
Рис. 2.
Влияние аппликации агониста P2X7-рецепторов на вызванную активность моторных синапсов при блокировании паннексина 1 пробенецидом: а – примеры оригинальных записей ПКП в контроле и на фоне 1 мМ пробенецида совместно с 30 мкМ BZATP; б – изменения квантового состава ПКП по ходу залпа ПКП в контроле (n = 16) и на фоне 1 мМ пробенецида совместно с 30 мкМ BZATP (n = 12) в нервно-мышечных препаратах диафрагмы WT мышей. *p < 0.05 по сравнению с контролем.
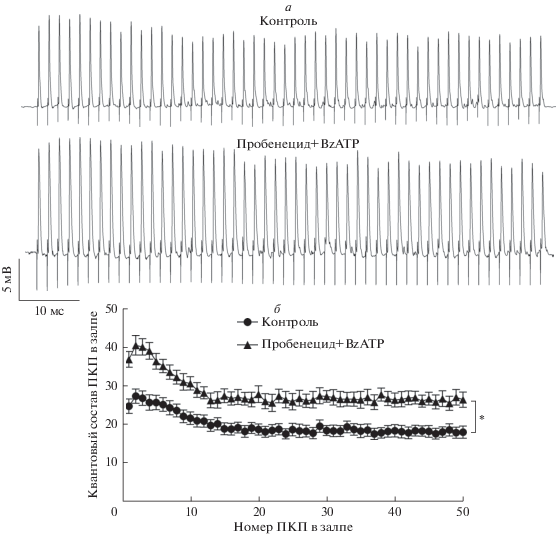
Рис. 3.
Влияние аппликации агониста P2X7-рецепторов на фоне блокады паннексина 1 при помощи 10Panx1: а – примеры оригинальных записей ПКП в контроле и на фоне 10 мкМ 10Panx1 совместно с 30 мкМ BzATP; б – изменение квантового состава ПКП по ходу залпа ПКП в контроле (n = 18) и на фоне 10 мкМ 10Panx1 совместно с 30 мкМ BzATP (n = 16) в нервно-мышечных препаратах диафрагмы WT мышей. *p < 0.05 по сравнению с контролем.
Ранее в наших исследованиях, посвященных исследованию механизмов потенцирующего действия Р2Х7-рецепторов на квантовый состав ПКП при нокауте гена паннексина 1, проводился анализ возможных причин повышения квантового состава ПКП в залпе. Согласно современным моделям функционирования машинерии экзоцитоза и синаптической пластичности [11], увеличение квантового состава может быть связано с возрастанием вероятности выброса квантов АХ или с увеличением в нервной терминали числа непосредственно готовых к высвобождению квантов (RRP). Проведенный расчет размера RRP показал, что индуцируемое агонистом Р2Х7-рецепторов устойчивое и равномерное возрастание квантового состава ПКП у всех ПКП в залпе обусловлено именно увеличением пула синаптических везикул, готовых к выбросу в активных зонах моторных терминалей, но не повышением вероятности выброса квантов АХ из первоначально готового к высвобождению пула [6].
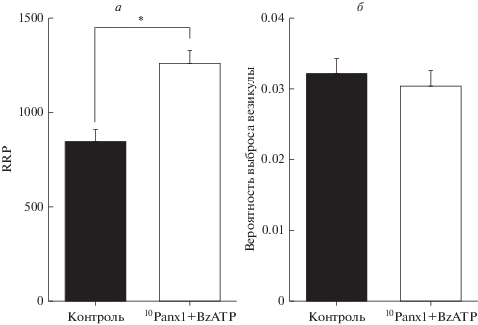
В настоящей работе мы также проверяли, наблюдается ли такой же механизм увеличения квантового состава ПКП в синапсах при острой блокаде паннексинов или же он проявляется только в синапсах Panx1–/– мышей под влиянием долгосрочных эффектов отсутствия экспрессии паннексина 1 и синаптических перестроек. Для этого на основании анализа изменений квантового состава ПКП по ходу залпа, регистрируемых на фоне 10Panx1 и последующей аппликации BzATP, рассчитали изменение размера RRP. Оказалось, что, как и в случае синапсов Panx1–/– мышей, пул везикул, готовых к выбросу, существенно увеличивается от 845.6 ± 63.6 (n = 18) в контроле, до 1261.0 ± 71.0 на фоне совместной аппликации 10Panx1 и BzATP (n = 16, p < 0.05) (рис. 4а). При этом вероятность секреции квантов АХ не отличалась в контроле и в присутствии агониста P2X7-рецепторов при действии пептидного ингибитора паннексина 1 (рис. 4б). Следовательно, сохраняется не только феномен облегченной активации Р2Х7-рецепторов и их способность увеличивать выброс квантов АХ, но и механизм потенцирующего влияния на секрецию АХ, вероятно, совпадает в случае генетической и фармакологической блокады паннексина 1.
Рис. 4.
Сопоставление размеров пула синаптических везикул, готовых к выбросу (RRP) в контроле и на фоне 1 мМ 10Panx1 совместно с 30 мкМ BzATP (а); вероятности выброса везикул в контроле и на фоне 1 мМ 10Panx1 совместно с 30 мкМ BzATP (б) в нервно-мышечных препаратах диафрагмы мышей WT. *p < 0.05 по сравнению с контролем.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенный в данной работе сравнительный анализ последствий острой фармакологической блокады или нокаута гена паннексина 1 в моторных синапсах диафрагмы мыши показал, что такие последствия в отношении регуляции вызванной секреции квантов АХ – одинаковы. В обоих случаях отсутствовали достоверные изменения параметров МПКП в покое и ПКП в ходе ритмической вызванной активности синапсов. Это могло бы означать отсутствие влияния поступающей во внеклеточную среду через каналы, образованные паннексином 1 ATP и ее образующихся метаболитов, на регуляцию работы синапсов. Однако анализ активности пресинаптических пуринорецепторов (в частности, Р2Х7-рецепторов) как регуляторов секреции АХ показал, что в обоих случаях наблюдаются идентичные сдвиги в пуринергических влияниях на работу синапсов, выражающиеся в частности, в появлении у Р2Х7-рецепторов способности потенцировать нервно-мышечную передачу при их активации BzATP, не наблюдавшейся ранее при наличии функционирующих паннексинов 1.
По данным литературы, выключение активности паннексинов под действием фармакологических агентов (пробенецид и др.) или за счет генетического нокаутирования [2, 20] действительно может приводить к уменьшению количества ATP, поступающей из глиальных [21, 22], мышечных [23] или других клеточных источников в межклеточную среду. Среди прочих эффектов такой блокады описаны изменения и параметров синаптической передачи в центральной нервной системе (ЦНС) [24, 25]. В случае отсутствия экспрессии паннексина 1 из-за нокаута соответствующего гена отмечены также возможные изменения плотности рецепторов в синапсах [16]. Однако в нашей работе наблюдаемые изменения, касающиеся пуринергической регуляции синапсов, совпали как при генетическом нокаутировании, так и при остром фармакологическом блокировании паннексинов. Эти изменения, по-видимому, были связаны не столько со структурными изменениями в моторных синапсах или плотности рецепторов, сколько с изменением баланса тормозных и потенцирующих влияний на секрецию АХ со стороны пуринов в синапсах при выключении паннексинового источника ATP [5, 6]. Это совпадает с данными ряда работ, где также сопоставлялось действие фармакологического блокирования и генетического нокаутирования паннексина 1 на функционирование структур ЦНС. В них было показано, что и нокаут паннексина 1 и острое блокирование каналов, образуемых этими белками, сопровождается сходными эффектами [4, 25]. В нашей работе впервые в моторных синапсах мыши также описан одинаковый паттерн изменений в секреции АХ в ответ на действие пуринов как при остром ингибировании паннексинов 1, так и при нокауте их гена.
Одинаковые изменения проявлялись, в частности, в характере активации Р2Х7-рецепторов при обоих типах выключения паннексинов и паннексинового источника ATP. Р2Х7-рецепторы известны своей способностью обеспечивать вход Са2+ в моторные терминали при их активации [26], но в то же время характеризуются как неактивные, обычно не вовлекаемые в пуринергическую регуляцию секреции АХ в моторных синапсах при их ритмической работе [5, 6]. Мы впервые установили, что при остром выключении паннексинов так же, как и при нокаутировании их гена, появляется одинаковая возможность, активируя Р2Х7-пуринорецепторы их экзогенным агонистом BzATP, вызывать усиление секреции АХ в виде увеличения квантового состава ПКП. Этого не удается достичь у WT синапсов с сохраненной активностью паннексинов. При этом наши расчеты показали, что при обоих способах блокады паннексинов облегчение вызванной квантовой секреции АХ, индуцируемое активацией Р2Х7-рецепторов, связано с увеличением размера пула синаптических везикул, непосредственно готовых к выбросу. Следовательно, любой способ выключения “паннексинового” источника ATP приводит к одинаковому изменению активности Р2Х7-рецепторов – их способности потенцировать быструю синхронную квантовую секрецию АХ по сходному в обоих случаях механизму. Полученные данные означают также, что “паннексиновые” источники эндогенной ATP активно вовлечены в регуляцию передачи в моторных синапсах, оказывая определенное регуляторное воздействие на нее. Выключение этих источников отражается на регуляторной активности пуринорецепторов, в частности, пресинаптических Р2Х7-рецепторов. Это согласуется с данными наших предыдущих исследований, где в моторных синапсах Panx1–/– мышей наблюдали сохранение активности разных типов пресинаптических пуринорецепторов, однако условия их избирательной активации эндогенными и экзогенными пуринами и вовлечения их в пуринергическую регуляцию секреции АХ оказывались измененными [5, 6].
Принято считать, что основным источником эндогенной ATP для пуринергической регуляции секреции АХ в моторных синапсах является везикулярная ATP, высвобождаемая в качестве комедиатора из холинергических везикул при их экзоцитозе [27]. Однако и в ЦНС, и на периферии в составе мембран скелетной мускулатуры [3], Шванновских клеток [22], моторных аксонов [28] показано присутствие паннексинов и наличие образованных ими каналов для высвобождения внутриклеточной ATP в среду, окружающую клетки [1]. Играет ли такой выход ATP роль ее тонической утечки, обеспечивая реализацию долговременных эффектов ATP в синапсах, или он может быть включен в пуринергическую кратковременную регуляцию синаптической активности, остается практически не изученным. Мы впервые показали, что достаточно выключить активность паннексинов у мышей за счет фармакологического ингибирования в остром опыте или путем нокаута гена паннексина 1, что равным образом изменяет характер и интенсивность активации пресинаптических пуринорецепторов в моторных синапсах, в частности Р2Х7-рецепторов. Это доказывает вклад активности паннексинов и “паннексиновых” источников ATP в краткосрочную пуринергическую регуляцию секреции АХ наряду с везикулярной ATP. Какой именно из внутриклеточных источников ATP (мышечный, глиальный, аксональный) играет роль дополнительного “паннексинового” компонента пуриновой регуляции секреции АХ, и каким именно образом он включен в эту регуляцию, предстоит выяснить в дальнейших исследованиях.
В заключение подчеркнем, что в данной работе впервые сопоставлены эффекты генетического нокаутирования и острого фармакологического блокирования паннексина 1 в моторных синапсах для оценки роли именно “паннексинового” источника ATP в пуринергическую регуляцию секреции АХ. Полученные данные позволяют утверждать, что последствия в отношении синаптической передачи при генетическом или фармакологическом выключении паннексинов совпадают. В обоих случаях ключевым моментом является отсутствие активности паннексинов как проводников ATP в область нервно-мышечных синапсов, одинаково отражающееся на пуринергической регуляции секреции АХ. Тем самым доказана возможность использования обоих методов как равноэффективных и правомочных для анализа механизмов участия паннексинов 1 и высвобождаемой с их помощью эндогенной ATP в регуляции секреции АХ нервно-мышечных синапсов.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Исследование выполнено в рамках научного проекта государственного задания МГУ № 121032300071-8. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-34-00189.
Соответствие принципам этики. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Dahl G. 2015. ATP release through pannexon channels. Philos. Trans. R. Soc. B. Biol Sci. 370 (1672), 20140191. https://doi.org/10.1098/rstb.2014.0191
Giaume C., Leybaert L., Naus C.C., Sáez J.C. 2013. Connexin and pannexin hemichannels in brain glial cells: Properties, pharmacology, and roles. Front. Pharmacol. 4, 88. https://doi.org/10.3389/fphar.2013.00088
Riquelme M.A., Cea L.A., Vega J.L., Boric, M.P., Monyer H., Bennett M.V.L., Frank M., Willecke K., Sáez J.C. 2013. The ATP required for potentiation of skeletal muscle contraction is released via pannexin hemichannels. Neuropharmacol. 75, 594–603. https://doi.org/10.1016/j.neuropharm.2013.03.022
Dossi E., Blauwblomme T., Moulard J., Chever O., Vasile F., Guinard E., Le Bert M., Couillin I., Pallud J., Capelle L., Huberfeld G., Rouachn N. 2018. Pannexin-1 channels contribute to seizure generation in human epileptic brain tissue and in a mouse model of epilepsy. Sci. Transl. Med. 10 (433), eaar3796. https://doi.org/10.1126/scitranslmed.aar3796
Miteva A.S., Gaydukov A.E., Shestopalov V.I., Balezina O.P. 2017. The role of pannexin 1 in the purinergic regulation of synaptic transmission in mouse motor synapses. Biochem. (Moscow), Suppl. Ser. A. Membr. Cell Biol. 11 (4), 311–320. https://doi.org/10.1134/S1990747817040067
Miteva A.S., Gaydukov A.E., Shestopalov V.I., Balezina O.P. 2018. Mechanism of P2X7 receptor-dependent enhancement of neuromuscular transmission in pannexin 1 knockout mice. Purinergic. Signal. 14 (4), 459–469.
Dvoriantchikova G., Ivanov D., Barakat D., Grinberg A., Wen R., Slepak V.Z., Shestopalov V.I. 2012. Genetic ablation of Pannexin1 protects retinal neurons from ischemic injury. PloS One. 7 (2), e31991. https://doi.org/10.1371/journal.pone.0031991
Тарасова Е.О., Митева А.С., Гайдуков А.Е., Балезина О.П. 2015. Роль аденозиновых рецепторов и кальциевых каналов L-типа в регуляции секреции медиатора в моторных синапсах мыши. Биол. мембраны. 32 (5–6), 409–409. https://doi.org/10.7868/S0233475515050151
McLachlan E.M., Martin A.R. 1981. Non-linear summation of end-plate potentials in the frog and mouse. J. Physiol. 311 (1), 307–324.
Elmqvist D., Quastel D.M. 1965. A quantitative study of end-plate potentials in isolated human muscle. J. Physiol. 178 (3), 505–529. https://doi.org/10.1113/jphysiol.1965.sp007639
Ruiz R., Cano R., Casañas J.J., Gaffield M.A., Betz W.J., Tabares L. 2011. Active zones and the readily releasable pool of synaptic vesicles at the neuromuscular junction of the mouse. J. Neurosci. 31 (6), 2000–2008. https://doi.org/10.1523/JNEUROSCI.4663-10.2011
Cano R., Ruiz R., Shen C., Tabares L., Betz W.J. 2012. The functional landscape of a presynaptic nerve terminal. Cell calcium. 52 (3–4), 321–326. https://doi.org/10.1016/j.ceca.2012.04.012
Deuchars S.A., Atkinson L., Brooke R.E., Musa H., Milligan C.J., Batten T.F., Deuchars J. 2001. Neuronal P2X7 receptors are targeted to presynaptic terminals in the central and peripheral nervous systems. J. Neurosci. 21 (18), 7143–7152.
Young M.T., Pelegrin P., Surprenant A. 2007. Amino acid residues in the P2X7 receptor that mediate differential sensitivity to ATP and BzATP. Mol. Pharmacol. 71 (1), 92–100. https://doi.org/10.3389/fphar.2018.00052
Savio L.E., de Andrade Mello P., da Silva C.G., Coutinho-Silva R. 2018. The P2X7 receptor in inflammatory diseases: Angel or demon? Front. Pharmacol. 9, 52.
Gajardo I., Salazar C.S., Lopez-Espíndola D., Estay C., Flores-Muñoz C., Elgueta C., Gonzalez-Jamett A.M., Martínez A.D., Muñoz P., Ardiles Á.O. 2018. Lack of pannexin 1 alters synaptic GluN2 subunit composition and spatial reversal learning in mice. Front. Mol. Neurosci. 11, 114. https://doi.org/10.3389/fnmol.2018.00114
Iglesias R., Spray D.C., Scemes E. 2010. Mefloquine blockade of pannexin1 currents: Resolution of a conflict. Cell. Commun. Adhes. 16 (5–6), 131–137. https://doi.org/10.3109/15419061003642618
Silverman W., Locovei S., Dahl G. 2008. Probenecid, a gout remedy, inhibits pannexin 1 channels. Am. J. Physiol. Cell. Physiol. 295 (3), C761–C767. https://doi.org/10.1152/ajpcell.00227.2008
McArdle J.J., Sellin L.C., Coakley K.M., Potian J.G., Quinones-Lopez M.C., Rosenfeld C.A., Sultatos L.G., Hognason K. 2005. Mefloquine inhibits cholinesterases at the mouse neuromuscular junction. Neuropharmacology. 49 (8), 1132–1139. https://doi.org/10.1016/j.neuropharm.2005.06.011
Suadicani S.O., Iglesias R., Wang J., Dahl G., Spray D.C., Scemes E. 2012. ATP signaling is deficient in cultured Pannexin1-null mouse astrocytes. Glia. 60 (7), 1106–1116. https://doi.org/10.1002/glia.22338
Zhang Z., Lei Y., Yan C., Mei X., Jiang T., Ma Z., Wang Q. 2019. Probenecid relieves cerebral dysfunction of sepsis by inhibiting pannexin 1-dependent ATP release. Inflammation. 42 (3), 1082–1092. https://doi.org/10.1007/s10753-019-00969-4
Wei Z.Y., Qu H.L., Dai Y.J., Wang Q., Ling Z.M., Su W., Zhao Y.Y., Shen W.X., Chen G. 2021. Pannexin 1, a large-pore membrane channel, contributes to hypotonicity-induced ATP release in Schwann cells. Neural. Regen. Res. 16 (5), 899. https://doi.org/10.4103/1673-5374.290911
He H., LiuD., Long Y., Wang X., Yao B. 2018. The pannexin-1 channel inhibitor probenecid attenuates skeletal muscle cellular energy crisis and histopathological injury in a rabbit endotoxemia model. Inflammation. 41 (6), 2030–2040. https://doi.org/10.1007/s10753-018-0846-z
Prochnow N., Abdulazim A., Kurtenbach S., Wildförster V., Dvoriantchikova G., Hanske J., Zoidl G. 2012. Pannexin1 stabilizes synaptic plasticity and is needed for learning. PloS One. 7 (12), e51767. https://doi.org/10.1371/journal.pone.0051767
Ardiles A.O., Flores-Muñoz C., Toro-Ayala G., Cárdenas A.M., Palacios A.G., Muñoz P., Fuenzalida M., Sáez J.C., Martínez A.D. 2014. Pannexin 1 regulates bidirectional hippocampal synaptic plasticity in adult mice. Front. Cell. Neurosci. 8, 326. https://doi.org/10.3389/fncel.2014.00326
Moores T.S., Hasdemir B., Vega-Riveroll L., Deuchars J., Parson S.H. 2005. Properties of presynaptic P2X7-like receptors at the neuromuscular junction. Brain Res. 1034 (1–2), 40–50. https://doi.org/10.1016/j.brainres.2004.12.001
Redman R.S., Silinsky E.M. 1994 ATP released together with acetylcholine as the mediator of neuromuscular depression at frog motor nerve endings. J. Physiol. 477, 117–127. https://doi.org/10.1113/jphysiol.1994.sp020176
Horton S.M., Luna Lopez C., Blevins E., Howarth H., Weisberg J., Shestopalov V.I., Makarenkova H.P., Shah S.B. 2017. Pannexin 1 modulates axonal growth in mouse peripheral nerves. Front. Cell Neurosci. 11, 365. https://doi.org/10.3389/fncel.2017.00365
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


