Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 6, стр. 450-463
Нарушение деформационных и функциональных характеристик эритроцитов у больных с V стадией хронической болезни почек
Ю. С. Судницына a, b, *, Е. А. Скверчинская b, И. М. Зубина c, Е. Д. Суглобова c, Т. Д. Власов c, А. В. Смирнов c, А. Н. Васильев c, Т. О. Ружникова b, Б. А. Калюжный b, И. В. Миндукшев b, Ю. А. Борисов c
a Центр теоретических проблем физико-химической фармакологии РАН
119991 Москва, Россия
b Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
c Первый Санкт-Петербургский государственный медицинский университет
им. акад. И.П. Павлова Минздрава РФ
197022 Санкт-Петербург, Россия
* E-mail: julia.sudnitsyna@gmail.com
Поступила в редакцию 14.04.2021
После доработки 03.06.2021
Принята к публикации 04.06.2021
Аннотация
Терминальная стадия хронической болезни почек (ХБП V) сопровождается рядом нарушений эритрона, в том числе структурными и функциональными изменениями циркулирующих эритроцитов, потенциально дестабилизирующими их функции и приводящими к различной степени анемии, однако механизмы этих явлений недостаточно изучены. В представленной работе методами проточной цитометрии, лазерной дифракции и спектрофотометрии мы исследовали влияние ХБП V и сеанса четырехчасового экстракорпорального гемодиализа (ГД) на деформационные (осмотическая и аммонийная резистентность) и функциональные (активность внутриклеточных эстераз, экстернализация фосфатидилсерина, состояние гемоглобина) показатели эритроцитов. Мы показали, что (i) эритроциты пациентов ГД имели сниженную осмотическую резистентность и повышенную скорость увеличения объема в аммонийном стресс-тесте по сравнению с клетками доноров; (ii) сеанс ГД не влиял на деформационные характеристики эритроцитов, однако приводил к (iii) образованию феррильных форм гемоглобина и (iiii) возникновению таких апоптоз-подобных явлений, как снижение активности внутриклеточных эстераз и повышение количества аннексин-позитивных клеток. Наши результаты указывают на то, что совокупность воздействия уремии и ГД терапии вызывает мультифакторное снижение функций эритроцитов пациентов ГД и играет важную роль в развитии и усугублении почечной анемии.
ВВЕДЕНИЕ
Терминальная стадия хронической болезни почек (ХБП V) вызывает множество дестабилизирующих гомеостаз и существенно снижающих качество жизни изменений в организме человека [1, 2], при этом сопутствующие ХБП V сердечно-сосудистые заболевания представляют основную причину смерти пациентов, достигая 50% от общего количества смертей вызываемых ХБП V [3]. К типичным серьезным осложнениям ХБП V относят нарушение эритропоэза, сниженную продукцию эритропоэтина и/или супрессию чувствительности рецепторов к эритропоэтину [4], дефицит железа, сокращение жизненного цикла эритроцитов и, как следствие, развитие почечной анемии [5]. Сокращение жизненного цикла эритроцитов пациентов отделения гемодиализа (ГД) может быть вызвано как воздействием уремических токсинов (п-крезилсульфат, метилглиоксаль, акролеин, индоксил сульфат и др.) [1, 2], приводящим в том числе к экстернализации фосфатидилсерина (ФС) на поверхности эритроцитов, гиперосмоляльностью плазмы [6], увеличением содержания промежуточных моноцитов CD14++/CD16+, фагоцитирующих апоптотические эритроциты [4], окислительным стрессом (ОС) и энергетическим истощением, так и быть следствием лечения хроническим ГД [7]. В условиях уремии наблюдаются различные структурные и функциональные нарушения эритроцитов, такие как сниженная антиоксидантная активность [8, 9], повышенные адгезионная способность к эндотелию и прокоагулянтная активность [10, 11], нарушение асимметрии бислоя [12] и белкового состава плазматической мембраны [13, 14], т.е. факторы, потенциально дестабилизирующие основную функцию эритроцитов – транспорт дыхательных газов, однако механизмы развития перечисленных нарушений изучены не в полной мере.
Вязко-эластичные свойства (деформируемость) эритроцита, т.е. способность клетки к обратимым деформациям, зависят не только от общих условий циркуляции: геометрии сосуда, давления крови, вязкости, гематокрита и температуры, но во многом от биомеханических и биохимических характеристик эритроцита [15–17]. Снижение деформируемости может приводить к нарушению микроциркуляции, гемолизу внутри капилляров и преждевременной элиминации эритроцитов ретикуло-эндотелиальной системой [18, 19] и, следовательно, иметь важное значение в прогрессии анемии. В процессе лечения программным ГД кровь пациента подвергается физическому и химическому воздействию в экстракорпоральном круге кровообращения на протяжении длительного времени [20–23], что также может приводить к нарушению деформируемости и снижению срока жизни эритроцитов и способствовать развитию анемии. Таким образом, сама процедура ГД также может участвовать в усугублении почечной анемии.
Детальное изучение свойств эритроцитов и механизмов воздействия на них травмирующих факторов имеет важное значение для создания и коррекции схем лечения анемии различной этиологии. В настоящее время существует ряд методов анализа деформационных характеристик эритроцитов, оценивающих как биомеханические, так и биохимические свойства эритроцита. Используемые методы можно разделить на два типа: анализирующие одиночные клетки (оптический пинцет, голотомография и др.) или ансамбль клеток (эктацитометрия, фильтрационный тест и др.) [15, 24, 25], однако их использование сопряжено с трудоемкостью, высокой стоимостью оборудования и необходимостью специального обучения персонала. Несмотря на множество разработанных методов все еще не создан унифицированный протокол оценки деформируемости эритроцитов. В связи с этим разработка простого, универсального метода является актуальной задачей.
В представленной работе методами проточной цитометрии, лазерной дифракции и спектрофотометрии мы исследовали влияние ХБП V и сеанса 4-часового экстракорпорального ГД на деформационные (осмотическая и аммонийная резистентность) и функциональные (активность внутриклеточных эстераз, экстернализация ФС, состояние гемоглобина) показатели эритроцитов. Эритроциты пациентов отделения хронического ГД характеризовались повышенной скоростью увеличения объема в аммонийном стресс-тесте и сниженной осмотической резистентностью по сравнению с клетками доноров. Сеанс ГД не влиял на деформационные характеристики эритроцитов, однако приводил к образованию феррильных форм гемоглобина и возникновению апоптоз-подобных явлений, таких как снижение активности внутриклеточных эстераз и повышение количества аннексин-позитивных клеток. Наши результаты указывают на то, что воздействие уремии и ГД-терапии в совокупности вызывает мультифакторное снижение функций эритроцитов пациентов ГД и играет важную роль в развитии и усугублении нефрогенной анемии.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Исследовали свойства эритроцитов 15 человек без ренальной патологии – “доноры” (42 ± 16 лет) и 10 пациентов отделения хронического гемодиализа (от 11 до 120 месяцев на лечении ХГД, 47 ± 13 лет) НИИ Нефрологии ПСПбГМУ им. акад. И.П. Павлова до и после ГД сессии. Группа пациентов состояла из больных с ХБП V, получающих лечение программным ГД, из них 7 мужчин и 3 женщины; причиной развития ХБП V в четырех случаях была мембранозная нефропатия, у трех больных был диагностирован хронический гломерулонефрит, у двоих отмечался нефросклероз, у одного больного был диагностирован гидронефроз. Проведение всех процедур было одобрено этическим комитетом ПСПБГМУ им. акад. И.П. Павлова (протокол № 217 от 17.01.2020), этическим комитетом ИЭФБ РАН (протокол № 2–02 от 02.02.2021) и соответствовало декларации Хельсинки.
Реактивы. В экспериментах использованы следующие реактивы (конечная концентрация в клеточной суспензии или в рабочей среде): кальцеин-AM, 0.1 мкМ (Sigma–Aldrich, США), аннексин-V-FITC, 0.1 мкг/мл (Biolegend, США), тиазоловый оранжевый, 0.4 мкг/мл (Sigma–Aldrich). Для работы с эритроцитами человека были использованы: среда № 1 – HEPES буфер (в мМ: NaCl 140, KCl 5, HEPES 10, MgCl2 2, D-глюкоза 5, EGTA 2; рН 7.4, осмоляльность 300 мОсм/л) и среда № 2 – ${\text{NH}}_{4}^{ + }$-буфер (в мМ: NH4Cl 140, KCl 5, HEPES 10, MgCl2 2, D-глюкоза 5, EGTA 2; pH 7.4, осмолярность 300 мОсм/л) при аммонийной нагрузке. Осмоляльность среды контролировали осмометром Osmomat 030 (Gonotec, Германия). В HEPES-буфер добавляли 2 мМ Ca2+ вместо 2 мМ EGTA, где отмечено.
Подготовка суспензии эритроцитов. Кровь доноров и пациентов после подписания ими письменного согласия отбирали в вакутейнеры с EDTA в качестве антикоагулянта. Эритроциты получали центрифугированием цельной крови (7 мин, 350 g), и ресуспендировали в HEPES буфере (RBC = 0.5 × 109 кл/мл, HCT 5%). Основные параметры крови и суспензии эритроцитов (концентрация эритроцитов – RBC, средний объем эритроцитов – MCV и т.д.) определяли с помощью гематологического анализатора Medonic-M20 (Boule Medical A.B., Швеция). Биохимический анализ крови и анализ содержания электролитов были выполнены в ЦКДЛ ПСПБГМУ им. акад. И.П. Павлова.
Исследования методом проточной цитометрии. Экстернализацию фосфатидилсерина и активность внутриклеточных эстераз регистрировали на проточном цитометре ЦКП ИЭФБ РАН – CytoFlex (BeckmanCoulter, США).
Определение экстернализации фосфатидилсерина. Экстернализацию ФС определяли с помощью ФС-специфичного лиганда аннексина-V–FITC. Аннексин-V является Ca2+-зависимым красителем, поэтому для аннексинового теста в HEPES-буфер вместо EGТА добавляли кальций (2 мМ). Эритроциты (0.5 × 109 кл/л) инкубировали с аннексином-V (0.1 мкг/мл, 20 мин, в темноте, 25°С). ФС-позитивные клетки определяли по флуоресценции аннексин-V на канале FL1 (530 нм, FITC). Для каждого образца были проанализированы не менее 10 000 событий. Гейт для негативного контроля выставляли по флуоресценции не связывающих аннексин-V эритроцитов здоровых доноров.
Исследование активности внутриклеточных эстераз. Эстеразную активность клеток оценивали по интенсивности флуоресценции кальцеина [26]. Эритроциты (0.5 × 109 кл/л) инкубировали с кальцеином-AM (С-AM, 5 мкМ, 40 мин, 37°С), флуоресценцию регистрировали в канале FL1 (530 нм, FITC).
Анализ количества ретикулоцитов. Содержание ретикулоцитов (RET%) определяли окраской тиазоловым оранжевым в цельной крови по методу Riley [27], для этого 5 мкл цельной крови ресуспендировали в 1 мл HEPES буфера c 10 мкл тиазолового оранжевого (конечная концентрация 0.4 мкМ, 20 мин). Популяцию эритроцитов определяли на диаграмме рассеяния (прямое рассеяние FSC против бокового рассеяния SSC) для исключения мелких частиц и тромбоцитов. Флуоресценцию тиазолового оранжевого регистрировали в канале FL1 (530 нм, FITC) при гейтировании положительной зеленой флуоресценции по сравнению с неокрашенным контролем, гейт выставляли по неокрашенной пробе каждого образца (blanc).
Исследование деформационных характеристик эритроцитов методом лазерной дифракции. Деформационные характеристики эритроцитов оценивали методом лазерной дифракции на анализаторе частиц LaSca-TМ (ООО “Биомедицинские системы”, Россия), адаптированном для цитологических исследований [28]. В основе метода – регистрация рассеянного излучения под разными углами с помощью многоэлементного детектора. По полученной зависимости интенсивности рассеянного излучения от угла рассеяния (индикатриса рассеяния) осуществляется расчет размеров частиц и распределения частиц по размерам, таким образом, в каждый момент времени считывается распределение всей популяции по объемам. Для оценки динамики изменения среднего объема клеток (MCV) использовали алгоритм оценки размеров частиц программного обеспечения LaSca_32 v.1498. В качестве стандартов использовали CML Latex beads 6, 10, 16 мкм (C37256, C37259, C37260, Invitrogen, США).
Стресс-модели. Аммонийный стресс-тест. В отличие от других клеток крови при помещении в изотоническую аммонийную среду эритроциты человека способны увеличивать объем до критических значений и лизировать. На основании этого уникального свойства эритроцитов нами был разработан оригинальный аммонийный стресс-тест для характеристики деформационно-функциональных свойств эритроцитов [29]. Для создания модели аммонийного стресса в 1 мл изотонического ${\text{NH}}_{4}^{ + }$ буфера (37°C) вносили 5 мкл суспензии эритроцитов (RBC = 0.5 × 109 кл/мл, HCT 5%, конечная концентрация 5 × 105 кл/мл), регистрацию показателей светорассеяния проводили до окончания лизиса. Скорость увеличения объема клеток (Vi) оценивали по данным кинетики прямого светорассеяния в диапазоне угла 2.5°. Для количественного описания кинетики гемолиза использовали параметры Tmax (время достижения максимальной скорости гемолиза) и Vmax (максимальная скорость гемолиза) в диапазоне угла 1°.
Гипоосмотический стресс. Для проведения теста на осмотическую резистентность эритроциты (0.5 × 109 кл/мл, 5 мкл) вносили в 1 мл HEPES буфера с последующими добавками дистиллированной воды (dH2O, мкл: 500, 500, 250, 250, 250, 250) и соответствующего объема эритроцитов для поддержания неизменной концентрации клеток в пробе. Лизис эритроцитов регистрировали методом лазерной дифракции по убыли интенсивности светорассеяния в диапазоне угла 2.5°. Для каждого образца строили диаграммы распределения эритроцитов (эритрограммы) по осмотической резистентности в диапазоне осмоляльности от 300 до 92 мОсм/кг H2O. Для количественного описания осмотической резистентности эритроцитов (ОРЭ) использовали следующие параметры: H10, H50, H90, значения осмоляльности среды, при которой лизирует 10, 50 и 90% эритроцитов соответственно; W – ширина распределения клеток по осмотической резистентности, определяется разностью в осмоляльности среды при лизисе 90 и 10% эритроцитов [30].
Исследование форм гемоглобина спектральным методом. Спектры поглощения гемоглобина регистрировали спектрофотометром СПЕКС ССП-715-M (ООО “Спектроскопические системы”, РФ) в ряду длин волн 300–700 нм с шагом 1 нм (25°C). Для исследования трансформации гемоглобина, цельную кровь лизировали в дистиллированной воде и регистрировали спектры поглощения.
Анализ содержания свободного гемоглобина в плазме. Свободный гемоглобин определяли в плазме, полученной центрифугированием цельной крови (7 мин, 350g) и разведенной в 20 раз дистиллированной водой. Расчет проводили по значениям оптической плотности раствора плазмы при 540 нм, оптическую плотность лизата цельной крови (разведение в 100 раз; Total) принимали за 100%. Для корректной оценки учитывали мутность растворов по оптической плотности при 700 нм по следующей формуле: Hb free, % = = ((Plasma540 – Plasma700) × 100)/((Total540 – ‒ Total700)/5), где 540 и 700 – соответствующая длина волны, нм; 5 – поправка на разведение проб. Для пересчета свободного гемоглобина в плазме из % в г/л как 100% использовали значения концентрации гемоглобина (HGB), полученные на гематологическом анализаторе.
Расчет форм гемоглобина. Сравнительный анализ спонтанного образования окисленных форм гемоглобина проводили по экстинкции гемолизатов проб при длинах волн 560, 577, 630 и 700 нм. Процент окисленного гемоглобина рассчитывался по коэффициентам молярной экстинкции производных форм гемоглобина: oxyHb (HbFe(II)O2), мет-Hb или ферри-Hb (ferric Hb, HbFe(III)), феррил-Hb (ferryl Hb, HbFe(IV)) или гемихром (HbChr) по методу Kanias [31]. Данные представлены как процент от суммы всех форм гемоглобина в образце, принятой за 100%.
Анализ данных. Данные, полученные методом проточной цитометрии, анализировали с использованием программ CytExpert (BeckmanCoulter, США) и FCS Express Flow 7 (De Novo Software, США). Время достижения максимальной скорости гемолиза (Them), максимальную скорость гемолиза (Vhem) и начальную скорость увеличения объема клеток (Vi) рассчитывали с использованием оригинальной программы лазерного анализатора LaSca-TM – LaSca v.1498. Статистическую значимость результатов определяли с помощью программы GraphPad Prism 9 (GraphPad Software, США). Оценку нормальности проводили тестом Шапиро–Уилки, разницу между группами оценивали one-way ANOVA c апостериорным анализом Тьюки (доноры в сравнении с пациентами) до/после ГД сессии), разницу между связанными группами оценивали t-тестом Стьюдента для связанных выборок (“пациенты до” в сравнении с “пациентами после” сеанса ГД). Во всех экспериментах данные представлены как среднее ± стандартное отклонение (M ± SD). В каждой серии экспериментов участвовали не менее десяти доноров. Различия между группами считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
Эритроциты пациентов с ХБП V имеют повышенный объем несмотря на гиперосмоляльность плазмы. В условиях уремического синдрома у пациентов с ХБП V наблюдаются структурные и функциональные нарушения эритроцитов [18, 19]. Кроме того, срок жизни уремических эритроцитов снижен в среднем на 20%: до 73 дней при норме 100–120 дней [2, 12, 32]. Мы провели сравнение клинических и биохимических анализов крови доноров (в том числе референсных значений нормы по данным лаборатории Хеликс) и пациентов до и после ГД-сессии (табл. 1). У пациентов не было выявлено ни гипо/гипернатриемии, ни гипо/гипергликемии. Однако уремические токсины (креатинин, мочевина, мочевая кислота и др.) суммарно повышали измеренную осмоляльность плазмы до 330 ± 21 мОсм/л H2O, вплоть до 380 мОсм/л H2O в единичных случаях. Сеанс ГД снимал уремический синдром, однако показатель уровня мочевины превышал норму даже после ГД сессии. Тем не менее в условиях циклического гиперосмоляльного окружения эритроциты больных имели на 12% больший объем (MCV): 93.02 ± ± 2.77 фл у пациентов до и 93.23 ± 2.91 фл после ГД-сессии (n = 10, p < 0.0001) по сравнению с 82.75 ± 1.39 фл у доноров (рис. 1а).
Таблица 1.
Показатели клинического и биохимического анализа крови доноров с референсными значениями нормы и пациентов до и после сеанса ГД. Данные представлены как M ± SD
| Группа | Возраст, годы |
Время на ГД, мес. | Общий анализ крови | Осмоля-
льность плазмы, мОсм/ л H2O |
Глюкоза, мМ | Мочевая кислота, мкмоль/л | Креатинин, мМ/л | Мочевина, мМ/л | СРБ, мг/л |
Электролит, мМ/л | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| RBC × × 1012, кл/л | HGB, г/л | PLT × × 109, кл/л | WBC × × 109, кл/л | натрий | фосфор | кальций | калий | |||||||||
| Доноры | 41.81 ± ± 15.53 | – | 3.99 ± ± 0.33 | 124.41 ± ± 5.89 | 198.01 ± ± 30.6 | 5.25 ± ± 1.17 | 296.01 ± ± 8.52 | 4.10–6.10 | 202.30–416.50 | 0.53–1.15 | 2.1–7.1 | 0–10 | 136–145 | 0.78–1.42 | 2.10–2.55 | 3.5–5.1 |
| Пациенты до сеанса ГД (n = 10) | 47.30 ± ± 13.26 | 57.10 ± ± 41.49 | 3.54 ± ± 0.35# | 112.71 ± ± 8.47# | 263.91 ± ± 92.12 | 8.78 ± ± 3.78## | 329.81 ± ± 21.26## | 5.379 ± ± 0.88 | 462.6 ± ± 76.24 | 0.99 ± ± 0.14 | 23.26 ± ± 5.65 | 6.27 ± ± 3.97 | 138.11 ± ± 3.22 | 2.45 ± ± 0.79 | 2.23 ± ± 0.25 | 5.41 ± ± 0.53 |
| Пациенты после сеанса ГД (n = 10) | 3.87 ± ± 0.46** | 123.81 ± ± 13.17** | 258.31 ± ± 77.28 | 7.62 ± ± 2.45 | 305.83 ± ± 13.73* | 5.379 ± ± 0.88 | 100.56 ± ± 25.24*** | 0.40 ± ± 0.08**** | 7.68 ± ± 2.05**** | 138.9 ± ± 1.91 | 1.08 ± ± 0.18*** | 2.59 ± ± 0.16*** | 4.21 ± ± 0.41**** | |||
Примечание: RBC – количество эритроцитов, HGB – средняя концентрация гемоглобина в эритроците, PLT – количество тромбоцитов, WBC – количество лейкоцитов; СРБ – С-реактивный белок. * p < 0.05, ** p < 0.005, *** p < 0.001, **** p < 0.0001, t-тест Стьюдента для связанных выборок – пациенты до ГД по сравнению с пациентами после ГД сессии. #p < 0.05, ##p < 0.005, ANOVA, апостериорный критерий Тьюки – доноры по сравнению с пациентами до ГД/после ГД-сессии. Серым выделены референсные значения нормы по стандартам лаборатории Хеликс.
Рис. 1.
Гематологический профиль пациентов с ХБП V в сравнении с донорами. У пациентов с ХБП V были отмечены: достоверное увеличение среднего объема эритроцитов (MCV) (а) и гетерогенности эритроцитов по объему (RDWa) (б), процента молодых ретикулоцитов с высокой флуоресценцией (RET-H) (в) и содержания свободного гемоглобина в плазме (Hb в плазме) (г). MCV и RDWa получали с помощью гематологического анализатора; RET-H – методом проточной цитометрии; содержание свободного Hb в плазме оценивали спектрально при длине волны 540 нм. Данные представлены как M ± SD, n = 10. Различия между показателями эритроцитов пациентов до и после ГД определяли t-тестом Стьюдента для связанных выборок, ** p < 0.005; различия между показателями эритроцитов доноров и пациентов определяли с помощью ANOVA, апостериорный анализ Тьюки, * p < 0.05, ** p < 0.005, **** p < 0.0001.
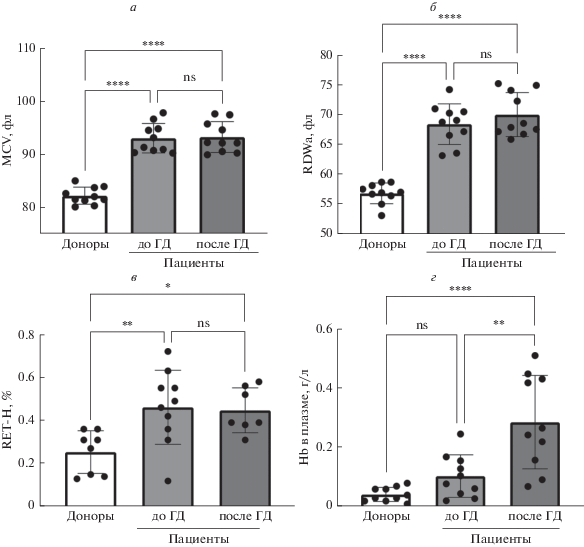
Эритроциты пациентов как до, так и после сеанса ГД имели достоверно большее значение индекса гетерогенности по объему (RDWa) (рис. 1б), что указывает на наличие воспаления и/или его прогрессию [33]. Анализ ретикулоцитов (RET) не выявил достоверных различий в абсолютном значении, однако наблюдалось достоверное увеличение процента молодых ретикулоцитов (RET-H) с большим содержанием РНК (рис. 1в) у пациентов ХГД по сравнению с донорами.
Уремический синдром, а не сеанс ГД, вызывает изменение деформационных характеристик эритроцитов. Структурная целостность сети цитоскелета – основной фактор, определяющий вязко-эластичные свойства эритроцита и его деформируемость [34, 35]. Ранее мы показали при 25°C, что сеанс ГД не влиял на функциональные характеристики эритроцитов пациентов [36]. Однако отсутствие различий могло быть вызвано снижением чувствительности эритроцитов к стрессорным воздействиям при 25°С. В этой работе для оценки влияния ГД-сессии на деформационные характеристики эритроцитов были проведены тест на осмотическую резистентность эритроцитов (рис. 2а–2г) и аммонийный стресс-тест (рис. 3а–3г) при 37°С.
Рис. 2.
Уремический синдром, а не сеанс ГД, приводит к снижению осмотической резистентности эритроцитов. а – Запись оригинальных экспериментов по исследованию осмотической резистентности эритроцитов доноров и пациентов методом лазерной дифракции. Эритроциты (0.5 × 109 кл/мл) вносили в 1 мл HEPES буфера с последующими добавками дистиллированной воды (dH2O, мкл: 500, 500, 250, 250, 250, 250) и соответствующего объема эритроцитов для поддержания концентрации клеток в пробе. Гемолиз эритроцитов регистрировали по убыли интенсивности светорассеяния в диапазоне угла 2.5°. б–г – По интенсивности светорассеяния в диапазоне осмоляльности от 300 до 92 мОсм/кг H2O строили кривые гемолиза, из которых получали значения осмоляльности, при которой лизировали 10% эритроцитов (H10) (б); 50% эритроцитов (H50) (в); 90% эритроцитов (H90) (г). Данные представлены как M ± SD, n = 10. Различия между показателями эритроцитов пациентов до и после ГД-сессии определяли t-тестом Стьюдента для связанных выборок; различия между показателями эритроцитов доноров и пациентов определяли с помощью ANOVA, апостериорный анализ Тьюки, * p < 0.05.
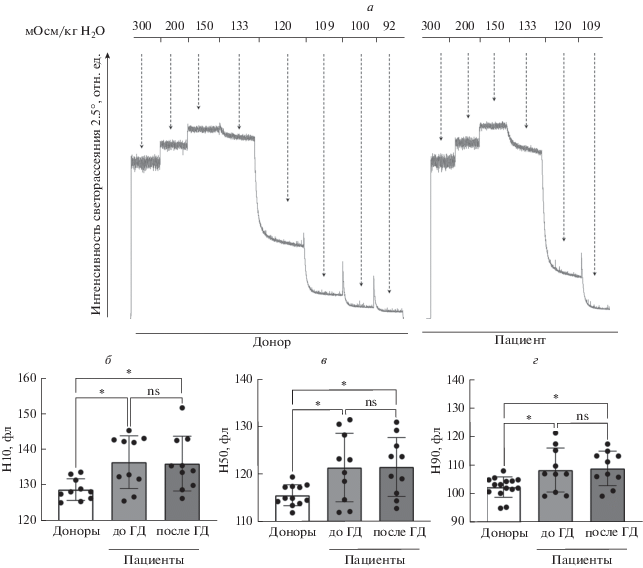
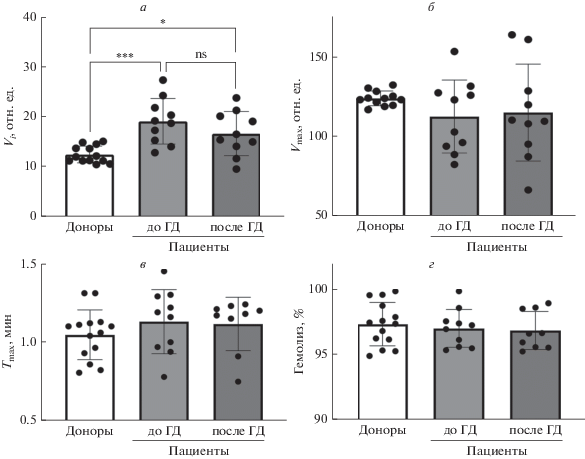
Рис. 3.
Сеанс ГД не вызывает деформационных характеристик эритроцитов в аммонийном стресс-тесте. Эритроциты (106 кл/мл) помещали в изотонический ${\text{NH}}_{4}^{ + }$ буфер (среда № 2, pH 7.4), методом лазерной дифракции регистрировали увеличение сигнала, соответствующее увеличению объема клеток, с последующим снижением сигнала, соответствующим гемолизу. Далее рассчитывались параметры аммонийного стресс-теста: а – скорость начального увеличения объема эритроцитов (Vi); б – максимальная скорость гемолиза (Vmax); в – время достижения максимальной скорости гемолиза (Tmax), г – процент гемолиза. Данные представлены как M ± SD, n = 10. Различия между показателями эритроцитов пациентов до и после ГД-сессии определяли t-тестом Стьюдента для связанных выборок; различия между показателями эритроцитов доноров и пациентов определяли с помощью ANOVA, апостериорный анализ Тьюки, * p < 0.05, *** p < 0.001.
При исследовании осмотической резистентности не было выявлено значимых отличий между показателями эритроцитов пациентов до и после сеанса ГД, однако эритроциты пациентов были достоверно более хрупкими, чем эритроциты доноров (H10, H50, H90, p < 0.05).
При проведении аммонийного стресс-теста было выявлено, что скорость начального увеличения объема эритроцитов (Vi) в аммонийной среде у доноров была достоверно ниже, чем у пациентов как до, так и после ГД (p < 0.0001 и p < < 0.05 соответственно), что указывает на изменение функции белка полосы 3 в условиях уремии. Значимых различий в скорости (рис. 3б), времени (рис. 3в) и проценте гемолиза (рис. 3г) ни на протяжении ГД-сессии, ни при сравнении показателей доноров и пациентов до и после сеанса ГД не было выявлено.
Таким образом, полученные данные указывают на отсутствие значимого влияния сеанса ГД на деформационные характеристики эритроцитов, однако эритроциты доноров были достоверно более осмотически резистентными по сравнению с эритроцитами пациентов как до, так и после ГД-сессии, что говорит о повышенной хрупкости эритроцитов пациентов с ХБП V.
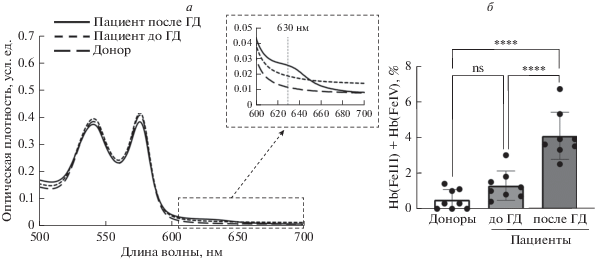
ГД вызывает увеличение образования феррильных форм гемоглобина. Осуществление основной функции эритроцита, газообмена, напрямую зависит от состояния гемоглобина, белка, обратимо связывающего и переносящего молекулы кислорода к тканям [37, 38]. Мы провели спектральный анализ образцов крови доноров и пациентов в ходе ГД-сессии (рис. 4б). Расчет процентного содержания форм гемоглобина в образцах выявил, что в ходе диализной сессии достоверно увеличивалось процентное содержание феррильных форм гемоглобина (рис. 4а), нестабильных форм гемоглобина, потенциально приводящих к деградации и потере гема [39, 40].
Рис. 4.
Сеанс ГД приводит к увеличению % феррильных форм гемоглобина Hb(FeIII) и Hb(FeIV). а – Спектры поглощения гемоглобина доноров и пациентов до и после ГД-сессии. Эритроциты (1.25 × 107 кл/мл) доноров и пациентов до и после ГД-сессии гипоосмотически лизировали, сканировали спектры гемолизатов и проводили расчет форм гемоглобина по экстинкции проб при длинах волн 560, 577, 630 и 700 нм по методу Kanias [36]. б – Количественная оценка спонтанного образования окисленных форм гемоглобина по данным спектров поглощения гемоглобина доноров и пациентов до и после ГД-сессии. Данные представлены как M ± SD, n = 10. Различия между показателями эритроцитов пациентов до и после ГД определяли t-тестом Стьюдента для связанных выборок, **** p < 0.0001; различия между показателями эритроцитов доноров и пациентов определяли с помощью ANOVA, апостериорный анализ Тьюки, **** p < 0.0001.
Сеанс ГД приводит к снижению активности внутриклеточных эстераз и экстернализации фосфатидилсерина в эритроцитах. Ранее (рис. 1в) мы показали, что сеанс ГД вызывал достоверное увеличение спонтанного гемолиза, однако анемия может быть вызвана также и преждевременной элиминацией эритроцитов. Поэтому мы проверили, как ГД-сессия влияет на активность внутриклеточных эстераз и экстернализацию ФС на поверхности эритроцитов. Оценку влияния уремического синдрома и/или ГД-сессии на жизнеспособность эритроцитов [26, 30] пациентов до и после сеанса ГД проводили по активности внутриклеточных эстераз с помощью красителя кальцеина-AM (С-AM) (рис. 5а, 5б). Было выявлено, что активность внутриклеточных эстераз в эритроцитах доноров достоверно выше (n = 10, p < < 0.0001), чем у пациентов как до, так и после ГД-сессии. При этом сама ГД-сессия приводила к еще большему снижению эстеразной активности эритроцитов пациентов (n = 10, p < 0.0001).
Рис. 5.
Сеанс ГД приводит к снижению эстеразной активности и увеличению экстернализации ФС в эритроцитах пациентов ХГД. Эритроциты (0.5 × 109 кл/мл) инкубировали с кальцеином (С-AM, 0.1 мкг/мл, 20 мин, в темноте, 25°С) (а, б) или аннексином-V (5 мкМ, 40 мин, 37°С) (в, г). а – Количественная оценка активности внутриклеточных эстераз эритроцитов доноров и пациентов до и после сеанса ГД; б – репрезентативный эксперимент по исследованию активности внутриклеточных эстераз в эритроцитах методом проточной цитометрии; в – количественная оценка аннексин-положительных клеток среди эритроцитов доноров и пациентов до и после сеанса ГД; г – репрезентативные эксперименты по определению аннексин-положительных клеток среди эритроцитов доноров и пациентов после сеанса ГД, события в аннексин-положительном гейте эмфазированы с помощью программы FCS Express 7. Данные представлены как M ± SD, n = 10. Различия между показателями эритроцитов пациентов до и после ГД определяли t-тестом Стьюдента для связанных выборок, **** p < 0.0001; различия между показателями эритроцитов доноров и пациентов определяли с помощью ANOVA, апостериорный анализ Тьюки, ** p < 0.005, **** p < 0.0001.
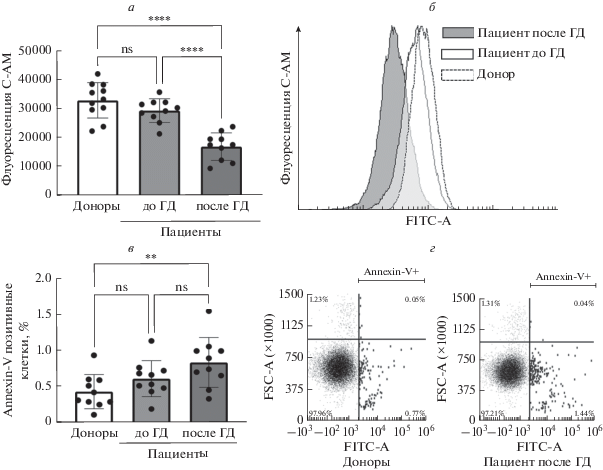
Один из сигналов используемый макрофагами для элиминации старых или поврежденных эритроцитов – экстернализация ФС на поверхности. Поэтому мы проверили данный параметр с помощью теста на связывание аннексина-V (рис. 5в, 5г). Эритроциты пациентов после сеанса ГД характеризовались достоверно большим процентом аннексин-положительных клеток (p < 0.005) по сравнению с эритроцитами доноров, однако в ходе ГД-сессии не было выявлено достоверных отличий.
Таким образом, мы показали, что как сам уремический синдром, так и сеанс ГД вызывают изменения эритроцитов с маркерными признаками апоптоз-подобного сценария клеточной гибели: ингибирование эстеразной активности, экстернализация ФС.
ОБСУЖДЕНИЕ
Структурная целостность сети цитоскелета определяет вязко-эластичные свойства эритроцита и его деформируемость [40, 41]. Изменение в экспрессии интегральных белков, маркеров адгезии и транспортных белков может стать причиной нарушения вязко-эластичных свойств эритроцита и молекулярных путей сигнализации в эритроцитах [3, 42]. Протеомным анализом было выявлено, что набор белков в цитоплазматической мембране эритроцитов пациентов, страдающих от уремического синдрома, значительно отличается от здоровых людей. В эритроцитах пациентов с ХБП V была отмечена сниженная экспрессия спектрина, белка полосы 3 (AE1), актина и CD47 (маркера, препятствующего фагоцитозу) [43], что, вероятно, вовлечено в патогенез нарушения способности эритроцитов к обратимым деформациям, выявленного у пациентов с терминальной стадией ХБП [3, 42].
В проведенном исследовании был использован метод лазерной дифракции для оценки деформационных характеристик эритроцитов. Были предложены оригинальные осмотический и аммонийный стресс-тесты, которые показали высокую эффективность в детекции осмотической резистентности эритроцитов и оценки реакции эритроцитов на аммонийный стресс. Аммонийным стресс-тестом мы показали, что скорость увеличения объема эритроцитов (Vi) у пациентов значимо выше, чем у здоровых доноров (рис. 3а). Этот показатель характеризует функцию белка полосы 3, основного структурного белка мембраны эритроцита, одной из важных функций которого также является поддержание внутриклеточного pH. По-видимому, уремический синдром дестабилизирует функцию этого белка, что также негативно сказывается как на деформационных, так и функциональных характеристиках эритроцитов пациентов. Ранее было показано, что белок полосы 3 вовлечен в транспорт ряда уремических токсинов внутрь эритроцита [1, 44]. Таким образом, необходимо дальнейшее исследование роли белка полосы 3 в прогрессии деструктивных изменений мембраны и цитоскелета эритроцитов пациентов с ХБП V.
Гиперосмоляльность плазмы, вызванная повышением концентрации уремических токсинов [6], в совокупности с самим действием уремических токсинов [1, 44] может преждевременно запускать апоптоз эритроцитов [10, 11], также приводя к почечной анемии. Несмотря на высокую лабильность эритроцитов к деформациям и широким диапазонам осмоляльности, влияние циклического долговременного нахождения в гиперосмоляльной среде, как в случае больных с терминальной стадией ХБП, на транспортные характеристики эритроцитов недостаточно изучено. В норме в изоосмотической среде эритроциты человека представляют собой двояковогнутый диск, такая форма обеспечивает им высокое соотношение поверхности к объему и, соответственно, возможность подвергаться широкому диапазону объемных изменений и обратимых деформаций в циркуляции. В гипоосмотической среде эритроциты трансформируются в стоматоциты, увеличивая свой объем до 74%, а в гиперосмотической среде – трансформируются в эхиноциты и сжимаются на 34% [41, 45]. Однако несмотря на цикличное нахождение в гиперосмоляльном окружении, средний объем эритроцитов пациентов как до, так и после сеанса ГД был на 13% выше по сравнению с донорами (рис. 1а). Также было выявлено, что эритроциты пациентов как до, так и после ГД сессии были менее осмотически резистентны по сравнению с эритроцитами доноров (рис. 2а–2г). Такое снижение ОРЭ может быть вызвано увеличенным средним объемом эритроцитов (рис. 1а), и, вероятно, является причиной отмеченного повышенного содержания свободного гемоглобина в плазме (рис. 1в). Таким образом, описанные изменения деформационных характеристик эритроцитов, по-видимому, являются одной из причин внутрисосудистого и внутрикапиллярного гемолиза, ассоциированного с ХБП V [43].
Уремические токсины не только влияют на функцию клетки извне, но и способны воздействовать изнутри, аккумулируясь внутри клетки [1, 44, 46]. В наших экспериментах в эритроцитах пациентов ХГД помимо сниженной осмотической резистентности (рис. 2) и изменения функции белка полосы 3 (рис. 3а) было отмечено повышенное образование феррильных форм гемоглобина (рис. 4), снижение эстеразной активности (рис. 5а, 5б) и повышение экстернализации ФС (рис. 5в, 5г) на поверхности эритроцитов, т.е. маркерных признаков апоптоза эритроцитов, ассоциированного со слабым окислительным стрессом [30]. ОС – один из важных факторов, приводящих к снижению срока жизни эритроцитов [47]. При ОС происходит окисление гемоглобина до мет-Hb или ферри-Hb (ferric Hb, HbFe(III)) и сверх-окисленных форм (феррил-Hb (ferryl Hb, HbFe(IV)) – гемихромов (HbChr) [39, 40], образование активных форм кислорода и последующее окисление белков, липидов и полиненасыщенных жирных кислот [48]. Описанные явления наряду с накоплением метаболитов также могут приводить к нарушению деформируемости эритроцита, так как при фосфорилировании белка полосы 3, сопровождающем ОС, происходит нарушение взаимодействия “белок полосы 3 – цитоскелет” [40], дестабилизирующее структуру и целостность мембраны и цитоскелета, и липидную асимметрию мембраны. Образование гемихромов в свою очередь индуцирует выход микрочастиц, содержащих окисленные формы Hb [30]. Описанные явления, вероятно, играют важную роль в прогрессии нарушения функций эритроцита и усугублении почечной анемии при ХБП V.
Уремический синдром оказывает негативное воздействие на продукцию и деструкцию эритроцитов, функцию лимфоцитов и тромбоцитов, а также на активацию коагуляционной системы [4]. У пациентов с ХБП V отмечается хроническое воспаление и повышенное содержание промежуточных моноцитов [4], которое также может играть роль в патогенезе почечной анемии. Совместно со снижением экспрессии CD47, маркера, противодействующего элиминации эритроцитов макрофагами [49], эти факторы могут усугублять анемический синдром. При сравнении клинического и биохимического анализов крови пациентов ГД и здоровых доноров (табл. 1) было выявлено достоверное повышение индекса гетерогенности эритроцитов по размеру (RDWa) (рис. 1б), что также указывает на наличие воспаления или его прогрессию [33], в то время как такой маркер системного острого воспаления, как С-реактивный белок (табл. 1), был в пределах нормы. После ГД-сессии наблюдалось достоверное увеличение концентрации эритроцитов по сравнению с показателями до сеанса ГД (табл. 1, рис. 1а), при этом концентрация тромбоцитов и лейкоцитов не менялась. Можно предположить, что в ходе сеанса ГД из селезенки высвобождается пул эритроцитов, однако эти данные требуют дальнейшей проверки.
Ранее мы показали, что эритроциты человека способны как транспортировать, так и импортировать аммоний/аммиак [29, 50], они экспрессируют аммонийный транспортер RhAG и, по-видимому, играют важную роль в поддержании аммонийного и/или азотистого баланса в организме. В связи с этим поддержание структурной целостности и пластичности мембраны и цитоскелета приобретают особенно важное значение в таких группах риска гипераммониемии, как пациенты отделения хронического гемодиализа (нарушение биохимического гомеостаза и постоянное химическое и механическое воздействие на клетки), взрослые с повышенной физической нагрузкой (неспособность организма справиться с избыточным потоком аммония/аммиака) и др.
ЗАКЛЮЧЕНИЕ
Полученные результаты указывают на то, что у пациентов отделения хронического ГД уремическая интоксикация и цикличное нахождение эритроцитов в окружении гиперосмоляльной плазмы, а не сам сеанс ГД, вызывают нарушение деформационных характеристик эритроцитов, отчасти приводящее к анемическому синдрому. С другой стороны, сеанс ГД приводил к увеличению процента феррильных форм гемоглобина, снижению активности внутриклеточных эстераз и повышению экстернализации фосфатидилсерина на поверхности эритроцита, т.е. к образованию маркеров элиминации клеток макрофагами и ретикуло-эндотелиальной системой. Таким образом, мы показали, что совокупность воздействия уремии и ГД-сессии вызывает мультифакторное снижение деформируемости и функциональных показателей эритроцитов пациентов отделения ГД и играет важную роль в развитии и усугублении почечной анемии. Дальнейшее исследование нарушения свойств эритроцитов позволит расширить понимание механизмов развития почечной анемии, ассоциированной с терминальной стадией ХБП.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Источники финансирования. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта №19-315-60015 (ЮС) и ГЗ AAAA-A18-118012290371-3 (ЮС, ЕС, ИМ).
Соответствие принципам этики. Проведение всех процедур было одобрено этическим комитетом ПСПБГМУ им. ак. И.П. Павлова (протокол № 217 от 17.01.2020), этическим комитетом ИЭФБ РАН (протокол № 2–02 от 02.02.2021) и соответствовало декларации Хельсинки.
Список литературы
Glassock R.J. 2008. Uremic toxins: what are they? An integrated overview of pathobiology and classification. J. Ren. Nutr. 18 (1), 2–6.
Vos F.E., Schollum J.B., Coulter C.V., Doyle T.C., Duffull S.B., Walker R.J. 2011.Red blood cell survival in long-term dialysis patients. Am. J. Kidney Dis. 58 (4), 591–598.
Kliche K., Gerth U., Pavenstädt H., Oberleithner H. 2015. Recharging red blood cell surface by hemodialysis. Cell Physiol. Biochem. 35 (3), 1107–1115.
Bonan N.B., Steiner T.M., Kuntsevich V., Virzì G.M., Azevedo M., Nakao L.S., Barreto F.C., Ronco C., Thijssen S., Kotanko P., Pecoits-Filho R., Moreno-Amaral A.N. 2016. Uremic toxicity-induced eryptosis and monocyte modulation: The erythrophagocytosis as a novel pathway to renal anemia. Blood Purif. 41 (4), 317–323.
Fishbane S., Spinowitz B. 2018. Update on anemia in ESRD and earlier stages of CKD: Core curriculum 2018. Am. J. Kidney Dis. 71 (3), 423–435.
Georgatzakou H.T., Tzounakas V.L., Kriebardis A.G., Velentzas A.D., Papageorgiou E.G., Voulgaridou A.I., Kokkalis A.C., Antonelou M.H., Papassideri I.S. 2017. Pathophysiological aspects of red blood cells in end-stage renal disease patients resistant to recombinant human erythropoietin therapy. Eur. J. Haematol. 98 (6), 590–600.
Tozoni S.S., Dias G.F., Bohnen G., Grobe N., Pecoits-Filho R., Kotanko P., Moreno-Amaral A.N. 2019. Uremia and hypoxia independently induce eryptosis and erythrocyte redox imbalance. Cell Physiol. Biochem. 53, 794–804.
Ayala A., Muñoz M.F., Argüelles S. 2014. Lipid peroxidation: Production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal. Oxid. Med. Cell Longev. 2014, 360438.
Sindhu R.K., Ehdaie A., Farmand F., Dhaliwal K.K., Nguyen T., Zhan C.D., Roberts C.K., Vaziri N.D. 2005. Expression of catalase and glutathione peroxidase in renal insufficiency. Biochim. Biophys. Acta. 1743 (1–2), 86–92.
Gao C., Xie R., Yu C., Ma R., Dong W., Meng H., Zhang Y., Si Y., Zhang Z., Novakovic V., Zhang Y., Kou J., Bi Y., Li B., Xie R., Gilbert G.E., Zhou J., Shi J. 2015. Thrombotic role of blood and endothelial cells in uremia through phosphatidylserine exposure and microparticle release. PLoS One. 10 (11), e0142835.
Bonomini M., Sirolli V., Merciaro G., Antidormi T., Di Liberato L., Brummer U., Papponetti M., Cappelli P., Di Gregorio P., Arduini A. 2005. Red blood cells may contribute to hypercoagulability in uraemia via enhanced surface exposure of phosphatidylserine. Nephrol. Dial. Transplant. 20 (2), 361–366.
Luo J.F., Li J.H., Nie J.J., Li P.P., Zhang H.D., Ma Y.J. 2019. Effect of hemodialysis on the red blood cell life span in patients with end-stage kidney disease. Ther. Apher. Dial. 23 (4), 336–340.
Scherer A., Günther O.P., Balshaw R.F., Hollander Z., Wilson-McManus J., Ng R., McMaster W.R., McManus B.M., Keown P.A. 2013. Alteration of human blood cell transcriptome in uremia. BMC Med. Genomics. 6, 23.
Antonelou M.H., Kriebardis A.G., Velentzas A.D., Kokkalis A.C., Georgakopoulou S.C., Papassideri I.S. 2011. Oxidative stress-associated shape transformation and membrane proteome remodeling in erythrocytes of end stage renal disease patients on hemodialysis. J. Proteomics. 74 (11), 2441–2452.
Huisjes R., Bogdanova A., van Solinge W.W., Schiffelers R.M., Kaestner L., van Wijk R. 2018. Squeezing for life – Properties of red blood cell deformability. Front. Physiol. 9, 656.
McMahon T.J. 2019. Red blood cell deformability, vasoactive mediators, and adhesion. Front. Physiol. 10, 1417.
Orbach A., Zelig O., Yedgar S., Barshtein G. 2017. Biophysical and biochemical markers of red blood cell fragility. Transfus. Med. Hemother. 44 (3), 183–187.
Kikuchi Y., Koyama T., Koyama Y., Tozawa S., Arai T., Horimoto M., Kakiuchi Y. 1982. Red blood cell deformability in renal failure. Nephron. 30 (1), 8–14.
Barns S., Balanant M.A., Sauret E., Flower R., Saha S., Gu Y. 2017. Investigation of red blood cell mechanical properties using AFM indentation and coarse-grained particle method. Biomed. Eng. Online. 16 (1), 140.
Bowry S.K., Gatti E. 2011. Impact of hemodialysis therapy on anemia of chronic kidney disease: The potential mechanisms. Blood Purif. 32 (3), 210–219.
Тугушева Ф.А., Зубина И.М. 2009. Оксидативный стресс и его участие в неиммунных механизмах прогрессирования хронической болезни почек. Нефрология. 13 (3), 42–48.
Dutka P. 2008. Guarding against hidden hemolysis during dialysis: An overview. Nephrol. Nurs. J. 35, 45.
Ahmadmehrabi S., Tang W.H.W. 2018. Hemodialysis-induced cardiovascular disease. Semin. Dial. 31 (3), 258–267.
Depond M., Henry B., Buffet P., Ndour P.A. 2020. Methods to investigate the deformability of RBC during malaria. Front. Physiol. 10, 1613.
Sohn M., Lee J.E., Ahn M., Park Y., Lim S. 2021. Correlation of dynamic membrane fluctuations in red blood cells with diabetes mellitus and cardiovascular risks. Sci. Rep. 11 (1), 7007.
Bratosin D., Estaquier J., Petit F., Arnoult D., Quatannens B., Tissier J.P., Slomianny C., Sartiaux C., Alonso C., Huart J.J., Montreuil J., Ameisen J.C. 2001. Programmed cell death in mature erythrocytes: A model for investigating death effector pathways operating in the absence of mitochondria. Cell Death. Differ. 8, 1143–1156.
Riley R.S., Ben-Ezra J.M., Goel R., Tidwell A. 2001. Reticulocytes and reticulocyte enumeration. J. Clin. Lab. Anal. 15 (5), 267–294.
Mindukshev I.V., Sudnitsyna J.S., Skverchinskaya E.A., Andreyeva A.Yu., Dobrylko I.A., Senchenkova E.Yu., Krivchenko A.I., Gambaryan S.P. 2019. Erythrocytes’ reactions to osmotic, ammonium, and oxidative stress are inhibited under hypoxia. Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology. 13 (4), 352–364.
Sudnitsyna J.S., Skvertchinskaya E.A., Dobrylko I.A., Nikitina E.R., Krivchenko A.I., Gambaryan S.P., Mindukshev I.V. 2016. Human erythrocyte ammonium transport is mediated by functional interaction of ammonium (RhAG) and anion (AE1) transporters. Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology. 10 (4), 301–310.
Sudnitsyna J., Skverchinskaya E., Dobrylko I., Nikitina E., Gambaryan S., Mindukshev I. 2020. Microvesicle Formation induced by oxidative stress in human erythrocytes. Antioxidants (Basel). 9 (10), 929.
Kanias T., Acker J.P. 2010. Mechanism of hemoglobin-induced cellular injury in desiccated red blood cells. Free Radic. Biol. Med. 49 (4), 539–547.
Ly J., Marticorena R., Donnelly S. 2004. Red blood cell survival in chronic renal failure. Am. J. Kidney Dis. 44, 715–719.
Koma Y., Onishi A., Matsuoka H., Oda N., Yokota N., Matsumoto Y., Koyama M., Okada N., Nakashima N., Masuya D., Yoshimatsu H., Suzuki Y. 2013. Increased red blood cell distribution width associates with cancer stage and prognosis in patients with lung cancer. PLoS One. 8 (11), e80240.
Evans E.A., Hochmuth R.M. 1976. Membrane viscoelasticity. Biophys. J. 16 (1), 1–11.
Bruce L.J., Beckmann R., Ribeiro M.L., Peters L.L., Chasis J.A., Delaunay J., Mohandas N., Anstee D.J., Tanner M.J. 2003. A band 3-based macrocomplex of integral and peripheral proteins in the RBC membrane. Blood. 101 (10), 4180–4188.
Борисов Ю.А., Судницына Ю.С., Власов Т.Д., Дульнева Л.В., Аболмасов В.О., Миндукшев И.В., Смирнов А.В. 2020. Уремический синдром вызывает нарушение деформационно-функциональных характеристик эритроцитов у пациентов хронического гемодиализа. Рос. физиол. журн. им. И.М. Сеченова. 106 (8), 1025–1040.
Evans B.A., Ansari A.K., Kamyszek R.W., Salvagno M., Welsby J., Fuller M., Welsby I. 2021. Modulation of red blood cell oxygen affinity with a novel allosteric modifier of hemoglobin is additive to the Bohr effect. Blood Cells Mol. Dis. 87, 102520.
Jensen F.B. 2009. The dual roles of red blood cells in tissue oxygen delivery: Oxygen carriers and regulators of local blood flow. J. Exp. Biol. 212 (Pt21), 3387–3393.
Chintagari N.R., Jana S., Alayas A.I. 2016. Oxidized ferric and ferryl forms of hemoglobin trigger mitochondrial dysfunction and injury in alveolar type I cells. Am. J. Respir. Cell Mol. Biol. 55, 288–298.
Pantaleo A., Ferru E., Pau M.C., Khadjavi A., Mandili G., Mattè A., Spano A., De Franceschi L., Pippia P., Turrini F. 2016. Band 3 erythrocyte membrane protein acts as redox stress sensor leading to its phosphorylation by p (72) Syk. Oxid. Med. Cell Longev. 2016, 6051093.
Sugie J., Intaglietta M., Sung L.A. 2018. Water transport and homeostasis as a major function of erythrocytes. Am. J. Physiol. Heart Circ. Physiol. 314 (5), H1098–H1107.
Jani V.P., Lucas A., Jani V.P., Munoz C., Williams A.T., Ortiz D., Yalcin O., Cabrales P. 2020. Numerical model for the determination of erythrocyte mechanical properties and wall shear stress in vivo from intravital microscopy. Front. Physiol. 10, 1562.
Van Avondt K., Nur E., Zeerleder, S. 2019. Mechanisms of haemolysis-induced kidney injury. Nat. Rev. Nephrol. 15, 671–692.
Deltombe O., Van Biesen W., Glorieux G., Massy Z., Dhondt A., Eloot S. 2015. Exploring protein binding of uremic toxins in patients with different stages of chronic kidney disease and during hemodialysis. Toxins (Basel). 7 (10), 3933–3946.
Itano H.A., Keitel H.G., Thompson D. 1956. Hyposthenuria in sickle cell anemia: A reversible renal defect. J. Clin. Invest. 35 (9), 998–1007.
Bonomini M., Pieroni L., Ronci M., Sirolli V., Urbani A. 2018. Blood cell proteomics in chronic kidney disease. Open Urology and Nephrology. 11, 28–38.
Mohanty J.G., Nagababu E., Rifkind J. M. 2014. Red blood cell oxidative stress impairs oxygen delivery and induces red blood cell aging. Front. Physiol. 5, 84.
Welbourn E.M., Wilson M.T., Yusof A., Metodiev M.V., Cooper C.E. 2017. The mechanism of formation, structure and physiological relevance of covalent hemoglobin attachment to the erythrocyte membrane. Free Radic. Biol. Med. 103, 95–106.
Oldenborg P.A., Zheleznyak A., Fang Y.F., Lagenaur C.F., Gresham H.D., Lindberg F.P. 2000. Role of CD47 as a marker of self on red blood cells. Science. 288 (5473), 2051–2054.
Судницына Ю.С., Гамбарян С.П., Кривченко А.И., Миндукшев И.В. 2018. Импорт аммиака/аммония в эритроциты человека. Биол. мембраны. 35 (5), 398–402.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


