Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 6, стр. 464-473
Антитромбоцитарный эффект нобилетина опосредован активацией аденозинового рецептора A2A
В. С. Шпакова a, *, А. В. Авдеева b, Н. Аль Араве b, А. М. Прилепская b, С. П. Гамбарян a, Е. С. Алексеева b, Н. И. Рукояткина a
a Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: spakovavalentina@gmail.com
Поступила в редакцию 09.04.2021
После доработки 27.05.2021
Принята к публикации 31.05.2021
Аннотация
Нобилетин – полиметоксилированный флавон, выделяемый из кожуры цитрусовых, который обладает множеством полезных свойств. В частности, нобилетин способен оказывать противовоспалительное, антибактериальное и антиоксидантное действие. Недавние исследования показали, что нобилетин снижает адгезию и агрегацию тромбоцитов, что делает возможным его использование в профилактике и лечении тромбообразования, однако точные механизмы его действия на тромбоциты неизвестны. В связи с этим основной целью данной работы являлось исследование молекулярных механизмов ингибирования тромбоцитов, опосредованного нобилетином. Мы показали, что нобилетин блокирует индуцированную активацию тромбоцитов, не вызывая при этом их гибель. Ингибирующий эффект нобилетина на тромбоциты по крайней мере частично обусловлен активацией рецептора A2A к аденозину и запуском сигнальной системы АЦ/cAMP/PKA.
ВВЕДЕНИЕ
Тромбоциты – это небольшие безъядерные клетки, образующиеся из мегакариоцитов в красном костном мозге, выполняющие множество функций в организме. Тромбоциты вовлечены в поддержание и регуляцию сосудистого тонуса, участвуют в транспорте веществ [1], процессах врожденного иммунитета [2, 3], однако основной функцией тромбоцитов является регуляция гемостаза [4].
В норме интактные клетки эндотелия блокируют процессы активации тромбоцитов за счет синтеза ингибирующих сигнальных молекул [5]. При повреждении кровеносного сосуда эта супрессия прекращается и происходит запуск активирующих сигнальных каскадов, приводящих к адгезии и последующей агрегации тромбоцитов с образованием тромба для предотвращения кровотечения [6]. Нарушение функционирования тромбоцитов способствует развитию тромбофилии или тромбоцитопатии [7].
Нормальный гемостаз может быть нарушен патологическими факторами, приводящими к неконтролируемому образованию тромба и частичной или полной закупорке сосудов [8]. Тромбоциты играют важную роль в патогенезе тромбозов, являясь одним из главных медиаторов тромбообразования [9]. Согласно данным Всемирной организации здравоохранения, тромбозы являются одной из основных причин смертности по всему миру [10], однако применение доступных на текущий момент противотромбозных препаратов осложнено рядом ограничений и возможностью возникновения серьезных побочных эффектов, включая сильные кровотечения [11]. В связи с этим в настоящее время поиск более совершенных лекарственных средств для профилактики и лечения тромбоза является приоритетным направлением исследований.
Флавоноиды – группа фенольных соединений растительного происхождения, характеризующаяся структурным разнообразием, широким спектром активностей и низкой токсичностью. Эпидемиологические исследования продемонстрировали, что регулярное употребление богатой флавоноидами пищи снижает риск возникновения болезней сердечно-сосудистой системы, в частности, за счет способности веществ этой группы снижать уровень жиров и поддерживать целостность кровеносных сосудов [12]. Среди полиметоксилированных флавонов особый интерес исследователей привлекает нобилетин. Данное вещество содержится в высоких концентрациях в кожуре неспелых цитрусовых и обладает множеством полезных свойств. В частности, нобилетин оказывает противовоспалительное [13], нейропротекторное [14], антибактериальное и антиоксидантное действия [15]. Кроме того, исследования на различных линиях раковых клеток показали, что нобилетин обладает противораковой активностью за счет способности ингибировать рост и миграцию клеток и вызывать арест клеточного цикла и запуск апоптоза [16, 17]. В то же время в неопухолевых клетках данное вещество способно блокировать апоптоз, оказывая протекторное действие [18, 19].
В последнее время активно рассматривается возможность применения нобилетина в профилактике и лечении тромбообразования. Исследования in vivo и in vitro показали, что нобилетин способен ингибировать активацию и снижать адгезивные свойства тромбоцитов [20, 21], однако точные механизмы его действия на тромбоциты неизвестны. В связи с этим целью данной работы являлось исследование действия нобилетина на функциональное состояние тромбоцитов.
В настоящей работе было исследовано влияние нобилетина на тромбин- и CRP-XL-опосредованную активацию тромбоцитов, а также проверена способность нобилетина индуцировать апоптоз или образование прокоагулянтных тромбоцитов. Мы показали, что нобилетин блокирует активацию тромбоцитов, не вызывая их гибель или переход в прокоагулянтное состояние. При этом ингибирование тромбоцитов нобилетином, по крайней мере частично, опосредовано активацией рецептора A2A к аденозину и запуском АЦ/cAMP/PKA сигнальной системы.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовались следующие реактивы: нобилетин (Sigma-Aldrich, Германия), фибриноген меченый Alexa-Fluor 647 (Molecular Probes, Германия), тромбин, выделенный из человеческой плазмы (Roche, Германия), перекрестно-сшитый родственный коллагену пептид (CRP-XL), любезно предоставленный проф. М.А. Пантелеевым (Центр теоретических проблем физико-химической фармакологии РАН, Москва), аннексин V, конъюгированный с R-фикоэритрином (BD-Bioscience, Германия), индуктор апоптоза ABT-737 (Selleckchem, Германия), SQ22563 и ODQ (Sigma-Aldrich), форсколин (Sigma-Aldrich), SNP (Alexis Biochemicals, Германия), Cay 10441 (Cayman Chemical, США), L161 982 (Sigma-Aldrich), ZM 241385 (Sigma-Aldrich), BW A868C (Cayman Chemical, США), моноклональные фосфо-VASPser239-антитела (Nano Tools, Германия), антитела к каспазе 3 (Cell Signalling, Германия), конъюгированные с пероксидазой хрена anti-mouse и anti-rabbit IgG вторичные антитела (Amersham, Германия).
Выделение тромбоцитов. Тромбоциты человека выделяли из крови здоровых доноров. Все экспериментальные протоколы были утверждены и одобрены этическим комитетом Института эволюционной физиологии и биохимии РАН (протокол № 3-03 от 02.03.20) и соответствуют Хельсинкской декларации. Кровь собиралась в пробирку с цитратным буфером (12 мМ лимонной кислоты, 15 мМ цитрата натрия, 25 мМ D-глюкозы, 2 мкМ EGTA) и затем центрифугировалась 7 мин при 200 g (центрифуга CM-6M ELMI). Полученную плазму, обогащенную тромбоцитами (platelet-rich plasma, PRP), разводили в HEPES-буфере (150 мМ хлорида натрия, 5 мМ хлорида калия, 1 мМ хлорида магния, 1 мМ хлорида кальция, 5 мМ D-глюкозы, 10 мМ HEPES, pH 7.4) в соотношении 1 : 10. Для экспериментов на отмытых тромбоцитах PRP разводили раствором CGS (120 мМ хлорида натрия, 12 мМ тринатрий цитрата, 10 мМ D-глюкозы, pH 6.5) в пропорции 1 : 2 и центрифугировали при 330 g в течение 4 мин. Полученный осадок растворяли в 1.5 мл раствора CGS и вновь центрифугировали 4 мин при 330 g, после чего осадок ресуспендировали в HEPES-буфере. Далее к отмытым тромбоцитам добавляли CaCl2 в конечной концентрации 1 мМ. Для проведения опытов использовали рабочую концентрацию тромбоцитов 1 × 108/мл для проточной цитометрии и 3 × 108/мл для Вестерн-блот-анализа.
Проточная цитометрия. Уровень активация тромбоцитов оценивался по степени связывания активированных интегринов αIIbβ3 с фибриногеном, меченным флуоресцентным красителем Alexa-Fluor 647. К 100 мкл отмытых тромбоцитов (1 × 108/мл) добавляли фибриноген (15 мкг/мл, конечная концентрация) и нобилетин в конечных концентрациях 12.5, 25 или 75 мкМ, после чего тромбоциты инкубировали в течение 10 мин при 37°C. Затем в пробы добавляли тромбин (10 mU), CRP-XL (0.5 мкг × мл–1, конечная концентрация), инкубировали еще 4 мин при 37°C и останавливали реакцию в 400 мкл фосфатного буфера. Для экспериментов на PRP в разбавленную плазму при комнатной температуре вводили фибриноген (15 мкг/мл, конечная концентрация) и ингибитор аденозинового рецептора A2A (ZM 241385), инкубировали 10 мин, после чего добавляли нобилетин в конечной концентрации 50 мкМ и инкубировали еще 10 мин. Далее в пробы добавляли ADP, инкубировали еще 4 мин и в каждую пробирку добавляли CaCl2 в конечной концентрации 1 мМ, после чего останавливали реакцию 400 мкл фосфатного буфера.
Для оценки экстернализации фосфатидилсерина (PS) использовали аннексин V, конъюгированный с фикоэритрином (PE). После добавления аннексина V–PE в пробы (1 : 10) суспензию сразу растворяли в 400 мл аннексин V связывающего буфера (140 мM NaCl, 10 мM HEPES, 2.5 мM CaCl2), необходимого для связывания аннексина V–PE с PS, после чего пробы инкубировали 10 мин при комнатной температуре в темноте. В качестве положительного контроля использовали индуктор апоптоза ABT-737 (1 мкМ), с которым тромбоциты инкубировали в течение 60 мин (37°C).
Анализ проводился на проточном цитофлуориметре NaviousTM (Beckman Coulter, США; прибор ЦКП ИЭФБ РАН). Каждый образец оценивался по 15 000 событиям. Полученные данные обрабатывались при помощи Cytometry List Mode Data Aquisition & Analysis Software for Navios cytometer 1.2.
Вестерн-блот-анализ. Для определения активации каспазы 3 пробы инкубировали с нобилетином (1, 10 и 50 мкМ) в течение 10 мин при 37°C, после чего в пропорции 1 : 1 добавляли лизирующий буфер, содержащий додецилсульфатнатрия (SDS) и меркаптоэтанол (10%). Затем пробы кипятили 5 мин при 95°C. В качестве положительного контроля использовали ABT-737 (1 мкМ, конечная концентрация, 60 мин).
Для определения степени фосфорилирования белка VASP отмытые тромбоциты инкубировали с нобилетином в концентрациях 1, 12.5, 25, 50 и 100 мкМ в течение 1, 2, 10 и 30 мин, после чего в пробы вводили лизирующий буфер (1 : 1).
Для оценки вклада cAMP- и cGMP-зависимых сигнальных путей в ингибирующий эффект нобилетина к тромбоцитам добавляли ингибитор аденилатциклазы (АЦ) SQ22536 (100 мкМ) или ингибитор гуанилатциклазы (ГЦ) ODQ (20 мкМ) и инкубировали в течение 10 мин при 37°C. Далее в суспензию тромбоцитов вводили нобилетин (25 мкМ) и инкубировали еще 10 мин. Затем в пробы вносили лизирующий буфер, после чего кипятили пробы при 95°C в течение 5 мин. В качестве положительного контроля использовались активатор АЦ форсколин в концентрации 1 мкМ (2 мин инкубации) и донор окиси азота нитропруссид натрия (SNP, 1 мкМ, 2 мин).
Белки разделяли при помощи электрофореза в SDS полиакриламидном геле (SDS-PAGE), затем переносили на нитроцеллюлозную мембрану при помощи мокрого переноса (wet transfer). Далее мембрану отмывали в растворе TBS-T (20 мM трис(гидроксиметил)аминометана, 150 мM NaCl, 0.1% Tween 20, pH 7.5) в течение 30 мин, после чего мембрану инкубировали с первичными антителами в течение ночи при 4°C. Неспецифическое связывание блокировали 3% раствором обезжиренного молока, растворенного в TBS-T буфере. Для визуализации сигнала применялись вторичные антитела, конъюгированные с пероксидазой хрена. Проявка мембран осуществлялась при помощи сканера C-DiGit (Li-COR, США). Анализ хемилюминесценции проводили с использованием Image Studio Digits Ver.5.2.
Статистическая обработка. Все эксперименты были выполнены в количестве не менее четырех. Данные выражались как среднее арифметическое ± ± ошибка среднего. Статистическая обработка проводилась с помощью программы GraphPadPrism v8. Достоверность различий средних значений между группами определялась по U-критерию Манна–Уитни. Значения p < 0.05 считали статистически значимыми, n = 6.
РЕЗУЛЬТАТЫ
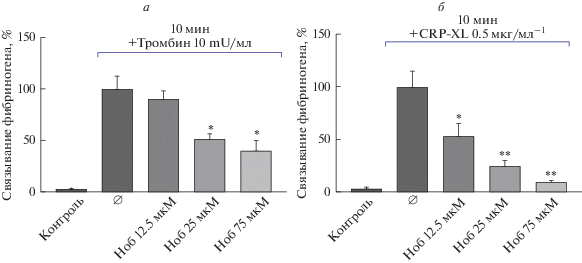
Нобилетин блокирует тромбин- и CRP-индуцированную активацию тромбоцитов. Для оценки действия нобилетина на активацию тромбоцитов в качестве агонистов были использованы тромбин и CRP-XL, действие которых опосредуется связыванием с разными группами рецепторов и запуском различных сигнальных каскадов. Тромбин-опосредованная активация происходит за счет взаимодействия с PAR-рецепторами, тогда как синтетический пептид CRP-XL, имитируя трехспиральную структуру коллагена, связывается с рецептором к коллагену GPVI [22]. Нобилетин дозозависимо ингибировал тромбин- и CRP-XL опосредованную активацию тромбоцитов (рис. 1). При этом нобилетин ингибировал активацию тромбоцитов, вызванную CRP-XL, в меньших концентрациях по сравнению с тромбин-опосредованной активацией (рис. 1).
Рис. 1.
Нобилетин ингибирует тромбин- и CRP-XL опосредованную активацию тромбоцитов. Исследование проводили на проточном цитометре. (а, б) Отмытые тромбоциты (1 × 108/мл) инкубировали с нобилетином в концентрациях 12.5, 25 и 75 мкМ в течение 10 мин. Активация интегринов αIIbβ3, вызванная тромбином или CRP-XL (Ø), принята за 100%, n = 6, * – p < 0.05 по сравнению с контролем, ** – p < 0.01 по сравнению с контролем.
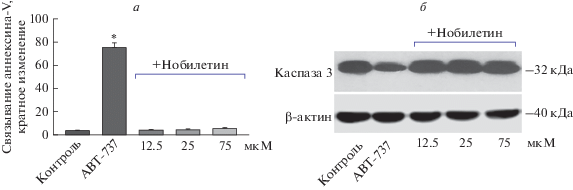
Нобилетин не вызывает апоптоз тромбоцитов. Для нобилетина показана способность блокировать апоптоз в неопухолевых клетках и, наоборот, вызывать программируемую гибель в опухолевых клетках [23]. Известно, что активация апоптоза в тромбоцитах может приводить к блокированию их активации, поэтому мы проверили, способен ли нобилетин индуцировать гибель тромбоцитов [24]. Была проведена серия экспериментов по оценке степени экстернализации PS на поверхности тромбоцитов и активации каспазы 3 после инкубации с нобилетином.
Введение нобилетина во всех исследуемых дозах не вызывало переход PS на внешний слой плазматической мембраны тромбоцитов (рис. 2а) и не приводило к активации каспазы 3 (рис. 2б), которая является основным эффекторным белком в процессе апоптоза в клетках.
Рис. 2.
Нобилетин не вызывает апоптоз тромбоцитов. (а) Отмытые тромбоциты (1 × 108/мл) инкубировали с нобилетином в концентрации 12.5, 25 и 75 мкМ в течение 10 мин, после чего анализировали на проточном цитометре. Активатор апоптоза ABT-737 использовали в качестве позитивного контроля. Уровень экстернализации PS оценивался по степени связывания с аннексином V, n = 6, * – p < 0.05 по сравнению с контролем. (б) Вестерн-блот каспазы 3. Отмытые тромбоциты (3 × 108/мл) инкубировали с нобилетином в концентрации 12.5, 25 и 75 мкМ в течение 10 мин. Активатор апоптоза ABT-737 использовали в качестве позитивного контроля. Актин использовали для контроля количества белка.
Нобилетин активирует АЦ/cAMP/PKA сигнальный путь в тромбоцитах. Состояние покоя тромбоцитов в просвете сосуда обеспечивается функционированием двух основных сигнальных систем – cAMP- и cGMP-зависимой. Активация аденилатциклазы (АЦ) и гуанилатциклазы (ГЦ) приводит к повышению концентраций cAMP и cGMP, что ведет к активации протеинкиназы А (PKA) и протеинкиназы G (PKG) [25]. Одним из субстратов этих протеинкиназ является белок VASP, фосфорилирование которого служит надежным маркером активации ингибиторных PKA/PKG сигнальных систем в тромбоцитах (рис. 3) [25]. При этом PKA фосфорилирует VASP преимущественно по сайту Ser157, а PKG – по Ser239, однако при сильной активации любой из киназ происходит фосфорилирование VASP по обоим сайтам. Важно отметить, что фосфорилированный по Ser157 VASP при белковом электрофорезе подвергается шифтированию с 46 до 50 кДа, что отражается на блоте появлением второй (верхней) полосы [26]. Специфичные фосфо-Ser239 антитела, которые использовались в нашей работе, позволяют детектировать фосфорилирование VASP по Ser239, однако появление на блоте второй полосы свидетельствует о фосфорилировании белка VASP по обоим сайтам [26].
Рис. 3.
Нобилетин вызывает фосфорилирование белка VASP в тромбоцитах путем активации АЦ/cAMP/PKA сигнального пути. Отмытые тромбоциты (3 × 108/мл) инкубировали с нобилетином (а) в указанных концентрациях и (б) указанное время. Форсколин (Ф) использовали в качестве позитивного контроля. в – Тромбоциты инкубировали с SQ 22536 (100 мкМ) или ODQ (20 мкМ) в течение 10 мин, после чего вводили нобилетин и инкубировали еще 30 мин. Активность PKA/PKG определяли по форфорилированию белка VASP. В качестве позитивного контроля использовали форсколин и SNP. Актин использовали для контроля количества белка. К – контроль.

Нобилетин вызывал фосфорилирование VASP во всех исследуемых дозах (рис. 3а), при этом интенсивность фосфорилирования по обоим сайтам возрастала со временем (рис. 3б). Эти данные свидетельствуют о том, что нобилетин вызывает активацию PKA/PKG сигнальных систем в тромбоцитах.
Для определения вклада cAMP и cGMP-зависимых сигнальных путей в ингибирующий эффект нобилетина использовали SQ22536, блокирующий АЦ, и ODQ, ингибирующий ГЦ. Контролем к данной серии опытов служили специфичные активаторы АЦ (форсколин) и ГЦ (SNP). Вестерн-блот-анализ показал, что SQ22536 уменьшал интенсивность фосфорилирования VASP, вызванного нобилетином в концентрации 25 мкМ, тогда как ODQ не блокировал нобилетин-опосредованное фосфорилирование VASP (рис. 3в). Эти данные свидетельствуют о том, что ингибиторный эффект нобилетина может быть опосредован запуском cAMP-зависимого сигнального каскада.
Действие нобилетина опосредовано активацией аденозинового А2А-рецептора. Основным путем активации АЦ и запуска синтеза cAMP в тромбоцитах является рецепторный путь, поэтому мы проверили, опосредовано ли действие нобилетина активацией поверхностных рецепторов на тромбоцитах, участвующих в регуляции АЦ/cAMP/ PKA сигнального пути.
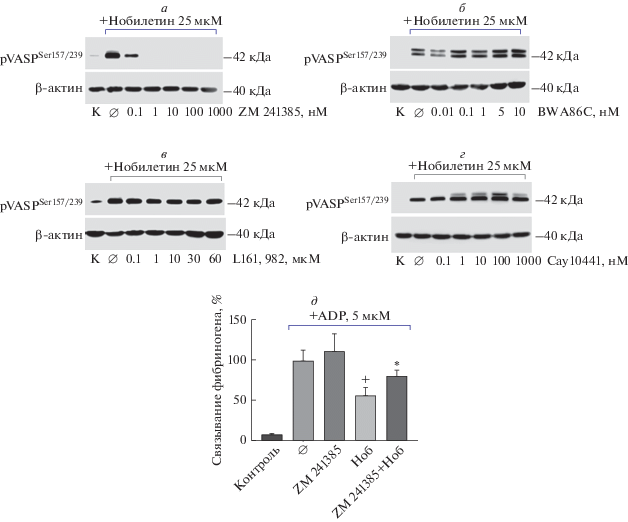
На тромбоцитах представлены несколько рецепторов, способных активировать АЦ и запускать синтез cAMP с последующей активацией PKA. Все они относятся к рецепторам, ассоциированным с G-белком, и содержат Gαs-субъединицу в своем составе. Большинство этих рецепторов являются простагландиновыми и активируются после связывания с соответствующим типом простагландина. Так, в тромбоцитах экспрессируется рецептор DP1, который селективно связывается с простагландином D, рецепторы EP2 и EP4, которые связываются с простагландином Е2, и IP-рецептор к простагландину I2 [27]. Помимо простагландинов, вызывать увеличение уровня cAMP в тромбоцитах может аденозин, который выделяется при повреждении клеток и связывается с аденозиновым А2-рецептором на тромбоцитах [28]. Для того чтобы определить, какие из перечисленных рецепторов могут быть мишенями нобилетина, мы использовали ингибиторы к каждому из этих рецепторов и проанализировали фосфорилирование белка VASP (рис. 4). Ингибиторы рецепторов DP1 (BW A868C), IP (Cay10441) и EP4 (L-161,982) не блокировали фосфорилирование VASP, вызванное нобилетином (рис. 4б, 4в, 4г), тогда как ингибитор рецептора А2А (ZM 241385) существенно снижал фосфорилирование VASP после введения нобилетина (рис. 4а). Ингибирование аденозинового А2А-рецептора ZM 241385 при введении нобилетина приводило к частичному восстановлению фибриногенового связывания на тромбоцитах, активированных ADP (рис. 4д). Введение в пробы самого ZM 241385 вызывало незначительное увеличение фибриногенового связывания по сравнению с контролем (14 ± 0.7%, данные не представлены), а введение ZM 241385 совместно с ADP приводило к потенцированию активации тромбоцитов (11.8 ± 7.01%). Подобный эффект наблюдается вследствие того, что даже при снижении базального уровня cAMP может происходить активация тромбоцитов. Эти данные служат подтверждением того, что ингибирующее действие нобилетина на тромбоциты, по крайней мере частично, опосредовано активацией аденозинового рецептора А2А.
Рис. 4.
Ингибирующее действие нобилетина на тромбоциты опосредовано активацией аденозинового рецептора А2А. Отмытые тромбоциты (3 × 108/мл) инкубировали с ингибиторами рецепторов (а) ZM 241385, (б) BW A868C, (в) L161,982, (г) Cay10441 в указанных концентрациях в течение 10 мин, после чего вводили нобилетин и инкубировали еще 30 мин. Актин использовали для контроля количества белка. (д) Плазму, обогащенную тромбоцитами, инкубировали с ингибитором аденозинового A2A-рецептора (ZM 241385) в течение 10 мин, после чего вводили нобилетин (50 мкМ) и инкубировали еще 10 мин. Далее тромбоциты активировали ADP (5 мкМ, 5 мин) и анализировали на проточном цитометре. Активация интегринов αIIbβ3, вызванная ADP (Ø), принята за 100%, n = 9; + различия между ADP (Ø) и Ноб достоверны при p < 0.01, * – различия между Ноб и Ноб+ZM 241385 достоверны при p < 0.01. Ноб – нобилетин, К – контроль.
ОБСУЖДЕНИЕ
При анализе действия полиметоксилированного флавона нобилетина на тромбоциты человека было обнаружено снижение адгезивных свойств тромбоцитов, что соответствует данным, полученным другими исследователями [29, 30]. Нами было показано, что нобилетин дозозависимо ингибирует активацию интегринов αIIbβ3 на тромбоцитах, вызванную как тромбином, являющимся агонистом PAR-рецепторов, так и CRP-XL, связывающимся с GPVI-рецептором. При этом ингибиторный эффект достигается при более низких дозах исследуемого вещества у тромбоцитов, стимулированных CRP (рис. 1). Необходимость больших доз нобилетина для блокирования PAR 1-сигнальной системы вероятно связана с тем, что тромбин является более сильным активатором и вызывает необратимую активацию тромбоцитов, поддерживаемую усилением синтеза и высвобождения вторичных активаторов, таких как ADP и TxA2 [31].
В исследованиях на неопухолевых клетках нобилетин оказывал антиапоптотическое действие, ингибируя запуск апоптоза. В частности, в клетках, изолированных из островков Лангерганса, данное соединение подавляло экспрессию проапоптотических белков и усиливало синтез антиапоптотического белка BCL-2 [32]. Вместе с тем на различных линиях раковых клеток была продемонстрирована способность нобилетина индуцировать апоптоз в опухолевых клетках [23], в связи с чем в настоящее время данное соединение рассматривается в качестве перспективного противоопухолевого агента. В работе Lu и соавт. было показано, что даже в высоких концентрациях (100 мкМ) нобилетин не вызывает цитолиз тромбоцитов [30], однако в литературе отсутствуют данные о том, вызывает ли исследуемое вещество апоптоз тромбоцитов. В наших экспериментах нобилетин не индуцировал переход тромбоцитов в прокоагулянтное состояние и не вызывал запуск апоптоза (рис. 2). Отсутствие цитотоксического эффекта, сопряженное со способностью блокировать адгезию и агрегацию тромбоцитов, является преимуществом нобилетина и как антиагрегантного средства, и как противоопухолевого препарата в связи с повышенным риском тромбоза у онкологических больных [33] и вклада активированных тромбоцитов в метастазирование и ангиогенез [34].
В настоящее время существует два основных подхода определения активности АЦ/cAMP/PKA и ГЦ/cGMP/PKG сигнальных систем в тромбоцитах. Первый подход связан с использованием ингибиторов или активаторов самих PKA и PKG. Однако активаторы (8-Br-cGMP, 8-pCPT-cGMP, 8-Br-PET-cGMP) и ингибиторы (Rp-8-PCPT-cGMPS, Rp-8-Br-PET-cGMPS) PKG способны активировать и ингибировать тромбоциты независимо от действия на данную протеинкиназу [35]. Кроме того, доступные на сегодняшний день селективные ингибиторы PKA (H89 и KT5720) не являются специфичными и обладают даже большей аффинностью к другим протеинкиназам [36, 37]. Таким образом, не существует специфичных ингибиторов PKA и PKG, которые можно было бы использовать для изучения PKA/PKG ингибиторных систем в тромбоцитах.
Второй подход связан с уменьшением количества самих циклических нуклеотидов в тромбоцитах ингибиторами АЦ (SQ22536) и ГЦ (ODQ). Однако и этот подход нужно использовать с осторожностью, поскольку было показано, что иммуноферментные методы определения уровня cGMP часто дают ложноположительные результаты для тромбоцитов при определенных условиях [7]. Однако среди прочих ингибиторов SQ22536 и ODQ являются достаточно специфичными [38–40], в связи с чем для изучения эффекта нобилетина на тромбоциты были выбраны именно эти ингибиторы. Одним из самых достоверных и чувствительных методов оценки активности cAMP- и cGMP-зависимых сигнальных каскадов является анализ фосфорилирования белка VASP, используемого в качестве индикатора активности PKA и PKG в тромбоцитах [35].
Нобилетин вызывал дозозависимое фосфорилирование белка VASP, которое усиливалось со временем (рис. 3а, 3б). Эти результаты позволяют сделать вывод о том, что нобилетин способен активировать PKA и/или PKG в тромбоцитах, которые опосредуют его ингибиторный эффект.
В нашей работе было показано снижение вызванного нобилетином (25 мкМ) фосфорилирования VASP под воздействием SQ22536 при отсутствии эффекта ODQ (рис. 3в). Из этих данных следует, что ингибиторный эффект нобилетина может быть опосредован активацией АЦ и повышением концентрации cAMP в тромбоцитах с последующей активацией PKA. Однако в работе Jayakumar и соавт. в аналогичных опытах с использованием SQ22536 и ODQ (ингибиторы АЦ и ГЦ, соответственно) для определения вклада циклических нуклеотидов в нобилетин-опосредованную активацию протеинкиназ, данные вещества не влияли на степень фосфорилирования VASP, вызванного нобилетином в концентрации 30 мкМ [21]. Исходя из этих данных, авторы сделали вывод о том, что эффект нобилетина на тромбоциты не связан с повышением уровня циклических нуклеотидов [21]. В наших экспериментах более высокие дозы нобилетина (50 мкМ) также вызывали фосфорилирование VASP, которое не ингибировалось ни SQ22536, ни ODQ, однако действие нобилетина в меньших дозах (25 мкМ) частично блокировалось SQ22536. Эти данные явно указывают на наличие cAMP-зависимого эффекта действия нобилетина. Расхождение в данных, полученных нами и группой Jayakumar и соавт. можно объяснить тем, что, вероятно, ЕC50 для нобилетина находится на отметке 25 мкМ или ниже, поэтому ингибирующий эффект SQ22536 не наблюдается при более высоких дозах нобилетина. Кроме того, различия в методике выделения тромбоцитов и условиях проведения экспериментов также могли оказывать влияние на полученные результаты.
Известно, что некоторые флавоноиды способны активировать поверхностные клеточные рецепторы. В частности, в работе Liu и соавт. на клеточных линиях была показана способность некоторых флавоноидов активировать рецептор GRP 30 к эстрогену, повышая тем самым уровень cAMP в клетках [41]. Однако нет никаких данных относительно способности нобилетина специфически связывать и активировать клеточные рецепторы. В нашем исследовании действие нобилетина блокировалось ингибитором аденозинового рецептора А2А, что свидетельствует о способности данного вещества активировать АЦ через воздействие на поверхностные рецепторы в тромбоцитах.
ЗАКЛЮЧЕНИЕ
В последние годы флавоноиды привлекают пристальное внимание ученых по всему миру, поскольку обладают множеством полезных биологических активностей и низкой токсичностью. Для нобилетина показаны антиоксидантная, противоопухолевая, цитопротекторная и противотромбозная активности. Однако механизм антитромбоцитарного действия нобилетина на молекулярном уровне остается малоизученным. Наша работа вносит существенный вклад в понимание внутриклеточных молекулярных механизмов, которые обуславливают действие нобилетина на тромбоциты. Нам удалось продемонстрировать, что нобилетин может влиять на активность рецепторов и вызывать активацию АЦ/cAMP/PKA сигнальной системы в тромбоцитах, чем и может быть обусловлена его противотромбозная активность.
Исследования методом проточной цитометрии выполнены на базе ЦКП ИЭФБ РАН.
Источники финансирования. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-315-90102 (ВС) и по ГЗ AAAA-A18-118012290371-3 (ВС, НИ, СП).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Соответствие принципам этики. Все процедуры, выполненные в настоящем исследовании, были утверждены и одобрены этическим комитетом Института эволюционной физиологии и биохимии РАН (протокол № 3-03 от 02.03.20) и соответствуют Хельсинкской декларации 1964 года. От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Список литературы
Kaul S., Padgett R.C., Heistad D.D. 1994. Role of platelets and leukocytes in modulation of vascular tone. Ann. N.Y. Acad. Sci. 714, 122–135.
Hamzeh-Cognasse H., Damien P., Chabert A., Pozzetto B., Cognasse F., Garraud O. 2015. Platelets and infections – complex interactions with bacteria. Front. Immunol. 6, 82.
Assinger A. 2014. Platelets and infection – an emerging role of platelets in viral infection. Front. Immunol. 5, 649.
Jurk K., Kehrel B.E. 2005. Platelets: Physiology and biochemistry. Semin. Thromb. Hemost. 31 (4), 381–392.
Makhoul S., Walter E., Pagel O., Walter U., Sickmann A., Gambaryan S., Smolenski A., Zahedi R.P., Jurk K. 2018. Effects of the NO/soluble guanylate cyclase/cGMP system on the functions of human platelets. Nitric Oxide. 76, 71–80.
Bye A.P., Unsworth A.J., Gibbins J.M. 2016. Platelet signaling: a complex interplay between inhibitory and activatory networks. J. Thromb. Haemost. 14 (5), 918–930.
Gambaryan S., Tsikas D. 2015. A review and discussion of platelet nitric oxide and nitric oxide synthase: Do blood platelets produce nitric oxide from L-arginine or nitrite? Amino Acids. 47 (9), 1779–1793.
Papapanagiotou A., Daskalakis G., Siasos G., Gargalionis A., Papavassiliou A.G. 2016. The role of platelets in cardiovascular disease: Molecular mechanisms. Curr. Pharm. Des. 22 (29), 4493–4505.
Koupenova M., Kehrel B.E., Corkrey H.A., Freedman J.E. 2017. Thrombosis and platelets: An update. Eur. Heart J. 38 (11), 785–791.
Wendelboe A.M., Raskob G.E. 2016. Global burden of thrombosis: Epidemiologic aspects. Circ. Res. 118 (9), 1340–1347.
Thachil J. 2016. Antiplatelet therapy – a summary for the general physicians. Clin. Med. (Lond). 16 (2), 152–160.
Panche A.N., Diwan A.D., Chandra S.R. 2016. Flavonoids: An overview. J. Nutr. Sci. 5, e47.
Yang G., Lin C.C., Yang Y., Yuan L., Wang P., Wen X., Pan M.H., Zhao H., Ho C.T., Li S. 2019. Nobiletin prevents trimethylamine oxide-induced vascular inflammation via inhibition of the NF-kappaB/MAPK pathways. J. Agric. Food Chem. 67 (22), 6169–6176.
Nakajima A., Ohizumi Y. 2019. Potential benefits of nobiletin, a citrus flavonoid, against Alzheimer’s disease and Parkinson’s disease. Int. J. Mol. Sci. 20 (14), 3380.
Huang H., Li L., Shi W., Liu H., Yang J., Yuan X., Wu L. 2016. The multifunctional effects of nobiletin and its metabolites in vivo and in vitro. Evid. Based Complement Alternat. Med. 2016, 2918796.
Hsiao P.C., Lee W.J., Yang S.F., Tan P., Chen H.Y., Lee L.M., Chang J.L., Lai G.M., Chow J.M., Chien M.H. 2014. Nobiletin suppresses the proliferation and induces apoptosis involving MAPKs and caspase-8/-9/-3 signals in human acute myeloid leukemia cells. Tumour Biol. 35 (12), 11 903–11 911.
Sousa D.P., Pojo M., Pinto A.T., Leite V., Serra A.T., Cavaco B.M. 2020. Nobiletin alone or in combination with cisplatin decreases the viability of anaplastic thyroid cancer cell lines. Nutr. Cancer. 72 (2), 352–363.
Cho H.W., Jung S.Y., Lee G.H., Cho J.H., Choi I.Y. 2015. Neuroprotective effect of citrus unshiu immature peel and nobiletin inhibiting hydrogen peroxide-induced oxidative stress in HT22 murine hippocampal neuronal cells. Pharmacogn. Mag. 11 (Suppl. 2), S284–S289.
Liu B., Huang J., Zhang B. 2016. Nobiletin protects against murine l-arginine-induced acute pancreatitis in association with downregulating p38MAPK and AKT. Biomed. Pharmacother. 81, 104–110.
Ikemura M., Sasaki Y., Giddings J.C., Yamamoto J. 2012. Preventive effects of hesperidin, glucosyl hesperidin and naringin on hypertension and cerebral thrombosis in stroke-prone spontaneously hypertensive rats. Phytother. Res. 26 (9), 1272–1277.
Jayakumar T., Lin K.C., Lu W.J., Lin C.Y., Pitchairaj G., Li J.Y., Sheu J.R. 2017. Nobiletin, a citrus flavonoid, activates vasodilator-stimulated phosphoprotein in human platelets through non-cyclic nucleotide-related mechanisms. Int. J. Mol. Med. 39 (1), 174–182.
Sodergren A.L., Ramstrom S. 2018. Platelet subpopulations remain despite strong dual agonist stimulation and can be characterised using a novel six-colour flow cytometry protocol. Sci. Rep. 8 (1), 1441.
Goh J.X.H., Tan L.T., Goh J.K., Chan K.G., Pusparajah P., Lee L.H., Goh B.H. 2019. Nobiletin and derivatives: Functional compounds from citrus fruit peel for colon cancer chemoprevention. Cancers (Basel). 11 (6), 867.
Rukoyatkina N., Butt E., Subramanian H., Nikolaev V.O., Mindukshev I., Walter U., Gambaryan S., Benz P.M. 2017. Protein kinase A activation by the anti-cancer drugs ABT-737 and thymoquinone is caspase-3-dependent and correlates with platelet inhibition and apoptosis. Cell. Death Dis. 8 (6), e2898.
Nagy Z., Smolenski A. 2018. Cyclic nucleotide-dependent inhibitory signaling interweaves with activating pathways to determine platelet responses. Res. Pract. Thromb. Haemost. 2 (3), 558–571.
Smolenski A., Bachmann C., Reinhard K., Honig-Liedl P., Jarchau T., Hoschuetzky H., Walter U. 1998. Analysis and regulation of vasodilator-stimulated phosphoprotein serine 239 phosphorylation in vitro and in intact cells using a phosphospecific monoclonal antibody. J. Biol. Chem. 273 (32), 20029–20035.
Braune S., Kupper J.H., Jung F. 2020. Effect of prostanoids on human platelet function: An overview. Int. J. Mol. Sci. 21 (23), 9020.
Noe L., Peeters K., Izzi B., Van Geet C., Freson K. 2010. Regulators of platelet cAMP levels: clinical and therapeutic implications. Curr. Med. Chem. 17 (26), 2897–2905.
Vaiyapuri S., Roweth H., Ali M.S., Unsworth A.J., Stainer A.R., Flora G.D., Crescente M., Jones C.I., Moraes L.A., Gibbins J.M. 2015. Pharmacological actions of nobiletin in the modulation of platelet function. Br. J. Pharmacol. 172 (16), 4133–4145.
Lu W.J., Lin K.C., Liu C.P., Lin C.Y., Wu H.C., Chou D.S., Geraldine P., Huang S.Y., Hsieh C.Y., Sheu J.R. 2016. Prevention of arterial thrombosis by nobiletin: In vitro and in vivo studies. J. Nutr. Biochem. 28, 1–8.
Holinstat M., Preininger A.M., Milne S.B., Hudson W.J., Brown H.A., Hamm H.E. 2009. Irreversible platelet activation requires protease-activated receptor 1-mediated signaling to phosphatidylinositol phosphates. Mol. Pharmacol. 76 (2), 301–313.
Keshtkar S., Kaviani M., Jabbarpour Z., Geramizadeh B., Motevaseli E., Nikeghbalian S., Shamsaeefar A., Motazedian N., Al-Abdullah I.H., Ghahremani M.H., Azarpira N. 2019. Protective effect of nobiletin on isolated human islets survival and function against hypoxia and oxidative stress-induced apoptosis. Sci. Rep. 9 (1), 11701.
Abdol Razak N.B., Jones G., Bhandari M., Berndt M.C., Metharom P. 2018. Cancer-Associated thrombosis: An overview of mechanisms, risk factors, and treatment. Cancers (Basel). 10 (10), 380.
Wojtukiewicz M.Z., Hempel D., Sierko E., Tucker S.C., Honn K.V. 2017. Antiplatelet agents for cancer treatment: A real perspective or just an echo from the past? Cancer Metastasis Rev. 36 (2), 305–329.
Гамбарян С.П., Шпакова, В.С. 2019. NO/цГМФ сигнальный путь в тромбоцитах. Росс. физиол. журн. им. И.М. Сеченова. 105 (8), 933–953.
Davies S.P., Reddy H., Caivano M., Cohen P. 2000. Specificity and mechanism of action of some commonly used protein kinase inhibitors. Biochem. J. 351 (Pt 1), 95–105.
Bain J., McLauchlan H., Elliott M., Cohen P. 2003. The specificities of protein kinase inhibitors: An update. Biochem. J. 371 (Pt 1), 199–204.
Rukoyatkina N., Walter U., Friebe A., Gambaryan S. 2011. Differentiation of cGMP-dependent and -independent nitric oxide effects on platelet apoptosis and reactive oxygen species production using platelets lacking soluble guanylyl cyclase. Thromb. Haemost. 106 (5), 922–933.
Emery A.C., Eiden M.V., Eiden L.E. 2013. A new site and mechanism of action for the widely used adenylate cyclase inhibitor SQ22,536. Mol. Pharmacol. 83 (1), 95–105.
Lies B., Groneberg D., Gambaryan S., Friebe A. 2013. Lack of effect of ODQ does not exclude cGMP signalling via NO-sensitive guanylyl cyclase. Br. J. Pharmacol. 170 (2), 317–327.
Liu E.Y.L., Xu M.L., Xia Y., Kong X., Wu Q., Dong T.T.X., Tsim K.W.K. 2019. Activation of G protein-coupled receptor 30 by flavonoids leads to expression of acetylcholinesterase in cultured PC12 cells. Chem. Biol. Interact. 306, 147–151.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


