Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 1, стр. 44-53
Этилметилгидроксипиридина сукцинат индуцирует противовоспалительную поляризацию микроглии в мозге стареющих крыс
Ю. И. Кирова a, *, Ф. М. Шакова a, Т. А. Воронина b
a Научно-исследовательский институт общей патологии и патофизиологии
125315 Москва, Россия
b Научно-исследовательский институт фармакологии имени В.В. Закусова
125315 Москва, Россия
* E-mail: bioenerg@mail.ru
Поступила в редакцию 13.04.2021
После доработки 06.06.2021
Принята к публикации 07.06.2021
- EDN: CAVMAJ
- DOI: 10.31857/S0233475521060049
Аннотация
Сукцинатный рецептор SUCNR1 (GPR91) конститутивно экспрессируется главными популяциями иммуноцитов. Сукцинат, как иммунометаболит (метабокин), осуществляет SUCNR1-зависимую модуляцию морфофункционального состояния иммунных клеток и является важным регулятором врожденного, адаптивного иммунитета и тканевого гомеостаза. Противоречивые интерпретации роли сукцинатной сигнализации в функционировании макрофагов, отсутствие исследований влияния SUCNR1 на морфофункциональную трансформацию микроглии, проблема низкой проницаемости гематоэнцефалического барьера (ГЭБ) для любых перспективных аналогов сукцината предопределили проведение настоящего исследования. Цель работы заключалась в оценке влияния этилметилгидроксипиридина сукцината на поляризацию микроглии при хроническом воспалении в стареющем мозге. Работа была выполнена на белых беспородных крысах-самцах в возрасте 3 (молодые), 6 (средневозрастные) и 18 месяцев (старые). В качестве формы сукцината, преодолевающей ГЭБ, был использован препарат мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат). Мексидол вводили внутрибрюшинно в дозе 100 мг/кг ежедневно на протяжении 3, 7, 14 дней. В образцах коры головного мозга методом иммуноблотинга выявляли поверхностные маркеры про- (M1) и противовоспалительного (M2) фенотипа микроглии (CD86 и CD206 соответственно), цитоплазматический маркер микроглии Iba1, а также провоспалительные цитокины IL-1β и TNF-α (экспрессируются M1-микроглией), иммуносупрессорный цитокин TGF-β1 и нейротрофин BDNF (экспрессируются M2-микроглией). Было показано, что экспрессия клеточных маркеров про- (CD86) и особенно противовоспалительной микроглии (СD206), снижается у старых крыс, однако уровень маркера Iba1, экспрессируемого независимо от фенотипа, остается неизменным во всех исследованных группах, что указывает на поддержание количественно равноценных популяций микроглии в разновозрастных группах. При этом уровень TNF-α и IL-1β увеличивался, а содержание TGF-β1 и BDNF было значимо ниже у старых крыс в сравнении с молодыми и средневозрастными. В целом полученные данные свидетельствуют о доминировании провоспалительного статуса микроглии в стареющем мозге. 14-дневный курс мексидола вызывал слабое снижение уровня CD86 у старых крыс и значимое увеличение на 45% содержания CD206 до уровня CD206 у 6-месячных крыс. Увеличение экспрессии CD206 происходило сопряженно с увеличением уровня TGF-β1 и BDNF на 60% и 35% соответственно, что свидетельствует о вовлечении сукцинат/SUCNR1-сигнализации в противовоспалительную поляризацию микроглии в стареющем мозге. Полученные данные развивают представления о церебральных эффектах сукцинат/SUCNR1-сигнализации и раскрывают новый компонент механизма нейропротекторного действия мексидола.
ВВЕДЕНИЕ
Сукцинатный рецептор SUCNR1 (GPR91, G-protein coupled receptor 91), открытый в 2004 г., экспрессируется в различных типах клеток организма и служит системой детекции экстремальных состояний (локального стресса), таких как ишемия, гипоксия, повреждение тканей, воспаление [1]. Лиганд рецептора янтарная кислота – интермедиат цикла трикарбоновых кислот (ЦТК) – в условиях физиологического покоя обнаруживается в крови и внеклеточной среде в низких концентрациях (2–20 мкМ) [2]. При гипоксии/ишемии продукция янтарной кислоты экспоненциально увеличивается в восстановительном (обратном) цикле Кребса в результате фумарат-редуктазной активности сукцинатдегидрогеназы (СДГ), что позволяет рассматривать сукцинат как сигнал опасности (алармин), инициирующий через активацию сукцинатного рецептора SUCNR1 адаптивные механизмы, направленные на снижение кислородного/энергетического дефицита, включая вазодилатацию, ангиогенез, пролиферацию эритроидных прогениторных клеток, повышение артериального давления, стимуляцию сердечной деятельности [3, 4].
Исследования минувшего пятилетия раскрыли иммуномодулирующую роль янтарной кислоты. Было показано, что сукцинатный рецептор конститутивно экспрессируется главными популяциями иммуноцитов (лимфоциты, моноциты, макрофаги, дендритные клетки), а сигнальная система сукцинат/SUCNR1 является важным регулятором врожденного [5], адаптивного иммунитета [6] и тканевого гомеостаза [7].
Одним из нерешенных вопросов текущего этапа изучения иммуномодулирующей активности янтарной кислоты остается ее роль в воспалительной реакции. Некоторые исследования продемонстрировали провоспалительную природу сукцината и его участие в развитии хронического нерегулируемого воспаления. Согласно этому представлению провоспалительные стимулы инициируют производство и высвобождение сукцината из цитотоксических (воспалительных) макрофагов, после чего внеклеточный сукцинат стимулирует в SUCNR1-экспрессирующих мононуклеарных фагоцитах продукцию IL-1β, поддерживая хроническое воспалительное состояние через аутокринный и паракринный механизмы [8, 9]. Однако недавние исследования подтвердили ключевую роль оси сукцинат/SUCNR1 в активации противовоспалительных механизмов. Было показано, что SUCNR1–/– макрофаги демонстрируют более выраженную провоспалительную поляризацию (М1-фенотип) в сравнении с контролем в ответ на стимуляцию липополисахаридом [10], SUСNR1-экспрессирующие нервные стволовые клетки под действием внеклеточного сукцината оказывают противовоспалительные эффекты [11], активация SUCNR1 макрофагов мышей индуцирует преобладающий противовоспалительный М2-фенотип [12].
В настоящее время внеклеточный сукцинат определяют как метабокин (иммунометаболит), способный оказывать рецептор-опосредованное влияние на метаболизм, морфологию и функции иммунных клеток [13]. В целом накопленные данные свидетельствуют о том, что сукцинат, производимый и высвобождаемый провоспалительными макрофагами, может активировать SUCNR1 на мононуклеарных фагоцитах и формировать как провоспалительные, так и противовоспалительные фенотипы [10]. Противоречивые интерпретации роли сукцинатной сигнализации в функционировании макрофагов, отсутствие исследований влияния SUCNR1 на морфофункциональную трансформацию резидентных макрофагов (микроглия) центральной нервной системы (ЦНС), проблема низкой проницаемости гематоэнцефалического барьера (ГЭБ) для любых перспективных аналогов сукцината [10] предопределили проведение настоящего исследования.
В работе в качестве формы сукцината, способной преодолевать ГЭБ, был использован отечественный препарат мексидол (этилметилгидроксипиридина сукцинат), который в настоящее время широко применяется в клинической и амбулаторной практике для лечения различных заболеваний, связанных с синдромами ишемии и гипоксии различного генеза, в том числе патологией мозга и сердечно-сосудистой системы, включая инсульты и возрастные нейродегенеративные болезни. Широкий спектр эффектов мексидола (энерготропный, антигипоксический, антиоксидантный) определяется его базисным политаргетным механизмом действия и мультимодальными свойствами, реализуемыми SUCNR1-опосредованно и SUCNR1-независимо [14–16]. Мексидол гидролизуется до сукцинат-аниона и этилметилгидроксипиридинового (ЭМГП) катиона, преодолевает ГЭБ, достигает наибольшего содержания в коре головного мозга, выявляется в цитозольной и митохондриальной фракциях, окисляется в митохондриях, реализуя антигипоксическое действие. Пиридиновый цикл ЭМГП облегчает транспорт сукцината через мембраны, повышает проницаемость ГЭБ для мексидола, оказывает антиоксидантное действие [17, 18]. Мексидол улучшает энергетический статус клетки [19], повышает активность Se-зависимой глутатионпероксидазы, снижает активность индуцибельной NO-синтазы [16], уменьшает глутаматную эксайтотоксичность [20]. Установлено, что мексидол оптимизирует процессы обучения и памяти, нарушенные у старых мышей, улучшая как обучение, так и хранение и воспроизведение информации, и увеличивает продолжительность жизни животных [21, 22].
Ранее нами было показано [23], что курсовое введение мексидола аутбредным крысам-самцам молодого и старческого возраста сопровождается дозозависимой индукцией в коре головного мозга (КГМ) животных сукцинатного рецептора SUCNR1 и белков-маркеров биогенеза митохондрий: транскрипционного коактиватора PGC-1α, транскрипционных факторов NRF1, TFAM, каталитических субъединиц дыхательных ферментов (NDUFV2, SDHA, cyt b, COX2) и ATP-синтазы (ATP5A). Полученные данные свидетельствуют о способности мексидола индуцировать церебральный митохондриогенез и устранять митохондриальную дисфункцию у молодых и старых животных и, таким образом, оказывать влияние на одно из ключевых патогенетических звеньев развития нарушений при старении и нейродегенеративных заболеваниях. В развитии сукцинат/SUCNR1-зависимой индукции митохондриальных ферментов в КГМ нельзя исключать потенцирующие эффекты других сигнальных систем, в частности, SUCNR1-опосредованное формирование нейропротекторного репаративного фенотипа микроглии (М2-поляризация) и M2-зависимую секрецию ростовых и нейротрофических факторов, активирующих митохондриогенез [7].
Противовоспалительные эффекты мексидола в аспекте регуляторного влияния сигнальной системы сукцинат/SUCNR1 на иммунные и воспалительные реакции ранее не исследовались.
Цель работы заключалась в оценке влияния этилметилгидроксипиридина сукцината на поляризацию микроглии при хроническом воспалении в стареющем мозге.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было выполнено на белых беспородных крысах-самцах в возрасте 3, 6 и 18 месяцев (молодые, средневозрастные, старые крысы; n = 90), выращенных в стандартных условиях вивария ФГБНУ “НИИ общей патологии и патофизиологии” при естественном чередовании суточной освещенности, свободном доступе к пище и воде. Эксперименты проводили в соответствии с Национальным стандартом РФ ГОСТ Р-53 434-2009 “Принципы надлежащей лабораторной практики”, Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях. Протоколы экспериментов были утверждены этическим комитетом ФГБНУ “НИИОПП”.
Мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат) использовали в инъекционной форме (ООО “НПК “ФАРМАСОФТ”, 50 мг/мл) для внутрибрюшинного (в/б) введения в дозе 100 мг/кг ежедневно в течение 3, 7, 14 дней. Для каждого анализируемого периода курса (3, 7, 14-й день) и для каждого возраста (3, 6, 18 месяцев) были сформированы группы контроля (курс ежедневных в/б инъекций изотонического раствора (NaCl 0.9%) в соответствии со схемой введения мексидола; 9 групп, в каждой n = 4) и опытные группы (9 групп, в каждой n = 6). Забой животных осуществляли декапитацией под эфирным наркозом через сутки после заключительной инъекции. Непосредственно после декапитации КГМ отделяли на льду, замораживали и хранили в жидком азоте.
В лизатах КГМ методом иммуноблотинга выявляли поверхностные маркеры про- (M1) и противовоспалительного (M2) фенотипа микроглии (CD86, T‑lymphocyte activation antigen; CD206, macrophage mannose receptor 1 соответственно), цитоплазматический маркер микроглии/макрофагов Iba1 (ionized calcium-binding adapter molecule 1), а также провоспалительные интерлейкины TNF-α (tumor necrosis factor alpha) и IL-1β (interleukin 1 beta) (экспрессируются M1-микроглией), иммуносупрессорный цитокин TGF-β1 (transforming growth factor beta) и нейротрофин BDNF (brain-derived neurotrophic factor) (экспрессируются M2-микроглией) [24].
Замороженные образцы КГМ растирали в жидком азоте до порошкообразного состояния. Навески массой 100 мг лизировали на льду в течение 30 мин в охлажденном до 2°С лизис-буфере (в соотношении 1V ткань : 6V буфер; 50 мМ HEPES, pH 7.6, 150 мМ NaCl, 2 мМ EGTA, 1% тритон X-100, 10% глицерин, 1 мМ дитиотреитол, 1 мМ Na3VO4, 1 мМ AEBSF, 60 мкг/мл апротинин, 10 мкг/мл леупептин, 1 мкг/мл пепстатин A) (Sigma-Aldrich, США) [25]. После центрифугирования (30 мин, 14 000 g, 4°C) супернатант (лизат КГМ без ядерной фракции), содержащий искомые белки, смешивали с загрузочным буфером (4× Laemmli Sample Buffer), инкубировали 5 мин при 95°С и хранили при –80°C. Концентрацию общего белка в пробах определяли спектрофотометрически по методу Бредфорда. Белки лизата КГМ разделяли в 10% полиакриламидном геле, переносили на нитроцеллюлозную мембрану электроэлюцией. Мембрану инкубировали с первичными моноклональными антителами (разведение 1 : 500, 14 ч, 4°С; Santa Cruz Biotechnology Inc., США) против CD86 (sc-28347), CD206 (sc-58986), Iba1 (sc-32725), BDNF (sc-65514), SDHA (sc-166909); первичными поликлональными антителами (разведение 1 : 500, 14 ч, 4°С; Santa Cruz Biotechnology Inc., США; Abcam plc, Великобритания) против IL-1β (sc-1252), TNF-α (sc-1349), TGF-β1 (ab-92486), SUCNR1/GPR91 (ab-41505); вторичными антителами (разведение 1 : 5000, 1 ч, 4°С), коньюгированными с пероксидазой хрена (anti-mouse sc-516102, anti-goat sc-2768, anti-rabbit ab-205718). В качестве контроля использовали антитела к актину (sc-376421). Детектирование белков осуществляли в реакции с ECL-реагентами (Pierce Biotechnology, США) на пленку фирмы Kodak с последующей денситометрией в программе Adobe Photoshop 7.0 (Adobe Systems, США). О содержании искомых белков судили по плотности окрашивания полосы связывания антител с белком. Результат выражали в относительных денситометрических единицах (ОДЕ).
Статистический анализ данных проводили с помощью программы Statistica 10 (StatSoft Inc., США) с использованием непараметрического рангового U-критерия Уилкоксона–Манна–Уитни. Различия между сравниваемыми группами считали статистически достоверными при p < < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В исследовании была выполнена оценка уровня экспрессии белков-маркеров провоспалительного (цитотоксического) М1-фенотипа микроглии и противовоспалительного (регенеративного) М2-фенотипа. М1-трансформация микроглии развивается в ответ на воздействие бактериальных и вирусных агентов, молекул паттерна клеточного повреждения (damage-associated molecular pattern, DAMP), интерферонов, гипоксии/ишемии и характеризуется округлой формой, утолщенными короткими отростками, высокой пролиферативной и миграционной активностью, продукцией провоспалительных цитокинов и хемокинов, матриксных металлопротеиназ, цитотоксичных активных форм кислорода и азота. М1-микроглия выполняет микробицидную, антигенпредставляющую, иммуностимулирующую функции [24, 26, 27]. М2-микроглия формируется в ответ на воздействие глюкокортикоидов, противовоспалительных цитокинов, некоторых метаболитов (аденозин), характеризуется крупными размерами, амебоидной формой, высокой фагоцитарной активностью, секрецией ростовых факторов, противовоспалительных цитокинов, нейротрофинов. М2-микроглия подавляет воспалительную реакцию, активирует механизмы репарации/ регенерации [24, 26, 27]. Концепция полярных состояний (М1/М2) микроглии (макрофагов) подверглась в последние годы существенному пересмотру. Согласно текущим представлениям в условиях in vivo мононуклеарные фагоциты представлены в виде промежуточных (смешанных) состояний активации, образующих широкий вариативный спектр между крайними фенотипами поляризации М1/М2 и обеспечивающих высокоэффективную координацию воспалительных/репаративных ответов в зависимости от изменения условий и стимулов [27, 28].
Оценка базового уровня экспрессии поверхностных маркеров, специфически продуцируемых провоспалительным (CD86) и противовоспалительным (CD206) фенотипом микроглии, показала, что содержание CD86 в КГМ снижалось у старых крыс на 20% в сравнении с 3- и 6-месячными крысами, в то время как содержание CD206 прогрессивно снижалось с увеличением возраста животных: на 25% в группе 6-месячных крыс и на 55% в группе старых крыс в сравнении с молодыми 3-месячными крысами (рис. 1а, 1б, 2а, 2б). Снижение экспрессии поверхностных рецепторов является типичной особенностью стареющей (дистрофической) микроглии, также как уменьшение размеров микроглиоцитов, количества отростков и их разветвлений [29].
Рис. 1.
Динамика экспрессии поверхностных маркеров провоспалительного (CD86, а) и противовоспалительного/регенеративного (CD206, б) фенотипа микроглии, воспалительных цитокинов (TNF-α, в; IL-1β, д), трансформирующего фактора роста (TGF-β1, г), нейротрофического фактора мозга (BDNF, е), сукцинатного рецептора (SUCNR1, ж) и каталитической субъединицы сукцинатдегидрогеназы (SDHA, з) в коре головного мозга крыс в возрасте 3, 6 и 18 месяцев на протяжении 14-дневного курса мексидола (100 мг/кг; в/б; ежедневные инъекции). Показаны результаты денситометрического анализа иммуноблотов. ОДЕ – относительные денситометрические единицы. △ – данные отличаются от группы молодых (3-месячных) крыс (p < 0.01) в соответствующем временнóм периоде; ▲ – данные отличаются от группы средневозрастных (6-месячных) крыс (p < 0.01) в соответствующем временнóм периоде; * – данные отличаются от контроля внутри возрастной группы (p < 0.01). CD86 – T‑lymphocyte activation antigen, CD206 – macrophage mannose receptor 1, TNF-α – tumor necrosis factor alpha, TGF-β1 – transforming growth factor beta 1, IL-1β - interleukin 1 beta, BDNF – brain-derived neurotrophic factor, SUCNR1 – succinate receptor 1, SDHA – succinate dehydrogenase subunit A.
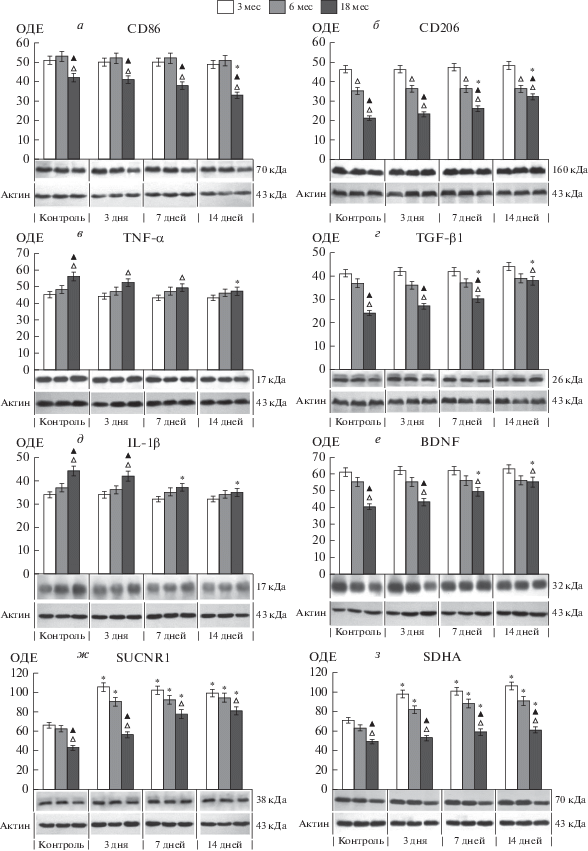
Несмотря на возрастзависимое снижение уровня поверхностных маркеров про- и, особенно, противовоспалительного фенотипов микроглии, содержание цитоплазматического микроглиального маркера Iba1, экспрессируемого независимо от фенотипа, оставалось неизменным во всех исследованных группах (рис. 2и), что косвенно указывает на поддержание количественно равноценных популяций микроглии в разновозрастных группах.
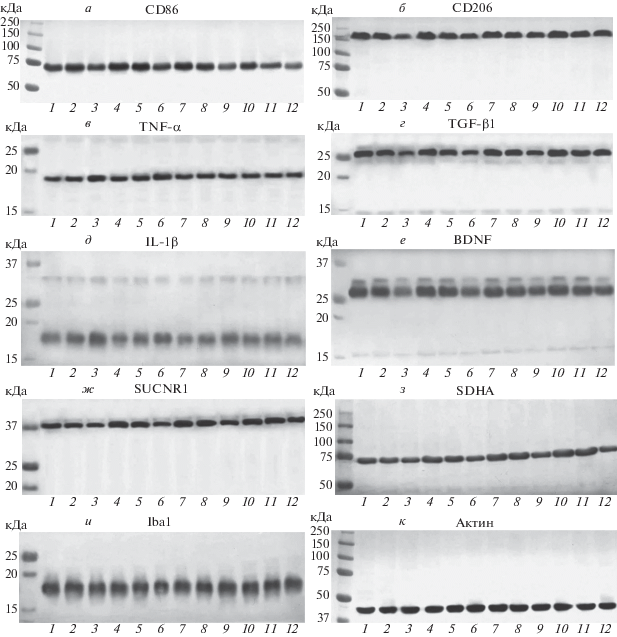
Рис. 2.
Фотографии Rg-пленок, совмещенных с нитроцеллюлозной мембраной (предокрашенный маркер молекулярных масс белков, кДа), демонстрируют результаты хемолюминесцентной детекции белков-маркеров микроглиальных фенотипов в коре головного мозга крыс в возрасте 3, 6 и 18 месяцев на протяжении 14-дневного курса мексидола (100 мг/кг; в/б; ежедневные инъекции). Показаны репрезентативные иммуноблоты лизатов КГМ молодых (1, 4, 7, 10), средневозрастных (2, 5, 8, 11) и старых (3, 6, 9, 12) крыс в контроле и через 3, 7, 14 дней введения мексидола соответственно. Поверхностные маркеры провоспалительного (CD86, а) и противовоспалительного/регенеративного (CD206, б) фенотипа микроглии, воспалительные цитокины (TNF-α, в; IL-1β, д), трансформирующий фактор роста (TGF-β1, г), нейротрофический фактор мозга (BDNF, е), сукцинатный рецептор (SUCNR1, ж), каталитическая субъединица сукцинатдегидрогеназы (SDHA, з), цитоплазматический маркер микроглии (Iba1, и), актин (к).
Содержание провоспалительных цитокинов TNF-α и IL-1β в КГМ увеличивалось на 20% в группе старых животных в сравнении с молодыми и средневозрастными (рис. 1в, 1д, 2в, 2д). Уровень экспрессии BDNF снижался на 30%, а TGF-β1 – на 40% у 18-месячных крыс в сравнении с молодыми и средневозрастными (рис. 1г, 1е, 2г, 2е).
В целом выявленное значительное снижение содержания маркеров противовоспалительной поляризации микроглии у старых крыс свидетельствует о доминировании провоспалительного статуса микроглии в стареющем мозге. Факт провоспалительной трансформации стареющей микроглии хорошо известен и, предположительно, связан с накоплением повреждений ДНК в долгоживущих микроглиоцитах нервной ткани [29].
Курсовое введение мексидола (100 мг/кг, в/б, 14 дней, ежедневно) сопровождалось слабым снижением (на 15%) уровня экспрессии CD86 и значимым увеличением (на 45%) уровня CD206 в КГМ старых животных, который достигал содержания CD206 у средневозрастных крыс (рис. 1а, 1б, 2а, 2б).
14-дневный курс мексидола вызывал слабое снижение (на 15%) уровня провоспалительных цитокинов TNF-α и IL-1β (рис. 1в, 1д, 2в, 2д), в то время как содержание TGF-β1 и BDNF (маркеры противовоспалительного фенотипа) увеличивалось на 60 и 35% соответственно (рис. 1г, 1е, 2г, 2е).
Полученные результаты свидетельствуют о способности сукцинатсодержащего препарата мексидола индуцировать противовоспалительную поляризацию микроглии в условиях хронического умеренного воспаления в стареющем мозге. Морфофункциональные изменения стареющей микроглии остаются малоизученными, также как причины формирования устойчивого к фармакологической коррекции М1-подобного провоспалительного фенотипа [29]. В нашем исследовании показано, что уровень экспрессии провоспалительных маркеров микроглии слабо увеличивается при старении, в то время как уровень маркеров противовоспалительного М2-фенотипа микроглии (CD206, TGF-β1, BDNF) снижался значительно. Таким образом, одной из вероятных причин развития асептического нейровоспаления и формирования провоспалительного состояния микроглии в стареющем мозге может быть возрастзависимое снижение уровня важнейших регуляторов противовоспалительного ответа, таких как глюкокортикоиды, половые и тиреоидные гормоны, подавляющие активность главного провоспалительного фактора транскрипции NF-kB [30].
Наблюдаемый эффект противовоспалительной поляризации микроглии под действием ЭМГП сукцината (мексидола) могут быть опосредованы сукцинатным рецептором SUCNR1, конститутивно экспрессируемым микроглией [7]. В нашей предшествующей работе [23] было показано, что курсовое введение мексидола в дозах 40 и 100 мг/кг вызывало в КГМ молодых, средневозрастных и старых крыс дозозависимое увеличение содержания фактора роста эндотелия сосудов (vascular endothelial growth factor, VEGF), что является хорошо известным эффектом активации SUCNR1 в мозге [31]. Изолированное введение ЭМГП в количествах, эквивалентых его содержанию в применяемых дозах мексидола, не влияло на экспрессию VEGF, что свидетельствует о вовлеченности сукцината и сукцинат/ SUCNR1-сигнализации в обнаруженный ангиогенный эффект мексидола.
В настоящем исследовании влияния курсового применения мексидола на поляризацию микроглии обращает внимание отсутствие заметных эффектов у молодых и средневозрастных животных. Одной из возможных причин ограничения регуляторного влияния сукцинат/SUCNR1-сигнализации на формирование противовоспалительного фенотипа микроглии у молодых животных может быть высокая экспрессия/активность митохондриальной СДГ, осуществляющей окисление янтарной кислоты и, тем самым, ограничивающей эффективность сукцинатной сигнализации. В нашем исследовании у молодых и средневозрастных крыс уровень экспрессии каталитической субъединицы СДГ (SDHA, рис. 1з, 2з) превосходил ее содержание у старых животных на 30%. Более того, у молодых и средневозрастных крыс курсовое введение мексидола сопровождалось быстрой и значительной индукцией SDHA (в 1.5–1.7 раз), что происходило сопряженно с увеличением содержания сукцинатного рецептора SUCNR1 в КГМ (рис. 1ж, 2ж). У старых крыс уровень SUCNR1 был снижен на 40% в сравнении с молодыми и взрослыми крысами, а увеличение содержания SUCNR1 до его уровня у средневозрастных крыс и слабая индукция SDHA наблюдались только после продолжительных (7- и 14-дневные) курсов мексидола (рис. 1ж, 1з, 2ж, 2з).
Поскольку митохондрии являются главным источником сукцината старческая супрессия митохондриогенеза и редукция митохондриального аппарата при старении [32] сопровождаются снижением продукции сукцината, уровня экспрессии SUCNR1, ослаблением межклеточной сукцинатной сигнализации между нейронами, астроцитами и микроглией, подавлением SUCNR1-зависимых адаптивных механизмов, что в целом может потенцировать провоспалительную поляризацию стареющей микроглии.
При обсуждении механизмов выявленной противовоспалительной активности сукцинатсодержащего препарата мексидола необходимо подчеркнуть, что регуляторные влияния внеклеточного сукцината и внутриклеточного сукцината могут оказывать противоположные эффекты на развитие воспалительной реакции [2, 3]. В ЦНС внеклеточный сукцинат активирует специфический рецептор SUCNR1 на поверхности нейронов, астроцитов и микроглиоцитов (резидентные иммунные клетки ЦНС) [7, 11, 13]. SUCNR1 принадлежит к классу рецепторов, сопряженных с G-белком (G-protein-coupled receptors, GPCRs). В гетеротримерных G-белках (Gαβγ) Gα-субъединица определяет специфичность связывания с рецептором и внутриклеточным эффектором. В настоящее время SUCNR1 ЦНС рассматривают как Gαq-, Gαi-сопряженный рецептор [33]. Активация Gαi-белка связана с ингибированием аденилатциклазного сигнального пути, инициацией сигнальных каскадов митоген-активируемых протеинкиназ (ERK1/2), контролирующих пролиферацию, дифференцировку, миграцию клеток, продукцию провоспалительных цитокинов TNF-α, IL-1β [7], что предопределило формирование представления о сукцинате как усилителе (алармин) воспалительной реакции. Однако прямая стимуляция дендритных клеток сукцинатом не вызывает индукцию провоспалительных цитокинов [2]. Противоспалительная/регенеративная активность миелоидных клеток считается опосредованной активацией Gαq-белка и развитием внутриклеточного кальциевого каскада. Примерами таких Gαq-сопряженных рецепторов являются лактатный и пуриновый P2Y1-рецепторы, контролирующие противовоспалительную поляризацию миелоидных клеток [33]. Хорошо известная для сукцинатного рецептора мобилизация внутриклеточного кальция, связываемая с активацией Gαq-белка, объясняется также активностью гетеродимера Gβγ Gi-белка. Gβγ-зависимая активация фосфолипазы С (PLCβ) и последующая мобилизация внутриклеточного кальция [33] активирует Ca2+/ кальмодулин (СаМ)-зависимые протеинкиназы, которые фосфорилируют/активируют транскрипционный фактор CREB, контролирующий экспрессию генов противовоспалительных факторов, таких как PGC-1α, IL-10 [34, 35]. Транскрипционный коактиватор PGC-1α необходим в развитии регенеративной/противовоспалительной М2-поляризации макрофагов, блокирует активацию главного провоспалительного фактора транскрипции NF-kB [36], контролирующего экспрессию провоспалительных цитокинов (TNF-α, IL-1β, IL-6), и активирует ключевые противовоспалительные транскрипционные факторы PPARs и ERRs, ответственные за усиление процессов митохондриогенеза и окислительного фосфорилирования, характеризующих М2-фенотип микроглии/макрофагов [9, 24]. Активатором PPAR, по данным хемореактомного анализа, также может служить этилметилгидроксипиридин мексидола [37].
В настоящее время определяющая роль регуляторной оси сукцинат/SUCNR1 в ограничении воспалительной реакции находит все больше подтверждений, а состояние устойчивого воспаления связывают с недостаточной экспрессией рецептора SUCNR1 иммунными клетками и/или дефектами структуры SUCNR1 [12].
Важно отметить, что внутриклеточный сукцинат вовлекается в провоспалительную поляризацию микроглии/макрофагов, что было детально изучено ранее и осуществляется по SUCNR1-независимому механизму. Провоспалительная поляризация макрофагов может быть вызвана гипоксией/ишемией, провоспалительными сигналами (патогены, лиганды TLRs, воспалительные цитокины, интерфероны), связана с активацией и стабилизацией NF-kB, HIF-1α, инициирующих экспрессию воспалительных цитокинов и прооксидантных ферментов, а также блокаду ЦТК на уровне изоцитратдегидрогеназы и сукцинатдегидрогеназы, что сопровождается внутриклеточной аккумуляцией сукцината. Сукцинат ингибирует пролилгидроксилазы, инициирующие деградацию HIF-1α и деактивацию NF-kB, и, тем самым, усиливает воспалительную реакцию [2, 9, 24, 26].
Таким образом, сукцинат может играть двойную роль в воспалении: как активатор на ранних стадиях воспаления (внутриклеточный сукцинат, SUCNR1-независимый клеточно-автономный механизм) и на более поздних стадиях как фактор ограничения воспаления (внеклеточный сукцинат, механизм SUCNR1-зависимого межклеточного взаимодействия) [2].
ЗАКЛЮЧЕНИЕ
Впервые исследовано влияние этилметилгидроксипиридина сукцината (мексидола) на поляризацию микроглии в стареющем мозге. 14-дневное курсовое в/б введение препарата (100 мг/кг) вызывало увеличение уровня экспрессии маркеров противовоспалительного М2-фенотипа микроглии в коре головного мозга старых крыс, что свидетельствует о вовлечении сукцинат/ SUCNR1-сигнализации в М2-противовоспалительную поляризацию резидентных иммунных клеток при хроническом умеренном нейровоспалении в стареющем мозге. Данные развивают представления о церебральных эффектах сигнальной системы сукцинат/SUCNR1 и раскрывают механизм противовоспалительной активности мексидола.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Источники финансирования. Работа выполнялась в рамках программы исследований “Патогенетические механизмы нейродегенеративных заболеваний и разработка их комплексной терапии” № 0520-2019-0029, запланированных в ФГБНУ “НИИ Общей патологии и патофизиологии”.
Соответствие принципам этики. Все применимые международные, национальные и институциональные принципы ухода и использования животных были соблюдены.
Список литературы
He W., Miao F.J.P., Lin D.C.H., Schwandner R.T., Wang Z., Gao J., Chen J.L., Tian H., Ling L. 2004. Citric acid cycle intermediates as ligands for orphan G-protein-coupled receptors. Nature. 429, 188–193.
Grimolizzi F., Arranz L. 2018. Multiple faces of succinate beyond metabolism in blood. Haematologica. 103 (10), 1586–1592.
Guo Y., Cho S.W., Saxena D., Li X. 2020. Multifaceted actions of succinate as a signaling transmitter vary with its cellular locations. Endocrinol. Metab. 35, 36–43.
Lukyanova L.D., Kirova Y.I. 2015. Mitochondria-controlled signalling mechanisms of brain protection in hypoxia. Front. Neurosci. 9, 1–13.
Rubic T., Lametschwandtner G., Jost S., Hinteregger S., Kund J., Carballido-Perrig N., Schwärzler C., Junt T., Voshol H., Meingassner J.G., Mao X., Werner G., Rot A., Carballido J.M. 2008. Triggering the succinate receptor GPR91 on dendritic cells enhances immunity. Nat. Immunol. 9, 1261–1269.
Caielli S., Veiga D. T., Balasubramanian P., Athale S., Domic B., Murat E., Banchereau R., Xu Z., Chandra M., Chung C.-H., Walters L., Baisch J., Wright T., Punaro M., Lorien N., Stewart K., Fuller J., Ucar D., Ueno H., Zhou J., Banchereau J., Pascual V. 2019. A CD4+ T cell population expanded in lupus blood provides B cell help through interleukin-10 and succinate. Nat. Med. 25 (1), 75–81.
Krzak G., Willis C.M., Smith J.A., Pluchino S., Peruzzotti-Jametti L. 2021. Succinate receptor 1: An emerging regulator of myeloid cell function in inflammation. Trends Immunol. 42 (1), 45–58.
Littlewood-Evans A., Sarret S., Apfel V., Loesle P., Dawson J., Zhang J., Muller A., Tigani B., Kneuer R., Patel S., Valeaux S., Gommermann N., Rubic-Schneider T., Junt T., Carballido J.M. 2016. GPR91 senses extracellular succinate released from inflammatory macrophages and exacerbates rheumatoid arthritis. J. Exp. Med. 213 (9), 1655–1662.
Diskin C., Palsson-McDermott E.M. 2018. Metabolic modulation in macrophage effector function. Front. Immunol. 9, 270. https://doi.org/10.3389/fimmu.2018.00270
Harber K.J., de Goede K.E., Verberk S.G.S., Meinster E., de Vries H.E., van Weeghel M., de Winther M.P.J., Van den Bossche J. 2020. Succinate is an inflammation-induced immunoregulatory metabolite in macrophages. Metabolites. 10 (9), 372. https://doi.org/10.3390/metabo10090372
Peruzzotti-Jametti L., Bernstock J.D., Vicario N., Costa A.S.H., Kwok C.K., Leonardi T., Booty L.M., Bicci I., Balzarotti B., Volpe G., Mallucci G., Manferrari G., Donega M., Iraci N., Braga A., Hallenbeck J.M., Murphy M.P., Edenhofer F., Frezza C., Pluchino S. 2018. Macrophage-derived extracellular succinate licenses neural stem cells to suppress chronic neuroinflammation. Cell. Stem. Cell. 22 (3), 355–368.
Keiran N., Ceperuelo-Mallafre V., Calvo E., Hernandez-Alvarez M.I., Ejarque M., Nunez-Roa C., Horrillo D., Maymo-Masip E., Rodriguez M.M., Fradera R., de la Rosa J.V., Jorba R., Megia A., Zorzano A., Medina-Gomez G., Serena C., Castrillo A., Vendrell J., Fernandez-Veledo S. 2019. SUCNR1 controls an anti-inflammatory program in macrophages to regulate the metabolic response to obesity. Nat. Immunol. 20 (5), 581–592.
Rodriguez-Gomez J.A., Kavanagh E., Engskog-Vlachos P., Engskog M.K.R., Herrera A.J., Espinosa-Oliva A.M., Joseph B., Hajji N., Venero J.L., Burguillos M.A. 2020. Microglia: Agents of the CNS pro-inflammatory response. Cells. 9 (7), 1717.https://doi.org/10.3390/cells9071717
Воронина Т.А. 2009. Мексидол: основные нейропсихотропные эффекты и механизм действия. Фарматека. 180 (6), 1–4.
Воронина Т.А. 2012. Мексидол: спектр фармакологических эффектов. Журн. неврологии и психиатрии им. С.С. Корсакова. 112 (12), 86–90.
Дюмаев К.М., Воронина Т.А., Смирнов Л.Д. 1995. Антиоксиданты в профилактике и терапии патологий ЦНС. М.: Ин-та биомед. химии РАМН. 271 с.
Пожилова Е.В., Новиков В.Е., Новикова А.В. 2013. Фармакодинамика и клиническое применение препаратов на основе гидроксипиридина. Вестник Смоленской гос. мед. академии. 12 (3), 56–66.
Щулькин А.В., Якушева Е.Н., Черных И.В. 2014. Распределение мексидола в структурах головного мозга, его клеточных элементах и субклеточных фракциях. Журн. неврологии и психиатрии им. С.С. Корсакова. 114 (8), 169–172.
Лукьянова Л.Д. 2019. Сигнальные механизмы гипоксии. М.: РАН. 215 с.
Щулькин А.В. 2012. Влияние мексидола на развитие феномена эксайтотоксичности нейронов in vitro. Журн. неврологии и психиатрии им. С.С. Корсакова. 112 (2), 35–39.
Воронина Т.А., Кутепова О.А. 2003. Влияние антиоксиданта из класса 3-оксипиридина на функциональную активность центральной нервной системы мышей разных возрастных групп. Журн. высшей нервной деятельности им. И.П. Павлова. 38 (6), 1126–1131.
Воронина Т.А. 2020. Геропротективные эффекты этилметилгидроксипиридина сукцината в экспериментальном исследовании. Журн. неврологии и психиатрии им. С.С. Корсакова. 120 (4), 81–87.
Кирова Ю.И., Шакова Ф.М., Германова Э.Л., Романова Г.А., Воронина Т.А. 2020. Влияние Мексидола на церебральный митохондриогенез в молодом возрасте и при старении. Журн. неврологии и психиатрии им. С.С. Корсакова. 120 (1), 62–69.
Jiang C.T., Wu W.F., Deng Y.H., Ge J.W. 2020. Modulators of microglia activation and polarization in ischemic stroke. Mol. Med. Reports. 21 (5), 2006–2018.
Baghirova S., Hughes B.G., Hendzel M.J., Schulz R. 2015. Sequential fractionation and isolation of subcellular proteins from tissue or cultured cells. MethodsX. 2, 440–445.
Amici S.A., Dong J., Guerau-de-Arellano M. 2017. Molecular mechanisms modulating the phenotype of macrophages and microglia. Front. Immunol. 8, 1520. https://doi.org/10.3389/fimmu.2017.01520
Furman N.T., Gottlieb A., Prabhakara K.S., Bedi S., Caplan Henry W., Ruppert K.A., Srivastava A.K., Olson S.D., Cox Jr. C.S. 2020. High‑resolution and differential analysis of rat microglial markers in traumatic brain injury: Conventional flow cytometric and bioinformatics analysis. Sci. Report. 10, 11991–12005.
Jurga A.M., Paleczna M., Kuter K.Z. 2020. Overview of general and discriminating markers of differential microglia phenotypes. Front. Cell. Neurosci. 14, 198. https://doi.org/10.3389/fncel.2020.00198
Angelova D.M., Brown D.R. 2019. Microglia and the aging brain: Are senescent microglia the key to neurodegeneration? J. Neurochem. 151, 676–688.
Luo Y., Zheng S.G. 2016. Hall of fame among pro-inflammatory cytokines: interleukin-6 gene and its transcriptional regulation mechanisms. Front. Immunol. 7, 604. https://doi.org/10.3389/fimmu.2016.00604
Hamel D., Sanchez M., Duhamel F., Roy O., Honore J.-C., Noueihed B., Zhou T., Nadeau-Vallee M., Hou X., Lavoie J.-C., Mitchell G., Mamer O.A., Chemtob S. 2014. G-protein–coupled receptor 91 and succinate are key contributors in neonatal postcerebral hypoxia-ischemia recovery. Arterioscler. Thromb. Vasc. Biol. 34, 285–293.
Bratic A., Larsson N.-G. 2013. The role of mitochondria in aging. J. Clin. Invest. 123 (3), 951–957.
Gilissen J., Jouret F., Pirotte B., Hanson J. 2016. Insight into SUCNR1 (GPR91) structure and function. Pharmacol. Ther. 159, 56–65.
Greer P.L., Greenberg M.E. 2008. From synapse to nucleus: Calcium-dependent gene transcription in the control of synapse development and function. Neuron. 59 (6), 846–860.
Kitagawa K. 2007. CREB and cAMP response element-mediated gene expression in the ischemic brain. FEBS J. 274, 3210–3217.
Eisele P.S., Salatino S., Sobek J., Hottiger M.O., Handschin C. 2013. The peroxisome proliferator-activated receptor γ coactivator 1α/β (PGC-1) coactivators repress the transcriptional activity of NF-κB in skeletal muscle cells. J. Biol. Chem. 288 (4), 2246–2260.
Торшин И.Ю., Громова О.А., Сардарян И.С., Федотова Л.Э., Семенов В.А. 2016. Сравнительный хемореактомный анализ мексидола. Фармакокинетика и фармакодинамика. 4, 19–30.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


