Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 1, стр. 54-62
Присутствие азуленов на поверхности растительных клеток как тест на чувствительность к озону
В. В. Рощина a, *, А. В. Кучин a, А. Р. Куньев a, Г. А. Солтани b, Л. М. Хайбулаева a, Н. К. Призова a
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Пущино, Московская обл., Россия
b Сочинский национальный парк
354002 Сочи, Россия
* E-mail: roshchinavic@mail.ru
Поступила в редакцию 09.04.2021
После доработки 07.06.2021
Принята к публикации 08.06.2021
- EDN: HBXOXH
- DOI: 10.31857/S023347552201008X
Аннотация
Исследованы реакции на озон поверхностных клеток листьев и хвои пяти интродуцированных древесных видов дендрария Сочинского национального парка в хронической экспозиции в течение трех дней в общих дозах до 0.05 мкл/л. У секреторных структур серебристых листьев Eucalyptus cinerea F. Muell. ex. Benth в клетках наблюдались заметные изменения поглощения (выцветания) и автофлуоресценции. Голубая и серебристая хвоя видов Picea pungens Engelm. cv Argentea, Cedrus atlantica (Endl.) Manetti ex Carrière cv. Argentea, Pinus parviflora Siebold & Zucc. cv. Glauca и листья Acacia dealbata Link. практически не были чувствительны к озону. Показано, что поверхностные слои кутикулы и клеточной стенки этих растений включали азулены. Предполагается, что именно эти пигменты могут быть первичными мишенями для озона у данных видов, и их антиоксидантные свойства определяют низкую чувствительность для клеток к озону.
ВВЕДЕНИЕ
Растения чувствительны к тропосферным загрязнителям воздуха, например, озону. В субтропиках России эта проблема особенно актуальна. Урбанизированная среда крупных курортов, таких как Сочи, может производить высокие концентрации этого газа под влиянием выхлопов автотранспорта. Это значительно влияет на рост и развитие интродуцированных древесных видов. Ввиду этого актуально изучение клеточных механизмов их чувствительности и устойчивости к озону.
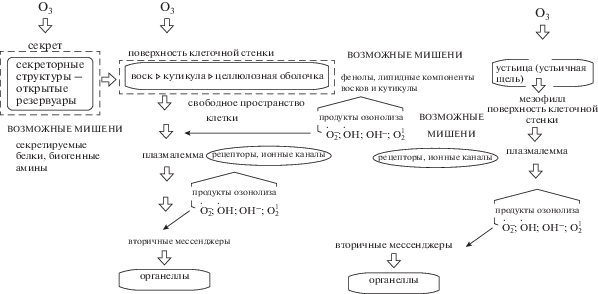
При анализе сложившихся представлений (рис. 1) нужно было установить малоисследованные пути транспорта озона в растение. До недавнего времени в литературе основным транспортным потоком О3 в растение считались устьица с открытой щелью [1–3] и не учитывался тот факт, что при жаркой погоде необходимость сохранения влаги приводит к их закрытию. Тогда именно вся поверхность растений с закрытыми устьицами чувствительна к изменениям концентрации тропосферного озона. В реальности эти возможности есть и при открытых устьицах, когда концентрация озона очень высока, а пропускная способность устьичной щели ограничена. Механизм действия озона (рис. 1) зависит главным образом от глубины проникновения в клетку через клеточную оболочку [4]. В этой ситуации воспринимают внешние сигналы компоненты поверхности – клеточная стенка и плазмалемма, a также сенсорами могут быть и секреты специализированных секреторных клеток (железы, волоски и др.). Недавно было установлено заметное повреждение таких клеток в кратковременном остром опыте и при хроническом воздействии озоном [5, 6]. Часто секреторные структуры поверхности растения представляют собой открытые или открывающиеся время от времени резервуары с секретом.
Секрет сложного состава может включать белки, амины, фенолы и другие соединения. Например, у эвкалипта пепельного Eucalyptus cinerea гистохимически обнаружены холинэстераза [7] и биогенные амины (гистамин и дофамин) [5, 7]. Ранее установлено ингибирующее влияние озона на этот фермент in vitro [8], который представляется мишенью для озона. Во всех случаях роль первичного сенсора и мишеней выполняют компоненты клеточной стенки и соединения свободного пространства клетки – апопласта, в первую очередь воспринимающие внешние сигналы [4]. Однако до сих пор не исследованы другие участники сенсорных реакций. Обычно рассматриваются образование активных форм кислорода и их первичное связывание с антиоксидантами поверхности (в основном фенолами клеточной стенки). Только после этого, часть несвязанного озона и образованных активных форм кислорода реагирует с плазмалеммой. Появившиеся на этом этапе активные формы кислорода – свободные радикалы, перекиси и синглетный кислород, а также остатки несвязанного озона могут действовать уже как внешние сигналы, которые передаются от плазмалеммы внутрь клетки через системы вторичных мессенджеров (ионов кальция, инозиттрифосфата и др.) [4].
При взаимодействии озона с клеткой первый этап контакта с поверхностью может определять устойчивость определенного вида растения к этому окислителю. У некоторых растений поверхность листьев и стеблей имеет голубой или серебристый цвет. Это не просто отражение воздухоносных участков. Среди таких видов подобную окраску имеют некоторые эвкалипты и хвойные растения. Относительная устойчивость эвкалиптов разных видов к озону была показана австралийскими исследователями [9]. У голубых и серебристых видов сосны Pinus parviflora, ели Picea pungens и других проростки в разной степени устойчивы к озону [10]. Голубой или серебристый цвет поверхностей указанных растений может быть связан с присутствием синих пигментов азуленов. Известно также, что листья эвкалипта Eucalyptus cinerea с серебристой поверхностью содержат голубой пигмент сесквитерпен, азулен [11]. До сих пор возможной роли азуленов в чувствительности к озону не уделялось внимания.
Целью нашей работы является исследование реакций на озон растительных клеток, на поверхности которых могут быть азулены.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты. В качестве объектов исследований c голубыми поверхностными секреторными структурами выбраны древесные виды, устойчивые к озону: листья эвкалипта пепельного Eucalyptus cinerea F.Muell. ex Benth (Myrtaceae), а также хвоя ели колючей Серебристой Picea pungens Engelm. cv. Argentea (Pinaceae), кедра атласского Серебристого Cedrus atlantica (Endl.) Manetti ex Carrière cv. Argentea (Pinaceae), сосны мелкоцветковой Голубой Pinus parviflora Siebold & Zucc. cv. Glauca (Pinaceae), собранных в 2019–2020 годах в дендрарии Сочинского национального парка г. Сочи и дендропарке “Южные культуры” Кавказского заповедника, Адлер.
Кроме того, использовались листья комнатных саженцев эвкалипта пепельного Eucalyptus cinerea F. Muell. ex Benth, на них мы оценивали эффекты озона на поверхностные секреторные структуры – железы.
Озонирование. Свежие листья растений на воздухе подвергались воздействию озоном 0.05 мкл/л, 5 ч в день в течение 3 дней. Озон производился генератором КПМЗ (Россия) [5, 6].
Спектральные методы. Поглощение и собственную флуоресценцию клеток измеряли непосредственно на предметных стеклах с помощью спектрофотометров Specord M-40 (Германия), Unicam Helios-epsilon (США), микроспектрофотометра/флуориметра МСФ-15 (ЛОМО, Россия), спектрофлуориметра Perkin-Elmer 350 MPF-44B (Великобритания) и лазер-сканирующего конфокального микроскопа Leica TCS SP5 (Германия). Фотографировали образцы с помощью люминесцентного микроскопа Leica DM 6000 B (Германия), вышеупомянутых конфокального микроскопа и микроспектрофотометра/флуориметра МСФ-15 с камерой Levenhuk М300 Base (Россия). Спектры поглощения и флуоресценции экстрактов 100% ацетоном из клеток (1 : 10 вес/объем в течение от 5 мин до 1 ч и более) в 0.5 см кюветах или на бумажных хроматограммах регистрировали с помощью вышеупомянутых спектрофотометров и спектрофлуориметра.
Хроматография. Для выявления азуленов экстракты хроматографировали на бумаге Whatman № 1 без или после пропитки вазелиновым маслом или на тонкослойных пластинках силикагеля Silufol, как описано ранее для пыльцы ряда семенных растений и микроспор хвоща [12, 13]. Затем регистрировали их спектры поглощения и флуоресценции, чтобы сравнить с данными, полученными на интактных клетках.
Концентрацию азуленов (А) оценивали в растворах этанола или ацетона по формуле: A = = D580/εl, где D580 – оптическая плотность при 580 нм, ε – коэффициент молярной экстинкции 328 М–1 см–1, l – толщина слоя жидкости в кювете, см.
В работе использовали азулен (Fluka, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Моделями для работы были выбраны растения, листья или хвоя которых содержат растворимые в маслах азулены или где предполагается их присутствие. Это представляло интерес, поскольку липофильные секреторные структуры (масляные железы и смоляные ходы) специально как сенсоры озона не изучены. Наши исследования включали микроскопический и спектральный анализ поверхности листа или хвои с секреторными структурами до и после экспозиции с озоном в более естественных дозах 0.05 мкл/л по 5 ч в день в течение 3 дней. Основное внимание уделялось их спектральным характеристикам.
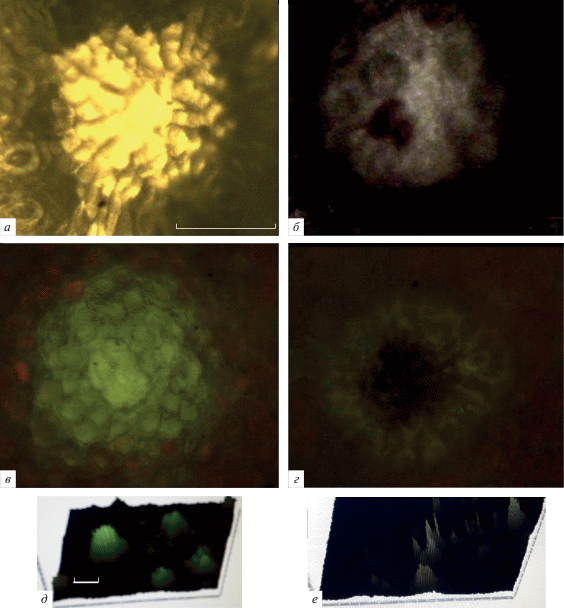
Спектральные характеристики секреторных структур. Среди исследованных видов у высушенных на воздухе целых листьев эвкалипта пепельного Eucalyptus cinerea с поверхностными секреторными структурами ранее [5, 6] наблюдали выцветание оранжевых, желтых и красных масляных желез после экспозиции с озоном как в остром опыте в общей дозе 0.7 мкл/л за 10 мин, так и хроническом (доза 0.05 мкл/л за 5 ч в день за 3 дня). В обоих вариантах за время экспозиции заметно снизился уровень пигментации клеток при окислении [7]. В настоящей работе мы рассмотрели изменения спектральных характеристик свежих листьев и высушенной на воздухе хвои. Наиболее выразительные данные на секреторных структурах получены для эвкалипта. На рис. 2б показано, что зеленовато-желтый цвет железы (рис. 2а) эвкалипта почти исчезает после обработки озоном. Сложная многоклеточная структура при этом открывается, внутри виден красный секрет. Железа была способна флуоресцировать в зеленой области спектра под люминесцентным микроскопом (рис. 2в), в основном при возбуждении светом в области 460–480 нм [6]. Озон также снижает уровень ее флуоресценции. Объемная картина (3D) поверхности листа, воспринимающей озон, показывает резкое снижение свечения желез, выступающих как антенны над поверхностью (рис. 2д, 2е). Наблюдалось также снижение поглощения листа с железами при 580 нм, области характерной для спектра поглощения азулена, и в области хлорофилла (666 нм). Но некоторым азуленам свойственны максимумы и в области, относящейся к хлорофиллу [14]. Отметим, что озон вызывает снижение поглощения при 580 и 666 нм не только самой железы, но и несекреторных клеток, которые ответственны за серебристо-голубоватую окраску листа в целом. Автофлуоресценция этой секреторной структуры также снижается под действием озона.
Рис. 2.
Вид секреторной структуры – железы эвкалипта пепельного Eucalyptus cinerea до (а, в) и после воздействия озоном 0.05 мкл/л (б, г) – под люминесцентным микроскопом. а, б – проходящий свет, в, г – флуоресценция при возбуждении светом 460–480 нм; д, е – 3D-изображение флуоресцирующей поверхности без и с обработкой озоном по программе камеры Levenhuk. Шкала – 100 мкм.
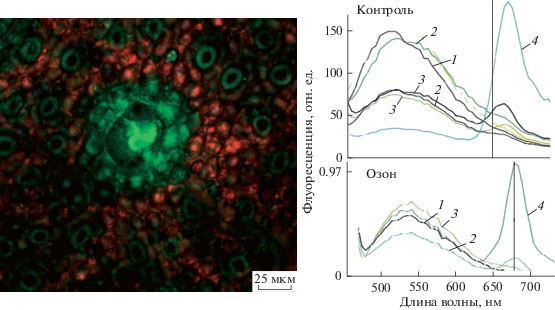
В спектре флуоресценции (рис. 3), полученном с помощью лазер-сканирующего конфокального микроскопа, железа (1 и 2) и связанный с ней масляный проток (3) флуоресцируют с максимумами 535–540 нм. Отметим, что в середине секреторной структуры (1) виден максимум 515 нм и плечо 535 нм, а в несекреторных клетках (4) преобладает хлорофилл с максимумом 680 нм. Под действием озона уровень эмиссии сильно снижается: более чем на 100 отн. ед., что видно изначально по спектрам на рис. 3. Отметим возможный вклад в наблюдаемое свечение для известных соединений. Максимумы флуоресценции в голубой или зелено-желтой области спектра могут быть свойственны и некоторым фенолам, например, флавоноидам [5]. Ранее нами показано [6], что у листьев изучаемого вида эвкалипта в спектре эмиссии есть свойственные фенолам пики при 450 и 470 нм, которые не исчезают даже после высокой дозы озона и легко обнаруживаются в водных смывах. Возможная роль фенолов в защите поверхности от повреждающего действия озона обсуждалась в указанной работе. Но в данном исследовании мы сфокусировали внимание на терпенах, которыми обогащен эвкалипт. Они флуоресцируют в области 400–440 нм. Среди таких соединений известны голубые пигменты – азулены, найденные у эвкалипта [11].
Рис. 3.
Конфокальная микроскопия поверхности листа эвкалипта пепельного. Слева –флуоресцирующая железка листа, сумма оптических срезов через 2 мкм в трех каналах. Справа – спектры автофлуоресценции до и после воздействия на клетки озоном в общей дозе 0.05 мкл/л. Возбуждение флуоресценции – лазер 458 нм. 1 и 2 – середина и обкладка железы, 3 – проток с секретом, 4 – клетки вне железы.
В отличие от эвкалипта, в клетках хвои использованных серебристых и голубых видов внешних изменений под действием озона не было выявлено, как и достоверных изменений в спектрах поглощения и флуоресценции. Смоляные ходы были бесцветны и не флуоресцировали. Заметных спектральных сдвигов не обнаружено в клетках голубоватых листьев Acacia dealbata. Можно предположить, что этого не произошло благодаря детоксикации – связыванию озона на поверхности клеток указанных видов, довольно устойчивых к озону по литературным данным [1–3] и поэтому отобранных для экспериментов. Как показал наш опыт, синий цвет к поверхности испытуемых образцов не может принадлежать водорастворимым антоцианам при рН > 7, так как добавление щелочи или кислоты не привело к изменению голубой окраски. Следовало проверить присутствие в этих образцах другого пигмента, азулена, синего ароматического углеводорода, обладающего уникальной химической структурой и важными биологическими свойствами.
Обнаружение азуленов. Азулены являются липофильными веществами, сильно окрашенными в синий, фиолетовый, иногда в зеленый цвет (S-гвайазулен существует в виде сине-фиолетовых ромбических пластинок) [14]. Пластины видны в проходящем свете микроскопа при большом увеличении. Они легко растворяются в этаноле и других органических растворителях, не растворяются в воде, но перегоняются с эфирными маслами, связываются с концентрированными кислотами за счет образования комплексов. К щелочам азулены индифферентны, а при доступе воздуха и на интенсивном свету окисляются с разрывом двойной связи. Тогда происходит изменение синей и фиолетовой окраски на зеленую, желтую или коричневую. Тоже предполагается и в кутикуле, покрывающей поверхность листа.
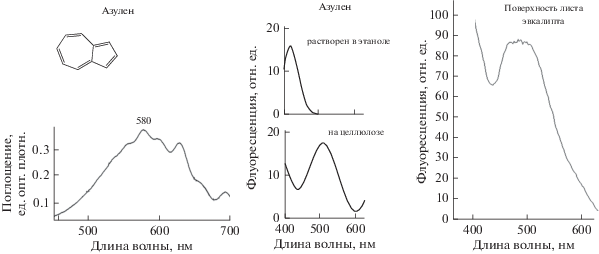
На рис. 4 приведены основная формула и спектральные данные для синтетического азулена. Голубой цвет этого вещества соответствует основному максимуму 580 нм в спектре его поглощения. Разнообразие включений в скелет данного азулена боковых групп в природе дает также пики в области 570–625 нм [14]. Раствор азулена в этаноле имеет максимум флуоресценции 400–410 нм, а после включения его в целлюлозу – 510–520 нм. Микроспектрофлуориметрия серебристо-голубой поверхности целого листа эвкалипта (на всех участках, включая секреторные клетки) показывает максимум 510–520 нм в спектре флуоресценции (рис. 4), как и в модельном эксперименте с целлюлозой [12]. Подобное сходство дает основание для поиска азуленов в наших образцах и обсуждения их возможной защитной роли от озона и образуемых активных форм кислорода при взаимодействии с клетками поверхности растений.
Рис. 4.
Спектры поглощения (слева) и флуоресценции (справа) синтетического азулена (2 мг/мл) в сравнении с флуоресценцией серебристо-голубой поверхности листа эвкалипта.
Предположение о защитной роли азуленов в кутикуле на поверхности листьев и хвои проверялось нами в опытах с экстрактами. Голубая окраска может принадлежать самой клеточной стенке или слою кутикулы, покрывающей ее поверхность. Кутикула представляет собой слой из липидных компонентов (кутина, суберина и восков) клеточных оболочек эпидермиса. Воска удаляются органическими растворителями, что нами было сделано на образцах 96% этанолом или 100% ацетоном. После этого, поверхность листьев эвкалипта, акации и хвои сосны, ели и кедра лишилась голубоватой или серебристой окраски.
В табл. 1 и на рис. 5 представлены данные о появлении азуленов с максимумами поглощения 600–610 нм в экстрактах образцов с голубой поверхностью клеток у исследованных видов. Время появления азуленов в экстракте показывает, насколько глубоко в клеточной стенке, покрытой воском, располагаются азулены. Обнаружение в экстракте максимумов поглощения 665 нм или флуоресценции 680 нм, относящихся к хлорофиллу, свидетельствует, что растворитель (ацетон или этанол) проник через плазмалемму к хлоропластам. Это хорошо видно на спектрах поглощения экстрактов, в частности, у Pinus parviflora (рис. 5).
Таблица 1.
Время появления в экстракте и содержание азуленов в поверхностном слое клеток растений с голубой окраской
| Вид | Максимум в спектре поглощения*, нм | Время появления в экстракте, мин | Концентрация, мкг/г сухой массы |
|---|---|---|---|
| Acacia dealbata | 607–610 | 60 | 475 ± 34 |
| Cedrus atlantica | 606–610 | 480 | 180 ± 10 |
| Eucalyptus сinerea | 600 | 40–60 | 1256 ± 56 |
| Picea pungens | 607 | 15 | 550 ± 70 |
| Pinus parviflora | 610 | 10 | 880 ± 81 |
* Максимумы свойственны фенилазулену, по данным работы [14].
Рис.5.
Спектры поглощения синих пигментов из хвои различных видов: 1 – Cedrus atlantica, 2 – Picea pungens, 3 – Pinus parviflora, на хроматографической бумаге Whatman 1. Справа – раствор ацетонового экстракта из хвои Pinus parviflora за 10 или 60 мин экспозиции.
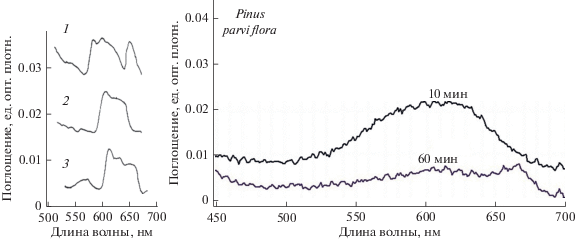
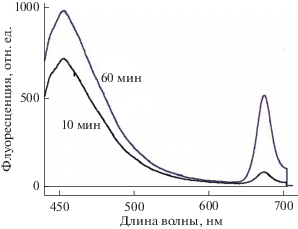
Пигмент заметен уже после 10 мин экстракции, после 60 мин количество его падает, и есть вклад хлорофилла (666 нм, рис. 5). В спектрах флуоресценции (рис. 6) хорошо виден максимум 406–410 нм уже после 10 мин экстракции и небольшой вклад пика 680 нм, принадлежащего хлорофиллу. До 5 мин экстракции практически вклада хлорофилла нет совсем. Спустя 60 мин количество хлорофилла в экстракте возрастает до 5 раз по сравнению с экстракцией в течение 10 мин.
Рис. 6.
Спектры флуоресценции ацетоновых экстрактов из хвои Pinus parviflora через 10 и 60 мин экстракции.
В табл. 1 видно, что медленнее всего экстрагируется азулен из хвои Сedrus atlantica. Большая концентрация азуленов есть у листьев эвкалипта, окраска появляется за 40 и более минут экстракции. Наименьшее время (10 мин) требуется для экстракции синего пигмента из хвои Pinus parviflora. На хроматограмме фракция делится на две полосы с Rf 0.91 и 0.86. Для листьев эвкалипта и акации отделение азуленовой фракции от хлорофилла и каротиноидов хроматографически происходит после добавления в экстракт серной кислоты (50–60%). У эвкалипта на Whatman 1 появляется четыре голубых полосы с разными Rf 0.52, 0.34, 0.14, 0.06, а у акации – две c Rf 0.67–0.70 и 0.44. Если разделение азуленовых фракций происходило на силикагеле или на Whatman 1, бумаге с пропиткой вазелиновым маслом, то обычно видно по одной широкой полосе с Rf 0.9 или 0.86, а хлорофилл в последнем варианте остается на старте.
Долгие годы химики обнаруживали азулены при отгонке эфирных масел из лекарственных трав полыни горькой Artemisia absinthium L. или тысячелистника обыкновенного Achillea millefolium L, приобретавших синюю окраску [14]. Но такие пигменты были найдены и в экстрактах органическими растворителями у мхов печеночника Сalypogeia azurea и др. [15, 16], пыльцы разных цветковых видов и пыльцы-обножки, собранной пчелами [12], клеток микроспор хвоща полевого Equisetum arvense L. [13], поверхностных клеток хвои голубой ели Picea excelsa [17], изолированных хлоропластов гороха Pisum sativum L. и клевера Trifolium repens L. [17]. В обзоре [14] приводятся также сведения об опытах по обнаружению азуленов в секреторных волосках ряда растений.
Наши данные могут свидетельствовать о локализации азуленов именно в поверхностных клетках древесных растений, поскольку экстракция этих пигментов происходила с поверхности целых неповрежденных клеток уже в первые 10 мин настаивания образцов с растворителем. У листьев эвкалипта с выраженными секреторными структурами допускается присутствие азуленов и в самом секрете, и в поверхностных несекреторных клетках. Серебристый слой на листьях после экстракции ацетоном исчезает. Неясно, весь ли азулен расположен в кутикуле на клеточной стенке (при фильтрации экстрактов выпадает воск кутикулы) или часть этого синего вещества есть в хлоропластах поверхностной клетки. По нашим данным (табл. 1), азулены медленнее всего экстрагируются из хвои кедра атласского Cedrus atlantica из-за их более прочного связывания с восками кутикулы на клеточной стенке. Хлорофилл также появляется в этом экстракте не ранее 5 ч настаивания с ацетоном. При этом известно, что оба пигмента найдены в изолированных хлоропластах травянистых растений [17]. Взаимодействие же их и локализация (различная или в каком-то комплексе с хлорофиллом) в этих органеллах совсем не исследованы. Это предполагается сделать в дальнейшем.
При обсуждении полученных результатов следует отметить, что роль азуленов для самих растений до сих пор не рассматривалась в литературе, хотя есть единственная трактовка их свойств как регуляторов роста [18]. По крайней мере, показано, что водорастворимый азулен стимулирует прорастание семян [18]. В составе лекарственных трав эти вещества широко использовали в течение сотен лет в медицинской практике, а сейчас они уже направленно применяются в антиаллергической, антибактериальной и противовоспалительной терапии [19]. Благодаря своим физико-химическим свойствам, азулен и его производные c множеством двойных связей и их конъюгированные биологически активные соединения нашли применение в технологии, особенно в оптоэлектронных устройствах [20]. В опытах с экзогенным азуленом на вегетативных микроспорах хвоща показаны свойства этого сесквитерпена как антагониста гистамина [21]. В этом случае понятно, что пятичлен в молекуле азулена может замещать гистамин при рецепции на соответствующем рецепторе. Синтезированные производные азулена, азуленилпиперазины, также имеют сродство к гистаминовым и дофаминовым рецепторам клеток животных [22]. Следует отметить, что гистамин образуется в живых клетках при неблагоприятных условиях, в частности под влиянием озона, его обнаружили непосредственно в листьях эвкалипта пепельного [5]. Присутствие азуленов в поверхностных клетках исследованных образцов в этом случае может выполнять защитную функцию. Как нами указано выше, подобная же роль известна и для фенольных соединений, присутствующих во всех растениях в разных количествах.
Рассматривая возможное защитное действие азуленов на поверхности исследованных растений от токсичного влияния озона и образуемых активных форм кислорода, надо подчеркнуть, что древесные виды, представленные в работе, обогащены сесквитерпеновыми лактонами, проазуленами, которые легко превращаются в азулены [11, 14]. Роль азуленов в защитных реакциях растений пока еще мало исследована, в отличие от общеизвестной функции фенольных соединений. В модельных экспериментах показано токсичное действие азулена на жизнедеятельность дафний [23]. Защитный эффект природных и модифицированных азуленов в медицине как фотосенсоров рассматривается в фотодинамической терапии, где они вызывают антифунгальный, бактерицидный и антивирусный эффекты [19]. В данный момент в литературе описана защитная антиоксидантная активность эфирных масел, содержащих природные азулены ромашки, полыни, тысячелистника [24]. Во всех случаях механизм действия азуленов в отношении активных форм кислорода рассматривается с позиции антиоксидантных возможностей основной азуленовой структуры.
Хотя в этой статье мы использовали только электрический разряд для получения озона, но в предыдущей работе [6] отмечены похожие изменения под влиянием ультрафиолетового излучения у масляных желез эвкалипта (выцветание и снижение флуоресценции). При этом уровень выделяемого озона был сопоставим с данными, полученными нами под влиянием электрического разряда. Следует поэтому отметить роль азуленов как оптического фильтра, поглощающего избыток УФ-радиации и света в видимой области. Эти стрессовые факторы при высокой интенсивности солнечного излучения могут усиливать негативное действие озона.
ЗАКЛЮЧЕНИЕ
Чувствительность к озону поверхностных клеток растений может объясняться присутствием в клеточной стенке пигментов азуленов, которые как мощные антиоксиданты могут быть сенсорами для озона. У рассмотренных древесных видов они предположительно препятствуют и распространению активных форм кислорода с поверхности внутрь клеток. Это может определять устойчивость данных растений к озону, а присутствие азуленов на их поверхности быть тестом на толерантность к исследованному загрязнителю воздуха.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнялась в рамках государственной программы фундаментальных научных исследований (ГП 14) по теме (проекту) 61.3. (0191-2019-0022), регистрационный номер НИОКТР: АААА-А20-120101390067-0.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Ernst D., Jürgensen M., Bahnweg G., Heller W., Müller-Starck G. 2012. Common links of molecular biology with biochemistry and physiology in plants under ozone and pathogen attack. In: Growth and Defense in Plants. Eds. Matyssek R., Schnyder H., Oßwald W. Heidelberg, New York: Springer, p. 29–51.
Pearson M. 1995. Effects of ozone on growth and gas exchange of Eucalyptus globulus seedlings. Tree Physiology. 15 (3), 207–210.
Pell E.J., Schlagnhaufer C.D., Arteca R.N. 2006. Ozone-induced oxidative stress: Mechanisms of action and reaction. Phisiologia Plantarum 100 (2), 264–273.
Roshchina V.V., Roshchina V.D. 2003. Ozone and Plant Cell. Dordrecht: Kluwer. 267 p.
Roshchina V.V. 2020. How tropospheric ozone influences the allelopathy of woody species: Some experimental approaches. J. Plant Sci. 8 (4), 71–79.
Roshchina V.V., Soltani G.A. 2020. Effects of ozone (O3) on leaf secretory cell characteristics related to allelopathy of woody plants: Modelling allelopathic interactions. Allelopathy J. 51 (2), 209–220.
Рощина В.В., Хайбулаева Л.М., Призова Н.К., Кучин А.В., Солтани Г.А., Куньев А.Р. 2021.Чувствительность к озону поверхностных клеток растений как сенсоров. В кн.: Рецепторы и внутриклеточная сигнализация. Ред. Бережнов А.В., Зинченко В.П. Пущино 24–28 мая 2021. Т. 2, с. 581–587.
Budantsev A.Yu., Roshchina V.V. 2020. Enzymatic tissue biotests (MAO and AChE biotests) and bioindicators. In: Macro, Micro, and Nano-Biosensors. Eds. Rai M., Reshetilov A., Plekhanova Y., Ingle A.P. Cham, Switzerland: Springer Int. Publ. Ag., p. 37–55.
Monk R.J., Murray F. 1995. The relative tolerance of some Eucalyptus species to ozone exposure. Water Air Soil Pollut. 85, 1405–1411.
Townsend A.M., Dochinger L. S.1982. Relative sensitivity of pine species to ozone. J. Arboriculture, 8 (7), 186–188.
Коновалов Д.А. 1995. Природные азулены. Растительные ресурсы. 31 (1), 101–130.
Рощина В.В., Мельникова Е.В., Спиридонов Н.А., Ковалева Л.В. 1995. Азулены – синие пигменты пыльцы. Доклады РАН. 340 (5), 715–718.
Рощина В.В., Мельникова Е.В., Яшин В.А., Карнаухов В.Н. 2002. Автофлуоресценция интактных спор хвоща Equisetum arvense L. в процессе развития. Биофизика. 47 (2), 318–324.
Heilbronner E. 1959. Azulenes. In: Non-benzenoid aromatic compounds. Ed. Ginsburg D. New York, London: Intersci. Publ. p.171–276.
Nakagawa S., Katoh K., Kusumi T., Komura H., Nomoto K., Konno H., Huneck S., Takeda R. 1992. Two azulenes produced by liverwort, Calypogeia azurea, during in vitro culture. Phytochemicstry. 31 (5), 1667–1670.
Siegel U., Mues R., Dönig R., Eicher Th., Blechschmidt M., Becker H. 1992. Ten azulenes from Plagiochila longispina and Calypogeia azurea. Phytochemistry 31 (5), 1671–1678.
Roshchina V.V. 1999. Mechanisms of cell-cell communication. In: Allelopathy Update. Ed. Narwal. S.S., Delhi, Calcutta: Oxford and IBH Publ., vol. 2, p.1–25.
Muir R.M., Hansch C. 1961. Azulene derivatives as plant growth regulators. Nature. 190, 741–742.
Bakun P., Czarczynska-Goslinska B., Goslinski T., Lijewski S. 2021. In vitro and in vivo biological activities of azulene derivatives with potential applications in medicine. Med. Chem. Res 30, 834–846.
Shoji T., Okujima T., Ito S. 2020. Development of heterocycle-substituted and fused azulenes in the last decade (2010–2020). Int. J. Mol. Sci. 21, 7087–7092.
Рощина В.В., Яшин В.А., Вихлянцев И.М. 2011. Флуоресценция растительных микроспор как биосенсоров. Биол. мембраны. 28 (6), 547–556.
Löber S., Hübner H., Buschauer A., Sanna F., Argiolas A., Melis M.R., Gmeiner P. 2012. Novel azulene derivatives for the treatment of erectile disfunction. Bioorg. Med. Chem. Lett. 22, 7151–7154.
Sweet L.I., Meier P.G. 1997. Lethal and sublethal effects of azulene and longifolene to microtox R Ceriodaphnia dubia, Daphnia magna, and Pimephales promelas. Bull. Environ. Contam. Toxicol. 58, 268–274.
Sizova N.V. 2012. Composition and antioxidant activity of essential oils containing azulene derivatives. Pharm. Chem. J. 46(6), 369–371.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии