Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 1, стр. 28-43
Регуляция структурной устойчивости эритроцитов пероксидом водорода: математическая модель и эксперимент
В. В. Войнаровский a, *, Г. Г. Мартинович a
a Белорусский государственный университет
220030 Минск, Республика Беларусь
* E-mail: voynarovskiy@bsu.by
Поступила в редакцию 28.03.2021
После доработки 26.07.2021
Принята к публикации 27.07.2021
- EDN: UOPPCK
- DOI: 10.31857/S0233475522010091
Аннотация
В работе проведен анализ регуляторных механизмов, индуцируемых внеклеточным пероксидом водорода, на основе математической модели, учитывающей ключевые этапы образования метгемоглобина и феррилгемоглобина и их связывания с мембраной эритроцитов. В результате численного моделирования показано, что обратимое связывание метгемоглобина с мембраной является адаптивным механизмом, направленным на стабилизацию липидного бислоя мембраны. С другой стороны, рост концентрации феррилгемоглобина и его связывание с мембраной приводит к усилению патофизиологических процессов, снижающих структурную стабильность клеток. Количество образованных метгемоглобинов и феррилгемоглобинов зависит от концентрации внеклеточного пероксида водорода и времени инкубирования, числа клеток в растворе, состояния антиокислительной системы эритроцитов, метаболической активности клеток и внешних метаболических условий. На основе численного моделирования установлены оптимальные условия (концентрация окислителя, время инкубирования), при которых наблюдается активация адаптационных процессов. При гемолизе эритроцитов в экспериментах in vitro показано, что при действии пероксида водорода в концентрации 10–200 мкМ наблюдаются повышение структурной стабильности мембраны и снижение доли гемолизированных эритроцитов.
ВВЕДЕНИЕ
Важным явлением при клеточном дыхании является образование активных форм кислорода (АФК), обладающих широким спектром физиологического и патофизиологического действий. До недавнего времени доминировала точка зрения об исключительно патологической роли АФК, образование которых связывали с развитием хронических и дегенеративных заболеваний. Однако на сегодняшний день известно, что АФК являются участниками ряда физиологических процессов, среди которых регуляция метаболизма, активация адаптационных механизмов, запуск апоптоза и др. [1–4].
Согласно современным представлениям, пероксид водорода является основной молекулой группы АФК, участвующей в регуляторных процессах [2]. Сигналы, передаваемые пероксидом водорода, характеризуются своим концентрационным порогом активации и длительностью. Действие таких сигналов обратимо, о чем свидетельствует присутствие в клетке особого набора ферментативных систем, среди которых каталаза (Cat), глутатионпероксидаза (Gpx), пероксиредоксин (Prx) и др. [2, 5–7]. Умеренное повышение концентрации пероксида водорода активирует механизмы, связанные с защитой и адаптацией [2–4]. Благодаря этим механизмам поддерживается баланс образования и утилизации пероксида водорода, а нарушение этого баланса приводит к развитию различных заболеваний [1, 3]. Таким образом, действие пероксида водорода на клетки при низких концентрациях приводит к адаптации и усилению защиты, при высоких – к повреждению клеточных структур. Такое свойство живых систем, описываемое изменением знака биологического эффекта при увеличении величины стрессора, называется гормезисом и объясняется наличием специфических компенсаторно-адаптационных механизмов [8, 9].
Ключевую роль в адаптационных процессах большинства клеток играет фактор транскрипции Nrf2 (nuclear E2-related factor 2), активность которого регулируется с участием редокс-зависимого белка Keap1 (Kelch-like ECH-associating protein 1) [10, 11]. Однако данная система поддержания редокс-гомеостаза отсутствует у эритроцитов, в связи с чем вопрос о механизмах активации адаптационных процессов эритроцитов в условиях окислительного стресса остается открытым.
Эритроциты являются самыми многочисленными клетками в организме человека и выполняют ряд функций, связанных с гомеостазом [9, 12, 13]. Изменения функционального состояния организма, в том числе связанные с нарушением редокс-гомеостаза, будут сказываться на состоянии эритроцитов, что делает необходимым исследование защитных механизмов клеток и поиск способов регуляции их функционирования при окислительном стрессе. В норме концентрация пероксида водорода в крови обычно не превышает 10 мкМ [14]. При патофизиологических процессах внеклеточная концентрация пероксида водорода может повышаться до 200–250 мкМ [15, 16]. Исследование возможных механизмов адаптационного ответа эритроцитов при действии пероксида водорода в диапазоне от 10 до 250 мкМ являлось целью данной работы.
В работе изучена роль пероксида водорода как стимулирующего агента, приводящего к повышению структурной стабильности эритроцитов человека при окислительном гемолизе, опосредованном хлорноватистой кислотой (HOCl). Механизм разрушения клеток под действием HOCl проходит по коллоидно-осмотическому механизму с образованием пор высокой проницаемости [17], следовательно, уменьшение доли негемолизированных клеток может быть обусловлено повышением структурной стабильности мембраны.
Одним из важнейших механизмов повышения структурной стабильности мембран является их взаимодействие с основным белком эритроцитов – гемоглобином [9]. Гемоглобин является регулятором гомеостаза эритроцитов и ключевым участником внутриклеточных окислительных процессов [9, 12]. Связывание гемоглобина с мембраной регулирует множество внутриклеточных процессов, таких как энергетический метаболизм, деформируемость мембраны, эриптоз и др. Связывание проходит с мембранными белками за счет ковалентных и нековалентных взаимодействий или с липидами мембраны в результате гидрофобного взаимодействия [18–21]. Константы скорости образования и распада комплекса гемоглобин–мембрана зависят от состояния гемоглобина [19, 21]. Наиболее высокой константой связывания с компонентами мембраны характеризуется процесс взаимодействия метгемоглобина (MetHb), образующегося при окислении оксигемоглобина, что позволяет предположить его важную роль в регуляции стабильности мембраны. Изучение молекулярных механизмов данного эффекта показало, что при незначительном и обратимом окислении наблюдается стабилизирующее действие гемоглобина на мембраны, в то время как образование феррилгемоглобинов (FerHb) под действием окислительного стресса нарушает взаимодействие мембраны с цитоскелетом [22]. Таким образом, регуляция окислительного метаболизма гемоглобина может лежать в основе эффекта гормезиса при действии окислителей на эритроциты.
Подтверждение данной гипотезы может быть осуществлено с помощью построения математической модели внутриклеточных процессов на основе известных данных. Начало исследования редокс-метаболизма эритроцитов с использованием математического моделирования можно отнести к 60-м годам прошлого века. В работе Николлса [23] описаны процессы транспорта и утилизации пероксида водорода на основе диффузии и разложения окислителя каталазой. В начале 2000-х моделирование метаболизма пероксида водорода в эритроцитах дополняется сложными процессами, связанными с окислением гемоглобина и переходом его в окисленные формы [6]. Одновременно в работах Киношиты и соавт. [24] были предложены модели для восстановительных процессов, учитывающие вклад нескольких путей восстановления окисленных форм гемоглобина. В свою очередь энергия для восстановления может восполняться только за счет процессов гликолиза, первые модели которого были построены в 80-е годы прошлого века группами Раппопорта–Якобаш [25] в Германии и группой Атауллаханова [26] в СССР. В последующие десятилетия математические модели гликолиза были дополнены и уточнены [24, 27]. В настоящей работе изучено влияние предварительного инкубирования клеток с пероксидом водорода на структурную стабильность эритроцитов при окислительном гемолизе и проведена численная оценка вклада участников метаболизма гемоглобина в регуляцию структурной стабильности мембран.
ОПИСАНИЕ МОДЕЛИ
В работе построена математическая модель, описывающая ключевые этапы образования метгемоглобина и феррилгемоглобина при действии внеклеточного пероксида водорода и их связывания с мембраной. Модель включает процессы диффузии и утилизации пероксида водорода в клетке, образование и восстановление метгемоглобина и феррилгемоглобина, образование и распад комплекса гемоглобин–мембрана и образование восстановительных эквивалентов за счет гликолиза. Общая схема процессов представлена на рис. 1. Все уравнения и скорости представлены в табл. 1. Константы и начальные условия указаны в табл. 2 и 3.
Рис. 1.
Процессы метаболизма эритроцитов с участием пероксида водорода, рассмотренные в модели. Hb – гемоглобин; MetHb – метгемоглобин; FerHb – феррилгемоглобин; H2O2 – пероксид водорода; H2O2 (внеш) – внеклеточный пероксид водорода; Cat – каталаза; Gpx – глутатионпероксидаза; GSH – глутатион; GSSG – глутатион-дисульфид; cyt b5 (окисл) – окисленная форма цитохрома b5; cyt b5 (вос) – восстановленная форма цитохрома b5; cyt b5 R – цитохром-b5-редуктаза; NAD+/NADH – окисленная и восстановленная форма никотинамидадениндинуклеотида; Asc – аскорбиновая кислота; DHA – дегидроаскорбат; DHAR – дегидроаскорбатредуктаза; GSHR – глутатионредуктаза; NADP+/NADPH – окисленная и восстановленная форма никотинамидадениндинуклеотидфосфата; MetHb complex – мембранный комплекс с метгемоглобином; FerHb complex – мембранный комплекс с феррилгемоглобином.
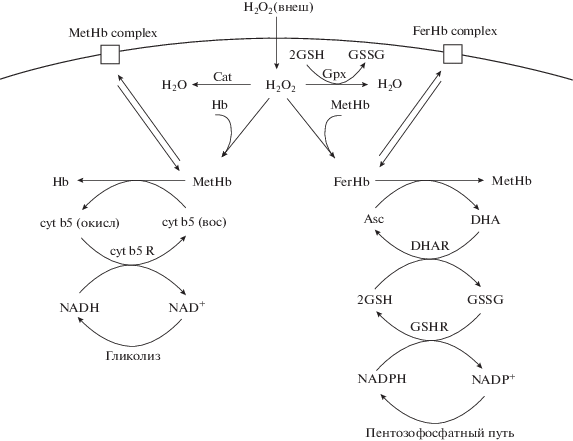
Таблица 1.
Реакции и уравнения скорости в модели
| № | Реакция | Уравнение скорости |
|---|---|---|
| 1 | ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}({\text{внеш}}) \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}$ | ${{{v}}_{1}} = - P({{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} - {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}({\text{внеш}}))\frac{{{{S}_{{{\text{клет}}}}}}}{V}{{N}_{{{\text{клет}}}}}$ |
| 2 | ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}({\text{внеш}}) \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}$ | ${{{v}}_{2}} = - P({{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} - {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}({\text{внеш}}))\frac{{{{S}_{{{\text{клет}}}}}}}{{{{V}_{{{\text{клет}}}}}}}$ |
| 3 | ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}\xrightarrow{{{\text{Cat}}}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ | ${{{v}}_{3}} = {{k}_{3}} \cdot {\text{Cat}} \cdot {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}}$ |
| 4 | ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}\xrightarrow{{{\text{CompI}}}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{O}}}_{{\text{2}}}}$ | ${{{v}}_{4}} = {{k}_{4}} \cdot {\text{Compl}} \cdot {{{\text{H}}}_{2}}{{{\text{O}}}_{2}}$ |
| 5 | ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} + 2{\text{GSH}}\xrightarrow{{{\text{Gpx}}}}2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{GSSG}}$ | ${{{v}}_{5}} = \frac{{{\text{Gpx}} \cdot {\text{GSH}} \cdot {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}}}}{{{{K}_{1}} \cdot {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} + {{K}_{2}} \cdot {\text{GSH}}}}$ |
| 6 | $2{\text{Hb}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to 2{\text{MetHb}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}$ | ${{{v}}_{6}} = {{k}_{6}} \cdot {\text{Hb}} \cdot {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}}$ |
| 7 | ${\text{MetHb}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to {\text{FerHb}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}$ | ${{{v}}_{7}} = {{k}_{7}} \cdot {\text{MetHb}} \cdot {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}}$ |
| 8 | ${\text{MetHb}} + {\text{cyt}}{\kern 1pt} {\text{b5}}{\kern 1pt} ({\text{вос}}) \to {\text{Hb}} + {\text{cyt}}{\kern 1pt} {\text{b5}}{\kern 1pt} ({\text{окис}})$ | ${{{v}}_{8}} = {{k}_{8}} \cdot {\text{MetHb}} \cdot {\text{cytb}}5{\kern 1pt} ({\text{вос}})$ |
| 9 | ${\text{NADH}} + {\text{cyt}}{\kern 1pt} {\text{b5}}{\kern 1pt} ({\text{окис}})\xrightarrow{{{\text{cyt}}{\kern 1pt} {\text{b5}}{\kern 1pt} {\text{R}}}}{\text{NA}}{{{\text{D}}}^{ + }} + {\text{cyt}}{\kern 1pt} {\text{b5}}{\kern 1pt} ({\text{вос}})$ | $\begin{gathered} {{{v}}_{9}} = {{k}_{9}}{\kern 1pt} \cdot {\text{cyt}}{\kern 1pt} {\text{b}}{\kern 1pt} 5{\kern 1pt} {\text{R}}\frac{{{\text{NADH}}}}{{K_{M}^{{{\text{NADH}}}} + {\text{NADH}}}} \times \\ \times \,\,\frac{{{\text{cyt}}{\kern 1pt} {\text{b}}{\kern 1pt} 5{\kern 1pt} ({\text{окис}})}}{{K_{M}^{{{\text{cyt}}{\kern 1pt} {\text{b}}{\kern 1pt} 5{\kern 1pt} ({\text{окис}})}} + {\text{cyt}}{\kern 1pt} {\text{b}}{\kern 1pt} 5{\kern 1pt} ({\text{окис}})}} \\ \end{gathered} $ |
| 10 | ${\text{FerHb}} + 2{\text{Asc}} \to {\text{MetHb}} + {\text{DHA}} + {\text{Asc}}$ | ${{{v}}_{{10}}} = {{k}_{{10}}} \cdot {\text{FerHb}} \cdot {\text{Asc}}$ |
| 11 | ${\text{DHA}} + 2{\text{GSH}}\xrightarrow{{{\text{DHAR}}}}{\text{Asc}} + {\text{GSSG}}$ | ${{{v}}_{{11}}} = \frac{{{{k}_{{13}}} \cdot {\text{DHAR}}}}{{1 + \frac{{{{K}_{{{\text{DHA}}}}}}}{{{\text{DHA}}}} + \frac{{{{K}_{{{\text{GSH}}}}}}}{{{\text{GSH}}}}}}$ |
| 12 | ${\text{GSSG}} + {\text{NADPH}}\xrightarrow{{{\text{GSHR}}}}{\text{NADP}}{{{\text{ }}}^{ + }} + 2{\text{GSH}}$ | ${{{v}}_{{12}}} = \frac{{{\text{GSHR}} \cdot {\kern 1pt} \,{\kern 1pt} {\text{GSSG}}\,{\kern 1pt} \cdot {\kern 1pt} \,{\text{NADPH}}}}{{{{K}_{1}} \cdot {\text{NADPH}} + {{K}_{2}} \cdot {\text{GSH}}}}$ |
| 13 | ${\text{MetHb}} + {\text{Band}}{\kern 1pt} {\text{3}} \to {\text{M}}{\kern 1pt} {\text{e}}{\kern 1pt} {\text{t}}{\kern 1pt} {\text{H}}{\kern 1pt} {\text{b}}{\kern 1pt} {\text{c}}{\kern 1pt} {\text{o}}{\kern 1pt} {\text{m}}{\kern 1pt} {\text{p}}{\kern 1pt} {\text{l}}{\kern 1pt} {\text{e}}{\kern 1pt} {\text{x}}$ | ${{{v}}_{{13}}} = {{k}_{{13}}} \cdot {\text{MetHb}} \cdot {\text{Band}}{\kern 1pt} 3$ |
| 14 | ${\text{M}}{\kern 1pt} {\text{e}}{\kern 1pt} {\text{t}}{\kern 1pt} {\text{H}}{\kern 1pt} {\text{b}}{\kern 1pt} {\text{c}}{\kern 1pt} {\text{o}}{\kern 1pt} {\text{m}}{\kern 1pt} {\text{p}}{\kern 1pt} {\text{l}}{\kern 1pt} {\text{e}}{\kern 1pt} {\text{x}} \to {\text{MetHb}} + {\text{Band}}{\kern 1pt} {\text{3}}$ | ${{{v}}_{{14}}} = {{k}_{{14}}} \cdot {\text{MetHbcomplex}}$ |
| 15 | ${\text{FerHb}} + {\text{Band}}{\kern 1pt} {\text{3}} \to {\text{Fer}}{\kern 1pt} {\text{H}}{\kern 1pt} {\text{b}}{\kern 1pt} {\kern 1pt} {\text{c}}{\kern 1pt} {\text{o}}{\kern 1pt} {\text{m}}{\kern 1pt} {\text{p}}{\kern 1pt} {\kern 1pt} {\text{l}}{\kern 1pt} {\text{e}}{\kern 1pt} {\text{x}}$ | ${{{v}}_{{15}}} = {{k}_{{15}}} \cdot {\text{FerHb}} \cdot {\text{Band}}{\kern 1pt} 3$ |
| 16 | ${\text{Fer}}{\kern 1pt} {\text{H}}{\kern 1pt} {\text{b}}{\kern 1pt} {\text{c}}{\kern 1pt} {\text{o}}{\kern 1pt} {\text{m}}{\kern 1pt} {\text{p}}{\kern 1pt} {\text{l}}{\kern 1pt} {\text{e}}{\kern 1pt} {\text{x}} \to {\text{FerHb}} + {\text{Band}}{\kern 1pt} {\text{3}}$ | ${{{v}}_{{16}}} = {{k}_{{16}}} \cdot {\text{FerHb}}{\kern 1pt} {\text{complex}}$ |
Таблица 2.
Значения параметров в модели
| № | Константа реакции из табл. 1 | Источник |
|---|---|---|
| 1 | P = 6 × 10–6 м с–1 Sклет = 1.09 × 10–10 м2 V = 10–6 м3 Nклет = 3 × 107 |
[28, 29] |
| 2 | P = 6 × 10–6 м с–1 Sклет = 1.09 × 10–10 м2 Vклет = 6.3 × 10–17 м3 |
[28, 29] |
| 3 | k3 = 6 × 106 М–1 с–1 | [6] |
| 4 | k4 = 1.6 × 107 М–1 с–1 | [6] |
| 5 | Gpx = 1.4 × 10–6 M K1 = 2.5 × 10–5 M с K2 = 2.4 × 10–8 M с |
[7] |
| 6 | k6 = 100 М–1 с–1 | [6] |
| 7 | k7 = 98 М–1 с–1 | [30] |
| 8 | k8 = 6200 М–1 с–1 | [24] |
| 9 | k9 = 418 с–1 cyt b5 R = 7 × 10–8 М $K_{M}^{{{\text{NADH}}}}$ = 3.1 × 10–7 M $K_{M}^{{{\text{cyt}}{\kern 1pt} {\text{b}}5{\kern 1pt} ({\text{окис}})}}$ = 1.5 × 10–5 M |
[24] |
| 10 | k10 = 400 М–1 с–1 | [30] |
| 11 | k11 = 5.27 с–1 DHAR = 10–7 М KDHA = 2.1 × 10–4 М KGSH = 3.5 × 10–3 М |
[31] |
| 12 | GSHR = 1.4 × 10–6 М K1 = 2.4 × 10–8 M с K2 = 2.5 × 10–5 M с |
[7] |
| 13 | k13 = 3 М–1 с–1 | [12] |
| 14 | k14 = 7.8 × 10–5 с–1 | [12] |
| 15 | k15 = 30 М–1 с–1 | [21] |
| 16 | k16= 0.8 × 10–5 с–1 | [21] |
Таблица 3.
Начальные значения параметров в модели
| Обозначение реагента | Начальное значение | Источник |
|---|---|---|
| H2O2 (внеш) | 0–2.5 × 10–4 M | Данная работа |
| H2O2 | 0 | Данная работа |
| Cat | 5.5 × 10–6 M | [7] |
| Comp I | 5.5 × 10–6 M | [7] |
| Hb | 0.01 M | [24] |
| MetHb | 0 | [24] |
| FerHb | 0 | [30] |
| cyt b5(вос) | 8.12 × 10–7 M | [24] |
| cyt b5(окисл) | 0 | [24] |
| NADH | 1.48 × 10–7 M | [32] |
| NAD+ | 8.9 × 10–5 M | [32] |
| Asc | 7.5 × 10–5 M | [1] |
| DHA | 0 | [1] |
| GSH | 1.5 × 10–3 M | [7] |
| GSSG | 0 | [7] |
| NADPH | 5 × 10–5 M | [7] |
| NADP+ | 0.2 × 10–6 M | [7] |
| Band 3 | 2.6 × 10–5 M | [33] |
| complex MetHb | 0 | [12] |
| complex FerHb | 0 | [21] |
Скорость изменения концентрации внеклеточного пероксида водорода обусловлена диффузией окислителя в клетки и описывается первым законом Фика для мембран [33]. Диффузия окислителя в клетку и его утилизация обуславливает уменьшение внеклеточной концентрации H2O2 (v1), которая прямо пропорциональна количеству клеток в суспензии, и изменение концентрации пероксида водорода во внутриклеточной среде (v2).
В клетке пероксид водорода восстанавливается до воды с участием ферментов Cat и Gpx [7]. При высоких концентрациях пероксида водорода главным участником утилизации является Cat, поскольку ее константа скорости реакции выше, чем у других ферментов и при этом она не требует дополнительных субстратов. Cat при взаимодействии с пероксидом водорода переходит в состояние Comp I (v3), а при взаимодействии со следующей молекулой окислителя она возвращается обратно в исходное состояние (v4). Дополнительным участником утилизации является Gpx (v5), катализирующая восстановление пероксида водорода внутриклеточным глутатионом (GSH), который также используется для восстановления аскорбиновой кислоты (Asc) [31].
Конкурирующими процессами с участием пероксида водорода будут являться окисление гемоглобина с образованием метгемоглобина (v6) [24, 34–36] и окисление метгемоглобина с образованием феррилгемоглобина (v7) [6]. Скорости данных процессов, согласно закону действующих масс, пропорциональны концентрации участников.
Показано [24], что при повышенных концентрациях метгемоглобина основным путем его восстановления является взаимодействие с цитохромом b5 (v8), который затем восстанавливается NADH с участием фермента цитохром-b5-редуктазы (cyt b5 R) (v9). Восстановление феррилгемоглобина осуществляется клеточными антиоксидантами без участия ферментов. В модели учитывается реакция феррилгемоглобина с Asc, поскольку ее константа реакции имеет наиболее высокое значение (v10). При восстановлении аскорбата образуются радикалы, которые быстро дисмутируют до дегидроаскорбата (DHA) в прямой реакции или с участием ферментов [37].
В работе построена полная модель гликолиза и пентозофосфатного пути, вид уравнений которой представлен в приложении к статье. Основной вклад в регуляцию состояния редокс-пары NAD+/ NADH вносят реакции с участием ферментов глицеральдегид-3-фосфатдегидрогеназы (GAPDH) и лактатдегидрогеназы (LDH) [24, 32, 38]. Первая реакция является одной из стадий гликолиза, она катализирует окисление глицеральдегид-3-фосфата (gap) с образованием 1,3-дифосфоглицерата (13pg) и выделением NADH. Вторая катализирует превращение пирувата (pyr) в лактат (lac) с выделением NAD+. При физиологических условиях данная реакция проходит в направлении образования лактата и NAD+, тем самым используя электроны, высвобождаемые в первой реакции. Благодаря этому в эритроцитах наблюдается отношение концентраций [пируват] : [лактат] = 1 : 15, а отношение [NADH] : [NAD+] = 1 : 600 [24, 32]. При снижении концентрации NADH равновесие нарушается, что приводит к тому, что LDH начинает катализировать обратную реакцию для восстановления баланса.
Регуляция редокс-пары Asc/DHA осуществляется с участием электронов GSH ферментом дегидроаскорбатредуктазой (DHAR) (v11) [31]. В результате этой реакции образуется глутатион-дисульфид (GSSG), который восстанавливается ферментом глутатионредуктазой (GSHR) (v12) с участием электронов NADPH. Восстановление NADPH проходит в пентозофосфатном пути с участием ферментов глюкозо-6-фосфатдегидрогеназы (G6PDH) и фосфоглюконатдегидрогеназы (GO6PDH) [33, 38].
Образование метгемоглобина приводит к его взаимодействию с мембраной эритроцитов, а именно к связыванию с белком полосы 3 (Band 3) [12, 20]. Для моделирования данного процесса рассматривается кинетика лиганд-рецепторного связывания [33]. В качестве лиганда выступает метгемоглобин, а рецептором служит мембранный белок Band 3. Образование комплекса является обратимым и характеризуется константами образования и распада комплекса (v13, v14). Избыток пероксида водорода приводит к образованию феррилгемоглобина, который также способен связываться с мембраной эритроцитов. Данный процесс рассматривается аналогично предыдущему со скоростями (v15, v16).
Построенная математическая модель является нелинейной и содержит 41 дифференциальное уравнение. Принципиально новым является учет динамики процесса, что позволяет изучать не только амплитуды, но и длительности действия сигналов. Все константы и начальные условия взяты из литературных источников. Выполнен анализ на устойчивость системы. Численное решение системы выполнено в программе Wolfram Mathematica. Полный вид дифференциальных уравнений представлен в приложении к статье.
На основе численного моделирования процессов взаимодействия метгемоглобина с мембраной эритроцитов можно установить область концентраций внеклеточного пероксида водорода, при которых будет наблюдаться активация адаптационных процессов, что позволяет проведение экспериментальной проверки. Влияние пероксида водорода на структурную стабильность мембран исследовали в экспериментах in vitro при гемолизе эритроцитов, индуцированном хлорноватистой кислотой.
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментах использовали гипохлорит натрия (NaOCl) (Sigma-Aldrich) и пероксид водорода (Белмедпрепараты, Беларусь).
Концентрацию раствора NaOCl определяли спектрофотометрически, как концентрацию OCl– при pH 12.0, коэффициент молярной экстинкции (ε292) равен 350 М–1 см–1. Поскольку pKα для HOCl ~7.5 при физиологических pH, половина соединения присутствует в протонированной форме HOCl и половина в депротонированной форме OCl–. Таким образом, под термином HOCl понимается смесь HOCl/OCl–. Рабочий раствор HOCl готовили непосредственно перед анализом путем растворения препарата в 10 мМ натрий-фосфатном буфере (pH 7.4), содержащем 137 мМ NaCl.
В эксперименте использовали кровь здоровых доноров, полученную в ГУ “Республиканский научно-практический центр трансфузиологии и медицинских биотехнологий”. Эритроциты выделяли и промывали путем центрифугирования при 300 g в фосфатно-солевом буфере (ФСБ), содержащем 10 мМ Na2HPO4/KH2PO4, 137 мМ NaCl, 2.7 мМ KCl, 5 мМ D-глюкозы (рН 7.4).
Кинетики гемолиза эритроцитов измеряли с использованием спектрофлуориметра Solar CM-2203 (SOLAR, Беларусь) путем регистрации оптической плотности клеточной суспензии (3 × × 107 клеток/мл) на длине волны 640 нм. Концентрация эритроцитов выбрана таким образом, чтобы начальная оптическая плотность составляла 0.5, что является наиболее оптимальной для измерения. В измерительную кювету добавляли 1 мл суспензии отмытых эритроцитов и термостатировали в течение 3–4 мин при температуре 37°C при постоянном перемешивании. Гемолиз инициировали путем добавления 0.2 мМ HOCl к суспензии эритроцитов в ФСБ при предварительном инкубировании с H2O2 в течение 5 и 15 мин при концентрациях 10–250 мкМ.
Оценка эффекта (I) определялась как относительная разность оптической плотности после 10 мин инкубирования с хлорноватистой кислотой в присутствии пероксида водорода и оптической плотности после 10 мин инкубирования с хлорноватистой кислотой без пероксида водорода.
Результаты представлены как средние значения плюс-минус стандартное отклонение среднего для трех–пяти независимых экспериментов. Статистический анализ проводился с использованием программы Microsoft Excel. Достоверность значений определяли с помощью t-критерия Стьюдента, различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предложенная модель позволила вычислить динамику внутриклеточных сигнальных процессов с участием метгемоглобина и феррилгемоглобина в зависимости от величины внеклеточной концентрации пероксида водорода. Ниже представлены результаты численных экспериментов на основе построенной модели.
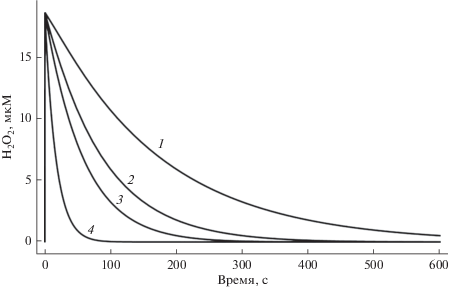
В результате диффузии и действия каталазы происходит быстрое (порядка секунды) установление градиента концентраций H2O2 на плазматической мембране. Величина внутриклеточной концентрации пероксида водорода зависит от величины внеклеточной концентрации, которая снижается в результате утилизации окислителя клетками. Утилизация, а следовательно, и динамика изменения внеклеточной и внутриклеточной концентраций пероксида водорода пропорциональна количеству клеток в суспензии. На рис. 2 представлена динамика внутриклеточного пероксида водорода при внеклеточной концентрации 200 мкМ и различном количестве эритроцитов в растворе. Следствием утилизации окислителя является экспоненциальное снижение величин внутриклеточной и внеклеточной концентрации. Из рис. 2 также видно, что при концентрации порядка 200 мкМ и количестве клеток 3 × 107 общее время действия сигнала пероксида водорода не превышает 300 с, а внутриклеточная концентрация не превышает 10% от внеклеточной концентрации, что согласуется с данными полученными в работе [23].
Рис. 2.
Кинетика утилизации внутриклеточного пероксида водорода при различном количестве клеток в кювете (1 – 1 × 107, 2 – 2 × 107, 3 – 3 × 107, 4 – 108).
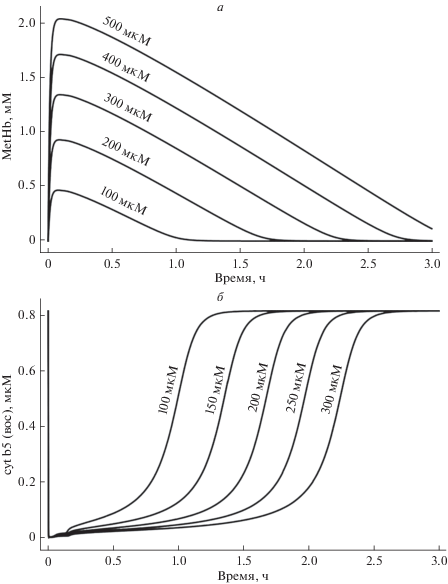
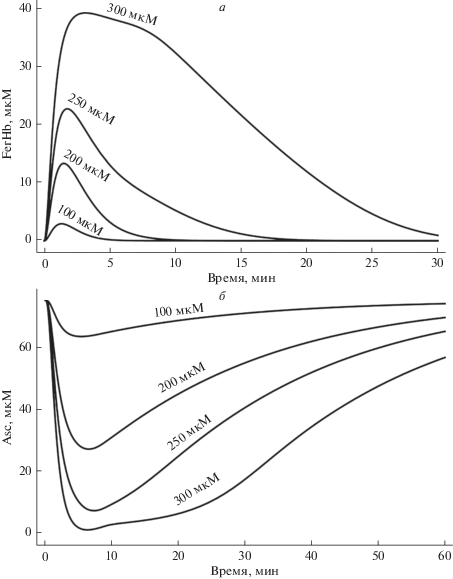
Рост внутриклеточной концентрации пероксида водорода приводит к увеличению образования метгемоглобина (рис. 3а), количество которого достигает значений 2–3 мМ. Полученные значения подтверждаются результатами экспериментальных исследований, представленных в работе [39]. Метгемоглобин, образуя комплексы с белками цитоскелета, индуцирует стабилизацию мембраны и повышение структурной стабильности [9, 40]. Снижение концентрации метгемоглобина в результате его восстановления ферментом цитохромом b5 приводит к распаду мембранных комплексов метгемоглобина. Общее время восстановления метгемоглобина для концентрации пероксида водорода 200–300 мкМ составляет 2–3 часа в модели, что сопоставимо со временем, приводимым в работе [39]. Динамика изменения концентрации цитохрома b5, используемого для восстановления окисленного гемоглобина, зависит от концентрации H2O2 и при концентрациях окислителя, превышающих 100 мкМ, количество восстановленного белка снижается до нулевых значений, что увеличивает время восстановления метгемоглобина (рис. 3б). Увеличение скорости восстановления NADH при повышении внеклеточной концентрации лактата (что может наблюдаться при мышечных нагрузках, гипоксии и ряде патологических процессов) будет ускорять процесс восстановления метгемоглобина.
Рис. 3.
Кинетика образования и восстановления метгемоглобина (MetHb) (a) и цитохрома b5(вос) (б) при различной концентрации внеклеточного пероксида водорода.
Дальнейшее увеличение количества внеклеточного H2O2 будет приводить к окислению метгемоглобина и образованию феррилгемоглобина, который также способен связываться с мембраной клетки. Количество образованного феррилгемоглобина зависит от количества поступившего пероксида водорода и количества образованного метгемоглобина. В работе [41] представлены данные экспериментов по количеству феррилгемоглобина при отношении [H2O2] : [MetHb] = 10 : 1 и указывается на полное окисление метгемоглобина. В наших экспериментах данное отношение не поднималось выше 1 : 1 и модель предсказывала окисление 5% метгемоглобина. Образование комплекса феррилгемоглобина с мембраной эритроцита нарушает ее взаимодействие с цитоскелетом, что приводит к снижению структурной стабильности клетки [21]. На рис. 4а представлена зависимость количества образованного феррилгемоглобина от концентрации внеклеточного пероксида водорода. При достижении 250 мкМ H2O2 наблюдается увеличение интенсивности образования феррилгемоглобина, что связанно с истощением внутриклеточного пула аскорбата (рис. 4б). Учет гликолиза в модели показывает, что при гипогликемии будет наблюдаться замедление образования NADH и NADPH, что будет приводить к накоплению окисленных форм гемоглобина и увеличению количества мембранных комплексов феррилгемоглобина.
Рис. 4.
Кинетика образования и восстановления феррилгемоглобина (FerHb) (а) и аскорбата (б) при различной концентрации внеклеточного пероксида водорода.
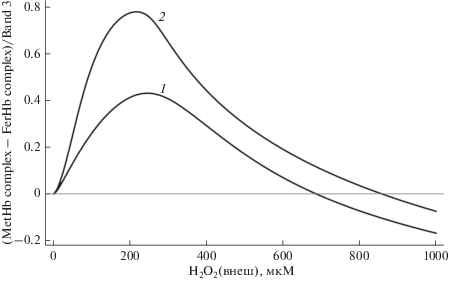
В рамках предложенной модели адаптационного механизма степень увеличения структурной стабильности мембраны зависит от количества образованных комплексов мембрана–метгемоглобин и мембрана–феррилгемоглобин. Доля занятых тем или иным белком рецепторов, в свою очередь, зависит от величины внеклеточной концентрации пероксида водорода и времени инкубирования. На рис. 5 представлены теоретически рассчитанные зависимости доли образованных мембранных комплексов белков от внеклеточной концентрации пероксида водорода. Зависимость относительной разности количества комплексов мембрана–метгемоглобин и мембрана–феррилгемоглобин от концентрации окислителя имеет куполообразный вид (рис. 6). При концентрациях пероксида водорода, не превышающих 200 мкМ, в клетке наблюдается увеличение количества комплексов с метгемоглобином с ростом концентрации. Увеличение времени инкубирования с 5 до 15 мин также приводит к росту числа мембранных комплексов, образованных метгемоглобином. При более высоких концентрациях окислителя доля образованных мембранных комплексов с метгемоглобином уменьшается. Превышение концентрации 200 мкМ индуцирует резкий рост количества комплексов феррилгемоглобин–мембрана, что связано с уменьшением числа молекул восстановителей. При достижении концентрации H2O2 800 мкМ количество комплексов сравнивается. Таким образом, согласно данной модели при действии внеклеточного Н2О2 в концентрации от 10 до 200 мкМ будет наблюдаться дозозависимое увеличение количества комплексов мембрана–метгемоглобин, а следовательно, и повышение структурной стабильности мембраны.
Рис. 5.
Доля образованных комплексов метгемоглобин–мембрана (1 – 5 мин, 2 – 15 мин предварительного инкубирования) и доля комплексов феррилгемоглобин–мембрана (3 – 5 мин, 4 – 15 мин предварительного инкубирования) в зависимости от концентрации внеклеточного пероксида водорода.
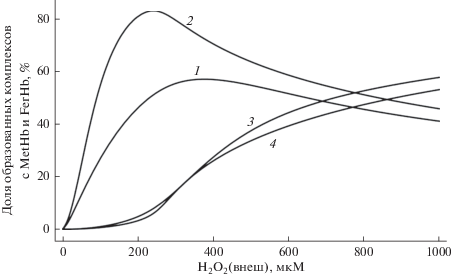
Рис. 6.
Относительная разность количества образованных комплексов метгемоглобин–мембрана и феррилгемоглобин–мембрана для различной концентрации внеклеточного пероксида водорода (1 – 5 мин, 2 – 15 мин предварительного инкубирования).
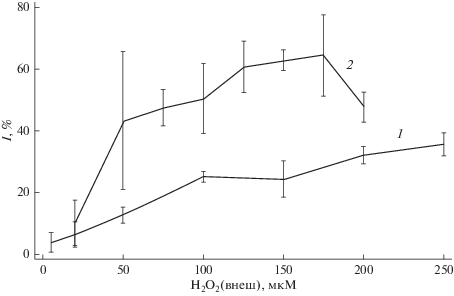
В экспериментах по исследованию скорости гемолиза эритроцитов показано, что предварительное инкубирование клеток с пероксидом водорода в концентрациях 10–200 мкМ действительно позволяет снизить долю гемолизированных эритроцитов. Максимальный защитный эффект, как и предсказывала модель (рис. 6), зависит от времени инкубирования клеток с окислителем. На рис. 7 представлены зависимости доли неразрушенных эритроцитов от внеклеточной концентрации пероксида водорода для различных времен инкубирования, которые составили 5 и 15 мин. При предварительном инкубировании клеток в течение 5 мин наблюдается стабилизирующий эффект, достигающий 30% от контрольных значений. При инкубировании клеток в течение 15 мин с пероксидом водорода наблюдается более выраженный стабилизирующий эффект: доля неразрушенных эритроцитов достигает 60% для пероксида водорода в концентрации 175 мкМ. Однако при более высоких концентрациях проявляется обратная зависимость: с увеличением концентрации окислителя снижается доля неразрушенных эритроцитов, что, вероятно, обусловлено ростом количества комплексов феррилгемоглобин–мембрана. Увеличение количества этих комплексов может инициировать процессы перекисного окисления липидов и нарушить взаимодействие цитоскелета с мембраной, что приводит к снижению эффекта увеличения структурной стабильности при высоких концентрациях H2O2.
ЗАКЛЮЧЕНИЕ
Построение адекватной математической модели адаптационного механизма эритроцитов способствует анализу оптимальных условий его регуляции внешними факторами. В работе построена математическая модель, учитывающая вклад различных участников метаболизма гемоглобина в регуляцию структурной стабильности мембраны. Результаты численного моделирования показывают, что обратимое связывание метгемоглобина с мембраной может являться адаптивным механизмом, направленным на стабилизацию липидного бислоя мембраны. С другой стороны, рост концентрации более окисленной формы гемоглобина – ферилгемоглобина, и его связывание с мембраной приводит к усилению патофизиологических процессов (перекисное окисление липидов, нарушение взаимодействия мембраны с цитоскелетом и др.), снижающих структурную стабильность клеток. Соотношение мембранных комплексов различных окисленных форм гемоглобина, по-видимому, определяет гормезисную зависимость ответа эритроцитов на действие пероксида водорода: регуляторное при низких концентрациях и повреждающее при высоких. При анализе оптимальных условий в модели учитывается величина внеклеточной концентрации пероксида водорода, число клеток в растворе, состояние антиокислительной системы эритроцитов (содержание аскорбата и других восстановителей), метаболическая активность клеток (гликолиз, пентозофосфатный путь) и внешние метаболические условия (содержание лактата). В результате теоретических и экспериментальных исследований показано, что при действии пероксида водорода в концентрации 10–200 мкМ активируется адаптационный механизм эритроцитов, обусловленный ростом числа мембранно-связанного метгемоглобина, что повышает структурную стабильность мембраны при окислительном стрессе. Полученные данные позволяют расширить представления о механизмах защиты эритроцитов, построить прогнозы о защитных свойствах клеток при окислительном стрессе.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена при частичной финансовой поддержке Белорусского республиканского фонда фундаментальных исследований (грант № Б20У-1).
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Мартинович Г.Г., Черенкевич С.Н. 2008. Окислительно-восстановительные процессы в клетках. Минск: БГУ. 159 с.
Sies H., Jones D.P. 2020. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nat. Rev. Mol. Cell Biol. 21 (3), 1–21.
Ghezzi P., Jaquet V., Marcucci F., Schmidt H. 2017. The oxidative stress theory of disease: Levels of evidence and epistemological aspects. Br. J. Pharmacol. 174, 1784–1796.
Ursini F., Maiorino M., Forman H.J. 2016. Redox homeostasis: The golden mean of healthy living. Redox Biology. 8, 205–215.
Lim J.B., Huang B.K., Deen W.M., Sikes H.D. 2015. Analysis of the lifetime and spatial localization of hydrogen peroxide generated in the cytosol using a reduced kinetic model. Free Radic. Biol. Med. 89, 47–53.
Johnson R.M., Goyette G.Jr., Ravindranath Y., Ho Y. 2005. Hemoglobin autoxidation and regulation of endogenous H2O2 levels in erythrocytes. Free Radic. Biol. Med. 39, 1407–1417.
Orrico F., Möller M.N., Cassina A., Denicola A., Thomson L. 2018. Kinetic and stoichiometric constraints determine the pathway of H2O2 consumption by red blood cells. Free Radic. Biol. Med. 121, 231–239.
Merry T.L., Ristow M. 2015. Mitohormesis in exercise training. Free Radic. Biol. Med. (11), 123–130.
Космачевская О.В., Насыбуллина Э.И., Блиндарь В.Н., Топунов А.Ф. 2019. Связывание эритроцитарного гемоглобина с мембраной как способ осуществления сигнально-регуляторной функции (обзор). Прикл. биохим. и микробиол. 55 (2), 107–123.
Зенков Н.К., Чечушков А.В., Кожин П.М., Кандалинцева Н.В., Мартинович Г.Г., Меньщикова Е.Б. 2017. Лабиринты регуляции Nrf2. Биохимия. 82 (5), 749–759.
Cuadrado A., Rojo A., Wells G., Hayes J., Cousin S., Rumsey W., Attucks O., Franklin S., Levonen A., Kensler T., Dinkova-Kostova A. 2019. Therapeutic targeting of the NRF2 and KEAP1 partnership in chronic diseases. Nat. Rev. Drug Discov. 18, 295–317.
Arashiki N., Kimata N., Manno S., Mohandas N., Takakuwa Y. 2013. Membrane peroxidation and methemoglobin formation are both necessary for band 3 clustering: Mechanistic insights into human erythrocyte senescence. Biochemistry. 52, 5760−5769.
Kuhn V., Diederich L., Stevenson Keller IV T.C., Kramer C.M., Lückstädt W., Panknin C., Suvorava T., Isakson B.E., Kelm M., Cortese-Krott M.M. 2017. Red blood cell function and dysfunction: redox regulation, nitric oxide metabolism, anemia. Antioxid. Redox Signal. 26 (13), 718–742.
Forman H.J., Bernardo A., Davies K.J.A. 2016. What is the concentration of hydrogen peroxide in blood and plasma? Arch. Biochem. Biophys. 603, 48–53.
Roy S., Khanna S., Nallu K., Hunt T.K., Sen C.K. 2006. Dermal wound healing is subject to redox control. Mol. Ther. 13 (1), 211–220.
Niethammer P., Grabher C., Look A.T., Mitchison T.J. 2009. A tissue-scale gradient of hydrogen peroxide mediates rapid wound detection in zebrafish. Nature. 459 (7249), 996–999.
Zavodnik I.B., Lapshina E.A., Zavodnik L.B., Soszynski M., Bartosz G., Bryszewska M. 2002. Hypochlorous acid-induced oxidative damage of human red blood cells: Effects of tert-butyl hydroperoxide and nitrite on the HOCl reaction with erythrocytes. Bioelectrochemistry. 58, 127–135.
Liu S., Palek J. 1984. Hemoglobin enhances the self-association of spectrin heterodimers in human erythrocytes. J. Biol. Chem. 259 (18), 11556–11562.
Snyder L.M., Fortier N.L., Trainor J., Jacobs J., Lob L., Lubin B., Chiu D., Shohet S., Mohandas N. 1985. Effect of hydrogen peroxide exposure on normal human erythrocyte deformability, morphology, surface characteristics, and spectrin-hemoglobin cross-linking. J. Clin. Invest. 76, 1971–1977.
Kaul R.K., Köhler H. 1983. Interaction of hemoglobin with Band 3: A Review. Klin Wochenschr. 61, 831–837.
Welbourn E.M., Wilson M.T., Yusof A., Metodiev M.V., Cooper C.E. 2017. The mechanism of formation, structure and physiological relevance of covalent hemoglobin attachment to the erythrocyte membrane. Free Radic. Biol. Med. 103, 95–106.
Jarolim P., Lahav M., Liu S.C., Palek J. 1990. Effect of hemoglobin oxidation products on the stability of red cell membrane skeletons and the associations of skeletal proteins: Correlation with a release of hemin. Blood. 76. 2125–2131
Nicholls P. 1965. Activity of catalase in the red cell. Biochim. Biophys. Acta 99, 286–297.
Kinoshita A., Nakayama Y., Kitayama T., Tomita M. 2007. Simulation study of methemoglobin reduction in erythrocytes. Differential contributions of two pathways to tolerance to oxidative stress. FEBS J. 274, 1449–1458.
Rapoport T.A., Heinrich R., Jacobasch G., Rapoport S. 1974. A linear steady-state treatment of enzymatic chains. A mathematical model of glycolysis of human erythrocytes. Eur. J. Biochem. 42, 107–120.
Атауллаханов Ф.И., Витвицкий В.М., Жаботинский А.М., 1977. Количественная модель гликолиза в эритроцитах человека. Биофизика. 22 (3), 483–488.
Mulquiney P.J., Kuchel P.W. 1999. Model of 2,3-bisphosphoglycerate metabolism in the human erythrocyte based on detailed enzyme kinetic equations: Equations and parameter refinement. Biochem. J. 342, 581–596.
Мартинович Г.Г., Черенкевич С.Н. 2005. Утилизация пероксида водорода эпителиальными клетками амниона человека. Биомед. химия. 51 (6), 626–633.
Липунова Е.А., Скоркина М.Ю. 2004. Система красной крови: Сравнительная физиология. Белгород: Изд-во БелГУ, 216 с.
Gebicka L., Banasiak E. 2009 Flavonoids as reductants of ferryl hemoglobin. Acta Biochim. Pol. 56 (3) 509–513.
Peng Xu D., Washburn M.P., Ping Sun G. Wells W. 1996. Purification and characterization of a glutathione dependent dehydroascorbate reductase from human erythrocytes. Biochem. Biophys. Res. Commun. 221 (1), 117–121.
Bali M., Thomas S.R. 2001. A modelling study of feedforward activation in human erythrocyte glycolysis. C. R. Acad. Sci. III. 324, 185–199.
Черенкевич С.Н., Мартинович Г.Г., Хмельницкий А.И. 2008. Биол. мембраны. Минск: БГУ. 184 с.
Miłek J. 2018. Estimation of the kinetic parameters for H2O2 enzymatic decomposition and for catalase deactivation. Braz. J. Chem. Eng. 35 (3), 995–1004.
Benfeitas R., Selvaggio G., Antunes F., Coelho P.M.B.M., Salvador A. 2014. Hydrogen peroxide metabolism and sensing in human erythrocytes: A validated kinetic model and reappraisal of the role of peroxiredoxin II. Free Radic. Biol. Med. 74, 35–49.
Kanias T., Acker J.P. 2010. Biopreservation of red blood cells – the struggle with hemoglobin oxidation. FEBS J. 277, 343–356.
May J.M., Qu Z., Cobb C.E. 2004. Human erythrocyte recycling of ascorbic acid. J. Biol. Chem. 279 (15), 14975–14982.
Мартинович Г.Г., Сазанов Л.А., Черенкевич С.Н. 2017. Клеточная биоэнергетика: физико-химические и молекулярные основы. М.: ЛЕНАНД. 196 с.
Jaffe E.R. 1963. The reduction of methemoglobin in erythrocytes of a patient with congenital methemoglobinemia, subjects with erythrocyte glucose-6-phosphate dehydrogenase deficiency, and normal individuals. Blood. 21 (5), 561–572.
Mendanha S.A., Anjos J.L.V., Silva A.H.M., Alonso A. 2012. Electron paramagnetic resonance study of lipid and protein membrane components of erythrocytes oxidized with hydrogen peroxide. Braz. J. Med. Biol. Res. 45, 473–481.
Kassa T., Jana S., Meng F., Alayash A.I. 2016. Differential heme release from various hemoglobin redox states and the upregulation of cellular heme oxygenase-1. FEBS Open Bio. 6, 876–884.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии