Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 1, стр. 63-74
Неканоническое потенцирующее действие каннабиноидов анандамида и 2-арахидоноил-глицерина на вызванную квантовую секрецию ацетилхолина в моторных синапсах мыши
Е. О. Тарасова a, Н. А. Хоткина a, П. О. Богачева a, К. А. Чернышев a, А. Е. Гайдуков a, *, О. П. Балезина a
a Московский государственный университет им. М.В. Ломоносова,
биологический факультет
119234 Москва, Россия
* E-mail: gaydukov@gmail.com
Поступила в редакцию 08.04.2021
После доработки 26.05.2021
Принята к публикации 27.05.2021
- EDN: KCYYDB
- DOI: 10.31857/S0233475521060128
Аннотация
Исследовали действие каннабиноидов анандамида (АЭА) и 2-арахидоноил-глицерина (2-АГ) на вызванную стимуляцией нерва быструю синхронную секрецию ацетилхолина (АХ) в моторных синапсах диафрагмы и мышцы длинного разгибателя пальцев (m. EDL) мыши. С помощью микроэлектродной техники регистрировали спонтанные миниатюрные потенциалы концевой пластинки (МПКП) и мультиквантовые потенциалы концевой пластинки (ПКП) в ходе коротких ритмических (50 Гц, 1 с) залпов. АЭА (30 мкМ) вызывал увеличение частоты, но не амплитуды МПКП, это сопровождалось возрастанием амплитуды и квантового состава ПКП по всему ходу ритмического залпа. Квантовый анализ показал, что увеличение квантового состава ПКП по ходу залпа в присутствии АЭА происходит за счет возрастания размера пула синаптических везикул, непосредственно готовых к выбросу. Потенцирующее действие АЭА на вызванную секрецию АХ предотвращалось блокатором Ca2+-каналов L-типа нитрендипином, что свидетельствует о растормаживании данного пресинаптического Са2+-входа под действием АЭА. 2-АГ (1 мкМ) вызывал значимый прирост амплитуды, но не частоты МПКП в нервно-мышечных синапсах диафрагмы мыши. Одновременно происходило увеличение амплитуды вызванных ПКП по всему ходу залпа, но квантовый состав ПКП при этом оставался на контрольном уровне. Аналогичное потенцирующее действие 2-АГ на амплитуду МПКП и ПКП было выявлено и в моторных синапсах m. EDL. Индуцируемое 2-АГ возрастание амплитуд ПКП предотвращалось ингибитором протеинкиназы А H-89. В совокупности с ранее полученным нами свидетельством об утрачивании 2-АГ способности увеличивать амплитуду МПКП при ингибировании везикулярного транспорта АХ настоящие результаты позволяют заключить, что в основе механизма потенцирующего действия 2-АГ лежит его способность стимулировать закачку АХ в синаптические везикулы с участием протеинкиназы A, что приводит к увеличению размера квантов АХ. Таким образом, впервые у каннабиноидов 2-АГ и АЭА обнаружена способность оказывать быстро развивающиеся неканонические потенцирующие эффекты на синаптическую передачу в ритмически активных моторных синапсах мыши. Несмотря на сходный характер действия АЭА и 2-АГ – усиление нервно-мышечной передачи, установлено, что эффекты этих эндоканнабиноидов осуществляются посредством запуска различных сигнальных механизмов и предполагают потенцирование разных параметров секреции АХ.
ВВЕДЕНИЕ
Эндоканнабиноиды – липофильные производные жирных кислот, вырабатывающиеся в клетках за счет активности определенных липаз [1, 2]. Cвою cигнальную функцию эндоканнабиноиды осуществляют, действуя преимущественно на семидоменные G-белок-сцепленные рецепторы двух типов (CB1 и СB2), сопряженные с Gi-белками [3]. Совокупность эндоканнабиноидов, ферментов их синтеза и метаболизма, а также CB-рецепторов составляет эндоканнабиноидную систему, наличие компонентов которой в той или иной ткани свидетельствует о ее возможной регуляторной роли в данной структуре [4]. В центральной нервной системе (ЦНС) наиболее известны два эндоканнабинноида: анандамид (АЭА) и 2-арахидоноил-глицерин (2-АГ) [1, 4–6]. Образуясь в постсинаптическом нейроне под действием нейромедиаторов Ca2+-зависимым образом, эндоканнабиноиды, высвобождаясь, действуют на пресинаптические CB-рецепторы и преимущественно угнетают секрецию нейромедиаторов. Именно поэтому эндоканнабиноиды считаются специфическими сигнализаторами, обеспечивающими каноническое ретроградное торможение синаптической активности [7–10].
В скелетных мышцах и периферических моторных синапсах в настоящее время описаны компоненты эндоканнабиноидной системы [11–14]. Имеются свидетельства аутокринной регуляции метаболизма мышцы с участием эндоканнабиноидов и их рецепторов [14]. Данные о влиянии эндоканнабиноидов на активность моторных синапсов и нервно-мышечную передачу в настоящее время малочисленны и противоречивы. В моторных синапсах холоднокровных животных описано снижение спонтанной и вызванной секреции медиатора при активации CB1-рецепторов [15–17], что согласуется с каноническим тормозным действием эндоканнабиноидов в синапсах ЦНС. Совсем недавно были получены свидетельства о способности эндоканнабиноидов и их рецепторов потенцировать спонтанную секрецию АХ в нервно-мышечных синапсах млекопитающих [18–20]. Так, в наших недавних исследованиях было впервые показано, что два классических эндоканнабиноида 2-АГ и АЭА при их экзогенной аппликации оказывают неканоническое потенцирующее влияние на различные параметры спонтанной секреции АХ в моторных синапсах диафрагмы мыши. Активируя одни и те же пресинаптические СВ1-рецепторы, они приводили к запуску разных сигнальных путей и к изменениям разных параметров одноквантовых миниатюрных потенциалов концевой пластинки (МПКП): 2-АГ увеличивал амплитуду МПКП, а АЭА – их частоту [20]. Неизбежно возник вопрос: способны ли данные эндоканнабиноиды оказывать облегчающие синаптическую передачу эффекты и в случае вызванной стимуляцией нерва быстрой синхронной мультиквантовой секреции АХ? В связи с этим целью нашей работы было изучить действие АЭА и 2-АГ на вызванный выброс АХ в условиях кратковременной ритмической залповой активности нервно-мышечных синапсов мыши и провести сравнительный анализ их влияний.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Эксперименты были проведены на изолированных нервно-мышечных препаратах диафрагмальной мышцы (m. diaphragma – n. phrenicus), а также мышцы длинного разгибателя пальцев ноги (m. extensor digitorum longus – n. peroneus (m. EDL)) взрослых мышей (7–9 недель, весом 25–35 г) линии BALB/c обоих полов. Мыши были получены из лаборатории экспериментальных животных биологического факультета МГУ (Москва, Россия). И содержание животных (12-часовой цикл света и темноты со свободным доступом к еде и воде), и проведенные экспериментальные процедуры соответствовали директиве 86/609/EEC по обращению человека с лабораторными животными и были одобрены комиссией по биоэтике биологического факультета МГУ. Эвтаназию мышей проводили путем быстрой декапитации. В исследовании было использовано 16 животных.
Электрофизиология. Все эксперименты проводили при температуре 20–22°С. Нервно-мышечный препарат левой половины диафрагмы с диафрагмальным нервом или m. EDL с малоберцовым нервом помещали в экспериментальную камеру объемом 3 мл и проводили перфузию оксигенированным (95% O2, 5% CO2) раствором Лайли (pH 7.2–7.4) [19]. Регистрировали спонтанные МПКП и вызванные стимуляцией нерва многоквантовые потенциалы концевой пластинки (ПКП). Для исследования вызванной стимуляцией нерва секреции АХ проводили поперечное рассечение мышечных волокон. В результате данной процедуры мембранный потенциал стабилизировался на сниженном по сравнению с нерассеченными волокнами уровне (менее –50 мВ), что предотвращало сокращение мышцы при стимуляции нерва. Сразу после рассечения препарат промывали в растворе Лайли (более 150 мл) не менее 1 ч, что позволяло предотвратить возможную блокаду проведения потенциала действия по нерву. При изучении вызванной активности сначала производили запись МПКП в течении 70–90 с, а затем стимулировали нерв короткими залпами сверхпороговых импульсов (50 стимулов длительностью 0.08–0.1 мс с частотой 50 Гц) и в том же синапсе регистрировали ПКП. Среднее значение амплитуд МПКП, зарегистрированных до залпа ПКП, затем использовали для вычисления квантового состава ПКП. Ранее было выявлено отсутствие статистически значимых различий в значениях амплитуд МПКП, зарегистрированных до и сразу после залпа [21, 22]. Это позволяет исключить возможное влияние десенситизации постсинаптических никотиновых холинорецепторов в развитии изменений амплитуд и квантового состава ПКП по ходу залпа. Стимуляцию нерва проводили с перерывами не менее 5–6 мин, что предотвращало развитие утомления синапсов или изменения частоты МПКП. Регистрацию постсинаптических потенциалов осуществляли с использованием стеклянных микроэлектродов, заполненных 2.5 М KCl, сопротивление кончика микроэлектрода составляло 15–20 МОм. Сигналы регистрировали при помощи усилителя Neuroprobe Amplifier Model 1600 (A-M Systems, США) или Axoclamp‑2B (Molecular Devices, США). Запись производили с использованием аналого-цифровых преобразователей Е‑154 (L–Card, Россия) с интерфейсом PowerGraph 3.3.8 (ДИСофт, Россия). Первичный анализ параметров постсинаптических потенциалов проводили в программе MiniAnalysis (Synaptosoft, США). В контроле регистрировали потенциалы минимум от 5 синапсов, затем в перфузионный раствор добавляли исследуемые вещества в определенном порядке и регистрировали активность разных синапсов таким же образом, как и в контроле, в течение 1–1.5 ч. Критерием включения синапса в выборку для дальнейшей обработки служило устойчивое значение мембранного потенциала в течение записи – допускались изменения этого параметра менее чем на 5 мВ, в противном случае регистрацию прекращали, а запись не включали в выборку. Время нарастания МПКП составляло не более 1 мс, а ПКП – не более 1.7 мс. В каждой серии экспериментов использовали не менее трех нервно-мышечных препаратов.
Анализ данных и статистика. Оценивали амплитуду и временные характеристики МПКП и ПКП, частоту МПКП, квантовый состав ПКП. Амплитуду ПКП корректировали на нелинейную суммацию [23], квантовый состав ПКП вычисляли как отношение корректированной амплитуды ПКП к средней в данном синапсе амплитуде МПКП. Кроме того, при изменении квантового состава ПКП под действием АЭА оценивали размер пула непосредственно готовых к выбросу везикул (Readily Releasable Pool, RRP). Для этого использовали последовательную модель, которая предполагает, что уменьшение квантового состава ПКП в начале залпа отражает непрерывное истощение единого RRP при высокочастотной ритмической активности моторных синапсов. При этом стабилизация амплитуды и квантового состава ПКП на заключительном этапе короткого залпа, выражающаяся в виде фазы плато, возникает за счет рекрутирования в RRP синаптических везикул, компенсируя его истощение [24]. Используя линейную регрессию на начальном этапе депрессии передачи (5–12 ПКП), проводили пересечение с осью абсцисс (кумулятивный квантовый состав в коротком залпе ПКП). ПКП в самом начале залпа, где регистрируется облегчение синаптической передачи, не учитывались при расчете размера RRP. Вероятность выброса квантов АХ рассчитывали как отношение квантового состава первого ПКП в залпе к значению RRP [24, 25].
Статистическую значимость различий между сравниваемыми выборками оценивали с использованием GraphPad Prism 7.0 (GraphPad, США). Тест Д’Агостино–Пирсона применяли для оценки нормальности распределения значений параметров. В случае нормально распределенных величин применяли t-критерий Стьюдента, в случае распределения, отличного от нормального, – критерий Манна–Уитни. Двухфакторный дисперсионный анализ с последующим применением апостериорного критерия Бонферрони использовали для анализа амплитуд и квантового состава ПКП в залпе. Различия параметров выборок считали статистически значимыми при p < < 0.05, n – количество исследованных синапсов в выборке. В тексте и на рисунках данные представлены в виде среднего значения ± стандартная ошибка среднего.
Материалы. В экспериментах были использованы: эндоканнабиноиды АЭА и 2-АГ, блокатор потенциалзависимых Са2+-каналов L-типа – нитрендипин и ингибитор протеинкиназы А – H-89 (Tocris Bioscience, Великобритания). Для приготовления стоковых растворов для всех веществ, кроме H-89, в качестве растворителя использовали диметилсульфоксид (DMSO, Хеликон, Россия), растворителем для H-89 служила деионизированная вода. Концентрация DMSO в рабочих растворах не превышала 0.01% по объему, растворитель не оказывал самостоятельного действия на исследуемые параметры.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
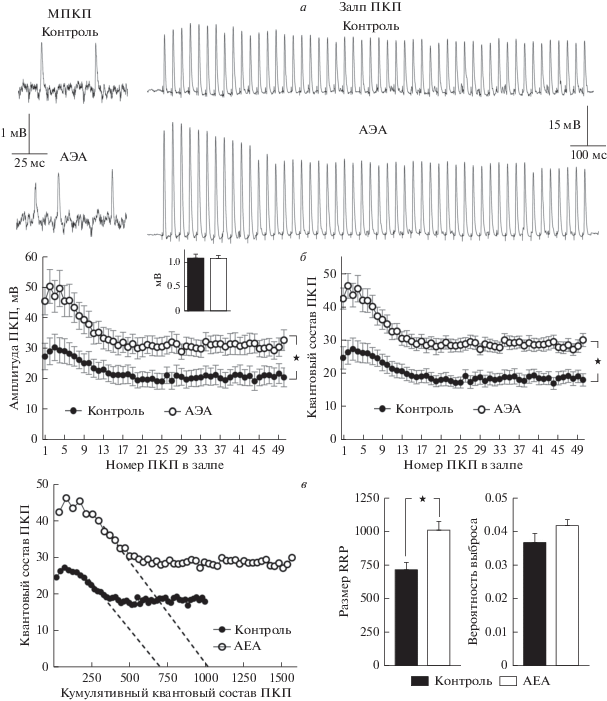
В первой серии экспериментов исследовали влияние АЭА (30 мкМ) на вызванную секрецию АХ в нервно-мышечных препаратах диафрагмы мыши. Оказалось, что в контроле среднее значение частоты МПКП, измеренное в синапсах до начала ритмической стимуляции нерва, составило 0.42 ± 0.05 Гц (n = 16), а на фоне действия АЭА данный параметр статистически значимо увеличивался до 0.67 ± 0.08 Гц (n = 24, p < 0.05). Это совпадет с описанным в нашей предыдущей работе сдвигом данного параметра МПКП на фоне действия АЭА в нервно-мышечных препаратах с нерассеченными мышечными волокнами [20]. Регистрация вызванной активности моторных синапсов мыши выявила, что в присутствии АЭА происходит значительное возрастание амплитуды каждого ПКП в залпе, начиная с первого, в среднем на 70% по сравнению с контролем, при этом форма залпа ПКП не менялась (рис. 1а). Возрастание амплитуд ПКП под действием АЭА не сопровождалось увеличением амплитуд МПКП, а происходило вследствие возрастания квантового состава ПКП. Квантовый состав первого ПКП в залпе увеличивался приблизительно на 60% по сравнению с контролем, и далее данный прирост стойко сохранялся на повышенном уровне на протяжении всего ритмического залпа (рис. 1б). Анализ изменений квантового состава показал, что усиление вызванной секреции АХ на фоне АЭА связано с возрастанием пула синаптических везикул, непосредственно готовых к выбросу (RRP) – от 712.5 ± 60.0 в контроле до 1015.1 ± ± 66.1 при действии АЭА (p < 0.05). При этом не происходило статистически значимого увеличения вероятности выброса везикул – среднее значение этого параметра составило 0.037 ± 0.003 в контроле и 0.042 ± 0.002 при действии АЭА (p > > 0.05) (рис. 1в). Такая совокупность изменений параметров быстрой синхронной квантовой секреции АХ свидетельствует о вовлечении в секрецию АХ ранее молчавших активных зон нервных терминалей, что вызывает равномерное увеличение квантового состава и амплитуд ПКП по всему ходу залпа [24, 25].
Рис. 1.
АЭА усиливает вызванную стимуляцией нерва синаптическую передачу в моторных синапсах диафрагмы. Репрезентативные записи МПКП (слева) и короткого высокочастотного залпа ПКП (справа) в контроле и на фоне действия 30 мкМ АЭА (а). Изменение амплитуды (слева) и квантового состава ПКП (справа) по ходу залпа в контроле (n = 16) и под действием АЭА (n = 24). На врезке – средняя амплитуда МПКП в контроле и на фоне АЭА (б). Графики квантового состава ПКП по ходу залпа в зависимости от кумулятивного квантового состава ПКП в контроле и под действием АЭА. Пересечение с осью Х, экстраполированное из начальной фазы депрессии, отражает размер пула везикул, непосредственно готовых к выбросу (RRP). АЭА вызывает увеличение размера RRP, но не вероятности выброса квантов АХ (в). ★ – p < 0.05 по сравнению с контролем.
В предыдущих работах мы наблюдали аналогичную картину потенцирования вызванной секреции АХ в виде единообразного симметричного прироста амплитуд и квантового состава ПКП по всем ходу залпа. Это происходило в ответ на растормаживание обычно молчащих Ca2+-каналов L-типа различными способами: при блокаде кальций-активируемых K+-каналов BK-типа [26, 27], ингибировании кальцинейрина [28], блокировании A1-рецепторов или активации А2А-рецепторов аденозина [21], стимуляции Р2Х7-пуринорецепторов [25]. Иными словами, единообразный прирост амплитуд и квантового состава всех ПКП в коротком ритмическом залпе может, на наш взгляд, служить характерным маркером, свидетельствующем о вовлечении в регуляцию вызванной секреции АХ Ca2+-каналов L-типа. Эти потенциалзависимые каналы хоть и присутствуют на пресинаптической мембране моторных нервных окончаний, но в обычных условиях не участвуют в запуске быстрого синхронного выброса квантов АХ [29–31].
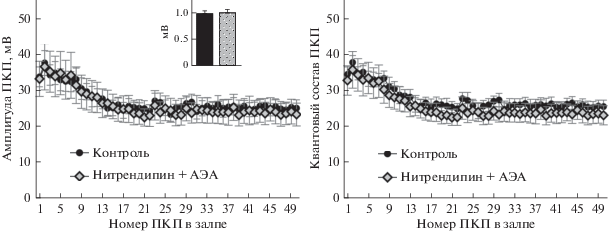
Совсем недавно мы установили, что постепенное возрастание частоты МПКП под действием АЭА может быть связано с активацией именно пресинаптических Ca2+-каналов L-типа, поскольку такое возрастание предотвращалось нитрендипином – блокатором этого типа каналов [20]. В связи с этим, в данной работе мы также проводили блокаду Ca2+-каналов L-типа при помощи нитрендипина (1 мкМ) и исследовали на этом фоне действие АЭА. Оказалось, что нитрендипин, сам по себе не влияя на амплитуду и квантовый состав ПКП в залпах [21, 28], полностью предотвращал возрастание этих параметров быстрой синхронной секреции квантов АХ под действием АЭА (рис. 2). Таким образом, блокирование Са2+-каналов L-типа нитрендипином способно предотвратить не только АЭА-индуцированное усиление спонтанной секреции АХ в моторных синапсах мыши в виде увеличения частоты МПКП: 0.44 ± 0.06 Гц в контроле (n = 15), 0.46 ± 0.07 Гц на фоне действия АЭА в присутствии нитрендипина (n = 19, p > 0.05), но и потенцирование вызванной секреции АХ, проявляющуюся в виде стойкого прироста квантового состава ПКП и их амплитуды.
Рис. 2.
АЭА-индуцированное потенцирование быстрой синхронной секреции квантов АХ, вызванной стимуляцией нерва в моторных синапсах диафрагмы, происходит за счет демаскирования потенциалзависимых кальциевых каналов L-типа. Изменение амплитуды (слева) и квантового состава ПКП по ходу залпа (справа) в контроле (n = 15) и под действием 30 мкМ АЭА в присутствии 1 мкМ блокатора кальциевых каналов L-типа нитрендипина (n = 19). На врезке – средняя амплитуда МПКП в контроле и на фоне АЭА в присутствии нитрендипина.
Полученные результаты позволяют предполагать, что АЭА оказывает в моторных синапсах мыши пресинаптическое облегчающее действие на вызванную секрецию АХ в виде увеличения амплитуд и квантового состава ПКП по всему ходу ритмических залпов. Мы впервые показали, что такое потенцирующее действие АЭА связано, видимо, с активацией потенциалзависимых Ca2+-каналов L-типа и входом по ним кальция. Мы также впервые установили, что механизм такого облегчающего действия на вызванную активность моторных синапсов с участием L-типа Ca2+-каналов предполагает вовлечение в секрецию АХ ранее молчавших активных зон и возрастанием размера пула синаптических везикул, непосредственно готовых к высвобождению (RRP). Такой же механизм был отмечен нами ранее и в случаях потенцирования квантового состава ПКП с участием L-типа Ca2+-каналов при их растормаживании путем активации пресинаптических Р2Х7-пуринорецепторов [25].
Ранее нами было показано, что пресинаптическое влияние АЭА на спонтанную секрецию АХ с участием L-типа Ca2+-каналов предотвращается блокированием СB1-типа рецепторов [20]. Это позволяет нам предполагать, что и в случае с вызванной секрецией АХ эффекты АЭА реализуются через активацию CB1-рецепторов, однако это требует отдельной проверки с использованием блокатора CB1-рецепторов. Согласно классическим представлениям, в синапсах ЦНС эндоканнабиноиды, действуя на пресинаптические СВ1-рецепторы, сопряженные с Gi-белками, угнетают активность аденилатциклазы и протеинкиназы А (PKA) и тормозят функционирование Са2+-каналов N- или P/Q-типов. Это главный механизм реализации канонического ретроградного торможения синаптической передачи с участием эндоканнабиноидов [4, 9, 10]. В нашей работе в моторных синапсах впервые обнаружен неканонический – потенцирующий эффект АЭА в отношении основного способа нервно-мышечной передачи – быстрой синхронной мультиквантовой секреции АХ. Наши данные позволяют предполагать, что механизм такого неканонического действия АЭА заключается в его возможном действии на пресинаптические СВ1-рецепторы, что в конечном итоге приводит к развитию потенциации спонтанной и вызванной секреции АХ посредством облегчения дополнительного пресинаптического входа Са2+ по Са2+-каналам L-типа и увеличения, за счет этого, размера пула готовых к высвобождению везикул АХ в нервных терминалях синапсов за счет рекрутирования в этот пул ранее молчавших активных зон и их везикул.
Во второй части работы мы исследовали действие другого эндоканнабиноида 2-АГ (1 мкМ) на вызванную секрецию АХ в нервно-мышечных синапсах диафрагмы мыши в течение коротких высокочастотных залпов синаптической активности. 2-АГ вызывал прирост амплитуды МПКП на треть по сравнению с контролем (рис. 3а, 3б). При этом данный эндоканнабиноид не влиял на частоту спонтанного выброса АХ – среднее значение этого параметра МПКП составило 0.57 ± ± 0.09 Гц в контроле (n = 16) и 0.58 ± 0.05 Гц под действием 2-АГ (n = 20, p > 0.05). Такие изменения в присутствии 2-АГ параметров МПКП, зарегистрированные в моторных синапсах перед их ритмической стимуляцией, совпадают с описанными нами ранее потенцирующими эффектами 2-АГ в отношении спонтанной секреции АХ в моторных синапсах мыши в препаратах с интактными мышечными волокнами. Нами также было показано, что действие 2-АГ на параметры спонтанной секреции АХ реализуются при активации CB1-типа рецепторов [20].
Рис. 3.
2-АГ усиливает вызванную стимуляцией нерва синаптическую передачу в моторных синапсах диафрагмы. Репрезентативные записи МПКП (слева) и короткого высокочастотного залпа ПКП (справа) в контроле и на фоне действия 1 мкМ 2-АГ (а). Изменение амплитуды (слева) и квантового состава ПКП (справа) по ходу залпа в контроле (n = 16) и под действием 2-АГ (n = 20). На врезке – средняя амплитуда МПКП в контроле и на фоне 2-АГ (б). Изменение амплитуды (слева) и квантового состава ПКП (справа) по ходу залпа в контроле (n = 18) и под действием 2-АГ в присутствии обратного агониста CB1-рецепторов АМ251 (1 мкМ) (n = 29). На врезке – средняя амплитуда МПКП в контроле и на фоне 2-АГ в присутствии AM251 (в). ★ – p < 0.05 по сравнению с контролем.
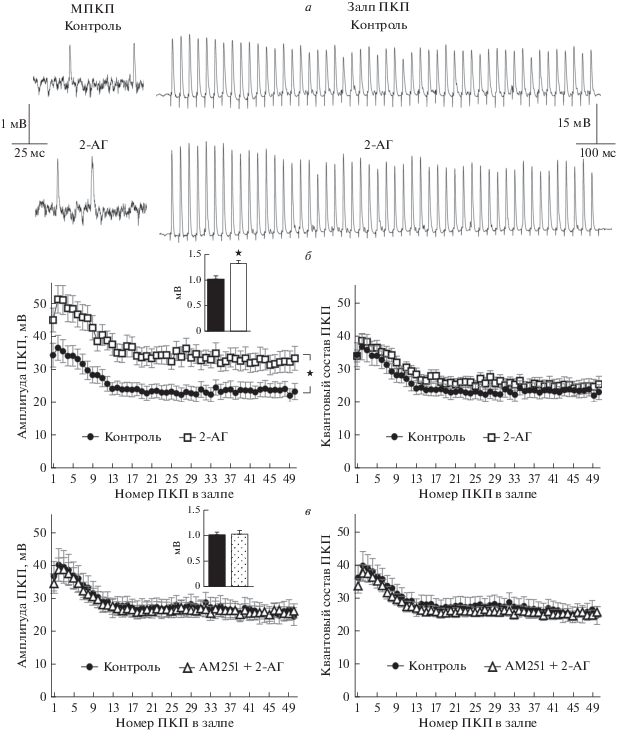
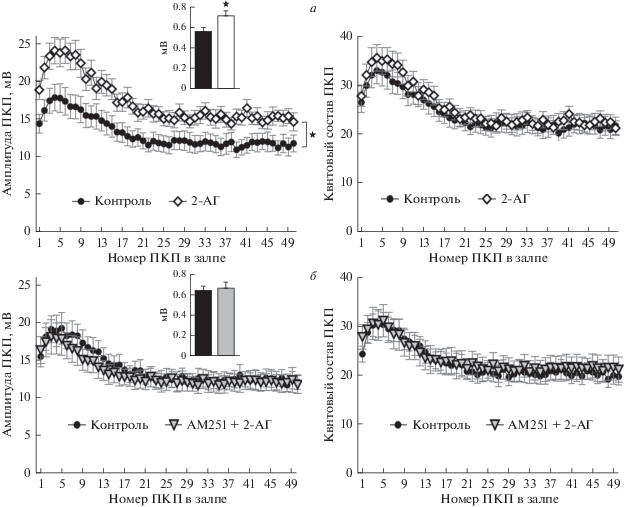
Что касается вызванной стимуляцией нерва мультиквантовой секреции АХ, то на фоне 2-АГ, как и при действии АЭА, происходил значительный прирост амплитуд ПКП по всему ходу залпа примерно на 40% по сравнению с контролем (рис. 3а, 3б). Однако, в отличие от действия АЭА, такое 2-АГ-индуцированное увеличение амплитуд ПКП не сопровождалось возрастанием их квантового состава, поскольку происходило параллельное увеличение амплитуд, соответствующих одноквантовых МПКП (рис. 3б). Таким образом, усиление вызванной активности нервно-мышечных синапсов на фоне 2-АГ в виде возрастания амплитуд ПКП в залпе связано, видимо, с увеличением размера отдельных квантов АХ в составе мультиквантовых ПКП. В присутствии блокатора CB1-рецепторов АМ251 (1 мкМ) 2-AГ утрачивал способность увеличивать амплитуду постсинаптических потенциалов (рис. 3в), что позволяет предположить, что 2-AГ реализует свое потенцирующее действие в отношении размера квантов АХ, специфически активируя пресинаптические СB1-рецепторы и запуская, таким образом, сигнальный каскад, направленный на стимуляцию транспорта АХ в везикулы. Аналогичный эффект 2-АГ был получен нами и в нервно-мышечных синапсах m. EDL. В присутствии 2-АГ (1 мкМ) в моторных синапсах этой мышцы также наблюдалось выраженное увеличение амплитуды МПКП по сравнению с контролем (рис. 4). Как и в нервно-мышечных препаратах диафрагмы, вызванное 2-АГ возрастание амплитуд МПКП не сопровождалось изменениями частоты спонтанной секреции АХ: в контроле значение этого параметра МПКП составило 0.40 ± 0.06 Гц (n = 19), а в присутствии 2-АГ – 0.45 ± 0.05 Гц (n = 24, p > > 0.05). Под действием 2-АГ аналогично тому, что происходило в моторных синапсах диафрагмы мыши, в синапсах m.EDL было зарегистрировано увеличение амплитуд ПКП по всему ходу короткого высокочастотного залпа при неизменном уровне квантового состава ПКП (рис. 4а). Блокирование СB1-рецепторов AM251 (1 мкМ) в синапсах m. EDL, как и в диафрагмальных синапсах, эффективно предотвращало 2АГ-индуцируемое увеличение амплитуд спонтанных и вызванных постсинаптических потенциалов (рис. 4б). Полученный результат однозначно свидетельствует об облегчающем СB1-опосредованном действии 2-АГ на нервно-мышечную передачу вне зависимости от типа исследуемой мышцы.
Рис. 4.
2-АГ усиливает вызванную стимуляцией нерва синаптическую передачу в моторных синапсах длинного разгибателя пальцев (m. EDL). Изменение амплитуды (слева) и квантового состава ПКП (справа) по ходу залпа в контроле (n = 19) и под действием 1 мкМ 2-АГ (n = 22). На врезке – средняя амплитуда МПКП в контроле и на фоне 2-АГ (а). Изменение амплитуды (слева) и квантового состава ПКП (справа) по ходу залпа в контроле (n = 18) и под действием 2-АГ в присутствии обратного агониста CB1-рецепторов АМ251 (1 мкМ) (n = 20). На врезке – средняя амплитуда МПКП в контроле и на фоне 2-АГ в присутствии AM251 (б). ★ – p < 0.05 по сравнению с контролем.
Очевидно, что в основе потенцирования вызванной секреции АХ под действием 2-АГ лежит иной механизм, чем при действии АЭА. Если в случае с АЭА усиление нервно-мышечной передачи реализуется за счет количества синхронно секретируемых квантов АХ в ответ на стимуляцию нерва, то в случае 2-АГ количество выбрасываемых в ответ на нервный импульс из терминали квантов остается неизменным, но увеличивается размер каждого одиночного кванта АХ. В подтверждение этому в нашей предыдущей работе было выявлено, что прирост амплитуд МПКП, зарегистрированных на нерассеченных нервно-мышечных препаратах диафрагмы при действии 2-АГ, полностью предотвращается ингибированием везикулярного транспортера АХ везамиколом (1 мкМ) [20]. Таким образом, наблюдаемый на фоне 2-АГ прирост амплитуды как МПКП, так и ПКП при регистрации вызванной активности моторных синапсов является, по-видимому, следствием усиления транспорта АХ в синаптические везикулы, т.е. обусловлен изменением процессов, протекающих на пресинаптическом уровне. Совсем недавно в условиях длительного воздействия синтетического агониста CB-рецепторов на моторные синапсы мыши была выявлена принципиальная возможность каннабиноид-индуцированного увеличения размера квантов АХ [18].
Известно, что усиление работы везикулярного транспортера АХ в моторных синапсах может быть связано с пресинаптической активностью PKA [32–34]. Действительно, для CB-рецепторов была показана возможность функциональной сцепки c Gs-белками, которые при активации CB-рецепторов стимулируют активность аденилатциклазы, что приводит к увеличению уровня cAMP в терминали и возрастанию активности РKА [35, 36]. В связи с этим требовалось экспериментально проверить предположение, что сигнальный путь, запускаемый действием 2-АГ в моторных синапсах мыши, может приводить к активации PKA и тем самым в конечном итоге к усилению везикулярного транспорта и увеличению размера одиночных квантов АХ.
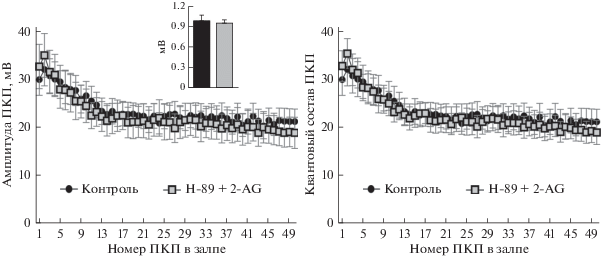
Для проверки данного предположения мы исследовали влияние 2-АГ на секрецию АХ в нервно-мышечных синапсах на фоне ингибитора PKA – Н-89 (1 мкМ). Сам по себе Н-89 не оказывает влияния на параметры ни спонтанной, ни вызванной нервно-мышечной активности [21, 33, 34]. Однако в присутствии H-89 2-AГ утрачивал способность увеличивать амплитуды постсинаптических потенциалов как спонтанных МПКП, так ПКП в коротких высокочастотных залпах (рис. 5). Тем самым мы показали, что увеличение размера кванта АХ, обусловленное действием 2-АГ, действительно происходит с участием PKA.
Рис. 5.
2-AГ-индуцированное увеличение амплитуд МПКП и ПКП, вызванных стимуляцией нерва в моторных синапсах диафрагмы, требует участия PKA. Изменение амплитуды (слева) и квантового состава ПКП по ходу залпа (справа) в контроле (n = 15) и под действием 1 мкМ 2-АГ в присутствии 1 мкМ ингибитора PKA H-89 (n = 20). На врезке – средняя амплитуда МПКП в контроле и на фоне 2-АГ в присутствии H-89.
Суммируя представленные в данной работе результаты, можно заключить, что нами впервые получены сведения о возможности неканонического потенцирующего действия не только на спонтанную (в покое), но и на вызванную секрецию АХ при ритмической залповой активности синапсов двух классических эндогенных каннабиноидов, АЭА и 2-АГ. Мы показали, что оба эндоканнабиноида способны потенцировать вызванный выброс АХ, действуя пресинаптически (и, вероятнее всего, через одни и те же СВ1-рецепторы). При этом облегчение нервно-мышечной передачи в случае действия АЭА и 2-АГ проявляется через потенцирование разных параметров секреции АХ (возрастание квантового состава ПКП или размеров квантов АХ, соответственно) и реализацию принципиально разных механизмов с вовлечением, по всей видимости, разных сигнальных каскадов.
В настоящее время происходит пересмотр классических представлений об однозначных и традиционно тормозных эффектах каннабиноидов даже в синапсах ЦНС. Способность эндоканнабиноидов оказывать облегчающее действие на вызванную секрецию медиаторов хоть и считается примером их неканонической активности, но подкрепляется в последнее время все большим числом свидетельств [37–41]. Обсуждается возможность сопряжения эндоканнабиноидных рецепторов не только с Gi-, но и Gq-, а также Gs-типами G-белков. Так, в определенных синапсах ЦНС стимуляция СВ1-рецепторов увеличивает уровень cAMP, что является (хотя и непрямым) доказательством активации эндоканнабиноидами Gs-белков, приводящей к развитию неканонических эффектов [35, 36].
Показано также, что активация одного и того же типа пресинаптических СВ1-рецепторов разными синтетическими агонистами или эндогенными лигандами, такими как АЭА или 2-АГ, может сопровождаться запуском множества сигнальных каскадов [42–44]. Это явление, получившее название смещенного агонизма, выражается в виде развития широкого спектра модулирующих эффектов в синапсах [18–20, 44]. Функциональное разнообразие последствий активации CB-рецепторов в настоящее время объясняется наличием разных конформационных состояний рецепторов, имеющих потенциальное сродство к разным G-белкам. От того, какой агонист действует на CB-рецептор, зависит стабилизация этого рецептора в конформационном состоянии, обеспечивающим активацию G-белков с определенного составом субъединиц и последующим запуском сигнальных путей, причем не обязательно тормозящих секрецию медиатора [45, 46]. Кроме смещенного агонизма при анализе синаптических эффектов эндоканнабиноидов необходимо учитывать возможность запуска G-белок-независимых сигнальных путей за счет рекрутирования к СB-рецепторам β-аррестинов с последующей активацией сигнальных каскадов с участием митоген-активируемых протеинкиназ или системы аденилатциклаза/cAMP, что может приводить к вариабельным функциональным последствиям [45, 47, 48].
Подобное разнообразие эффектов эндоканнабиноидов и механизмов их реализации также было выявлено и в нашей работе.
Является ли обнаруженное нами неканоническое острое облегчающее действие двух классических эндоканнабиноидов на вызванную квантовую секрецию АХ следствием их избирательной активности именно в периферических моторных синапсах, или же оно отражает специфику тонического экзогенного действия этих сигнальных молекул, отличную от эффектов эндоканнабиноидов, выделяющихся в моторных синапсах эндогенно при определенных режимах их функционирования, – вопросы, которые предстоит выяснить в дальнейших специальных исследованиях.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа поддержана грантом РФФИ 19-04-00616а.
Соответствие принципам этики. Все применимые международные, национальные и институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Nicolussi S., Gertsch J. 2015. Endocannabinoid transport revisited. Vitam. Horm. 98, 441–485. https://doi.org/10.1016/bs.vh.2014.12.011
Silver R.J. 2019. The Endocannabinoid system of animals. Animals. 9, 686. https://doi.org/10.3390/ani9090686
Zou S., Kumar U. 2018. Cannabinoid receptors and the endocannabinoid system: Signaling and function in the central nervous system. Int. J. Mol. Sci. 19, 833. https://doi.org/10.3390/ijms19030833
Cristino L., Bisogno T., Di Marzo V. 2020. Cannabinoids and the expanded endocannabinoid system in neurological disorders. Nat. Rev. Neurol. 16, 9–29. https://doi.org/10.1038/s41582-019-0284-z
Sugiura T., Kondo S., Sukagawa A., Nakane S., Shinoda A., Itoh K., Yamashita A., Waku K. 1995. 2-arachidonoylglycerol: A possible endogenous cannabinoid receptor ligand in brain. Biochem. Biophys. Res. Commun. 215, 89–97. https://doi.org/10.1006/bbrc.1995.2437
Chevaleyre V., Takahashi K.A., Castillo P.E. 2006. Endocannabinoid-mediated synaptic plasticity in the CNS. Annu. Rev. Neurosci. 29, 37–76. https://doi.org/10.1146/annurev.neuro.29.051605.112834
Kreitzer A.C., Regehr W.G. 2002. Retrograde signaling by endocannabinoids. Curr. Opin. Neurobiol. 12, 324–330. https://doi.org/10.1016/S0959-4388(02)00328-8
Lovinger D.M. 2008. Presynaptic modulation by endocannabinoids. Handb. Exp. Pharmacol. 184, 435–477. https://doi.org/10.1007/978-3-540-74805-2_14
Kano M., Ohno-Shosaku T., Hashimotodani Y., Uchigashima M., Watanabe M. 2009. Endocannabinoid-mediated control of synaptic transmission. Physiol. Rev. 89, 309–380. https://doi.org/10.1152/physrev.00019.2008
Castillo P.E., Younts T.J., Chávez A.E., Hashimotodani Y. 2012. Endocannabinoid signaling and synaptic function. Neuron. 76, 70–81. https://doi.org/10.1016/j.neuron.2012.09.020
Cavuoto P., McAinch A.J., Hatzinikolas G., Janovská A., Game P., Wittert G.A. 2007. The expression of receptors for endocannabinoids in human and rodent skeletal muscle. Biochem. Biophys. Res. Commun. 364, 105–110. https://doi.org/10.1016/j.bbrc.2007.09.099
Crespillo A., Suárez J., Bermúdez-Silva F.J., Rivera P., Vida M., Alonso M., Palomino A., Lucena M., Serrano A., Pérez-Martín M., Macias M., Fernández-Llébrez P., Rodríguez de Fonseca F. 2011. Expression of the cannabinoid system in muscle: Effects of a high-fat diet and CB1 receptor blockade. Biochem. J. 433, 175–185. https://doi.org/10.1042/BJ20100751
Hutchins-Wiese H.L., Li Y., Hannon K., Watkins B.A. 2012. Hind limb suspension and long-chain omega-3 PUFA increase mRNA endocannabinoid system levels in skeletal muscle. J. Nutr. Biochem. 23, 986–993. https://doi.org/10.1016/j.jnutbio.2011.05.005
Maccarrone M., Bab I., Bíró T., Cabral G.A., Dey S.K., Di Marzo V., Konje J.C., Kunos G., Mechoulam R.,Pacher P., Sharkey K.A., Zimmer A. 2015. Endocannabinoid signaling at the periphery: 50 years after THC. Trends Pharmacol. Sci. 36, 277–296. https://doi.org/10.1016/j.tips.2015.02.008
Van der Kloot W. 1994. Anandamide, a naturally-occurring agonist of the cannabinoid receptor, blocks adenylate cyclase at the frog neuromuscular junction. Brain Res. 649, 181–184. https://doi.org/10.1016/0006-8993(94)91062-6
Sánchez-Pastor E., Trujillo X., Huerta M., Andrade F. 2007. Effects of cannabinoids on synaptic transmission in the frog neuromuscular junction. J. Pharmacol. Exp. Ther. 321, 439–445. https://doi.org/10.1124/jpet.106.116319
Silveira P.E., Silveira N.A., de Cássia Morini V., Kushmerick C., Naves L.A. 2010. Opposing effects of cannabinoids and vanilloids on evoked quantal release at the frog neuromuscular junction. Neurosci. Lett. 473, 97–101. https://doi.org/10.1016/j.neulet.2010.02.026
Morsch M., Protti D.A., Cheng D., Braet F., Chung R.S., Reddel S.W., Phillips W.D. 2018. Cannabinoid-induced increase of quantal size and enhanced neuromuscular transmission. Sci. Rep. 8, 4685. https://doi.org/10.1038/s41598-018-22888-4
Gaydukov A.E., Dzhalagoniya I.Z., Tarasova E.O., Balezina O.P. 2020. The participation of endocannabinoid receptors in the regulation of spontaneous synaptic activity at neuromuscular junctions of mice. Biochemistry (Moscow) Suppl. Ser. A: Membr. Cell Biol. 14, 7–16. https://doi.org/10.1134/S1990747819060059
Тарасова Е.О., Хоткина Н.А., Гайдуков А.Е., Балезина О.П. 2021. Потенциация спонтанной секреции ацетилхолина в моторных синапсах мыши под действием 2-арахидоноилглицерина и анандамида. Вестник Московского университета. Сер. 16. Биология. 76, 3–9.
Tarasova, E.O., Miteva A.S., Gaidukov A.E., Balezina O.P. 2015. The role of adenosine receptors and L-type calcium channels in the regulation of the mediator secretion in mouse motor synapses. Biochemistry (Moscow). Suppl. Ser. A: Membr. Cell Biol. 9, 318–328. https://doi.org/10.1134/S1990747815050141
Gaydukov A.E., Bogacheva P.O., Balezina O.P. 2019. The participation of presynaptic alpha7 nicotinic acetylcholine receptors in the inhibition of acetylcholine release during long-term activity of mouse motor synapses. Neurochem. J. 13, 20–27. https://doi.org/10.1134/s1819712419010082
McLachlan E.M., Martin A.R. 1981. Non-linear summation of end-plate potentials in the frog and mouse. J. Physiol. 311, 307–324. https://doi.org/10.1113/jphysiol.1981.sp013586
Ruiz R., Cano R., Casañas J.J., Gaffield M.A., Betz W.J., Tabares L. 2011. Active zones and the readily releasable pool of synaptic vesicles at the neuromuscular junction of the mouse. J. Neurosci. 31, 2000–2008. https://doi.org/10.1523/JNEUROSCI.4663-10.2011
Miteva A.S., Gaydukov A.E., Shestopalov V.I., Balezina O.P. 2018. Mechanism of P2X7 receptor-dependent enhancement of neuromuscular transmission in pannexin 1 knockout mice. Purin. Signal. 14, 459–469. https://doi.org/10.1007/s11302-018-9630-7
Gaydukov A.E., Melnikova S.N., Balezina O.P. 2009. Facilitation of acetylcholine secretion in mouse motor synapses caused by calcium release from depots upon activation of L-type calcium channels. Bull. Exp. Biol. Med. 148, 163–166. https://doi.org/10.1007/s10517-009-0678-9
Tarasova E.O., Gaydukov A.E., Balezina O.P. 2015. Methods of activation and the role of calcium/calmodulin-dependent protein kinase II in the regulation of acetylcholine secretion in the motor synapses of mice. Neurochem. J. 9, 101–107. https://doi.org/10.1134/S1819712415020099
Gaydukov A.E., Tarasova E.O., Balezina O.P. 2013. Calcium-dependent phosphatase calcineurin downregulates evoked neurotransmitter release in neuromuscular junctions of mice. Neurochem. J. 7, 29–33. https://doi.org/10.1134/S1819712413010030
Urbano F.J., Depetris R.S., Uchitel O.D. 2001. Coupling of L-type calcium channels to neurotransmitter release at mouse motor nerve terminals. Pflügers Arch. 441, 824–831. https://doi.org/10.1007/s004240000489
Flink M.T., Atchison W.D. 2003. Iberiotoxin-induced block of Ca2+-activated K+ channels induces dihydropyridine sensitivity of ACh release from mammalian motor nerve terminals. J. Pharmacol. Exp. Ther. 305, 646–652. https://doi.org/10.1124/jpet.102.046102
Pagani R., Song M., McEnery M., Qin N., Tsien R.W., Toro L. Stefani E., Uchitel O.D. 2004. Differential expression of alpha 1 and beta subunits of voltage dependent Ca2+ channel at the neuromuscular junction of normal and P/Q Ca2+ channel knockout mouse. Neuroscience, 123, 75–85. https://doi.org/10.1016/j.neuroscience.2003.09.019
Gaydukov A.E., Bogacheva P.O., Balezina O.P. 2016. Calcitonin gene-related peptide increases acetylcholine quantal size in neuromuscular junctions of mice. Neurosci. Lett. 628, 17–23. https://doi.org/10.1016/j.neulet.2016.06.014
Van Der Kloot W., Benjamin W.B., Balezina O.P. 1998. Calcitonin gene-related peptide acts presynaptically to increase quantal size and output at frog neuromuscular junctions. J. Physiol. 507, 689–695. https://doi.org/10.1111/j.1469-7793.1998.689bs.x
Gaydukov A.E, Bogacheva P.O., Tarasova E.O., Molchanova A.I., Miteva A.S., Pravdivceva E.S., Bale-zina O.P. 2019. Regulation of acetylcholine quantal release by coupled thrombin/BDNF signaling in mouse motor synapses. Cells. 8, 762. https://doi.org/10.3390/cells8070762
Glass M., Felder C.C. 1997. Concurrent stimulation of cannabinoid CB1 and dopamine D2 receptors augments cAMP accumulation in striatal neurons: Evidence for a G(s) linkage to the CB1 receptor. J. Neurosci. 17, 5327–5333. https://doi.org/10.1523/jneurosci.17-14-05327.1997
Abadji V., Lucas-Lenard J.M., Chin C.N., Kendall D.A. 1999. Involvement of the carboxyl terminus of the third intracellular loop of the cannabinoid CB1 receptor in constitutive activation of G(s). J. Neurochem. 72, 2032–2038. https://doi.org/10.1046/j.1471-4159.1999.0722032.x
Xu J.Y., Zhang J., Chen C. 2012. Long-lasting potentiation of hippocampal synaptic transmission by direct cortical input is mediated via endocannabinoids. J. Physiol. 590, 2305–2315. https://doi.org/10.1113/jphysiol.2011.223511
Cui Y., Prokin I., Xu H., Delord B., Genet S., Venance L., Berry H. 2016. Endocannabinoid dynamics gate spike- timing dependent depression and potentiation. ELife. 5, e13185. https://doi.org/10.7554/eLife.13185
Silva-Cruz A., Carlström M., Ribeiro J.A., Sebastião A.M. 2017. Dual influence of endocannabinoids on long-term potentiation of synaptic transmission. Front. Pharmacol. 8, 921. https://doi.org/10.3389/fphar.2017.00921
Augustin S.M., Lovinger D.M. 2018. Functional relevance of endocannabinoid-dependent synaptic plasticity in the central nervous system ACS Chem. Neurosci. 9, 2146–2161. https://doi.org/10.1021/acschemneuro.7b00508
Piette C., Cui Y., Gervasi N., Venance L. 2020. Lights on endocannabinoid-mediated synaptic potentiation. Front. Mol. Neurosci. 13, 132. https://doi.org/10.3389/fnmol.2020.00132
Varga E., Georgieva T., Tumati S., Alves I., Salamon Z., Tollin G.,Yamamura H.I., Roeske W.R. 2008. Functional selectivity in cannabinoid signaling. Curr. Mol. Pharmacol. 1, 273–284. https://doi.org/10.2174/1874467210801030273
Laprairie R.B., Bagher A.M., Kelly M.E.M., Dupré D.J., Denovan-Wright, E.M. 2014. Type 1 cannabinoid receptor ligands display functional selectivity in a cell culture model of striatal medium spiny projection neurons. J. Biol. Chem. 289, 24845–24862. https://doi.org/10.1074/jbc.M114.557025
Diez-Alarcia R., Ibarra-Lecue I., Lopez-Cardona Á.P., Meana J., Gutierrez-Adán A., Callado L.F., Agirregoitia E., Urigüen L. 2016. Biased agonism of three different cannabinoid receptor agonists in mouse brain cortex. Front. Pharmacol. 7, 415. https://doi.org/10.3389/fphar.2016.00415
Finlay D.B., Cawston E.E., Grimsey N.L., Hunter M.R., Korde A., Vemuri V.K., Makruyannis A., Glass M. 2017. Gαs signalling of the CB1 receptor and the influence of receptor number. Br. J. Pharmacol. 174, 2545–2562. https://doi.org/10.1111/bph.13866
Di Marzo V. 2018. New approaches and challenges to targeting the endocannabinoid system. Nat. Rev. Drug Discov. 17, 623–639. https://doi.org/10.1038/nrd.2018.115
Ibsen M.S., Connor M., Glass M. 2017. Cannabinoid CB1 and CB2 receptor signaling and bias. Cannabis Cannabinoid Res. 2, 48–60. https://doi.org/10.1089/can.2016.0037
Morales P., Bruix M., Jiménez M.A. 2020. Structural insights into β-arrestin/cb1 receptor interaction: Nmr and cd studies on model peptides. Int. J. Mol. Sci. 21, 1–18. https://doi.org/10.3390/ijms21218111
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


