Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 2, стр. 116-125
Эффекты лития и селективных ингибиторов натрий-кальциевого обменника на генерируемые им транспортные токи в нейронах и HEK293 клетках
С. И. Бойков a, Н. Н. Шестакова a, С. М. Антонов a, Д. А. Сибаров a, *
a Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
* E-mail: dsibarov@gmail.com
Поступила в редакцию 28.05.2021
После доработки 28.06.2021
Принята к публикации 01.07.2021
- EDN: HGZDGA
- DOI: 10.31857/S0233475522010054
Аннотация
Натрий-кальциевый обменник (NCX) имеет большое значение в поддержании внутриклеточного кальциевого баланса нейронов и является регулятором глутаматергической синаптической передачи. Дисфункции NCX связаны с развитием разнообразных нейродегенеративных и психических заболеваний, а фармакологические агенты, модулирующие NCX (специфические антагонисты, аллостерические модуляторы, ионы лития и др.), рассматриваются в качестве потенциальных лекарственных препаратов. Тем не менее, действие селективных блокаторов обменника и ионов лития на электрогенный транспорт NCX в нейронах ранее не изучалось. В настоящем исследовании методом patch-clamp регистрации трансмембранных токов в нейронах неокортекса в первичной культуре и в клетках линии HEK293 мы исследуем влияние селективных антагонистов NCX – KB-R7943 и SN6 на вольт-амперные характеристики (ВАХ) клеток, а также изучаем эффект ионов лития как нетранспортируемого субстратного ингибитора NCX на генерируемые NCX транспортные токи. В нейронах коры транспортный ток, создаваемый NCX, вносит вклад в ВАХ нейронов, который можно выявить при ингибировании NCX блокаторами KB-R7943 и SN6. При использовании пипеточного раствора, не содержащего Ca2+ ([Ca2+]i < 100 нМ), можно регистрировать выходящий транспортный ток обменника только в обратном режиме работы при деполяризации нейронов, но не в прямом режиме работы при потенциале покоя. Пипеточный раствор с высоким содержанием свободного Ca2+ ([Ca2+]i > 1000 нМ) позволяет смоделировать условия, требующие активации NCX, и выявлять прямой режим работы NCX при отрицательных значениях мембранного потенциала. Замена Na+ на Li+ во внеклеточном растворе подавляет транспортный ток NCX как в нейронах, так и в клетках HEK293. Однако в отличие от HEK293, на нейронах замена свыше 50% Na+ на Li+ во внеклеточном растворе приводит к ингибированию не только NCX, но и других натрий-зависимых электрогенных транспортных механизмов, что сопровождается падением входного сопротивления, существенно затрудняя выявление транспортных токов, создаваемых NCX. Таким образом, здесь мы демонстрируем возможность прямого изучения особенностей транспорта NCX и его фармакологических характеристик на нейронах и HEK293 клетках.
ВВЕДЕНИЕ
Основной вклад в процесс выведения кальция из нейронов и глиальных клеток в центральной нервной системе вносит натрий-кальциевый обменник (NCX) плазматической мембраны. Дисфункции NCX вовлечены в патогенез разнообразных нейродегенеративных и психических заболеваний: инсульта и ишемии [1–3], различных форм склероза [4, 5], болезни Альцгеймера [6], эпилепсии [7], нейропатической боли [8] и других. Различные изоформы NCX экспрессированы в плазматической мембране большинства живых клеток, где они осуществляют транспорт кальция путем обмена одного иона Ca2+ на три иона Na+ за счет натриевого градиента плазматической мембраны [9]. Такая стехиометрия объясняет электрогенность, так как за один транспортный цикл переносится 1 положительный заряд (число переноса для Na+ = 1). В нейронах в основном экспрессируются изоформы NCX1 и NCX3 [10]. NCX3, в отличие от NCX1, может функционировать в отсутствии ATP [11], что увеличивает выживаемость нейронов при ишемическом падении уровня ATP и стрессе, вызываемом гиперактивацией глутаматом [12]. Существует также калий-зависимый натрий-кальциевый обменник (NCKX), изоформы которого экспрессируются некоторыми подтипами нейронов (см. обзор [13]). Вклад NCKX в транспорт кальция особенно заметен в нейронах сетчатки, мозжечка и гиппокампа, но незначителен в нейронах коры [13, 14]. Кроме того, NCKX нечувствителен к действию селективного блокатора NCX KB-R7943 (KBR), поэтому его ток в нейронах нельзя выявить с помощью этого блокатора [15].
В нормальных условиях NCX выводит кальций из цитоплазмы наружу клетки (прямой режим работы) и генерирует входящий ток. При падении натриевого градиента (повышение внутриклеточной концентрации Na+) NCX переходит в обратный режим работы, закачивая кальций в клетку, и создает выходящий трансмембранный ток.
Распространенным модельным объектом для изучения функций NCX являются кардиомиоциты как клетки с чрезвычайно высокой конститутивной экспрессией обменника [16]. Транспортный ток NCX ингибируется ионами никеля [17]. Большинство электрофизиологических работ выполнено на кардиомиоцитах или в искусственных системах с гиперэкспрессией заданных изоформ NCX: HEK293 [18], CCL39 [19], BHK [20] клетках. Имеются единичные публикации, в которых изучались вольт-амперные характеристики (ВАХ) транспортных токов NCX, нативно экспрессированного нейронами гиппокампа [21, 22] или коры [1]. В этих работах авторы применяли неспецифические ингибиторы NCX – никель, ифенпродил и Ro 25-6981, а не селективные блокаторы подобные KBR или SN6.
Влияние KBR и лития на функционирование NCX в нейронах представляет большой интерес, поскольку ранее было показано, что KBR [23], а также ионы лития [24] непрямым образом усиливают кальций-зависимую десенситизацию NMDA-рецепторов, по-видимому, за счет подавления работы NCX, колокализованного с рецепторами в мембранных плотиках [24, 25]. При этом литий используется в настоящее время как лекарственный препарат для терапии нервных и психических расстройств [26]. Имеются экспериментальные данные, что KBR способен подавлять вызываемую 4-аминопиридином эпилептиформную активность в коре мозга крыс [27]. Сходным кальций-зависимым эффектом на NMDA-рецепторы обладают также и другие потенциальные модуляторы NCX, в частности этанол [28] и амитриптилин [29]. Таким образом, управляя уровнем примембранного внутриклеточного кальция, NCX способен модулировать функционирование возбуждающей глутаматергической синаптической передачи в нервной системе.
Ингибиторы NCX, в частности KBR, одинаково эффективно блокируют как обратный, так и прямой режим работы обменника [16]. В отсутствие активной генерации потенциалов действия концентрация внутриклеточного кальция в нейронах не достигает порога активации NCX (cм. обзор [30]). В связи с этим применение ингибиторов NCX позволяет выявлять только ток, соответствующий обратному режиму работы обменника. Для выявления прямого режима работы NCX требуется загрузка кальция в цитоплазму в качестве субстрата для транспорта [1, 16] и снижение концентрации внеклеточного кальция [16].
Следует отметить, несмотря на значение NCX в поддержании внутриклеточного Ca2+-баланса нейронов и возможное применение его антагонистов в качестве лекарственных препаратов, действие селективных блокаторов NCX и ионов лития на его электрогенный транспорт в нейронах ранее не изучалось. Учитывая ключевую роль регуляции внутриклеточного Ca2+ в мембранных микродоменах нейронов для функционирования синаптической передачи и десенситизации NMDA-рецепторов, прямое измерение транспортного тока NCX в нейронах представляет большой интерес. В настоящем исследовании на нейронах коры и HEK293 клетках мы выявляем трансмембранные токи, создаваемые NCX в клетках культуры ткани, с использованием селективных ингибиторов обменника KBR и SN6, а также различных концентраций ионов лития как нетранспортируемого субстратного ингибитора NCX [31].
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на первичной культуре нейронов коры большого мозга, полученного из эмбрионов крыс линии Вистар [32]. На 16–17 день пренатального развития (E16–E17) выделяли ткань неокортекса и культивировали при 37°C и 5% CO2 в питательной среде Neurobasal (Invitrogen, США) c ростовой добавкой B-27 (Invitrogen) на покровных стеклах, покрытых поли-D-лизином.
Часть экспериментов выполняли на культуре клеток HEK293, которые высаживали на стекла, покрытые поли-L-лизином, как было описано ранее [33, 34].
Эксперименты на нейронах проводили на 10–14 день культивирования, а опыты на клетках HEK293 через сутки культивирования. В опытах применяли внеклеточный раствор следующего состава (мМ): NaCl 144, KCl 2.8, HEPES 10, CaCl2 1, MgCl2 1 (pH 7.2–7.4, доводили NaOH). Кроме того, во внеклеточный раствор добавляли нифедипин 10 мкМ и тетродотоксин 100 нМ для блокады кальциевых и натриевых потенциал-чувствительных каналов. В ряде экспериментов применяли внеклеточный раствор, в котором NaCl был заменен на LiCl в эквимолярных количествах для субстратного ингибирования работы NCX. Использовали два пипеточных раствора: (1) без добавления кальция и (2) с высоким содержанием свободного кальция ([Ca2+]i > 1000 нМ), чтобы обеспечить внутриклеточный субстрат для работы NCX в прямом режиме работы. Раствор (1) следующего состава (мМ): CsF 120, CsCl 10, HEPES 10, EGTA 10, ATP-Na 2 (pH 7.2–7.4, доводили с помощью CsOH). Ожидаемая внутриклеточная концентрация свободного кальция <100 нМ. Раствор (2) следующего состава (мМ): CsF 120, CsCl 10, HEPES 10, EGTA 10.5, CaCl2 10, ATP-Na 2 (pH 7.2–7.4, доводили с помощью CsOH). Вычисленная концентрация свободного кальция в растворе (2) составляла 1240 нМ (MAXCHELATOR software by Chris Patton). В пипеточном растворе обязательно присутствовала ATP, необходимая для работы NCX (см. обзор [30]). Экспериментально измеренный [35] жидкостный потенциал между внеклеточным и пипеточным раствором (liquid junction potential, LJP) составил около 10 мВ. Данные в статье приведены с учетом коррекции на LJP.
Используя протоколы плавного пилообразного (ramp-протокол) и скачкообразного (step-протокол) изменения мембранного потенциала (Vm), измеряли ВАХ клеток. Регистрацию трансмембранных токов нейронов проводили методом patch-clamp в конфигурации “целая клетка” с использованием стеклянных микропипеток (Sutter BF150-86-10) с сопротивлением кончика 4–6 МОм. Регистрацию токов осуществляли при помощи усилителя MultiClamp 700B (Molecular Devices, США) с системой сбора данных DigiData 1440A под управлением программы pClamp 10. Быструю смену внеклеточного раствора проводили системой быстрой локальной перфузии с многоканальным кончиком, расположенным в 300–500 мкм от сомы регистрируемого нейрона.
Для сравнения групп, состоящих из нескольких опытов, применяли парный критерий Стьюдента. Группы измерений считали достоверно различающимися при уровне доверительной вероятности p < 0.05. На графиках звездочками показаны различные уровни статистически значимых различий: *p < 0.05, **p < 0.01.
Для выявления токов NCX применяли его специфические блокаторы (Tocris, Великобритания): KB-R7943 (KBR, 2-[2-[4-(4-нитробензилокси)фенил]этил]изотиомочевина метан сульфонат) и SN6 (2-[[4-[(4-нитрофенил)метокси]фенил]метил]-4-тиазолидинкарбоксиловая кислота этиловый эфир). Остальные реактивы поставлены Sigma-Aldrich, США.
РЕЗУЛЬТАТЫ
Для выявления токов NCX в нейронах применяли селективные ингибиторы KBR или SN6 в концентрации 10 мкМ, заведомо и многократно превышающие значения IC50 ингибирования обменника. Применяли пипеточный раствор (1), не содержащий кальция. Запись ВАХ нейрона в конфигурации целой клетки в диапазоне от –100 до +60 мВ (рис. 1а) показала обратимое уменьшение тока при аппликации и последующей отмывке обоих ингибиторов (рис. 1б). Разница токов (a – b) в контроле и в присутствии ингибиторов (рис. 1в) соответствовала вкладу транспортного тока, переносимому NCX, в ВАХ нейронов. Усредненные по нескольким нейронам значения токов NCX выявили одинаковый эффект KBR и SN6. Наибольшая величина ингибирования тока NCX выявлялась при положительных потенциалах, а потенциал реверсии составил Vrev ≈ –30 мВ.
Рис. 1.
Вольт-амперные характеристики (ВАХ) нейронов коры, полученные при плавном изменении мембранного потенциала в контроле и при ингибировании тока обменника специфическими блокаторами. а – Экспериментальный протокол изменения командного потенциала от –100 до +60 мВ. б – ВАХ трансмембранных токов при применении командного потенциала (а), зарегистрированные в контроле (Кон.), в присутствии KBR (10 мкМ) или SN6 (10 мкМ) и после отмывки ингибиторов (Отм.). в – Получение ВАХ NCX как разности токов (a – b) в отсутствие (а) и присутствии (b) во внеклеточном растворе ингибиторов NCX. г – Наложение средних ВАХ транспортных токов NCX, полученных из нескольких опытов: KBR (n = 6), SN6 (n = 6). Области с заливкой иллюстрируют стандартную ошибку среднего.
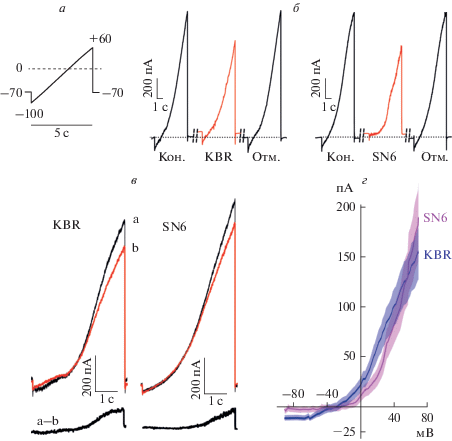
KBR и SN6 считаются ингибиторами обратного режима работы NCX, наблюдаемого при положительных потенциалах, что соответствует выходящему току обменника и входу кальция в цитоплазму. Однако при использовании обычного пипеточного раствора, не содержащего кальций, при отрицательных мембранных потенциалах NCX испытывает дефицит внутриклеточного субстрата, т.е. ионов Ca2+, для транспорта во внеклеточное пространство. В результате в наших экспериментах ингибирование транспортного тока NCX при Vm < Vrev в 5–30 раз слабее, чем при Vm > Vrev.
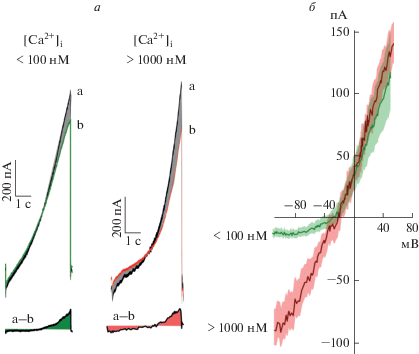
Для того чтобы выявить прямой режим работы обменника, нами был использован пипеточный раствор (2) с расчетной концентрацией свободного кальция >1000 нМ, что многократно превышает Kd связывания кальция обменником (~200 нМ для NCX1, [36]) (рис. 2а). При использовании бескальциевого внутриклеточного раствора наблюдается изгиб ВАХ ингибирования обменника при отрицательных значениях Vm (рис. 2б), а в присутствии высокой концентрации внутриклеточного кальция KBR демонстрирует приблизительно одинаковую степень ингибирования тока, создаваемого NCX, при положительных и отрицательных мембранных потенциалах. Таким образом, повышение цитоплазматического кальция позволяет выявить прямой транспортный ток NCX при отрицательных значениях Vm.
Рис. 2.
Вольт-амперные характеристики (ВАХ) транспортных токов NCX нейронов коры, полученные при ингибировании тока обменника 10 мкМ KBR. a – ВАХ нейронов, зарегистрированные в контроле (a) и в присутствии KBR (b) при использовании пипеточного раствора без кальция (слева) и пипеточного раствора с содержанием свободного кальция >1000 нМ (справа). Разница токов a – b характеризует транспортный ток NCX, ингибируемый блокатором. б – Наложение средних ВАХ обменника, полученных из нескольких опытов для пипеточных растворов с низким ([Ca2+]i < 100 нМ, n = 8) и высоким ([Ca2+]i > 1000 нМ, n = 5) содержанием свободного кальция. Области с заливкой иллюстрируют стандартную ошибку среднего.
Еще одним способом ингибирования работы NCX является замена ионов Na+ во внеклеточном растворе на ионы Li+, которые не транспортируются обменником [31]. Частичная 15% замена Na+ на Li+ ингибировала трансмембранный ток, демонстрируя ВАХ ингибированного тока, сходную с таковой у NCX по форме и величине потенциала реверсии (рис. 3а). Однако ВАХ тока, ингибируемого более высокими концентрациями лития 50 и 100%, демонстрировали отсутствие тока или вход тока при положительных потенциалах мембраны, что не соответствует работе NCX. По-видимому, это связано с тем, что в нейронах внеклеточный Li+ ингибирует все натрий-зависимые процессы, включая транспортеры нейромедиаторов, и сопровождается неквантовым освобождением глутамата [37]. При этом затруднено выявление транспортных токов NCX из-за падения входного сопротивления клеток. Для того чтобы оценить, является ли ток, ингибируемый литием, током NCX хотя бы при 15% замене Na+ на Li+, мы сравнили эффект KBR в контроле и в присутствии 15% Li+. В отсутствие Li+ KBR ингибировал ток, создаваемый NCX, на ~60 и ~130 пА при мембранных потенциалах –70 и +50 мВ соответственно. Однако в присутствии 15% Li+ KBR ингибировал ток только на ~13–15 пА при тех же мембранных потенциалах (рис. 3б). Таким образом, ингибирование KBR тока NCX в присутствии Li+ многократно ослабевает, что говорит в пользу ингибирования литием тока NCX.
Рис. 3.
Вольт-амперные характеристики (ВАХ) ингибирования литием натрий-зависимых транспортных токов, полученные на нейронах с применением различных протоколов при разных концентрациях внеклеточного лития. а – Усредненные ВАХ (n = 5) тока, ингибируемого в отдельном нейроне различными концентрациями лития. Вставка демонстрирует ramp-протокол применения командного потенциала. б – Усредненные ВАХ (n = 5) тока, ингибируемого 15% литием и 15% литием в присутствии 10 мкМ KBR, полученные при применении протокола (а). в – Протокол изменения командного потенциала ступеньками напряжения (step-протокол) и пример токов, ингибируемых различными концентрациями лития. г – Средние значения (n = 6) токов, ингибируемых в нейронах различными концентрациями лития, полученные при применении протокола (в).
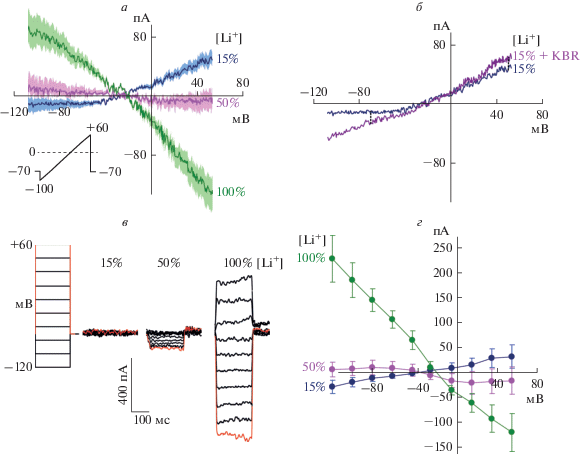
При использовании протокола плавного изменения командного потенциала (ramp-протокола) возникает вопрос о том, достигает ли ток обменника равновесия при каждом конкретном потенциале. Применение другого экспериментального протокола (step-протокола), в котором трансмембранные токи измеряли не при плавном изменении командного потенциала, а при использовании ступенек напряжения длительностью 200 мс и с шагом в 20 мВ от +60 до –120 мВ (рис. 3в) дает обменнику достаточное время для достижения равновесия. Сходные методики регистрации ВАХ ионных каналов широко применялись ранее, например, на астроцитах [38].
При использовании step-протокола были получены ВАХ (рис. 3г), не отличающиеся от ВАХ, полученных с использованием ramp-протокола, как по форме, так и по величине потенциала реверсии (Vrev ramp: –22 ± 4 мВ, n = 5; Vrev step: –19 ± 5, n = 6). Совпадение результатов указывает на рациональность использования обоих методов в наших экспериментах.
Вероятнее всего, на нейронах в условиях замены половины или всего внеклеточного Na+ на Li+ трудно выявить транспортный ток, соответствующий NCX, на фоне токов других натрий-зависимых обменников и ионных каналов. Таким образом, несмотря на ингибирование NCX литием, измерение токов NCX с его помощью в нейронах методически проблематично.
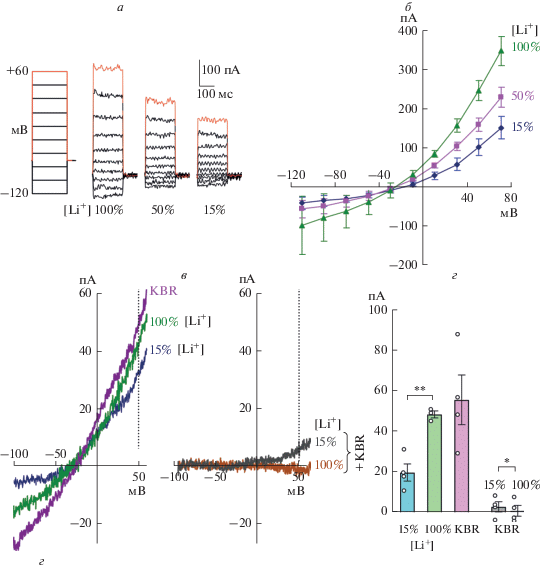
Для количественной оценки ингибирования тока NCX литием были использованы клетки линии HEK293 (рис. 4), обладающие достаточно высокой нативной экспрессией NCX1 [39], но не имеющие большинства натрий-зависимых обменников и ионных каналов, присущих нейронам. С использованием внутриклеточного раствора (2) с высоким содержанием Ca2+ мы провели измерение ВАХ тока, ингибируемого литием при использовании возрастающих концентраций лития (15, 50 и 100%) (рис. 4а). Степень ингибирования трансмембранного тока была пропорциональна концентрации ионов лития, а потенциал реверсии тока составил примерно –25 мВ (рис. 4б). При сравнении средних значений амплитуды ингибированных токов обменника при Vm = +50 мВ блокатором KBR и 100% заменой Na+ на Li+ (рис. 4в) достоверно не различалась (рис. 4г). При этом 15% замена Na+ на Li+ ингибировала ток обменника приблизительно наполовину от полного ингибирования (**p = 0.003, n = 4), так как KBR вызывал дополнительное ингибирование на фоне 15% Li+ (*p = 0.04, n = 4) (рис. 4в, 4г). На фоне 100% замены Na+ на Li+ дополнительного ингибирования тока при действии KBR не наблюдалось (рис. 4в, 4г), что говорит о полном ингибировании NCX в отсутствие внеклеточного Na+.
Рис. 4.
Вольт-амперные характеристики (ВАХ) транспортных токов NCX, нативно экспрессированного клетками HEK293, полученные при ингибировании обменника различными концентрациями лития. Использован пипеточный раствор с концентрацией свободного кальция >1000 нМ. а – Протокол изменения командного потенциала ступеньками напряжения (step) и пример токов, ингибируемых различными концентрациями лития. б – Средние значения токов, ингибируемых в нейронах различными концентрациями лития, полученные при применении протокола (а) (n = 5). в – Пример ВАХ токов, ингибируемых в отдельной клетке при применении 10 мкМ KBR, 100% и 15% замены Na+ на Li+ (левая панель), а также при применении KBR на фоне 15% или 100% замены Na+ на Li+ (правая панель). г – Средние значения амплитуды токов, ингибируемых KBR или Li+ при мембранном потенциале +50 мВ. Статистические различия групп по критерию Стьюдента (**p = 0.003, n = 4; *p = 0.04, n = 4).
ОБСУЖДЕНИЕ
В исследовании на нейронах коры мы показали, что регистрация трансмембранных токов в нейронах позволяет выявлять транспортные токи NCX при использовании селективных блокаторов последнего, в частности KBR и SN6. Различные методики применения командного потенциала – плавное (ramp-протокол) и ступеньки напряжения (step-протокол), демонстрируют одинаковую картину ВАХ транспортных токов обменника, несмотря на то что step-протокол дает обменнику больше времени для достижения равновесия. Если бы при применении ramp-протокола создаваемый обменником транспортный ток не достигал равновесия, мы наблюдали бы разницу ВАХ NCX между ramp- и step-протоколами. Такого расхождения не обнаружено.
Из уравнения потенциала реверсии NCX: Vrev = = RT/F(3 ln([Na+]out/[Na+]in) – ln([Ca2+]out/[Ca2+]in)), учитывая [Na+] = 2 мМ в пипеточном растворе и предполагая [Ca]in = 100 нМ, можно было бы ожидать значительного сдвига Vrev в область положительных потенциалов: Vrev = 25 мВ(3 ln(144/2) – ‒ ln(1/0.000100)) = +90 мВ. Однако экспериментально измеренный потенциал реверсии был в районе –30 мВ. Вероятно, это связано с отсутствием полного диализа цитоплазмы и существенной разницей между концентрацией ионов в пипеточном растворе и в примембранной области. В частности, даже при [Na+] = 2 мМ в пипеточном растворе, его вычисленное значение в примембранной области цитоплазмы может составлять около 17 мМ [40].
При использовании обычного пипеточного раствора без кальция можно выявить ток обменника только в обратном режиме работы (выход натриевого тока и вход кальция). Пипеточный раствор с высоким (>1000 нМ) содержанием свободного кальция позволяет смоделировать условия, требующие активации NCX и выявлять прямой режим работы NCX при потенциале покоя менее –70 мВ.
Мы не наблюдали значительного изменения потенциала реверсии NCX при многократном увеличении концентрации кальция в пипеточном растворе, что вероятно объясняется тем, что для сохранения постоянства Vrev многократное увеличение [Ca2+]in может быть скомпенсировано физиологически нормальным увеличением [Na+]in.
При работе на нейронах частичная 15% замена внеклеточного Na+ на Li+ вызывает ингибирование тока обменника, что уменьшает эффективность KBR. Однако концентрация ионов лития >15% вызывает ингибирование также других электрогенных натрий-зависимых обменников и ионных каналов, токи которых суммируются с током обменника, что не позволяет измерять транспортный ток NCX в “чистом” виде.
Клетки HEK293 не экспрессируют большинство присущих нейронам натрий-зависимых обменников (NCKX, транспортеры глутамата EAAT, транспортеры ГАМК) или ионных каналов (ионотропные рецепторы медиаторов, потенциал-зависимые натриевые и кальциевые каналы). На этих клетках частичная замена Na+ на Li+ во внеклеточном растворе вызывала ингибирование тока NCX. При этом степень ингибирования была прямо пропорциональна внеклеточной концентрации ионов Li+. Полная 100% замена Na+ на Li+ ингибировала ток обменника полностью, поэтому добавление KBR не вызывало дополнительного ингибирования. Напротив, 15% замена Na+ на Li+ частично ингибировала ток NCX, так что на фоне 15% [Li+] KBR вызывал дополнительное ингибирование.
Ранее нами было показано, что KBR и Li+ вызывают значительное уменьшение токов через NMDA-рецепторы за счет усиления кальций-зависимой десенситизации последних [23, 24]. При этом сами по себе KBR и Li+ не вызывали ингибирования токов рецепторов в отсутствие внеклеточного кальция. Полумаксимальные эффективные концентрации ингибирования NMDA-рецепторов KBR (5.3 мкМ) [23] и Li+ (32% замена Na+ на Li+) [24], измеренные в присутствии 1 мМ Ca2+, соответствуют полумаксимальным эффективным концентрациям ингибирования этими веществами NCX. Это подтверждает большое функциональное значение NCX в модуляции функций рецепторов, подверженных кальций-зависимой десенситизации.
Таким образом, замена Na+ на Li+ во внеклеточном растворе позволяет эффективно ингибировать токи NCX как в нейронах, так и в клетках HEK293. Следует отметить, что нативные HEK293 клетки являются хорошим объектом для исследования NCX, так как их ВАХ имеют значительный компонент, обеспечиваемый транспортными токами. В отличие от HEK293, на нейронах замена Na+ на Li+ ингибирует не только NCX, но и другие электрогенные транспортные механизмы, что затрудняет выявление транспортных токов NCX.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 20-515-18 008 Болг_а). Работа выполнялась в рамках государственного задания ИЭФБ РАН тема AAAA-A18-118012290427-7. Работа выполнена с использованием ресурсов центра коллективного пользования ИЭФБ РАН.
Соответствие принципам этики. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Molinaro P., Cuomo O., Pignataro G., Boscia F., Sirabella R., Pannaccione A., Secondo A., Scorziello A., Adornetto A., Gala R., Viggiano D., Sokolow S., Herchuelz A., Schurmans S., Di Renzo G., Annunziato L. 2008. Targeted disruption of Na+/Ca2+ exchanger 3 (NCX3) gene leads to a worsening of ischemic brain damage. J. Neurosci. 28, 1179–1184. https://doi.org/10.1523/JNEUROSCI.4671-07.2008
Pignataro G., Gala R., Cuomo O., Tortiglione A., Giaccio L., Castaldo P., Sirabella R., Matrone C., Canitano A., Amoroso S., Di Renzo G., Annunziato L. 2004. Two sodium/calcium exchanger gene products, NCX1 and NCX3, play a major role in the development of permanent focal cerebral ischemia. Stroke. 35, 2566–2570. https://doi.org/10.1161/01.STR.0000143730.29964.93
Cerullo P., Brancaccio P., Anzilotti S., Vinciguerra A., Cuomo O., Fiorino F., Severino B., Di Vaio P., Di Renzo G., Annunziato L., Pignataro G. 2018. Acute and longterm NCX activation reduces brain injury and restores behavioral functions in mice subjected to neonatal brain ischemia. Neuropharmacology. 135, 180–191. https://doi.org/10.1016/j.neuropharm.2018.03.017
Casamassa A., La Rocca C., Sokolow S., Herchuelz A., Matarese G., Annunziato L., Boscia F. 2016. Ncx3 gene ablation impairs oligodendrocyte precursor response and increases susceptibility to experimental autoimmune encephalomyelitis. Glia 64, 1124–1137. https://doi.org/10.1002/glia.22985
Anzilotti S., Brancaccio P., Simeone G., Valsecchi V., Vinciguerra A., Secondo, Petrozziello T., Guida N., Sirabella R., Cuomo O., Cepparulo P., Herchuelz A., Amoroso A.S., Di Renzo G., Annunziato L., Pignataro G. 2018. Preconditioning, induced by sub-toxic dose of the neurotoxin L-BMAA, delays ALS progression in mice and prevents Na+/Ca2+ exchanger 3 downregulation. Cell Death Dis. 9, 206. https://doi.org/10.1038/s41419-017-0227-9
Pannaccione A., Secondo A., Molinaro P., D’Avanzo C., Cantile M., Esposito A., Boscia F., Scorziello A., Sirabella R., Di Renzo G., Annunziato L. 2012. A new concept: Abeta1-42 generates a hyperfunctional proteolytic NCX3 fragment that delays caspase-12 activation and neuronal death. J. Neurosci. 32, 10 609–10 617. https://doi.org/10.1523/JNEUROSCI.6429-11.2012
Kawanai T., Taruta A., Inoue A., Watanabe R., Ago Y., Hashimoto H., Hasebe S., Ooi Y., Takuma K., Matsuda T. 2015. Decreased expression of hippocampal Na+/Ca2+ exchanger isoform-1 by pentylenetetrazole kindling in mice. Epilepsy Res. 115, 109–112. https://doi.org/10.1016/j.eplepsyres.2015.06.002
Huang Y., Wen L.L., Xie J.D., Ouyang H.D., Chen D.T., Zeng W.A. 2019. Antinociceptive effectiveness of the inhibition of NCX reverse-mode action in rodent neuropathic pain model. Mol. Pain. 15, 1744806919864511. https://doi.org/10.1177/1744806919864511
Blaustein M.P., Lederer W.J. 1999. Sodium/calcium exchange: Its physiological implications. Physiol. Rev. 79, 763–854. https://doi.org/10.1152/physrev.1999.79.3.763
Thurneysen T., Nicoll D.A., Philipson K.D., Porzig H. 2002. Sodium/calcium exchanger subtypes NCX1, NCX2 and NCX3 show cell-specific expression in rat hippocampus cultures. Mol. Brain Res. 107 (2), 145–156. https://doi.org/10.1016/s0169-328x(02)00461-8
Secondo A., Staiano R.I., Scorziello A., Sirabella R., Boscia F., Adornetto A., Valsecchi V., Molinaro P., Canzoniero L.M., Di Renzo G., Annunziato L. 2007. BHK cells transfected with NCX3 are more resistant to hypoxia followed by reoxygenation than those transfected with NCX1 and NCX2: Possible relationship with mitochondrial membrane potential. Cell Calcium 42, 521–535. https://doi.org/10.1016/j.ceca.2007.01.006
Bano D., Young K.W., Guerin C.J., Lefeuvre R., Rothwell N.J., Naldini L., Rizzuto R., Carafoli E., Nicotera P. 2005. Cleavage of the plasma membrane Na+/Ca2+ exchanger in excitotoxicity. Cell. 120 (2), 275–285. https://doi.org/10.1016/j.cell.2004.11.049
Altimimi H.F., Schnetkamp P.P. 2007. Na+/Ca2+-K+ exchangers (NCKX): Functional properties and physiological roles. Channels (Austin). 1 (2), 62–69. https://doi.org/10.4161/chan.4366
Kiedrowski L., Czyz A., Baranauskas G., Li X.F., Lytton J. 2004. Differential contribution of plasmalemmal Na/Ca exchange isoforms to sodium-dependent calcium influx and NMDA excitotoxicity in depolarized neurons. J. Neurochem. 90, 117–128. https://doi.org/10.1111/j.1471-4159.2004.02462.x
Iwamoto T., Kita S., Uehara A., Inoue Y., Taniguchi Y., Imanaga I., Shigekawa M. 2001. Structural domains influencing sensitivity to isothiourea derivative inhibitor KB-R7943 in cardiac Na+/Ca2+ exchanger. Mol. Pharmacol. 59 (3), 524–531. https://doi.org/10.1124/mol.59.3.524
Kimura J., Watano T., Kawahara M., Sakai E., Yatabe J. 1999. Direction independent block of bi-directional Na+/Ca2+ exchange current by KBR7943 in guinea-pig cardiac myocytes. Br. J. Pharmacol. 128, 969–974. https://doi.org/10.1038/sj.bjp.0702869
Wang Z., Nolan B., Kutschke W., Hill J.A. 2001. Na+-Ca2+ exchanger remodeling in pressure overload cardiac hypertrophy. J. Biol. Chem. 276 (21), 17706–17711. https://doi.org/10.1074/jbc.M100544200
Cross J.L., Boulos S., Shepherd K.L., Craig A.J., Lee S., Bakker A.J., Knuckey N.W., Meloni B.P. 2012. High level over-expression of different NCX isoforms in HEK293 cell lines and primary neuronal cultures is protective following oxygen glucose deprivation. Neurosci. Res. 73 (3), 191–198. https://doi.org/10.1016/j.neures.2012.04.007
Iwamoto T., Uehara A., Nakamura T.Y., Imanaga I., Shigekawa M. 1999. Chimeric analysis of Na+/Ca2+ exchangers NCX1 and NCX3 reveals structural domains important for differential sensitivity to external Ni2+ or Li+. J. Biol. Chem. 274 (33), 23094–23102. https://doi.org/10.1074/jbc.274.33.23094
Secondo A., Staiano R.I., Scorziello A., Sirabella R., Boscia F., Adornetto A., Valsecchi V., Molinaro P., Canzoniero L.M., Di Renzo G., Annunziato L. 2007. BHK cells transfected with NCX3 are more resistant to hypoxia followed by reoxygenation than those transfected with NCX1 and NCX2: Possible relationship with mitochondrial membrane potential. Cell Calcium 42, 521–535. https://doi.org/10.1016/j.ceca.2007.01.006
Brittain M.K., Brustovetsky T., Brittain J.M., Khanna R., Cummins T.R., Brustovetsky N. 2012. Ifenprodil, a NR2B-selective antagonist of NMDA receptor, inhibits reverse Na+/Ca2+ exchanger in neurons. Neuropharmacol. 63 (6), 974–982. https://doi.org/10.1016/j.neuropharm.2012.07.012
Brustovetsky T., Brittain M.K., Sheets P.L., Cummins T.R., Pinelis V., Brustovetsky N. 2011. KB-R7943, an inhibitor of the reverse Na+/Ca2+ exchanger, blocks N-methyl-D-aspartate receptor and inhibits mitochondrial complex I. Br. J. Pharmacol. 162, 255–270. https://doi.org/10.1111/j.1476-5381.2010.01054.x
Sibarov D.A., Abushik P.A., Poguzhelskaya E.E., Bolshakov K.V., Antonov S.M. 2015. Inhibition of plasma membrane Na/Ca-exchanger by KB-R7943 or lithium reveals its role in Ca-dependent N-methyl-D-aspartate receptor inactivation. J. Pharmacol. Exp. Ther. 355 (3), 484–495. https://doi.org/10.1124/jpet.115.227173
Sibarov D.A., Poguzhelskaya E.E., Antonov S.M. 2018. Downregulation of calcium-dependent NMDA receptor desensitization by sodium-calcium exchangers: A role of membrane cholesterol. BMC Neurosci. 19 (1), 73. https://doi.org/10.1186/s12868-018-0475-3
Sibarov D.A., Antonov S.M. 2018. Calcium-dependent desensitization of NMDA receptors. Biochemistry (Moscow), 83 (10), 1173–1183. https://doi.org/10.1134/S0006297918100036
Can A., Schulze T.G., Gould T.D. 2014. Molecular actions and clinical pharmacogenetics of lithium therapy. Pharmacol. Biochem. Behav. 123, 3–16. https://doi.org/10.1016/j.pbb.2014.02.004
Hernandez-Ojeda M., Ureña-Guerrero M.E., Gutierrez-Barajas P.E., Cardenas-Castillo J.A., Camins A., Beas-Zarate C. 2017. KB-R7943 reduces 4-aminopyridine-induced epileptiform activity in adult rats after neuronal damage induced by neonatal monosodium glutamate treatment. J. Biomed. Sci. 24 (1), 27. https://doi.org/10.1186/s12929-017-0335-y
Boikov S.I., Sibarov D.A., Antonov S.M. 2020. Ethanol inhibition of NMDA receptors in calcium-dependent and -independent modes. Biochem. Biophys. Res. Commun. 522, 1046–1051. https://doi.org/10.1016/j.bbrc.2019.12.007
Stepanenko Y.D., Boikov S.I., Sibarov D.A., Abushik P.A., Vanchakova N.P., Belinskaia D., Shestakova N.N., Antonov S.M. 2019. Dual action of amitriptyline on NMDA receptors: Enhancement of Ca-dependent desensitization and trapping channel block. Sci. Rep. 9 (1), 19454. https://doi.org/10.1038/s41598-019-56072-z
Török T.L. 2007. Electrogenic Na+/Ca2+-exchange of nerve and muscle cells. Progr. Neurobiol. 82 (6), 287–347. https://doi.org/10.1016/j.pneurobio.2007.06.003
Giladi M., Lee S.Y., Refaeli B., Hiller R., Chung K.Y., Khananshvili D. 2019. Structure-dynamic and functional relationships in a Li+-transporting sodium-calcium exchanger mutant. Biochim. Biophys. Acta Bioenerg. 1860 (3), 189–200. https://doi.org/10.1016/j.bbabio.2018.11.015
Mironova E.V., Evstratova A.A., Antonov S.M. 2007. A fluorescence vital assay for the recognition and quantification of excitotoxic cell death by necrosis and apoptosis using confocal microscopy on neurons in culture. J. Neurosci. Methods, 163(1), 1–8. https://doi.org/10.1016/j.jneumeth.2007.02.010
Qian A., Buller A.L., Johnson J.W. 2005. NR2 subunit dependence of NMDA receptor channel block by external Mg2+. J. Physiol. 562, 319–331. https://doi.org/10.1113/jphysiol.2004.076737
Sibarov D.A., Boikov S.I., Karelina T.V., Antonov S.M. 2020. GluN2 subunit-dependent redox modulation of NMDA receptor activation by homocysteine. Biomolecules. 10, 1441. https://doi.org/10.3390/biom10101441
Neher E. 1992. Correction for liquid junction potentials in patch clamp experiments. Meth. Enzymol. 207, 123–131. https://doi.org/10.1016/0076-6879(92)07008-c
Giladi M., Boyman L., Mikhasenko H., Hiller R., Khananshvili D. 2010. Essential role of the CBD1–CBD2 linker in slow dissociation of Ca2+ from the regulatory two-domain tandem of NCX1. J. Biol. Chem. 285 (36), 28117–28125. https://doi.org/10.1074/jbc.M110.127001
Antonov S.M., Magazanik L.G. 1988. Intense non-quantal release of glutamate in an insect neuromuscular junction. Neurosci. Lett. 93 (2–3), 204–208. https://doi.org/10.1016/0304-3940(88)90082-1
Kucheryavykh Y.V., Shuba Y.M., Antonov S.M., Inyushin M.Y., Cubano L., Pearson W.L., Kurata H., Reichenbach A., Veh R.W., Nichols C.G., Eaton M.J., Skatchkov S.N. 2008. Complex rectification of Müller cell Kir currents. Glia. 56 (7), 775–790. https://doi.org/10.1002/glia.20652
Rosker C., Graziani A., Lukas M., Eder P., Zhu M.X., Romanin C., Groschner K. 2004. Ca2+ signaling by TRPC3 involves Na+ entry and local coupling to the Na+/Ca2+ exchanger. J. Biol. Chem. 279 (14), 13 696–13 704. https://doi.org/10.1074/jbc.M308108200
Quinn F.R., Currie S., Duncan A.M., Miller S., Sayeed R., Cobbe S.M., Smith G.L. 2003. Myocardial infarction causes increased expression but decreased activity of the myocardial Na+-Ca2+ exchanger in the rabbit. J. Physiol. 553 (Pt 1), 229–242. https://doi.org/10.1113/jphysiol.2003.050716
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


