Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 2, стр. 126-137
Роль иммобилизованной фракции фосфолипидов в инициации свертывания крови в условиях потока
А. Д. Мегалинский a, c, В. М. Логинова b, c, А. М. Шибеко c, Ф. И. Атауллаханов a, b, c, d, М. А. Пантелеев a, b, c, d, Д. Ю. Нечипуренко a, c, d, *
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
b Московский физико-технический институт (государственный университет)
115184 Москва, Россия
c Центр теоретических проблем физико-химической фармакологии РАН
109029 Москва, Россия
d Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии
им. Дмитрия Рогачева Минздрава России
117198 Москва, Россия
* E-mail: ne4ipur@gmail.com
Поступила в редакцию 20.04.2021
После доработки 24.05.2021
Принята к публикации 26.05.2021
- EDN: MIGEDI
- DOI: 10.31857/S0233475522020049
Аннотация
Локализованная наработка тромбина является центральным событием в процессе гемостатического ответа организма на повреждение сосудистой стенки: данный белок приводит к необратимой активации тромбоцитов, а также отвечает за формирование фибриновой сети, прочно скрепляющей гемостатический сгусток. Традиционно считается, что поток оказывает сильное ингибирующее действие на протекание реакций плазменного звена гемостаза, и наработка тромбина может происходить в областях, защищенных от размывающего действия потока крови: например, внутри тромбоцитарного агрегата или в субэндотелиальном матриксе. Однако экспериментальные данные указывают на возможность полимеризации фибрина in vitro при артериальных скоростях сдвига в отсутствие тромбоцитов. В данной работе на основе соотнесения результатов моделирования с полученными экспериментальными данными было показано, что в условиях артериальных скоростей сдвига инициация свертывания крови может происходить благодаря наличию иммобилизованной фракции фосфолипидов в области, имитирующей поврежденную сосудистую стенку. Полученные результаты свидетельствуют о том, что связывание факторов свертывания с фосфолипидами обеспечивает защиту начальных этапов плазменного свертывания от потока и приводит к быстрой наработке тромбина даже в условиях артериальных скоростей течения крови. Таким образом, полученные данные позволяют предположить, что в некоторых условиях активация плазменного звена гемостаза может предшествовать и способствовать активации и агрегации тромбоцитов.
ВВЕДЕНИЕ
Одной из важнейших проблем современной коагулологии является понимание механизмов, регулирующих тромбообразование в условиях артериального русла. На сегодняшний день остается неопределенной роль плазменного звена гемостаза на начальных этапах формирования артериального тромба и гемостатической пробки. Считается, что в условиях артериального кровотока ключевые реакции плазменного гемостаза могут активно проходить только в областях с малыми скоростями течения (например, в агрегате тромбоцитов) из-за эффекта сноса и разбавления активных молекул потоком. Однако ряд экспериментальных данных [1, 2] свидетельствует о возможности наработки тромбина и формирования фибрина в условиях артериальных скоростей сдвига в отсутствие тромбоцитов. Динамика процесса наработки тромбина и фибрина в условиях высоких (т.е. артериальных) скоростей сдвига, а также механизмы, отвечающие за этот феномен, остаются малоизученными.
Процесс плазменного гемостаза традиционно представляется в виде сети протеолитических реакций, называемых каскадом свертывания. Свертывание в большинстве случаев инициируется контактом компонентов плазмы с трансмембранным белком – тканевым фактором, который в норме присутствует только в экстраваскулярных клетках. Поэтому такой контакт возможен преимущественно в результате нарушения целостности сосудистой стенки. В процессе коагуляции участвует около 100 биохимических реакций, но только несколько из них идут особенно медленно по сравнению с остальными и в результате ограничивают скорость генерации тромбина [3–5]. Главным результатом работы каскада является превращение растворимого фибриногена в фибрин под действием тромбина, что приводит к полимеризации фибрина и желированию плазмы. Таким образом, достаточная наработка тромбина является необходимым условием для появления фибринового сгустка [5, 6].
Свертывание крови является пространственно неоднородным процессом, протекание которого зависит как от скоростей химических реакций, так и от транспорта ключевых молекул-участников в результате конвекции и диффузии. Известно, что в присутствии потока каскад реакций свертывания крови демонстрирует пороговое поведение по нескольким ключевым параметрам: скорости сдвига, концентрации тканевого фактора и размеру области повреждения [1, 2, 7]. Молекулярные механизмы, регулирующие инициацию свертывания в условиях потока и определяющие значения соответствующих порогов, на сегодняшний день остаются предметом исследований.
Известно, что наличие фосфолипидных поверхностей может на порядки ускорять протекание важнейших реакций каскада свертывания в гомогенных системах без потока [6], однако вопрос о роли неподвижной относительно потока фракции фосфолипидов в свертывании на сегодняшний день остается открытым [8]. Возможность связывания молекул-участников каскада с фосфолипидными мембранами может являться важным фактором, защищающим процессы активации от ингибирующего действия потока, однако прямая экспериментальная проверка этой гипотезы является крайне нетривиальной задачей, так как фосфолипиды также напрямую ускоряют реакции свертывания.
Данная работа посвящена исследованию роли иммобилизованной фракции фосфолипидов в начальных этапах плазменного свертывания в потоке при помощи объединения экспериментальных подходов in vitro с методами компьютерного моделирования. Первая часть статьи посвящена экспериментальному анализу свертывания плазмы в in vitro системе, где этот процесс инициировался рекомбинантным (релипидированным) тканевым фактором в составе фосфолипидных микровезикул, которые сорбируются на поверхности, содержащей полиэтиленимин, и поэтому являются неподвижными (иммобилизованными) относительно потока. Вторая часть статьи посвящена теоретическому анализу наблюдаемых в эксперименте явлений.
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты. Буфер А, состав: 150 мM NaCl, 2.7 мM KCl, 1 мM MgCl2, 0.4 мM NaH2PO4, 20 мM HEPES, 5 мM глюкоза, 0.5% бычий сывороточный альбумин (БСА), pH 7.4; БСА 0.5%, pH 7.4; БСА 2% в натрий-фосфатном буфере (Sigma–Aldrich); полидиметилсилоксан (ПДМС, Sylgard 184, Dow Cornig); полиэтиленимин (Sigma–Aldrich).
В качестве активирующего свертывание белка применяли тканевый фактор (ТФ) (RecombiPlasTin 2G, HemosIL), 10 нМ. В процессе инкубации соотношение объема раствора к поверхности составляло 0.05 мкл/мм2. При проведении экспериментов в проточных камерах использовались: человеческий фибриноген (Sigma–Aldrich), меченный флуоресцентной краской Alexa Fluor 647 (Invitrogen), среднее количество краски на 1 молекуле белка α = 4.92; ингибитор трипсина из кукурузы (КТИ) 5 мг/мл (Институт белка РАН, Пущино, Россия); гепарин натрия (B. Braun Melsungen) 1250 МЕ/мл в буферном растворе (HEPES); 3.2% цитрат натрия Na3C6H5O7 (pH 5.5); флуоресцентные микросферы (FluoSpheres Fluorescent Microspheres) 488 нм, d = 0.5 мкм, концентрация 0.29 × 109 шт/мкл; раствор конъюгата Annexin V-FITC.
Процедура мечения Annexin V. Аннексин конъюгировали с Alexa Fluor 647 с помощью реакции Alexa Fluor 647 NGS (Thermo Fisher) с белком в 0.2 М карбонатном буфере, рН 8.5. Соотношение аннексин : Alexa Fluor 647 NGS при синтезе составляло 1 : 5. Полученный конъюгат аннексин–Alexa Fluor 647 очищали от несвязавшейся краски гель-фильтрацией на колонке с Sephadex G-25 и характеризовали спектрофотометрически по поглощению аннексина при 280 нм (молярный коэффициент поглощения 24 000 М–1 с–1) и Alexa Fluor 647 при 650 нм (молярный коэффициент поглощения 270 000 М–1 с–1). Степень модификации белка составляла около 1–1.2 молекулы Alexa Fluor 647 на молекулу белка. В очищенный конъюгат аннексин–Alexa Fluor 647 добавляли азид натрия до 0.05% и хранили при +4°C [9].
Изготовление микрофлюидных камер. Для постановки экспериментов in vitro использовали плоскопараллельные проточные камеры из ПДМС c размерами каналов 10 000 × 500 × 50 мкм (рис. 1а). Для изготовления камер смесь ПДМС с отверждающим агентом в жидком состоянии наносили на кремниевую подложку с рельефной структурой, полученной методом фотолитографии, после чего подложку с ПДМС помещали в сухой термостат при температуре 60°C на 2 ч. Полимеризованный ПДМС, отделенный от подложки, повторяет ее рельеф. При его соединении с плоской поверхностью (подложка из поликарбоната) образуются герметичные полости, через которые в дальнейшем прокачиваются растворы. Для подсоединения подводящих трубочек в крайних точках этих полостей делаются сквозные отверстия (рис. 1б).
Рис. 1.
Экспериментальная система для анализа динамики свертывания плазмы в условиях потока. а – Схематическое изображение микрофлюидной камеры (вид сверху). Каждый канал имеет вход (справа), куда подается плазма, свободная от тромбоцитов, выход, откуда откачиваются все растворы при помощи шприцевого насоса, а также дополнительный вход для введения антикоагулянта в систему (гепарина), препятствующего свертыванию плазмы в соединительных трубках. Микрофлюидный чип содержит три эквивалентных канала и вакуумный контур для его прижатия к поликарбонату. Черным цветом показаны углубления в ПДМС, которые формируют каналы. Серым цветом – места прокола ПДМС для подсоединения трубок. Красным цветом показано положение полоски с тканевым фактором в собранной системе. б – Сверху: подложка из поликарбоната с нанесенным активатором (ТФ, красный цвет) – вид сверху. Снизу: собранный чип, вид сбоку в сечении вдоль одного из каналов. Красным цветом показана область с тканевым фактором. в – Общий вид экспериментальной системы. г – Схематичное указание веществ, находящихся в проточной камере в процессе эксперимента (вид сбоку). д – Средние значения и среднеквадратичные отклонения длин треков флуоресцентных шариков в промежутках 0–5 и 15–20 мин после захода плазмы в канал.
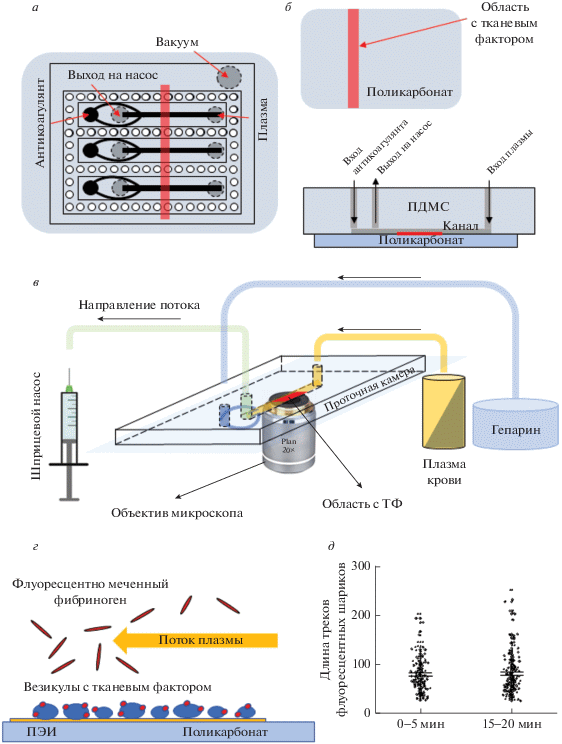
Подготовка подложки с активатором свертывания. Для имитации сосудистой стенки с ограниченной областью повреждения использовали поликарбонат. Очищенная поверхность пластины поликарбоната толщиной 100 мкм размерами 50 × 50 мм обрабатывали в низкотемпературной кислородной плазме (Harrick Plasma, Ithaca) при давлении 400 мторр в течение 5 мин. Затем на нее наносили 2.5% раствор полиэтиленимина и инкубировали в течение 15 мин, после чего высушивали.
В качестве активирующего свертывание белка применяли тканевый фактор (рекомбипластин, 10 нМ). Везикулы, содержащие тканевый фактор высокой плотности, локально наносили на поверхность поликарбоната с полиэтиленимином (в виде полоски размерами 1 × 30 мм) и инкубировались 30 мин (рис. 1б). Такая методика нанесения тканевого фактора приводит к величине поверхностной плотности порядка 60–120 молекул на квадратный микрон (определялась при помощи анализа генерации фактора Xa) и примерно соответствует плотности тканевого фактора на фибробластах человека [10].
Пластину поликарбоната с иммобилизованным тканевым фактором располагали относительно рельефной заготовки ПДМС так, чтобы полости для прокачивания жидкости были ориентированы перпендикулярно полоске с ТФ (рис. 1а, 1б). После этого к ПДМС подсоединяли подводящие трубочки. Места стыковок трубочек, поликарбоната и ПДМС герметизировали и через трубочки получившуюся проточную камеру заполняли 2% раствором бычьего сывороточного альбумина в натрий-фосфатном буфере.
Приготовление свободной от тромбоцитов плазмы. Для получения очищенной от тромбоцитов плазмы цельную кровь здоровых доноров с 5% раствором цитрата натрия центрифугировали 15 мин с ускорением 1000 g. Затем верхнюю фракцию (без осажденной эритромассы) центрифугировали повторно со скоростью 15 000 g в течение 5 мин, после чего отбирали 2/3 верхней фракции.
Эксперимент в микрофлюидных камерах. Для визуализации точного местоположения границы иммобилизованного тканевого фактора в проточной камере применяли 0.285 мкМ раствор конъюгата Annexin V-FITC в буфере А, обеспечивающий специфичное окрашивание микровезикул с ТФ благодаря кальций-зависимому связыванию аннексина с фосфатидилсерином. После определения положения границы активатора (по сигналу от Annexin V-FITC) в камеру повторно вносили 2% раствор альбумина для отмывания системы от аннексина, так как этот белок блокирует свертывание крови.
Перед введением плазмы крови в проточную камеру, к выходному отверстию камеры подавали раствор гепарина (1.25 МЕ/мл). Затем к плазме добавляли раствор хлорида кальция (до конечной концентрации 20 мМ), ингибитор контактного пути свертывания (КТИ 50 мкг/мл), а также человеческий фибриноген, меченный флуоресцентной краской Alexa Fluor 647 (0.29 мкМ, 25.4 мкг/мл). Конечная концентрация свободных ионов кальция (Са2+) после добавления к “цитратной” плазме раствора хлорида кальция (до расчетного уровня 20 мМ) составляла около 1 мМ, что соответствует физиологическому значению концентрации свободных ионов кальция. Начало эксперимента отсчитывалось от момента, когда в проточную камеру поступала плазма с концентрацией Са2+, восстановленной до физиологического уровня.
Для съемки использовали конфокальный микроскоп Zeiss AxioObserver Z1 в режиме эпифлуоресценции и в проходящем свете (рис. 1в, 1г). Анализ изображений проводили в программе ImageJ.
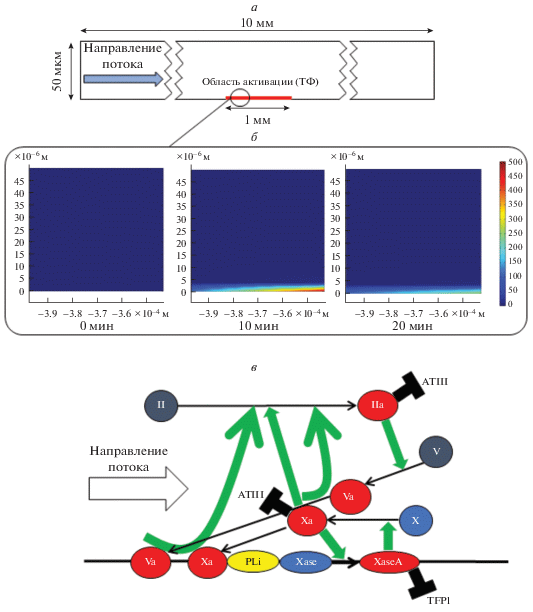
Компьютерное моделирование инициации свертывания в потоке. Описание кинетики наработки тромбина в экспериментальной системе проводили с помощью двумерной редуцированной математической модели свертывания плазмы крови, основанной на опубликованной ранее модели [7]. Редуцированная описывает динамику факторов свертывания в центральном сечении экспериментальной системы (рис. 2а, 2б): рассматривается двумерная область размером 50 мкм (соответствует высоте экспериментального канала) на 10 000 мкм (что соответствует протяженности канала вдоль направления потока плазмы).
Рис. 2.
Описание двумерной математической модели свертывания. а – Геометрические параметры модели. Размеры моделируемой проточной камеры – 10 000 × 50 мкм. б – Карты распределения концентрации тромбина в области, отстоящей на 130 мкм от первой в направлении потока границы с активатором для различных моментов времени; шкала соответствует значениям концентрации в единицах наномолей, результаты представлены для варианта модели с присутствием фосфолипидов. в – Схематическое изображение ключевых реакций плазменного звена свертывания, задействованных в математической модели. Здесь Xase – неактивная теназа (ТФ + фактор свертывания VII), XaseA – активная внешняя теназа (ТФ + фактор свертывания VII в активной форме), PLi – свободные фосфолипиды на поверхности, ATIII – антитромбин III. Черные стрелки соответствуют химическим реакциям, а зеленые – связям между ферментами, которые катализируют реакции, и соответствующими реакциями. Черные “молотки” обозначают реакции ингибирования ферментов (ингибиторы указаны рядом с “молотками”).
При моделировании потока плазмы крови применяли стандартные методы вычислительной гидродинамики: плазма крови описывалась как ньютоновская несжимаемая жидкость, а ее течение – уравнениями Навье–Стокса в стационарном приближении:
Граничные условия – отсутствие проскальзывания на областях, соответствующих стенкам камеры (u = 0), и постоянные давления на входе и выходе моделируемого участка системы (давление на входе подбиралось для достижения пристеночной скорости сдвига значения 1000 с–1, а давление на выходе бралось равным нулю).
Стационарные уравнения Навье–Стокса дополнялись нестационарными уравнениями, описывающими пространственно-временнýю динамику концентрации ключевых участников инициации каскада свертывания в рассматриваемой системе, т.е. нестационарными уравнениями типа конвекции–диффузии–реакции. Для этого была составлена упрощенная схема каскада свертывания крови, описывающая процесс образования тромбина по пути тканевого фактора (внешний путь свертывания) (рис. 2в). Такая система включает ключевые реакции, отвечающие за инициацию свертывания и описывает начальные этапы этого процесса.
Реакции были записаны в виде уравнений в соответствии с законом действующих масс, с соответствующими начальными условиями и параметрами (табл. 1), а также эффективными константами в случае ферментативных реакций (табл. 2). Уравнения разделены на несколько условных блоков с учетом геометрических особенностей модели (рис. 2а):
Таблица 1.
Начальные условия для переменных и значения постоянных параметров для веществ, входящих в математическую модель
| Обозначение | Начальное значение | Смысл величины |
|---|---|---|
| Xa, Va, IIa | $0$ | Концентрации факторов свертывания Xa, Va, IIa в объеме (переменные) |
| Xase | $0.9{\text{\;TF}}$ | Поверхностная плотность неактивной внешней теназы (переменная) |
| XaseA | $0.1{\text{\;TF\;}}$ | Поверхностная плотность активной внешней теназы (переменная) |
| TF | $60 \times {{10}^{{ - 12}}}$${{{\text{моль}}} \mathord{\left/ {\vphantom {{{\text{моль}}} {{{{\text{м}}}^{2}}}}} \right. \kern-0em} {{{{\text{м}}}^{2}}}}$ | Поверхностная плотность тканевого фактора (константа) |
| PLi | $2.4 \times {{10}^{{ - 7}}}$${{{\text{моль}}} \mathord{\left/ {\vphantom {{{\text{моль}}} {{{{\text{м}}}^{2}}}}} \right. \kern-0em} {{{{\text{м}}}^{2}}}}$ | Поверхностная плотность свободных (доступных) фосфолипидных молекул (переменная) |
| X | $1.7 \times {{10}^{{ - 4}}}$${{{\text{моль}}} \mathord{\left/ {\vphantom {{{\text{моль}}} {{{{\text{м}}}^{3}}}}} \right. \kern-0em} {{{{\text{м}}}^{3}}}}$ | Концентрация фактора свертывания X в объеме (константа) |
| II | $1.4 \times {{10}^{{ - 3}}}$${{{\text{моль}}} \mathord{\left/ {\vphantom {{{\text{моль}}} {{{{\text{м}}}^{3}}}}} \right. \kern-0em} {{{{\text{м}}}^{3}}}}$ | Концентрация фактора свертывания II в объеме (константа) |
| V | $2 \times {{10}^{{ - 5}}}$${{{\text{моль}}} \mathord{\left/ {\vphantom {{{\text{моль}}} {{{{\text{м}}}^{3}}}}} \right. \kern-0em} {{{{\text{м}}}^{3}}}}$ | Концентрация фактора свертывания V в объеме (константа) |
| ATIII | $3.4 \times {{10}^{{ - 3}}}$${{{\text{моль}}} \mathord{\left/ {\vphantom {{{\text{моль}}} {{{{\text{м}}}^{3}}}}} \right. \kern-0em} {{{{\text{м}}}^{3}}}}$ | Концентрация антитромбина III в объеме (константа) |
| XaB, VaB, XaVaB | 0 | Поверхностная плотность cвязанного с иммобилизованными липидами фактора Xа, Va и прототромбиназы (переменные) |
| VB | 0 | Поверхностная плотность cвязанного с иммобилизованными липидами фактора V |
| XaVa | 0 | Концентрация протромбиназы (комплекса XaVа) в объеме (переменная) |
Таблица 2.
Константы скоростей реакций, входящих в модель
| Параметр | Значение константы | Источник |
|---|---|---|
| ${\text{K}}_{{{\text{eff}}}}^{{{\text{X}},{\kern 1pt} {\text{XaseA}}}}$ | ${{10}^{5}}$${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,{\kern 1pt} {\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,{\kern 1pt} {\text{с}})}}$ | [11–13] |
| ${\text{K}}_{{{\text{eff}}}}^{{{\text{Xase}},{\kern 1pt} {\text{Xa}}}}$ | $4.5 \times {{10}^{3}}$${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [14] |
| ${{{\text{K}}}^{{{\text{VB}},{\kern 1pt} {\text{IIa}}}}}$ | $3.2 \times {{10}^{3}}$${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [15] |
| ${\text{K}}_{{\text{a}}}^{{{\text{Xa}},{\text{Va}}}}$ | $4.44 \times {{10}^{3}}$${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [16] |
| ${\text{K}}_{{\text{d}}}^{{{\text{XaVa}}}}$ | $2 \times {{10}^{{ - 3}}}$${1 \mathord{\left/ {\vphantom {1 {\text{с}}}} \right. \kern-0em} {\text{с}}}$ | [16] |
| ${\text{K}}_{{\text{a}}}^{{{\text{Va}},{\kern 1pt} {\text{PLi}}}}$ | 140 ${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [16] |
| ${\text{K}}_{{\text{d}}}^{{{\text{VaB}}}}$ | $4 \times {{10}^{{ - 4}}}$${1 \mathord{\left/ {\vphantom {1 {\text{с}}}} \right. \kern-0em} {\text{с}}}$ | [16] |
| ${\text{K}}_{{\text{a}}}^{{{\text{XaB}},{\kern 1pt} {\text{VaB}},{\kern 1pt} {\text{PLi}}}}$ | 44 400 ${{{{{\text{м}}}^{2}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{2}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [16] |
| ${\text{K}}_{{\text{a}}}^{{{\text{V}},{\kern 1pt} {\text{PLi}}}}$ | 140 ${{{{{\text{м}}}^{2}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{2}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [16] |
| ${\text{K}}_{{{\text{eff}}}}^{{{\text{II}},{\kern 1pt} {\text{XaVa}}}}$ | $3.6 \times {{10}^{5}}$${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [17] |
| ${\text{K}}_{{{\text{eff}}}}^{{{\text{II}},{\kern 1pt} {\text{Xa}}}}$ | 1.1 ${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [17, 18] |
| ${\text{K}}_{{\text{i}}}^{{{\text{Xa}}}}$ | 2.5 ${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [19] |
| ${\text{K}}_{{\text{i}}}^{{{\text{IIa}}}}$ | 5.6 ${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [20] |
| Ki_XaVa | 0.14 ${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [21] |
| ${{{\text{D}}}_{{{\text{Xa}}}}}$ | $6.17 \times {{10}^{{ - 11}}}$${{{{{\text{м}}}^{2}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{2}}} {\text{с}}}} \right. \kern-0em} {\text{с}}}$ | [22] |
| ${{{\text{D}}}_{{{\text{IIa}}}}}$ | $6.67 \times {{10}^{{ - 11}}}$${{{{{\text{м}}}^{2}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{2}}} {\text{с}}}} \right. \kern-0em} {\text{с}}}$ | [22] |
| ${{{\text{D}}}_{{{\text{Va}}}}}$ | $3.67 \times {{10}^{{ - 11}}}$${{{{{\text{м}}}^{2}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{2}}} {\text{с}}}} \right. \kern-0em} {\text{с}}}$ | [22] |
| ${\text{K}}_{{\text{d}}}^{{{\text{XaB}}}}$ | 0.5 ${1 \mathord{\left/ {\vphantom {1 {\text{с}}}} \right. \kern-0em} {\text{с}}}$ | [22] |
| ${\text{K}}_{{\text{d}}}^{{{\text{VB}}}}$ | $4 \times {{10}^{{ - 4}}}$${1 \mathord{\left/ {\vphantom {1 {\text{с}}}} \right. \kern-0em} {\text{с}}}$ | [22] |
| ${\text{K}}_{{\text{a}}}^{{{\text{Xa}},{\kern 1pt} {\text{PLi}}}}$ | 700 ${{{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{3}}} {({\text{моль}}\,\,{\text{с}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{с}})}}$ | [23] |
| nXa | 50 | [24] |
| nVa | 40 | [17, 25] |
| nV | 130 | [17, 25] |
| ${{{\text{K}}}^{{{\text{TFPI}}}}}$ | 0.002 ${1 \mathord{\left/ {\vphantom {1 {\text{с}}}} \right. \kern-0em} {\text{с}}}$ | [26] |
Поток веществ из области активатора (с поверхности в объем):
Реакции, происходящие на поверхности в области, имитирующей повреждение:
Уравнения для концентрации веществ в “объеме” системы:
Для всех границ вне активатора потоки веществ считались равными нулю (граничные условия для уравнений, описывающих объемные переменные).
В качестве программного инструмента для решения систем уравнений использовался пакет Comsol Multiphysics, использующий метод конечных элементов для численного решения дифференциальных уравнений в частных производных (https://www.comsol.ru/contact).
В модели течение Пуазейля в рассмотренной области возникает в результате численного решения стационарного уравнения Навье–Стокса для конечной области пространства (в связи с этим имеются незначительные отличия от аналитической формулы Пуазейля вблизи вертикальных границ рассматриваемой области).
Двумерное описание процессов в данной модели является следствием приближения однородности рассматриваемой системы в направлении Z (направление, перпендикулярное вертикальной плоскости симметрии канала). Так как ширина канала (500 мкм) на порядок превосходит его высоту, то процессы, происходящие вблизи вертикальной плоскости симметрии канала, можно считать однородными на расстояниях порядка 300 мкм по оси Z, так как на этих расстояниях скорости течения практически не зависят от Z. Двумерное описание, предложенное в данной работе, следует рассматривать как усреднение трехмерной модели процессов по некоторой эффективной толщине Z (толщине, на которой все процессы считаются однородными по Z). Таким образом, все величины, входящие в модель, сохраняют привычные трехмерные размерности, однако сама координата Z из описания уходит в силу приближения однородности процессов вдоль этой координаты.
РЕЗУЛЬТАТЫ
Экспериментальный анализ динамики формирования фибрина в условиях потока. Для получения пространственно-временнóй картины формирования фибринового сгустка при артериальных скоростях течения плазмы в отсутствие тромбоцитов, нами была разработана проточная система специальной геометрии (рис. 1а). Эксперимент состоял в прокачивании через проточную камеру свободной от тромбоцитов плазмы здоровых доноров с фиксированной скоростью сдвига (1000 c–1). При помощи методов флуоресцентной микроскопии детектировали процессы формирования фибринового сгустка в области активатора, после чего анализировали его пространственно-временная динамика.
Для оценки изменения скорости потока в ходе эксперимента проводилось измерение длины треков (т.е. “размытых” вдоль направления потока изображений) флуоресцентных шариков диаметром 0.5 мкм, добавляемых в плазму крови перед началом эксперимента. На рис. 1д представлены результаты анализа длин четко наблюдаемых треков (вне области полимеризации фибрина) для разных интервалов времени – в начале и ближе к концу типичного эксперимента. Большой разброс длин обработанных изображений шариков (при выдержке камеры 100 мс) связан с эпифлуоресцентным режимом съемки и наличием градиента скорости вблизи поверхности канала: на изображениях видны треки шариков, которые двигаются в разных горизонтальных плоскостях системы и ввиду существенного градиента скорости течения имеют разные скорости. Таким образом, примерное постоянство средней длины треков шариков на протяжении всего времени эксперимента свидетельствует об отсутствии значительного изменения скорости течения за время наблюдения.
Для исследования динамики полимеризации фибрина была построена зависимость усредненного сигнала флуоресценции в канале фибрина (фибриногена) от расстояния до границы начала активатора, представляющего собой иммобилизованные фосфолипидные везикулы, содержащие тканевый фактор.
Анализ данных проводился следующим образом: выделялась область во всем поле съемки (желтый контур размером 320 на 234 мкм, соответствующий области в центре канала вблизи границы активатора), и усреднялась интенсивность сигнала флуоресценции по оси y (рис. 3а). Таким образом, каждой точке по оси X соответствует усредненное значение интенсивности по вертикали.
Рис. 3.
Динамика полимеризации фибрина и результаты численного моделирования динамики плазменного свертывания в условиях артериального потока. a, сверху – Эпифлуоресцентные изображения области с активатором в канале флуоресцентно меченного фибриногена через 0, 5 и 20 мин после попадания плазмы на участок с тканевым фактором. Области с большей локальной концентрацией фибриногена (высоким значением интенсивности флуоресценции) соответствует большее количество фибрина. а, снизу – Вид интегральных кривых интенсивности сигнала флуоресценции (I) от меченого фибриногена при усреднении значений интенсивности по вертикальной оси (в условных единицах). Анализ данных проводился во всем поле зрения (желтая рамка). б – Кривые распределения локальной интенсивности флуоресценции от меченого фибриногена в пространстве с фиксированным шагом по времени от 0 до 20 мин. в – Зависимость положения начала фибринового сгустка относительно границы активатора от времени. Показаны средние значения и ошибки средних для N = 6 экспериментов. Точки для каждой индивидуальной кривой были выбраны путем сечения набора кривых из б горизонтальной прямой, соответствующей 10% от максимальной амплитуды изменения сигнала. Данную кривую можно также представить как зависимость времени начала полимеризации фибрина от положения по отношению к границе активатора. г – Кинетические кривые концентрации тромбина, снятые на расстоянии 1 мкм над центром области с активатором, в моделях с различными параметрами. Здесь черная кривая – модель со средней величиной поверхностной плотности тканевого фактора (60 × 10–12 моль/м2 или 36 молекул на квадратный микрон) в отсутствие фосфолипидов (PLi = 0); красная кривая – модель с высоким значением концентрации ТФ (20 × 10–11 моль/м2), наличием фосфолипидов (начальная концентрация доступных для связывания фосфолипидов PLi = 2.4 × 10–7 моль/м2) и в присутствии механизма ингибирования внешней теназы за счет ингибитора пути тканевого фактора (TFPI); синяя кривая – модель с высокой концентрацией ТФ (20 × 10–11 моль/м2 или 120 молекул на квадратный микрон) в отсутствие фосфолипидов (PLi = 0); зеленая кривая – модель с крайне высоким значением поверхностной плотности ТФ (60 × 10–11 моль/м2 или 360 молекул на квадратный микрон) в отсутствие фосфолипидов (PLi = 0). д – Сравнение репрезентативных экспериментальных данных по времени задержки появления фибринового сгустка в различных областях активатора и времени достижения пороговой концентрации тромбина в 1 нМ тромбина как функции расстояния до начала активатора (параметры соответствуют красной кривой на графике г).
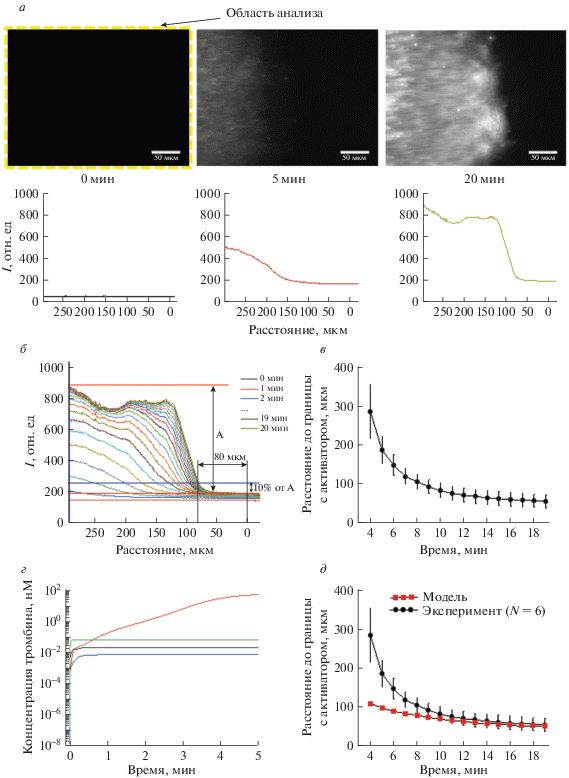
На рис. 3б показана динамика изменения профиля флуоресценции во времени для шести экспериментов. Представленные данные позволяют сделать следующие выводы:
1) появление фибрина на расстояниях более 200 мкм от начала области с активатором детектируется в течение нескольких минут от начала взаимодействия потока плазмы с активатором;
2) чем ближе рассматриваемая область к границе начала активатора (положение 0 по осям абсцисс на рис. 3а, 3б), тем позже детектируется появление фибрина (рис. 3б, 3в).
3) фибрин, как правило, не появляется на расстояниях ближе, чем 50 мкм от места повреждения, даже после 15 мин наблюдения: усредненный график демонстрирует выход на плато.
Так как процесс полимеризации фибрина зависит от активности тромбина, наблюдаемая кинетика свертывания свидетельствует о его быстрой наработке, несмотря на артериальные скорости сдвига и отсутствие тромбоцитов.
Для объяснения полученных результатов была использована редуцированная модель начальных этапов свертывания.
Моделирование начальных этапов свертывания в условиях потока. Разработанная двумерная модель инициации свертывания позволяет исследовать влияние различных параметров на пространственно-временнýю динамику наработки тромбина и соотнести результаты моделирования с экспериментальными данными (рис. 2). Для упрощения рассмотрения в данной модели не описывался процесс полимеризации фибрина: выводы о возможном начале полимеризации делались исходя из локальных концентраций тромбина (так как именно пространственное распределение концентрации тромбина определяет процессы полимеризации фибрина в условиях потока [4]).
Для анализа зависимости динамики наработки тромбина от концентрации тканевого фактора и доступных (для связывания факторов свертывания) фосфолипидов были получены кинетические кривые концентрации тромбина в области активатора (рис. 3г). В качестве варьируемых параметров системы выделялись поверхностные плотности свободных фосфолипидов и тканевого фактора в области повреждения.
Модель продемонстрировала высокую чувствительность к поверхностной плотности фосфолипидов. При нулевой концентрации иммобилизованной фракции фосфолипидов, в модели не удается получить значительной наработки тромбина даже в случае нереалистично высоких значений поверхностной плотности тканевого фактора (рис. 3г). Явный учет фосфолипидов на поверхности канала позволяет описать быструю наработку тромбина выше условного порога в 1 нМ [9] (рис. 3г): при достаточно высоких поверхностных плотностях фосфолипидов надпороговая концентрация тромбина достигается уже через несколько десятков секунд после активации, что качественно соответствует экспериментальным данным, полученным in vitro (рис. 3).
Для сопоставления пространственно-временнóй динамики наработки фибрина в эксперименте с данными компьютерного моделирования, был построен график зависимости времени достижения пороговой концентрации тромбина от расстояния до начала области с активатором (рис. 3д). Стоит отметить, что результаты моделирования находятся в качественном соответствии с репрезентативными экспериментальными данными и демонстрируют значительное увеличение времени задержки свертывания для областей активатора, находящихся на расстояниях ближе, чем 100 мкм к границе начала активатора (рис. 3д).
ОБСУЖДЕНИЕ
В данной работе представлены новые сведения о возможных механизмах активной наработки тромбина, наблюдаемой в условиях артериальных скоростей течения крови (плазмы). Для исследования этого вопроса была разработана экспериментальная система, позволяющая детально анализировать процесс полимеризации фибрина при прокачивании свободной от тромбоцитов плазмы через поверхность, содержащую фосфолипидные везикулы с тканевым фактором. Полученные результаты позволили сделать вывод о быстрой наработке тромбина в области активатора в силу коротких времен задержки появления фибриновой сети вблизи границы с активатором свертывания (в направлении потока плазмы). Для объяснения полученных данных была использована математическая модель, которая позволила описать быструю наработку тромбина только в случае явного описания процессов взаимодействия факторов свертывания с неподвижной относительно потока фракцией фосфолипидов. Учет связывания ключевых молекул-участников, в том числе факторов Xa и Va, c фосфолипидами, находящимися на одной из стенок канала, а также учет формирования комплекса протромбиназы на соответствующих мембранах приводят к существенному увеличению скорости наработки тромбина. Следует подчеркнуть, что наличие фосфолипидов на поверхности, которая в нашем случае имитирует поврежденную стенку сосуда, приводит не только к удалению факторов свертывания из объемной фазы (где происходит конвекционный транспорт и быстрое разбавление), но и к концентрации этих факторов на соответствующей поверхности, что приводит к существенному увеличению скорости наработки тромбина. Таким образом, полученные результаты свидетельствуют о том, что в условиях потока наличие богатых фосфолипидами (и неподвижных относительно течения крови) мембран может представлять не только “плацдарм” для сборки белковых комплексов, необходимых для наработки тромбина, но и служить важным механизмом удержания и накопления активированных молекул вблизи места повреждения, тем самым “защищая” начальные этапы свертывания от разбавляющего действия потока. Связывание активных молекул с фосфолипидами, по всей видимости, позволяет избежать сильного ингибирующего действия потока крови на начальные этапы плазменного гемостаза и, таким образом, обеспечить достаточно высокую локальную концентрацию тромбина, необходимую как для образования фибрина, так и для активации тромбоцитов. Следует отметить, что наблюдаемый эффект значительного увеличения скорости генерации тромбина при наличии явно учитываемых фосфолипидов, продемонстрированный результатами математического моделирования, связан как с биохимическим эффектом (возможность сборки комплекса протромбиназы), так и с физическим эффектом (связывание активированных десятого и пятого фактора с фосфолипидными мембранами позволяет уменьшить влияние конвекции на инициацию свертывания).
Известно, что поток также оказывает сильное ингибирующее действие на этапе полимеризации фибрина – процесса, который не рассматривался в предложенной теоретической модели. Одним из возможных механизмов защиты начальных этапов полимеризации фибрина от потока в описанных экспериментах может служить неспецифическое связывание молекул фибриногена и фибрина с поверхностью, содержащей полиэтиленимин и везикулы с тканевым фактором. Детальное изучение этих процессов требует отдельного экспериментального и теоретического анализа.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Теоретическая часть работы выполнена при поддержке гранта РФФИ НЦНИ_а 19-51-15 004, а также Междисциплинарной научно-образовательной школы Московского университета “Фотонные и квантовые технологии. Цифровая медицина”. Экспериментальная часть работы выполнена при поддержке гранта РНФ 21-45-00012. Проточные камеры были разработаны при поддержке фонда “Наука – детям”. Компьютерная модель свертывания крови была разработана при поддержке гранта РНФ 20-45-01014.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Onasoga-Jarvis A.A., Puls T.J., O’Brien S.K., Kuang L., Liang H.J., Neeves K.B. 2014. Thrombin generation and fibrin formation under flow on biomimetic tissue factor-rich surfaces. J. Thromb. Haemost. 12 (3), 373–382. https://doi.org/10.1111/jth.12491
Shen F., Kastrup C.J., Liu Y., Ismagilov R.F. 2008. Threshold response of initiation of blood coagulation by tissue factor in patterned microfluidic capillaries is controlled by shear rate. ATVB. 28 (11), 2035–2041. https://doi.org/10.1161/ATVBAHA.108.173930
Rana K., Neeves K.B. 2016. Blood flow and mass transfer regulation of coagulation. Blood Rev. 30 (5), 357–368. https://doi.org/10.1016/j.blre.2016.04.004
Panteleev M.A., Dashkevich N.M., Ataullakhanov F.I. 2015. Hemostasis and thrombosis beyond biochemistry: Roles of geometry, flow and diffusion. Thromb. Res. 136 (4), 699–711. https://doi.org/10.1016/j.thromres.2015.07.025
Panteleev M.A., Balandina A.N., Lipets E.N., Ovanesov M.V., Ataullakhanov F.I. 2010. Task oriented modular decomposition of biological networks: Trigger mechanism in blood coagulation. Biophys. J. 98, 1751–1761. https://doi.org/10.1016/j.bpj.2010.01.027
Neeves K.B., Illing D.A., Diamond S.L. 2010. Thrombin flux and wall shear rate regulate fibrin fiber deposition state during polymerization under flow. Biophys. J. 98 (7), 1344–1352. https://doi.org/10.1016/j.bpj.2009.12.4275
Shibeko A.M., Lobanova E.S., Panteleev M.A., Ataullakhanov F.I. 2010. Blood flow controls coagulation onset via the positive feedback of factor VII activation by factor Xa. BMC Syst. Biol. 4 (1), 5. https://doi.org/10.1186/1752-0509-4-5
Podoplelova N.A., Sveshnikova A.N., Kotova Y.N., Eckly A., Receveur N., Nechipurenko D.Y., Obydennyi S.I., Kireev I.I., Gachet C., Ataullakhanov F.I., Mangin P.H., Panteleev M.A. 2016. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745–1755. https://doi.org/10.1182/blood-2016-02-696898
Logue S.E., Elgendy M., Martin S.J. 2009. Expression, purification and use of recombinant annexin V for the detection of apoptotic cells. Nat. Protoc. 4 (9), 1383–1395. https://doi.org/10.1038/nprot.2009.143
Balandina A.N., Shibeko A.M., Kireev D.A., Novikova A.A., Shmirev I.I., Panteleev M.A., Ataullakhanov F.I. 2011. Positive feedback loops for factor V and factor VII activation supply sensitivity to local surface tissue factor density during blood coagulation. Biophys. J. 101 (8), 1816–1824. https://doi.org/10.1016/j.bpj.2011.08.034
Baugh R.J., Krishnaswamy S. 1996. Role of the activation peptide domain in human factor X activation by the extrinsic Xase complex. J. Biol. Chem. 271, 16126–16134.
Komiyama Y., Pedersen A.H., Kisiel W. 1990. Proteolytic activation of human factors IX and X by recombinant human factor VIIa: Effects of calcium, phospholipids, and tissue factor. Biochemistry. 29, 9418–9425. https://doi.org/10.1021/bi00492a016
Krishnaswamy S., Field K.A., Edgington T.S., Morrissey J.H., Mann K.G. 1992. Role of the membrane surface in the activation of human coagulation factor X. J. Biol. Chem. 267, 26110–26120.
Butenas S., Mann K.G. 1996. Kinetics of human factor VII activation. Biochemistry. 35, 1904–1910. https://doi.org/10.1021/bi951768c
Monkovic D.D., Tracy P.B. 1990. Activation of human factor V by factor Xa and thrombin. Biochemistry. 29 (5), 1118–1128. https://doi.org/10.1021/bi00457a004
Saenko E.L., Scandella D., Yakhyaev A.V., Greco N.J. 1998. Activation of factor VIII by thrombin increases its affinity for binding to synthetic phospholipid membranes and activated platelets. J. Biol. Chem. 273 (43), 27918–27926. https://doi.org/10.1074/jbc.273.43.27918
Tracy P.B., Eide L.L., Mann K.G. 1985. Human prothrombinase complex assembly and function on isolated peripheral blood cell populations. J. Biol. Chem. 260 (4), 2119–2124.
Dieijen G., Tans G., Rosing J., Hemker H.C. 1981. The role of phospholipid and factor VIIIa in the activation of bovine factor X. J. Biol. Chem. 256 (7), 3433–3442.
Rezaie A.R. 1998. Calcium enhances heparin catalysis of the antithrombin-factor Xa reaction by a template mechanism. Evidence that calcium alleviates Gla domain antagonism of heparin binding to factor Xa. J. Biol. Chem. 273 (27): 16824-16827. https://doi.org/10.1074/jbc.273.27.16824
Prendergast F.G., Mann K.G. 1978. Chemical and physical properties of aequorin and the green fluorescent protein isolated from Aequorea forskålea. Biochemistry. 17 (17), 3448–3453. https://doi.org/10.1021/bi00610a004
Ellis V., Scully M.F., Kakkar V.V. 1984. Inhibition of prothrombinase complex by plasma proteinase inhibitors. Biochemistry. 23 (24), 5882–5887. https://doi.org/10.1021/bi00319a030
Marshall A.G. 1978. Biological chemistry: Principles, technics, and applications. New York: John Wiley and Sons.
Podoplelova N.A., Sveshnikova A.N., Kurasawa J.H., Sarafanov A.G., Chambost H., Vasil’ev S.A., Demina I.A., Ataullakhanov F.I., Alessi M.C., Panteleev M.A. 2016. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochim. Biophys. Acta. 1858 (6), 1216–1227. https://doi.org/10.1016/j.bbamem.2016.02.008
Scandura J.M., Ahmad S.S., Walsh P.N. 1996. A binding site expressed on the surface of activated human platelets is shared by factor X and prothrombin. Biochemistry. 35 (27), 8890–8902. https://doi.org/10.1021/bi9525029
Tracy P.B., Nesheim M.E., Mann K.G. 1992. Platelet factor Xa receptor. Methods Enzymol. 215, 329–360. https://doi.org/10.1016/0076-6879(92)15075-n
Panteleev M.A., Zarnitsina V.I., Ataullakhanov F.I. 2002. Tissue factor pathway inhibitor: A possible mechanism of action. Eur. J. Biochem. 269 (8), 2016–2031. https://doi.org/10.1046/j.1432-1033.2002.02818.x
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


