Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 3, стр. 215-223
N-Концевой фрагмент виментина отвечает за связь с митохондриями in vitro
А. А. Даял a, Н. В. Медведева a, А. А. Минин a, *
a Институт белка РАН
119334 Москва, Россия
* E-mail: alexminin@gmail.com
Поступила в редакцию 17.01.2022
После доработки 29.01.2022
Принята к публикации 31.01.2022
- EDN: NFFRFD
- DOI: 10.31857/S0233475522030057
Аннотация
Роль промежуточных филаментов в регуляции функций митохондрий стала очевидной в результате исследований последних лет. Так, ранее было показано, что виментин влияет на подвижность митохондрий и на уровень их мембранного потенциала. Однако было неизвестно, может ли он связываться с митохондриями напрямую, без участия белков-посредников. В настоящей работе при помощи биоинформатического анализа была исследована последовательность виментина и обнаружен участок в N-концевой части молекулы, который может играть роль сигнала митохондриальной локализации, т.е. непосредственно связываться с этими органеллами. Чтобы экспериментально проверить такую возможность, при помощи центрифугирования через сахарозную “подушку” исследовалось связывание митохондрий, изолированных из печени крысы, с протофиламентами, полученными из рекомбинантного виментина человека. Показано, что виментин может связываться с митохондриями in vitro. Обнаружено, что под действием связанной с митохондриями протеазы происходит потеря N-концевой части молекулы виментина и нарушается ее взаимодействие с митохондриями. При помощи ингибиторного анализа было выяснено, что ответственным за деградацию виментина является атипичный кальпаин, цистеиновая Са2+-зависимая протеаза, не чувствительная к действию кальпастатина.
ВВЕДЕНИЕ
Промежуточные филаменты (ПФ), один из основных компонентов цитоскелета животных клеток, выполняют разнообразные функции [1, 2]. Виментиновые ПФ (ВПФ), будучи типичными для мезенхимных клеток, придают им механическую прочность [3], регулируют внутриклеточный транспорт [4], участвуют в передаче различных сигналов [5] и обеспечивают нормальное функционирование митохондрий [6]. Так, было показано, что нарушения функций митохондрий часто связаны с болезнями, которые вызваны мутациями в генах различных белков ПФ. Например, отмечались патологические изменения в морфологии, распределении и дыхательных функциях митохондрий у пациентов с нейродегенеративными заболеваниями, вызванными мутациями в белках нейрофиламентов [7], и у больных с миопатиями и кардиомиопатиями, у которых наблюдались мутации в гене десмина [8]. Нарушения в функциях митохондрий наблюдаются также у больных булезным эпидермолизом, вызванным мутациями в генах кератинов [9], и в фибробластах, полученных из мышей с нокаутом гена виментина [10]. Поскольку митохондрии играют центральную роль в клеточной физиологии, являясь основным источником энергии [11] и регулятором внутриклеточной концентрации Са2+ [12], а также участвуют в индукции апоптоза [13], представляется важным выяснить, как взаимодействие с виментином влияет на их свойства.
Одним из первых вопросов, вставших перед исследователями, был следующий: способен ли виментин напрямую связываться с митохондриями, или для этого необходимы белки-посредники. Данные, полученные в лаборатории Г. Вихе, указывали на вероятную роль в этом процессе плектина – белка, способного связывать как промежуточные филаменты, так и другие цитоскелетные структуры и органеллы [14, 15]. Обнаруженная изоформа плектина 1b, которая специфически связывается с митохондриями и колокализуется с ВПФ, могла бы играть такую роль посредника. Однако в мышиных фибробластах с нокаутом гена плектина 1b не было выявлено изменений в распределении и функциях митохондрий [15].
Ранее мы продемонстрировали, что в фибробластах, лишенных виментина, митохондрии более подвижны [16] и обладают пониженным мембранным потенциалом [6]. Восстановление ВПФ в таких клетках при помощи трансфекции плазмидой, кодирующей виментин, снижало подвижность и увеличивало уровень потенциала митохондий [6, 16]. Используя серию мутантов виментина, мы определили участок, отвечающий за ингибирование подвижности митохондрий [16]. Он располагается в N-концевой части молекулы виментина между 41-й и 96-й аминокислотными остатками. Отдельно экспрессируемый в клетках такой пептид имеет митохондриальную локализацию [16]. Особенностью этого участка, отвечающего за связь виментина с митохондриями, является его структурное сходство с сигналами митохондриальной локализации, обнаруженными у других митохондриальных белков. Эти сигналы характеризуются наличием слабогидрофобной последовательности, ограниченной с двух сторон группами положительно заряженных аминокислот [17]. Виментин с точечными мутациями в этом участке образовывал филаменты, но терял способность ограничивать подвижность митохондрий [16, 18]. На основании этих результатов мы предположили, что виментин может непосредственно связываться с митохондриями без участия каких-либо посредников.
Целью настоящей работы была экспериментальная проверка этого предположения. Начали мы с поиска сигнала митохондриальной локализации в последовательности виментина при помощи программы TargetP-1.1, чтобы выяснить, может ли выполнять эту роль обнаруженный нами ранее [16] участок в N-концевой части молекулы. Получив утвердительный ответ, мы проверили, может ли очищенный рекомбинантный виментин связываться напрямую с митохондриями, изолированными из печени крысы, in vitro. Для разделения свободного виментина и митохондрий со связанным виментином было использовано центрифугирование через слой сахарозы. Чтобы избежать осаждения виментина в форме длинных филаментов независимо от митохондрий, мы использовали белок с мутацией Vim(Y117L), блокирующей сборку ПФ на стадии протофиламентов [19], которые седиментируют только при высокоскоростном центрифугировании. Наши данные свидетельствуют о том, что виментин связывается с митохондриями, и за это взаимодействие отвечает N-концевая часть его молекулы.
МАТЕРИАЛЫ И МЕТОДЫ
Плазмиды и антитела. Для клонирования и экспрессии мутантных форм виментина использовали вектор pET-23b+. Чтобы получить плазмиду pET-23b(+)-Vim, кДНК, кодирующую человеческий виментин (из плазмиды pIRES-GFP-Vim), амплифицировали при помощи ПЦР с праймерами TTTCATATGTCCACCAGG-TCCGT и TTTAAGCTTCTCGAGGTCATCGTG и вставляли в вектор по сайтам Nde I и Hind III. Плазмиду pET-23b(+)-Vim(Y117L), кодирующую виментин с заменой тирозина Y117 на лейцин, получили при помощи инвертированного ПЦР [20] плазмиды pET-23b(+)-Vim с праймерами TTAATCGACAAGGTGCGCTTCCT и GTTGGCGAAGCGGTCATTCAGC с последующим лигированием продукта по тупым концам. Для получения плазмиды pET-23b(+)-Vim(Y117L)-delta-C, кодирующей делеционный мутант виментина, лишенный 55 аминокислот с С-конца, использовали ПЦР плазмиды pET-23b(+)-Vim (Y117L) с праймерами TTTCATATGTCCACCAGG-TCCGT и TTTAAGCTTTTAAATCCTGCTCTCCTCG и вставляли в вектор pET-23b+ по сайтам Nde I и Hind III. Правильность продуктов клонирования проверяли секвенированием.
Для иммуноблотинга использовали моноклональные мышиные антитела против виментина V-9 (Sigma, США). В качестве вторичных антител использовали кроличьи анти-мышиные антитела, конъюгированные с пероксидазой из хрена (The Jackson Laboratory, США).
Выделение и очистка виментина. Экспрессию виментина в бактериях проводили методом автоиндукции. Клетки Escherichia сoli BL21, трансформированные соответствующей плазмидой, инкубировали в среде LB в течение ночи при 37°С. Затем 25 мл ночной культуры переносили в 500 мл 3-кратной среды LB, содержащей 100 мкг/мл карбенициллина и инкубировали при интенсивном перемешивании при 37°С в течение дня, затем продолжали выращивание в течение ночи при 30°С. Полученную клеточную суспензию центрифугировали при 4000 g в течение 20 мин, супернатант удаляли, клеточный осадок суспендировали в 50 мл лизис-буфере 5 мМ Трис-НСl рН 8.4, 1 мМ EDTA, 1 мМ EGTA с добавлением смеси ингибиторов протеаз (S8830, Sigma), разделяли на порции по 10 мл, замораживали и хранили при –20°С. Клетки разрушали в течение 4 мин при помощи ультразвукового дезинтегратора Sonic Dismembrator 550 (Fisher Scientific, США). Затем тельца включения осаждали центрифугированием в течение 30 мин при 15 000 об/мин в роторе JA-20 (Beckman, США). Осадок отмывали несколько раз, последовательно заменяя среду (1 раз лизис-буфер, 1 раз лизис-буфер, содержащий 1% Triton X-100, 1 раз лизис-буфер, содержащий 1 М NaCl, и 1 раз лизис-буфер). Осадок “отмытых” телец включения хранили при –20°С. Для выделения виментина из телец включения их растворяли в 5 мМ буфере Трис-HCl, pH 8,4, содержащем 8 М мочевины и ингибиторы протеаз S8830 (Sigma), и центрифугировали в течение 30 мин при 15000 об/мин на роторе JA-20. Ренатурацию белка проводили при помощи диализа против буфера 5 мМ Трис-HCl, pH 8,4, постепенно снижая концентрацию мочевины: 6 М мочевины в течение 30 мин при комнатной температуре, 4 М мочевины (30 мин, при комнатной температуре), 2 М мочевины (30 мин, при 4°С), буфер без мочевины (дважды по 60 мин при 4°С). Полученный раствор белка центрифугировали 30 мин при 30000 об/мин в роторе TLS-55 на центрифуге TL100 (Beckman, Germany). Концентрация виментина в растворе, которую определяли методом ВСА с использованием бицинхониновой кислоты, составляла около 2.0 мг/мл.
Выделение митохондрий. Митохондрии выделяли из печени крысы с соблюдением всех правил обращения с лабораторными животными. Извлеченную печень быстро погружали в холодный солевой раствор на фосфатном буфере (PBS), измельчали ножницами и тщательно отмывали от крови. Гомогенизацию проводили при помощи гомогенизатора Поттера в буфере выделения: 220 мМ маннитола, 70 мМ сахарозы, 1 мМ EDTA, 10 мМ K-HEPES рН 7.4. На 1 г ткани печени брали 10 мл буфера. Гомогенат центрифугировали при 3000 об/мин 10 мин в роторе JA-20. Полученный супернатант фильтровали через несколько слоев марли и центрифугировали в течение 20 мин при 9500 об/мин в роторе JA-20. Полученный осадок митохондрий гомогенезировали в буфере выделения, а затем повторно центрифугировали 20 мин при 9500 об/мин в роторе JA-20. К полученному осадку добавляли 100 мкл буфера выделения (общий объем около 1 мл), ресуспендировали и наслаивали на ступенчатый градиент, состоящий из 1.2 М сахарозы и 1.6 М сахарозы в 10 мМ K-HEPES буфере, рН 7.4. с 1 мМ EDTA, и центрифугировали при 30000 об/мин 20 мин в роторе TLS-55 на центрифуге TL100 (Beckman, Германия). Суспензию митохондрий бурого цвета, хорошо различимую на границе между ступеньками градиента, аккуратно собирали, разводили буфером выделения и осаждали при 9500 об/мин 10 мин в роторе JA-21. К осадку добавляли 50 мкл буфера выделения и ресуспендировали. Концентрация белка в полученном препарате митохондрий составляла 60 ± 20 мг/мл.
Определение связывания виментина с митохондриями. Взаимодействие митохондрий с рекомбинантным виментином определяли при помощи центрифугирования через сахарозную “подушку”. Связавшийся виментин оказывался в осадке митохондрий, в то время как свободный белок оставался в супернатанте. Инкубацию виментина (0.1 мг/мл) с митохондриями (2 мг/мл) проводили в 10 мМ буфере K-HEPES, pH 7,4, содержащем 220 мМ маннитола, 70 мМ сахарозы и 1 мМ EDTA в объеме 420 мкл при 25°С в течение 20 мин. Ингибиторы протеаз лейпептин, кальпептин и PD150606 добавляли, где указано, до конечной концентрации 1.0, 15.0 и 20.0 мкг/мл, соответственно. После инкубации образцы объемом 400 мкл наслаивали на 500 мкл “подушки”, представляющей собой плотный неперемешивающийся слой, содержащий 1.2 М сахарозы, 10 мМ K-HEPES, рН 7.4, и 1 мМ EDTA, и центрифугировали при 30000 об/мин в течение 10 мин. 200 мкл супернатантов (верхняя фаза), содержащих несвязавшийся виментин, смешивали с буфером Лэммли (100 мM ТрисHCl, pH 6.8, 20% глицерина, 4% SDS, 0.2% бромфенолового синего, 200 мМ 2-β-меркаптоэтанола) и инкубировали 10 мин при 98°С. После тщательной промывки сахарозной “подушки” ее удаляли, осадок митохондрий ресуспендировали в 100 мкл воды, смешивали с буфером Лэммли и инкубировали 10 мин при 98°С. Полученные образцы разделяли при помощи ПААГ-электрофореза в 15% геле и переносили на нитроцеллюлозную мембрану для последующего анализа при помощи иммуноблотинга с антителами к десмину. Виментин на фильтрах выявляли при помощи антител V-9 (Sigma) и вторичных антител в разведении 1 : 1000 и 1 : 2000 соответственно и окрашивали с использованием диаминобензидина.
Биоинформатический анализ последовательностей белков. Для поиска возможного сигнала митохондриальной локализации использовался метод TargetP 1.1. (http://www.cbs.dtu.dk/services/ TargetP-1.1/index.php), который осуществляет расчеты с помощью двухслойных нейронных сетей, обученных на аннотированных последовательностях базы UniProt с уже экспериментально установленным сигналом локализации [21]. Результатом является показатель прогноза, говорящий о наличии или отсутствии пептида с сигналом локализации в митохондрии – mTP. Показатель mTP выше 0.55 свидетельствует о высокой вероятности наличия сигнала митохондриальной локализации.
РЕЗУЛЬТАТЫ
Предсказание сигнала митохондриальной локализации в молекуле виментина. Первичная структура найденного нами ранее участка в N-концевой части молекулы виментина [16], который отвечает за взаимодействие ВПФ с митохондриями, позволила предположить, что она может играть роль сигнала митохондриальной локализации [6]. Для проверки этого предположения мы провели биоинформатический анализ молекулы виментина человека при помощи программы TargetP 1.1 [21], которая предсказывает наличие сигналов митохондриальной локализации, а также длину сигнальной последовательности до сайта протеолитического расщепления при созревании белка. Анализ показал, что, действительно, последовательность из первых 38 аминокислот молекулы виментина с определенной вероятностью содержит сигнал для локализации в митохондриях (mTP = 0.749) (рис. 1а). Поскольку, по нашим данным, делеция участка с 28-й по 39-ю аминокислоту не нарушала способность ВПФ уменьшать подвижность митохондрий [16], а за их связь в мышиных фибробластах ответственным был участок с 45-й по 70-ю аминокислоту (показан на рисунке пунктиром), мы проверили, содержит ли сигнал митохондриальной локализации делеционный мутант виментина, лишенный первых 40 аминокислот. Оказалось, что наличие такого сигнала длиной 48 аминокислот в укороченном N-концевом фрагменте программа TargetP 1.1 предсказывает с очень высокой вероятностью (mTP = 0.943) (рис. 1б). Интересно, что при делеции 38 аминокислот с N-конца такого укороченного фрагмента, т.е. участка, содержащего предсказанный сайт связывания митохондрий [16], белок полностью теряет сигнал митохондриальной локализации (mTP = 0.065) (рис. 1в). Таким образом, теоретически виментин может связываться с митохондриями, используя сигнал митохондриальной локализации, расположенный в его N-концевом домене.
Рис. 1.
Предполагаемые сигналы митохондриальной локализации в N-концевой части молекулы виментина по результатам биоинформатического анализа. а – Весь N-концевой домен с фрагментом 1А-домена альфа-спиральной части, показанным в виде синего прямоугольника, и та же часть молекулы, лишенная 40 (б) и 78 (в) аминокислот с N‑конца. Розовым цветом выделены предполагаемые сигнальные последовательности до сайтов гипотетического отщепления (показаны стрелками). Пунктиром выделен ранее определенный участок [16], ответственный за взаимодействие ВПФ с митохондриями. Значения mTP [21], определенные для каждого варианта, показаны рядом с его изображением.

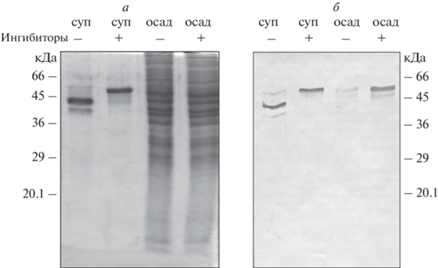
N-конец виментина отвечает за его связывание с митохондриями. Чтобы экспериментально проверить возможность непосредственного связывания виментина с митохондриями, мы использовали рекомбинантный виментин человека, экспрессированный в бактериях, и митохондрии из печени крысы. Виментин, содержащий замену 117-го тирозина на лейцин (Y117L), в результате ренатурации из 8М мочевины образует частицы, которые седиментируют только при высокоскоростном центрифугировании [19]. Поэтому при центрифугировании смеси такого виментина с митохондриями через слой 1.2 М сахарозы он оказывался в осадке только, если связывался с более тяжелыми митохондриями. На рис. 2 видно, что в осадке митохондрий присутствует виментин. Однако это наблюдалось только в том случае, если в инкубационной смеси присутствовали ингибиторы протеаз. Также видно, что инкубация виментина с митохондриями без добавления ингибиторов приводила к его частичной деградации. Молекула виментина, по данным электрофореза, укорачивалась примерно на 10 кДа (рис. 2а), и он практически весь оставался в супернатанте (рис. 2б). Таким образом, полноразмерный виментин связывался с митохондриями и осаждался с ними через слой сахарозы, а его укороченный вариант такой способности был лишен. Кроме того, оказалось, что митохондриальная фракция содержит компонент(ы) с протеолитической активностью, приводящей к укорочению молекулы виментина и потере им способности связываться с ними.
Рис. 2.
Рекомбинантный виментин-(Y117L) связывается с митохондриями из печени крысы. а – Разделение при помощи электрофореза в ПААГ супернатантов и осадков после центрифугирования смеси виментина и митохондрий в присутствии и в отсутствие ингибиторов протеаз (S8830, Sigma, USA). б – Анализ тех же образцов при помощи иммуноблотинга с антителами к виментину.
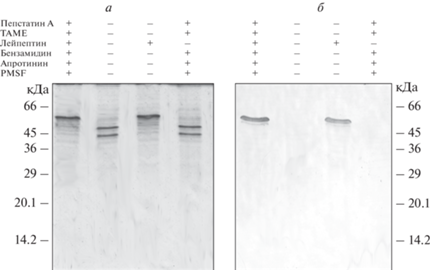
Известно, что с митохондриями связано более 40 различных протеаз, которые поддерживают их нормальное функционирование [22]. Мы предположили, что деградация виментина в результате взаимодействия с митохондриями может быть связана с активностью одной (или несколькими) из этих протеаз, и решили выяснить, с какой (какими) именно. Для этого мы использовали ингибиторный анализ. Из смеси ингибиторов протеаз, состоящей из ТАМЕ, пепстатина А, бензамидина, апротинина, PMSF и лейпептина, только последний препятствовал протеолизу виментина (рис. 3а). На рис. 3б видно, что в присутствии лейпептина наблюдалось связывание виментина с митохондриями так же, как при добавлении полной смеси ингибиторов протеаз. Поскольку лейпептин является ингибитором как цистеиновых, так и сериновых протеаз, а ингибиторы последних, как например PMSF, не препятствовали деградации виментина, мы заключили, что искомый фермент относится к цистеиновым протеазам.
Рис. 3.
Анализ осаждения виментина-(Y117L) с митохондриями. а – Разделение при помощи электрофореза в ПААГ супернатантов после центрифугирования смеси виментина и митохондрий в отсутствие и в присутствии различных ингибиторов протеаз. б – Анализ осадков после центрифугирования смеси виментина и митохондрий в отсутствие и в присутствии различных ингибиторов протеаз при помощи иммуноблотинга с антителами к виментину.
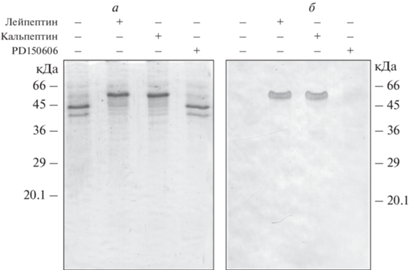
Для определения цистеиновой протеазы в митохондриях, ответственной за деградацию виментина, мы использовали более специфические ингибиторы – кальпептин и PD150606. Оказалось, что, в то время как кальпептин, ингибитор кальпаинов и катепсинов L и K [23, 24], эффективно защищал этот виментин от действия протеаз в препарате митохондрий (рис. 4), PD150606, специфический ингибитор кальпаинов I и II [25], не оказывал защитного эффекта (рис. 4). Поскольку PD150606, который ингибирует типичные кальпаины, не защищает виментин от деградации, можно предположить, что искомой протеазой является атипичный кальпаин-10, ранее обнаруженный в митохондриях [26].
Рис. 4.
Анализ осаждения виментина-(Y117L) с митохондриями после инкубации в отсутствие и в присутствии лейпептина, кальпептина или PD150606. а – Разделение при помощи электрофореза в ПААГ супернатантов после центрифугирования смеси виментина-(Y117L) и митохондрий. б – Анализ осадков после центрифугирования смеси виментина-(Y117L) и митохондрий в отсутствие и в присутствии ингибиторов протеаз при помощи иммуноблотинга с антителами к виментину.
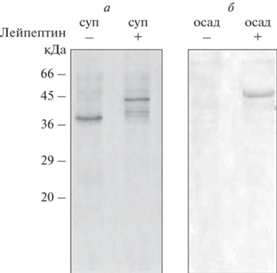
Наиболее чувствительными к действию цистеиновых протеаз в молекуле виментина являются N- и C-концевые фрагменты, а центральный альфа-спиральный домен относительно устойчив [27]. Как видно из данных рис. 2 и 3, основной продукт деградации десмина в результате инкубации с митохондриями без ингибиторов протеаз был легче исходного полипептида примерно на 10 кДа. Следовательно, укороченный вариант виментина мог быть лишен как N-, так и С-конца. Поскольку, согласно результатам биоинформатического анализа, за связь с митохондриями отвечает N-конец виментина, мы решили проверить в эксперименте in vitro возможное участие С-концевой части молекулы. Для этого мы сконструировали, экспрессировали в бактериях и очистили белок ΔС-виментин-(Y117L), лишенный участка с 412-й по 466-ю аминокислоту. На рис. 5 видно, что в присутствии лейпептина виментин, лишенный С-концевого домена, осаждается с митохондриями точно так же, как целый белок, а в отсутствие ингибитора протеаз он деградирует, и его укороченный вариант остается в супернатанте. Следовательно, виментин может непосредственно связываться с митохондриями, и за это связывание отвечает участок, расположенный в N-концевой части его молекулы.
Рис. 5.
Лишенный С-концевого домена виментин-(Y117L) связывается с митохондриями из печени крысы. а – Разделение при помощи электрофореза в ПААГ супернатантов после центрифугирования смеси ΔC-виментина-(Y117L) и митохондрий в присутствии и в отсутствие ингибиторов протеаз. б – Анализ осадков после центрифугирования смеси ΔC-виментина-(Y117L) и митохондрий в отсутствие и в присутствии ингиппбиторов протеаз при помощи иммуноблотинга с антителами к виментину.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные в настоящей работе данные свидетельствуют о том, что белок ПФ виментин способен связываться с митохондриями напрямую, без участия каких-либо посредников. Это подтвердило наши предположения, сделанные ранее при изучении свойств митохондрий в фибробластах [6, 16]. Поскольку похожие последовательности аминокислот присутствуют в молекулах некоторых других белков ПФ [6], можно ожидать, что они также взаимодействуют с митохондриями непосредственно. Так, способность десмина, белка ПФ мышечных клеток, напрямую связываться с митохондриями in vitro была нами недавно экспериментально продемонстрирована [28]. Таким образом, по крайней мере, некоторые ПФ, имеющие в своем составе сигнал митохондриальной локализации, могут определять их положение и подвижность в клетках в результате прямого взаимодействия. Эти сигналы узнаются специальными транслоказными комплексами в наружной мембране митохондрий (ТОМ), которые совместно с транслоказными комплексами во внутренней мембране (ТIМ) отвечают за импорт и локализацию белков в различных митохондриальных компартментах [29]. Однако виментин, как и другие белки ПФ, образует полимерные структуры, самые маленькие из которых, протофиламенты, содержат в своем составе от 30 до 40 полипептидных цепей. Поэтому после связывания сигнальной последовательности ТОМ комплексом транслокация виментина через мембрану не происходит из-за больших размеров полимера. Можно предположить, что взаимодействие виментина с митохондриями обеспечивается путем связывания его N-конца с комплексом импорта митохондриальных белков. Насколько такое взаимодействие ПФ с системой митохондриального импорта является универсальным механизмом, предстоит выяснить, однако для виментина и десмина, судя по нашим данным [6, 16, 28], такой механизм очень вероятен.
Обнаружение сигнала митохондриальной локализации на N-конце виментина позволяет сделать еще одно важное предположение: эта часть его молекулы в процессе связывания оказывается внутри митохондрии, в то время как центральный домен и С-конец остаются снаружи. Это косвенно подтверждается тем, что именно N-конец отщепляется митохондриальными протеазами в первую очередь. Наиболее вероятным ферментом, ответственным за протеолиз, по данным проведенного нами ингибиторного анализа, является атипичный кальпаин-10, который был обнаружен в матриксе и в межмембранном пространстве митохондрий [26]. Таким образом, кальпаин-10, будучи Са2+-зависимым белком, может участвовать в регуляции связи виментиновых ПФ с митохондриями. Можно предположить, что при снижении мембранного потенциала митохондрий концентрация Са2+ в межмембранном пространстве растет, и активность кальпаина-10 увеличивается. Таким образом, связь митохондрий с ВПФ может зависеть от их мембранного потенциала. Это предположение хорошо согласуется с нашими данными о том, что в клетках мембранный потенциал подвижных не связанных с ВПФ митохондрий ниже, чем стационарных, связанных с ВПФ [30].
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 17-04-01775-а).
Соответствие принципам этики. При выделении митохондрий из печени крысы соблюдались все правила обращения с лабораторными животными.
Список литературы
Минин А.А., Молдавер М.В. 2008. Виментиновые промежуточные филаменты и их роль во внутриклеточном распределении органелл. Успехи биол. химии. 48, 221–252.
Schwarz N., Leube R.E. 2016. Intermediate filaments as organizers of cellular space: How they affect mitochondrial structure and function. Cells. 5 (3), 30.
Wang N., Stamenovic D. 2000. Contribution of intermediate filaments to cell stiffness, stiffening, and growth. Am. J. Physiol. Cell Physiol. 279, 188–194.
Styers M.L., Kowalczyk A.P., Faundez V. 2005. Intermediate filaments and vesicular membrane traffic: The odd couple’s first dance? Traffic. 6, 359–365.
Ivaska J. 2011. Vimentin: Central hub in EMT induction? Small GTPases. 2, 51–53.
Chernoivanenko I.S., Matveeva E.A., Gelfand V.I., Goldman R.D., Minin A.A. 2015. Mitochondrial membrane potential is regulated by vimentin intermediate filaments. FASEB J. 29 (3), 820–827.
Perez-Olle R., Lopez-Toledano M.A., Goryunov D., Cabrera-Poch N., Stefanis L., Brown K., Liem R.K. 2005. Mutations in the neurofilament light gene linked to Charcot-Marie-Tooth disease cause defects in transport. J. Neurochem. 93, 861–874.
Milner D.J., Mavroidis M., Weisleder N., Capetanaki Y. 2000. Desmin cytoskeleton linked to muscle mitochondrial distribution and respiratory function. J. Cell Biol. 150, 1283–1298.
Kumemura H., Harada M., Yanagimoto C., Koga H., Kawaguchi T., Hanada, S., Taniguchi E., Ueno T., Sata M. 2008. Mutation in keratin 18 induces mitochondrial fragmentation in liver-derived epithelial cells. Biochem. Biophys. Res. Commun. 367, 33–40.
Tolstonog G.V., Shoeman R.L., Traub U., Traub P. 2001. Role of the intermediate filament protein vimentin in delaying senescence and in the spontaneous immortalization of mouse embryo fibroblasts. DNA Cell Biol. 20, 509–529.
Nicholls D.G., Budd S.L. 2000. Mitochondria and neuronal survival. Physiol. Rev. 80, 315–360.
Pathak T., Trebak M. 2018. Mitochondrial Ca2+ signaling. Pharmacol. Ther. 192, 112–123.
Burke P.J. 2017. Mitochondria, bioenergetics and apoptosis in cancer. Trends Cancer. 3 (12), 857–870.
Rezniczek G.A., Abrahamsberg C., Fuchs P., Spazierer D., Wiche G. 2003. Plectin 5'-transcript diversity: Short alternative sequences determine stability of gene products, initiation of translation and subcellular localization of isoforms. Hum. Mol. Genet. 12 (23), 3181–3194.
Winter L., Abrahamsberg C., Wiche G. 2008. Plectin isoform 1b mediates mitochondrion – intermediate filament network linkage and controls organelle shape. J. Cell Biol. 181 (6), 903–911.
Nekrasova O.E., Mendez M.G., Chernoivanenko I.S., Tyurin-Kuzmin P.A., Kuczmarski E.R., Gelfand V.I., Goldman R.D., Minin A.A. 2011. Vimentin intermediate filaments modulate the motility of mitochondria. Mol. Biol. Cell. 22, 2282–2289.
Rapaport D. 2003. Finding the right organelle: Targeting signals in mitochondrial outer-membrane proteins. EMBO Rep. 4, 948–952.
Matveeva E.A., Venkova L.S., Chernoivanenko I.S., Minin A.A. 2015. Vimentin is involved in regulation of mitochondrial motility and membrane potential by Rac1. Biol. Open. 4, 1290–1297.
Meier M., Padilla G.P., Herrmann H., Wedig T., Hergt M., Patel T.R., Stetefeld J., Aebi U., Burkhard P. 2009. Vimentin coil 1A-A molecular switch involved in the initiation of filament elongation. J. Mol. Biol. 390 (2), 245–261.
Erster O., Liscovitch M. 2010. A modified inverse PCR procedure for insertion, deletion, or replacement of a DNA fragment in a target sequence and its application in the ligand interaction scan method for generation of ligand-regulated proteins. Methods Mol. Biol. 634, 157–174.
Emanuelsson O., Brunak S., von Heijne G., Nielsen H. 2007. Locating proteins in the cell using TargetP, SignalP and related tools. Nat. Protoc. 2, 953–971.
Quirós P. M., Langer T., López-Otín C. 2015. New roles for mitochondrial proteases in health, ageing and disease Nat. Rev. Mol. Cell Biol. 16 (6), 345–359.
Ebisui C., Tsujinaka T., Kido Y., Iijima S., Yano M., Shibata H., Tanaka T., Mori T. 1994. Role of intracellular proteases in differentiation of L6 myoblast cells. Biochem. Mol. Biol. Int. 32(3), 515–521.
Siklos M., Ben Aissa M., Thatcher G.R. 2015. Cysteine proteases as therapeutic targets: Does selectivity matter? A systematic review of calpain and cathepsin inhibitors. Acta Pharm. Sin. B. 5 (6), 506–519.
Wang K.K., Nath R., Posner A., Raser K.J., Buroker-Kilgore M., Hajimohammadreza I. 1996. An alpha-mercaptoacrylic acid derivative is a selective nonpeptide cell-permeable calpain inhibitor and is neuroprotective. Proc. Natl. Acad. Sci. USA. 93, 6687–6692.
Arrington D.D., Van Vleet T.R., Schnellmann R.G. 2006. Calpain 10: A mitochondrial calpain and its role in calcium-induced mitochondrial dysfunction. Amer. J. Physiol. – Cell Physiol. 291 (6), 1159–1171.
Nelson W.J., Traub P. 1983. Proteolysis of vimentin and desmin by the Ca2+-activated proteinase specific for these intermediate filament proteins. Mol. Cell. Biol. 3, 1146–1156.
Dayal A.A., Medvedeva N.V., Nekrasova T.M., Duhalin S.D., Surin A.K., Minin A.A. 2020. Desmin interacts directly with mitochondria. Int. J. Mol. Sci. 21 (21), 8122.
Pfanner N., Warscheid B., Wiedemann N. 2019. Mitochondrial proteins: From biogenesis to functional networks. Nat. Rev. Mol. Cell. Biol. 20 (5), 267–284.
Chernoivanenko I.S., Matveeva E.A., Minin A.A. 2011. Vimentin intermediate filaments increase mitochondrial membrane potential. Biochemistry (Moscow). Supplement Series A. Membr. Cell Biol. 5 (1), 21–28.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


