Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 3, стр. 195-204
Изменения флуоресценции хлоропластов в связи с возбудимостью клеток Chara и переносом метаболитов в потоке цитоплазмы
А. А. Булычев a, *, А. В. Алова a
a Московский государственный университет им. М.В. Ломоносова,
биологический факультет
119991 Москва, Россия
* E-mail: bulychev@biophys.msu.ru
Поступила в редакцию 13.12.2021
После доработки 18.01.2022
Принята к публикации 18.01.2022
- EDN: IVJKXZ
- DOI: 10.31857/S0233475522030033
Аннотация
Распространение потенциала действия и перенос метаболитов с потоком цитоплазмы составляют основные способы дальней сигнализации в гигантских клетках харовых водорослей. В работе показано, что возбуждение плазматических мембран и остановка течения цитоплазмы в междоузлиях Chara на слабом свету (при отсутствии масштабных изменений рН на поверхности клетки) сопровождаются переходным возрастанием или серией колебаний фактической флуоресценции хлорофилла (F ') в хлоропластах, лежащих вблизи зон наружной кальцификации, но не оказывают влияния на свечение хлоропластов в преобладающих по площади некальцифицированных участках. Разная чувствительность к генерации потенциала действия у хлоропластов, лежащих вблизи и вдали от зон инкрустации, вероятно связана со структурными и биохимическими различиями клеточных доменов и влиянием течения цитоплазмы на окружение хлоропластов в области измерения. Кинетические кривые изменений F ' при возбуждении клетки и число отдельных полос в ответной реакции зависели от освещаемой площади препарата. Число полос сокращалось при переходе от общего освещения к освещению узкого участка клетки световодами с диаметром 2.0 и 0.4 мм. Результаты свидетельствуют о том, что начальные стадии изменений F ' после генерации потенциала действия обусловлены внутренними процессами в хлоропластах, а более поздние изменения F ' связаны с поступлением метаболитов из возобновляющегося потока цитоплазмы в хлоропласты исследуемой зоны. Амплитуда вызванных возбуждением изменений F ' резко снижалась в начальный период после перехода от общего к локальному освещению, что объясняется потреблением восстановительных эквивалентов цитоплазмы в процессах постсветовой фиксации СО2 в условиях прекращения фотопродукции NADPH в области затенения.
ВВЕДЕНИЕ
Возбудимость представляет одно из фундаментальных свойств живых клеток. Генерация потенциала действия (ПД) в клетках растений сопровождается повышением уровня Ca2+ в цитоплазме, что оказывает влияние на синтез фитогормонов [1], приводит к закрыванию листьев у сейсмочувствительных и насекомоядных растений [2, 3], вызывает изменения дыхания и фотосинтеза [4, 5]. Влияние возбудимости на фотосинтез отчетливо проявляется по изменениям флуоресценции (Фл) хлорофилла (Хл) в междоузлиях харовых водорослей на ярком свету, при котором на поверхности клетки поддерживаются чередующиеся кислые и щелочные зоны с перепадами рН от 6.5 до 10 [6, 7]. Генерация ПД временно устраняла эти неравновесные структуры, а также снижала квантовую эффективность фотосистемы II (ФСII) и линейный поток электронов в области щелочных зон, но оказывала слабое влияние на хлоропласты, расположенные под наружными кислыми зонами [8]. Показано, что наблюдаемое снижение максимальной флуоресценции $F_{{\text{m}}}^{{\text{'}}}$ обусловлено возрастанием ΔрН на тилакоидных мембранах освещенных хлоропластов и усилением тепловых потерь в антенне (нефотохимическое тушение) после генерации ПД [6]. Неоднородный профиль рН в клетках Chara исчезает в темноте, но пространственная неоднородность в распределении некоторых органелл (харасомы) [9] сохраняется в течение 7–10 сут. Еще более устойчивы к долгому затенению кристаллы солей кальция на поверхности клеточной стенки, которые осаждаются на свету в области наружных щелочных зон. Cведения о влиянии возбудимости на фотосинтез и Фл Хл в клетках Chara на слабом свету в условиях сглаживания продольного профиля наружного рН в настоящее время отсутствуют.
При низкой освещенности, недостаточной для развития нефотохимического тушения (NPQ), влияние возбуждения плазматических мембран на хлоропласты может включать регуляторные пути, основанные на изменении редокс-состояния пула пластохинонов (PQ) и первичного хинонного акцептора ФСII QA. Сведения о влиянии возбудимости мембран на состояние переносчиков электронов между фотосистемами остаются пока единичными. На листьях венериной мухоловки обнаружено переходное возрастание фактической флуоресценции хлорофилла (F ', F или Ft в разных обозначениях) после индукции ПД при низкой интенсивности света, что указывает на временное восстановление QA и пула PQ [10, 11]. В условиях слабого стационарного освещения (при отсутствии NPQ), когда значения максимальной и минимальной флуоресценции $F_{{\text{m}}}^{{\text{'}}}$ и Fo поддерживаются на постоянном уровне, изменения флуоресценции F ' служат удобным показателем фотохимического тушения qP в ФСII. Возрастание F ' отражает восстановление QA и увеличение доли закрытых реакционных центров, а снижение F ' соответствует увеличению содержания окисленной формы QA. Сглаживание неоднородного профиля рН в примембранных слоях среды при низких интенсивностях света исключает масштабные изменения наружного рН в качестве переменной величины и упрощает интерпретацию процессов, запускаемых в хлоропластах при возбуждении.
Влияние ПД на фотосинтетическую функцию включает два важных фактора. Повышение концентрации Ca2+ в цитоплазме харовых водорослей при генерации ПД (от 0.1 до 10–40 мкМ) [12, 13] сопровождается светозависимым поглощением Ca2+ хлоропластами и возрастанием уровня Ca2+ в строме [14], что ведет к подавлению фотосинтетической фиксации CO2 [15]. Кроме того, влияние ПД на активность хлоропластов включает еще одно, ранее не включенное в обсуждение обстоятельство. Повышение уровня Са2+ в цитозоле во время потенциала действия вызывает временную остановку течения цитоплазмы [16], что вероятно модифицирует обмен веществ между хлоропластами и цитоплазмой, а также концентрации метаболитов в потоке жидкости. Эти события могут проявляться в дальних межхлоропластных взаимодействиях, опосредованных круговым течением цитоплазмы. Изучение индуцируемых потенциалом действия изменений F ' позволит понять, как сказывается временное прерывание течения цитоплазмы на распределении метаболитов, доставляемых с потоком к исследуемым хлоропластам.
О существовании дальних опосредованных циклозом взаимодействий между неподвижными хлоропластами в гигантских клетках Chara говорят резкие различия индукционных кривых Фл Хл в условиях освещения всего междоузлия в сравнении с освещением небольшого (диаметр ~2 мм) участка клетки, а также исчезновение этих различий после остановки течения цитоплазмы под действием ингибитора актина – цитохалазина D [17, 18]. Аналогичный подход – сравнение ответных реакций хлоропластов на генерацию ПД в условиях общего и локального освещения – может оказаться полезным для выявления дальних внутриклеточных взаимодействий, участвующих в передаче сигнала от возбудимых мембран к фотосинтетическому аппарату.
В данной работе изучали влияние генерации потенциала действия на изменения Фл Хл в клетках междоузлий харовой водоросли, экспонированных на слабом свету, достаточном для поддержания фотосинтетического аппарата в активном состоянии. Наряду со стационарным фоновым освещением всей клетки, использовали длительное (>10 мин) локальное освещение небольшого участка, которое сопровождается инактивацией светозависимых транспортеров оболочки у хлоропластов, расположенных вне освещаемой области. В итоге выявлена неоднородность ответных реакций хлоропластов разных участков клетки на генерацию ПД и установлена важная роль транспортеров оболочки и микрофлуидного транспорта в динамике изменений редокс-состояния фотосинтетической электрон-транспортной цепи (ЭТЦ) при возбуждении плазматических мембран.
МАТЕРИАЛЫ И МЕТОДЫ
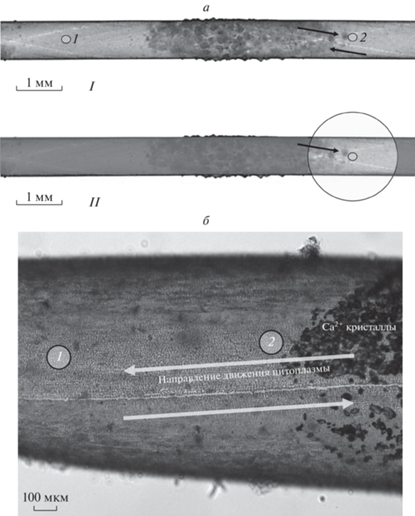
Растительный материал. Эксперименты проводили на клетках междоузлий Chara australis R. Br. Водоросли выращивали при рассеянном комнатном освещении. Использовали боковые побеги длиной 25–30 мм и диаметром 0.7–0.9 мм, а также закончившие рост клетки центральной оси длиной до 5 см, которые помещали в искусственную прудовую воду, содержащую 0.1 мМ KCl, 1 мМ NaCl и 0.1 мМ CaCl2. Значения рН среды доводили до рН 7.0 добавлением раствора бикарбоната натрия. Изолированные клетки выдерживали в искусственной прудовой воде не менее суток после отрезания соседних междоузлий. Некоторые особенности строения клеток Chara – наличие зон кальцификации клеточной стенки, ротационное течение цитоплазмы, плотная однослойная упаковка неподвижных хлоропластов – представлены на рис. 1.
Рис. 1.
Микрофотографии сегментов междоузлия Chara и варианты освещения клетки в ходе эксперимента. Стрелками отмечены встречные направления течения цитоплазмы по разные стороны от линии разделения потоков (узкая полоса цитоплазмы, не содержащая хлоропластов). а – Расположение кальцифицированных и свободных от кристаллов участков на поверхности клетки Chara. Окружностями 1 и 2 отмечены области измерения флуоресценции хлоропластов вдали от мест отложения кристаллов CaCO3 и на границе с кристаллами соответственно. Верхняя и нижняя части рисунка соответствуют режимам общего освещения всей клетки (I) и локального освещения выбранного участка клетки (II) при затемнении остальных частей клетки. Исходное изображение предоставлено профессором Ilse Foissner (Университет г. Зальцбурга, Австрия). б – Участок плотно упакованного слоя хлоропластов на границе зоны отложения кристаллов. Круговые области 1 и 2 соответствуют выбору мест измерения флуоресценции на разном удалении от кристаллов.
Микрофлуориметрия хлорофилла. Выход фактической флуоресценции хлорофилла F ' измеряли на микроучастке клеток (диаметр ~100 мкм) с помощью инвертированного микроскопа Axiovert 25-CFL (Zeiss, Германия), оборудованного микрофлуориметром с импульсно-модулированным освещением Microscopy-PAM (Walz, Германия). Перед измерениями препарат адаптировали к слабому фоновому свету, направленному от верхнего осветителя микроскопа через сине-зеленый фильтр (СЗС-22, толщина 5 мм) и нейтральный стеклянный светофильтр (плотность потока квантов на уровне объекта ~10 мкмоль м–2 с–1, λ < 580 нм). Низкая интенсивность освещения достаточна для поддержания светозависимых ферментов в активном состоянии, но исключает энергозависимое нефотохимическое тушение. Выход модулированной флуоресценции хлорофилла F ' регистрировали при непрерывном фоновом освещении. Сигнал, поступающий с фотоумножителя, обрабатывали в программе WinControl-3 (Walz), оцифровывали с интервалом ~51 мс аналого-цифровым преобразователем PCI-6024E (National Instruments, США) и записывали на компьютер. Измерения проводили при температуре 21–23°С.
Локальное освещение. Для локального освещения области измерения F ' и окружающих участков использовали гибкий оптоволоконный кабель длиной 10 см с диаметром оптического пучка 2 мм [18, 19]. Один конец оптического кабеля проходил через светозащитный экран; на него падал свет от верхнего осветителя микроскопа. Другой конец кабеля был направлен на клетку сверху. Положение торца оптического кабеля относительно области измерения Фл в горизонтальной плоскости и по вертикали регулировали с помощью микроманипулятора при наблюдении в микроскоп. Для большего сужения освещаемой области препарата применяли одноволоконный кварцевый световод с диаметром 0.4 мм. Интенсивности света, падающего на исследуемую область клетки в режимах общего и локального освещения, отличались незначительно, о чем говорят близкие измеряемые значения F ' для этих экспериментальных условий.
Электростимуляция. Изолированную клетку междоузлия помещали в двухсекционную камеру из оргстекла. Стимулирующие токовые Ag/AgCl электроды располагались в разных отсеках камеры. Пропускание импульса электрического тока (10 мкА, 150 мс) между наружными электродами вызывало возбуждение клетки и временное прекращение течения цитоплазмы. Остановку внутриклеточного потока под влиянием ПД проверяли во всех опытах визуально в проходящем свете. Для этого измерения Фл Хл временно прерывали в начале каждой отдельной записи. Последействие однократного электрического возбуждения на эффективный квантовый выход ФСII продолжается от 10 до 45 мин [6]. В данной работе интервалы между возбуждающими стимулами составляли 10–15 мин. Наружный pH возле кальцифицированных и некальцифицированных участков клеток измеряли с помощью сурьмяных рН-микроэлектродов в стеклянной изоляции, как описано ранее [20].
Усредненные кинетические кривые изменения F ', показанные на рисунках, получены при 2–5-кратном воспроизведении в репрезентативных экспериментах на отдельных клетках. В каждой серии экспериментов использовали не менее четырех клеток. Количество измерений указано в подписях к рисункам.
РЕЗУЛЬТАТЫ
Возрастание F ' в хлоропластах вблизи зон кальцификации после генерации ПД. Приложение короткого импульса электрического тока между частями клетки, находящимися в разных отсеках экспериментальной камеры, вызывало генерацию потенциала действия (ПД), что проявлялось в резкой остановке течения цитоплазмы. Возобновление потока цитоплазмы начинается примерно через 30 с после генерации спайка, а полное восстановление скорости течения достигается в течение 10–15 мин [21]. Опыты, проведенные на кальцифицированных и свободных от кристаллов участках клеток, выявили качественно различную чувствительность флуоресценции хлоропластов F ' к генерации ПД. В областях, далеких от зон отложения кальциевых кристаллов и занимающих подавляющую часть поверхности клетки, возбуждение плазматических мембран при слабом фоновом освещении (10 мкмоль м–2 с–1) не оказывало влияния на уровень Фл Хл (рис. 2а). Вместе с тем, в участках, расположенных вблизи кальциевых отложений, генерация ПД вызывала временное повышение Фл хлоропластов и последующее ее снижение до исходного уровня (рис. 2б, 2в). При выдерживании клеток в темноте генерация ПД не вызывала изменений флуоресценции F '. Переходные изменения Фл Хл проявлялись наиболее ярко в хлоропластах, омываемых потоком цитоплазмы на выходе из зоны инкрустации. На противоположной стороне инкрустированной зоны, где цитоплазма поступала в область кальцификации, изменения Фл Хл после генерации ПД были небольшими или отсутствовали.
Рис. 2.
Различия ответных изменений флуоресценции F ' хлорофилла Chara australis при генерации потенциала действия (ПД) в участках разной локализации: (а) вдали (> 3 мм) от зон кальцификации клеточных стенок; (б, в) на границе с зонами отложения наружных кристаллов кальция. а – Отсутствие влияния ПД на F ' в зонах без инкрустации при низкоинтенсивном освещении (10 мкмоль м–2 с–1) всего междоузлия; представлены усредненные записи для пяти клеток. б и в – Примеры вызванных возбуждением изменений F ' при аналогичном освещении всего междоузлия (кривые 1) и небольшого (∅ 2 мм) участка клетки (кривые 2) на границе с зоной отложения кристаллов кальция. В части б представлены усредненные кривые F ' и стандартные ошибки для n = 2–3, а в части в – усредненные кривые для n = 8–9. Стрелками отмечены моменты пропускания электрического тока (~10 мкА, 150 мс), вызывающие генерацию ПД и временную остановку течения цитоплазмы.
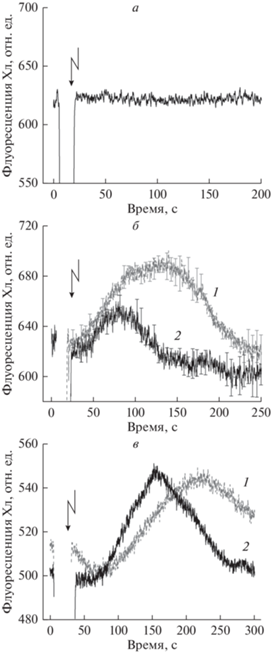
На рис. 2б и 2в показаны типичные изменения флуоресценции F ', вызванные генерацией потенциала действия в условиях общего и локального освещения клеток Chara светом слабой интенсивности (10 мкмоль м–2 с–1). Измерения проводили на свободных от кристаллов участках клетки, граничащих с зонами кальцификации. При общем стационарном освещении активность светозависимых транспортеров оболочки хлоропластов, отвечающих за накопление Ca2+ в строме и перенос восстановительных эквивалентов, сохраняется в пределах всей клетки, а в случае локального освещения активность транспортеров ограничена освещаемой зоной. Как видно из рис. 2б и 2в, пиковые значения F ' после генерации ПД достигались раньше при узком диаметре светового луча (кривые 2), чем при широком поле облучения (кривые 1). Кроме того, при общем освещении возврат F ' к исходному уровню продолжался существенно дольше, чем при локальном освещении области измерения и примыкающих участков. Эти наблюдения позволяют предполагать, что ответные изменения F ' после генерации ПД при общем освещении представляют собой суперпозицию нескольких процессов разной природы.
Повышение F ' после генерации ПД, по-видимому, вызвано подъемом уровня Ca2+ в строме освещенных хлоропластов [14] и подавлением фиксации СО2 [15]. Падение потребления NADPH в реакциях цикла Кальвина понижает содержание акцептора NADP+, что замедляет отток электронов от ФСI, способствуя восстановлению PQ и QA фотосистемой II и повышению флуоресценции F '. Известно, что медленные стадии индукционных изменений Фл Хл в фотосинтезирующих организмах тесно связаны с использованием NADPH в метаболических процессах [22]. Установлено также, что электроны поступают от NADPH и восстановленного ферредоксина в пул PQ по сегментам циклической цепи (по антимицин А-чувствительному и антимицин-нечувствительному путям) [23], что также повышает уровень F '. Параллельно с этим избыток NADPH удаляется из стромы в цитоплазму посредством транспортеров оболочки (“малатный клапан” и переносчик триозофосфатов) [24, 25].
Отмечая замедленный спад F ' на кривых 1 в сравнении с кривыми 2 на рис. 2б и 2в, следует учитывать, что площадь освещаемой области препарата определяет длину участка клетки, где происходит экспорт восстановителей из освещенных хлоропластов после временной остановки циклоза. При общем освещении содержание восстановительных эквивалентов в цитоплазме повышается в широкой области по всей клетке, тогда как при локальном освещении область повышенного содержания восстановителей в цитоплазме не выходит за пределы освещаемой зоны. Поэтому в период возобновления циклоза после ПД поступление восстановителей из цитоплазмы в строму анализируемых хлоропластов занимает более длительное время в условиях общего, а не локального освещения.
После генерации ПД при общем освещении всей клетки часто наблюдалось начальное снижение уровня F ' (рис. 2в, кривая 1). Появление этой стадии указывает на то, что редокс состояние стромы анализируемых хлоропластов контролируется составом цитоплазмы, поступающей с потоком в зону измерения Фл Хл из области кальциевых отложений, где фиксация СО2 заторможена. Остановка течения цитоплазмы нарушает микрофлуидную регуляцию, в результате чего редокс-состояние стромы временно смещается на новый уровень за счет диффузии и биохимических реакций.
Генерация ПД выявляет неоднородное продольное распределение фотометаболитов. Различия в кинетике изменений F ', вызванных потенциалом действия в условиях общего и локального освещения клетки лучами равной интенсивности (рис. 2) дают основания полагать, что изменения F ' имеют комплексную природу и обусловлены как внутренними процессами, протекающими в хлоропластах при повышении уровня Ca2+ в строме, так и обменом фотометаболитов между подвижной цитоплазмой и стромой хлоропластов. В зависимости от физиологического состояния клеток и экспериментальных условий эти процессы могут перекрываться в большей или меньшей степени. В пользу этого предположения говорит регистрация нескольких компонент в изменениях F ' после генерации ПД (рис. 3).
Рис. 3.
Колебания F ', вызванные генерацией ПД в условиях освещения (а) всей клетки и (б) участка клетки диаметром 2 мм. а: 1 – поддержание F ' на стационарном уровне в покое без приложения возбуждающего стимула; 2 – мультифазные изменения F ', вызванные генерацией ПД. б –Изменения F ' в ответ на генерацию ПД при разных расстояниях от места поступления цитоплазмы в освещаемую зону до области измерения F ': 1 – на удалении 1 мм, 2 – на расстоянии 0.5 мм. Стрелками отмечены моменты приложения возбуждающего электрического стимула. Результаты а и б получены при измерениях на одном и том же участке клетки.
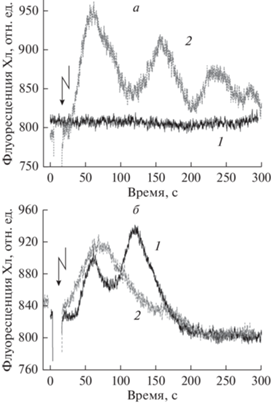
При экспозиции интернодальной клетки на слабом непрерывном свету уровень флуоресценции F ' в покое не претерпевал заметных изменений (рис. 3а, кривая 1). Однако электрическая стимуляция клетки запускала переходные процессы, при которых сигнал F ' менялся во времени колоколообразно и нередко в виде серии колебаний (рис. 3а, кривая 2). Существенно, что число наблюдаемых колебаний F ' сокращалось при сужении освещаемой площади препарата (рис. 3б). При переходе от общего освещения клетки к стационарному воздействию узким (диаметром 2 мм) лучом той же интенсивности и того же спектрального состава число осцилляций в ответной реакции F ' на возбуждение уменьшалось от 3–4 до двух. Кроме того, вторая полоса в серии из двух осцилляций дополнительно ослаблялась при сужении освещаемой области, из которой поступала “облучаемая” цитоплазма в зону измерения флуоресценции (кривые 1 и 2 на рис. 3б). Такое сужение дистанции достигалось путем смещения положения световода, а не области измерения F '. При локальном освещении оптоволокном более узкого диаметра (0.4 мм) ответные изменения F ' на возбуждение включали лишь один максимум, достигаемый через 50–80 с после генерации ПД. Зависимость числа колебаний F ' от размера освещаемой части клетки указывает на то, что второе и последующие колебания обусловлены дальними межхлоропластными взаимодействиями, а именно доставкой восстановительных эквивалентов в хлоропласты анализируемой зоны из соседних освещенных участков клетки. По-видимому, прекращение циклоза усиливает неоднородность продольного распределения восстановительных эквивалентов в цитоплазме, что проявляется в образовании чередующихся пиков F ' (рис. 3а, кривая 2). Это контрастирует с отсутствием изменений на записи F ' от времени при стационарной скорости течения цитоплазмы (рис. 3а, кривая 1).
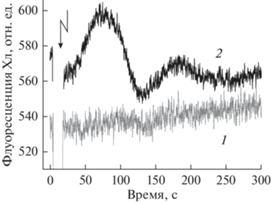
Зависимость индуцированных изменений F ' от состояния транспортеров оболочки. Для выявления роли транспортеров оболочки пластид в ответных реакциях F ' на генерацию ПД интернодальную клетку помещали в темноту, оставляя фоновое освещение лишь на узком (диаметром 2 мм) участке, по центру которого располагалась область регистрации Фл Хл. Результаты более ранней работы позволяют предполагать, что перенос клетки в темноту сопровождается временным понижением содержания восстановительных эквивалентов в цитоплазме [19], так как ферменты цикла фиксации СО2 и транспортеры редокс-соединений сохраняют активность на протяжении до десятков секунд в темноте и обеспечивают постсветовую ассимиляцию углекислоты. Как показано на рис. 4, генерация ПД через 2 мин после перехода от общего к локальному освещению не оказывала влияния на уровень Фл хлоропластов. Вместе с тем, в условиях стационарного локального освещения (15–60 мин) возбуждение клетки вызывало переходные изменения F ', которые в данном случае включали две волны возрастания свечения. Полученные результаты дополнительно подтверждают предположение о том, что смена общего на локальное освещение клетки Chara сопровождается временным подавлением дальней сигнализации между хлоропластами и последующим возобновлением передачи сигналов при переходе к новому стационарному режиму [19].
Рис. 4.
Различное влияние генерации ПД на флуоресценцию F ' после (1) короткого (2 мин) и (2) длительного (>15 мин) затенения всего препарата, за исключением небольшого (∅ 2 мм) участка клетки, экспонируемого на фоновом свету стандартной интенсивности. Стрелкой отмечен момент приложения электростимула и генерации ПД. Записи 1 и 2 получены для n = 2 и n = 4 соответственно.
ОБСУЖДЕНИЕ
Результаты данной работы показывают, что наличие щелочных зон с рН 10–10.5 на поверхности освещенных клеток Chara не является необходимым условием для трансформации электрического сигнала плазматической мембраны, приводящей к изменению состояния фотосинтетических мембран. Вместе с тем, ответные реакции F’ хлоропластов на возбуждение плазмалеммы проявлялись преимущественно вблизи участков наружной кальцификации, т.е. в местах возникновения наружных щелочных зон на свету повышенной интенсивности, и отсутствовали в фотосинтетически активных зонах, свободных от кристаллов кальция. Несмотря на отсутствие высокоамплитудных сдвигов рН на поверхности клетки в условиях слабого освещения, рН в области расположения кристаллов был на 0.5–0.75 ед. выше (вследствие гидратации CaCO3), чем на поверхности некальцифицированных участков и в объеме раствора. Известно, что смещение наружного рН в щелочную сторону повышает проводимость плазмалеммы для Н+ или ОН–, увеличивая входящий поток Н+ (или выход ОН–) [26], что может вызывать подкисление цитоплазмы. Поэтому вполне вероятно, что хлоропласты, лежащие вблизи кристаллов кальция и вдали от них, окружены цитоплазмой с неравными уровнями рН, причем повышенные значения рН стромы более благоприятны для фиксации СО2.
Известно также, что участки под зонами инкрустации отличаются от свободных областей отсутствием харасом – особых органелл, представляющих собой инвагинации плазмалеммы, обогащенные Н+-ATP-азой [9]. Значительное преобладание харасом и Н+-насосов в зонах, лишенных кристаллов, и их отсутствие в местах отложения нерастворимых солей кальция может вносить дополнительный вклад в неравномерное распределение Н+ в цитоплазме по длине междоузлий. Структурные и биохимические различия кальцифицированных и свободных от кристаллов областей, по-видимому, лежат в основе неодинаковых реакций хлоропластов в этих зонах на генерацию ПД. Участки с высоким содержанием харасом, соответствующие наружным кислым зонам, отличаются повышенным уровнем Са2+-связывающих белков в мембранных фракциях [27], что может сглаживать изменения [Ca2+] в цитоплазме таких доменов во время потенциала действия. С другой стороны, во фракции мембран щелочных (кальцифицированных) участков выявлено повышенное содержание фотосинтетических белков [27], что может определять высокую чувствительность флуоресценции F ' хлоропластов в этих областях к индуцированному возбуждением повышению концентрации Ca2+ в цитоплазме.
Изменения F ', вызванные генерацией ПД при общем освещении, часто проявляются в виде размытой полосы с характерной длительностью от 100 до 300 с на уровне половины высоты. Вместе с тем, в кинетике ответа нередко присутствовали локальные минимумы или узкие индивидуальные полосы (рис. 3, 4). Число пиков в изменениях F ' после генерации ПД сокращалось с уменьшением освещаемой площади препарата. При локальном освещении анализируемой области лучом с диаметром 0.4 мм ответная реакция F ' включала только один ранний пик. Это говорит о том, что относительно быстрые изменения F ' после генерации ПД отражают внутренние процессы в хлоропластах, протекающие в период остановки циклоза до возобновления активного движения цитоплазмы. В отличие от этого, последующие задержанные стадии связаны с восстановлением течения цитоплазмы, переносом фотометаболитов в потоке жидкости и их обменом между подвижной цитоплазмой и неподвижными хлоропластами. Дальние опосредованные течением цитоплазмы взаимодействия в интернодальных клетках Chara отчетливо выявляются по различиям индукционных кривых Фл Хл, вызываемых локальным и общим освещением [17, 18].
Предполагаемая схема влияния ПД на флуоресценцию F ' включает нарастание [Ca2+] в цитоплазме [12], поступление Са2+ в хлоропласты по механизму светозависимого унипорта [28], подавление фиксации СО2 [29], сопряженное с повышением содержания NADPH в строме, торможение в связи с этим линейного потока электронов, а также восстановление PQ и QA при переносе электронов от NADPH в пул PQ при участии оксидоредуктазы NDH (NAD(P)H-dependent dehydrogenase complex) [22, 23] и антимицин А-чувствительного сегмента циклической ЭТЦ [30]. Одним из элементов рассматриваемой схемы служит экспорт избытка восстановительных эквивалентов в период временного Са2+-зависимого подавления реакций цикла Кальвина, что повышает содержание восстановителей в цитоплазме. После возобновления циклоза восстановительные эквиваленты поступают по градиенту концентрации из обогащенной цитоплазмы в хлоропласты, где содержание NADPH и фотосинтетическая фиксация СО2 нормализуются в связи с удалением избытка Са2+ посредством Са2+/Н+-антипорта тилакоидных мембран [15].
Наблюдения нескольких волн возрастания F ' после генерации ПД говорят о том, что восстановительные эквиваленты, накапливаемые в цитоплазме в период остановки движения цитоплазмы, распределены неравномерно в осевом направлении. В случае их равномерного распределения изменения F ' проявляются в виде одной размытой полосы с затянутой стадией спада свечения. У клеток в состоянии покоя уровень фотометаболитов в цитоплазме, по-видимому, также распределен неравномерно, однако в стационарных условиях эта неравномерность остается скрытой. Она выявляется при индуцированной возбуждением остановке цитоплазмы. В частности, начальное снижение F ' после генерации ПД при общем освещении всей клетки указывает на то, что редокс-состояние хлоропластов вблизи зоны расположения кристаллов кальция при стационарном потоке смещено в сторону избытка восстановителей, но это смещение устраняется при остановке циклоза. Такое объяснение представляется обоснованным, поскольку хлоропласты в зоне инкрустации возможно экспортируют большее количество восстановителей в текущую цитоплазму из-за пониженного содержания доступного СО2 в области наружных щелочных зон [20]. Таким образом, возбуждение клеточных мембран позволяет выявить неоднородность распределения фотометаболитов по длине клетки. Не исключено также, что временная остановка течения цитоплазмы усиливает неоднородность распределения метаболитов, что проявляется в последовательном возникновении нескольких волн возрастания F ' после генерации ПД.
Учитывая положение первого пика F ' во времени на рис. 3 и 4, а также тот факт, что движение цитоплазмы становится заметным лишь через 30 с после генерации ПД, становится очевидным, что первый фронт нарастания F ', в отличие от последующей волны, происходит в период остановки циклоза. Поэтому первая волна отражает изменение редокс-состояния стромы за счет внутренних процессов в хлоропластах. Предполагая на основе рис. 3 и 4, что вторая волна изменений F ' достигает пика примерно через 100 с после начала возобновления циклоза, а скорость течения составляет к этому моменту 10 мкм/с при 21°С [21], находим, что за 100-секундный интервал активные метаболиты проходят с потоком расстояние менее 1000 мкм. Таким образом, появление второго максимума F ' вполне может быть связано с опосредованной циклозом доставкой восстановительных эквивалентов в пределах локально освещенного участка с диаметром 2 мм.
Следует отметить, что переход от общего к локальному освещению междоузлия сопровождался временным понижением F ' и сильным подавлением ответных изменений F ' после генерации ПД (рис. 4). Ранее показано, что аналогичная смена световых условий вызывает практически полное переходное устранение дальней передачи сигнала, опосредованной течением цитоплазмы [19]. Эти данные интерпретированы как результат совместного действия двух факторов: (1) прекращение образования NADPH в фотореакциях после затенения хлоропластов и (2) временное сохранение активности метаболических транспортеров оболочки хлоропластов и реакций ассимиляции СО2 после перехода свет–темнота. Сочетание этих факторов вызывает интенсивное поглощение восстановительных эквивалентов цитоплазмы для нужд постсветовой фиксации СО2 [31]. В этих условиях восстановительные эквиваленты цитоплазмы активно потребляются хлоропластами на границе освещенной и затемненной областей и не достигают с потоком зоны измерения F '. Следует отметить, что при генерации ПД через 2–3 мин после перехода от общего к локальному освещению в записях F ' часто отсутствовала первая волна изменений, индуцированных возбуждением. Это может говорить о том, что при активном потреблении NAD(P)H вне освещаемой зоны и сохранении активности метаболических транспортеров оболочки накопления NADPH в строме не происходит из-за высокой скорости экспорта восстановительных эквивалентов. Это объяснение аналогично интерпретации подавления стадий S–M–T в индукции Фл Хл клеток Chara после перехода от общего к локальному освещению [18].
Подводя итог, следует отметить, что (1) генерация ПД оказывает влияние на Фл хлоропластов, расположенных вблизи кальцифицированных зон, но не оказывает влияния на F ' в преобладающих по размеру некальцифицированных участках; (2) изменения Фл Хл, вызванные генерацией потенциала действия, включают ранние стадии, обусловленные внутренними процессами в хлоропластах, а также задержанные стадии, обусловленные циклоз-зависимым обменом фотометаболитов между подвижной цитоплазмой и неподвижными хлоропластами; (3) влияние потенциала действия на Фл Хл временно устраняется после перехода от общего освещения клетки к локальному освещению ее небольшого участка, включающего область регистрации F '. Такое нарушение трансформации сигнала связано, вероятно, с усиленным потреблением затененными хлоропластами восстановительных эквивалентов цитоплазмы в период, когда светозависимое образование NADPH прекращается из-за остановки фотосинтетического транспорта электронов, а “малатный клапан” и транслокатор триозофосфатов остаются некоторое время активными в темноте, понижая содержание восстановленных редокс-агентов в цитоплазме.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 20-54-12 015), а также в рамках научного проекта государственного задания МГУ № 121032500058-7.
Соответствие принципам этики. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Król E., Dziubinska H., Trebacz K. 2010. What do plants need action potentials for? In: Action potential: biophysical and cellular context, initiation, phases and propagation. Ed. DuBois M.L. New York: Nova Science, p. 1–26.
Hagihara T., Toyota M. 2020. Mechanical signaling in the sensitive plant Mimosa pudica L. Plants. 9, 1–10.
Hedrich R., Neher E. 2018.Venus flytrap: How an excitable, carnivorous plant works. Trends Plant Sci. 23, 220–234.
Grams T.E.E., Lautner S., Felle H.H., Matyssek R., Fromm J. 2009. Heat-induced electrical signals affect cytoplasmic and apoplastic pH as well as photosynthesis during propagation through the maize leaf. Plant, Cell Environ. 32, 319–326.
Sukhov V. 2016. Electrical signals as mechanism of photosynthesis regulation in plants. Photosynth. Res. 130, 373–387.
Krupenina N.A., Bulychev A.A. 2007. Action potential in a plant cell lowers the light requirement for non-photochemical energy-dependent quenching of chlorophyll fluorescence. Biochim. Biophys. Acta. 1767, 781–788.
Krupenina N.A., Bulychev A.A., Roelfsema M.R.G., Schreiber U. 2008. Action potential in Chara cells intensifies spatial patterns of photosynthetic electron flow and non-photochemical quenching in parallel with inhibition of pH banding. Photochem. Photobiol. Sci. 7, 681–688.
Bulychev A.A., Kamzolkina N.A. 2006. Differential effects of plasma membrane electric excitation on H+ fluxes and photosynthesis in characean cells. Bioelectrochemistry. 69, 209–215.
Hoepflinger M.C., Hoeftberger M., Sommer A., Hametner C., Foissner I. 2017. Clathrin in Chara australis: Molecular analysis and involvement in charasome degradation and constitutive endocytosis. Front. Plant Sci. 8, 20. https://doi.org/10.3389/fpls.2017.00020
Pavlovič A., Slováková L., Pandolfi C., Mancuso S. 2011. On the mechanism underlying photosynthetic limitation upon trigger hair irritation in the carnivorous plant Venus flytrap (Dionaea muscipula Ellis). J. Exp. Bot. 62, 1991–2000.
Vredenberg W., Pavlovič A. 2013. Chlorophyll a fluorescence induction (Kautsky curve) in a Venus flytrap (Dionaea muscipula) leaf after mechanical trigger hair irritation. J. Plant Physiol. 170, 242–250.
Williamson R.E., Ashley C.C. 1982. Free Ca2+ and cytoplasmic streaming in the alga Chara. Nature. 296, 647–651.
Berestovsky G.N., Kataev A.A. 2005. Voltage-gated calcium and Ca2+-activated chloride channels and Ca2+ transients: Voltage-clamp studies of perfused and intact cells of Chara. Eur. Biophys. J. 34, 973–986.
Kreimer G., Melkonian M., Latzko E. 1985. An electrogenic uniport mediates light-dependent Ca2+ influx into intact spinach chloroplasts. FEBS Lett. 180, 253–258.
Johnson C.H., Shingles R., Ettinger W.F. 2007. Regulation and role of calcium fluxes in the chloroplast. In: The structure and function of plastids. Eds Wise R.R., Hoober J.K. Dordrecht: Springer, p. 403–416.
Kamiya N. 1986. Cytoplasmic streaming in giant algal cells: A historical survey of experimental approaches. Bot. Mag. Tokyo. 99, 441–467.
Булычев А.А. 2021. Индукционные изменения флуоресценции клеток Chara, связанные с обменом метаболитов между хлоропластами и потоком цитоплазмы. Биол. мембраны 38, 187–198.
Bulychev A.A., Cherkashin A.A., Shapiguzov S.Yu., Alova A.V. 2021. Effects of chloroplast–cytoplasm exchange and lateral mass transfer on slow induction of chlorophyll fluorescence in Characeae. Physiol. Plant. 173, 1901–1913.
Bulychev A.A. 2020. Transient depletion of transported metabolites in the streaming cytoplasm of Chara upon shading the long-distance transmission pathway. Biochim. Biophys. Acta. 1861,148257.
Bulychev A.A., Cherkashin A.A., Rubin A.B., Vredenberg W.J., Zykov V.S., Müller S.C. 2001. Comparative study on photosynthetic activity of chloroplasts in acid and alkaline zones of Chara corallina. Bioelectrochemistry. 53, 225–232.
Tsuchiya Y., Yamazaki H., Aoki T. 1991. Steady and transient behaviors of protoplasmic streaming in Nitella internodal cell. Biophys. J. 59, 249–251.
Ogawa T., Suzuki K., Sonoike K. 2021. Respiration interacts with photosynthesis through the acceptor side of photosystem I, reflected in the dark-to-light induction kinetics of chlorophyll fluorescence in the cyanobacterium Synechocystis sp. PCC 6803. Front. Plant Sci. 12, 717968. https://doi.org/10.3389/fpls.2021.717968
Shikanai T., Yamamoto H. 2017. Contribution of cyclic and pseudo-cyclic electron transport to the formation of proton motive force in chloroplasts. Mol. Plant. 10, 20–29.
Scheibe R. 2004. Malate valves to balance cellular energy supply. Physiol. Plant. 120, 21–26.
Taniguchi M., Miyake H. 2012. Redox-shuttling between chloroplast and cytosol: integration of intra-chloroplast and extra-chloroplast metabolism. Curr. Opin. Plant Biol. 15, 252–260.
Bisson M.A., Walker N.A. 1980. The Chara plasmalemma at high pH. Electrical measurements show rapid specific passive uniport of H+ or OH–. J. Membr. Biol. 56, 1–7.
Pertl-Obermeyer H., Lackner P., Schulze W.X., Hoepflinger M.C., Hoeftberger M., Foissner I., Obermeyer G. 2018. Dissecting the subcellular membrane proteome reveals enrichment of H+ (co-) transporters and vesicle trafficking proteins in acidic zones of Chara internodal cells. PLoS One. 13, 1–28.
Kreimer G., Melkonian M., Holtum J.A.M., Latzko E. 1988. Stromal free calcium concentration and light-mediated activation of chloroplast fructose-1,6-bisphosphatase. Plant Physiol. 86, 423–428.
Stael S., Wurzinger B., Mair A., Mehlmer N., Vothknecht U.C., Teige M. 2012. Plant organellar calcium signalling: an emerging field. J. Exp. Bot. 63, 1525–1542.
Bulychev A.A. Rybina A.A. 2018. Long-range interactions of Chara chloroplasts are sensitive to plasma-membrane H+ flows and comprise separate photo- and dark-operated pathways. Protoplasma. 255, 1621–1634.
Pearcy R.W., Krall J.P., Sassenrath-Cole G.F. 2006. Photosynthesis in fluctuating light environments. In: Photosynthesis and the environment. Ed. Baker N. Dordrecht: Kluwer, p. 321–346.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


