Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 4, стр. 292-306
Физиология перехватов Ранвье живых миелиновых волокон
О. С. Сотников a, С. В. Ревенко b, *
a Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
b НИИ экспериментальной кардиологии ФГБУ НМИЦ кардиологии Минздрава РФ
121552 Москва, Россия
* E-mail: s_revenko@mail.ru
Поступила в редакцию 14.01.2022
После доработки 02.03.2022
Принята к публикации 03.03.2022
- EDN: ICKKMY
- DOI: 10.31857/S0233475522040077
Аннотация
Известно, что все фиксированные гистологические препараты не могут претендовать на доказательства динамики морфофизиологических объектов, являясь лишь основой для гипотетической физиологии. В то же время прижизненная микроскопия подвижных и изменяющихся структур может рассматриваться как область клеточной физиологии. Настоящее исследование сфокусировано на раскрытии особенностей этого отдела нейрофизиологии в отношении нервных волокон. Важно отметить, что приготовление препаратов живых изолированных нейронов по Тасаки непременно вызывает определенное механическое воздействие на структуру перехвата, масштаб и значимость которого остаются малоизученными. Альтерации могут заключаться в деформации или исчезновении миелинового конуса перехвата, частично луковицы волокна и в изменении щели перехвата. Такие же изменения возникают и у интактного волокна в течение длительного переживания в растворе Рингера. При электронной микроскопии набухание и увеличение объема нейроплазмы паранодальных петель в гипотонических растворах сопровождаются захватом территории аксоплазмы конуса при сужении аксона. Эти процессы являются обратимыми. По-видимому, они отражают новую форму метаболического трансмембранного нейроглиального обмена глюкозы, аминокислот и других низкомолекулярных соединений, ведущего к образованию смешанной общей цитоплазмы нервного волокна. Потеря четкой границы миелина конуса и частично луковицы зависит от массового расщепления одиночных главных плотных линий и обводнения пучков нодальных петель. Влияние гипертонического раствора мочевины (2 М), не вызывающей набухания цитоплазмы, но денатурирующей белки, вызывает сходные изменения перехвата Ранвье. Следовательно, описанные изменения перехватов Ранвье связаны не с явлением внешней осмотической альтерации, а с влиянием неспецифических физических изменений конформации протеинов аксоплазмы. Проведенные электрофизиологические эксперименты с исследованием перехватов методом фиксации потенциала продемонстрировали соответствие структурных и электрофизиологических изменений натриевой и калиевой проводимостей, а также проводимости утечки. Опыты с модификатором натриевых каналов батрахотоксином не выявили структурных изменений перехватов в течение часа. Рассмотренные данные означают, что исходным механизмом альтерации перехватов, по-видимому, является не изменение белковых структур аксолеммы, а конформационная перестройка белков аксоплазмы.
ВВЕДЕНИЕ
Большинство исследователей считают перехваты Ранвье главной физиологически значимой структурой миелиновых волокон [1–6]. Именно перехваты Ранвье обеспечивают высокоскоростное сальтаторное проведение нервных импульсов. В дискуссии о значении глии в функции нервной системы, миелиновые нервные волокна, и особенно, их перехваты занимают важное место. Считается, что “именно клетки глии и обеспечивают существование и функционирование нервных клеток, выполняя опорную, разграничительную, трофическую, защитную и секреторную функции”. “Глиальные клетки являются ключевыми регуляторами функции нервных цепей” [7]. При этом остается неясным, каким образом электрическая активность самого нейрона влияет на состояние и микроструктуру глии, в частности, на перехват Ранвье и насечки Шмидта–Лантермана. Несомненно, изменение морфологии перехватов (глии) сказывается и, возможно, весьма существенно, на функции миелинового волокна.
Морфологическое строение перехватов Ранвье (nodus, узел) в статике хорошо известно. Под электронным микроскопом можно выявить их самостоятельные структуры: два терминальных отдела смежных миелиновых оболочек [8] с паранодальными мембранными петлями [9–11] и аксоглиальными септами [5, 6, 12, 13], а также суженный аксон между терминалями миелиновых оболочек [11, 14–16]. По-видимому, только путем экспериментов на перехватах живых миелиновых волокон можно выяснить особенности их морфофизиологической динамики, интегрированную связь между ними, их влияние на функцию нервных волокон и воздействие самой нервной активности на морфологическую динамику перехватов.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на седалищных нервах лягушек Rana temporaria (n = 87), выловленных в водоемах Ленинградской области. Эксперименты проведены в гипотоническом растворе Рингера, в вазелиновом масле, в растворе мочевины (2 М), а также в растворе Рингера с батрахотоксином (20 мкМ). Исследования проводили методом фазового контраста на микроскопе МБИ-13 (ЛОМО, СССР). Кинетику морфологических изменений перехвата Ранвье нерва лягушки регистрировали с помощью видеосъемки. Использована видеокамера DCM310 (Scopetek, Китай).
Ультратонкие срезы готовили на ультратоме LKB-5 (Bromma, Швеция) и окрашивали тройным контрастом по Рейнольдсу. Ультраструктурные исследования проводили с помощью электронного микроскопа LEO-10 (Carl Zeiss, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физические свойства структур перехватов живых волокон в статике. Миелиновая оболочка представляет собой слоистое образование со свойствами жидкости. Ее форма объясняется тем, что, обладая такими физическими свойствами, как вязкость и адгезия, миелин располагается вокруг осевого цилиндра (аксона), имеющего определенное сходство с сократимым гелем, способным в отличие от жидкости длительное время удерживать цилиндрическую форму, даже протеолитически лишенным наружной опорной соединительной ткани [17]. Обладая в целом стабильной трубчатой формой, живое волокно характеризуется резким сужением в области перехвата Ранвье. В центре перехвата оболочка образует миелиновый конус, достигающий размеров также суженного аксона, причем по обе стороны от этого центра диаметр волокна увеличивается (рис. 1а). Физические свойства миелина являются свидетельством динамики его онтогенетического построения. Поскольку миелин является жидкой субстанцией, ему присуще поверхностное натяжение и свободная поверхностная энергия Гиббса [18]. На концах межперехватного сегмента миелиновой оболочки давление Лапласа (P) стремится сформировать каплевидное утолщение (луковицу перехвата). Известно, что внутри микроскопических капель это давление может быть очень большим, так как оно обратно пропорционально радиусу (R) капли согласно формуле: P = 2а/R, где а является поверхностным натяжением. Стремясь сократить площадь своей поверхности, миелин ретрагирует и отдаляет друг от друга миелиновые оболочки смежных шванновских клеток, тем самым формируя щель перехвата (рис. 1а) и позволяя межклеточной жидкости достичь внешней стороны аксона. В результате этого оказывается возможным движение ионов через мембрану, необходимое для электрической активности перехвата Ранвье. Стремясь образовать сферу, миелин одновременно в силу молекулярного внутриклеточного давления сужает аксон в конусе перехвата. Увеличение объема в области луковицы происходит благодаря жидкостным свойствам геля аксоплазмы (рис. 1в). В норме в области щели перехвата обнаруживается уникальное физическое свойство аксоплазмы перехвата, незамеченное в предыдущих исследованиях. Действительно, аксоплазма в норме дифференцируется на два слоя: периферическую жидкую аксоплазму и относительно твердую фазу с низкой степенью дисперсности аксоплазматических белковых микротрубочек. В результате в центре цитоплазмы аксона выделяется относительно твердый, плотный агрегат белковых микротрубочек, который называется аксиальным тяжем. В этом месте экструзия жидкого слоя может превращаться в пресинаптическое выпячивание или в тканевой рецептор [19].
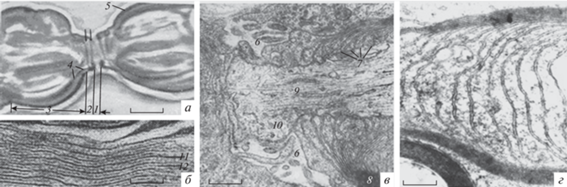
Рис. 1.
Структурные элементы условно нормального живого перехвата Ранвье в световом (а) и электронном (б–г) микроскопах. 1 – Межсегментарная щель перехвата; 2 – миелиновый конус; 3 – луковица перехвата; 4 – уменьшение толщины мякотной оболочки в области конуса; 5 – мякотная оболочка; 6 – наружные отростки шванновской клетки; 7 – паранодальные петли и формирующиеся септы; 8 – компактный миелин; 9 – уменьшение дисперсности микротрубочек аксоплазмы; 10 – жидкая фракция экструзии аксоплазмы; 11 – главная линия; 12 – промежуточная линия. а – Прижизненная микроскопия, фазовый контраст. Ph 90, Ок. 20. б–г – Электронная микроскопия, увеличение 78 000× (б), 50 000× (в), 56 000× (г). Масштабные полоски: 3.0 (а), 7.4 (б), 3 (в), 8.5 мкм (г).
Представленные физические свойства прижизненной статической морфологии дают новые возможности для гипотез о морфофизиологической динамике перехватов. Несмотря на то, что в литературе широко обсуждаются различные гипотетические молекулярные механизмы формирования перехватов Ранвье после сборки “ранних кластеров” Na+-каналов аксолеммы, до сих пор нет убедительных данных об их структурной динамике [20].
Варианты ультраструктуры перехватов в статике увеличивают возможность морфофизиологической динамики. Электронная микроскопия выявила особенности структуры живого волокна (рис. 1). Компактный миелин (рис. 1б–1г) в области конуса оказался состоящим из пластин, известных как главные и вспомогательные линии Робертсона [21]. Расщепление главных плотных линий и их последующий контакт с образованием истинных мембран оказались паранодальными глиальными петлями (рис. 1в), которые в трехмерном пространстве представляют собой единый низкоомный электрический проводящий путь между внешней средой и аксоном (рис. 1г). Обращают на себя внимание три ультраструктурные особенности. Во-первых, на разных собственных фотографиях препаратов и иллюстрациях других авторов петли различаются объемом их содержимого. Эти препараты могут представлять собой крупные объемные вытянутые петли с четким раздвоением главных плотных линий миелина, а также малые по объему шаровидные полости. Логично предположить, что указанные структуры могут быть фазами или стадиями некоторого единого динамического процесса, физиологически связанного с водообменом в цитоплазме глиоцита (в частности, с набуханием).
Вторым существенным вариантом глиоплазмы паранодиума является электронно-плотный материал петель (рис. 2). Несмотря на то что электронная микроскопия не считается строгим гистохимическим методом, она способна выявить биологические мембраны с четко определяемой формой, а также белки, которые бывают различной оптической плотности, зависящей от их локальной концентрации [21–23]. С учетом этого обстоятельства следует обратить внимание на характер плотности заполнения паранодального канала белками глиоплазмы (рис. 2). Исследования выявили различную степень концентрации белков в глиальных паранодальных петлях конуса перехвата: от плотного их заполнения до следовых количеств, оцениваемых по маркеру белка в отдельных агрегатах, которые адгезированы, главным образом, на глиальной мембране [24]. Важно отметить, что снижение дисперсности агрегатов должно приводить к просветлению глиоплазмы аналогично тому, что наблюдается при любой агрегации протеинов в растворах. При этом остается неясным, почему при геометрически аккуратной и упорядоченно четкой организации светлых нормальных паранодальных петель в них полностью отсутствует глиоплазма. Они не только лишены гранул и других органелл, но в них также обесцвечен маркер цитоплазматического белка.
Рис. 2.
Характер распределения межмембранных аксоглиальных белков паранодальной зоны (а, б). 1 – Межклеточные аксоглиальные щели, полностью заполненные диффузным черным веществом, отмеченным маркером белка; 2 – появление признаков замаскированных септ; 3 – сформированные белковые агрегаты межклеточных септ; 4 – основные плотные линии миелина по Робертсону; 5 – белковые структуры глии; 6 – плотное заполнение паранодальных петель белковым материалом. Электронная микроскопия, увеличение 55 000×. Масштабные полоски: 5.7 (а) и 6.0 мкм (б).
Наконец, третьим признаком предполагаемой динамики структуры можно считать наличие или отсутствие септированных (лестничных) контактов (мостиков) в аксоглиальной межклеточной щели [24, 25]. Нейроморфологам хорошо известно, что эти контакты в норме нередко не могут быть выделены; при этом они выглядят как непрерывные бесщелевые, плотно импрегнированные контакты в связи с тем, что межклеточная глионейрональная щель полностью заполнена электронно-плотным белковым материалом. Плотность его столь велика, что она закрывает собой как глиальную, так и нейрональную мембраны [9, 15]. Часть препаратов имеет форму с едва заметными межклеточными агрегатами белка (рис. 2а), напоминающими септы со светлым окружением и выявляющимися мембранами [11, 12, 26]. Другие исследователи выявили выраженные многочисленные септы на границе паранодальных петель и аксона [12, 27]. В настоящее время изучен подробный состав этих своеобразных межклеточных контактов [5, 6, 25, 28]. При сравнении вариантов таких препаратов возникает предположение о том, что указанные септы являются не постоянными, а транзиторными структурами, связанными с какими-то парабиотическими альтерациями, способствующими обратимой конформации ранее компактных мембранных протеинов. В работах [26, 29] петли и аксоглиальные контакты на одних рисунках заполнены контрастным гранулярным веществом, а на других можно различить значительное число септированных паранодальных контактов. В этих и других работах исследователи рассматривают септы как постоянные статичные структуры перехватов, барьеры между ионными каналами аксолеммы или перегородками субмембранных каналов [5]. Возможно, это тот же структурный эффект, который маскирует и межклеточную щель между паранодальными петлями и аксолеммой. По-видимому, диаметр аксонального тяжа внутри щели перехвата изменяется мало, однако на разных препаратах у нас и других авторов существенно варьирует объем и форма слоя окружающей его аксоплазмы. В некоторых случаях она напоминает результат экструзии аксоплазмы, “выдавленной” с двух сторон паранодальными петлями смежных миелиновых волокон (рис. 3а). Указанное обстоятельство предполагает возможность временного сближения и расхождения миелиновых оболочек, а главное, временных колебаний площади аксолеммы и плотности распределения на ней Na+- и K+-каналов. При этом не исключены гипотетическое влияние сократимости терминалей соседних миелиновых оболочек и отрыв групп глиальных пластин от компактного комплекса миелина.
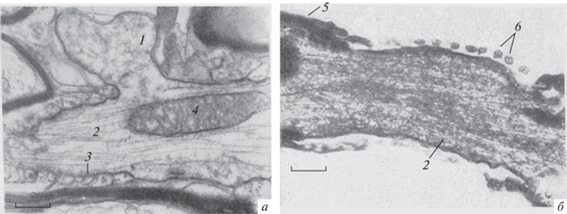
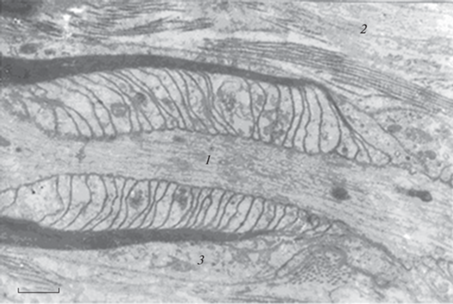
Рис. 3.
Варианты ультраструктур интранодальных щелей и структуры аксонов перехватов Ранвье. а – Экструзия жидкой фракции аксоплазмы, позволяющая предположить ее возможное сдавление в щели перехвата паранодальными петлями; б – микротубулярный аксональный тяж при возможном расширении щели перехвата, удлинении безглиальной части аксона и растяжении выступающей жидкой фракции аксоплазмы от центра щели по бокам к сегментам миелина; 1 – хлопьевидный материал жидкой фракции; 2 – микротубулярный аксиальный тяж; 3 – глиальные паранодальные мембранные петли перехвата; 4 – митохондрия; 5 – терминальные отростки шванновской клетки; 6 – периаксональные микроворсинки терминальных отростков глиоцита. Электронная микроскопия, увеличение 40 000×. Масштабные полоски: 3.2 (а), 3.1 мкм (б).
Статика электронной микроскопии раскрывает широкие просторы для гипотетических представлений о динамике морфологической физиологии, однако истинная динамика структуры перехватов может быть реализована только при изучении живых нервных волокон и реальной изменчивости перехватов in vivo.
Реальная морфологическая физиология изменчивой структуры живых перехватов. Длительные наблюдения за живыми перехватами свидетельствуют о том, что их структура в разные промежутки времени постоянно находится в процессах обратимых изменений. Весьма вероятно, что тщательное и осторожное препарирование одиночных миелиновых волокон по методу Тасаки [30] является неконтролируемым механическим воздействием на нерв, приводящим к определенным микроскопическим изменениям щели перехвата, а нередко и к едва заметному расщеплению компактного слоистого миелина конуса перехвата (рис. 4). По-видимому, это никак не сказывается на электрических параметрах нервного волокна в условиях контролируемого воздействия на мембрану электрическим током, позволяющим задать необходимый уровень “поддерживаемого” потенциала покоя [31–33]. Поэтому такие картины можно принимать за условную норму, представляющую собой интактный контрольный образец (рис. 1). При этом у многих соседних волокон во время механического препарирования развиваются более значительные изменения, так что их перехваты можно выстроить в ряд возрастающей степени альтерации при физическом воздействии (рис. 4а–4г). Начало изменений перехватов живых волокон в световом микроскопе проявляется в виде расширения щели перехвата (рис. 5а). Этот процесс сопровождается расщеплением миелина конусов перехвата и их визуальным исчезновением (рис. 5б). Отделяющиеся от компактного миелина комплексы ламелл смещаются внутрь аксоплазмы и в сторону от щели перехвата. Они принимают S-образную форму, оставаясь закрепленными у контактов с аксолеммой, но отщепленными от компактного миелина. Адгезия и расщепление ламелл миелина отражают два противоположных процесса: мембранные отщепления мелких слоев и повторное их слияние в новые крупные комплексы, способные организовывать структуру вторичного миелинового конуса такого же диаметра, как аксиальный тяж в щели перехвата (рис. 5в). Одновременно в аксоплазме в области луковицы перехвата начинает появляться продольная тень оптически более плотной продольной осевой структуры, равной по диаметру аксиальному тяжу перехвата (рис. 5б), свидетельствуя о диссоциации аксоплазмы на две фракции: на более жидкую периферическую и на белковый агрегированный пучок, являющийся продолжением аксиального тяжа и агрегатов микротрубочек в щели перехвата. На этом этапе паранодальная аксоплазма превращается в истонченный аксиальный тяж. Важно отметить, что в работах, описывающих цитоскелет аксоплазмы, не отмечена такая явная перестройка цитоскелета микротрубочек [26, 34]. Образование аксонального тяжа при патологии не замечают и другие авторы [35]. Существенно, что его не видел и Ramon y Cajal на своих препаратах [36]. В результате указанных альтераций весь освободившийся объем жидкой аксоплазмы занят набухшими паранодальными петлями. Между слоями расщепившегося миелина всегда наблюдаются обводненные фракции глиоплазмы (рис. 6). Полученные данные ставят вопрос, откуда у глиальных мембранных петель живых волокон берется вода для набухания конусов и луковиц, содержащих петли паранодиума.
Рис. 4.
Схемы вариантов структуры перехватов Ранвье, полученных в результате препарирования по методике Тасаки [30]. а – Нормальная структура перехвата; б – расслоение миелина в области конусов перехвата; в – расширение щели перехвата и потеря видимости перехвата в результате увеличения диссоциации пластин миелина; г – перехват с деформированными луковицами и расслоением в них миелина; 1 – щель перехвата; 2 – миелиновые конусы; 3 – луковица перехвата с расслоениями компактного миелина.
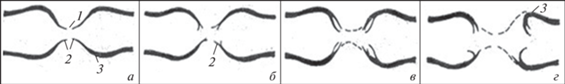
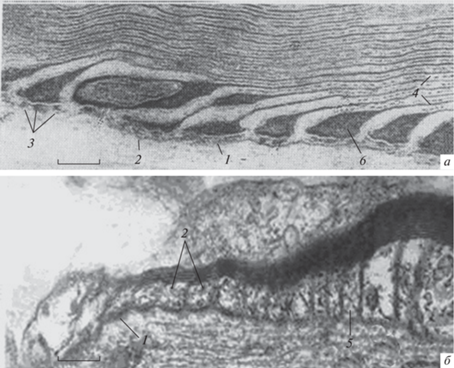
Рис. 5.
Морфологические функционально значимые эффекты спонтанной аутоальтерации перехвата в растворе Рингера. а – Первичное расщепление компактного миелина перехвата (3 ч 40 мин переживания); б – выраженное кольцевидное расслоение компактного миелина конца луковицы, появление признаков диссоциации аксоплазмы на две фракции: жидкую и твердую; в – деструктуризация компактного миелина конуса в результате массового расщепления слоев миелина; 1 – комплексы ламелл миелина, отщепленного в области конуса; 2 – аксиальный тяж; 3 – жидкая фракция аксоплазмы; 4 – вторичный миелиновый конус; 5 – снижение контрастности структур в результате массового расщепления ламелл миелина. Прижизненная микроскопия. Об. Ph. 40. Ок. 20. Масштабные полоски: 5.4 (а), 5.4 (б), 4.1 мкм (в).
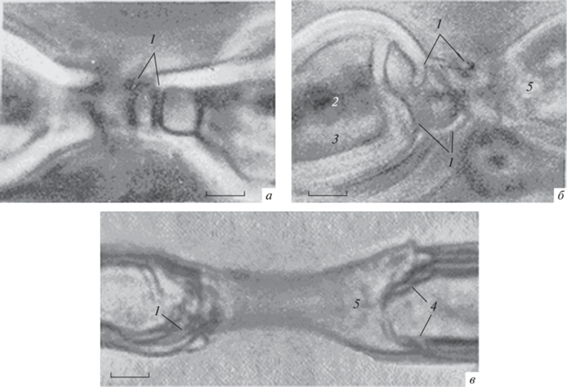
Рис. 6.
Перехват Ранвье живого миелинового волокна, переживающего в гипотоническом растворе Рингера в течение 3 ч. 1 – Расслоение компактного миелина; 2 – светорассеяние ламелл компактного миелина при их массовой дезинтеграции; 3 – набухшая полость в области расщепления миелинового конуса, напоминающая цистерну набухшей насечки Шмидта–Лантермана; 4 – формирующийся аксиальный тяж. Прижизненная микроскопия. Об. Ph. 40, Ок. 20. Масштабная полоска: 4.6 мкм.
Новый класс общего метаболизма аксона и глии в морфологической физиологии перехватов. Известно, что набухание любых живых клеток всегда связано с водой внешней среды. Мы выполнили серию опытов с помещением изолированных нормальных миелиновых волокон лягушки в гипотонический раствор Рингера, разбавленный в 2 раза, надеясь увидеть набухание и увеличение общего диаметра всех частей живого миелинового волокна. В гипотоническом растворе в течение получаса идеальное, нормальное волокно (рис. 6) действительно обнаружило набухание в зоне паранодальных петель миелинового конуса (эта картина подобна набуханию в это же время всех насечек Шмидта–Лантермана). Удивительно, что при этом внешний диаметр всего живого волокна не увеличивался. Естественные оптические колебания размеров живого волокна в среде гипотонического раствора Рингера не превышали ±4%.
Под фазово-контрастным микроскопом у экспериментальных перехватов можно наблюдать глиальные, видимо заполненные глиоплазмой, “цистерны”, оккупирующие пространство, ранее занятое жидкой аксоплазмой и сдавленное набухшими паранодальными петлями (рис. 6). Такую альтерацию можно ошибочно принять за удлинение аксона [37] (рис. 7). Действительно, при своем расщеплении и рассеивании одиночные ламеллы теряют оптическую плотность и перестают быть четко видимыми в световом микроскопе (рис. 6); при этом контрастная граница оболочки представляется смещенной в сторону от щели перехвата.
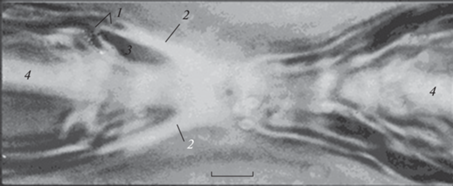
Рис. 7.
Удлинение аксона (аксиального тяжа) при оккупации набухшими паранодальными петлями зоны бывшей жидкой фракции аксоплазмы. 1 – Аксиальный тяж; 2 – пучок соединительнотканных волокон эндоневрия; 3 – наружный слой шванновской аксоплазмы. Электронная микроскопия, увеличение 40 000×. Масштабная полоска: 5.1 мкм.
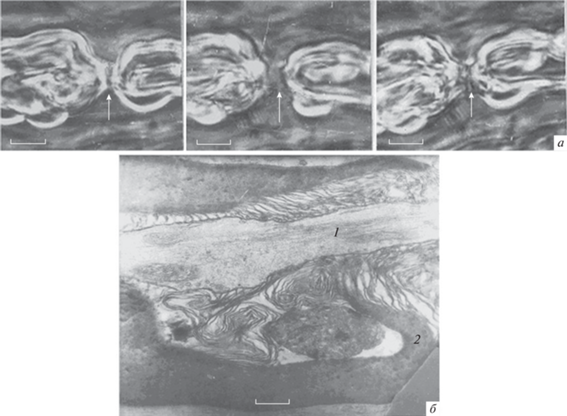
Динамику живого перехвата с расширением щели можно наблюдать с помощью видеосъемки (рис. 8а). При такой съемке сегменты плотного миелина представляются расходящимися, расширяя щель перехвата и увеличивая площадь обнаженного аксиального тяжа. Однако данное представление является обманчивым: оно связано с диффузным рассеиванием контактных ламелл и потерей их видимости. В течение 40 мин отчетливо видно, как развивалось отделение целых ламеллярных комплексов компактного миелина (рис. 8б). При этом усиливалось расщепление компактного миелина и одновременно набухали насечки Шмидта–Лантермана, что принципиально важно. После замены гипотонического раствора на изотонический раствор Рингера структура конуса и измененной миелиновой луковицы перехвата полностью восстанавливалась (рис. 8б). На нескольких препаратах удалось отметить, что размер щели перехвата и всей структуры конусов восстанавливались лучше по сравнению с наблюдениями в начале эксперимента (рис. 8в). Возможность подобного “супернормального” восстановления скорости проведения предполагали Kanda и соавторы [2]. По-видимому, в данных опытах мы впервые наблюдали морфофизиологический эффект этого уникального физического явления. Комплекс живых волокон в гипотонической среде длительное время не набухает и не увеличивается в объеме. При этом нельзя не заметить значительного локального уменьшения объема аксона под паранодальной областью миелиновой оболочки. Диаметр аксона здесь выравнивается с толщиной его безмиелинового отдела, то есть аксиального тяжа в щели перехвата (рис. 6, 7 и 8а). Наряду с указанными альтерациями существенно увеличивается плотность распределения микротрубочек. Стоит подчеркнуть, что уменьшение степени дисперсности белковых структур и их физическая агрегация высвобождает значительный объем связанной воды. Очевидно, что именно эта вода, уменьшая осмотическое давление аксоплазмы, проникает через мембраны и создает эффект набухания глиоплазмы паранодальных протоков петель перехвата. Такой физический эффект способен предотвратить общее набухание волокна за счет гипотоничности нейроплазмы волокна в перехвате и в насечках. Этот процесс легко обратим (рис. 8б, 8в).
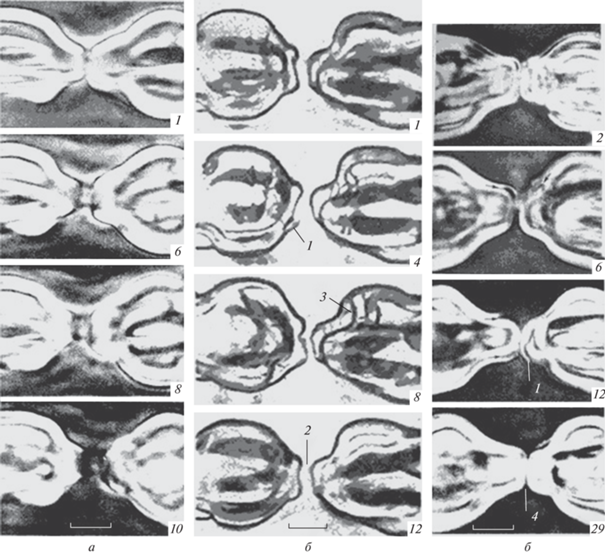
Рис. 8.
Обратимая морфофизиологическая динамика перехвата Ранвье живого миелинового нервного волокна при воздействии гипотонического раствора, разбавленного в 2 раза, и его восстановление в растворе Рингера. а – Динамика кажущегося расширения щели перехвата Ранвье при альтерации миелинового волокна в течение 30 мин; б – выраженное расслоение компактного миелина конуса и луковицы (циркулярное распространение групп отщепившихся пучков ламелл). Восстановление структуры в нормальном растворе Рингера через 40 мин; в – супервосстановление размеров щели и степени расщепления миелинового конуса; 1 – начало расщепления конуса миелина; 2 – восстановление размеров щели перехвата; 3 – циркулярное расщепление s-образного комплекса ламелл миелина; 4 – супервосстановление щели и компактности ламелл миелина конуса. В правом нижнем углу даны номера кадров цейтраферной съемки. Об. Ph. 40. Ок. 20. Масштабные полоски 3 мкм.
Представлялось важным проверить данный эффект с помощью мочевины с высокой концентрацией (2 М), тоничность раствора которой в несколько раз превышает таковую у раствора Рингера. Как известно, мочевина способна вызывать денатурационные изменения структуры белка [38]. При этом трудно представить, что набухание паранодальных петель конуса и расслоение миелина (типичная реакция “гипотонического типа”) может возникнуть у перехвата под влиянием гипертонического раствора мочевины, во много раз превышающего тоничность раствора Рингера. Вопреки ожиданиям, опыты выявили, что при действии мочевины миелин конусов полностью разрыхлялся. При действии мочевины миелин конусов разрыхлялся. Эти конусы теряли отчетливость и лизировались. Щель перехвата быстро расширялась (рис. 9). В течение десятков секунд происходило расщепление миелина луковиц перехвата. Процесс происходил быстро, однако он следовал тем же этапам, что наблюдали 1) при переживании волокна, 2) после механического воздействия во время препарирования или 3) после действия гипотонического раствора Рингера. Таким образом, данный процесс был неспецифичным. Эти наблюдения свидетельствуют о том, что они отражают неспецифические конформационные изменения белков (некробиоз). При быстром отмывании перехватов его структуру можно было восстановить (рис. 9а), хотя для этого требовалось продолжительное время (5–10 мин).
Рис. 9.
Действие мочевины (2 М) на перехват Ранвье живого волокна и восстановление его структуры после замены на раствор Рингера. а – Расширение щели перехвата (стрелки) после воздействия мочевины (около 1.5 с) и восстановление ее размера через 6 мин; б – разрушение паранодальных петель и сужение аксона до размеров аксиального тяжа через 10 мин после воздействия мочевины; 1 – удлинение аксиального тяжа за счет сужения жидкой аксоплазмы; 2 – расслоение миелина и смещение ламеллярных комплексов в сторону от щели перехвата. а – световая микроскопия. Об. 40 Ph, Ок. 20; б – электронная микроскопия, увеличение 42 000×. Масштабные полоски: 2.8 (а), 9.4 мкм (б).
В прижизненных исследованиях впервые отмечена новая функция миелиновых волокон: многосторонняя физико-химическая нейроглиальная взаимная деятельность, в которой нейрит и глиоцит выступают как равноправные участники. Они образуют нейрит–глиоцит, отличающийся общей водной фракцией цитоплазмы в функционально важных структурах миелиновых волокон и регулирующий интегральный водный обмен с участием таких ключевых метаболитов, как глюкоза, аминокислоты и другие малые молекулы, а также возбудимость и электропроводимость. По-видимому, эта новая функция является уникальным примером еще неизученного метаболического протеин-опосредованного нейроглиального межклеточного обмена цитоплазмы, которая существует наряду с обменом через щелевые межклеточные контакты. Таким образом, функционально малозначимые, не патологические, а парабиотические воздействия на живые миелиновые нервные волокна могут помочь в объединении ряда функциональных процессов в перехватах Ранвье. Действительно, даже незначительное набухание глиоплазмы паранодальных петель должно уменьшать локальное сопротивление миелиновой оболочки, отрицательно влияя на функцию проведения перехвата. Одновременно этот же процесс увеличивает сопротивление аксоплазмы суженого аксона и крупнодисперсной фракции агрегированных белковых микротрубочек, которая удлиняет аксиальный тяж и изменяет площадь и емкость аксолеммы. При этом сложно оценить изменения плотности распределения натриевых и калиевых каналов аксолеммы. Определенную роль при перераспределении этих каналов могут играть белки ТРААК и ТЕК-1, способствующие их перемещению [1, 2]. Моделирование нодальной геометрии показало, что увеличение видимой длины аксона в перехвате может замедлить проведение нервных импульсов [39]. В целом, как показано выше, вся морфологическая физиология в перехвате является интегрированной, так что геометрия аксона не может рассматриваться отдельно. Набухание паранодальных петель зависит от денатурации белка. Важно, что увеличение объема петель происходит одновременно с истончением и удлинением аксиального тяжа микротрубочек и с наблюдаемым под микроскопом расширением щели перехвата. Анализ процессов возбуждения и проведения перехвата может быть успешным только при интеграции синхронных исследований морфологических и физиологических процессов на одном и том же живом объекте.
Сравнительный анализ морфологических и физиологических характеристик перехватов Ранвье. При одновременном сопоставлении прижизненных морфологических и физиологических свойств удается выявить определенное соответствие между динамикой структурных процессов и снижением максимальных значений натриевой и калиевой проводимости аксоплазмы. С этой целью мы провели исследование перехватов с помощью метода фиксации потенциала, в котором попытались выяснить, каким образом динамика строения перехватов, обусловленная механической травмой в процессе препарирования, влияет на натриевую и калиевую проводимости, а также на проводимость утечки [31]. Структурные и электрофизиологические характеристики сопоставляли прижизненно и одновременно на одних и тех же миелиновых волокнах Rana ridibunda с помощью фазово-контрастной микроскопии и регистрации ионных токов перехвата Ранвье.
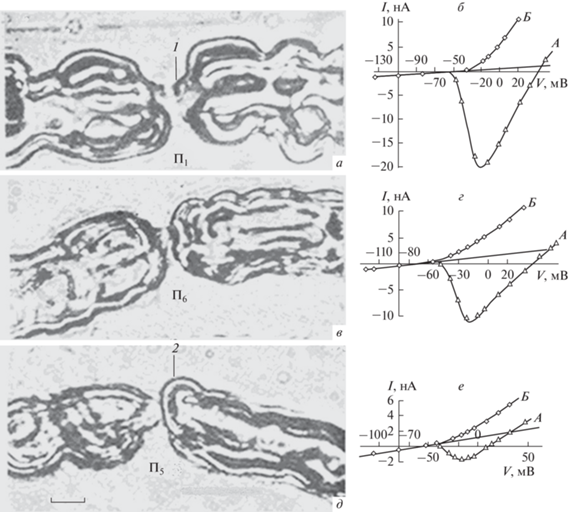
На рис. 10 (справа) показаны вольт-амперные характеристики для натриевых и калиевых токов, а также для тока утечки. Соответствующие им перехваты Ранвье приведены на рис. 10 (слева). Электрофизиологические параметры даны в табл. 1. Оказалось, что перехваты П1 и П6, отличавшиеся условно нормальной структурой, обладали удельными проводимостями мембраны gNa/gL и gK/gL в 11 и 17 раз больше (соответственно), чем перехват П5 с максимальными морфологическими изменениями. Из табл. 1 видно, что перехваты с потерей миелиновых конусов и частичным расщеплением пластин миелина луковицы волокна не генерировали потенциал действия (ПД). Выявлено четкое влияние морфофизиологических процессов перехвата на ионные токи аксолеммы. На рис. 10 видны параллельные изменения пиковых значений натриевого тока и стационарного уровня калиевого тока индивидуальных перехватов Ранвье живых волокон. При этом перехваты П1 и П6 оказались способными генерировать ПД. Результаты экспериментов выявили несомненное соответствие между степенью морфологических изменений паранодальной области перехвата (обводнение и агрегация белка петель глиоплазмы, увеличение которых сдавливает аксоплазму, вызывая уменьшение ее диаметра и увеличение ее сопротивления) и величиной изменений его электрофизиологических характеристик. Кроме того, увеличивается и длина аксиального тяжа, не защищенного компактной миелиновой оболочкой. При незначительной локальной альтерации еще сохраняются миелиновые конусы. Повреждения луковицы миелина даже с одной стороны перехвата соответствуют выраженному уменьшению натриевой и калиевой проводимости мембраны и сопровождаются элиминацией ПД (рис. 10).
Рис. 10.
Микрофотоснимки (а, в, д) и вольт-амперные характеристики (б, г, е) изолированных перехватов Ранвье. А – Пиковые значения ионного тока (INa + IL); Б – стационарное значение ионного тока (IK + IL). Кривые с треугольниками – пиковые значения ионного тока (INa + IL), кривые с кружками – стационарные значения ионного тока (IK + IL). IL – ток утечки; 1 – конус перехвата; 2 – деформированная луковица перехвата. П1, П5, П6 – номера опытов. Диаметр волокон: а – 11; в – 10; д – 7 мкм. Об. 40, Ок. 20. Масштабные полоски: 3 (а, в), 2.8 мкм (д).
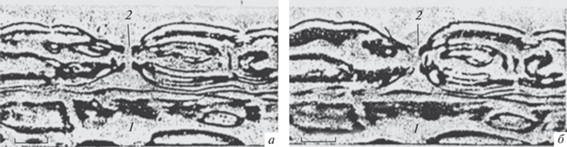
Выше мы проанализировали влияние структурных изменений перехвата Ранвье на его электрофизиологические характеристики, однако нельзя исключить и обратного процесса, при котором изменения электрической активности перехвата влияют на его структуру. Для проверки такой возможности мы исследовали действие батрахотоксина, который радикально изменяет натриевые каналы перехватов, что ведет к персистентной деполяризации мембраны и к необратимой потере возбудимости [40–42]. Чтобы минимизировать механическое воздействие на перехват при выделении одиночного волокна, эксперименты проводили на живых и хорошо видимых перехватах, защищенных от механической травмы соседними нервными волокнами (рис. 11). Фотосъемка таких перехватов доказала отсутствие заметных изменений перехватов Ранвье в течение 1.5 ч их переживания в растворе батрахотоксина (20 мкМ). Представляется возможным, что при механической травме стартовые неспецифические изменения перехватов начинаются не с модификации ионных каналов возбудимой мембраны, а с физиологических конформационных паранекротических альтераций белка аксоплазмы, вызывающих освобождение связанной воды протеинов аксоплазмы и обводнение ею глиоплазмы набухающих паранодальных петель конусов миелина.
Рис. 11.
Перехват Ранвье, инкубированный в присутствии батрахотоксина (20 мкМ) в течение 1.5 ч. а – Перехват до введения батрахотоксина; б – тот же перехват через 60 мин после экспозиции батрахотоксина; 1 – соседнее волокно, предохраняющее экспериментальный перехват от чрезмерного механического воздействия; 2 – неизмененная щель перехвата. Прижизненная микроскопия. Об. 40 Ph, Ок. 20. Масштабные полоски: 2.7 мкм.
Разумеется, обсуждаемые предположения нуждаются в дополнительных исследованиях. В частности, остаются малопонятными роль и механизм появления аксоглиальных септированных контактов перехвата, отмеченных многими авторами [16], а также влияние нейрональной активности на структурную перестройку миелиновых волокон. В приведенных материалах мы попытались на живых нервных волокнах выявить ранние (пока еще непатологические) структурные и парабиотические обратимые альтерации, а также их реверсирование. Были обнаружены взаимосвязанные, внутриволоконные, метаболические и нейрит-глиальные процессы, которые, по-видимому, неразрывно связаны и с другими морфофизиологическими событиями, которые требуют отдельного анализа. Важно подчеркнуть, что изменения морфофизиологических свойств перехватов Ранвье связано с впервые выявленным интенсивным глиально-нейрональным взаимодействием, сопровождающимся разделением аксоплазмы на две фракции.
Предметом будущих морфологических исследований должны стать процесс набухания насечек Шмидта–Лантермана и появление белковых агрегатов (глиоаксональных септ) в перехватах Ранвье, играющих особую электрофизиологическую роль в сальтаторном проведении нервных импульсов.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена при поддержке Госпрограммы 47 ГП “Научно-технологическое развитие Российской Федерации” (2019–2030), тема 0134-2019-0001.
Соответствие принципам этики. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Brohawn S.G., Wang W., Handler A., Campbell E.B., Schwarz J.R., MacKinnon R. 2019. The mechanosensitive ion channel TRAAK is localized to the mammalian node of Ranvier. Elife. 8, e50403.
Kanda H., Ling J., Tonomura S., Noguchi K., Matalon S., Gu J.G. 2019. TREK-1 and TRAAK are principal K+ channels at the nodes of Ranvier for rapid action potential conduction on mammalian myelinated afferent nerves. Neuron. 104 (5), 960–971.
Cohen C.C.H., Popovic M.A., Klooster J., Weil M.T., Möbius W., Nave K.A., Kole M.H.P. 2020. Saltatory conduction along myelinated axons involves a periaxonal nanocircuit. Cell. 180 (2), 311–322.
Patel A., Rumsey J.W., Lorance C., Long C.J., Lee B., Tetard L., Lambert S., Hickman J.J. 2020. Myelination and node of ranvier formation in a human motoneuron-schwann cell serum-free coculture. ACS Chem. Neurosci. 11 (17), 2615–2623.
Zhang Y., Yuen S., Peles E., Salzer J.L. 2020. Accumulation of neurofascin at nodes of Ranvier is regulated by a paranodal switch. J. Neurosci. 40 (30), 5709–5723.
Rasband M.N., Peles E. 2021. Mechanisms of node of Ranvier assembly. Nat. Rev. Neurosci. 22 (1), 7–20.
Хачатрян А.А., Ерофеева Л.М., Кутвицкая С.А. 2014. Роль нейроглии в функционировании нервной системы. Усп. совр. естеств. 6, 66–70.
Robertson J.D. 1959. Preliminary observations on the ultrastructure of nodes of Ranvier. Z. Zellforsch. 50, 553–560.
Phillips D.D., Hibbs R.G., Ellison J.P., Shapiro H. 1972. An electron microscopic study of central and peripheral nodes of Ranvier. J. Anat. 111 (Pt 2), 229–238.
Rasband M.N. 2013. Cytoskeleton: Axons earn their stripes. Curr. Biol. 23 (5), 197–198.
Ghosh A., Sherman D.L., Brophy P.J. 2018. The axonal cytoskeleton and the assembly of nodes of Ranvier. Neuroscientist. 24 (2), 104–110.
Hirano A., Dembitzer H.M. 1967. A structural analysis of the myelin sheath in the central nervous system. J. Cell. Biol. 34 (2), 555–567.
Nualart-Marti A., Solsona C., Fields R.D. 2013. Gap junction communication in myelinating glia. Biochim. Biophys. Acta. 1828 (1), 69–78.
Peters A. 1960. The formation and structure of myelin sheaths in the central nervous system. J. Biophys. Biochem. Cytol. 8, 431–446.
Metuzals J. 1965. Ultrastructure of the nodes of Ranvier and their surrounding structures in the central nervous system. Z. Zellforsch. Mikrosk. Anat. 65, 719–759.
Suminaite D., Lyons D.A., Livesey M.R. 2019. Myelinated axon physiology and regulation of neural circuit function. Glia. 67 (11), 2050–2062.
Sotnikov O.S. 2016. Properties of living axoplasm. N.Y.: NOVA. 138 p.
Гиббс Дж.В. 1982. Термодинамика. Статистическая механика. М.: Наука. 584 с.
Сотников О.С., Скибо Г.Г., Кулешова Т.Ф. 1984. Ультраструктурные данные о синаптической, рецепторной и проводящей функциях перехватов Ранвье. Нейрофизиология. 16 (4), 546–549.
Malavasi E.L., Ghosh A., Booth D.G., Zagnoni M., Sherman D.L., Brophy P.J. 2021. Dynamic early clusters of nodal proteins contribute to node of Ranvier assembly during myelination of peripheral neurons. Elife. 10, e68089.
Робертсон Дж. 1963. Молекулярная биология клеточных мембран. В кн.: Молекулярная биология. М.: Изд-во иностр. лит., с. 102–151.
Mercer E.H. 1959. An electron microscopic study of Amoeba proteus. Proc. R. Soc. Lond. B Biol. Sci. 150 (939), 216–232.
Миронов А.А., Комиссарчик Я.Ю., Миронов В.А. 1994. Методы электронной микроскопии в биологии и медицине: методическое руководство. СПб.: Наука. 400 с.
Jarjour A.A., Velichkova A.N., Boyd A., Lord K.M., Torsney C., Henderson D.J., Ffrench-Constant C. 2020. The formation of paranodal spirals at the ends of CNS myelin sheaths requires the planar polarity protein Vangl2. Glia. 68 (9), 1840–1858.
Livingston R.B., Pfenniger K., Moor H., Akert K. 1973. Specialized paranodal and interparanodal glial-axonal junctions in the peripheral and central nervous system: A freeze-etching study. Brain. Res. 58 (1), 1–24.
Brivio V., Faivre-Sarrailh C., Peles E., Sherman D.L., Brophy P.J. 2017. Assembly of CNS nodes of Ranvier in myelinated nerves is promoted by the axon cytoskeleton. Curr. Biol. 27 (7), 1068–1073.
Laatsch R.H., Cowan W.M. 1966. A structural specialization at nodes of Ranvier in the central nervous system. Nature. 210 (5037), 757–758.
Rasband M.N. 2006. Neuron-glia interactions at the node of Ranvier. Results Probl. Cell Differ. 43, 129–149.
Peters A. 1966. The node of Ranvier in the central nervous system. Q. J. Exp. Physiol. Cogn. Med. Sci. 51 (3), 229–236.
Тасаки И. 1971. Нервное возбуждение. Макромолекулярный подход. М.: Мир. 219 с.
Dodge F.A., Frankenhaeuser B. 1958. Membrane currents in isolated frog nerve fibre under voltage clamp conditions. J. Physiol. 143 (1), 76–90.
Mueller-Mohnssen H. 1961. Structural changes in Ranvier’s nodes during electrical tone and during functional destruction. Z. Zellforsch. Mikrosk. Anat. 54, 468–498.
Сотников О.С. 1973. Дискуссионные вопросы об особых свойствах аксона на концах миелиновых сегментов. Архив АГЭ. 64 (3), 95–101.
D’Este E., Kamin D., Balzarotti F., Hell S.W. 2017. Ultrastructural anatomy of nodes of Ranvier in the peripheral nervous system as revealed by STED microscopy. Proc. Natl. Acad. Sci. USA. 114 (2), 191–199.
Djannatian M., Timmler S., Arends M., Luckner M., Weil M.T., Alexopoulos I., Snaidero N., Schmid B., Misgeld T., Möbius W., Schifferer M., Peles E., Simons M. 2019. Two adhesive systems cooperatively regulate axon ensheathment and myelin growth in the CNS. Nat. Commun. 10 (1), 4794.
Ramón y Cajal S. 1984. The neuron and the glial cell. Springfield, IL: Charles C. Thomas. 355 p.
Vallat J.M., Magy L., Corcia P., Boulesteix J.M., Uncini A., Mathis S. 2020. Ultrastructural lesions of nodo-paranodopathies in peripheral neuropathies. J. Neuropathol. Exp. Neurol. 79 (3), 247–255.
Guckeisen T., Hosseinpour S., Peukert W. 2021. Effect of pH and urea on the proteins secondary structure at the water/air interface and in solution. J. Coll. Interface Sci. 590, 38–49.
Arancibia-Cárcamo I.L., Ford M. C., Cossell L., Ishida K., Tohyama K., Attwell D. 2017. Node of Ranvier length as a potential regulator of myelinated axon conduction speed. Elife. 6, e23329.
Khodorov B.I., Peganov E.M., Revenko S.V., Shishkova L.D. 1975. Sodium currents in voltage clamped nerve fiber of frog under the combined action of batrachotoxin and procaine. Brain Res. 84 (3), 541–546.
Ревенко С.В., Ходоров Б.И. 1977. Влияние батрахотоксина на селективность натриевых каналов в мембране миелинизированного нервного волокна. Нейрофизиология. 9 (3), 313–316.
Khodorov B.I., Revenko S.V. 1979. Further analysis of the mechanisms of action of batrachotoxin on the membrane of myelinated nerve. Neuroscience. 4 (9), 1315–1330.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


