Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 5, стр. 355-363
Механизмы ингибирования слияния липидных везикул экстрактами чаги и листьев облепихи
С. С. Ефимова a, *, П. Д. Злодеева a, Е. В. Шекунов a, О. С. Остроумова a
a Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: efimova@incras.ru
Поступила в редакцию 16.04.2022
После доработки 01.06.2022
Принята к публикации 02.06.2022
- EDN: BMQZFY
- DOI: 10.31857/S0233475522050048
Аннотация
В работе оценена способность экстрактов семян грейпфрута (ЭСГ), листьев облепихи (ЭЛО) и чаги (ЭЧ) ингибировать слияние мембран. Установлено, что ЭЛО и ЭЧ подавляют слияние фосфатидил-глицерин-обогащенных липидных везикул под действием кальция: индекс ингибирования составляет около 90 и 100% соответственно. ЭСГ не характеризуется способностью ингибировать слияние отрицательно заряженных липосом, индуцированное введением кальция. Помимо кальций-опосредованного слияния липосом ЭЧ ингибирует и слияние везикул из смеси фосфатидилхолина и холестерина под действием полиэтиленгликоля с молекулярной массой 8000 Да (индекс ингибирования равен 80%). Два других экстракта на полимер-индуцированное слияние незаряженных мембран не действуют. Проведена оценка влияния на слияние везикул некоторых мажорных компонентов тестируемых экстрактов. Показано, что флавонолы кверцетин и мирицетин, являющиеся мажорными компонентами ЭЛО, ингибируют слияние отрицательно заряженных мембран под действием кальция (индекс ингибирования составляет около 85 и 60% соответственно). Другой флавонол ЭЛО, гликозид кверцетина рутин, такого действия не оказывает. Полученные данные позволяют связывать подавление ЭЛО кальций-индуцированного слияния липидных везикул с наличием в его составе кверцетина и мирицетина. Эти флавонолы практически не влияют на полиэтиленгликоль-индуцированное слияние везикул, что согласуется с отсутствием действия ЭЛО на слияние липосом под действием полимера. Продемонстрирована способность кверцетина и мирицетина уменьшать температуру плавления фосфатидилглицерина с насыщенными углеводородными цепями и увеличивать полуширину соответствующего плавлению пика. Наблюдаемая корреляция между параметрами, характеризующими термотропное поведение липида в присутствии кверцетина и мирицетина, и индексом ингибирования этими соединениями кальций-опосредованного слияния липосом может указывать на взаимосвязь между способностью флавонолов влиять на упаковку мембранных липидов и подавлять слияние везикул. Пентациклические тритерпеноиды бетулин и люпеол, входящие в состав ЭЧ, не подавляют слияние везикул под действием как кальция, так и полиэтиленгликоля, и их присутствие в составе ЭЧ не может быть ответственно за антифьюзогенную активность ЭЧ.
ВВЕДЕНИЕ
Природные экстракты широко используются в медицине как самостоятельные лекарственные препараты, так и в комбинации с другими биологически активными соединениями. Кроме того, экстракты активно используют в составе косметических средств, поскольку они оказывают выраженный противовоспалительный и антимикробный эффекты.
Литературные данные указывают на высокую противовирусную активность экстракта семян грейпфрута (ЭСГ). Установлено, что ЭСГ имеет значительный потенциал применения в птицеводстве в качестве дезинфектанта, поскольку существенно снижает титр вирусов, вызывающих инфекционные заболевания у домашних птиц, в частности, птичьего гриппа и болезни Ньюкасла [1]. Результаты недавно опубликованных работ показали, что коммерчески доступный назальный спрей, содержащий экстракт семян грейпфрута (ЭСГ), может быть использован в качестве дополнительной терапии COVID-19 легкой и средней степени тяжести [2].
Известно, что облепиха проявляет противовирусные свойства в отношении вируса денге [3, 4]. Так, экстракт листьев облепихи (ЭЛО) оказался столь же эффективен в поддержании жизнеспособности клеток, инфицированных вирусом денге, как и известный противовирусный препарат рибавирин [5]. Показано, что ЭЛО также проявляет сравнимую с осельтамивиром активность против вирусов гриппа А и Б [6].
В последнее время широко обсуждается противовирусная активность березового гриба или чаги, в том числе в отношении SARS-CoV-2 [7, 8]. Результаты проведения молекулярного докинга показали, что компоненты экстракта чаги (ЭЧ) (бета-глюкан, галактоманнан и бетулиновая кислота) связываются с С-концевым фрагментом рецептор-связывающего домена S-белка SARS-CoV-2 [9]. ЭЧ также ингибирует слияние вируса простого герпеса 1 типа с клеточной мембраной [10]. Обнаружено, что ЭЧ проявляет противовирусную активность в отношении большого числа вирусов, вызывающих заболевания у кошек: калицивируса, герпеса 1 типа, гриппа H3N2 и H5N6, панлейкопении, инфекционного перитонита и иммунодефицита [11, 12]. Исследование механизма противовирусного действия ЭЧ в отношении кошачьего калицивируса показало, что ингибирующее действие экстракта связано с блокированием связывания/абсорбции вируса [11]. Продемонстрирована активность ЭЧ и против вируса иммунодефицита человека [13].
Очевидно, что противовирусная активность природных экстрактов должна быть обусловлена их специфическим химическим составом. Известно, что в состав ЭСГ в большом количестве входят гликозиды флавононов: нарингин, гесперидин и нарирутин [14]. Нарингин и нарирутин являются гликозидами нарингенина, а геспередин – гликозидом близкого аналога нарингенина, гесперетина. Анализ литературных данных показывает, что ЭЛО богаты флавонолами: кверцетином, мирицетином и кемпферолом, а также различными гликозидами кверцетина, в частности, рутином (кверцетин-3-рутинозидом) [15–17]. К настоящему моменту в составе ЭЧ идентифицировано около сорока ланостановых тритерпеноидов, прежде всего, ланостерин и его производное, инотодиол. В несколько раз меньших концентрациях, чем тетрациклические тритерпеноиды, в составе чаги обнаруживаются пентациклические тритерпеноиды, такие как, бетулин и люпеол, а также другие стерины, в частности, эргостерин [18].
В работе проведена оценка способности ЭСГ, ЭЛО и ЭЧ ингибировать слияние отрицательно заряженных и незаряженных липидных везикул под действием кальция и высокомолекулярного полиэтиленгликоля соответственно. Определена роль некоторых компонентов экстрактов в ингибировании слияния липосом, а также установлено, модуляция каких физико-химических свойств бислоя ответственна за ингибирование слияния мембран компонентами экстрактов.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали следующие реактивы: хлорид натрия (NaCl), HEPES, NaOH, этанол, диметилсульфоксид (ДМСО), тритон Х-100, сефадекс G-50, кальцеин, сорбитол, хлорид кальция (CaCl2), полиэтиленгликоль с молекулярной массой 8000 Да (ПЭГ-8000), кверцетин, мирицетин, рутин, бетулин, люпеол, 1,2-диолеил-sn-глицеро-3-фосфохолин (ДОФХ), 1,2-диолеоил-sn-глицеро-3-фосфо-(1′-rac-глицерин) (ДОФГ), холестерин (ХОЛ), 1,2-дипальмитоил-sn-глицеро-3-фосфо-(1′-rac-глицерин) (ДПФГ) и 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-(лиссамин родамин) производства фирмы Sigma (США).
Экстракт семян грейпфрута (ЭСГ), экстракт листьев облепихи (ЭЛО) и экстракт чаги (ЭЧ) предоставлены ЗАО “Эвалар”. Тестирование проводилось для трех образцов каждого экстракта, представляющих собой независимые серии экстрагирования.
Исследование способности тестируемых экстрактов и их компонентов ингибировать слияние липидных везикул, опосредованное различными индукторами. Одноламеллярные липидные везикулы из смесей ДОФХ/ХОЛ (80/20 мол. %) и ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %), нагруженные флуоресцентным маркером кальцеином, формировали с помощью мини-экструдера производства Avanti Polar Lipids (США). Исходный раствор липидов в хлороформе помещали в виалу, после чего растворитель удаляли потоком азота. Полученную липидную пленку гидратировали буфером (35 мМ кальцеина, 10 мМ HEPES-NaOH, pH 7.4) и после пятикратного замораживания–размораживания 13 раз пропускали через поликарбонатную мембрану (Nucleopore TM, США) с диаметром пор 100 нм для получения гомогенной популяции больших однослойных липосом. Не захваченный липосомами кальцеин удаляли гель-фильтрацией на колонке, заполненной сефадексом G-50. В качестве элюента использовали свободный от кальцеина буфер (150 мМ NaCl, 10 мМ HEPES-NaOH, pH 7.4). Кальцеин внутри липосом в концентрации 35 мМ испытывал самотушение. Для индукции слияния ДОФХ/ДОФГ/ХОЛ и ДОФХ/ХОЛ липосом использовали кальций (40 мМ CaCl2) и полиэтиленгликоль с молекулярной массой 8000 Да (ПЭГ-8000 в концентрации 20 вес. %) соответственно [19–22].
Образцы экстрактов из исходных растворов в воде или ДМСО вводили в суспензию липосом до концентрации 100 мкг/мл.
Интенсивность свечения кальцеина, вытекающего в окружающий липидные везикулы раствор при их слиянии, измеряли с помощью спектрофлюориметра Флюорат Панорама-02 (при длине волны возбуждения 490 нм, эмиссии 520 нм). В конце каждого эксперимента в раствор вводили тритон X-100. При концентрации 10 мМ этот детергент разрушает все липосомы в суспензии, высвобождая захваченный везикулами маркер.
Индекс ингибирования слияния липидных везикул (ИИ) тестируемыми экстрактами рассчитывали как:
(1)
$ИИ = \frac{{R{{F}_{{{\text{Ind}}}}} - R{{F}_{{{\text{Inh}}}}}}}{{R{{F}_{{{\text{Ind}}}}}}} \cdot 100\% ,$Величины утечки RF (%) (RFInd и RFInh) определяли по формуле:
(2)
$RF = \frac{{{\kern 1pt} {{I}_{{\text{i}}}} - {{I}_{0}}}}{{1.1I_{{\max }}^{{}} - {{I}_{0}}}} \cdot 100\% ,$Кинетику высвобождения маркера под действием индукторов слияния до и после введения тестируемых экстрактов характеризовали временем увеличения относительной флуоресценции в е раз.
Для каждого вида экстракта было выполнено девять независимых повторений с образцами из трех различных партий. Параметры, характеризующие действие отдельных компонентов экстрактов на слияние мембран, определены путем вычисления среднего арифметического величин, полученных в 2–3 независимых экспериментах.
Чтобы доказать статистическую значимость обнаруженных различий средних величин RF до и после введения экстрактов или их компонентов, использовали непараметрический критерий Манна–Уитни–Уилкоксона (* p ≤ 0.01).
Конфокальная флуоресцентная микроскопия гигантских липосом. Визуализацию изменений в поведении везикул до и после введения в суспензию ПЭГ-8000 и экстракта чаги проводили с использованием конфокальной флуоресцентной микроскопии. Гигантские однослойные везикулы готовили из смеси ДОФХ/ХОЛ (80/20 мол. %) и 1 мол. % флуоресцентного липидного зонда 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-(лиззамин родамина) методом электроформации (стандартный протокол, 3 В, 10 Гц, 1 ч, 25°С) с использованием коммерчески доступного прибора Nanion vesicle prep pro (Германия). Полученная суспензия липосом содержала 0.5 мМ липида в 1 М растворе сорбитола. Для индукции слияния везикул в суспензию вводили ПЭГ-8000 до концентрации 10 вес. % и инкубировали в течение 5–10 мин при комнатной температуре (25 ± 1°С). В экспериментальные образцы последовательно вводили 35 мкг/мл ЭЧ и 10 вес. % ПЭГ-8000 с инкубацией на каждом этапе 10 мин. Липосомы наблюдали через иммерсионный объектив 100.0 × /1.4 HCX PL в Leica TCS SP5 конфокальной лазерной системы Apo (Leica Microsystems, Германия). Наблюдение препаратов проводили при температуре 25°C. Свечение 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-(лиззамин родамина) возбуждали светом с длиной волны 543 нм (гелий-неоновый лазер).
Дифференциальная сканирующая микрокалориметрия липидных везикул, модифицированных компонентами экстрактов. Гигантские одноламеллярные липосомы формировали из ДПФГ методом электроформации c помощью прибора Nanion vesicle prep pro (Германия). На стекла подавали переменное напряжение с амплитудой 3 В и частотой 10 Гц в течение 1 ч при температуре 55°C. Концентрация липида составляла 3 мМ. В экспериментальные образцы вводили кверцетин, мирицетин и рутин до достижения соотношения липид : флавонол, равного 10 : 1. Термограммы липосомальных суспензий получали при помощи дифференциального сканирующего микрокалориметра µDSC7 (Setaram, Франция). Воспроизводимости температурной зависимости теплоемкости достигали путем повторного нагревания образца сразу после охлаждения с постоянной скоростью 0.2°C/мин. Пики на термограммах характеризовали максимальной температурой основного фазового перехода (Tm) ДПФГ и шириной основного пика на полувысоте (T1/2). Изменение указанных параметров позволяет судить о влиянии флавонолов на плотность упаковки мембранных липидов.
Параметры, характеризующие действие флавонолов на термотропное поведение липидов, определены путем вычисления среднего арифметического величин, полученных для 2 независимых серий приготовления липосом.
Величины RF, t, ИИ, ΔTm, и ΔT1/2 представлены в виде среднее ± стандартная ошибка среднего (среднее ± SE).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1а представлены временные зависимости относительной интенсивности флуоресценции кальцеина (RF, %), вытекающего из ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) липосом при слиянии везикул, индуцированном введением в суспензию 40 мМ CaCl2 до и после инкубации с ЭСГ, ЭЛО и ЭЧ при концентрации 100 мкг/мл в течение 30 мин при комнатной температуре. В табл. 1 приведены средние значения максимальной утечки кальцеина (RF) при слиянии ДОФХ/ДОФГ/ХОЛ везикул под действием кальция в отсутствие и в присутствии различных экстрактов. Средняя максимальная утечка флуорофора при слиянии немодифицированных экстрактами липидных везикул при введении хлорида кальция составляет около 90%. Снижение или рост этой величины указывает на ингибирование или активацию кальций-опосредованного слияния отрицательно заряженных везикул в присутствии соответствующего экстракта. Из рис. 1а и табл. 1 видно, что ЭЛО и ЭЧ существенно подавляют слияние ДОФХ/ДОФГ/ХОЛ везикул, вызванное введением в суспензию хлорида кальция: соответствующие величины RF составляют 8 и 2% соответственно. Для сравнения антифьюзогенной активности экстрактов на основании значений RF в соответствии с формулой (1) были рассчитаны их индексы ингибирования (ИИ) (табл. 1). ИИ ЭЛО составляет около 90%, а в случае ЭЧ достигает практически 100% (табл. 1). ЭСГ способностью ингибировать кальций-опосредованное слияние отрицательно заряженных липосом не характеризуется (рис. 1а и табл. 1).
Рис. 1.
Зависимость относительной интенсивности флуоресценции кальцеина (RF, %), вытекшего при (а) кальций-опосредованном слиянии ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) липосом или (б) ПЭГ-8000-индуцированном слиянии ДОФХ/ХОЛ (80/20 мол. %) везикул в отсутствие (контроль, черная линия) или после инкубации с 100 мкг/мл ЭСГ (красная линия), ЭЛО (зеленая линия) и ЭЧ (синяя линия), от времени.
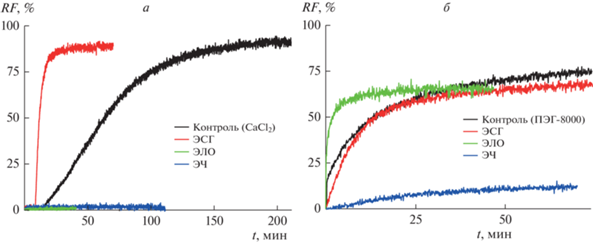
Таблица 1.
Параметры, характеризующие влияние экстрактов в концентрации 100 мкг/мл на утечку кальцеина при слиянии везикул, сформированных из смеси ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) или ДОФХ/ХОЛ (80/20 мол. %), при введении 40 мМ CaCl2 или 20 вес. % ПЭГ-8000 соответственно
| Экстракт | RF, % | t, мин | ИИ, % | RF, % | t, мин | ИИ, % |
|---|---|---|---|---|---|---|
| CaCl2 | ПЭГ-8000 | |||||
| – | 90 ± 6 | 61 ± 6 | – | 75 ± 5 | 46 ± 8 | – |
| ЭСГ | 92 ± 5 | 9 ± 5 | –3 ± 2 | 73 ± 6 | 33 ± 5 | –10 ± 5 |
| ЭЛО | 8 ± 3* | –# | 90 ± 3 | 72 ± 7 | 4 ± 2 | –8 ± 9 |
| ЭЧ | 2 ± 1* | –# | 97 ± 3 | 13 ± 5* | –# | 79 ± 3 |
Примечание. RF – максимальная утечка флуоресцентного маркера при слиянии липосом, сформированных из смеси ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) и ДОФХ/ХОЛ (80/20 мол. %), при добавлении в суспензию 40 мМ CaCl2 или 20 вес. % ПЭГ-8000 в отсутствие (–) и в присутствии тестируемых экстрактов в концентрации 100 мкг/мл; t – константа времени, характеризующая кинетику высвобождения маркера при слиянии везикул (зависимость вытекания маркера от времени аппроксимирована одноэкспоненциальной функцией); ИИ – индекс ингибирования экстрактами кальций- и ПЭГ-8000-опосредованного слияния липидных везикул различного состава. # Оценка не проведена ввиду малости величины RF, %. * p ≤ 0.01 (критерий Манна–Уитни–Уилкоксона, сравнение кальций- или ПЭГ-8000-индуцированной утечки красителя из везикул в отсутствие и в присутствии экстрактов).
На рис. 1б представлены временные зависимости относительной интенсивности флуоресценции кальцеина (RF, %), вытекающего при слиянии ДОФХ/ХОЛ (80/20 мол. %) везикул после введения 20 вес.% ПЭГ-8000 до и после инкубации с 100 мкг/мл ЭСГ, ЭЛО и ЭЧ. Средняя максимальная утечка при слиянии немодифицированных экстрактами липосом при введении ПЭГ-8000 в отсутствие экстрактов составляет 75% (табл. 1). Из рис. 1б и табл. 1 видно, что ЭСГ и ЭЛО не способны подавлять ПЭГ-индуцированное слияние незаряженных везикул: соответствующие величины RF (79 и 72% соответственно) близки к контрольному значению. При этом как и в случае кальций-индуцированного слияния отрицательно заряженных липосом, ЭЧ подавляет слияние незаряженных везикул под действием ПЭГ-8000: RF составляет около 10%, а ИИ превышает 70% (табл. 1).
В табл. 1 также представлены характеристические времена высвобождения маркера при слиянии липосом в отсутствие и в присутствии экстрактов. Из представленных данных видно, что константа времени, характеризующая кинетику высвобождения маркера при слиянии ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) и ДОФХ/ХОЛ (80/20 мол. %) везикул под действием кальция и ПЭГ, составляет около 60 и 50 мин соответственно. Обращает на себя внимание ускорение кинетики слияния ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) везикул под действием кальция в присутствии ЭСГ и ДОФХ/ХОЛ (80/20 мол. %) липосом под действием ПЭГ-8000 в присутствии ЭЛО в несколько раз. Эти различия можно объяснить ускорением адсорбции соответствующих индукторов слияния на мембранах, модифицированных тестируемыми экстрактами.
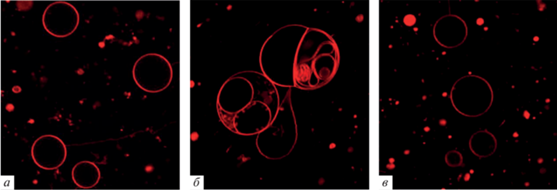
Для визуализации слияния везикул под действием ПЭГ-8000 и его ингибирования ЭЧ была проведена конфокальная флуоресцентная микроскопия гигантских однослойных везикул, сформированных из смеси ДОФХ/ХОЛ (80/20 мол. %). На рис. 2 представлены флуоресцентные микрофотографии ДОФХ/ХОЛ липосом в отсутствие каких-либо агентов (рис. 2а), в присутствии 10 вес. % ПЭГ-8000 (рис. 2б) и после введения 10 вес.% ПЭГ-8000 к липосомам, предварительно модифицированным 35 мкг/мл ЭЧ (рис. 2в). ПЭГ-8000 вызывает увеличение размера липосом, их деформацию и индуцирует образование многослойных и мультивезикулярных везикул (рис. 2б), что указывает на высокую эффективность слияния липидных везикул под действием полимера. При этом из рис. 2в видно, что ПЭГ-8000 не оказывает подобного эффекта на обработанные ЭЧ липидные везикулы: вероятность появления мультиламеллярных структур мала, в суспензии в большом количестве обнаруживаются одиночные одноламеллярные везикулы. Эти данные подтверждают вывод о подавлении ЭЧ слияния везикул под действием ПЭГ-8000.
Рис. 2.
Примеры флуоресцентных микрофотографий гигантских везикул, сформированных из смеси ДОФХ/ХОЛ (80/20 мол. %) и 1 мол. % флуоресцентного липидного зонда, дипальмитоилфосфатидилэтаноламина-N-(лиссамин родамин B сульфонила), в отсутствие каких-либо агентов (а), в присутствии 10% ПЭГ-8000 (б) и после введения 10 вес. % ПЭГ-8000 в суспензию липосом, предварительно обработанных 35 мкг/мл ЭЧ (в). Размер каждой микрофотографии составляет 65 × 65 мкм.
Для выяснения механизмов ингибирования кальций- и ПЭГ-индуцированного слияния везикул ЭЛО и ЭЧ нами проведена оценка влияния на этот процесс некоторых мажорных компонентов экстрактов: флавонолов, входящих в состав ЭЛО, кверцетина, рутина и мирицетина, а также пентациклических тритерпеноидов, обнаруживаемых в составе ЭЧ, бетулина и люпеола. Химические структуры перечисленных соединений представлены на рис. 3.
Рис. 3.
Химическая структура некоторых компонентов ЭЛО и ЭЧ: кверцетина, мирицетина, рутина, бетулина и люпеола.
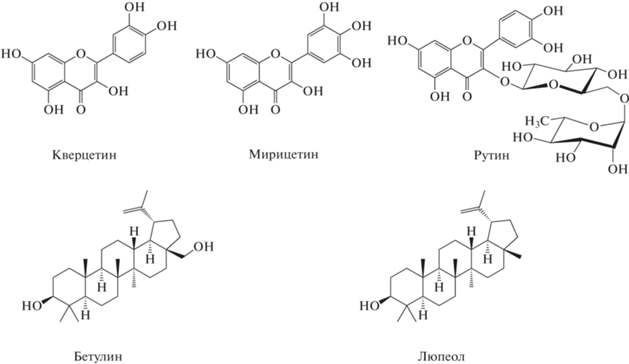
Рисунок 4 и табл. 2 суммируют данные, полученные при исследовании антифьюзогенной активности тестируемых компонентов ЭЛО и ЭЧ. Из рис. 4а и табл. 2 видно, что флавонолы ЭЛО, кверцетин и мирицетин, ингибируют слияние отрицательно заряженных мембран под действием кальция (ИИ составляет около 85 и 60% соответственно), другой компонент ЭЛО, гликозид кверцетина, рутин, таким эффектом не характеризуется. Таким образом, подавление кальций-индуцированного слияния липидных везикул под действием ЭЛО можно связывать с наличием в его составе кверцетина и мирицетина. Неспособность флавонолов ингибировать слияние незаряженных липосом под действием ПЭГ-8000 (рис. 4б и табл. 2) хорошо согласуется с отсутствием влияния ЭЛО на этот процесс (табл. 1).
Рис. 4.
Зависимость относительной интенсивности флуоресценции (RF, %) кальцеина, вытекшего при (а) кальций-опосредованном слиянии ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) липосом или (б) ПЭГ-8000-индуцированном слиянии ДОФХ/ХОЛ (80/20 мол. %) везикул в отсутствие (контроль, черная линия) и после инкубации с 20 мкМ флавонолов (кверцетина (красная линия), мирицетина (синяя линия) и рутина (циановая линия)) или 10 мкМ пентациклических тритерпеноидов (бетулина (фиолетовая линия) и люпеола (оранжевая линия)).
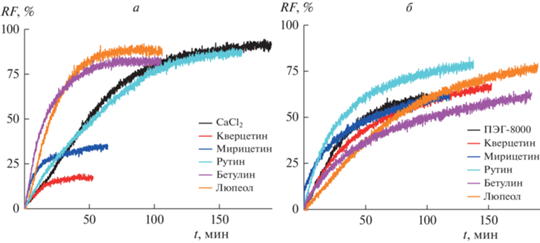
Таблица 2.
Параметры, характеризующие влияние компонентов тестируемых экстрактов, на утечку кальцеина при слиянии везикул, сформированных из смеси ДОФХ/ДОФГ/ХОЛ (40/40/20 мол. %) или ДОФХ/ХОЛ (80/20 мол. %), под действием 40 мМ CaCl2 или 20 вес. % ПЭГ-8000 соответственно
| Компонент, мкМ |
RF, % | ИИ, % | RF, % | ИИ, % | –ΔTm, °C | ΔT1/2, °C |
|---|---|---|---|---|---|---|
| CaCl2 | ПЭГ-8000 | ДПФГ | ||||
| – | 90 ± 6 | – | 75 ± 5 | – | – | – |
| Кверцетин, 20 | 9 ± 1* | 85 ± 2 | 77 ± 11 | –2 ± 5 | 1.2 ± 0.2 | 0.8 ± 0.1 |
| Мирицетин, 20 | 31 ± 3* | 58 ± 4 | 76 ± 12 | 3 ± 10 | 1.1 ± 0.2 | 0.6 ± 0.2 |
| Рутин, 20 | 88 ± 1 | –5 ± 2 | 80 ± 3 | –7 ± 6 | 0 | 0 |
| Бетулин, 10 | 90 ± 2 | 1 ± 1 | 67 ± 5 | 11 ± 2 | 0.1 ± 0.1а | 0.1 ± 0.1а |
| Люпеол, 10 | 82 ± 9 | 7 ± 8 | 70 ± 4 | 8 ± 2 | 0.1 ± 0.1а | 0.2 ± 0.1а |
Примечание. а согласно [25]; RF – максимальная утечка флуоресцентного маркера при слиянии липосом; ИИ – индекс ингибирования мажорными компонентами тестируемых экстрактов кальций- и ПЭГ-8000-опосредованного слияния везикул; ΔTm, ΔT1/2 – изменение температуры и полуширины пика главного фазового перехода ДПФГ (cоотношение липид : флавонол и липид : тритерпеноид составляет 10 : 1 и 50 : 1, соответственно). * p ≤ 0.01 (критерий Манна–Уитни–Уилкоксона, сравнение кальций- или ПЭГ-8000-индуцированной утечки красителя из везикул в отсутствие и в присутствии компонентов экстрактов).
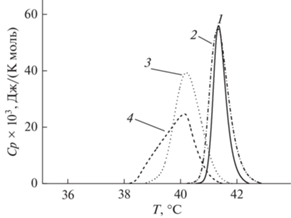
Для понимания взаимосвязи между влиянием компонентов ЭЛО на слияние отрицательно заряженных липосом, обогащенных фосфатидил-глицерином, и их способностью модифицировать физические свойства фосфатидилглицерин-содержащих мембран было изучено термотропное поведение ДПФГ до и после введения в липосомальную суспензию кверцетина, мирицетина и рутина. В отсутствие флавонолов температура главного фазового перехода ДПФГ, Tm, составляет 41.3°C, ширина пика на полувысоте, T1/2, равна 0.6°С (рис. 5). Основные параметры, характеризующие плавление ДПФГ в присутствии флавонолов, представлены в табл. 2. Кверцетин и мирицетин при соотношении липид : флавонол 10 : 1 вызывают падение Tm на 1.2 и 1.1°C соответственно. При этом кверцетин увеличивает T1/2 на 0.8°C, а мирицетин – на 0.6°C (табл. 2). Введение рутина в такой же концентрации не сопровождается изменением термотропного поведения ДПФГ (табл. 2). Наблюдаемая корреляция между параметрами, характеризующими плавление ДПФГ в присутствии флавонолов, и их антифьюзогенной активностью в отношении кальций-индуцированного слияния фосфатидилглицерин-содержащих везикул (табл. 2) указывает на взаимосвязь между их способностью влиять на плотность упаковки мембранообразующих липидов и ингибировать слияние липосом. Аналогичное заключение было сделано нами при сопоставлении влияния алкалоидов на кальций-опосредованное слияние везикул и термотропное поведение липидов [23].
Рис. 5.
Термограммы плавления ДПФГ (Ср(Т)) в отсутствие (1) и в присутствии рутина (2), мирицетина (3) и кверцетина (4). Соотношение липид : флавонол составляет 10 : 1.
Ранее нами показано, что кверцетин и мирицетин оказывают менее выраженное действие на термотропное поведение дипальмитоилфосфохолина (ДПФХ), чем ДПФГ: при соотношении ДПФХ : флавонол 10 : 1 кверцетин и мирицетин вызывают падение Tm на 0.3°C и рост T1/2 на 0.7 и 0.2°C соответственно [24]. Как и в случае ДПФГ, рутин не оказывает влияния на плавление ДПФХ [24]. С учетом данных о значительном подавлении кальций-опосредованного слияния фосфатидилглицерин-содержащих везикул в присутствии кверцетина и мирицетина и отсутствием ингибирующей способности этих флавонолов в отношении ПЭГ-8000-индуцированного слияния фосфатидилхолин-обогащенных везикул (табл. 2), выраженное действие кверцетина и мирицетина на плавление ДПФГ (табл. 2) и снижение эффектов в случае ДПФХ [24] позволяют полагать, что антифьюзогенная активность этих флавонолов обусловлена их способностью разупорядочивать мембраны из фосфатидилглицеринов. При этом менее выраженное влияние кверцетина и мирицетина на плотность упаковки бислоев из фосфатидилхолинов приводит к неспособности флавонолов подавлять слияние фосфатидилхолин-обогащенных везикул.
На рис. 4 видно, что пентациклические тритерпеноиды, входящие в состав ЭЧ, бетулин и люпеол, практически не подавляют слияния ни отрицательно заряженных везикул под действием кальция (рис. 4а), ни незаряженных липосом в присутствии ПЭГ-8000 (рис. 4б). Таким образом, ввиду невыраженной антифьюзогенной активности этих тритерпеноидов в обеих системах (табл. 2), бетулин и люпеол не могут быть компонентами, ответственными за подавление ЭЧ слияния везикул под действием как кальция, так и ПЭГ-8000 (табл. 1). Следует отметить, что тестируемые тритерпеноиды характеризуются невыраженным действием на термотропное поведение ДПФГ (Tm уменьшается менее чем на 0.3°C, а T1/2 увеличивается на 0.1°C (табл. 2)) и ДПФХ [25]. Это хорошо согласуется с предположением о связи разупорядочивающей способности тестируемых соединений с их антифьюзогенной активностью: слабое влияние бетулина и люпеола на плавление ДПФГ (табл. 2) и ДПФХ [25] выражается в неспособности этих тритерпеноидов ингибировать слияние фосфатидилглицерин- и фосфатидилхолин-обогащенных везикул (табл. 2).
Маловероятно, что антифьюзогенная способность ЭЧ обусловлена присутствием в его составе стеринов, поскольку они известны своей способностью увеличивать отрицательную спонтанную кривизну липидных монослоев при адсорбции [26] и тем самым могут скорее индуцировать слияние мембран. Наличие гидроксильной группы в боковой цепи гидрофильного производного ланостерина, инотодиола, может препятствовать его погружению в углеводородный остов бислоя и изменять трансмембранный профиль латерального давления таким образом, чтобы увеличивать энергию образования промежуточных интермедиатов слияния и подавлять процесс объединения мембран. Ингибирование экстрактом чаги слияния незаряженных липидных везикул может указывать на противовирусное действие этого экстракта.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Источник финансирования. Работа выполнена при частичной финансовой поддержке ЗАО “Эвалар”. Исследования влияния флавонолов на слияние мембран и термотропное поведение липидов выполнены при поддержке Российского научного фонда (проект № 22-15-00417).
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Komura M., Suzuki M., Sangsriratanakul N., Ito M., Takahashi S., Alam M.S., Ono M., Daio C., Shoham D., Takehara K. 2019. Inhibitory effect of grapefruit seed extract (GSE) on avian pathogens. J. Vet. Med. Sci. 81, 466–472.
Go C.C., Pandav K., Sanchez-Gonzalez M.A., Ferrer G. 2020. Potential role of xylitol plus grapefruit seed extract nasal spray solution in COVID-19: Case series. Cureus. 12, e11315.
Monika J.A., Sudipta C., Malleswara R.E., Lilly G. 2016. Effect of hippophae rhamnoides leaf extract against dengue virus infection in U937 cells. Virol-Mycol. 5, 157.
Singh P.K., Rawat P. 2017. Evolving herbal formulations in management of dengue fever. J. Ayurveda Integr. Med. 8, 207–210.
Jain M., Ganju L., Katiyal A., Padwad Y., Mishra K.P., Chanda S., Karan D., Yogendra K.M.S., Sawhney R.C. 2008. Effect of Hippophae rhamnoides leaf extract against Dengue virus infection in human blood-derived macrophages. Phytomedicine. 15, 793–799.
Enkhtaivan G., Maria John K.M., Pandurangan M., Hur J.H., Leutou A.S., Kim D.H. 2017. Extreme effects of Seabuckthorn extracts on influenza viruses and human cancer cells and correlation between flavonol glycosides and biological activities of extracts. Saudi J. Biol Sci. 24, 1646–1656.
Shahzad F., Anderson D., Najafzadeh M. 2020. The antiviral, anti-inflammatory effects of natural medicinal herbs and mushrooms and SARS-CoV-2 infection. Nutrients. 12, 2573.
Arunachalam K., Sasidharan S., Yang X. 2022. A concise review of mushrooms antiviral and immunomodulatory properties that may combat against COVID-19. Food Chem. Advances. 1, 100023.
Eid J.I., Das B., Al-Tuwaijri M.M., Basal W.T. 2021. Targeting SARS-CoV-2 with Chaga mushroom: An in silico study toward developing a natural antiviral compound. Food. Sci. Nutr. 9, 6513–6523.
Pan H.H., Yu X.T., Li T., Wu H.L., Jiao C.W., Cai M.H., Li X.M., Xie Y.Z., Wang Y., Peng T. 2013. Aqueous extract from a Chaga medicinal mushroom, Inonotus obliquus (higher Basidiomycetes), prevents herpes simplex virus entry through inhibition of viral-induced membrane fusion. Int. J. Med. Mushrooms. 15, 29–38.
Tian J., Hu X., Liu D., Wu H., Qu L. 2017. Identification of Inonotus obliquus polysaccharide with broad-spectrum antiviral activity against multi-feline viruses. Int. J. Biol. Macromol. 95, 160–167.
Seetaha S., Ratanabunyong S., Tabtimmai L., Choowongkomon K., Rattanasrisomporn J., Choengpanya K. 2020. Anti-feline immunodeficiency virus reverse transcriptase properties of some medicinal and edible mushrooms. Vet. World. 13, 1798–1806.
Choengpanya K., Ratanabunyong S., Seetaha S., Tabtimmai L., Choowongkomon K. 2021. Anti-HIV-1 reverse transcriptase property of some edible mushrooms in Asia. Saudi J. Biol. Sci. 28, 2807–2815.
Avula B., Sagi S., Wang Y.H., Wang M., Gafner S., Manthey J.A., Khan I.A. 2016. Liquid chromatography-electrospray ionization mass spectrometry analysis of limonoids and flavonoids in seeds of grapefruits, other citrus species, and dietary supplements. Planta. Med. 82, 1058–1069.
Yogendra Kumar M.S., Tirpude R.J., Maheshwari D.T., Bansal A., Misra K. 2013. Antioxidant and antimicrobial properties of phenolic rich fraction of Seabuckthorn (Hippophae rhamnoides L.) leaves in vitro. Food Chem. 141, 3443–3450.
Pop R.M., Socaciu C., Pintea A., Buzoianu A.D., Sanders M.G., Gruppen H., Vincken J.-P. 2013. UHPLC/PDA-ESI/MS analysis of the main berry and leaf flavonol glycosides from different carpathian Hippophaë rhamnoides L. varieties. Phytochem. Anal. 24, 484–492.
Criste A., Urcan A.C., Bunea A., Pripon Furtuna F.R., Olah N.K., Madden R.H., Corcionivoschi N. 2020. Phytochemical composition and biological activity of berries and leaves from four romanian sea buckthorn (Hippophae rhamnoides L.) varieties. Molecules. 25, 1170.
Nikitina S.A., Khabibrakhmanova V.R., Sysoeva M.A. 2016. Composition and biological activity of triterpenes and steroids from Inonotus obliquus (chaga). Biochem. (Moscow) Supplement Series B. 62, 369–375.
Chicka M.C., Hui E., Liu H., Chapman E.R. 2008. Synaptotagmin arrests the SNARE complex before triggering fast, efficient membrane fusion in response to Ca2+. Nat. Struct. Mol. Biol. 15, 827–835.
Lai A.L., Millet J.K., Daniel S., Freed J.H., Whittaker G.R. 2017. The SARS-CoV fusion peptide forms an extended bipartite fusion platform that perturbs membrane order in a calcium-dependent manner. J. Mol. Biol. 429, 3875–3892.
Yang Q., Guo Y., Li L., Hui S.W. 1997. Effects of lipid headgroup and packing stress on poly(ethylene glycol)-induced phospholipid vesicle aggregation and fusion. Biophys. J. 73, 277–282.
Lentz B.R. 2007. PEG as a tool to gain insight into membrane fusion. Europ. Biophys. J. 36, 315–326.
Shekunov E.V., Efimova S.S., Yudintceva N.M., Muryleva A.A., Zarubaev V.V., Slita A.V., Ostroumova O.S. 2021. Plant alkaloids inhibit membrane fusion mediated by calcium and fragments of MERS-CoV and SARS-CoV/SARS-CoV-2 fusion peptides. Biomedicines. 9, 1434.
Ефимова С.С., Захарова А.А., Чернышова Д.Н., Остроумова О.С. 2022. Особенности действия экстрактов семян грейпфрута, листьев облепихи и чаги на свойства модельных липидных мембран. Цитология. В печати.
Efimova S.S., Ostroumova O.S. 2021. Is the membrane lipid matrix a key target for action of pharmacologically active plant saponins? Int. J. Mol. Sci. 22, 3167.
Chlanda P., Mekhedov E., Waters H., Schwartz C.L., Fischer E.R., Ryham R.J., Cohen F.S., Blank P.S., Zimmerberg J. 2016. The hemifusion structure induced by influenza virus haemagglutinin is determined by physical properties of the target membranes. Nat. Microbiol. 1, 16050.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


