Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 5, стр. 345-354
Исследования электрогенного ионного транспорта в Nа+,K+-ATP-азе на бислойных липидных мембранах импедансным методом
В. С. Соколов *
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: sokolovvs@mail.ru
Поступила в редакцию 04.05.2022
После доработки 24.05.2022
Принята к публикации 26.05.2022
- EDN: DSOOKR
- DOI: 10.31857/S0233475522050115
Аннотация
Рассмотрены результаты исследования электрогенного транспорта, осуществляемого Na+,K+-ATP-азой – белком, обеспечивающим активный транспорт ионов Na+ и K+ через мембраны клеток. Основной вклад в электрический ток при функционировании Na+,K+-ATP-азы вносит перемещения ионов натрия в каналах доступа – каналоподобных структурах, соединяющих центры связывания ионов с растворами. Электрогенный транспорт изучали на модельной системе, состоящей из бислойной липидной мембраны с адсорбированными на ней фрагментами мембран, содержащих Na+,K+-ATP-азу. Применение импедансного метода для изучения электрогенного транспорта, осуществляемого Na+,K+-ATP-азой позволило изучить каналы доступа ионов в этом белке. Большой вклад в эти исследования внес Ю.А. Чизмаджев, при активном участии которого разрабатывалась теоретическая модель транспорта ионов Na+,K+-ATP-азой, частично рассматриваемая в данной работе.
ВВЕДЕНИЕ
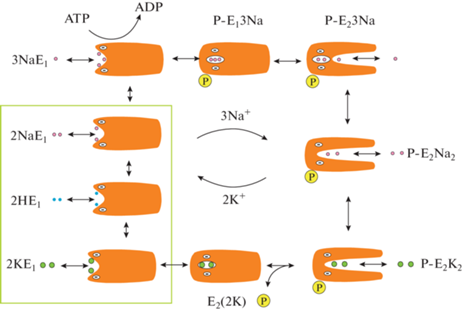
Исследования ионного транспорта через мембрану начали интенсивно развиваться, с тех пор как в 1963 году был описан способ формирования бислойной липидной мембраны – простой и удобной для измерения электрических токов модели биологической мембраны [1]. Эта мембрана представляет собой хороший изолятор, но если в нее встроить белки или более простые соединения, мембрана может начать проводить электрический ток, измеряя который можно исследовать механизмы ионной проницаемости мембраны, индуцированной этими соединениями. В Институте электрохимии такие исследования начались по инициативе А.Н. Фрумкина и значительно ускорились благодаря Ю.А. Чизмаджеву после того, как была организована лаборатория биоэлектрохимии. Исследования проводились как на теоретическом, так и на экспериментальном уровне. Первоначально их предметом были простые соединения и пептиды, делающие мембрану проницаемой для ионов щелочных металлов или водорода. Теоретические модели такого транспорта были изложены в монографии [2]. В дальнейшем предметом исследований стали более сложные виды пассивного обменного транспорта ионов калия и водорода, индуцированного соединениями нигерицинового ряда [3‒5], активный транспорт протонов, осуществляемый бактериородопсином [6], и Na+,K+-ATP-аза, осуществляющая активный транспорт ионов калия и натрия. Несмотря на то что этот белок представляет собой довольно сложную молекулярную машину, цикл функционирования которой включает переходы между большим числом состояний, оказалось, что отдельные стадии осуществляемого ею транспорта электрогенны, т.е. сопровождаются переносом внутри мембраны электрического заряда, и их можно изучать сравнительно простыми методами. Было показано, что активный транспорт ионов осуществляется за счет последовательного открывания и закрывания особых структур в белке, напоминающих ионные каналы, закрытые с одного конца. Они получили название “каналы доступа”. Каналы доступа обеспечивают перенос ионов калия или натрия к центрам связывания в белке. Сам цикл функционирования получил название “цикл Алберса–Поста” [7] (рис. 1). Наиболее существенной особенностью цикла Алберса–Поста является наличие двух основных конформаций белка Е1 и Е2, в которых открыт доступ ионов к центрам связывания либо из цитоплазмы, либо из внеклеточной среды. Конформационный переход из Е1 в Е2 происходит в результате гидролиза ATP, причем освободившийся в результате фосфат остается связанным с белком (происходит фосфорилирование) и освобождается только при обратном переходе из Е2 в Е1. Первоначально цикл Алберса–Поста был установлен в результате биохимических исследований в виде формальной схемы, но затем методами рентгеновского рассеяния были установлены структуры белка в разных состояниях этого цикла [8–13]. По схожему механизму функционирует целый ряд белков, осуществляющих активный транспорт различных ионов [14–17].
Рис. 1.
Упрощенная схема транспорта ионов натрия Na+,K+-ATP-азой на основе ферментативного цикла Алберса–Поста, модифицированного согласно [18]. Левая сторона диаграммы отражает реакции на цитоплазматической стороне мембраны, правая – на внеклеточной стороне. Символы E1 и E2 обозначают две основные конформации белка, стрелки указывают переходы между состояниями. В прямоугольной рамке представлены гипотетические состояния Na+,K+-ATP-азы, в которых для осуществления транспорта ионов могут принимать участие протоны.
ЭЛЕКТРОГЕННЫЙ ТРАНСПОРТ, ОСУЩЕСТВЛЯЕМЫЙ Nа+,K+-ATP-азой
Значительный прогресс в исследованиях электрогенного транспорта, осуществляемого Na+,K+-ATP-азой, был достигнут после публикаций 1980‑х годов нескольких групп из Германии и США. Было показано, что перенос ионов в каналах доступа между раствором и центром связывания в белке является электрогенным и происходит пассивно, т.е. на распределение ионов между центром связывания и раствором можно влиять, прикладывая к мембране электрическое поле [19–22]. Скачкообразное изменение напряжения на мембране с Na+,K+-ATP-азой приводит к появлению переходного электрического тока, вызванного перераспределением ионов между центром связывания и раствором, и заканчивающимся установлением нового равновесия. Изучение этого процесса, впервые открытого в электрофизиологических исследованиях на изолированных клетках сердечных миоцитов [23], давало возможность узнать свойства канала доступа, скорость переноса в нем ионов и оценить глубину канала. Информацию о глубине канала доступа можно получить, определив “диэлектрический коэффициент”, который характеризует “степень электрогенности” процесса переноса ионов в канале. Этот параметр определяет относительную глубину, в которой происходит в мембране перенос заряда, по вкладу этого перемещения заряда в мембране в измеряемый электрический ток. К сожалению, это не совсем глубина канала: вклад в ток, регистрируемый во внешней цепи, зависит не только от величины смещения заряда, но и от поляризуемости среды, в которой это смещение происходит [19, 24]. Диэлектрический коэффициент определяет, какая часть приложенного к мембране напряжения влияет на перенос заряда в белке, либо во сколько раз меньший заряд должен быть перенесен во внешней цепи в условиях короткозамкнутой цепи по сравнению с зарядом, перенесенным внутри белка [25]. Изучение электрогенного транспорта проводили на изолированных клетках сердечных миоцитов, ооцитов, гигантских аксонов кальмара, а также на изолированных фрагментах мембран (методом patch-clamp) [26–28]. Из-за того что электрический ток, генерируемый Na+,K+-ATP-азой, мал по сравнению с типичными токами, регистрируемыми в ионных каналах, стандартный метод patch-clamp оказался неприменим, и для регистрации таких токов был разработан метод “giant patch-clamp”, позволивший намного увеличить площадь изолированного фрагмента мембраны [29, 30].
ИССЛЕДОВАНИЯ НА БИСЛОЙНЫХ МЕМБРАНАХ
На бислойных липидных мембранах (БЛМ) изучение Na+,K+-ATP-азы началось с работ двух групп в Германии [31, 32]. Встроить Na+,K+-ATP-азу в липидный бислой не удалось, и фрагменты мембран, содержащие этот белок, адсорбировали на поверхности БЛМ, в результате чего образовывалась двухслойная структура (рис. 2).
Рис. 2.
а – Схематическое изображение БЛМ с адсорбированным мембранным фрагментом, содержащим Na+,K+-ATP-азу [25]. Сплошной линией показан профиль электрического потенциала, возникающий в результате заряжения контактирующих мембран при переносе ионов Na+,K+-ATP-азой в условиях коротко замкнутой цепи. б – эквивалентная электрическая схема: Cp – суммарная емкость адсорбированных на БЛМ мембранных фрагментов, содержащих Na+,K+-ATP-азу; CF – емкость области БЛМ, контактирующей с фрагментами; Ip(t) – ток, генерируемый всеми активными Na+,K+-ATP-азами; I(t) – ток, регистрируемый в эксперименте.
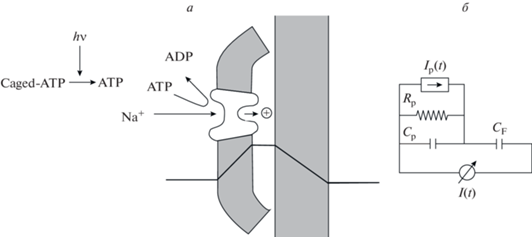
Одна из сторон мембраны с Na+,K+-ATP-азой при этом обращена в щель между ней и БЛМ. Такая структура не позволяет контролировать напряжение на мембране с Na+,K+-ATP-азой и регистрировать проходящий через нее постоянный электрический ток, но в ней можно регистрировать переменный ток в условиях короткозамкнутой цепи. Он возникает из-за того, что перемещение заряда в белке приводит к изменению заряда электрической емкости мембранного фрагмента, содержащего Na+,K+-ATP-азу, и для его компенсации во внешней цепи происходит перемещение заряда в обратном направлении, которое и регистрируется в эксперименте. Для того чтобы инициировать возникновение переходных токов в Na+,K+-ATP-азе, были использованы так называемые “Сaged” – соединения [33], в которых субстрат, необходимый для функционирования Na+,K+-ATP-азы, быстро освобождался из неактивного комплекса под действием вспышки ультрафиолетового света. Наиболее популярным соединением был Caged-ATP, позволяющий “включать” Na+,K+-ATP-азу с помощью быстрого освобождения молекул ATP. Позднее для изучения Na+,K+-ATP-азы стали применять другие соединения: Caged-P для быстрого освобождения фосфата [34], а также Caged-H+ для быстрого изменения рН.
Данная модельная система была использована в лаборатории биоэлектрохимии для изучения Na+,K+-ATP-азы. Исследования были начаты по инициативе Ю.А. Чизмаджева. Большую помощь оказал профессор Х.Ю. Апель из Университета г. Констанц (Германия). В начале исследований уже было известно, что электрические токи возникают в Na+,K+-ATP-азе в отсутствие ионов калия, когда белок не может совершать полный цикл функционирования, и основной вклад в электрический ток в этих условиях вносит перемещение ионов натрия в канале доступа, открытом с внеклеточной стороны белка. Такое перемещение приводит к появлению переходных токов, которые в экспериментах на клетках наблюдали в ответ на скачкообразное изменение мембранного потенциала. К мембранным фрагментам, адсорбированным на БЛМ, невозможно контролируемо приложить скачки напряжения, и переходные токи наблюдали в ответ на быстрое освобождение ATP из Caged-ATP. Для того чтобы изучать влияние электрического поля на эти переходные токи, был применен оригинальный подход, когда к мембране прикладывали переменное напряжение синусоидальной формы. Это напряжение вызывало появление переменной составляющей тока. В эксперименте эта переменная составляющая тока могла быть измерена как изменение емкости и проводимости мембраны с адсорбированными на ней фрагментами с Na+,K+-ATP-азой [35] в ответ на быстрое освобождение ATP из Caged-ATP. Такой подход позволил изучить натриевый ток в Na+,K+-ATP-азе в широком диапазоне концентраций ионов натрия. Оказалось, что помимо перемещения ионов натрия во внеклеточном канале, которое было достаточно хорошо изучено, данный подход позволяет обнаружить перемещение ионов натрия во внутриклеточном канале. Такой процесс приводит к появлению электрического тока, небольшого по величине по сравнению с током, связанным с перемещением во внеклеточном канале, поскольку глубина внутриклеточного канала значительно меньше глубины внеклеточного канала. Перемещение ионов натрия в этом канале происходит в отсутствие ATP, но после связывания и гидролиза ATP канал закрывается и открывается внеклеточный канал. Поэтому транспорт ионов во внутриклеточном канале не могли обнаружить в экспериментах на клетках, где электрические токи регистрировали в присутствии ATP. Проведенные с помощью данного метода эксперименты позволили детально изучить перенос ионов натрия во внутриклеточном канале, определить скорость переноса и относительную глубину канала (диэлектрический коэффициент). Для этого при непосредственном участии Ю.А. Чизмаджева была разработана теоретическая модель переноса ионов натрия в каналах Na+,K+-ATP-азы [36] (рис. 3).
Рис. 3.
Теоретическая модель нестационарного транспорта ионов натрия Na+,K+-ATP-азой [36]. Слева – совокупность состояний Na+,K+-ATP-азы, реализующихся в ходе гидролиза ATP. c – Цитоплазматическая сторона системы, e – внутриклеточная сторона. Символами E1 и E2 обозначен белок в двух разных конформациях. Справа – динамические потенциальные барьеры, введенные в рассмотрение Лойгером и Апелем [19, 24]. Ион натрия, участвующий в транспорте, обозначен черным кружком.
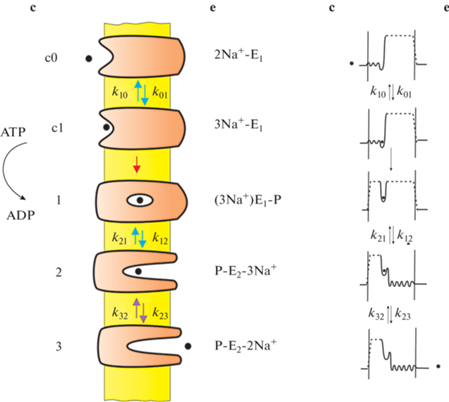
ТЕОРЕТИЧЕСКАЯ МОДЕЛЬ ПЕРЕНОСА ИОНОВ НАТРИЯ В КАНАЛАХ Na+,K+-ATP-азы
Транспорт ионов натрия рассматривается как переход между несколькими состояниями белка, в которых открыты каналы доступа ионов с цитоплазматической (обозначены как E1) или внеклеточной (E2) сторон мембраны. С физической точки зрения все состояния белка могут быть представлены как последовательная смена потенциальных барьеров для ионов натрия в мембране. Имеется также состояние окклюзии, в котором ион заперт (находится в потенциальной яме между двумя высокими потенциальными барьерами). В остальных состояниях остается только по одному из этих высоких барьеров, закрывающих каналы либо с внеклеточной (в состояниях c0 и c1), либо с цитоплазматической стороны (в состояниях 2 и 3). Электрогенными считаются только перемещения ионов натрия в цитоплазматическом и внеклеточном каналах доступа (переходы между состояниями c0 и c1, а также между состояниями 2 и 3). Эти переходы представляют из себя диффузию или миграцию Na+ в каналах доступа, во время которых никаких конформационных перестроек в белке не происходит. Перемещение ионов в каналах происходит благодаря приложению электрического напряжения к мембране, и приводит к появлению электрического тока во внешней цепи. Если электрическое поле в каналах и концентрация в них ионов Na+ малы, транспорт ионов в каналах может рассматриваться как перескоки через невысокие (по сравнению с рассмотренными выше) потенциальные барьеры. Математически переходы между состояниями были представлены дифференциальными уравнениями, решение которых позволило определить изменения емкости и проводимости мембраны в зависимости от концентрации ионов натрия и частоты приложенного переменного напряжения. Это позволило объяснить экспериментальные результаты, полученные на модельной системе, состоящей из содержащих Na+,K+-ATPазу мембранных фрагментов, адсорбированных на БЛМ.
ИМПЕДАНСНЫЕ ИЗМЕРЕНИЯ НА БЛМ
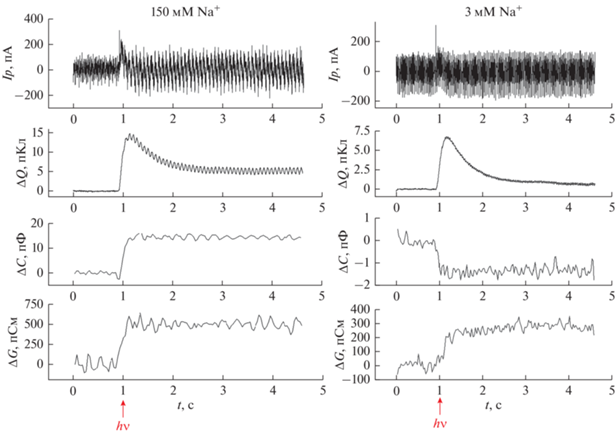
В эксперименте к мембране прикладывали переменное напряжение и записывали кинетику изменения тока при фотоиндуцированном освобождении ATP из Caged-ATP [37]. Полученные зависимости от времени тока короткого замыкания, его интеграла, а также изменения емкости и проводимости БЛМ с адсорбированными на ней фрагментами, содержащими Na+,K+-ATP-азу в ответ на освобождение ATP из Caged-ATP при вспышке ультрафиолетового света изображены на рис. 4. Записи приводятся при двух концентрациях ионов натрия: 150 мМ (слева) и 3 мМ (справа). При высокой концентрации ионов натрия освобождение ATP вызывает увеличение емкости и проводимости мембраны, а при низкой концентрации емкость уменьшается. Уменьшение емкости мембраны при низкой концентрации ионов натрия, в соответствии с рассмотренной выше моделью, объясняется тем, что в эксперименте регистрируется разностный сигнал: переменный ток, измеренный после введения ATP, вычитается из тока, измеренного в отсутствие ATP. Поэтому отрицательное приращение емкости и проводимости может быть вызвано электрогенным транспортом ионов, который подавляется при гидролизе ATP и последующем фосфорилировании Na+,K+-ATP-азы. Таким транспортом является электрогенное перемещение ионов в цитоплазматическом канале Na+,K+-ATP-азы.
Рис. 4.
Сигналы, регистрируемые в эксперименте при двух концентрациях ионов натрия: 150 мМ (слева) и 3 мМ (справа). Сверху вниз показаны: регистрируемый в эксперименте ток, интеграл этого тока, изменения емкости и проводимости во времени, полученные в результате вычислений и используемые для определения изменений адмиттанса мембраны. Стрелками указаны моменты вспышки УФ-света. Водный раствор содержал 150 мМ NaCl, 10 мМ MgCl2, 30 мМ имидазол, 1 мМ EDTA, pH 6.5, а также 100 мкМ Caged-ATP и суспензию фрагментов с Na+,K+-ATP-азой (0.05 мг белка на 1 мл раствора).
Зависимости приращений емкости и проводимости мембраны от частоты переменного напряжения измерялись при разных концентрациях ионов натрия в диапазоне от 3 мМ до 1 М. В соответствии с рассмотренной моделью, частотные зависимости приращений емкости ΔC и проводимости ΔG описывались линейной комбинацией функций Лоренца с разными характерными частотами. В частотной области эти функции эквивалентны экспонентам во временной области, с помощью которых описывались переходные токи после скачкообразного изменения напряжения в экспериментах на клетках. Каждая из таких функций отражает переход белка между двумя состояниями, а соответствующая ей характерная частота – скорость такого перехода. Характерная частота ω0 отражает скорость конформационного перехода из E1 в E2. Это самая медленная стадия. Характерная частота ω1 отражает скорость перемещения ионов натрия во внеклеточном, а ω2 в цитоплазматическом канале доступа. Амплитуды этих функций зависят от концентрации ионов натрия, принимая максимальное значение при концентрации, близкой к константе связывания в данной стадии. Амплитуда C2 с отрицательным знаком отражает вклад в переменный ток транспорта ионов натрия в цитоплазматическом канале, который закрывается после перехода Na+,K+-ATP-азы в состояние E2 в результате гидролиза ATP:
В результате аппроксимации частотных зависимостей емкости и проводимости этими функциями были получены значения их параметров при разной концентрации ионов натрия в растворе. Зависимости амплитуд C0, C1, C2 и характерных частот ω0, ω1, ω2, трех Лоренцианов от концентрации ионов натрия изображены на рис. 5.
Рис. 5.
Зависимость амплитуд (вверху) и характерных частот (внизу) функций Лоренца, аппроксимирующих частотные зависимости изменений емкости и проводимости, вызванных скачкообразным освобождением ATP при функционировании Na+,K+-ATP-азы от концентрации ионов натрия в растворе. Точки получены при усреднении результатов не менее трех экспериментов. Сплошные линии – теоретические кривые [37].
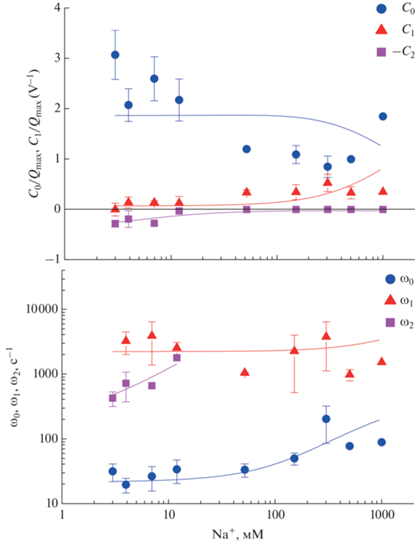
То, что характерная частота ω0 определяется скоростью конформационного перехода Na+,K+-ATP-азы, было подтверждено при изучении эффектов высоких концентраций солей на кинетику функционирования белка. Известно, что солевой эффект приводит к замедлению конформационного перехода [38]. В экспериментах, проведенных на БЛМ с помощью используемых нами методов было показано, что увеличение концентрации анионов Cl–, Br– или I– приводило к значительному уменьшению величины ω0 [39]. Значения скоростей ω0 и ω1 оказались в несколько раз меньше постоянных времени экспонент, аппроксимирующих переходные токи, измеренные при скачке напряжения на гигантском аксоне кальмара [26]. Такое отличие может быть вызвано несколькими причинами. Одна из них может быть связана с тем, что Na+,K+-ATP-аза обладает сильной температурной зависимостью, и измерения на клетках обычно проводились при температурах около 37°С, в то время как в данной работе измерения проводились при более низких температурах (20–25°С).
Константа диссоциации Na+ в активном центре с внеклеточной стороны, 1/Ke, оказалась равной 0.74 M, а с внутриклеточной – 1.5 мМ. Эти значения близки к литературным, полученным с помощью флуоресцентных зондов, где они составляли соответственно 500 мМ и 1–5 мМ (в последнем случае значение зависело от концентрации ионов магния) [40, 41]. Константы скорости связывания и освобождения ионов натрия в цитоплазматическом канале были определены впервые: первая (k12, константа скорости перехода из состояния c1 в состояние c2 около 2.4 c–1, вторая (k21, обратного перехода) – около 500 c–1. Константа скорости перехода между состояниями 2 и 3 (освобождение Na+ из внеклеточного канала доступа) – около 1500 c–1. Диэлектрический коэффициент перемещения натрия (характеризующий относительную глубину канала, соединяющего раствор с центром связывания) с цитоплазматической стороны (0.2) оказался значительно меньше, чем с внеклеточной стороны (0.89). Таким образом, место связывания третьего иона натрия расположено в мембране асимметрично и находится ближе к цитоплазматической стороне мембраны. Несмотря на то что сделанные оценки достаточно грубые, они хорошо согласуются с оценками диэлектрических коэффициентов, полученными независимыми методами, где были получены значения диэлектрических коэффициентов 0.25 для цитоплазматического канала и 0.7 для внеклеточного [18, 42, 43].
УЧАСТИЕ ПРОТОНОВ В ФУНКЦИОНИРОВАНИИ Na+,K+-ATP-азы
Дальнейшие работы были посвящены более детальному изучению связывания и транспорта ионов натрия и калия с цитоплазматической стороны белка. Оказалось, что связывание ионов происходит в обмен на протоны. Протонному транспорту и влиянию рН на транспорт других ионов Na+,K+-ATP-азой были посвящены исследования нескольких групп [44–47].Оказалось, что рН не только влияет на скорость функционирования Na+,K+-ATP-азы, но протоны участвуют в ее транспортном цикле, а в определенных условиях могут переноситься белком вместо ионов натрия и калия. Это объясняется гомологическим и структурным сходством Na+,K+-ATP-азы с другими ATP-азами P-типа, способными транспортировать через мембрану протоны, особенно с K+,H+-ATP-азой. Они наиболее близки по структуре и в определенных условиях могут “подменять” друг друга [48, 49]. На участие протонов в функционировании Na+,K+-ATP-азы указывают и рентгеноструктурные данные, согласно которым в связывании ионов в центре белка участвуют диссоциированные отрицательно заряженные аминокислотные остатки, которые при низких концентрациях ионов могут находиться в протонированном состоянии [12]. В исследованиях, проведенных нами на БЛМ с приложением переменного напряжения, было показано, что ATP-зависимые электрические токи зависят от рН и могут наблюдаться в условиях отсутствия ионов Na+, что говорит о возможности транспорта протонов Na+,K+-ATP-азой [50]. Для более детального исследования участия протонов в функционировании Na+,K+-ATP-азы вместо Caged-ATP для инициирования электрических сигналов стали применять другое соединение – Caged-H+. Это позволило исследовать токи смещения в цитоплазматическом канале Na+,K+-ATP-азы, вызванные быстрым скачком рН. В результате этих исследований удалось определить константы диссоциации ионов натрия и калия в центре связывания с цитоплазматической стороны белка [51–53].
ЗАКЛЮЧЕНИЕ
Таким образом, применение импедансного метода для изучения активного транспорта, осуществляемого Na+,K+-ATP-азой, позволило получить существенную информацию о механизме этого транспорта, в частности, оценить кинетические и равновесные параметры связывания ионов, а также относительные глубины каналов, соединяющих центры связывания ионов с растворами с двух сторон белка.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Источники финансирования. Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (регистрационный номер темы АААА-А20-12010190002-4.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Mueller P., Rudin D.O., Tien H.T., Wescott W.C. 1963. Methods for the formation of single bimolecular lipid membranes in aqueous solution. J. Phys. Chem. 67, 534–535.
Маркин В.С., Чизмаджев Ю.А. 1974. Индуцированный ионный транспорт. М.: Наука, 251 с.
Маркин В.С., Соколов В.С. 1986. Мембранный потенциал при сопряженном электрогенном транспорте. Термодинамическое рассмотрение. Биол. мембраны. 3, 638–649.
Соколов В.С., Маркин В.С. 1984. Электрогенный транспорт ионов калия и водорода через мембрану, осуществляемый артибиотиками нигерициноми и гризориксином. Биол. мембраны. 1 (10), 1071–1086.
Markin V.S., Sokolov V.S. 1990. A new concept of electrochemical membrane equilibrium. Coupled transport and membrane potential. Bioelectrochem. Bioenerg. 23, 1–16.
Portnov V.I., Mirsky V.M., Markin V.S. 1990. Bacteriorhodopsin: Current-voltage characteristics. Bioelectrochem. Bioenerg. 23, 45–63.
Post R.L., Hegyvary C., Kame S. 1972. Activation by adenosine triphosphate in the phosphorylation kinetics of sodium and potassium ion transport adenosine triphosphatase. J. Biol. Chem. 247, 6530–6540.
Morth J.P., Pedersen B.P., Toustrup-Jensen M.S., Sorensen T.L., Petersen J., Andersen J.P., Vilsen B., Nissen P. 2007. Crystal structure of the sodium-potassium pump. Nature. 450 (7172), 1043–1049.
Ogawa H., Shinoda T., Cornelius F., Toyoshima C. 2009. Crystal structure of the sodium-potassium pump (Na+,K+-ATPase) with bound potassium and ouabain. Proc. Natl. Acad. Sci. USA. 106 (33), 13742–13747.
Shinoda T., Ogawa H., Cornelius F., Toyoshima C. 2009. Crystal structure of the sodium-potassium pump at 2.4 Å resolution. Nature. 459 (7245), 446–450.
Kanai R., Ogawa H., Vilsen B., Cornelius F., Toyoshima C. 2013. Crystal structure of a Na+-bound Na+,K+-ATPase preceding the E1P state. Nature. 502 (7470), 201–206.
Toyoshima C., Kanai R., Cornelius F. 2011. First crystal structures of Na+,K+-ATPase: New light on the oldest ion pump. Structure. 19 (12), 1732–1738.
Nyblom M., Poulsen H., Gourdon P., Reinhard L., Andersson M., Lindahl E., Fedosova N., Nissen P. 2013. Crystal structure of Na+,K+-ATPase in the Na+-bound state. Science. 342 (6154), 123–127.
Bublitz M., Morth J.P., Nissen P. 2011. P-type ATPases at a glance. J. Cell Sci. 124 (Pt 15), 2515–2519.
Axelsen K.B., Palmgren M.G. 1998. Evolution of substrate specificities in the P-type ATPase superfamily. J. Mol. Evol. 46 (1), 84–101.
Palmgren M.G., Axelsen K.B. 1998. Evolution of P-type ATPases. Biochim. Biophys. Acta. 1365 (1–2), 37–45.
Pedersen C.N., Axelsen K.B., Harper J.F., Palmgren M.G. 2012. Evolution of plant p-type ATPases. Front. Plant Sci. 3, 31.
Wuddel I., Apell H.J. 1995. Electrogenicity of the sodium transport pathway in the Na,K-ATPase probed by charge-pulse experiments. Biophys. J. 69 (3), 909–921.
Lauger P. 1991. Electrogenic ion pumps. Sunderland, Massachusets, USA: Sinauer Associates, Inc., 312 p.
De Weer P., Gadsby D.C., Rakowski R.F. 1988. Voltage dependence of the Na-K pump. Ann. Rev. Physiol. 50, 225–241.
Gadsby D.C., Rakowski R.F., De Weer P. 1993. Extracellular access to the Na,K-pump: Pathway similar to ion channel. Science. 260, 100–103.
Apell H.-J., Borlinghaus R., Lauger P. 1989. Electrogenic properties of the Na/K pump-voltage dependence and kinetics of charge translocation. Curr. Top. Membr. Transp. 34, 229–252.
Nakao M., Gadsby D.C. 1986. Voltage dependence of Na translocation by the Na/K pump. Nature. 323 (6089), 628–630.
Apell H.J., Borlinghaus R., Lauger P. 1987. Fast charge translocations associated with partial reactions of the Na,K-pump: II. Microscopic analysis of transient currents. J. Membrane Biol. 97 (3), 179–191.
Павлов К.В., Соколов В.С. 1999. Электрогенный транспорт ионов Na+,K+,ATP-азой. Биол. мембраны. 16 (6), 604–638.
Holmgren M., Wagg J., Bezanilla F., Rakowski R.F., De Weer P., Gadsby D.C. 2000. Three distinct and sequential steps in the release of sodium ions. Nature. 403, 898–901.
Rakowski R.F., Paxson C.L. 1988. Voltage dependence of Na/K pump current in Xenopus oocytes. J. Membrane Biol. 106, 173–182.
Holmgren M., Rakowski R.F. 2006. Charge translocation by the Na+/K+ pump under Na+/Na+ exchange conditions: Intracellular Na+ dependence. Biophys. J. 90 (5), 1607–1616.
Hilgemann D.W. 1994. Channel-like function of the Na,K pump probed at microsecond resolution in giant membrane patches. Science. 263, 1429–1432.
Lu C.-C., Kabakov A., Markin V.S., Mager S., Frazier S., Frazier G.A., Hilgemann D.W. 1995. Membrane Transport mechanisms probed by capacitance measurements with megahertz voltage clamp. Proc. Natl. Acad. Sci. USA. 1995, 11220–11224.
Fendler K., Grell E., Haubs M., Bamberg E. 1985. Pump currents generated by the Na+,K+-ATPase from kidney on black lipid membranes. EMBO J. 4, 3079–3085.
Borlinghaus R., Apell H.J., Lauger P. 1987. Fast charge translocations associated with partial reactions of the Na,K-pump: I. Current and voltage transients after photochemical release of ATP. J. Membrane Biol. 97 (3), 161–178.
McCray J.A., Trentham D.R. 1989. Properties and uses of photoreactive caged compaunds. Annu. Rev. Biophys. Biophys. Chem. 18, 239–270.
Apell H.J., Roudna M., Corrie J.E., Trentham D.R. 1996. Kinetics of the phosphorylation of Na,K-ATPase by inorganic phosphate detected by a fluorescence method. Biochemistry. 35 (33), 10922–10930.
Соколов В.С., Павлов К.В., Джанджугазян К.Н., Бамберг Е. 1992. Изменение емкости и проводимости модельной мембраны при функционировании Na+,K+,ATP-азы. Биол. мембраны. 9, 961–969.
Щербаков А.А., Чизмаджев Ю.А., Ленц А.А., Соколов В.С. 2005. Импедансная спектроскопия транспорта ионов натрия в Na+,K+,ATP-азе. Биол. мембраны. 22 (6), 511–523.
Sokolov V.S., Shcherbakov A.A., Lenz A.A., Chizmadzhev Yu.A., Apell H.J. 2008. Electrogenic transport of sodium ions in cytoplasmic and extracellular ion access channels of Na+,K+-ATPase probed by admittance measurement technique. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology. 2 (2), 161–180.
Post R.L., Suzuki K. 1991. The sodium pump: Structure, mechanism and regulation. Ed. De Weer P., Kaplan J.H. New York: Rockfeller University Press, p. 202–209.
Sokolov V.S., Ayuyan A.G., Apell H.J. 2001. Assignment of charge movements to electrogenic reaction steps of Na,K-ATPase by analysis of salt effects on the kinetics of charge movements. Eur. Biophys. J. 30 (7), 515–527.
Schneeberger A., Apell H.J. 2001. Ion selectivity of the cytoplasmic binding sites of the Na,K-ATPase: II. Competition of various cations. J. Membrane Biol. 179 (3), 263–273.
Schneeberger A., Apell H.J. 1999. Ion selectivity of the cytoplasmic binding sites of the Na,K-ATPase: I. Sodium binding is associated with a conformational rearrangement. J. Membrane Biol. 168 (3), 221–228.
Heyse S., Wuddel I., Apell H.J., Sturmer W. 1994. Partial reactions of the Na,K-ATPase: Determination of rate constants. J. Gen. Physiol. 104 (2), 197–240.
Domaszewicz W., Apell H. 1999. Binding of the third Na+ ion to the cytoplasmic side of the Na,K-ATPase is electrogenic. FEBS Lett. 458 (2), 241–246.
Apell H.J., Diller A. 2002. Do H+ ions obscure electrogenic Na+ and K+ binding in the E1 state of the Na,K-ATPase? FEBS Lett. 532 (1–2), 198–202.
Apell H.J., Benz G., Sauerbrunn D. 2011. Proton diet for the sodium pump. Biochemistry. 50 (3), 409–418.
Vasilyev A., Khater K., Rakowski R.F. 2004. Effect of extracellular pH on presteady-state and steady-state current mediated by the Na+/K+ pump. J. Membrane Biol. 198 (2), 65–76.
Vedovato N., Gadsby D.C. 2014. Route, mechanism, and implications of proton import during Na+/K+ exchange by native Na+/K+-ATPase pumps. J. Gen. Physiol. 143 (4), 449–464.
Polvani C., Blostein R. 1988. Protons as substitutes for sodium and potassium in the sodium pump reaction. J. Biol. Chem. 263 (32), 16757–16763.
Polvani C., Sachs G., Blostein R. 1989. Sodium ions as substitutes for protons in the gastric H,K-ATPase. J. Biol. Chem. 264 (30), 17854–17859.
Гришанин К.О., Ташкин В.Ю., Ленц А.А., Апель Х.-Ю., Соколов В.С. 2010. О возможном участии протонов в функционировании Na+,K+,ATP-азы. Биол. мембраны. 27 (6), 512–518.
Ташкин В.Ю., Гаврильчик А.Н., Иловайский А.И., Апель Х.-Ю., Соколов В.С. 2015. Электрогенное связывание ионов с цитоплазматической стороны Na+,K+-ATP-азы. Биол. мембраны. 32 (2), 110–118.
Ташкин В.Ю., Щербаков А.А., Апель Х.-Ю., Соколов В.С. 2013. Конкурентный транспорт ионов натрия и протонов в цитоплазматическом канале Na+,K+-ATP-азы. Биол. мембраны. 30 (2), 105–114.
Вишнякова В.Е., Ташкин В.Ю., Терентьев А.О., Апель Х.-Ю., Соколов В.С. 2018. Связывание ионов калия в канале доступа с цитоплазматической стороны Na+,K+-ATP-азы. Биол. мембраны. 35 (5), 376–383.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


