Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 5, стр. 364-372
Шум в ультракоротких эластичных мембранных нанотрубках
К. А. Иванова a, b, П. В. Башкиров a, c, *
a Федеральный научно-клинический центр физико-химической медицины
Федерального медико-биологического агентства
119435 Москва, Россия
b Московский физико-технический институт
141701 Долгопрудный, Россия
c Научно-исследовательский институт системной биологии
и медицины Роспотребнадзора
117246 Москва, Россия
* E-mail: pavel.bashkirov@sysbiomed.ru
Поступила в редакцию 04.05.2022
После доработки 02.06.2022
Принята к публикации 03.06.2022
- EDN: FMYGUW
- DOI: 10.31857/S0233475522050061
Аннотация
Проведено исследование флуктуаций ионного тока в эластичных нанопорах в широком диапазоне частот и представлено полное описание их шумовых характеристик. В качестве модели эластичной нанопоры использовался просвет ультракоротких (<200 нм) липидных нанотрубок (укНТ), заполненный раствором электролита. Показано, что на низких частотах (f < 300 Гц) превалирует 1/f-тип шума. Этот низкочастотный шум был проанализирован при различных концентрациях соли и геометрических размерах нанопоры и обнаружено, что мощность 1/f шума пропорциональна обратному числу носителей заряда, что хорошо согласуется с эмпирическим соотношением Хуга. Линейная аппроксимация показала, что параметр Хуга для эластичных нанопор равен (2.5 ± 0.5) × 10–3 – это оказалось на порядок больше, чем для твердотельных аналогов. В высокочастотном режиме (f > 1 кГц) преобладающим становится белый шум, плотность мощности которого линейно зависит от ширины пропускания сигнала и при уменьшении длины укНТ и увеличении ионной силы хорошо согласуется с представлением его как суммы теплового шума Джонсона–Найквиста и дробового шума Шоттки.
ВВЕДЕНИЕ
Нанопоры, заполненные раствором электролита, через просвет которых под действием электрического поля течет ионный ток, обладают отличным потенциалом для использования в качестве универсального детектора и анализатора одиночных молекул ДНК и белков [1–3] благодаря своим исключительным разрешающим и пропускным способностям, а также низкой стоимости. Нанопоры могут быть как биологическими (например, порообразующие белки, встроенные в липидную [4, 5] или полимерную [6] мембрану), так и синтетическими (искусственными), полученными методами травления или высверливания отверстия в тонких пленках различного вещества [3, 7]. Независимо от природы нанопоры измерения основаны на регистрации и анализе формы импульсов падения ионного тока, вызванных электрофоретическим переносом одиночных молекул через просвет нанопоры. Средние значения глубины и длительности провалов тока несут информацию об объеме и суммарном заряде молекулы [2, 5]. Характерная форма сигнала отражает динамические преобразованиях молекулы на микросекундном или наносекундном временном масштабе и может быть использована для определения коэффициента вращательной диффузии и дипольного момента молекулы [8, 9]. Важнейшим фактором, определяющим чувствительность данного метода, является соотношение сигнал/шум, которое зависит от природы, структуры и формы нанопоры [10–14]. Ознакомиться с особенностями шумовых характеристик биологических и синтетических нанопор, а также с методами, направленными на уменьшение шумов, можно в обзорах [15, 16].
В то время как чувствительность биологических нанопор намного превышает разрешающую способность искусственных аналогов [16], последние в свою очередь не имеют ограничений в размерах и намного стабильнее. Для пассивации, изменения гидрофобных/гидрофильных свойств, заряда поверхности твердотельных нанопор используются различные модификаторы. Липидный бислой (ЛБ) – это двумерный жидкий кристалл, поэтому молекулы, закрепившиеся на его поверхности, могут свободно перемещаться вдоль него. Следовательно, модификация нанопор липидом не только придает им биомиметические свойства [8, 17–21]. Неспецифическая адсорбция молекулы аналита на поверхность ЛБ или ее специфическое связывание с рецептором, расположенным в ЛБ, существенно повышает пропускную способность нанопоры, предотвращает забивание просвета, а высокая вязкость липидного бислоя замедляет прохождение молекулы через нанопору, увеличивая длительность сигнала, что имеет большое значение для улучшения соотношения сигнал/шум [8, 21].
Липидный бислой обладает изгибной упругостью, что позволяет формировать из него устойчивые мембранные полые цилиндры [22]. В клетках такие трубки соединяют мембранные компартменты между собой, формируя транспортную сеть, в которой вещества переносятся через просвет или вдоль поверхности трубок [23, 24]. Радиус мембранного цилиндра определяется отношением модуля изгиба к латеральному натяжению мембраны. Из-за низкого натяжения мембран в клетках просвет трубочек обычно значительно превышает размеры транспортируемых молекул. Однако мембранные нанотрубки (НТ) с радиусом просвета 10 нм и менее могут быть сформированы из модельных бислойных липидных мембран (БЛМ), латеральное натяжение которых на несколько порядков больше, чем у клеток [25]. Использование пэтч-кламп-подхода для вытягивания НТ из плоской БЛМ стеклянной или кварцевой микропипеткой позволяет проводить измерение ионного тока, текущего через просвет НТ [26]. Высокое латеральное натяжение обеспечивает стабильность ультракоротких НТ (укНТ) длиной 50–200 нм, которые по своим геометрическим характеристикам соответствуют твердотельным нанопорам, используемым для детектирования одиночных макромолекул. Только в отличие от твердотельных нанопор стенка мембранных нанотрубок эластична и может упруго деформироваться под действием внешних факторов [27]. Для определения минимальной величины деформации, равно как и минимального размера макромолекулы, проходящей через просвет укНТ, который может быть разрешен как характерный сигнал изменения проводимости просвета укНТ, необходимо провести исследование шума ионного тока, текущего через укНТ.
В данной работе мы представляем исследование шума ионного тока для укНТ как в низкочастотном, так и высокочастотном режимах. Дан краткий обзор общих характеристик эластичных нанопор, для напряжений менее 100 мВ, показано линейное соотношение зависимости ток–напряжение (I–V) со значениями сопротивления, которые могут варьироваться с изменением длины и радиуса нанопоры. Мы показали, что спектральная плотность мощности высокочастотного тока хорошо описывается тепловым шумом Джонсона и дробовым шумом Шоттки. Исследование зависимости низкочастотного шума 1/f в укНТ различного размера и заполненных электролитом разной концентрации показало, что этот шум, как и в твердотельных нанопорах [28], связан с количеством носителей заряда и описывается эмпирическим соотношением Хуга. В заключение мы, используя наши результаты для расчета соотношения сигнал/шум, определяем оптимальные условия, в которых возможно детектирование деформации укНТ одиночным белком.
МАТЕРИАЛЫ И МЕТОДЫ
Формирование БЛМ. Для приготовления модельных мембран использовали липиды (Avanti Polar Lipids Inc., США): 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (ДОФЭ), 1,2-диолеоил-sn-глицеро-3-фосфолхолин (ДОФХ) и холестерин (Хол) и органические растворители, сквалан, октан и декан (Sigma, США). Растворенные в хлороформе липиды смешивались в молярном соотношении ДОФХ : ДОФЭ : Хол 6 : 3 : 1, после чего хлороформ испаряли под слабой струей аргона и полученную сухую смесь липидов растворяли в сквалане и в смеси октан/декан 1 : 1 в концентрациях 20 и 10 г/л соответственно. Плоские липидные мембраны формировали методом Рудина–Мюллера [29] на отверстиях медной сетки, обычно использующейся в электронной микроскопии в качестве подложки для образца. Предварительно на поверхность сеточек наносили небольшое (0.4 мкл) количество раствора липидов в смеси октан/декан, после чего органический растворитель испаряли в атмосфере азота в течение 10–15 мин. Далее обработанную сетку закрепляли на дне чашки Петри и заполняли чашку буферным раствором с pH 7.0. Все растворы готовились путем разведения стокового раствора (1M KCl, 20 мМ HEPES, 5 мМ EDTA) бидистиллированной водой. Далее на отверстия в медной сетке наносили толстые пленки из раствора липидов в сквалане. БЛМ спонтанно формировались в результате сужения таких пленок под действием расклинивающего давления, при этом весь лишний липидный материал и растворитель выдавливался на периферию, где формировался тороидальный мениск – резервуар липида. За образованием БЛМ наблюдали с помощью световой микроскопии.
Формирование укНТ. Липидные нанотрубки (НТ) вытягивали из БЛМ стеклянной или кварцевой микропипеткой с радиусом кончика около 1 мкм, используя метод пэтч-кламп, подробный протокол описан в работах [27, 30]. Объем пэтч-пипетки заполняли тем же раствором электролитом, что и чашку Петри. Внутрь пипетки помещали измерительный Ag/AgCl-электрод. Ag/AgCl-электрод заземления располагали в объеме чашки Петри. Электрическое сопротивление пэтч-пипетки в буфере 100 мМ KCl составляло 3–6 МОм.
Формирование НТ контролировали с помощью измерения ионного тока, используя электрофизиологический пэтч-кламп-усилитель (Axon 200B, Molecular Devices Inc., США). Ионный ток I измеряли в режиме фиксации разности потенциалов U = 100 мВ между электродами. Пипетку медленно подводили к БЛМ с помощью пьезомикроманипуляторов (Sensapex, Финлндия) до формирования плотного контакта между кончиком пипетки и БЛМ (сопротивление доступа более 10 ГОм). Далее участок мембраны, изолированный внутри пипетки, разрушали коротким электрическим импульсом высокого напряжения или скачком отрицательного гидростатического давления, подаваемого к пипетке через внешний порт держателя. После этого пипетку плавно отводили вертикально от БЛМ и вытягивали НТ, которая образовывалась в результате коллапса (резкого сужения) мембранного катеноида при его критическом удлинении [26, 31]. Момент формирования НТ регистрировали по резкому падению измеряемого ионного тока. Длину НТ контролировали с помощью прецизионного нанопозиционера (ESA-CSA, Newport, США) и контроллера к нему (Newport Motion Controller, Model 860-C2, Newport, США), который позволяет менять вертикальное смещение пипетки в диапазоне 30 мкм с точностью шага 10 нм. Показания контроллера нанопозиционера, усилителя и значение подаваемого напряжения оцифровывали и записывали на жесткий диск компьютера с помощью системы сбора данных (Digit Data 1550, Molecular Devices Inc., США). Данные собирали с частотой дискретизации (1/100 кГц) с использованием программного обеспечения pClamp 9.2 (Molecular Devices, США). Для защиты от вибрации и внешних радиационных электрических помех экспериментальная установка была размещена на антивибрационном столе и заключена в металлический ящик Фарадея. Все оборудование (корпус микроскопа, антивибрационный стол и изолированные части) было заземлено.
Радиус и длину просвета НТ находили из аппроксимации зависимости измеряемой проводимости G = I/U от величины вертикального смещения микропипетки гиперболической функций, как это подробно описано в [27]. Вкратце, радиус НТ находили, используя уравнение Ома для цилиндрического проводника $r = \sqrt {\frac{{{{G}_{{NТ}}}{{L}_{{NТ}}}}}{{\gamma \pi }}} $, где LNТ – длина НТ (фиксируется нанопозиционером), GNT – ионная проводимость просвета НТ, γ – удельная проводимость электролита, заполняющего внутренний просвет НТ, которая для электронейтральных мембран равна объемному значению [32].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
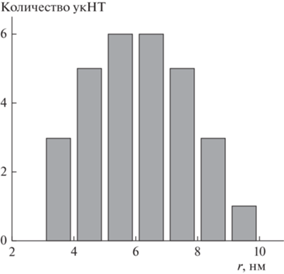
Общая характеристика эластичных нанопор. Согласно линейной теории упругости Хельфрика. значение радиуса НТ определяется исключительно механическими параметрами мембраны, а именно отношением модуля изгиба k к латеральному натяжению σ: $r = \sqrt {\frac{k}{{2\sigma }}} $. Модуль изгиба мембраны определяется ее липидным составом, и для используемой нами мембраны он составляет ~0.6 × 10–19 Дж [25], в то время как значение латерального натяжения может заметно меняться от мембраны к мембране. Поэтому радиус просвета НТ, вытянутых из разных БЛМ, был в диапазоне 3.5–9.0 нм (рис. 1) со средним значением r = 6.0 ± 1.6 нм. Было показано, что радиус НТ согласно линейной теории упругости не изменялся при укорочении НТ до 50 нм. При значениях длины 50–200 нм геометрические параметры просвета ультракоротких НТ (укНТ) становятся сравнимыми с размерами твердотельных нанопор, обычно используемых для детектирования одиночных молекул [3]. Стоит отметить, что минимальный диаметр твердотельных нанопор, поверхность которых удавалось покрыть липидным бислоем, составлял 17 нм [33]. Таким образом, мембранные укНТ представляют собой самые узкие наноканалы, чья внутренняя поверхность является двумерной жидкостью – липидным бислоем.
Рис. 1.
Гистограмма распределения значений радиусов просвета ультракоротких нанотрубок (укНТ), вытянутых из разных БЛМ с липидным составом ДОФХ : : ДОФЭ : Хол в мольном соотношении 6 : 3 : 1.
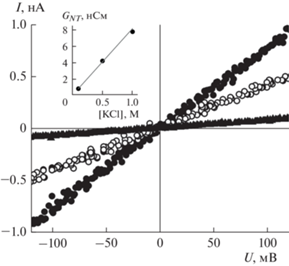
Исследование вольт-амперных характеристик укНТ при различных концентрациях электролита показало линейную зависимость тока от напряжения. Так, на рис. 2 изображены вольт-амперные зависимости, полученные при трех различных концентрациях электролита (0.1, 0.5 и 1 М KCl) для одной и той же укНТ с длиной 100 нм и радиусом просвета 5 нм. Приведенные на рис. 2 измерения демонстрируют, что для всех значений ионной силы в диапазоне от –100 до 100 мВ ток линейно зависит от напряжения, откуда следует, что изменение формы укНТ – расширение под действием электрокапиллярных сил [31] при указанных значениях напряжения не существенно. Важно, что проводимость просвета укНТ, GNT, вычисленная из наклона прямых I(U) пропорциональна концентрации электролита (рис. 2, вставка), следовательно, радиус укНТ, сформированной из незаряженных липидов, не меняется с увеличением или уменьшением концентрации ионов в омывающем ее растворе.
Рис. 2.
Вольт-амперная характеристика укНТ при различных концентрациях электролита: черные точки соответствуют концентрации электролита KCl 1 М, белые точки – 0.5 М, черные треугольники – 0.1 М. Радиус просвета укНТ 5 нм, длина 100 нм. На вставке – зависимость проводимости просвета укНТ от концентрации электролита, вычисленная из линейной аппроксимации вольт-амперных характеристик укНТ.
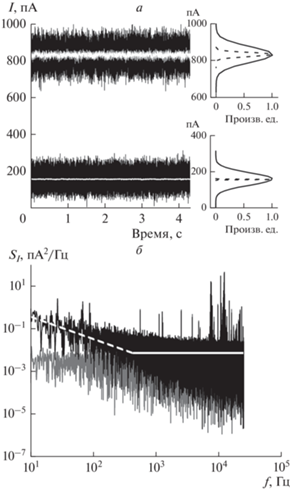
На рис. 3а изображены записи ионного тока для просвета укНТ c одинаковым радиусом, но разной длиной, которые существенно различаются по сопротивлению. Более низкое сопротивления соответствует укНТ длиной 70 нм. Увеличение длины укНТ в 4 раза ожидаемо в 4 раза увеличивает электрическое сопротивление ее просвета. Обе записи получены при приложенном напряжении 100 мВ и на частотах усилителя 100 и 1 кГц, как указано на рис. 3а. Отфильтрованные на 100 кГц сигналы ионного тока (черные кривые на рис. 3а) демонстрируют почти одинаковую амплитуду флуктуаций тока, что отражается в незначительном различии ширины их гистограмм (обозначенных сплошной линией на рис. 3а). Стандартное отклонение тока составляет 33 и 42 пА для укНТ длиной 300 и 70 нм соответственно. Однако разница в величине шума сигналов становится более очевидной при их фильтрации на частоте 1 кГц (белые кривые на рис. 3а). Из сравнения токов, измеренных при разных значениях сопротивления просвета укНТ, видно, что фильтрация на частоте 1 кГц на порядок эффективнее понижает флуктуации сигнала при более высоком сопротивлении. Действительно, после фильтрации стандартное отклонение тока на частоте 1 кГц уменьшается до 1 и 11 пА для укНТ длиной 300 и 70 нм соответственно. Можно заключить, что увеличение флуктуаций тока нанопоры с уменьшением длины канала обусловлены, в первую очередь, усилением низкочастотных шумов, что также видно из анализа спектральных мощностей тока SI, показанных на рис. 3б, где черная кривая соответствует более короткой укНТ.
Рис. 3.
а – Записи ионного тока просвета укНТ при приложенном напряжении 100 мВ при разных длинах: более низкое сопротивление соответствует НТ длиной 70 нм, более высокое сопротивление – 300 нм. Записи отфильтрованы по низким частотам на 100 кГц (черные кривые; сплошная линия в распределении справа) и 1 кГц (белым цветом, пунктирная линия в распределении). б – Спектральные мощности шума ионного тока укНТ разной длины: черным цветом обозначен спектр для НТ длиной 70 нм, серым цветом – 300 нм.
Стоит отметить, что, в отличие от твердотельных нанопор, в спектральную мощность ионного тока укНТ, измеряемого с помощью стандартно используемого в таких случаях пэтч-кламп-усилителя Axon 200B, на полосе пропускания сигнала 100 кГц вклад вносят только низкочастотный 1/f шум и белый шум, в то время как диэлектрический шум, спектральная мощность которого линейно растет с частотой пропорционально электрической емкости в цепи, не вносит заметного вклада в общий шум укНТ. Мы считаем, что это связано с тем, что емкость в электрической цепи (микропипетка + укНТ) на порядки ниже емкости нитридкремниевых (SiN) или оксид-кремниевых пленок, обычно используемых для травления в них нанопор [7, 34]. В итоге мощность шума ионного тока, текущего через просвет укНТ, на полосе пропускания сигнала 100 кГц соответствует самым лучшим показателям, которые удалось совсем недавно достичь в твердотельных нанопорах [14].
Анализ высокочастотных шумов ионного тока в укНТ. Как указано выше, основными источниками шума ионного тока укНТ на частотах ниже f < 300 Гц является, так называемый “розовый” 1/f шум (обозначен белой штриховой линией на рис. 3б), при частотах f > 1000 Гц превалирует белый шум. Измеряемая плотность спектральной мощности белого шума SI/I2 увеличивается по мере уменьшения проводимости укНТ как за счет удлинения или уменьшения радиуса ее просвета, так и при понижении концентрации электролита в растворе (рис. 4). Для НТ длиной около 100 нм в больших ионных силах шум в высокочастотном диапазоне приближается фундаментальному белому шуму, спектральная мощность которого определяется тепловым движением (тепловой шум) и флуктуацией количества носителей заряда (дробовой шум) в просвете укНТ. Согласно формулам Джонсона–Найквиста и Шоттки, тепловой шум ${{\left( {{{I}_{{rms{\text{,тепл}}}}}} \right)}^{2}} = 4{{k}_{B}}T{{G}_{{NT}}}\Delta f$, а дробовой ${{\left( {{{I}_{{rms{\text{,дроб}}}}}} \right)}^{2}} = 2qU{{G}_{{NT}}}\Delta f$. Так как источники шумов независимы, то их дисперсии аддитивны, следовательно, среднеквадратичная амплитуда флуктуаций ионного тока в высокочастотном диапазоне Irms может быть рассчитана как:
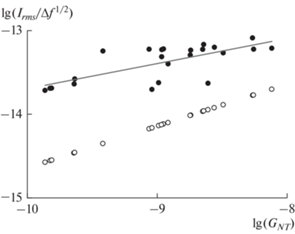
где q – элементарный заряд электрона, Δf – полоса пропускания высокочастотного фильтра. На рис. 5 в логарифмической шкале показана экспериментально измеренная зависимость среднеквадратичной амплитуды флуктуаций ионного тока в высокочастотном диапазоне f > 1 кГц от проводимости укНТ (закрашенные круги), которая рассчитывалась по формуле: ${{I}_{{rms}}} = \sqrt {\int_{1\,\,{\text{кГц}}}^{50\,\,{\text{кГц}}} {{{S}_{I}}df} } $, и зависимость Irms(GNT), предсказываемая уравнением (1), если бы единственным источником белого шума был адмиттанс укНТ (незакрашенные круги). Серая прямая на рис. 5, аппроксимирующая экспериментальные данные линейной функцией, указывает на сближение с теоретическими расчетами при увеличении проводимости укНТ. Очевидно, что при уменьшении проводимости укНТ помимо адмиттанса и теплового шума самой укНТ существенный вклад в высокочастотном диапазоне вносят адмиттанс и тепловой шум контура обратной связи, а также шум, генерируемый усилителем [28].Рис. 4.
Спектральная плотность мощности шума тока в НТ при разных концентрациях электролита: серым цветом обозначен спектр с концентрацией KCl 0.1 M, черным цветом – 1 M.
Рис. 5.
Зависимость отношения ${{I}_{{rms}}}{\text{/}}\Delta {{f}^{{1/2}}}$ белого шума от проводимости укНТ GNT, представленная в логарифмической шкале: черные точки – экспериментально измеренные величины, белые точки – теоретически предсказанные значения, серая прямая аппроксимация линейной функцией.
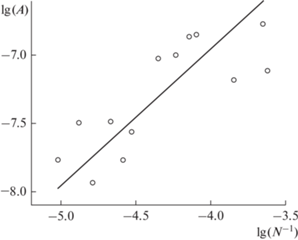
1/f шум укНТ. Согласно феноменологической модели Хуга, мощность шума в низкочастотном диапазоне (f < 300 Гц) определяется формулой
где A – амплитуда шума, I – среднее значение тока, а показатели степеней β и γ зависят от природы происхождения шумов и в электронных шумах обычно равны 1 и 2 соответственно. Из линейной аппроксимации зависимости плотности спектральной мощности шума SI/I2 от частоты в диапазоне 1–300 Гц (см. рис. 3б, белая штриховая линия) следует, что для укНТ значение β= 0.9 ± 0.1 близко к единице. Следовательно, 1/f шум ультракоротких НТ – равновесный процесс, в котором флуктуации тока вызваны флуктуациями электрического сопротивления просвета НТ. В таком случае амплитуда шума A связана с количеством носителей заряда N, $A = \frac{{{{\alpha }_{H}}}}{N}$, где αH – коэффициент Хуга, эмпирический параметр, который количественно определяет величину 1/f шума. Мы определили величину A из линейной аппроксимации SI/I2 от f. Амплитуда низкочастотного шума НТ могла меняться на два порядка по величине в зависимости от длины НТ и ионной силы раствора. Так как мы использовали электронейтральные липиды, то объемная концентрация ионов внутри укНТ не отличалась от концентрации c в окружающем растворе [35]. Поэтому количество ионов внутри НТ мы определяли из простого выражения$:~N = c\pi {{r}^{2}}{{L}_{{NT}}}$. Прямая на рис. 6 показывает наилучшее линейное приближение полученной зависимости A от N–1, из которого следует, что коэффициент Хуга ${{\alpha }_{Н}} = 2.5 \times {{10}^{{ - 3}}}$ для укНТ. Данное значение существенно больше того, что было измерено для нанопор, протравленных в SiN-пленках (αH = 10–4) [28], следовательно, измерения ионного тока в укНТ намного больше подвержены влиянию низкочастотных шумов, чем в твердотельных нанопорах. Это может быть связано с тем, что в каналах радиусом меньше 10 нм может стать существенным или даже доминирующим поверхностный 1/f шум, значение параметра Хуга для которого в некоторых случаях более чем на три порядка превышает объемное значение параметра Хуга [36]. Наблюдаемое в низкочастотном диапазоне усиление флуктуаций ионного тока в твердотельных нанопорах после их пассивации липидным бислоем [33] подтверждает предположение о том, что процессы, происходящие на поверхности ЛБ в укНТ, являются основным источником 1/f шума. Ответственными за высокий поверхностный 1/f шум могут быть флуктуации числа носителей заряда на границе раздела пор с электролитом, связанные с адсорбцией/десорбцией ионов на поверхности. Неоднородности на поверхности поры приводят к неоднородности констант реакции сорбции/десорбции и, следовательно, к генерации нескольких бистабильных шумов, имеющих разные Лоренцевские спектры, сумма которых приводит к возникновению характерного 1/f-спектра [37, 38]. В случае укНТ источником таких неоднородностей могут быть гидрофобные дефекты на поверхности мембраны [39–42]. Помимо поверхностных эффектов тепловые флуктуации формы эластичной укНТ также могут быть причиной увеличения в 1/f шума. Однако несмотря на то, что шумовые характеристики укНТ в низкочастотном диапазоне уступают нанопорам в SiN-пленках, обычно использующимся для детектирования и распознавания одиночных молекул, сенсор, сделанный на основе укНТ, будет обладать рядом уникальных преимуществ. Во-первых, это самый тонкий наноканал, поверхность которого представлена жидкокристаллическим липидным бислоем, соответственно, сохраняется возможность транспортировки вдоль его поверхности веществ, адсорбирующихся из объема [43]. Модификация липидного состава позволяет формировать укНТ с радиусом просвета, подстраиваемым под размер исследуемой молекулы белка за счет увеличения или уменьшения модуля изгиба мембраны [25, 44]. При уменьшении разницы в размерах просвета укНТ и молекулы аналита чувствительность измерения может значительно увеличиться за счет нелинейной зависимости амплитуды сигнала (падение тока) от величины зазора между молекулой и стенками канала. Во-вторых, мембрана укНТ обладает упругостью и, следовательно, может деформироваться при адсорбции на ее поверхность белков снаружи [27]. Существует целый класс белков, адсорбция которых на поверхности липидного бислоя индуцирует в нем спонтанную кривизну, и, если текущая геометрия мембраны не соответствует спонтанной, в липидном бислое возникает изгибный стресс. Адсорбция такого белка на поверхность укНТ приводит к ее локальной деформации – проминанию, что на языке измерения ионного тока, текущего через просвет укНТ, будет восприниматься как частичное перекрытие просвета нанопоры. Таким образом, укНТ может выступать универсальным строительным блоком для изготовления нанофлюидных устройств и нанопоровых сенсоров, которые помимо классической (внутри канала) обладают дополнительной измерительной модой.Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Wu Y., Gooding J.J. 2022. The application of single molecule nanopore sensing for quantitative analysis. Chem. Soc. Rev. 51, 3862–3885.
Varongchayakul N., Song J., Meller A., Grinstaff M.W. 2018. Single-molecule protein sensing in a nanopore: A tutorial. Chem. Soc. Rev. 47, 8512–8524.
Lee K., Park K.B., Kim H.J., Yu J.S., Chae H., Kim H.M., Kim K.B. 2018. Recent progress in solid-state nanopores. Adv. Mater. 30, 1–28.
Kasianowicz J.J., Brandin E., Branton D., Deamer D.W. 1996. Characterization of individual polynucleotide molecules using a membrane channel. Proc. Natl. Acad. Sci. USA. 93, 13770–13773.
Venkatesan B.M., Bashir R. 2011. Nanopore sensors for nucleic acid analysis. Nat. Nanotechnol. 6, 615–624.
Jain M., Olsen H.E., Paten B., Akeson M. 2016. The oxford nanopore MinION: Delivery of nanopore sequencing to the genomics community. Genome Biol. 17 (1), 239.
Ying C., Houghtaling J., Eggenberger O.M., Guha A., Nirmalraj P., Awasthi S., Tian J., Mayer M. 2018. Formation of single nanopores with diameters of 20–50 nm in silicon nitride membranes using laser-assisted controlled breakdown. ACS Nano. 12, 11458–11470.
Yusko E.C, Bruhn B.R., Eggenberger O.M., Houghtaling J., Rollings R.C., Walsh N.C., Nandivada S., Pindrus M., Hall A.R., Sept D., Li J., Kalonia D.S., Mayer M. 2017. Real-time shape approximation and fingerprinting of single proteins using a nanopore. Nat. Nanotechnol. 12, 360–367.
Houghtaling J., Ying C., Eggenberger O.M., Fennouri A., Nandivada S., Acharjee M., Li J., Hall A.R., Mayer M. 2019. Estimation of shape, volume, and dipole moment of individual proteins freely transiting a synthetic nanopore. ACS Nano. 13, 5231–5242.
Su S., Guo X., Fu Y., Xie Y., Wang X., Xue J. 2020. Origin of nonequilibrium 1/f noise in solid-state nanopores. Nanoscale. 12, 8975–8981.
Kumar A., Park K.B., Kim H.M., Kim K.B. 2013. Noise and its reduction in graphene based nanopore devices. Nanotechnology. 24 (49), 495503.
Bafna J.A., Soni G.V. 2016. Fabrication of low noise borosilicate glass nanopores for single molecule sensing. PLoS One. 11 (6), e0157399.
Wen C., Zeng S., Arstila K., Sajavaara T., Zhu Y., Zhang Z., Zhang S.L. 2017. Generalized noise study of solid-state nanopores at low frequencies. ACS sensors. 2, 300–307.
Uram J.D., Ke K., Mayer M.L. 2008. Noise and bandwidth of current recordings from submicrometer pores and nanopores. ACS Nano. 2, 857–872.
Liang S., Xiang F., Tang Z., Nouri R., He X., Dong M., Guan W. 2020. Noise in nanopore sensors: Sources, models, reduction, and benchmarking. Nami Jishu yu Jingmi Gongcheng/Nanotechnology Precis. Eng. 3, 9–17.
Fragasso A., Schmid S., Dekker C. 2020. Comparing current noise in biological and solid-state nanopores. ACS Nano. 14, 1338–1349.
Korman C.E., Megens M., Ajo-Franklin C.M., Horsley D.A. 2013. Nanopore-spanning lipid bilayers on silicon nitride membranes that seal and selectively transport ions. Langmuir. 29, 4421–4425.
Venkatesan B.M., Polans J., Comer J., Sridhar S., Wendell D., Aksimentiev A., Bashir R. 2011. Lipid bilayer coated Al2O3 nanopore sensors: Towards a hybrid biological solid-state nanopore. Biomed. Microdevices. 13, 671–682.
Marchand R., Thibault C., Carcenac F., Vieu C., Trévisiol E. 2017. Integration of solid-state nanopores into a functional device designed for electrical and optical cross-monitoring. Biomed. Microdevices. 19 (3), 60.
Dulka B.N., Bourdon A.K., Clinard C.T., Muvvala M.B.K., Campagna S.R., Cooper M.A. 2017. Metabolomics reveals distinct neurochemical profiles associated with stress resilience. Neurobiol. Stress. 7, 103–112.
Yusko E.C., Johnson J.M., Majd S., Prangkio P., Rollings R.C., Li J., Yang J., Mayer M. 2011. Controlling protein translocation through nanopores with bio-inspired fluid walls. Nat. Nanotechnol. 6, 253–260.
Zhong-Can O.Y., Helfrich W. 1989. Bending energy of vesicle membranes: General expressions for the first, second, and third variation of the shape energy and applications to spheres and cylinders. Phys. Rev. A, Gen. Phys. 39, 5280–5288.
Chia P.Z.C., Gleeson P.A. 2014. Membrane tethering. F1000Prime Rep. 6, 74.
Toh W.H., Gleeson P.A. 2016. Emerging insights into the roles of membrane tethers from analysis of whole organisms: The tip of an iceberg. Front. Cell Dev. Biol. 4, 12.
Bashkirov P.V., Kuzmin P.I., Lillo J.V., Frolov V.A. 2022. Molecular shape solution for mesoscopic remodeling of cellular membranes. Annu. Rev. Biophys. 51, 473–497.
Frolov V.A., Lizunov V.A., Dunina-Barkovskaya A.Y., Samsonov A.V., Zimmerberg J. 2003. Shape bistability of a membrane neck: A toggle switch to control vesicle content release. Proc. Natl. Acad. Sci. USA. 100, 8698–8703.
Bashkirov P.V., Kuzmin P.I., Chekashkina K., Arrasate P., Vera Lillo J., Shnyrova A.V., Frolov V.A. 2020. Reconstitution and real-time quantification of membrane remodeling by single proteins and protein complexes. Nat. Protoc. 15, 2443–2469.
Smeets R.M.M., Keyser U.F., Dekker N.H., Dekker C. 2008. Noise in solid-state nanopores. Proc. Natl. Acad. Sci. USA. 105, 417–421.
Mueller P., Rudin D.O. 1967. Action potential phenomena in experimental bi-molecular lipid membranes. Nature. 213, 603–604.
Bashkirov P.V., Chekashkina K.V., Shnyrova A.V., Frolov V.A. 2020. Electrophysiological methods for detection of membrane and hemifission by dynamin 1. Methods Mol. Biol. 2159, 141–162.
Ivchenkov D.V., Kuzmin P.I., Galimzyanov T.R., Shnyrova A.V., Bashkirov P.V., Frolov V.A. 2021. Nonlinear material and ionic transport through membrane nanotubes. Biochim. Biophys. Acta – Biomembr. 1863, 183677.
Евсеев А.И., Башкиров П.В. 2008. Деление мембранной нанотрубки, вызванное осмотическим давлением. Биол. мембраны. 25, 227–232.
Eggenberger O.M., Leriche G., Koyanagi T., Ying C., Houghtaling J., Schroeder T.B.H., Yang J., Li J., Hall A., Mayer M. 2019. Fluid surface coatings for solid-state nanopores: Comparison of phospholipid bilayers and archaea-inspired lipid monolayers. Nanotechnology. 30, 325504.
De Vreede L.J., Ying C., Houghtaling J., Figueiredo Da Silva J., Hall A.R., Lovera A., Mayer M. 2019. Wafer-scale fabrication of fused silica chips for low-noise recording of resistive pulses through nanopores. Nanotechnology. 30, 265301.
Vlassiouk I., Smirnov S., Siwyt Z. 2008. Ionic selectivity of single nanochannels. Nano Lett. 8, 1978–1985.
Vandamme L.K.J. 1989. Bulk and surface 1/f noise. IEEE Trans. Electron Devices. 36, 987–992.
Zhang D., Solomon P., Zhang S.L., Zhang Z. 2018. An impedance model for the low-frequency noise originating from the dynamic hydrogen ion reactivity at the solid/liquid interface. Sensors Actuators B Chem. 254, 363–369.
Kamada M., Laitinen A., Zeng W., Will M., Sarkar J., Tappura K., Seppä H., Hakonen P. 2021. Electrical low-frequency 1/f γ noise due to surface diffusion of scatterers on an ultra-low-noise graphene platform. Nano Lett. 21, 7637–7643.
Krylov N.A., Pentkovsky V.M., Efremov R.G. 2013. Nontrivial behavior of water in the vicinity and inside lipid bilayers as probed by molecular dynamics simulations. ACS Nano. 7, 9428–9442.
Vanni S., Hirose H., Barelli H., Antonny B., Gautier R. 2014. A sub-nanometre view of how membrane curvature and composition modulate lipid packing and protein recruitment. Nat. Commun. 5, 4916.
Campelo F., Kozlov M.M. 2014. Sensing membrane stresses by protein insertions. PLoS Comput. Biol. 10 (4), e1003556.
Tripathy M., Thangamani S., Srivastava A. 2020. Three-dimensional packing defects in lipid membrane as a function of membrane order. J. Chem. Theory Comput. 16, 7800–7816.
Чекашкина К.В., Галимзянов Т.Р., Кузьмин П.И., Акимов С.А., Романов С.А., Позмогова Г.Е., Клинов Д.В., Башкиров П.В. 2017. Регистрация молекул ДНК в каналах липидных нанотрубок в условиях малой ионной силы. Биол. мембраны. 34, 261–269.
Bashkirov P.V., Chekashkina K.V., Akimov S.A., Kuzmin P.I., Frolov V.A. 2011. Variation of lipid membrane composition caused by strong bending. Biochem. (Moscow) Suppl. Ser. A Membr. Cell Biol. 5, 205–211.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии