Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 5, стр. 337-344
Первые шаги в регистрации и интерпретации граничного потенциала липидных мембран
Ю. А. Ермаков *
Институт физической химии и электрохимии
им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: yury.a.ermakov@gmail.com
Поступила в редакцию 04.04.2022
После доработки 14.05.2022
Принята к публикации 17.05.2022
- EDN: TMAQYT
- DOI: 10.31857/S023347552205005X
Аннотация
Приведены основные этапы развития электрокинетических исследований в лаборатории биоэлектрохимии ИФХЭ РАН, руководимой чл.-корр. РАН Ю.А. Чизмаджевым. Дано краткое описание методики регистрации и анализа результатов измерения электрофоретической подвижности липосом с применением техники динамического светорассеяния. Показано преимущество использования электрокинетических данных в сочетании с измерением граничных потенциалов плоских бислойных липидных мембран с помощью метода компенсации внутримембранного поля. Описаны сведения, полученные в рамках такого подхода при изучении влияния некоторых мембраноактивных ионов и соединений на поверхностную и дипольную компоненты электрического поля на границах липидных мембран с водным окружением.
Биологическая тематика в институте электрохимии АН СССР появилась в 80-е годы прошлого века не случайно. Директор института академик АН СССР А.Н. Фрумкин уже в своих ранних работах проявлял интерес к распределению электрического поля на межфазных границах монослоев жирных кислот с водным раствором и к электрохимическим характеристикам более сложных биологических объектов [1, 2]. В последующие годы фосфолипидные монослойные и бислойные структуры оказались в центре внимания физической химии и активно использовались многими исследователями для построения и изучения липидных моделей клеточных мембран. Стала весьма актуальной разработка новых методов регистрации и количественной оценки их электрических характеристик. Поэтому инициатива группы теоретиков института образовать новую лабораторию под руководством Ю.А. Чизмаджева оказалась очень своевременной, а развитие ее экспериментальной базы было признано наиболее важной задачей. Активное участие Ю.А. Чизмаджева в формировании основных направлений исследований новой лаборатории привело к развитию своевременных представлений о характере и молекулярных механизмах образования электрического поля на межфазных границах липидных мембран.
Одна из очевидных задач биоэлектрохимии – оценить распределение заряда и потенциала на границах мембран. Эта задача предполагает наличие скачка потенциала (потенциал Гальвани) между точками, расположенными в двух фазах: внутри гидрофобной области мембраны и на удалении от ее поверхности в водном растворе электролита, где потенциал принимается обычно равным нулю (рис. 1). Очевидно, что непосредственное измерение абсолютной величины межфазного скачка потенциала принципиально невозможно, и внешними приборами можно зарегистрировать только его изменение в зависимости от условий опыта. В частности, при нанесении липидных монослоев на поверхность водного раствора регистрируется скачок потенциала (Вольта-потенциал), который составляет несколько сотен милливольт. Это электрическое поле существует и на каждой поверхности липидного бислоя в контакте с водным окружением. Наибольший интерес, с точки зрения физической химии и электрохимии, представляет выделение тех компонент этого поля, которые обусловлены особенностями молекулярной структуры межфазной границы, включая гидратацию полярных групп фосфолипидов и адсорбцию неорганических ионов.
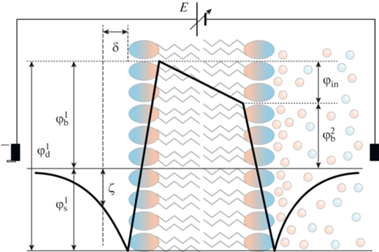
Рис. 1.
Распределение электрического поля в липидном бислое, в котором присутствуют отрицательно заряженные анионные фосфолипиды. На каждой границе БЛМ граничный потенциал, ϕb, содержит поверхностную, ϕs, и дипольную, ϕd, компоненты. В короткозамкнутой цепи различие граничных потенциалов ϕb создает внутримембранное поле ϕin, которое может быть скомпенсировано внешним источником Е. Величина ζ-потенциала меньше поверхностного ϕs из-за удаления плоскости скольжения от поверхности на расстояние δ.
На развитие экспериментальной техники, предназначенной для регистрации электростатических свойств липидных мембран, наибольшее влияние оказало наблюдение за изменением электрической емкости плоских бислойных мембран (БЛМ) при наложении внешнего электрического поля. Заметим, что первое сообщение об этом эффекте принадлежит российским ученым [3], которые привели результаты измерения емкости БЛМ и показали, что она принимает минимальное значение при отсутствии внешнего поля, и возрастает пропорционально квадрату его амплитуды. В дальнейшем были предложены несколько физических моделей, описывающих это явление, которое в конечном итоге было связано с электрострикцией липидного бислоя [4–7]. Теоретическая группа лаборатории биоэлектрохимии приняла самое активное участие в дискуссиях по поводу его физической природы и правомерности различных способов количественного описания. Эта дискуссия была особенно важной, поскольку на основе этого явления в лаборатории были предложены принципиально разные экспериментальные методики, позволяющие регистрировать изменение электрических характеристик БЛМ, вызванных проникновением ионов электролита в полярную область мембран и их влиянием на распределение электрического поля. В одном случае предлагалось накладывать на БЛМ линейно растущее электрическое напряжение и визуально контролировать положение минимума емкости мембраны [8], в другом варианте экспериментальной установки появление минимума фиксировалось по нулевой амплитуде второй гармоники емкостного тока [9]. Последний вариант оказался более удобным для объективного контроля разности граничных потенциалов плоских БЛМ в котором используется принцип компенсации внутримембранного поля (КВП) внешним источником напряжения. В частности, этот способ позволил непрерывно регистрировать кинетику изменений граничного потенциала с одной стороны мембраны при повышении концентрации мембраноактивных соединений. Эта возможность становится принципиально важной для оценки обратимости их адсорбции с помощью непрерывной перфузии ячейки [10], например при изучении адсорбции заряженных макромолекул [11] (рис. 2). Важно отметить, что оба метода позволяли оценить изменение разности граничных потенциалов на БЛМ в асимметричных условиях, когда на одной стороне мембраны варьировалась концентрация биологически значимых многовалентных ионов. Тем не менее оставался открытым вопрос, как сопоставить эти изменения с существующими представлениями о влиянии состава электролита на заряжение межфазной поверхности мембран и ожидаемыми эффектами, связанными с гидратацией липида и ориентацией дипольных моментов в полярной области. Для этого важно выделить их влияние на разные по физической природе составляющие граничного потенциала, ϕb, которые условно можно отнести к поверхностной, ϕs. и дипольной, ϕd, компонентам (рис. 1). Этот вопрос, безусловно, интересовал Ю.А. Чизмаджева и возглавляемую им группу теоретиков, хотя стало достаточно очевидным, что решение этой проблемы в значительной степени остается за экспериментом.
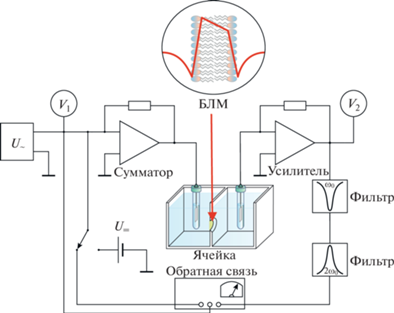
Рис. 2.
Примерная схема регистрации разности граничных потенциалов БЛМ методом компенсации внутримембранного поля от внешнего источника с применением отрицательной обратной связи для минимизации амплитуды второй гармоники переменного тока.
Одним из наиболее эффективных методов регистрации адсорбции ионов на заряженных поверхностях являются электрокинетические измерения в коллоидных суспензиях, в частности, липосом фосфолипидов. К моменту образования лаборатории основные экспериментальные данные об электрокинетической подвижности липосом в растворах разных электролитов и методика их анализа были уже опубликованы в серии работ С. Маклафлина (S. McLaughlin) [12–14]. Предстояло их осмыслить и сопоставить с результатами применения новых методов, разработанных сотрудниками лаборатории. И, конечно, было особенно важно самостоятельно формулировать условия измерений и получения результатов электрокинетическими методами. Эта задача казалась вполне реальной и даже очень перспективной, поскольку на одной из ежегодных научных выставок появилась первая информация о новом оборудовании английской компании Malvern Ins., основанном на новом принципе регистрации электрофоретической подвижности заряженных частиц в коллоидных суспензия с использованием регистрации динамических характеристик светорассеяния. Ю.А. Чизмаджев приложил незаурядные усилия, чтобы убедить Президиум АН СССР выделить значительные средства для вновь образованной лаборатории биоэлектрохимии для приобретения самой первой версии нового оборудования этой компании. Прибор (Zetasizer-2) был закуплен и до настоящего времени активно используется для решения многих экспериментальных задач. Как стало известно из личного контакта с инженерами этой компании, эта закупка оказала влияние и на ее дальнейшее развитие. К настоящему времени она стала одним из крупнейших производителей научного оборудования.
Физический принцип электрокинетических измерений достаточно прост и основан на регистрации автокорреляционных характеристик рассеяния света в коллоидной суспензии (рис. 3). Для этого используется коррелятор, который характеризует динамическую характеристику излучения в виде автокорреляционной функции, форма которой близка к экспоненциальной, когда единственной причиной флуктуаций интенсивности рассеянного света является случайное (броуновское) движение коллоидных частиц. Для регистрации направленного движения частиц в электрическом поле используется регистрация света, рассеянного в той точке в глубине ячейки, где пересекаются два лазерных пучка и образуется система интерференционных полос. Когда заряженные частицы перемещаются внешним полем поперек этих полос, появляются периодические флуктуации амплитуды рассеянного ими излучения с частотой, которая прямо связана со скоростью направленного перемещения частиц. Эти флуктуации меняют форму автокорреляционной функции, при численной обработке которой осуществляется Фурье-преобразование и определяется спектр подвижности коллоидных частиц в шкале частот, пропорциональной величине электрического ζ-потенциала частиц. Важно отметить, что в оптической схеме первоначальной версии прибора, созданного компанией Malvern, предусмотрено перемещение точки пересечения лучей лазера на некоторое расстояние от стенки ячейки в стационарную плоскость, где, согласно гидродинамическим условиям, жидкость остается неподвижной и, тем самым, устраняется эффект электродиффузии. К сожалению, в приборах нового поколения размеры ячейки не позволяют фиксировать это положение, что, в частности, затрудняет определение точки нулевого заряда частиц. В некоторых публикация этот фактор не учитывался и потому приводил к выводам, противоречащим классическим представлениям о влиянии ионного состава среды на распределение электрического поля вблизи заряженной поверхности [15].
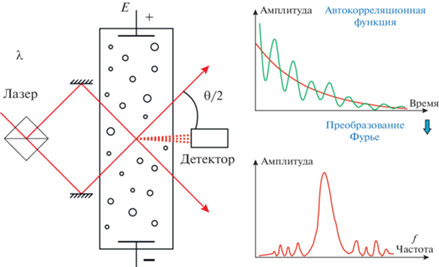
Рис. 3.
Условная схема регистрации электрокинетической подвижности коллоидных частиц (липосом) с применением техники анализа динамических характеристик рассеяния света. Слева – оптическая схема, справа – примерный вид автокорреляционной функции и результата ее Фурье-преобразования.
Описанный выше принцип в очень кратком виде был представлен в инструкции к прибору, где предлагался способ настройки и контроля оптической схемы измерения. Однако краткость изложения материала предполагала достаточно высокую квалификацию пользователя, и простого перевода инструкции, использованного группой И.Г. Абидора для первоначальной настройки прибора, было явно недостаточно. Более того, в некоторых случаях пояснения в инструкции оказались напрямую связанными с местными условиями в небольшом английском поселке Malvern. Например, предлагалось для настройки использовать некую пленку, доступную, как потом оказалось, его жителям. Неудивительно поэтому, что при настройке прибора возникли неожиданные трудности, а соответствующую пленку не удалось обнаружить даже в итоге специально организованной командировки Ю.А. Чизмаджева в Англию. Все эти трудности удалось преодолеть, когда для настройки прибора были использованы стандартные приемы юстировки оптического оборудования, и были выставлены все ключевые характеристики оптической схемы согласно физически ясным критериям, которые, конечно, не противоречили и первоначальной инструкции. Правильность юстировки подтвердил затем инженер компании Malvern, приглашенный в лабораторию из очередной международной выставки научного оборудования, который оставил также важные комментарии к использованному в нем программному обеспечению.
Следующая задача при освоении оборудования состояла в проверке результатов измерений и их сопоставлении с литературными данными. Наилучшим способом оказалось прямое воспроизведение условий измерений, подробно описанных в одной из фундаментальных публикаций с участием С. Маклафлина [13]. Эти измерения, проведенные на новом оборудовании, привели к результатам, весьма близким к литературным, хотя в их обработке был предложен несколько иной подход [16, 17]. При посещении лаборатории в 1989 году С. Маклафлин внимательно ознакомился с прибором и принципом измерений, который в значительной степени отличался от использованного им прямого микроскопического наблюдения липосом и регистрации их скорости в ручном режиме. Тот факт, что полученные на новом оборудовании экспериментальные данные с хорошей точностью совпали с его собственными, убедили и его, и нас в правомерности применения новых принципов измерений и способов их представления в виде оценки динамических характеристик упругого светорассеяния.
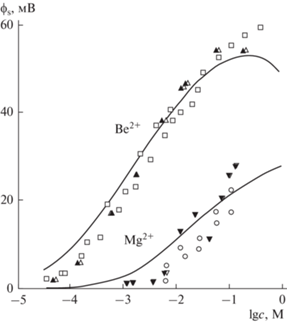
Важным шагом в развитии наших преставлений о межфазной границе липидных мембран стал анализ экспериментальных фактов, свидетельствующих о влиянии неорганических катионов на электрическую структуру этой границы. Это стало возможным при совместном использовании электрокинетических измерений и регистрации разности граничных потенциалов с обеих сторон плоских БЛМ (рис. 4). Разработанный в лаборатории метод КВП и методика анализа результатов с учетом электрокинетических измерений достаточно подробно описаны в обзоре [18]. Один из первых результатов с применением такого подхода был получен при измерении адсорбции популярного в то время потенциал чувствительного флуоресцентного зонда 1-анилин-8-нафталенсульфоната (АНС) как на плоских БЛМ методом КВП, так и липосомах, электрокинетическая подвижность которых была измерена классическим микроскопическим методом на оборудовании Parmoquant-2 (Carl Zeiss, Jena) [19]. Полученные данные в явном виде обнаружили заметное различие между влиянием ионной силы раствора на граничный потенциал БЛМ и ζ-потенциал липосом в присутствии АНС, оценка которого проводилась в рамках модели Гуи–Чепмена. Для описания указанного различия была предложена простая модель, учитывающая небольшое погружение зонда в полярную область мембраны. Теоретически эта модель представлялась достаточно спорной, поскольку в ней никак не учитывались казавшиеся очевидными особенности строения межфазной границы, например, изменение диэлектрической проницаемости в ее окрестности и дискретное распределение заряда вдоль поверхности. Ю.А. Чизмаджев предложил теоретикам лаборатории доработать модель, включая условие дискретного распределения молекул АНС на поверхности. Стало очевидным, что это условие вносит дополнительные параметры в модель, которые лишь немного улучшают описание экспериментальных данных [20]. Однако наибольшие возражения у теоретиков вызывал тот параметр модели Гуи–Чепмена, который характеризует гидродинамическое условие подвижности заряженных частиц. Согласно многим экспериментальным данным, в рамках этой модели удаление плоскости скольжения от поверхности оказывается практически одинаковым при адсорбции на поверхности мембран самых различных ионов и молекул и описывается параметром δ, величина которого (0.2 нм) близка к размерам молекул воды. В частности, нами были проведены измерения граничного потенциала БЛМ и электрофоретической подвижности липосом из фосфатидилхолина в присутствии бериллия, наименьшего из двухвалентных катионов, а также некоторых биологически значимых двухвалентных катионов [21] (рис. 4, 5). Как оказалось, изменение граничного потенциала в этих случаях происходит только благодаря изменению поверхностной плотности заряда и потенциала ϕs, которое отражается непосредственно на электрокинетических измерениях. При этом мы получили прекрасное совпадение данных двух методов именно при том значении δ = 0.2 нм, которое ранее было использовано в классических работах С. Маклафлина. Им же была проведена оценка нескольких факторов, которые могли бы повлиять на оценку поверхностного потенциала в рамках нескольких альтернативных физических моделей [22–24]. Конечно, любая модификация модели Гуи–Чепмена приводит к увеличению количества параметров системы и при этом лишь незначительно улучшает описание электрокинетических данных. Поскольку их точность всегда ограничена, для количественного анализа данных вполне достаточно эмпирических параметров, используемых в классической модели Гуи–Чепмена. Область применимости этой модели для анализа адсорбции на мембранах разных биологически значимых объектов подробно исследована нами в обзоре [25].
Рис. 4.
Значения поверхностного потенциала, рассчитанные по результатам измерений ζ-потенциала с учетом положения плоскости скольжения на расстоянии 0.2 нм от поверхности для липосом из PS в растворах NiSO4 (темные точки) и MgCl2 (крестики) Изменение граничного потенциала, измеренное на плоских БЛМ в тех же растворах, представлено светлыми точками, смещенными на величину поверхностного потенциала (–85 мВ), найденного по измерению ζ-потенциала липосом в фоновом электролите (0.1 М KCl, 20 мМ имидазол, рН 6.4). Теоретические кривые построены с константами связывания, равными 10 и 5 М–1 для ионов никеля и магния соответственно, с учетом конкурентной адсорбции ионов калия с константой 0.2 М–1 [21]
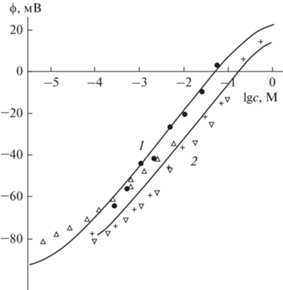
Рис. 5.
Изменения поверхностного потенциала плоских БЛМ (темные треугольники) и липосом из фосфатидилхолина в присутствии фонового электролита (0.1 М KCl, 20 мМ имидазола, рН 6.4), построенные с учетом измеренных значений ζ-потенциала в плоскости скольжения на расстоянии 0.2 нм. Теоретические кривые построены в рамках модели Гуи–Чепмена, дополненной изотермой Ленгмюра с константами связывания 400 и 5 М–1 для катионов Be2+ и Mg2+ соответственно [21].
Завершая этот краткий обзор первых шагов в изучении электрической структуры межфазных границ, необходимо отметить значительные усилия Ю.А. Чизмаджева в организации экспериментальных и теоретических исследований в этой области физической химии, которая получила название биоэлектрохимии. Конечно, эмпирические методы анализа электростатических явлений на границах мембран всегда вызывали критику Ю.А. Чизмаджева и его теоретической группы. Более приемлемыми для развития новых теоретических подходов оказались такие явления, как электропорация мембран, влияние физических факторов на их проницаемость, в том числе при наличии белков, обеспечивающих трансмембранный перенос веществ. Эти направления исследований представлялись более привлекательными для оценки роли мембран в биохимии клеток и для разработки новых биомедицинских приложений. Тем не менее развитый в лаборатории подход к изучению электрической структуры межфазной границы оказался достаточно продуктивным и привел к заметным успехам в последующие годы.
Сравнительно недавно стало понятным участие неорганических ионов в организации распределении электрического поля в полярной области мембран и важная роль молекул воды, формирующих систему водородных связей [26, 27]. Более того, удалось доказать влияние некоторых мембраноактивных катионов (Gd3+ и Be2+) не только на величину поверхностного заряда и потенциала мембран, но и на структуру самой границы. Наиболее ярко это проявилось в значительном, до 140 мВ, изменении дипольной компоненты граничного потенциала мембран, в составе которых присутствуют молекулы фосфатидилсерина (PS). Ее величина была рассчитана как разность изменений граничного потенциала плоских БЛМ и поверхностного потенциала липосом, найденного в рамках модифицированной нами модели Гуи–Чепмена по результатам электрокинетических измерений [28]. Эти наблюдения в дальнейшем были подтверждены измерением Вольта-потенциала липидных монослоев и было доказано, что адсорбция обоих катионов вызывает фазовый переход в мембране, который сопровождается конденсацией молекул PS. Удалось экспериментально показать, что это явление приводит к “замораживанию” мембранных белков и блокированию механочувствительных каналов Escherichia coli [29], а также к нарушению первых стадий апоптоза в результате маскировки молекул PS на поверхности клеток и, следовательно, к серьезному заболеванию бериллиозу [30]. Недавно с применением метода малоуглового рассеяния рентгеновского излучения на липидных монослоях димиристоил-производных фосфатидилсерина удалось получить важные сведения о структурном различии жидкокристаллического и конденсированного состояния монослоя, которое проявляется в значительном увеличении дипольной компоненты граничного потенциала. Анализ структуры монослоя методами молекулярной динамики позволил установить конкретные изменения в гидратационной оболочке фосфолипида, которые ответственны за изменение граничного потенциала и его дипольной компоненты [31]. Тем самым удалось завершить многолетние исследования в этом направлении и получить ответы на вопросы, возникшие уже на первых шагах применения биоэлектрохимических методов, разработанных в нашей лаборатории. Высокая информативность этих методов широко используется в настоящее время при изучении адсорбции на липидных мембранах заряженных полимеров и полипептидов [32]. Для количественного анализа экспериментальных данных разрабатываются новые теоретические модели сотрудниками теоретической группы, созданной и выпестованной Ю.А. Чизмаджевым.
Конфликт интересов. Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа поддержана темой АААА-А20-120101090002-4, запланированной в ИФХЭ РАН Министерством науки и образования России.
Соответствие принципам этики. Статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Фрумкин А.Н. 1925. К вопросу о строении поверхностного слоя. Часть 4. Электрические свойства мономолекулярных слоев. В кн.: Сбоpник pабот по чистой и пpикладной химии. Ред. Бах А.Н. Петpогpад: Химический ин-т им. Л.Я. Карпова, с. 75–87.
Фрумкин А.Н. 1925. К вопросу о строении поверхностного слоя. Часть 5. Об одном способе проверки уравнения Гиббса. В кн.: Сбоpник pабот по чистой и пpикладной химии. Ред. Бах А.Н. Петpогpад: Химический ин-т им. Л.Я. Карпова, с. 88–89.
Babakov A.V., Ermishkin L.N., Liberman E.A. 1966. Influence of electric field on the capacilty of phospholipid membranes. Nature. 210, 953–955.
Alvarez O., Latorre R. 1978. Voltage-dependent capacitance in lipid bilayers made from monolayers. Biophys. J. 21 (1), 1–17.
Берестовский Г.Н. 1981. Электрострикция плоских липидных мембран и модули упругости. Биофизика. 26, 474–480.
Пасечник В.И. 1981. Электрострикционные измерения вязкоупругих свойств бислойных липидных мембран. В кн.: Биофизика мембран. М.: ВИНИТИ, с. 267–305.
Лейкин С.Л. 1985. Тепловые колебания и емкость бислойных липидных мембран в электрическом поле. Биол. мембраны. 2, 222–233.
Абидор И.Г., Айтьян С.Х., Черномордик Л.В., Черный В.В., Чизмаджев Ю.А. 1979. Измерение внутримембранного скачка потенциала потенциодинамическим методом. ДАН СССР. 245, 977–981.
Соколов В.С., Кузьмин С.Г. 1980. Измерение разности поверхностных потенциалов бислойных липидных мембран по второй гармонике емкостного тока. Биофизика. 25, 170–172.
Ермаков Ю.А., Юсипович А.И. 2002. Граничный потенциал и натяжение плоских БЛМ в присутствии гадолиния. Регистрация в условиях непрерывной перфузии ячейки. Биол. мембраны. 19 (6), 541–548.
Marukovich N., McMurray M., Finogenova O., Nesterenko A., Batishchev O., Ermakov Yu. 2013. Interaction of polylysines with the surface of lipid membranes: The electrostatic and structural aspects. In: Advances in planar lipid bilayers and liposomes. Ed. Iglic A., Genova J. Amsterdam, London, San Diego: Elsevier, p. 139–166.
McLaughlin S. 1977. Electrostatic potentials at membrane-solution interfaces. In: Current topics membranes and transport. Ed. Bronnen F., Kleinzeller A. Cambridge: Acad. Press, p. 71–144.
Eisenberg M., Gresalfi T., Riccio T., McLaughlin S. 1979. Adsorption of monovalent cations to bilayer membranes containing negative phospholipids. Biochemistry. 18 (23), 5213–5223.
McLaughlin S., Mulrine N., Gresalfi T., Vaio G., McLaughlin A. 1981. Adsorption of divalent cations to bilayer membranes containing phosphatidylserine. J. Gen. Physiol. 77, 445–473.
Maity P., Saha B., Kumar G.S., Karmakar E. 2016. Binding of monovalent alkali metal ions with negatively charged phospholipid membranes. Biochem. Biophys. Acta. 1858, 706–714.
Ermakov Y.A. 1990. The determination of binding site density and association constants for monovalent cation adsorption onto liposomes made from mixtures of zwitterionic and charged lipids. Biochim. Biophys. Acta. 1023 (1), 91–97.
Ермаков Ю.А. 1990. Определение констант адсорбции и плотности центров связывания одновалентныs катионов на поверхности липосом. Электрохимия. 26 (2), 212–221.
Ermakov Yu.A., Sokolov V.S. 2003. Boundary potentials of bilayer lipid membranes: Methods and interpretations. In: Planar lipid bilayers (BLMs) and their applications. Ed. Tien H.T., Ottova A. Amsterdam: Elsevier, p. 109–141.
Ермаков Ю.А., Черный В.В., Соколов В.С., Татулян С.А. 1983. Граничные потенциалы на липидных мембранах в присутствии ионов 1-анилино-8-нафталенсульфоната. Биофизика. 28 (6), 1010–1013.
Козлов М.М., Черный В.В., Соколов В.С., Ермаков Ю.А., Маркин В.С. 1983. Теория адсорбции гидрофобных ионов в БЛМ с учетом их латерального взаимодействия и дискретности зарядов. Биофизика. 28 (1), 61–66.
Ермаков Ю.А., Черный В.В., Соколов В.С. 1992. Адсорбция бериллия на нейтральных и заряженных липидных мембранах. Биол. мембраны. 9, 201–213.
Cafiso D., McLaughlin A., McLaughlin S., Winiski A. 1989. Measuring electrostatic potentials adjacent to membranes. Methods Enzymol. 171, 342–364.
Kim J., Mosior M., Chung L.A., Wu H., McLaughlin S. 1991. Binding of peptides with basic residues to membranes containing acidic phospholipids. Biophys. J. 60 (1), 135–148.
McLaughlin S. 1989. The electrostatic properties of membranes. Annu. Rev. Biophys. Biophys. Chem. 18, 113–136.
Ермаков Ю.А. 2000. Равновесие ионов вблизи липидных мембран – эмпирический анализ простейшей модели. Коллоид. журн. 6 (4), 437–449.
Марукович Н.И., Нестеренко А.М., Ермаков Ю.А. 2014. Структурные факторы во взаимодействии лизина и полилизинов с липидными мембранами. Биол. мембраны. 31 (6), 401–409.
Нестеренко А.М., Ермаков Ю.А. 2012. Молекулярная динамика фосфолипидных мембран: распределение ионов вблизи границы нейтрального и заряженного жидкокристаллического бислоя. Биол. мембраны. 29 (5), 374–384.
Ermakov Y.A., Makhmudova S.S., Averbakh A.Z. 1998. Two components of boundary potentials at the lipid membrane surface: Electrokinetic and complementary methods studies. Colloids and Surfaces A–Physicochemical and Engineering Aspects. 140 (1–3), 13–22.
Ermakov Y.A., Kamaraju K., Sengupta K., Sukharev S. 2010. Gadolinium ions block mechanosensitive channels by altering the packing and lateral pressure of anionic lipids. Biophys. J. 98 (6), 1018–1027.
Ermakov Yu., Kamaraju K., Dunina-Barkovskaya A., Vishnyakova K., Egorov Y., Anishkin A., Sukharev S. 2017. High-affinity interactions of beryllium (2+) with phosphatidylserine result in a cross-linking effect reducing surface recognition of the lipid. Biochemistry. 56, 5457–5470.
Ermakov Yu.A., Asadchikov V.E., Roshchin B.S., Volkov Yu.O., Khomich D.A., Nesterenko A.M., Ti-khonov A.M. 2019. Comprehensive study of the LE-LC phase transition in DMPS monolayers: Surface pressure, Volta potential, X-ray reflectivity and MD modeling. Langmuir. 35, 12326–12338.
Molotkovsky R.J., Galimzyanov T.R., Ermakov Yu.A. 2021. Heterogeneity in lateral distribution of polycations at the surface of lipid membrane: From the experimental data to the theoretical model. MDPI, Materials. 14, 6623.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


