Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 5, стр. 373-383
Формирование пор амфипатическими пептидами в замкнутых мембранах
О. В. Кондрашов a, П. И. Кузьмин a, С. А. Акимов a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: akimov_sergey@mail.ru
Поступила в редакцию 08.04.2022
После доработки 23.05.2022
Принята к публикации 24.05.2022
- EDN: HBAPMW
- DOI: 10.31857/S0233475522050073
Аннотация
Многие амфипатические антимикробные пептиды (АМП) убивают бактерии за счет формирования сквозных пор в плазматических мембранах. Ранее высказывались по крайней мере два альтернативных типа гипотез о механизмах порации мембран АМП. Так называемые нелокальные модели предполагают, что АМП при взаимодействии с мембраной модифицируют ее интегральные упругие характеристики, в частности латеральное натяжение, что приводит к уменьшению энергии деформаций в процессе образования чисто липидной поры. Молекулы АМП при этом могут находиться вдали от образующейся поры. В локальных моделях предполагается, что поры формируются в непосредственной близости от одиночных молекул АМП или их агрегатов; при этом пептиды частично или полностью выстилают кромку поры. В обоих типах моделей предполагается, что процесс образования поры проходит через промежуточную структуру, так называемый гидрофобный дефект. В настоящей работе мы рассчитали энергию образования гидрофобного дефекта в мембране с адсорбированными молекулами АМП в предположении о нелокальном механизме порации. Было показано, что АМП действительно понижают энергию гидрофобного дефекта. Однако это понижение энергии оказывается недостаточным, чтобы объяснить наблюдаемое экспериментально среднее время ожидания порации мембран. Таким образом, можно заключить, что амфипатические пептиды образуют поры в мембранах преимущественно по локальному механизму, непосредственно участвуя в формировании кромки поры, хотя нелокальные эффекты взаимодействия АМП с мембраной несколько облегчают порацию мембраны в целом.
ВВЕДЕНИЕ
Амфипатические пептиды рассматриваются в качестве перспективных антимикробных препаратов с чрезвычайно низкой прогнозируемой вероятностью возникновения резистентности. Некоторые виды антимикробных пептидов (АМП) убивают бактерии путем формирования в их мембранах сквозных пор [1–3]. К ним, в частности, относятся многие природные пептиды: мелиттин из пчелиного яда [1, 4], магаинин из яда африканских лягушек Xenopus laevis [2, 5], кроталицидин из яда гремучей змеи [1]. Большой положительный электрический заряд молекул таких пептидов (например, +4 у мелиттина, +5 у магаинина, +16 у кроталицидина) обуславливает их избирательное связывание с отрицательно заряженными бактериальными мембранами [1–5]. При связывании с мембраной данные пептиды переходят в α-спиральную конформацию, причем одна боковая сторона спирали гидрофильна, а противоположная ей – гидрофобна. Молекула пептида встраивается в липидный монослой на небольшую глубину [6–8], при этом “раздвигая” в стороны полярные головки липидов, что приводит к деформации мембраны [9–11]. Было установлено, что интенсивное формирование пор в мембранах происходит при превышении некоторой пороговой поверхностной концентрации пептидов, причем пороговая поверхностная концентрация на мембране слабо зависит от деталей химической структуры пептидов и составляет приблизительно 1/25–1/100 мольных долей (пептид/липид) [1, 3, 12–14].
В большом количестве работ исследование порообразующей активности АМП проводится на модельных мембранах, в частности на больших или гигантских однослойных везикулах. Мембрана каждой однослойной визикулы представляет из себя липидный бислой. В суспензии больших однослойных везикул (БОВ) формирование пор регистрируется по утечке водорастворимого флуоресцентного красителя, предварительно загруженного внутрь БОВ, либо по тушению красителя внутри БОВ водорастворимым тушителем, добавленным снаружи. Измеряется зависимость интегральной флуоресценции от времени при различных объемных концентрациях антимикробного пептида [1]. В экспериментах, проводимых на гигантских однослойных везикулах (ГОВ), регистрируются не интегральные характеристики ансамбля, а изменение свойств одиночных ГОВ. В частности, регистрируется изменение флуоресценции внутреннего пространства ГОВ при воздействии АМП на мембрану [5]. Кроме того, в экспериментах по всасыванию мембраны ГОВ в микропипетку под действием небольшого отрицательного гидростатического давления [15, 16] возможно зарегистрировать увеличение площади мембраны ГОВ вследствие адсорбции АМП, а также момент необратимого разрушения мембраны по полному втягиванию всей ГОВ в микропипетку [2, 3]. Большие и гигантские однослойные везикулы являются замкнутыми мембранами без резервуара, т.е. мембрана каждой везикулы состоит из определенного числа липидных молекул, не изменяющегося в процессе эксперимента. Плазматические мембраны бактерий, по-видимому, с достаточной точностью также могут считаться системами с постоянным числом частиц, и поэтому БОВ и ГОВ являются более адекватными моделями бактериальных мембран при исследованиях антимикробной активности АМП, чем, например, связанные с липидным резервуаром плоские мембраны, формируемые методами Мюллера–Рудина [17], Монтала [18] или их модификациями [19]. Кроме того, плоские липидные бислои, как правило, находятся под значительным латеральным натяжением [20, 21], которое может влиять на процесс образования сквозных пор под действием АМП. В частности, было установлено, что приложенное латеральное натяжение активизирует индуцируемую магаинином порацию мембран ГОВ [22].
Молекулярные механизмы формирования пор в мембранах под действием АМП в настоящее время остаются невыясненными. В ряде работ показано, что частично встроенные пептиды могут находиться на поверхности мембраны, так что их продольные оси практически параллельны плоскости мембраны (S-конфигурация), либо пронизывать мембрану насквозь (I-конфигурация); в этом случае между осью α-спирали пептида и плоскостью мембраны имеется значительный угол [7, 12]. Однако переход между S- и I-конфигурациями и его промежуточные состояния в настоящее время детально не изучены. Относительно механизмов образования пор под действием АМП высказывались различные гипотезы, которые условно можно разделить на “локальные” и “нелокальные”. Локальные гипотезы подразумевают сильное латеральное взаимодействие пептидов, вследствие которого несколько пептидных молекул, собравшись вместе на небольшом участке мембраны, образуют сквозную пору [23], частично или полностью выстилая ее кромку [10, 24, 25]. Нелокальное действие АМП подразумевает модификацию средних упругих параметров мембраны (модуля изгиба, спонтанной кривизны липидных монослоев, латерального натяжения) таким образом, что энергия деформаций мембраны в процессе формирования сквозной поры значительно снижается. При этом пептидные молекулы могут находиться вдали от образующейся поры и влияют на ее образование опосредованно через изменение интегральных характеристик мембраны [6, 26].
Гипотеза о нелокальном действии АМП наглядно иллюстрируется на примере порации замкнутых мембран БОВ или ГОВ. При добавлении раствора АМП к суспензии БОВ или снаружи от одиночной ГОВ амфипатические молекулы АМП частично встраиваются лишь в наружные монослои везикул. Встраивание твердых пептидных молекул должно приводить к увеличению площади наружных монослоев мембран. Однако между наружным и внутренним монослоем не образуются полости, поэтому увеличение площади наружного монослоя мембраны ГОВ должно сопровождаться увеличением площади также и внутреннего монослоя, т.е. его латеральным растяжением. Величина относительного растяжения внутреннего монослоя может быть несколько уменьшена за счет латерального сжатия липида наружного монослоя. Таким образом, при встраивании АМП, в наружных монослоях мембран БОВ или ГОВ должно возникать латеральное давление, а во внутренних – латеральное натяжение. Латеральное давление и натяжение – интегральные свойства липидных монослоев, одинаковые по всему монослою и не зависящие от расстояния до ближайших встроенных молекул АМП. Используя закон Гука, нетрудно показать, что при встраивании в наружный монослой везикулы пептидов суммарной площадью Sp в равновесии наружный липидный монослой будет сжат на величину Sp/2, а внутренний липидный монослой растянут на ту же величину; увеличение площади мембраны везикулы составит Sp/2. В ряде работ латеральное натяжение внутренних монослоев мембран БОВ или ГОВ рассматривалось в качестве основной причины образования пор и считалось главным механизмом порообразующей активности АМП [6, 26, 27], однако количественный анализ энергетики формирования сквозной поры в таких условиях, насколько нам известно, не проводился.
По-видимому, первая модель формирования пор в тонкой бесструктурной пленке, к которой приложено латеральное натяжение σ, была разработана Дерягиным и Гутопом [28]. В этой модели предполагалось, что энергия поры в пленке зависит от избыточной энергии материала пленки на кромке поры по сравнению с его энергией вдали от поры и от работы латерального натяжения в процессе образования поры. Первый вклад пропорционален периметру поры (2πR для круглой поры радиуса R), а второй – ее площади (πR2): E = 2πRγ – πR2σ, где γ – так называемое линейное натяжение кромки поры. Первое слагаемое является изменением внутренней энергии системы при образовании поры, а второе слагаемое описывает (отрицательную) работу внешних сил в этом процессе. Энергия имеет максимум при критическом радиусе поры R* = γ/σ. Поры, радиус которых меньше критического, самопроизвольно закрываются (dE/dR > 0 при R < R*); поры закритического радиуса неограниченно растут (dE/dR < 0 при R > R*), что приводит к необратимому разрушению пленки. Модель Дерягина–Гутопа описывает образование пор в липидных мембранах лишь приблизительно, качественно, поскольку при типичных величинах критических радиусов пор (порядка единиц нанометров) мембрану нельзя считать ни бесконечно тонкой, ни бесструктурной пленкой. Наличие внутренней структуры мембран приводит к тому, что формально пора нулевого радиуса просвета не является интактным плоским липидным бислоем. Действительно, в плоском горизонтальном бислое продольные оси всех липидных молекул в среднем ориентированы вертикально, т.е. перпендикулярно плоскости бислоя. В поре даже нулевого радиуса часть липидных молекул на кромке ориентирована горизонтально, т.е. лежит в плоскости межмонослойной поверхности (рис. 1). Таким образом, для построения детальной модели формирования поры в плоском липидном бислое необходимо введение некоторого промежуточного состояния между бислоем и порой, в котором ориентация липидных молекул, составляющих кромку, будет непрерывно изменяться от вертикальной (плоский бислой) до горизонтальной (сквозная пора). Уже в самых ранних работах по электрическому пробою липидных мембран, выполненных сотрудниками лаборатории биоэлектрохимии ИЭЛАН под руководством Ю.А. Чизмаджева [29, 30], в качестве такого промежуточного состояния был предложен так называемый гидрофобный дефект. Гидрофобный дефект образуется при радиальном смещении липидных молекул от некоторой оси, перпендикулярной плоскости бислоя, приводящем к формированию заполненного водой цилиндра, пронизывающего мембрану насквозь, боковые стенки которого выстланы гидрофобными цепями липидных молекул. На границе гидрофобного дефекта мембрана деформируется таким образом, что ориентация липидных молекул непрерывно изменяется от вертикальной при малых радиусах дефекта до горизонтальной при увеличении радиуса дефекта (рис. 1) [31, 32]. В той же серии работ [29–32] было показано, что энергия гидрофильной поры, кромка которой полностью выстлана полярными головками липидов, должна иметь локальный минимум при некотором радиусе Rm, при котором оптимально взаимно компенсируются положительная меридиональная и отрицательная экваториальная кривизны поверхности кромки поры (рис. 1). Таким образом, линейное натяжение кромки поры должно зависеть от ее радиуса, и оно заведомо не является постоянным, как считалось в модели Дерягина–Гутопа. Величина линейного натяжения кромки поры в большой степени определяется энергией деформаций мембраны на кромке, которая, в свою очередь, возрастает при приложении к мембране латерального натяжения [32]. Таким образом, линейное натяжение кромки сквозной поры в липидной мембране зависит как от радиуса поры, так и от латерального натяжения мембраны. Гидрофильная пора оптимального радиуса Rm метастабильна: для уменьшения радиуса и закрытия поры через промежуточное состояние гидрофобного дефекта необходимо преодолеть некоторый энергетический барьер, причем вблизи вершины барьера происходит наиболее резкое изменение ориентации липидных молекул [31, 32]. Вершине барьера соответствует радиус гидрофобного дефекта R0 ≈ 0.7 нм (рис. 1), причем R0 практически не зависит от липидного состава мембраны (показано в работах [31–33] для диолеоилфосфатидилхолина (ДОФХ), пальмитоилолеоилфосфатидилхолина, стеароилолеоилфосфатидилхолина, димиристоилфосфатидилхолина) и приложенного трансмембранного электрического потенциала [32] и слабо зависит от латерального натяжения мембраны: при увеличении σ от 0 до 4 мН/м R0 возрастает лишь приблизительно на 0.2 нм [32].
Рис. 1.
Качественные зависимости энергии гидрофильной поры (синяя кривая) и гидрофобного дефекта (оранжевая кривая) от радиуса. Кривые пересекаются при радиусе R0, соответствующем вершине энергетического барьера перехода гидрофобного дефекта в гидрофильную пору. Энергия поры имеет локальный минимум при R = Rm. При превышении критического радиуса поры R* происходит необратимый разрыв мембраны.
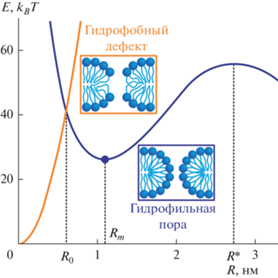
Для анализа механизма формирования сквозной поры в мембране БОВ или ГОВ, в наружном монослое которой имеется латеральное давление, а во внутреннем – латеральное натяжение, необходимо построить непрерывную траекторию процесса от интактного бислоя до гидрофильной поры и рассчитать энергию промежуточных состояний вдоль этой траектории. Однако, как только образуется гидрофильная пора, поверхность липидного монослоя становится непрерывной, т.е. на экваторе поры смыкаются поверхности наружного и внутреннего монослоев мембраны. При этом из-за разности латеральных натяжений должен начаться поток липида через пору из наружного монослоя во внутренний, который остановится лишь при выравнивании латеральных натяжений в этих монослоях. Таким образом, в мембране с асимметричным распределением латерального натяжения по монослоям гидрофильная пора является существенно неравновесной структурой, которая не описывается методами равновесной термодинамики. В таких мембранах имеет смысл рассматривать лишь гидрофобный дефект в диапазоне радиусов от 0 до R0 ≈ 0.7 нм, пока не происходит непрерывного объединения поверхностей наружного и внутреннего монослоев мембраны БОВ или ГОВ.
Количественные данные по адсорбции и порации мембран одиночных ГОВ были получены в работах [2, 3] для магаинина и амфипатического пептида PGLa из яда африканской лягушки Xenopus laevis. В них было показано, что при добавлении магаинина или PGLa снаружи от одиночной ГОВ, к которой приложено небольшое латеральное натяжение ∼0.5 мН/м путем частичного всасывания в микропипетку, площадь везикулы монотонно увеличивается на ∼3% в течение приблизительно 1 мин, причем изменение площади и время ее увеличения слабо зависят от объемной концентрации АМП. Затем рост площади мембраны останавливается на некоторое время, и потом площадь вновь возрастает приблизительно на ту же величину (∼3%). Далее система либо остается в этом состоянии долгое время, либо происходит разрушение мембраны ГОВ, и она полностью втягивается в микропипетку. Полученные результаты позволяют выявить несколько особенностей взаимодействия АМП с замкнутой мембраной ГОВ. На первом этапе остановка роста площади мембраны после увеличения площади на ∼3% и независимость этой величины от объемной концентрации пептида подразумевает, что: 1) пептидные молекулы встраиваются в наружный монослой мембраны ГОВ; именно это встраивание и приводит к росту площади мембраны ГОВ; 2) по-видимому, встраивание является антикооперативным процессом, в том смысле, что встраивание пептидов затрудняет встраивание последующих молекул АМП, поскольку через некоторое время рост площади мембраны ГОВ останавливается. Последующее удвоение роста площади мембраны ГОВ авторы работ [2, 3] интерпретируют как образование небольших пор в мембране и переход через них молекул АМП на внутренний монослой мембраны ГОВ. Таким образом, латеральное давление в наружном монослое и латеральное натяжение – во внутреннем, возникающие при общем увеличении площади мембраны ГОВ на ∼3%, оказываются достаточными для интенсивного образования пор, через которые могут проходить встроенные в мембрану молекулы АМП. Это же латеральное давление в наружном монослое полностью блокирует встраивание в мембрану молекул АМП из водного раствора.
Ранее были разработаны модели, позволяющие рассчитывать энергию деформаций в мембранах с различной толщиной и спонтанной кривизной монослоев [34, 35]. В настоящей работе мы разработали теоретическую модель, позволяющую рассчитать энергию гидрофобного дефекта в мембране с произвольным распределением латеральных натяжений/давлений по монослоям. Из результатов расчетов следует, что при антисимметричном распределении латерального натяжения (латеральное давление в наружном монослое, равное ему по величине латеральное натяжение во внутреннем монослое) в везикулах, сформированных из ДОФХ, для величин латерального натяжения/давления, при которых в мембранах ГОВ образуются сквозные поры, действительно понижается энергия гидрофобного дефекта. Однако это понижение энергии оказывается недостаточным, чтобы объяснить наблюдаемое экспериментально среднее время ожидания порации мембраны [2, 3]. Таким образом, хотя латеральное натяжение/давление, появляющиеся в мембране как следствие нелокального действия АМП, несколько облегчает образование гидрофобных дефектов, по-видимому, гидрофобные дефекты образуются преимущественно в наиболее деформационно напряженной области мембраны в непосредственной близости от частично встроенных в наружный монослой мембраны амфипатических пептидов. Иными словами, амфипатические пептиды образуют поры в мембранах преимущественно по локальному механизму, непосредственно участвуя в формировании кромки поры, в то время как нелокальные эффекты взаимодействия АМП с замкнутой мембраной лишь способствуют порации в непосредственной близости от встроенных молекул АМП. Этот вывод также качественно подтверждается тем, что в плоских бислоях также наблюдаются процессы АМП-стимулированной порации, при этом ввиду наличия липидного резервуара нелокальный эффект изменения натяжения/давления отсутствует.
ПОСТАНОВКА И РЕШЕНИЕ ЗАДАЧИ
Гидрофобный дефект в горизонтальном липидном бислое представляет собой гидрофобный цилиндр радиуса R и высоты L0, который сопрягается с деформированным липидным бислоем. Мы фиксировали радиус гидрофобного дефекта и оптимизировали энергию системы, включающую упругий и гидрофобный вклады.
Энергия гидрофобной цилиндрической полости, заполненной водой, согласно теории Марчельи, записывается в следующем виде [31, 32, 36]:
(1)
${{W}_{{hyd}}} = {{\sigma }_{0}}\left( {2\pi R{{L}_{0}}} \right)\frac{{{{I}_{1}}\left( {\frac{R}{{{{\xi }_{h}}}}} \right)}}{{{{I}_{0}}\left( {\frac{R}{{{{\xi }_{h}}}}} \right)}},$Для расчета упругой части энергии системы использовался функционал Хамма–Козлова [37], обобщенный для учета дополнительных деформационных мод [38, 39]. Средняя ориентация липидных молекул описывалась векторным полем единичных векторов n, называемых директорами. Это поле задавалось на так называемой нейтральной поверхности липидного монослоя, проходящей в окрестности сопряжения полярных головок и гидрофобных цепей липидов [40]. Форма нейтральной поверхности описывается векторным полем ее единичных нормалей N, направленных внутрь мембраны. Все деформации считались малыми, и энергия вычислялась во втором порядке по ним. Упругая энергия липидного монослоя рассчитывалась с учетом следующих деформаций: 1) поперечный изгиб, характеризующийся дивергенцией директора вдоль нейтральной поверхности; 2) наклон, характеризующийся вектором наклона t = n – N; 3) латеральное растяжение, характеризующееся относительным изменением площади элемента нейтральной поверхности α; 4) латеральное натяжение или давление. В силу вращательной симметрии системы относительно оси цилиндра гидрофобного дефекта, в упругую энергию не дает вклада деформация кручения, характеризующаяся rot(n). Следуя формализму, разработанному в работах [31, 32], мы не учитываем гауссову кривизну нейтральных поверхностей. Введем полярную систему координат Orφz, ось Oz которой совпадает с осью цилиндра гидрофобного дефекта; ось Or лежит в плоскости межмонослойной поверхности мембраны. Форму нейтральной поверхности монослоя будем описывать функцией z-координат ее точек, H(r). Форму межмонослойной поверхности будем описывать функцией z-координат ее точек, M(r). Поверхностная плотность упругой энергии липидного монослоя может быть записана в виде:
(2)
$\begin{gathered} w = \frac{{{{K}_{c}}}}{2}{{\left[ {{\text{div}}{\kern 1pt} \left( {\mathbf{n}} \right) + {{J}_{0}}} \right]}^{2}} - \frac{{{{K}_{c}}}}{2}J_{0}^{2} + \frac{{{{K}_{t}}}}{2}{{{\mathbf{t}}}^{2}} + \\ + \,\,\frac{{{{K}_{a}}}}{2}{{\alpha }^{2}} + \frac{\sigma }{2}{{\left[ {{\mathbf{grad}}{\kern 1pt} \left( H \right)} \right]}^{2}}, \\ \end{gathered} $(3)
$\begin{gathered} w = \frac{{{{K}_{c}}}}{2}{{\left[ {n{\kern 1pt} ' + \frac{n}{r} + {{J}_{0}}} \right]}^{2}} - \frac{{{{K}_{c}}}}{2}J_{0}^{2} + \frac{{{{K}_{t}}}}{2}{{\left( {n - H{\kern 1pt} '} \right)}^{2}} + \\ + \,\,\frac{{{{K}_{a}}}}{2}{{\alpha }^{2}} + \frac{\sigma }{2}{{\left( {H{\kern 1pt} '} \right)}^{2}}, \\ \end{gathered} $Ниже величины, относящиеся к верхнему монослою, будем снабжать индексом “u”, к нижнему монослою – индексом “l”. С высокой точностью липидный монослой может считаться локально объемно несжимаемым, поскольку модуль объемного сжатия липидов чрезвычайно велик и составляет ∼1010 Дж/м3 [41]. Условия локальной объемной несжимаемости для верхнего и нижнего монослоев записываются в виде:
(4)
$\begin{gathered} {{H}_{u}} - M = h - \frac{{{{h}^{2}}}}{2}\left( {n_{u}^{'} + \frac{{{{n}_{u}}}}{r}} \right) - h{{\alpha }_{u}}, \\ M - {{H}_{l}} = h - \frac{{{{h}^{2}}}}{2}\left( {n_{l}^{'} + \frac{{{{n}_{l}}}}{r}} \right) - h{{\alpha }_{l}}, \\ \end{gathered} $(5)
$\begin{gathered} {{\alpha }_{u}} = \frac{1}{h}\left( {M - {{H}_{u}}} \right) + 1 - \frac{h}{2}\left( {n_{u}^{'} + \frac{{{{n}_{u}}}}{r}} \right), \\ {{\alpha }_{l}} = \frac{1}{h}\left( {{{H}_{l}} - M} \right) + 1 - \frac{h}{2}\left( {n_{l}^{'} + \frac{{{{n}_{l}}}}{r}} \right). \\ \end{gathered} $Таким образом, полная упругая энергия мембраны может быть записана в виде:
(6)
$\begin{gathered} {{W}_{{el}}} = \int {d{{S}_{u}}\left\{ {\frac{{{{K}_{c}}}}{2}{{{\left[ {n_{u}^{'} + \frac{{{{n}_{u}}}}{r} + {{J}_{0}}} \right]}}^{2}} - \frac{{{{K}_{c}}}}{2}J_{0}^{2} + \frac{{{{K}_{t}}}}{2}{{{\left( {{{n}_{u}} - H_{u}^{'}} \right)}}^{2}}} \right.} + \\ \left. { + \,\,\frac{{{{K}_{a}}}}{2}{{{\left( {\frac{1}{h}\left( {M - {{H}_{u}}} \right) + 1 - \frac{h}{2}\left( {n_{u}^{'} + \frac{{{{n}_{u}}}}{r}} \right)} \right)}}^{2}} + \frac{{{{\sigma }_{u}}}}{2}{{{\left( {H_{u}^{'}} \right)}}^{2}}} \right\} + \\ + \,\,\int {d{{S}_{l}}\left\{ {\frac{{{{K}_{c}}}}{2}{{{\left[ {n_{l}^{'} + \frac{{{{n}_{l}}}}{r} + {{J}_{0}}} \right]}}^{2}} - \frac{{{{K}_{c}}}}{2}J_{0}^{2} + \frac{{{{K}_{t}}}}{2}{{{\left( {{{n}_{l}} + H_{l}^{'}} \right)}}^{2}}} \right.} + \\ \left. { + \,\,\frac{{{{K}_{a}}}}{2}{{{\left( {\frac{1}{h}\left( {{{H}_{l}} - M} \right) + 1 - \frac{h}{2}\left( {n_{l}^{'} + \frac{{{{n}_{l}}}}{r}} \right)} \right)}}^{2}} + \frac{{{{\sigma }_{l}}}}{2}{{{\left( {H_{l}^{'}} \right)}}^{2}}} \right\} - \\ - \,\,\pi {{R}^{2}}\left( {{{\sigma }_{u}} + {{\sigma }_{l}}} \right), \\ \end{gathered} $(7)
$\left\{ \begin{gathered} \left( {{{l}^{2}} + \frac{A}{4}{{h}^{2}}} \right)\left( {n_{u}^{{''}} + \frac{{n_{u}^{'}}}{r}} \right) - \left( {{{r}^{2}} + {{l}^{2}} + \frac{A}{4}{{h}^{2}}} \right)\frac{{{{n}_{u}}}}{{{{r}^{2}}}} + \hfill \\ + \,\,\left( {1 + \frac{A}{2}} \right)H_{u}^{'} - \frac{A}{2}M{\kern 1pt} ' = 0, \hfill \\ \left( {{{l}^{2}} + \frac{A}{4}{{h}^{2}}} \right)\left( {n_{l}^{{''}} + \frac{{n_{l}^{'}}}{r}} \right) - \left( {{{r}^{2}} + {{l}^{2}} + \frac{A}{4}{{h}^{2}}} \right)\frac{{{{n}_{l}}}}{{{{r}^{2}}}} - \hfill \\ - \,\,\left( {1 + \frac{A}{2}} \right)H_{l}^{'} + \frac{A}{2}M{\kern 1pt} ' = 0, \hfill \\ \left( {1 + \frac{A}{2}} \right)\left( {n_{u}^{'} + \frac{{{{n}_{u}}}}{r}} \right) - \left( {2{{s}_{u}} + 1} \right)\left( {H_{u}^{{''}} + \frac{{H_{u}^{'}}}{r}} \right) + \hfill \\ + \,\,\frac{A}{{{{h}^{2}}}}\left( {{{H}_{u}} - M - h} \right) = 0, \hfill \\ \left( {1 + \frac{A}{2}} \right)\left( {n_{l}^{'} + \frac{{{{n}_{l}}}}{r}} \right) + \left( {2{{s}_{l}} + 1} \right)\left( {H_{l}^{{''}} + \frac{{H_{l}^{'}}}{r}} \right) + \hfill \\ - \,\,\frac{A}{{{{h}^{2}}}}\left( {{{H}_{l}} - M + h} \right) = 0, \hfill \\ n_{u}^{'} + \frac{{{{n}_{u}}}}{r} - n_{l}^{'} - \frac{{{{n}_{l}}}}{r} + \frac{2}{{{{h}^{2}}}}\left( {{{H}_{u}} + {{H}_{l}} - 2M} \right) = 0, \hfill \\ \end{gathered} \right.$(8)
${{\lambda }^{2}}({{a}_{6}}{{\lambda }^{6}} + {{a}_{4}}{{\lambda }^{4}} + {{a}_{2}}{{\lambda }^{2}} + {{a}_{0}}) = 0,$(9)
$\begin{gathered} {{a}_{6}} = {{h}^{2}}{{l}^{2}}\left( {2{{s}_{l}} + 1} \right)\left( {2{{s}_{u}} + 1} \right)\left( {A{{h}^{2}} + 4{{l}^{2}}} \right), \\ {{a}_{4}} = {{h}^{2}}\left( {{{s}_{l}} + {{s}_{u}} + 4{{s}_{l}}{{s}_{u}}} \right)\left( {A{{h}^{2}} + 8{{l}^{2}}} \right) + \\ + \,\,4{{l}^{2}}A\left( {{{l}^{2}} - {{h}^{2}}} \right)\left( {{{s}_{l}} + {{s}_{u}} + 1} \right), \\ {{a}_{2}} = A{{l}^{2}} + 4{{h}^{2}}{{s}_{l}}{{s}_{u}} + A\left( {2{{l}^{2}} - {{h}^{2}}} \right)\left( {{{s}_{l}} + {{s}_{u}}} \right), \\ {{a}_{0}} = 4A\left( {{{s}_{l}} + {{s}_{u}}} \right). \\ \end{gathered} $Характеристическое уравнение (8) относительно λ2 имеет три нетривиальных корня p1, p2, p3, два из которых комплексно сопряженные, а один – действительный и отрицательный при типичных величинах упругих параметров мембраны, приведенных ниже в разделе “Результаты и обсуждение”. Корни находятся аналитически, однако они очень громоздкие, и здесь не приводятся. Для функции d(r) получается общее решение в следующем виде:
(10)
$\begin{gathered} d\left( r \right) = \frac{{{{c}_{1}}}}{r} + {{c}_{2}}{{J}_{1}}\left( {\sqrt {{{p}_{1}}} r} \right) + {{c}_{3}}{{J}_{1}}\left( {\sqrt {{{p}_{2}}} r} \right) + {{c}_{4}}{{J}_{1}}\left( {\sqrt {{{p}_{3}}} r} \right) + \\ + \,\,{{c}_{5}}{{Y}_{1}}\left( {\sqrt {{{p}_{1}}} r} \right) + {{c}_{6}}{{Y}_{1}}\left( {\sqrt {{{p}_{2}}} r} \right) + {{c}_{7}}{{Y}_{1}}\left( {\sqrt {{{p}_{3}}} r} \right), \\ \end{gathered} $В качестве граничных условий требовалась ограниченность деформаций. Кроме того, вдали от гидрофобного дефекта мембрана не деформирована, поэтому налагались следующие условия: nu(∞) = 0, nl(∞) = 0, Hu(∞) = h, Hl(∞) = −h, M(∞) = 0. На границе гидрофобного цилиндра, т.е. при r = R, ставились условия:
(11)
$\begin{gathered} {{H}_{u}}\left( R \right) - {{H}_{l}}\left( R \right) = {{L}_{u}} + {{L}_{l}}, \hfill \\ {{n}_{u}}\left( R \right) = \frac{{h - {{L}_{u}}}}{{\sqrt {L_{u}^{2} + {{{\left( {h - {{L}_{u}}} \right)}}^{2}}} }}, \hfill \\ {{n}_{l}}\left( R \right) = \frac{{h - {{L}_{l}}}}{{\sqrt {L_{l}^{2} + {{{\left( {h - {{L}_{l}}} \right)}}^{2}}} }}, \hfill \\ \end{gathered} $РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для получения количественных результатов и их графической иллюстрации использовались величины упругих параметров мембраны, характерные для ДОФХ (в расчете на один монослой): модуль изгиба Kc = 10 kBT (kBT ≈ 4.14 × 10–21 Дж) [16]; модуль наклона Kt = 40 мН/м ≈ 10 kBT/нм2 [37]; модуль латерального растяжения Ka = 133 мН/м ≈ 32 kBT/нм2 [16]; спонтанная кривизна J0 = –0.091 нм–1 [42]; толщина гидрофобной части монослоя h = 1.45 нм [31]. При вычислении энергии гидрофобного цилиндра согласно выражению (1) считалось, что σ0 = 50 мН/м ≈ 12.5 kBT/нм2; ξh = 1 нм [31, 32].
В работах [2, 3] было показано, что встраивание в наружный монослой мембраны ГОВ магаинина и PGLa из водного раствора прекращается, когда относительное увеличение площади мембраны достигает δ = 3%; после этого в мембране через некоторое время образуются поры, через которые адсорбированные молекулы АМП переходят на внутренний монослой мембраны. ГОВ формировались из смеси 60 : 40 ДОФХ : диолеоилфосфатидилглицерина. Предполагая, что модуль латерального растяжения монослоя такой мембраны приблизительно совпадает с модулем латерального растяжения монослоя ДОФХ, получим, что при увеличении площади мембраны ГОВ на 3% во внутреннем монослое возникает латеральное натяжение σl = Kaδ = 133 × 0.030 = 4.0 мН/м ≈ ≈ 1.0 kBT/нм2; в наружном монослое при этом возникает равное по абсолютной величине латеральное давление σu = –4.0 мН/м ≈ –1.0 kBT/нм2. Однако функционал упругой энергии (6) стабилен (является положительно определенной квадратичной формой малых деформаций) лишь при условии σu + σl ≥ 0. Поэтому при расчетах мы полагали, что мембрана в целом находится под небольшим эффективным латеральным натяжением 2σe = 0.02 мН/м (т.е. σu + σl = 2σe = 0.02 мН/м); от конкретной величины этого эффективного латерального натяжения результаты расчетов практически не зависят.
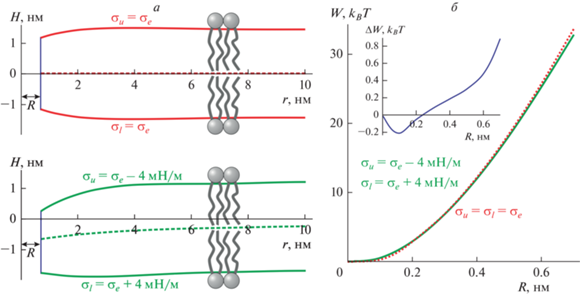
На рис. 2а показана рассчитанная форма мембраны с гидрофобным дефектом радиуса R = 0.7 нм для случаев одинакового небольшого латерального натяжения σu = σl = σe = 0.01 мН/м в наружном и внутреннем монослоях (вверху), а также большого латерального давления в наружном монослое и большого латерального натяжения во внутреннем монослое мембраны, σu = σe – 4 мН/м, σl = = σe + 4 мН/м (внизу). Из рис. 2а видно, что при одинаковом латеральном натяжении монослоев σu = σl = σe = 0.01 мН/м форма мембраны зеркально симметрична относительно плоской межмонослойной поверхности (показана штриховой линией на рис. 2а); равновесная длина гидрофобного цилиндра составляет L = Lu + Ll = 2.2 нм. При σu = σe – 4 мН/м, σl = σe + 4 мН/м мембрана выгибается внутрь ГОВ, в сторону внутреннего монослоя, к которому приложено латеральное натяжение. Равновесная длина гидрофобного цилиндра при этом составляет L = Lu + Ll = 2.0 нм, т.е. уменьшается приблизительно на 10% по сравнению со случаем одинакового латерального натяжения в монослоях. Зависимость энергии гидрофобного дефекта от радиуса приведена на рис. 2б для случаев σu = σl = σe (пунктирная красная кривая) и σu = σe – 4 мН/м, σl = σe + 4 мН/м (сплошная зеленая кривая). Из графика видно, что кривые различаются слабо. На вставке показана разность зависимостей энергии гидрофобного дефекта от радиуса для случаев σu = σl = σe и σu = σe – 4 мН/м, σl = σe + 4 мН/м; разность не превышает 0.9 kBT при R = 0.7 нм. При этом абсолютная величина энергии гидрофобного дефекта при R = 0.7 нм в случае σu = σl = σe составляет 33.7 kBT. В мембране из ДОФХ без приложенного латерального натяжения поры самопроизвольно не образуются, т.е. энергетический барьер в 33.7 kBT не может быть преодолен за типичное время эксперимента (например, порядка десятков минут) за счет энергии тепловых флуктуаций мембраны. Кинетика образования пор в мембране описывается уравнением, по форме аналогичным уравнению диффузии в потенциале E(R) [43]. В условиях, когда высота энергетического барьера образования поры ΔE намного превышает 1 kBT (ΔE $ \gg $ 1 kBT), что заведомо выполняется в нашей системе, диффузия мембранных дефектов в пространстве радиусов может считаться стационарной. В приближении стационарной диффузии среднее время ожидания порации (или первого перехода мембранного дефекта через энергетический барьер, т.е. превышения критического радиуса) находится аналитически и имеет аррениусовский вид: $\tau = \frac{1}{\nu }{{e}^{{\frac{{\Delta E}}{{{{k}_{B}}T}}}}}$, где ν – характерная частота возникновения дефектов [43]. Данная кинетическая теория была разработана для описания экспериментов по электрическому пробою мембран сотрудниками лаборатории биоэлектрохимии ИЭЛАН под руководством Ю.А. Чизмаджева [43]. Таким образом, понижение энергетического барьера на 0.9 kBT при приложении латерального натяжения и давления σu = σe – 4 мН/м, σl = σe + 4 мН/м должно сокращать среднее время ожидания перехода системы через энергетический барьер в e0.9 ≈ 2.5 раза. При этом в работах [2, 3] интенсивное образование пор, сопровождающееся переходом пептидных молекул на внутренний монослой ГОВ, начиналось в пределах нескольких минут после достижения латерального натяжения/давления σl = –σu = 4 мН/м. Таким образом, нелокальная модель формирования пор АМП противоречит результатам экспериментов работ [2, 3].
Рис. 2.
а – Форма мембраны вблизи гидрофобного дефекта радиуса R = 0.7 нм, рассчитанная для случаев одинакового малого латерального натяжения наружного и внутреннего монослоев, σu = σl = σe = 0.01 мН/м (вверху), а также большого латерального давления в наружном монослое и большого латерального натяжения во внутреннем монослое мембраны, σu = σe – 4 мН/м, σl = σe + 4 мН/м (внизу). б – Зависимость энергии гидрофобного дефекта от его радиуса в мембранах с одинаковым малым латеральным натяжением наружного и внутреннего монослоев, σu = σl = σe = = 0.01 мН/м (пунктирная красная кривая), а также с большим латеральным давлением в наружном монослое и большим латеральным натяжением во внутреннем монослое, σu = σe – 4 мН/м, σl = σe + 4 мН/м (сплошная зеленая кривая). На вставке показана разность зависимостей энергии гидрофобного дефекта от его радиуса для случаев σu = σl = = σe = 0.01 мН/м и σu = σe – 4 мН/м, σl = σe + 4 мН/м.
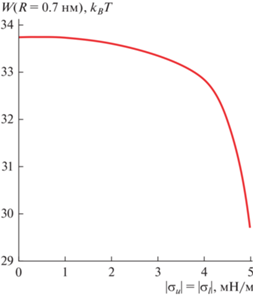
На рис. 3 показана зависимость энергии гидрофобного дефекта радиуса R = 0.7 нм от величины латерального давления, приложенного к наружному монослою замкнутой мембраны и равного ему по абсолютной величине латерального натяжения, приложенного к внутреннему монослою. Из графика видно, что при |σu|, |σl| > 4 мН/м энергия дефекта резко падает: при σu = σe – 4.5 мН/м, σl = = σe + 4.5 мН/м понижение энергии дефекта составляет ∼1.7 kBT, а при σu = σe – 5 мН/м, σl = σe + + 5 мН/м – приблизительно 4 kBT по сравнению со случаем σu = σl = σe. При этом в нашей оценке латерального натяжения/давления, возникающего при адсорбции PGLa на наружный монослой мембраны ГОВ (σl = –σu = Kaδ), используются относительное увеличение площади мембраны δ и модуль латерального растяжения Ka. Обе эти величины экспериментально определяются с погрешностью ±7%: δ = 0.029 ± 0.002 [3], 2Ka = 265 ± ± 18 мН/м [16]. С учетом этой погрешности величина латерального натяжения/давления, возникающего при адсорбции АМП, в принципе, может попасть на быстро падающий участок кривой W(R = 0.7 нм) (рис. 3), что обеспечит наблюдаемое экспериментально среднее время ожидания порации мембран ГОВ [2, 3], хотя достижение такой величины латерального натяжения/давления и крайне маловероятно. В среднем, понижение энергии гидрофобного дефекта вследствие изменения интегральных характеристик замкнутой мембраны при ее взаимодействии с АМП (т.е. латерального натяжения/давления) оказывается значительно меньшим, чем необходимо для количественного описания экспериментальных данных [2, 3]. Таким образом, можно заключить, что АМП лишь в некоторой степени облегчают образование пор по нелокальному механизму, т.е. повсеместно во всей мембране. Однако преимущественно поры должны образовываться в соответствии с гипотезой о локальном действии АМП в непосредственной близости от одиночных молекул АМП или их агрегатов, в наиболее деформированных участках мембраны. Нелокальное действие АМП понижает высоту энергетического барьера формирования гидрофобного дефекта во всей мембране, однако вблизи встроенной в наружный монослой мембраны ГОВ молекулы АМП это понижение должно быть еще большим. Таким образом, по-видимому, амфипатические пептиды образуют поры в мембранах преимущественно по локальному механизму, непосредственно участвуя в формировании кромки поры, хотя при этом нелокальные эффекты взаимодействия АМП с замкнутой мембраной несколько облегчают порацию мембраны в целом. В рамках модели Дерягина–Гутопа [28] высота энергетического барьера образования поры (энергия E = 2πRγ – πR2σ при R = R* = γ/σ) равна ΔE = πγ2/σ. Она может быть понижена либо за счет повышения латерального натяжения, либо за счет уменьшения линейного натяжения кромки поры. Нелокальное действие АМП приводит к изменению латерального натяжения, в то время как линейное натяжение может изменяться только по локальному механизму действия АМП. Результаты нашей работы показывают, что изменение латерального натяжения при встраивании молекул АМП в один из монослоев замкнутой мембраны оказывается недостаточным для эффективного образования пор, и необходимо непосредственно понижать линейное натяжение кромки поры.
Рис. 3.
Зависимость энергии гидрофобного дефекта радиуса R = 0.7 нм от величины латерального давления наружного монослоя замкнутой мембраны и равного ему по абсолютной величине латерального натяжения внутреннего монослоя.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при поддержке Российского научного фонда (грант № 22-24-00834).
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Pérez-Peinado C., Dias S.A., Domingues M.M., Benfield A.H., Freire J.M., Rádis-Baptista G., Gaspar D., Castanho M.A.R.B., Craik D.J., Henriques S.T., Veiga A.S., Andreu D. 2018. Mechanisms of bacterial membrane permeabilization by crotalicidin (Ctn) and its fragment Ctn (15–34), antimicrobial peptides from rattlesnake venom. J. Biol. Chem. 293, 1536–1549.
Hasan M., Karal M.A.S., Levadnyy V., Yamazaki M. 2018. Mechanism of initial stage of pore formation induced by antimicrobial peptide magainin 2. Langmuir 34, 3349–3362.
Parvez F., Alam J.M., Dohra H., Yamazaki M. 2018. Elementary processes of antimicrobial peptide PGLa-induced pore formation in lipid bilayers. Biochim. Biophys. Acta. 1860, 2262–2271.
Park S.C., Kim J.Y., Shin S.O., Jeong C.Y., Kim M.H., Shin S.Y., Cheong G.-W., Park Y., Hahm K.S. 2006. Investigation of toroidal pore and oligomerization by melittin using transmission electron microscopy. Biochem. Biophys. Res. Comm. 343, 222–228.
Tamba Y., Ariyama H., Levadny V., Yamazaki M. 2010. Kinetic pathway of antimicrobial peptide magainin 2-induced pore formation in lipid membranes. J. Phys. Chem. B. 114, 12018–12026.
Huang H.W. 2006. Molecular mechanism of antimicrobial peptides: The origin of cooperativity. Biochim. Biophys. Acta. 1758, 1292–1302.
Pan J., Tieleman D.P., Nagle J.F., Kučerka N., Tristram-Nagle S. 2009. Alamethicin in lipid bilayers: Combined use of X-ray scattering and MD simulations. Biochim. Biophys. Acta. 1788, 1387–1397.
Chen F.Y., Lee M.T., Huang H.W. 2003. Evidence for membrane thinning effect as the mechanism for peptide-induced pore formation. Biophys. J. 84, 3751–3758.
Zemel A., Ben-Shaul A., May S. 2005. Perturbation of a lipid membrane by amphipathic peptides and its role in pore formation. Eur. Biophys. J. 34, 230–242.
Santo K.P., Berkowitz M.L. 2012. Difference between magainin-2 and melittin assemblies in phosphatidylcholine bilayers: results from coarse-grained simulations. J. Phys. Chem. B. 116, 3021–3030.
Campelo F., McMahon H.T., Kozlov M.M. 2008. The hydrophobic insertion mechanism of membrane curvature generation by proteins. Biophys. J. 95, 2325–2339.
Huang H.W. 2000. Action of antimicrobial peptides: Two-state model. Biochemistry. 39, 8347–8352.
Huang H.W., Chen F.Y., Lee M.T. 2004. Molecular mechanism of peptide-induced pores in membranes. Phys. Rev. Lett. 92, 198304.
Manzini M.C., Perez K.R., Riske K.A., Bozelli Jr.J.C., Santos T.L., da Silva M.A., Saraiva G.K.V., Politi M.J., Valente A.P., Almeida F.C.L., Chaimovich H., Rodrigues M.A., Bemquerer M.P., Schreier S., Cuccovia I.M. 2014. Peptide: Lipid ratio and membrane surface charge determine the mechanism of action of the antimicrobial peptide BP100. Conformational and functional studies. Biochim. Biophys. Acta. 1838, 1985–1999.
Evans E., Rawicz W. 1990. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys. Rev. Lett. 64, 2094.
Rawicz W., Olbrich K.C., McIntosh T., Needham D., Evans E. 2000. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophys. J. 79, 328–339.
Mueller P., Rudin D.O., Tien H.T., Wescott W.C. 1963. Methods for the formation of single bimolecular lipid membranes in aqueous solution. J. Phys. Chem. 67, 534–535.
Montal M., Mueller P. 1972. Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties. Proc. Natl. Acad. Sci. USA. 69, 3561–3566.
Saitov A., Akimov S.A., Galimzyanov T.R., Glasnov T., Pohl P. 2020. Ordered lipid domains assemble via concerted recruitment of constituents from both membrane leaflets. Phys. Rev. Lett. 124, 108102.
Bashkirov P.V., Kuzmin P.I., Chekashkina K., Arrasate P., Vera Lillo J., Shnyrova A.V., Frolov V.A. 2020. Reconstitution and real-time quantification of membrane remodeling by single proteins and protein complexes. Nat. Protocols. 15, 2443–2469.
Galimzyanov T.R., Bashkirov P.V., Blank P.S., Zimmerberg J., Batishchev O.V., Akimov S.A. 2020. Monolayerwise application of linear elasticity theory well describes strongly deformed lipid membranes and the effect of solvent. Soft Matter. 16, 1179–1189.
Karal M.A.S., Alam J.M., Takahashi T., Levadny V., Yamazaki M. 2015. Stretch-activated pore of the antimicrobial peptide, magainin 2. Langmuir. 31, 3391–3401.
Kabelka I., Vácha R. 2015. Optimal conditions for opening of membrane pore by amphiphilic peptides. J. Chem. Phys. 143, 243115.
Qian S., Wang W., Yang L., Huang H.W. 2008. Structure of transmembrane pore induced by Bax-derived peptide: evidence for lipidic pores. Proc. Natl. Acad. Sci. USA. 105, 17379–17383.
Yang L., Harroun T.A., Weiss T.M., Ding L., Huang H.W. 2001. Barrel-stave model or toroidal model? A case study on melittin pores. Biophys. J. 81, 1475–1485.
Chen F.Y., Lee M.T., Huang H.W. 2003. Evidence for membrane thinning effect as the mechanism for peptide-induced pore formation. Biophys. J. 84, 3751–3758.
Zhdanov V.P. 2014. Interaction of amphipathic α-helical peptides with a lipid membrane: Adsorption and pore formation. Physica A. 401, 45–51.
Дерягин Б.В., Гутоп Ю.В. 1962. Теория разрушения (прорыва) свободных пленок. Коллоидн. журн. 24, 431–437.
Abidor I.G., Arakelyan V.B., Chernomordik L.V., Chizmadzhev Y.A., Pastushenko V.F., Tarasevich M.P. 1979. Electric breakdown of bilayer lipid membranes: I. The main experimental facts and their qualitative discussion. J. Electroanal. Chem. Interfacial Electrochem. 104, 37–52.
Weaver J.C., Chizmadzhev Y.A. 1996. Theory of electroporation: A review. Bioelectrochem. Bioenerg. 41, 135–160.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane I: Continuous reversible trajectory from intact bilayer through hydrophobic defect to transversal pore. Sci. Rep. 7, 12152.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane II: Energy landscape under external stress. Sci. Rep. 7, 12509.
Акимов С.А., Александрова В.В., Галимзянов Т.Р., Башкиров П.В., Батищев О.В. 2017. Механизм формирования пор в мембранах из стеароилолеоилфосфатидилхолина под действием латерального натяжения. Биол. мембраны. 34, 270–283.
Галимзянов Т.Р., Молотковский Р.Ю., Кузьмин П.И., Акимов С.А. 2011. Стабилизация бислойной структуры рафтов за счет упругих деформаций мембраны. Биол. мембраны. 28, 307–314.
Galimzyanov T.R., Molotkovsky R.J., Cohen F.S., Pohl P., Akimov S.A. 2016. “Galimzyanov et al. Reply”. Phys. Rev. Lett. 116, 079802.
Marcelja S. 1977. Structural contribution to solute-solute interaction. Croat. Chem. Acta 49, 347–357.
Hamm M., Kozlov M.M. 2000. Elastic energy of tilt and bending of fluid membranes. Eur. Phys. J. E. 3, 323–335.
Kondrashov O.V., Galimzyanov T.R., Pavlov K.V., Kotova E.A., Antonenko Y.N., Akimov S.A. 2018. Membrane elastic deformations modulate gramicidin A transbilayer dimerization and lateral clustering. Biophys. J. 115, 478–493.
Kondrashov O.V., Galimzyanov T.R., Jiménez-Munguía I., Batishchev O.V., Akimov S.A. 2019. Membrane-mediated interaction of amphipathic peptides can be described by a one-dimensional approach. Phys. Rev. E. 99, 022401.
Leikin S., Kozlov M.M., Fuller N.L. Rand R.P. 1996. Measured effects of diacylglycerol on structural and elastic properties of phospholipid membranes. Biophys. J. 71, 2623–2632.
Nagle J.F., Wilkinson D.A. 1978. Lecithin bilayers. Density measurement and molecular interactions. Biophys. J. 23, 159–175.
Kollmitzer B., Heftberger P., Rappolt M., Pabst G. 2013. Monolayer spontaneous curvature of raft-forming membrane lipids. Soft Matter. 9, 10877–10884.
Pastushenko V.F., Chizmadzhev Y.A., Arakelyan V.B. 1979. Electric breakdown of bilayer lipid membranes: II. Calculation of the membrane lifetime in the steady-state diffusion approximation. J. Electroanal. Chem. Interfacial Electrochem. 104, 53–62.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


