Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 6, стр. 474-481
Влияние гимантана на активность фосфолипазы А2 и уровень циклооксигеназы-2 при экссудативном воспалении
Е. А. Иванова a, *, Н. Н. Золотов a, А. И. Матюшкин a, Т. А. Воронина a
a НИИ фармакологии им. В.В. Закусова
125315 Москва, Россия
* E-mail: iwanowaea@yandex.ru
Поступила в редакцию 13.01.2022
После доработки 08.02.2022
Принята к публикации 11.02.2022
- EDN: GBNWWI
- DOI: 10.31857/S0233475522060068
Аннотация
Воспаление – защитно-приспособительная реакция организма, многие триггеры и медиаторы которой воздействуют на рецепторы, локализованные на клеточной мембране. Поэтому соединения, изменяющие свойства клеточной мембраны, могут влиять на воспалительный процесс. В проведенном исследовании оценено влияние производного адамантана N-(2-адамантил)-гексаметиленимина гидрохлорида (гимантана) на фосфолипазу А2 (КФ 3.1.1.4., ФЛА2) – фермент, под действием которого из фосфолипидов образуется предшественник простагландинов и лейкотриенов арахидоновая кислота, и циклооксигеназу-2 (КФ 1.14.99.1., ЦОГ-2), под действием которой при воспалении из арахидоновой кислоты образуются провоспалительные простагландины. Установлено, что при остром экссудативном воспалении у мышей гимантан снижает повышенную активность ФЛА2, но не влияет на уровень ЦОГ-2. Мы также показали, что курсовое превентивное применение препарата в течение 10 дней (1 раз в день) как при внутрибрюшинном введении (10 мг/кг), так и накожном нанесении в лекарственной форме для наружного применения (5% гель) способствует усилению противовоспалительного эффекта гимантана, что может быть обусловлено его влиянием на запуск воспалительного процесса и вследствие этого на активность ФЛА2.
ВВЕДЕНИЕ
Воспаление является защитно-приспособительной реакцией организма в ответ на повреждение тканей и/или действие патогенного раздражителя. Хотя воспаление направлено на локализацию и уничтожение патогенных факторов, участвующие в воспалительном ответе медиаторы и клетки могут вызвать повреждение здоровых тканей [1, 2]. Многие рецепторы триггеров воспаления (несколько Toll-подобных рецепторов) и медиаторов воспаления (простагландинов, лейкотриенов, интерлейкинов и хемокинов) локализованы на клеточной мембране. Структурно-функциональное состояние мембранно-рецепторных комплексов обеспечивается липидными рафтами [3]. Оказывая действие на фосфолипиды клеточной мембраны, в частности изменяя их жирнокислотный состав, можно влиять на липидные рафты и способность белков перемещаться в плоскости мембраны и, следовательно, на запуск воспалительного процесса [4]. Ряд вторичных мессенджеров, таких как лизофосфолипиды, диацилглицерин и способные проявлять противовоспалительную активность эндоканнабиноиды, образуется из фосфолипидов клеточной мембраны, а высвобождаемые из фосфолипидов полиненасыщенные жирные кислоты служат субстратом для циклооксигеназы (ЦОГ), липооксигеназы (ЛОГ) и цитохрома P450. Образующиеся из арахидоновой кислоты под действием ЦОГ и ЛОГ соответственно простагландины и лейкотриены являются хорошо описанными медиаторами воспаления [4].
Соединения, обладающие активностью в отношении клеточных мембран, могут влиять на воспалительную реакцию. Так, производное каркасного углеводорода адамантана N-(2-адамантил)-гексаметиленимина гидрохлорид (гимантан) проявляет мембранотропные свойства, в частности, повышает заряд мембран эритроцитов [5] и обладает противовоспалительной активностью. Противовоспалительная активность гимантана выявлена на моделях острого экссудативного воспаления как при однократном внутрибрюшинном введении [6, 7], так и накожном нанесении в лекарственной форме для наружного применения (5% гель) [8].
Цель данной работы состояла в исследовании способности гимантана влиять на активность фосфолипазы А2 (КФ 3.1.1.4., ФЛА2) и уровень ЦОГ-2 (КФ 1.14.99.1.) при экссудативном воспалении, а также в оценке его действия на вызванный конканавалином А отек лапы у мышей при внутрибрюшинном введении раствора субстанции гимантана и накожном нанесении гимантана в лекарственной форме для наружного применения при однократном и курсовом (10 дней) применении.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Использовали половозрелых аутбредных мышей-самцов массой 26–29 г, полученных из питомника лабораторных животных филиала “Столбовая” ФГБУН НЦБМТ ФМБА. Организацию и проведение работ осуществляли в соответствии с ГОСТ 33 216–2014 “Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами”, ГОСТ 33 215–2014 “Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур” и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 года по охране животных, используемых в научных целях. Проведение экспериментов одобрено Комиссией по биомедицинской этике ФГБНУ “НИИ фармакологии имени В.В. Закусова”.
Дозы, способы введения. Гимантан (субстанция) синтезирован и предоставлен химико-технологической лабораторией ФГБНУ “НИИ фармакологии имени В.В. Закусова”; лекарственная форма гимантана для наружного применения (5% гель, состав: гимантан – 2.5 г, гидроксипропилметилцеллюлоза – 1.0 г, нипагин – 0.075 г, нипазол – 0.025 г, диметилсульфоксид – 5.0 г, вода очищенная до 50.0 г) разработана и предоставлена лабораторией готовых лекарственных форм ФГБНУ “НИИ фармакологии имени В.В. Закусова”.
Модель уксусного перитонита у мышей. Уксусный перитонит у мышей моделировали путем внутрибрюшинного введения 1% раствора уксусной кислоты (из расчета 1 мл раствора на 100 г массы тела) [9]. Гимантан в дозе 20 мг/кг вводили внутрибрюшинно за 40 мин до индукции воспаления. Также за 40 мин до введения раствора уксусной кислоты мышам контрольных групп – группе пассивного контроля (мышам которой не вводили раствор уксусной кислоты, а вместо него вводили эквивалентный объем растворителя – физиологического раствора) и группе активного контроля (мышам вводили раствор уксусной кислоты) внутрибрюшинно вводили растворитель – физиологический раствор в объеме 10 мл/кг массы тела. Через 3 ч после введения раствора уксусной кислоты или физиологического раствора мышей подвергали эвтаназии методом цервикальной дислокации и в брюшную полость животных вводили 3 мл натрий-фосфатного буфера (4°C, pH 7.4), делали легкий массаж брюшной стенки и собирали перитонеальную жидкость. Супернатант перитонеальной жидкости получали центрифугированием при 5000 об/мин в течение 15 мин на центрифуге-встряхивателе медицинской СМ-70М-07 с 36-местным универсальным угловым ротором (производитель – ELMI лабораторное оборудование) и до проведения биохимического исследования хранили при температуре –20°С.
Модель отека, вызванного конканавалином А, у мышей. Отек лапы у мышей вызывали субплантарным введением (в подушечку задней̆ стопы) раствора конканавалина А (Кон А, Sigma-Aldrich) в дозе 100 мкг/20 г массы тела (концентрация раствора 5 мг/мл), в контралатеральную конечность мышам вводили эквивалентный объем изотонического раствора натрия хлорида [10]. Через 1 ч после введения Кон А мышей подвергали эвтаназии методом цервикальной дислокации, определяли массу задних лап и подсчитывали индекс реакции воспаления (Ир) по формуле:
В ФГБНУ “НИИ фармакологии имени В.В. Закусова” разработана лекарственная форма гимантана для наружного применения, и ее использование у грызунов с моделями экссудативного воспаления лап позволяет оценить действие изучаемого производного адамантана при непосредственном нанесении в область повреждения тканей. Ввиду этого в эксперимент по оценке действия гимантана на выраженность экссудативной воспалительной реакции у мышей с вызванным Кон А отеком лапы включены группы мышей, которым гимантан как вводили внутрибрюшинно, так и наносили в виде лекарственной формы для наружного применения накожно на заднюю лапу животных.
Оценку влияния гимантана при внутрибрюшинном введении и наружном нанесении в виде 5% гелевой лекарственной формы на вызванное Кон А воспаление проводили в двух экспериментах при превентивном применении препарата: однократном или курсовом (10 дней), при котором последнее применение препарата осуществляли за 1 ч до индукции воспаления. В первом эксперименте изучали противовоспалительное действие гимантана при однократном внутрибрюшинном введении в дозах 10 и 20 мг/кг или при однократном нанесении на лапу 5% геля; во втором опыте гимантан вводили внутрибрюшинно в дозе 10 мг/кг или наносили наружно (5% гель) ежедневно 1 раз в сутки в течение 10 дней. Животным контрольных групп обеих экспериментальных серий внутрибрюшинно вводили физиологический раствор однократно или в течение 10 дней соответственно схеме применения препаратов. В день проведения экспериментов гимантан животным вводили внутрибрюшинно или наносили наружно в виде 5% геля за 1 ч до субплантарного введения раствора Кон А.
Определение активности фосфолипазы А2 (ФЛА2) в перитонеальном экссудате. Определение активности ФЛА2 осуществляли флуориметрически. В качестве субстрата для ФЛА2 использовали умбеллифериларахидонат (Sigma-Aldrich, США). Гидролиз субстрата регистрировали по приросту флуоресценции при 460 нм (возбуждение при 380 нм) на микропланшетном ридере Varioscan LUX (ThermoFisher, США). Интенсивность флуоресценции коррелировала с количеством образующегося 7-гидроксикумарина. Количество гидролизованного субстрата определяли по калибровочной кривой, построенной по стандарту 7-гидроксикумарина. Субстрат готовили, смешивая 0.1 мкМ умбеллифериларахидоната с 0.9 мкМ 1-олеоил-2-стеароил-sn-3-фосфохолином в хлороформе. Растворитель удаляли в токе азота. Липидную пленку ресуспендировали до конечной концентрации в 1 мл 10 мМ буферного раствора HEPES (pH 7.0), содержащего 0.1 мМ EDTA, и смесь обрабатывали ультразвуком (22 кГц, ультразвуковой дезинтегратор УЗДН-1 У 4.2 № 242-1974, ТУ 25-05-1375-73, СССР) в течение 3–5 мин. Полученную суспензию разводили в 10 раз перед использованием в 1 мл буфера, содержащего 50 мМ Трис-HCl (pH 8.0), 0.1 мМ EDTA, 1.1 мМ CaCl2 при 30°С в микропланшетном ридере. Скорость сольволиза умбеллифериларахидоната мониторировали в течение 2–3 мин до начала реакции, которую запускали добавлением 100 мкл перитонеальной жидкости. Скорость ферментативной реакции рассчитывали после вычитания скорости сольволиза. Реакцию останавливали добавлением 5 мМ EGTA, 1 мМ дитиотреитола и 10 мМ глицерина с последующей обработкой ультразвуком [11].
Определение уровня ЦОГ-2 в перитонеальном экссудате. Определение уровня ЦОГ-2 в перитонеальном экссудате у мышей осуществляли методом иммуноферментного анализа, используя набор фирмы Calbiochem (CBA053), на микропланшетном ридере Varioscan LUX (ThermoFisher). Набор фирмы Calbiochem (CBA053) включает в себя 96-гнездный микропланшет, покрытый моноклональными анти-ЦОГ-2 антителами (Sigma-Aldrich), конъюгаты козьего антимышиного IgG, пероксидазу и специальный раствор для остановки реакции. Стандарты и образцы добавляют в ячейки, где ЦОГ-2 связывается с антителами. Добавление субстрата для пероксидазы 5,5'-тетраметилбензидина (Sigma-Aldrich) приводит к образованию синей окраски. Реакцию останавливают специальным раствором, содержащим 0.1 н серную кислоту.
Измеряли оптическую плотность при 450 нм с длиной волны сравнения 595 нм на микропланшетном ридере Varioscan LUX (ThermoFisher). Уровень ЦОГ-2 вычисляли по стандартной кривой, выполненной для стандарта рекомбинантной ЦОГ-2 (Sigma-Aldrich). При определении количества фермента в исследуемых образцах использовали 100 мкл перитонеальной жидкости (приблизительно 2–5 мг/мл общего белка).
Статистическую обработку результатов экспериментов проводили с помощью языка программирования R версии 3.5.1 [12]. Нормальность распределения данных проверяли критерием Шапиро–Уилка с последующей оценкой межгруппового равенства дисперсий критерием Бартлетта. При наличии нормального распределения в группах и равенства дисперсий для дальнейшей статистической обработки использовали дисперсионный анализ (ANOVA) и критерий Ньюмена–Кейлса, при их отсутствии – критерий Краскела–Уоллиса и критерий Манна–Уитни. Различия между группами считали статистически значимыми при p ≤ 0.05. Результаты на рисунках представлены в зависимости от использования параметрических или непараметрических методов анализа: в случае применения параметрической статистики – как среднее ± стандартное отклонение; в случае анализа непараметрическими методами – в виде боксплотов. Рисунки выполнены с помощью программы GraphPad Prism V. 8.4.3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
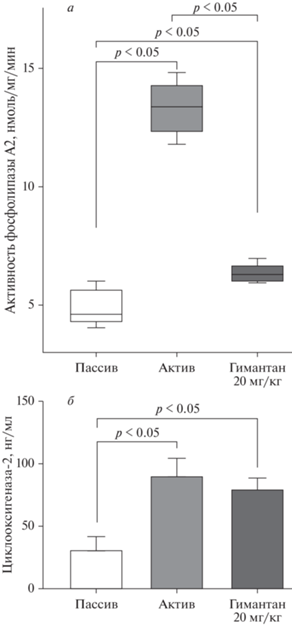
Полученные ранее экспериментальные данные свидетельствуют о том, что гимантан, как и ингибирующие ЦОГ нестероидные противовоспалительные препараты, эффективен на моделях экссудативного воспаления [5–8]. Поэтому в проводимом нами исследовании активность ФЛА2, уровень ЦОГ-2 и влияние гимантана на эти показатели оценивали у мышей с уксусным перитонитом – моделью острого экссудативного воспаления, позволяющей получить для анализа достаточный объем биологического материала – перитонеального экссудата. Результаты проведенного эксперимента свидетельствуют о том, что активность ФЛА2 в перитонеальном экссудате мышей группы “Активный контроль”, собранном через 3 ч после внутрибрюшинного введения им раствора уксусной кислоты (время, когда экссудативное воспаление у мышей с этой моделью максимально выражено), возросла в 2.9 раза по сравнению с показателем в группе животных без уксусного перитонита (группа “Пассивный контроль”). Гимантан при внутрибрюшинном введении в эффективной на этой модели дозе 20 мг/кг снижал повышенную при воспалении активность ФЛА2 в 2.1 раза (рис. 1а). Уровень ЦОГ-2 в перитонеальном экссудате мышей с уксусным перитонитом повысился в 2.9 раза, но гимантан не оказал значимого влияния на этот показатель (рис. 1б).
Рис. 1.
Влияние гимантана на активность фосфолипазы А2 (а) и уровень циклооксигеназы-2 (б) в перитонеальном экссудате мышей с уксусным перитонитом. а – Данные представлены в виде боксплотов (нормальность распределения в группах и/или равенство дисперсий отсутствовали); б – данные представлены в виде среднего значения и стандартного отклонения (нормальное распределение в группах, равенство дисперсий соблюдалось). Пассив – “Пассивная группа”, группа мышей, которым не вводили раствор уксусной кислоты, а вместо него вводили эквивалентный объем растворителя – физиологического раствора. Актив – “Активная группа”, группа мышей, которым внутрибрюшинно вводили 1% раствор уксусной кислоты. Гимантан 20 мг/кг – группа мышей с уксусным перитонитом, которым за 40 мин до его индукции внутрибрюшинно вводили гимантан в дозе 20 мг/кг. В каждой группе по 8 мышей.
Ранее было установлено, что гимантан в дозе 20 мг/кг (внутрибрюшинно) снижает повышенный при воспалении уровень продуктов свободнорадикального окисления (СРО) липидов, реагирующих с 2-тиобарбитуровой кислотой (ТБК), в перитонеальном экссудате мышей с гликогеновым перитонитом и крыс с уксусным перитонитом [5]. Гимантан снижает экссудативное воспаление у крыс с каррагинановым отеком лапы как при внутрибрюшинном введении в дозе 20 мг/кг, так и при местном нанесении на заднюю лапу в лекарственной форме для наружного применения (5% гель). При этом гимантан в виде 5% геля выраженно (на 62%) снижает повышенный уровень ТБК-активных продуктов СРО липидов в гомогенатах мягких тканей лап крыс с каррагинановым отеком, превосходя по этой способности гимантан при внутрибрюшинном введении [8]. Гимантан влияет на уровень ТБК-активных продуктов СРО липидов и в условиях других моделей патологических состояний у животных. Так, он уменьшает повышенный уровень продуктов СРО липидов в структурах головного мозга мышей C57BL/6 c 1-метил-4-фенил-1,2,3,6-тетрагидропиридин-индуцированным паркинсоническим синдромом и аутбредных крыс с 6-гидроксидофамин-индуцированным паркинсоническим синдромом [13]. Кроме того, установлено, что гимантан снижает уровень малонового диальдегида в системе аскорбат-зависимого СРО липидов в гомогенате печени интактных крыс [14].
Выраженность воспалительной реакции зависит не только от уровня и активности ЦОГ, но и от количества ее субстрата арахидоновой кислоты в составе клеточных мембран. Так, установлено, что потребление эйкозапентаеновой и докозагексаеновой кислот приводит к увеличению их содержания в составе фосфолипидов мембран клеток, и это происходит в основном за счет снижения в них арахидоновой кислоты [1]. Хотя эйкозапентаеновая кислота, как и арахидоновая кислота, является субстратом ЦОГ, ЛОГ и цитохрома P450, из-за структурных различий этих кислот из нее образуются эйкозаноиды, которые зачастую обладают меньшей биологической активностью, чем продуцируемые из арахидоновой кислоты [15–17]. Кроме того, известно, что эйкозапентаеновая и докозагексаеновая кислоты способны ингибировать метаболизм арахидоновой кислоты и экспрессию ЦОГ-2 [18, 19].
В отсутствие влияния на ЦОГ-2 гимантан снижал повышенную при воспалении активность ФЛА2 в перитонеальном экссудате мышей с уксусным перитонитом. Подавлением активности ФЛА2 достигается уменьшение продукции субстрата ЦОГ – арахидоновой кислоты и, соответственно, обеспечивающих развитие воспалительной реакции простагландинов и лейкотриенов [20]. Гимантан является низкоаффинным неконкурентным блокатором NMDA-рецепторов [21, 22], которые локализованы в том числе в энтеральной нервной системе [23, 24] и на лимфоцитах [25–27]. ФЛА2 относится к кальций-зависимым ферментам [28], поэтому способность гимантана влиять на повышенную при воспалении активность ФЛА2 может быть обусловлена снижением входа кальция в клетки за счет блокады NMDA-рецепторов.
Гимантан обладает высокой липофильностью и проявляет мембранотропные свойства [5]. Обладающие мембранотропной активностью соединения могут влиять на воспалительный процесс [4], поэтому представляет интерес изучение влияния гимантана при превентивном однократном и курсовом применении на экссудативное воспаление с целью выявления усиления его противовоспалительного эффекта при курсовом применении. Например, влияние на состав фосфолипидов мембран уже упоминаемых выше эйкозапентаеновой и докозагексаеновой кислот зависит как от дозы, так и от длительности их потребления [4, 29, 30]. Для реализации этой задачи в качестве модели экссудативного воспаления выбрана модель отека лапы у мышей, вызванного субплантарным введением Кон А. Ранее было установлено, что гимантан при однократном внутрибрюшинном введении в дозах 10, 20 и 40 мг/кг снижает выраженность вызванного Кон А отека лапы у мышей и повышенный в их крови уровень интерлейкина 6 (ИЛ-6) [7]. Так как повышение экспрессии ИЛ-6 может происходить за счет ее стимуляции простагландином Е2 [31], снижение уровня ИЛ-6 в крови мышей с воспалением после введения им гимантана объясняется влиянием препарата на повышенную при экссудативном воспалении активность ФЛА2, отвечающей за образование предшественника простагландинов – арахидоновой кислоты.
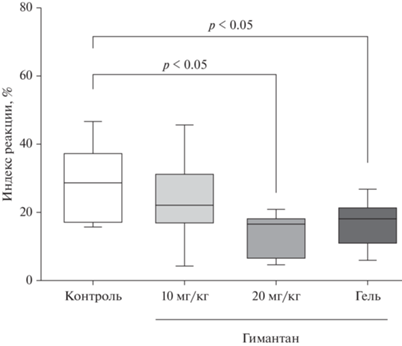
При изучении влияния однократного превентивного применения гимантана на воспаление лапы у мышей установлено, что при внутрибрюшинном введении препарат оказывает дозозависимый противовоспалительный эффект. Гимантан в дозе 10 мг/кг значимого влияния на вызванный Кон А отек лапы мышей не оказывал, а в дозе 20 мг/кг подавлял его выраженность на 41.5% по сравнению с контрольной группой животных (p < < 0.05). Эффективность гимантана в лекарственной форме для наружного применения не отличалась от эффективности препарата при внутрибрюшинном введении в дозе 20 мг/кг: при однократном нанесении 5% геля гимантана выраженность отека снижалась на 36.5% (рис. 2). Ранее было показано, что гимантан при внутрибрюшинном введении в дозе 10 мг/кг способен снижать вызванный Кон А отек лап у мышей линии CBA (масса 18–20 г) [7]. Отсутствие значимого влияния гимантана при внутрибрюшинном введении в дозе 10 мг/кг в этом исследовании мы объясняем тем, что у аутбредных мышей (масса 26–29 г) развилось более выраженное воспаление, чем в проведенном ранее опыте на мышах линии CBA.
Рис. 2.
Влияние гимантана при однократном внутрибрюшинном введении и наружном нанесении гелевой лекарственной формы на заднюю конечность на вызванный конканавалином А отек стопы у мышей. Контроль – группа мышей с вызванным конканавалином А отеком стопы. В каждой группе 11–12 животных. Индекс реакции (%) рассчитывали по формуле, приведенной в разделе “Материалы и методы“. Данные представлены в виде боксплотов (нормальность распределения в группах и/или равенство дисперсий отсутствовали).
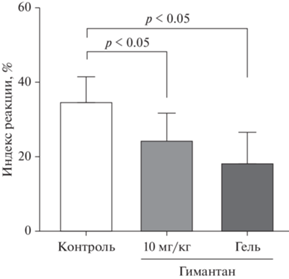
Эксперименты по изучению влияния курсового превентивного применения гимантана на выраженность вызванного Кон А отека лап у мышей показали, что у животных контрольной группы развилось более выраженное воспаление, чем у контрольных животных в эксперименте, оценивающем влияние однократного применения препарата. Об этом свидетельствует увеличение индекса реакции воспаления от 28.6 до 34.8 (рис. 2, 3). Несмотря на это, превентивное курсовое (ежедневно, 1 раз в день) внутрибрюшинное введение гимантана в дозе 10 мг/кг в течение 10 дней привело к усилению его антиэкссудативного эффекта по сравнению с однократным введением в этой дозе: препарат значимо снижал выраженность отека лапы у мышей на 29.5% по сравнению с контрольной группой. При курсовом превентивном применении гимантана в лекарственной форме для наружного применения было зафиксировано более выраженное снижение воспаления лапы у мышей – на 47.2% по сравнению с контрольной группой, что мы связываем с большей концентрацией действующего вещества в зоне повреждения тканей (рис. 3). Известно, что NMDA-рецепторы расположены на немиелинизированных аксонах в области дермоэпидермального соединения [32], и при воспалении количество сенсорных аксонов, на которых локализованы ионотропные глутаматные рецепторы, увеличивается [33]. Кроме того, установлено, что при воспалении усиление чувствительности к механическим и тепловым раздражителям обусловлено повышением активности NMDA-рецепторов [34]. Поэтому противовоспалительный эффект гимантана при вызванном Кон А отеке лап мышей, более выраженный при нанесении гимантана в лекарственном форме для наружного применения, вероятно, в том числе объясняется снижением повышенной при воспалении активности ФЛА2 вследствие уменьшения поступления кальция в клетки поврежденных тканей при блокаде гимантаном NMDA-рецепторов.
Рис. 3.
Влияние гимантана при внутрибрюшинном введении и наружном нанесении гелевой лекарственной формы на заднюю конечность в течение 10 дней на вызванный конканавалином А отек стопы у мышей. Контроль – группа мышей с вызванным конканавалином А отеком стопы. В каждой группе 11–12 животных. Индекс реакции (%) рассчитывали по формуле, приведенной в разделе “Материалы и методы”. Данные представлены в виде среднего значения и стандартного отклонения (нормальное распределение в группах, равенство дисперсий соблюдалось).
Таким образом, результаты экспериментов по оценке влияния превентивного однократного и курсового применения гимантана при внутрибрюшинном введении и накожном нанесении в лекарственной форме для наружного применения на острое экссудативное воспаление свидетельствуют о том, что курсовое превентивное применение препарата способствует усилению его противовоспалительного эффекта.
ЗАКЛЮЧЕНИЕ
Оценено влияние производного адамантана N-(2-адамантил)-гексаметиленимина гидрохлорида (гимантана) на повышенные при остром экссудативном воспалении активность фосфолипазы А2 и уровень циклооксигеназы-2 у мышей. Установлено, что гимантан не влияет на повышенный при воспалении уровень циклооксигеназы-2, но снижает повышенную активность фосфолипазы А2. Зарегистрированное в проведенном исследовании влияние гимантана на активность фосфолипазы А2 расширяет представление о его механизме действия. Наряду с этим изучено противовоспалительное действие гимантана при однократном и курсовом превентивном применении на выраженность острого экссудативного воспаления лап у мышей. Установлено, что курсовое превентивное применение препарата в течение 10 дней (1 раз в день) как при внутрибрюшинном введении, так и накожном нанесении в лекарственной форме для наружного применения способствует усилению его противовоспалительного эффекта.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена в рамках Госзадания по теме № 0521-2019-0007.
Соответствие принципам этики. Все применимые международные принципы ухода и использования животных были соблюдены. Проведение экспериментов одобрено Комиссией по биомедицинской этике ФГБНУ “НИИ фармакологии имени В.В. Закусова”.
Список литературы
Calder P.C., Albers R., Antoine J.-M., Blum S., Bourdet-Sicard R., Ferns G.A., Folkerts G., Friedmann P.S., Frost G.S., Guarner F., Løvik M., Macfarlane S., Meyer P. D., M’Rabet L., Serafini M., van Eden W., van Loo J., Vas Dias W., Vidry S., Winklhofer-Roob B.M., Zhao J. 2009. Inflammatory disease processes and interactions with nutrition. Br. J. Nutr. 101 (Suppl. 1), S1–S45.
Calder P.C, Ahluwalia N., Albers R., Bosco N., Bourdet-Sicard R., Haller D., Holgate S.T., Jönsson L.S., Latulippe M.E., Marcos A., Moreines J., M’Rini C., Müller M., Pawelec G., van Neerven R.J.J., Watzl B., Zhao J. 2013. A consideration of biomarkers to be used for evaluation of inflammation in human nutritional studies. Br. J. Nutr. 109 (Suppl. 1), S1–S34.
Sviridov D., Mukhamedova N., Miller Y. I. 2020. Lipid rafts as a therapeutic target. J. Lipid. Res. 61 (5), 687–695.
Calder P. 2020. N-3 PUFA and inflammation: From membrane to nucleus and from bench to bedside. Proc. Nutr. Soc. 79 (4), 404–416.
Матюшкин А.И., Иванова Е.А., Золотов Н.Н., Воронина Т.А. 2019. Мембранотропные и антиоксидантные свойства гимантана. Эксперим. и клин. фармакол. 82 (4), 28–31.
Иванова Е.А., Капица И.Г., Непоклонов А.В., Кокшенев И.И., Вальдман Е.А., Воронина Т.А. 2013. Противовоспалительная активность гимантана на моделях периферического воспаления и нейровоспаления, индуцированного липополисахаридом. Хим.-фарм. журн. 47 (10), 12–15.
Таллерова А.В., Иванова Е.А., Капица И.Г., Коваленко Л.П., Вальдман Е.А., Воронина Т.А. 2013. Влияние противопаркинсонического препарата гимантан на уровень цитокинов в эксперименте. Иммунология. 34 (5), 254–257.
Матюшкин А.И., Иванова Е.А., Золотов Н.Н., Воронина Т.А. 2020. Противовоспалительные свойства гимантана в лекарственной форме для наружного применения на моделях каррагенанового и декстрансульфатного отеков у крыс. Эксперим. клин. фармакол. 83 (5), 29–32.
Шварц Г.Я., Сюбаев Р.Д. 2012. Методические рекомендации по изучению нестероидных противовоспалительных лекарственных средств. В кн: Руководство по проведению доклинических исследований лекарственных средств. Под общ. ред. Миронова А.Н. Часть 1. М.: Гриф и К, с. 746–758.
Коваленко Л.П., Федосеева В.Н., Дурнев А.Д., Иванова А.С., Мастернак Т.Б., Миронов А.Н., Арзамасцев Е.В., Гуськова Т.А., Жоголева И.Б., Верстакова О.Л., Радченко Л.У. 2012. Методические рекомендации по изучению аллергизирующих свойств лекарственных средств. В кн: Руководство по проведению доклинических исследований лекарственных средств. Под общ. ред. Миронова А.Н. Часть 1. М.: Гриф и К, с. 51–63.
Huang Z., Laliberté F., Tremblay N.M., Weech P.K., Street I. P. 1994. Continuous fluorescence-based assay for the human high-molecular-weight cytosolic phospholipase A2. Anal. Biochem. 222 (1), 110–115.
Chan B.K.C. 2018. Data analysis using R programming. Adv. Exp. Med. Biol. 1082, 47–122.
Иванова Е.А., Капица И.Г., Золотов Н.Н., Вальдман Е.А., Непоклонов А.В., Колясникова К.Н., Воронина Т.А. 2016. Влияние гимантана на уровень продуктов перекисного окисления липидов в головном мозге при экспериментальном паркинсоническом синдроме. Фармакокинетика и фармакодинамика. 3, 9–12.
Вальдман Е.А. Разработка фармакологического средства патогенетической терапии паркинсонизма на основе анализа механизмов действия производных аминоадамантана. Дис. … докт. мед. наук. М.: НИИ фармакологии РАМН, 2001.
Goldman D.W., Pickett W.C., Goetzl E.J. 1983. Human neutrophil chemotactic and degranulating activities of leukotriene B5 (LTB5) derived from eicosapentaenoic acid. Biochem. Biophys. Res. Commun. 117 (1), 282–288.
Lee T.H., Mencia-Huerta J.-M., Shih C., Corey E.J., Lewis R.A., Austen K.F. 1984. Characterization and biologic properties of 5,12-dihydroxy derivatives of eicosapentaenoic acid, including leukotriene-B5 and the double lipoxygenase product. J. Biol. Chem. 259 (4), 2383–2389.
Bagga D., Wang L., Farias-Eisner R., Glaspy J.A., Reddy S.T. 2003. Differential effects of prostaglandin derived from ω-6 and ω -3 polyunsaturated fatty acids on COX-2 expression and IL-6 secretion. Proc. Natl. Acad. Sci. USA. 100 (4), 1751–1756.
Lee S.A., Kim H.J., Chang K.C., Baek J.C., Park J.K., Shin J.K., Choi W.J., Lee J.H., Paik W.Y. 2009. DHA and EPA down-regulate COX-2 expression through suppression of NF-κB activity in LPS-treated human umbilical vein endothelial cells. Korean J. Physiol. Pharmacol. 13 (4), 301–307.
Baker E.J., Valenzuela C.A., De Souza C.O., Yaqoob P., Miles E.A., Calder P.C. 2020. Comparative anti-inflammatory effects of plant- and marine-derived omega-3 fatty acids explored in an endothelial cell line. Biochim. Biophys. Acta Mol. Cell Biol. Lipids. 1865 (6), 158662.
Murakami M., Nakatani Y., Atsumi G.I., Inoue K., Kudo I. 2017. Regulatory functions of phospholipase A2. Crit. Rev. Immunol. 37 (2–6), 127–195.
Елшанская М.В., Соболевский А.И., Вальдман Е.А., Ходоров Б.И. 2001. Эксперим. клин. фармакол. 64 (1), 18–21.
Воронина Н.А., Лисина О.Ю., Красильникова И.А., Кучеряну В.Г., Капица И.Г., Воронина Т.А., Сурин А.М. 2021. Влияние гимантана на изменения Са2+ и Nа+, вызванные активацией NMDA-каналов в культивируемых нейронах мозга крысы. Нейрохимия. 8 (1), 3–13.
Suckow S.K., Caudle R.M. 2009. NMDA receptor subunit expression and PAR2 receptor activation in colospinal afferent neurons (CANs) during inflammation induced visceral hypersensitivity. Mol. Pain. 5, 54.
Golovynska I., Beregova T.V., Falalyeyeva T.M., Stepanova L.I., Golovynskyi S., Qu J., Ohulchanskyy T.Y. 2018. Peripheral N-methyl-D-aspartate receptor localization and role in gastric acid secretion regulation: Immunofluorescence and pharmacological studies. Sci. Rep., 8, 7445.
Boldyrev A.A., Kazey V.I., Leinsoo T.A., Mashkina A.P., Tyulina O.V., Johnson P., Tuneva J.O., Chittur S., Carpenter D.O. 2004. Rodent lymphocytes express functionally active glutamate receptors. Biochem. Biophys. Res. Commun. 324 (1), 133–139.
Miglio G., Varsaldi F., Lombardi G. 2005. Human T lymphocytes express N-methyl-D-aspartate receptors functionally active in controlling T cell activation. Biochem. Biophys. Res. Commun. 338 (4), 1875–1883.
Orihara K., Odemuyiwa S.O., Stefura W.P., Ilarraza R., HayGlass K.T., Moqbel R. 2017. Neurotransmitter signalling via NMDA receptors leads to decreased T helper type 1-like and enhanced T helper type 2-like immune balance in humans. Immunology. 153 (3), 368–379.
Murakami M., Kudo I. 2002. Phospholipase A2. J. Biochem. 131 (3), 285–292.
Browning L.M., Walker C.G., Mander A.P., West A.L., Madden J., Gambell J.M., Young S., Wang L., Jebb S.A., Calder P.C. 2012. Incorporation of eicosapentaenoic and docosahexaenoic acids into lipid pools when given as supplements providing doses equivalent to typical intakes of oily fish. Am. J. Clin. Nutr. 96 (4), 748–758.
Rees D., Miles E.A., Banerjee T., Wells S.J., Roynette C.E., Wahle K.W., Calder P.C. 2006. Dose-related effects of eicosapentaenoic acid on innate immune function in healthy humans: A comparison of young and older men. Am. J. Clin. Nutr. 83 (2), 331–342.
Cho J.-S., Han I.-H., Lee H.R., Lee H.-M. 2014. Prostaglandin E2 induces IL-6 and IL-8 production by the EP receptors/Akt/NF-κB pathways in nasal polyp-derived fibroblasts. Allergy Asthma Immunol. Res. 6 (5), 449–457.
Coggeshall R.E., Carlton S.M. 1998. Ultrastructural analysis of NMDA, AMPA, and kainate receptors on unmyelinated and myelinated axons in the periphery. J. Comp. Neurol. 391 (1), 78–86.
Carlton S.M., Coggeshall R.E. 1999. Inflammation-induced changes in peripheral glutamate receptor populations. Brain Res. 820 (1–2), 63–70.
Du J., Zhou S., Coggeshall R.E., Carlton S.M. 2003. N-methyl-D-aspartate-induced excitation and sensitization of normal and inflamed nociceptors. Neuroscience. 118 (2), 547–562.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


