Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 1, стр. 61-65
Выработка активных форм кислорода генетически кодируемыми фотосенсибилизаторами 4D5scFv-miniSOG и DARPin-miniSOG внутри живых клеток
Г. М. Прошкина a, *, Е. И. Шрамова a, С. М. Деев a, b
a Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
b Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
(Сеченовский Университет)
119991 Москва, Россия
* E-mail: gmb@ibch.ru
Поступила в редакцию 01.09.2022
После доработки 04.10.2022
Принята к публикации 05.10.2022
- EDN: NTUFGR
- DOI: 10.31857/S0233475523010073
Аннотация
В настоящее время в экспериментальной онкологии развиваются подходы, основанные на разработке адресных фотосенсибилизаторов, которые можно доставлять специфично к опухоли определенного молекулярного профиля. Данная работа посвящена изучению генерации активных форм кислорода фотосенсибилизаторами белковой природы 4D5scFv-miniSOG и DARPin-miniSOG, специфичными к онкомаркеру HER2. Установлено, что, несмотря на наличие одного и того же фототоксического модуля в своем составе, данные фотосенсибилизаторы характеризуются различным уровнем производства АФК, что, возможно, объясняется различной скоростью рецептор-опосредованной интернализации 4D5scFv-miniSOG и DARPin-miniSOG.
ВВЕДЕНИЕ
Фотодинамическая терапия представляет собой одну из интересных реализаций фотонной терапии для лечения рака. Терапевтический эффект достигается за счет использования фотосенсибилизаторов (ФС) органического (порфирины, фталоцианины и др.) или неорганического (например, наночастицы TiO2, CdSe/CdS, ZnO) происхождения, способных генерировать активные формы кислорода (АФК), включая синглетный кислород и свободные радикалы. Раковые клетки уничтожаются за счет передачи энергии от фотосенсибилизаторов, активируемых светом, к кислороду, что вызывает внутриклеточный окислительный стресс вследствие генерации АФК. Именно АФК, образующиеся при фотовозбуждении ФС, вызывают повреждение ДНК, белков и липидов раковых клеток. Данный подход отличается селективностью и локальностью терапевтического воздействия на опухоль, поскольку разрушение раковых клеток происходит только при облучении зоны опухоли светом определенной длины волны, необходимой для возбуждения накопившегося в клетках ФС [1, 2].
В настоящее время в экспериментальной онкологии развиваются подходы, основанные на разработке адресных ФС, представляющих собой химические конъюгаты с направляющими модулями белковой природы.
Опухоль-ассоциированный антиген HER2 (рецептор 2 эпидермального фактора роста человека), являющийся рецепторной тирозинкиназой, представляет собой привлекательную мишень для адресной терапии рака, поскольку он сверхэкспрессируется в 15–25% случаев рака молочной железы человека и его наличие коррелирует с агрессивной формой развития заболевания [3, 4].
Создание фототоксичных белков KillerRed [5] и miniSOG [6], способных к производству АФК, натолкнуло исследователей на мысль о создании адресных генетически кодируемых ФС. В качестве адресной молекулы может использоваться антитело, его фрагмент или искусственные белки неиммуноглобулиновой природы [7–9].
Фототоксичный белок miniSOG сконструирован на основе фототропина 2 Arabidopsis thaliana и содержит флавинмононуклеотид в качестве кофактора [6]. В хромофорном кармане кофактор связан с белковой глобулой нековалентно. Именно кофактор ФМН определяет фототоксические (генерацию АФК) и флуоресцентные свойства miniSOG под действием синего света [6, 10, 11].
Ранее нами были получены генетически кодируемые ФС на основе miniSOG, способные специфично и селективно взаимодействовать с рецептором HER2 на поверхности раковых клеток [12, 13]. В качестве HER2-специфичного домена в составе ФС использовали мини-антитело scFv4D5 [14] или DARPin_9-29 [15].
Оказалось, что при наличии одного и того же фототоксического модуля в своем составе данные ФС обладают различным цитотоксическим эффектом в отношении HER2-положительных раковых клеток in vitro. Так, IC50 для 4D5scFv-miniSOG составила 0.16 мкМ, в то время как для DARPin-miniSOG это значение равно 0.8 мкМ [12, 13]. Мы предположили, что возможным объяснением такой разницы в цитотоксичности может быть различная способность генерации АФК. Работа посвящена изучению фотоиндуцированной токсичности генетически кодируемыми ФС (4D5scFv-miniSOG и DARPin-mini-SOG) внутри живой клетки.
МАТЕРИАЛЫ И МЕТОДЫ
Клеточные линии. В работе использовали HER2-положительную клеточную линию аденокарциномы протоков молочной железы BT-474 (ATCC HTB-20) и линию аденокарциномы молочной железы с нормальным уровнем экспрессии рецептора HER2 – MDA-MB-231 (ATCC HTB-26). Клетки культивировали в среде RPMI-1640, содержащей 10% эмбриональной сыворотки теленка, 2 мМ L-глутамина, 100 мкг/мл стрептомицина и 100 мкг/мл пенициллина при +37°С в атмосфере с 5% СО2. Для проточной цитометрии и опытов по определению АФК снятие клеток с подложки проводили раствором Версена (ПанЭко, Россия) без использования трипсина.
Наработка белков. Экспрессию генов, кодирующих гибридные белки 4D5scFv-miniSOG и DARPin-miniSOG проводили в штамме Escherichia coli BL21(DE3) по методу автоиндукции [16]. Трансформанты E. coli культивировали в среде для автоиндукции ТВР-5052, содержащей 0.1 г/л ампициллина, при 25°C с интенсивной аэрацией до OD600 12–14 ч. Клетки собирали центрифугированием при 6000 g в течение 10 мин при 4°С. Осадок ресуспендировали в лизирующем буфере (20 мМ фосфат натрия (Na-Pi), 500 мМ NaCl, рН 7.5, 50 мкг/мл лизоцима), обрабатывали ультразвуком на ультразвуковом дезинтеграторе VibraCell (Sonics, США) (режим: 30 раз по 10 с с интервалом в 10 с). Клеточный дебрис удаляли центрифугированием при 15 000 g в течение 20 мин при 4°С. Осветленный лизат пропускали через фильтр 0.22 мкм и наносили на колонку Ni2+-NTA (GE Healthcare, США), уравновешенную буфером следующего состава: 20 мМ Na-Pi, pH 7.5, 500 мМ NaCl, 30 мМ имидазол. Последующую очистку целевого белка проводили в соответствии с инструкциями производителя колонки His-tag (GE Healthcare, США). Выход очищенного белка составил 40 мг на 1 л культуры для DARPin-miniSOG и 25 мг на 1 л культуры для 4D5scFv-miniSOG.
Проточная цитометрия. Клетки снимали с подложки раствором Версена, осаждали центрифугированием при 100 g в течение 2 мин и ресуспендировали в среде RPMI-1640 без сыворотки до конечной концентрации 106 клеток/мл. К 100 мкл клеточной суспензии добавляли 4D5scFv-miniSOG или DARPin-miniSOG до конечной концентрации 250 нМ. Инкубацию проводили в течение 10 мин в темноте при 37°С, после чего клетки отмывали трижды от не связавшегося с рецептором белка. Флуоресценцию детектировали с использованием проточного цитометра NovoCyte 3000 (ACEA Biosciences) при следующих параметрах: возбуждение – лазер с длиной волны 488 нм, детекция флуоресценции – фильтр 530 ± 30 нм. Для каждого образца исследовали не менее 10 000 событий.
Измерение АФК в живых клетках. Уровень внутриклеточных АФК в клетках BT-474, инкубированных с 4D5scFv-miniSOG и DARPin-miniSOG, определяли путем окрашивания клеток флуоресцентным красителем карбокси-2',7'-дихлордигидрофлуоресцеиндиацетатом (carboxy-H2DCFDA, Invitrogen). Для оценки продукции АФК при фотосенсибилизации, опосредованной внешним источником излучения, клетки высевали в 96-луночный планшет и выращивали в течение ночи. Затем к клеткам добавляли белки 4D5scFv-miniSOG или DARPin-miniSOG до конечной концентрации 500 нМ, инкубировали 10 мин при 37°С, отмывали от не связавшихся с рецептором молекул ФС и подвергали облучению светодиодом (465 нм, 55 мВт/см2, Ledszone) в течение 10 мин при 37°С. В качестве положительного контроля продукции АФК использовали клетки, обработанные 50 мМ H2O2 при 37°C в течение 30 мин. В качестве отрицательного контроля использовали клетки, инкубированные с 4D5scFv-miniSOG и DARPin-miniSOG, но не подвергнутые облучению. Клетки промывали фосфатно-солевым буфером и инкубировали в ростовой среде с 10 мМ карбокси-H2DCFDA в течение 1 ч при 37°C. Флуоресценцию окисленной формы карбокси-H2DCFDA измеряли на планшетном спектрофлуориметре Infinite Pro M1000 (Tecan) с возбуждением при 485 нм и эмиссией в диапазоне 500–̶ 650 нм с шагом 2 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка взаимодействия с рецептором HER2 гибридных белков 4D5scFv-miniSOG и DARPin-miniSOG. Эффективность взаимодействия HER2-специфичных адресных ФС 4D5scFv-miniSOG и DARPin-miniSOG с рецептором HER2 на поверхности раковых клеток оценивали методом проточной цитометрии. Для этого клетки инкубировали с 4D5scFv-miniSOG или DARPin-miniSOG, как описано в “Материалах и методах”. В качестве контроля специфичности взаимодействия использовали клетки аденокарциномы молочной железы MDA-MB-231, характеризующиеся нормальным для клеток эпителиального происхождения уровнем экспрессии рецептора HER2 [17]. Как видно из результатов проточной цитометрии (рис. 1а и 1б), оба белка, 4D5scFv-miniSOG и DARPin-miniSOG, одинаково эффективно взаимодействуют с рецептором HER2 на поверхности HER2-положительных раковых клеток, о чем свидетельствует значительный сдвиг медианы флуоресценции относительно клеток, не обработанных белком. В то же время для клеток MDA-MB-231, инкубированных с 4D5scFv-miniSOG или DARPin-miniSOG, сдвиг медианы флуоресценции относительно контроля остается незначительным (рис. 1б).
Рис. 1.
Функциональная характеристика адресного и цитотоксического модуля в составе генетически кодируемых ФС 4D5scFv-miniSOG и DARPin-miniSOG. а, б – Взаимодействие 4D5scFv-miniSOG и DARPin-miniSOG с рецептором HER2 на поверхности клеток SK-BR-3 (а) и MDA-MB-231 (б). Зеленая кривая соответствует клеткам, не обработанным белками (контроль автофлуоресценции), красная и синяя кривые соответствуют клеткам, обработанным DARPin-miniSOG и 4D5scFv-miniSOG соответственно. в – Определение уровня АФК, индуцируемых 4D5scFv-miniSOG и DARPin-miniSOG при облучении в живой клетке.
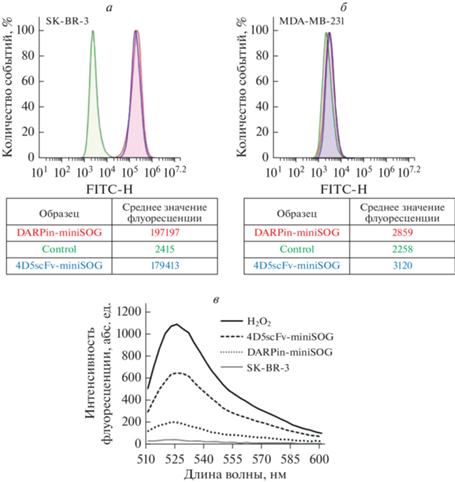
Оценка уровня АФК в живых клетках. Принимая во внимание данные проточной цитометрии и данные по цитотоксичности 4D5scFv-miniSOG и DARPin-miniSOG, полученные нами ранее [12, 13], мы предположили, что значительная разница в вызываемом цитотоксическом эффекте этих двух ФС при одинаково эффективном взаимодействии с рецептором, может быть обусловлена различным уровнем генерации АФК.
Для того чтобы оценить уровень продукции АФК, клетки BT-474 инкубировали с белками 4D5scFv-miniSOG или DARPin-miniSOG в течение 10 мин, облучали синим светом и измеряли АФК согласно протоколу, описанному в “Материалах и методах”. Оказалось, что уровень АФК в клетках, обработанных 4D5scFv-miniSOG, примерно в 4 раза выше, чем в клетках, обработанных DARPin-miniSOG (рис. 1в). Вероятным объяснением этому факту может быть различная скорость рецептор-опосредованной интернализации белков 4D5scFv-miniSOG и DARPin-miniSOG, связанная с размером белков. Как было показано нами ранее, DARPin-miniSOG локализуется в ранних эндосомах через 5–7 мин после начала инкубации, попадая в дальнейшем на терминальную деградацию в лизосомы [13], в то время как процесс интернализации 4D5scFv-miniSOG занимает до 30 мин [12]. Кроме того, также ранее было установлено, что интенсивность флуоресценции 4D5scFv-miniSOG и DARPin-miniSOG на поверхности HER2-положительных клеток в условиях, исключающих процесс рецептор-опосредованной интернализации, одинакова [18], а фототоксичность DARPin-miniSOG повышается, если проводить облучение клеток синим светом при пониженной температуре (4°С); IC50 в этом случае составляла 0.2 мМ [19]. Известно, что при пониженной температуре происходит замедление процесса рецептор-опосредованной интернализации. Таким образом, увеличение времени нахождения на мембране или в липидном бислое для DARPin-miniSOG приводит к тому, что его фотоиндуцированный цитотоксический эффект становится сравним с эффектом от 4D5scFv-miniSOG. Известно, что наибольшие фотодинамические повреждения от ФС можно ожидать, когда он локализуется в клеточной мембране, поскольку именно мембрана является главной мишенью для АФК, продуцируемых ФС [20]. Дополнительным фактором, способствующим повреждению липидов при фотодинамической терапии, является высокая растворимость молекулярного кислорода в липидах. Таким образом, в липидной среде у ФС больше шансов, чем в воде, столкнуться с O2 и выработать АФК. Более того, если в клетке образуются АФК, существует множество ферментативных и неферментативных способов поддержания внутриклеточного окислительно-восстановительного гомеостаза и защиты клетки от различных типов оксидантов. Система защиты клетки от АФК представлена глутатионом, супероксиддисмутазами, пероксиредоксинами, а также белками семейств тиоредоксина и глутаредоксина, каждый из которых имеет специфическую субклеточную локализацию и активность [21]. Принимая во внимание эти факты, а также наши данные по уровню генерации АФК, можно заключить, что скорость интернализации для генетически кодируемых ФС является одним из важных параметров, определяющих фототоксичность 4D5scFv-miniSOG и DARPin-miniSOG.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источник финансирования. Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации, соглашение № 075-15-2020-773.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Dougherty T.J., Kaufman J.E., Goldfarb A., Weishaupt K.R., Boyle D., Mittleman A. 1978. Photoradiation therapy for the treatment of malignant tumors. Cancer Res. 38 (8), 2628–2635.
Castano A.P., Mroz P., Hamblin M.R. 2006. Photodynamic therapy and anti-tumour immunity. Nat Rev Cancer. 6 (7), 535–545.
Slamon D.J., Clark G.M., Wong S.G., Levin W.J., Ullrich A., McGuire W.L. 1987. Human breast cancer: Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 235 (4785), 177–182.
Gusterson B.A., Gelber R.D., Goldhirsch A., Price K.N., Save-Soderborgh J., Anbazhagan R., Styles J., Rudenstam C.M., Golouh R., Reed R. 1992. Prognostic importance of c-erbB-2 expression in breast cancer. International (Ludwig) Breast Cancer Study Group. J. Clin. Oncol. 10 (7), 1049–1056.
Bulina M.E., Chudakov D.M., Britanova O.V., Yanushevich Y.G., Staroverov D.B., Chepurnykh T.V., Merzlyak E.M., Shkrob M.A., Lukyanov S., Lukyanov K.A. 2006. A genetically encoded photosensitizer. Nat. Biotechnol. 24 (1), 95–99.
Shu X., Lev-Ram V., Deerinck T.J., Qi Y., Ramko E.B., Davidson M.W., Jin Y., Ellisman M.H., Tsien R.Y. 2011. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 9 (4), e1001041.
Serebrovskaya E.O., Edelweiss E.F., Stremovskiy O.A., Lukyanov K.A., Chudakov D.M., Deyev S.M. 2009. Targeting cancer cells by using an antireceptor antibody-photosensitizer fusion protein. Proc. Natl. Acad. Sci. USA. 106 (23), 9221–9225.
Shipunova V.O., Deyev S.M. 2022. Artificial scaffold polypeptides as an efficient tool for the targeted delivery of nanostructures in vitro and in vivo. Acta Naturae. 14 (1), 54–72.
Tolmachev V.M., Chernov V.I., Deyev S.M. 2022. Targeted nuclear mediine. Seek and destroy. Russ. Chem. Rev. 91, RCR5034. https://doi.org/10.1070/RCR5034
Shramova E.I., Chumakov S.P., Shipunova V.O., Ryabova A.V., Telegin G.B., Kabashin A.V., Deyev S.M., Proshkina G.M. 2022. Genetically encoded BRET-activated photodynamic therapy for the treatment of deep-seated tumors. Light Sci. Appl. 11 (1), 38.
Zhai Y., Huang X., Zhang K., Huang Y., Jiang Y., Cui J., Zhang Z., Chiu C.K.C., Zhong W., Li G. 2022. Spatiotemporal-resolved protein networks profiling with photoactivation dependent proximity labeling. Nat. Commun. 13 (1), 4906.
Mironova K.E., Proshkina G.M., Ryabova A.V., Stremovskiy O.A., Lukyanov S.A., Petrov R.V., Deyev S.M. 2013. Genetically encoded immunophotosensitizer 4D5scFv-miniSOG is a highly selective agent for targeted photokilling of tumor cells in vitro. Theranostics. 3 (11), 831–840.
Proshkina G.M., Shilova O.N., Ryabova A.V., Stremovskiy O.A., Deyev S.M. 2015. A new anticancer toxin based on HER2/neu-specific DARPin and photoactive flavoprotein miniSOG. Biochimie. 118, 116–122.
Worn A., Plückthun A. 2001. Stability engineering of antibody single-chain Fv fragments. J. Mol. Biol. 305 (5), 989–1010.
Binz H.K., Amstutz P., Kohl A., Stumpp M.T., Briand C., Forrer P., Grutter M.G., Plückthun A. 2004. High-affinity binders selected from designed ankyrin repeat protein libraries. Nat. Biotechnol. 22 (5), 575–582.
Studier F.W. 2014. Stable expression clones and auto-induction for protein production in E. coli. Methods Mol. Biol. 1091, 17–32.
Subik K., Lee J.F., Baxter L., Strzepek T., Costello D., Crowley P., Xing L., Hung M.C., Bonfiglio T., Hicks D.G., Tang P. 2010. The expression patterns of ER, PR, HER2, CK5/6, EGFR, Ki-67 and AR by immunohistochemical analysis in breast cancer cell lines. Breast Cancer (Auckl). 4, 35–41.
Кузичкина Е.О., Шилова О.Н., Деев С.М. 2018. Механизм тушения флуоресценции белковых фотосенсибилизаторов на основе miniSOG в процессе интернализации рецептора HER2. Acta Naturae. 10 (4), 87–94.
Шилова О.Н., Прошкина Г.М., Лебеденко Е.Н., Деев С.М. 2015. Интернализация и рециркуляция рецептора HER2 при взаимодействии адресного фототоксичного белка DARPin-miniSOG с клетками аденокарциномы молочной железы человека. Acta Naturae. 7 (3), 141–148.
Girotti A.W. 2001. Photosensitized oxidation of membrane lipids: Reaction pathways, cytotoxic effects, and cytoprotective mechanisms. J. Photochem. Photobiol. B. 63 (1–3), 103–113.
Finkel T. 2011. Signal transduction by reactive oxygen species. J. Cell Biol. 194 (1), 7–15.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


