Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 1, стр. 55-60
Два типа клеточных биосенсоров серотонина
О. А. Рогачевская a, *, А. П. Черкашин a, Е. Е. Копылова a, М. Ф. Быстрова a
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Пущино, Московская обл., Россия
* E-mail: o.rogachevskaja@gmail.com
Поступила в редакцию 31.08.2022
После доработки 28.09.2022
Принята к публикации 30.09.2022
- EDN: NTZCSG
- DOI: 10.31857/S0233475523010085
Аннотация
Метод клеточных биосенсоров, позволяющий локально детектировать вещества, секретируемые одиночными клетками, традиционно используется в изучении периферической вкусовой системы. В основе этого метода лежит клетка, экспрессирующая рецептор секретируемой молекулы, который обычно сопряжен с мобилизацией Са2+. Таким образом, высвобождение нейротрансмиттера исследуемыми клетками можно отслеживать в реальном времени по Са2+-сигналам в клетках-биосенсорах. Определенной особенностью таких сенсоров является то, что Са2+-сигналы, инициируемые лигандами GPCR-рецепторов, могут генерироваться по принципу “все или ничего” за счет участия Ca2+-индуцированного выброса Ca2+ (CICR), являющегося триггер-подобным механизмом. По ответам такого биосенсора можно констатировать сам факт секреции нейромедиатора, но для изучения регуляций, влияющих на количество высвобождаемого нейромедиатора, такие биосенсоры малопригодны. С этой точки зрения градуальные биосенсоры, которые используют иные сигнальные системы, например сАМР-систему, могут оказаться более информативным. Нами были получены биосенсоры серотонина двух типов. Один биосенсор был получен на основе клеток CHO, экспрессирующих рекомбинантный рецептор 5-НТ2С, сопряженный фосфолипазным путем с мобилизацией внутриклеточного Са2+. Другой биосенсор представлял собой клетки HEK-293, экспрессирующие как рецептор 5-НТ4, сопряженный с активацией аденилатциклазы, так и флуоресцентный белок Pink Flamindo (НЕК/5-НТ4/PF), являющийся генетически кодируемым молекулярным сенсором сАМР. Хотя оба клеточных биосенсора позволяли детектировать серотонин в наномолярных концентрациях, 5-НТ2С-положительные клетки генерировали Са2+-ответы в соответствии с принципом “все или ничего”. Между тем в клетках, экспрессирующих рецептор 5-НТ4 и Pink Flamindo, серотонин-индуцируемые сАМР-сигналы градуально возрастали с концентрацией агониста в области 0.3–30 нМ. Представляется, что НЕК/5-НТ4/PF биосенсор вполне пригоден для исследований механизмов регуляции секреции серотонина.
ВВЕДЕНИЕ
Изучение секреции сигнальных молекул на уровне одиночной клетки сопряжено с необходимостью мониторинга секретируемого соединения в локальной области пространства и в режиме реального времени. Эффективным подходом для решения этой задачи является метод клеточного биосенсора. В основе этого метода лежит клетка, экспрессирующая рецептор секретируемой молекулы, который сопряжен с сигнальной системой, активность которой можно тем или иным образом детектировать. Обычно используются гептаспиральные рецепторы (G-protein-coupled receptor, GPCR), рекомбинантные или эндогенные, которые сопряжены с мобилизацией внутриклеточного Са2+. Методы мониторинга последнего в реальном времени хорошо отработаны [1]. С использованием метода клеточного биосенсора была проанализирована секреция различных нейротрансмиттеров, идентифицированных во вкусовой почке, таких как серотонин [2], АТР [3, 4], норадреналин [5], GAMK [6] и ацетилхолин [7]. Серотонин – первый нейромедиатор, идентифицированный во вкусовой системе вначале иммуногистохимически, а затем физиологически и методом клеточного биосенсора [2, 8]. Считается, что экзоцитозный механизм обеспечивает секрецию серотонина в ответ на вкусовую стимуляцию вкусовых клеток III типа. В режиме on-line это впервые было показано с использованием клеток CHO, стабильно экспрессирующих рекомбинантный рецептор 5-HT2C [2], и в этой работе решалась задача демонстрации стимул-зависимого выброса серотонина. Между тем количественные характеристики секреции, например анализ зависимости количества секретируемого серотонина от интенсивности вкусового стимула, требуют градуального сенсора, т.е. сенсора, ответы которого пропорциональны локальной концентрации соединения, высвобожденного клеткой за определенное время. В предыдущих работах было показано, что многие клетки в ответ на агонисты GPCR-рецепторов генерируют Са2+-сигналы по принципу “все или ничего” [9, 10]. Иными словами, при разных дозах выше пороговой, агонисты инициировали Са2+-сигналы, практически идентичные по амплитуде и близкие по форме. Возникает вопрос, можно ли получить градуальный клеточный сенсор серотонина путем гетерологичной экспрессии серотониновых GPCR-рецепторов, сопряженных фосфоинозитидным каскадом с мобилизацией Са2+, к которым относятся серотониновые рецепторы 5-HT2 типа [11]. На базе клеток CHO, трансфицированных плазмидой для гетерологичной экспрессии рецептора 5-НТ2С, нами был получен сенсор, способный детектировать серотонин в наномолярной области концентраций. Оказалось, однако, что 5-НТ2С-положительные клетки CHO генерировали Са2+-ответы на серотонин по принципу “все или ничего” и, следовательно, были непригодны для количественного анализа секреции. Следует отметить, что семейство GPCR-рецепторов серотонина включает рецепторы, сопряженные с аденилатциклазой [12], например 5-HT4, который стимулирует продукцию сАМР. Учитывая разницу в работе аденилатциклазной системы и системы Са2+-сигнализации, можно было ожидать, что клеточный сенсор серотонина на основе 5-HT4-рецептора окажется градуальным. Развитие генетически кодируемых флуоресцентных зондов предоставляет в настоящий момент возможность on-line мониторинга внутриклеточного сАМР. В частности, таким сенсором является Pink Flamindo (РF) [13], интенсивность флуоресценции которого растет с сАМР в физиологической области концентраций. В данной работе мы провели сравнительный анализ двух различных клеточных биосенсоров серотонина – CHO/5-НТ2С и НЕК/5-HT4/PF.
МАТЕРИАЛЫ И МЕТОДЫ
Молекулярная биология. Для клонирования рецепторов серотонина (5-HT2С, 5-НТ4) из мозга мыши с использованием набора GenElute Mammalian Total RNA Miniprep Kit (Sigma) была выделена тотальная РНК. Методом реакции обратной транскрипции с применением набора SuperScript IV VILO Master Mix (Invitrogene) в присутствии олиго(dТ)-праймеров была получена кДНК, которая служила матрицей для дальнейших ПЦР. Для амплификации полноразмерного рецептора 5-HT2С выбрана последовательность, кодирующая 5-HT2С (Htr2c, NM_008312.4), которая включает нуклеотиды 689-2065. ПЦР проводили с ген-специфичными праймерами TAAGAATTCTGGCCACCATGGTGAACCTGGGCACT и TATGTCGACTGCACACTACTAATCCTCTCGCTG, включающие сайты рестрикции EcoRI и SalI, по которым полученный транскрипт клонировали в плазмидный вектор pDsRed-Monomer-N1 (Clontech). Эта плазмида обеспечивала экспрессию химерного белка, состоящего из рецептора серотонина 5-НТ2С, на N-конце которого находится красный флуоресцентный белок DsRed. Последовательность рецептора 5-НТ4 (Htr4, NM_008313.4), включающую нуклеотиды 207-1376, амплифицировали с помощью праймеров TATAAGCTTCCTGTAATGGACAAACTTGATG и TATAAGCTTAGTATCACTGGGCTGAGC. ПЦР-продукт был клонирован по сайту HindIII в вектор pAcGFP1-Hyg-N1 (Takara Bio). Сконструированная плазмида обеспечивала экспрессию 5-НТ4 рецептора серотонина, слитого с зеленым флуоресцентным белком. Клонирование и наработка плазмид в препаративных количествах осуществлялась в соответствии с протоколами, подробно описанными нами ранее [9, 14].
Трансфекция клеток и получение моноклональных линий клеток-сенсоров. Клетки трансфицировали плазмидными векторами набором для трансфекции FuGENE 6 (Promega) по оптимизированному согласно рекомендациям производителя протоколу, используя 1 мкг конструкта pDsRed-Monomer-N1/5-HT2C или смесь двух плазмид в равном соотношении: 0.5 мкг pAcGFP1-Hyg-N1/5-НТ4 + + 0.5 мкг Pink Flamindо (#102356, Addgene) для трансфекции (2–4) × 105 клеток в 1 лунке 12-лучночного планшета. Из популяции трансфицированных клеток с помощью многоступенчатого последовательного отбора, включающего применение селективных антибиотиков, клеточного сортера, визуального контроля и физиологического тестирования (подобно полученным ранее клеткам [9, 14]), были получены две моноклональные линии клеток-сенсоров, СНО/5-НТ2С и НЕК/5-HT4/PF.
Культура клеток. Клетки линий CHO-K1 и НЕК-293 (Российская коллекция клеточных культур позвоночных) и модифицированные моноклональные линии CHO/5-HT2C и НЕК/5-HT4/PF культивировали в среде F12 (Invitrogen) и DMEM (Invitrogen) с высоким содержанием глюкозы соответственно, с добавлением 10% эмбриональной бычьей сыворотки (HyClone), 100 мг/мл гентамицина (Sigma), 2 мМ глутамина (Sigma) (ростовая среда) во влажной атмосфере c 5% содержанием CO2 в воздухе при 37 C. Для культивирования полученных моноклональных линий дополнительно добавляли к 1 мл ростовой среды 300 мкг антибиотика G418 (Invivogen) для клеток CHO/5-HT2C и 300 мкг G418 + 200 мкг гигромицина (Hygromycin B, Invivogen) для клеток НЕК/5-HT4/PF.
Мониторинг внутриклеточных сигналов клеток-сенсоров. Перед экспериментом клетки снимали с культурального пластика 0.25% раствором трипсина (Sigma-Aldrich), а затем прикрепляли ко дну фотометрической камеры с помощью адгезивного материала Cell Tak (Corning). При дальнейших манипуляциях клетки находились во внеклеточном растворе, содержащем (мМ): 130 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 10 HEPES, pH 7.4, 10 глюкозы (все соли и буферы произведены Sigma-Aldrich). Для загрузки флуоресцентным Ca2+-зондом клетки СНО/5-НТ2С инкубировали 30 мин в присутствии 4 мкМ Fluo-8 AM (ATTBioqest) и 0.02% детергента Pluronic (Molecular Probes). Затем клетки отмывали внеклеточным раствором и выдерживали в нем в течение 1 ч. Клетки НЕК/5-HT4/PF перед экспериментом инкубировали 1.5 ч в фотометрической камере в физиологическом растворе. Описанные манипуляции и дальнейшие эксперименты проводили при комнатной температуре (22–24°С). Фотометрические эксперименты осуществляли с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss), оборудованного объективом Plan NeoFluar 20×/0.75 и цифровой EMCCD камерой LucaR (Andor Technology). Флуоресценцию клеток СНО/5-НТ2С возбуждали на длине волны 480 ± 10 нм, эмиссию регистрировали в области 520 ± 20 нм, что соответствует спектральным характеристикам Fluo-8. Изменение уровня Са2+ в цитоплазме оценивали по относительному изменению интенсивности флуоресценции Fluo-8 ΔF/F0, где ΔF = F – F0, F и F0 – интенсивность эмиссии Са2+-зонда в текущий момент времени и в начале регистрации, соответственно. Флуоресценцию клеток НЕК/5-HT4/PF возбуждали при 572 ± 17.5 нм, эмиссию регистрировали в области 634 ± 34 нм, что соответствует характеристикам флуоресцентного белка Pink Flamindo. Количественный фотометрический анализ изображений осуществляли с использованием программы NIS-Elements AR 5.3 (Nikon). Полученные экспериментальные данные обрабатывали с помощью программы Sigma Plot 14.5 (Systat Software Inc). В работе использовали серотонин (Tocris Bioscience), апплицируя его путем полной замены раствора в фотометрической камере с помощью системы перфузии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
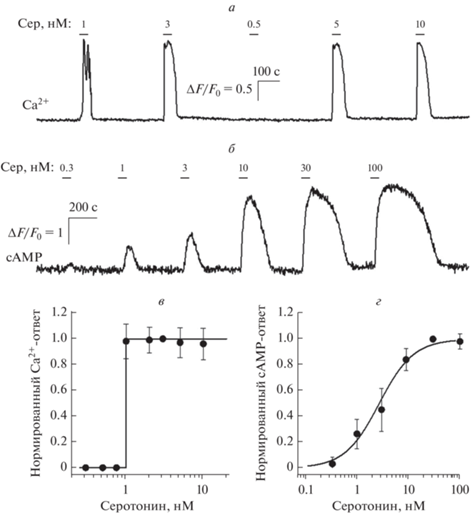
Основываясь на предыдущем опыте получения клеточных моноклонов [9, 14], мы получили собственную линию клеток СНО, стабильно экспрессирующую рекомбинантный рецептор 5-HT2C мыши. Далее были получены несколько моноклональных линий СНО/5-HT2C, большая часть клеток которых генерировала Ca2+-сигналы в ответ на серотонин с порогом 1–3 нМ (рис. 1а) и обладала высокой степенью селективности. Нам удалось многократно наблюдать выброс серотонина из отдельных вкусовых клеток III типа, однако полученные нами клетки СНО/5-НТ2С реагировали на появление нейромедиатора по принципу “все или ничего”, т.е. не реагировали на подпороговые концентрации серотонина, но генерировали одинаково максимальный Ca2+-сигнал при пороговых и значительно превосходящих порог концентрациях серотонина. (рис. 1в). Такое поведение биосенсора не позволяет проводить исследования количественной регуляции секреции серотонина.
Рис. 1.
Биосенсоры серотонина. а – Мониторинг внутриклеточного Ca2+ в 5-HT2C-положительной CHO-клетке по флуоресценции Fluo-8 при последовательной стимуляции серотонином в указанных концентрациях. б – Мониторинг внутриклеточного сАМР с помощью сенсора Pink Flamindo в клетке HEK-293, экспрессирующей рецептор 5-HT4 при последовательной стимуляции серотонином в указанных концентрациях. в – Кривая доза–ответ для биосенсора СНО/5-HT2C. В каждом конкретном эксперименте изменения концентрации Ca2+ (ΔF/F0), вызванные серотонином в данной концентрации, нормировались на серотониновый ответ при 3 нМ. Данные представлены как среднее ± стандартное отклонение (n = 46). Сплошная линия представляет собой функцию Хевисайда H(S-1) от концентрации серотонина S. г – Кривая доза–ответ для биосенсора НЕК/5-HT4/PF. В каждом конкретном эксперименте cAMP-ответы на серотонин в различных концентрациях нормировались на cAMP-ответ, вызванный 30 нМ серотонина. Данные представлены как среднее ± стандартное отклонение (n = 31). Сплошная прямая представляет уравнение Хилла R = Sn/($S_{{0.5}}^{n}$ + Sn) для нормированного cAMP-ответа R при коэффициенте Хилла n = 1.3 и концентрации полуэффекта S0.5 = 27 нМ.
Ранее было показано, что механизм “все или ничего” характерен для агонист-индуцированных Са2+-ответов мезенхимальных стромальных клеток из жировой ткани человека [15]. Ряд фактов свидетельствовал о том, что в основе этого явления лежит механизм CICR, который обеспечивает генерацию относительно универсальных ответов при разных дозах агонистов [15, 16]. Вероятно, механизм CICR присущ всем клеткам, экспрессирующим IP3- и рианодиновые рецепторы [17, 18]. Таким образом, для получения градуального клеточного биосенсора серотонина следовало использовать другой рецептор-сигнальный каскад.
Семейство рецепторов серотонина включает семь типов рецепторов (5-НТ1-7), шесть из которых являются GPCR (G-protein coupled receptors) рецепторами, а 5-HT3 представляет собой лиганд-управляемый катионный канал [12]. Поскольку нами исследовалась зависимость секреции серотонина не только от величины прикладываемого стимула, но и от внеклеточного Са2+, рецепторы семейства 5-НТ3, как и рецепторы, связанные с мобилизацией Са2+, не соответствовали нашим требованиям. Известно, что серотониновый рецептор 5-HT4 в основном сопряжен со стимуляцией аденилатциклазы, а не с мобилизацией Ca2+ [19]. Учитывая, что сАМР-сигнализация не включает в себя какой-либо триггероподобный механизм, такой как CICR [20], мы ожидали, что в 5-HT4-положительных клетках серотонин будет вызывать сАМР-сигналы, которые градуально увеличиваются с ростом дозы агониста. On-line мониторинг внутриклеточного сАМР стал возможен относительно недавно с появлением генетически кодируемых сенсоров, включая белок Pink Flamindo, флуоресценция которого зависит от концентрации сАМР в клетке [13].
Для получения клеточного биосенсора мы клонировали рецептор 5-HT4 из мозга мыши и экспрессировали его в клетках HEK-293 одновременно с генетически кодируемым сАМР-сенсором Pink Flamindo [13]. Было показано, что лишь небольшая часть 5-HT4-положительных клеток генерирует хорошо детектируемые сАМР-сигналы, проявлявшиеся в форме повышения флуоресценции Pink Flamindo, в ответ на серотонин в области наномолярных концентраций (рис. 1б). Используя методы клеточной селекции для отбора максимально чувствительных клеток, нам удалось получить несколько моноклональных линий клеток HEK/5-HT4/PF, большинство из которых демонстрировали достаточную чувствительность к серотонину и показывали градуальную зависимость внутриклеточных сАМР-сигналов от концентрации наружного серотонина. Полученные клетки НЕК/5-HT4/PF обычно отвечали на 1 нМ серотонина, хотя отдельные клетки могли детектировать появление агониста и при существенно меньших концентрациях. Насыщение сАМР-ответов достигалось при 20 нМ агониста. Таким образом, второй полученный нами клеточный биосенсор серотонина НЕК/5-HT4/PF характеризуется градуальной зависимостью доза – ответ в диапазоне 1–20 нМ (рис. 1г). Это позволило нам более детально исследовать секрецию серотонина вкусовыми клетками в разных физиологических условиях и при различных условиях стимуляции [9].
Авторы благодарят Д.М. Поташникову за помощь в проведении работ по сортировке клеток на клеточном сортере FACSAria SORP в рамках Программы развития МГУ.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при поддержке гранта РНФ № 19-75-10 068.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Neher E. 1995. The use of Fura-2 for estimating Ca buffers and Ca fluxes. Neuropharm. 11, 1423–1442.
Huang Y.J., Maruyama Y., Lu K.S., Pereira, E., Plonsky, I., Baur, J.E., Wu, D., Roper, S.D. 2005. Mouse taste buds use serotonin as a neurotransmitter. J. Neurosci. 25, 843–847.
Huang, Y.J., Maruyama Y., Dvoryanchikov G., Pereira E., Chaudhari N., Roper S.D. 2007. The role of pannexin 1 hemichannels in ATP release and cell-cell communication in mouse taste buds. Proc. Natl. Acad. Sci. USA. 104, 6436–6441.
Romanov R.A., Rogachevskaja O.A., Bystrova M.F., Jiang P., Margolskee R.F., Kolesnikov S.S. 2007. Afferent neurotransmission mediated by hemichannels in mammalian taste cells. EMBO J. 26, 657–667.
Huang Y.A., Maruyama Y., Roper S.D. 2008. Norepinephrine is coreleased with serotonin in mouse taste buds. J. Neurosci. 28, 13088–13093.
Huang Y.A., Pereira E., Roper S.D. 2011. Acid stimulation (sour taste) elicits GABA and serotonin release from mouse taste cells. PLoS ONE. 6, e25471.
Dando, R., Roper, S.D. 2012. Acetylcholine is released from taste cells, enhancing taste signalling. J. Physiol. 590, 3009–3017.
Yee C.L., Yang R., Bottger B., Finger T.E., Kinnamon J.C. 2001. “Type III” cells of rat taste buds: immunohistochemical and ultrastructural studies of neuron-specific enolase, protein gene product 9.5, and serotonin. J. Comp. Neurol. 440 (1), 97–108.
Cherkashin A.P., Rogachevskaja O.A., Kabanova N.V., Kotova P.D., Bystrova M.F., Kolesnikov S.S. 2022. Taste cells of the type III employ CASR to maintain steady serotonin exocytosis at variable Ca2+ in the extracellular medium. Cells. 11(8), 1369.
Kotova P.D., Bystrova M.F., Rogachevskaja O.A., Khokhlov A.A., Sysoeva V.Y., Tkachuk V.A., Kolesnikov S.S. 2018. Coupling of P2Y receptors to Ca2+ mobilization in mesenchymal stromal cells from the human adipose tissue. Cell Calcium. 71, 1–14.
Berg K.A., Clarke W.P., Sailstad C., Saltzman A., Maayani S. 1994 Signal transduction differences between 5-hydroxytryptamine type 2A and type 2C receptor systems. Mol. Pharmacol. 46, 477–484.
Barnes N.M., Ahern G.P., Becamel C., Bockaert J., Camilleri M., Chaumont-Dubel S., Claeysen S., Cunningham K.A., Fone K. C., Gershon M., Di Giovanni G., Goodfellow N.M., Halberstadt A.L., Hartley R.M., Hassaine G., Herrick-Davis K., Hovius R., Lacivita E., Lambe E.K., Leopoldo M., Levy F.O., Lummis S.C.R., Marin P., Maroteaux L., McCreary A.C., Nelson D.L., Neumaier J.F., Newman-Tancredi A., Nury H., Roberts A., Roth B. L., Roumier A., Sanger G.J., Teitler M., Sharp T., Villalón C.M., Vogel H., Watts S.W., Hoyer D. 2021. Classification of receptors for 5-hydroxytryptamine. Pharmacology and Function. Pharmacol. Rev. 73 (1), 310–520.
Harada K., Ito M., Wang X., Tanaka M., Wongso D., Konno A., Hirai H., Hirase H., Tsuboi T., Kitaguchi T. 2017. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Sci. Rep. 7, 735.
Котова П.Д., Рогачевская О.А. 2020. Клеточная тест-система с генетически кодируемыми сенсорами цитоплазматического и ретикулярного кальция. Биол. мембраны. 37 (5), 373–380.
Kotova P.D., Sysoeva V.Y., Rogachevskaja O.A., Bystrova M.F., Kolesnikova A.S., Tyurin-Kuzmin P.A., Fadeeva J.I., Tkachuk V.A., Kolesnikov S.S. 2014. Functional expression of adrenoreceptors in mesenchymal stromal cells derived from the human adipose tissue. Biochim. Biophys. Acta. 1843, 1899–1908.
Kaimachnikov N.P., Kotova P.D., Kochkina E.N., Rogachevskaja, O.A., Khokhlov A.A., Bystrova M.F., Kolesnikov S.S. 2021. Modeling of Ca2+ transients initiated by GPCR agonists in mesenchymal stromal cells. BBA Adv. 1, 100012.
Park J.B., Lee C.S., Jang J.H., Ghim J., Kim Y.J., You S., Hwang D., Suh P. G., Ryu S.H. 2012. Phospholipase signalling networks in cancer. Nat. Rev. Cancer. 12, 782–792.
Atakpa-Adaji P., Thillaiappan N.B., Taylor C.W. 2020. IP3 receptors and their intimate liaisons. Curr. Opin. Physiol. 17, 9–16.
Masson J., Emerit M.B., Hamon M., Darmon M. 2012. Serotonergic signaling: Multiple effectors and pleiotropic effects. WIREs Membr. Transp. Signal 1, 685–713.
Sassone-Corsi P. 2012. The cyclic AMP pathway. Cold Spring Harb. Perspect. Biol. 4, a011148.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


