Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 1, стр. 19-42
Механочувствительные каналы: история, многообразие, механизмы
С. Сухарев a, b, *, А. Анишкин a, **
a Кафедра биологии, Университет Мэриленда
20742 Мэрилэнд, Колледж Парк, США
b Институт физических наук и технологий, Университет Мэриленда
20742 Мэрилэнд, Колледж Парк, США
* E-mail: sukharev@umd.edu
** E-mail: anisan@umd.edu
Поступила в редакцию 02.09.2022
После доработки 10.09.2022
Принята к публикации 12.09.2022
- EDN: NUDIVL
- DOI: 10.31857/S0233475523010103
Аннотация
Многие клеточные процессы порождают механические напряжения. Деление клеток, их сократительная активность, а также адгезия создают внутренние напряжения в клетках, в то время как изменения во окружающей среде, такие как осмотический стресс, прямое механическое давление, сдвиговые деформации или звук, представляют собой внешние возмущения, силу которых клетки оценивают и на которые реагируют. Механочувствительные (МЧ) ионные каналы являются самыми быстрыми механoэлектрическими преобразователями (сенсорами) и представляют собой полифилетическую группу, характеризуемую многообразием белковых структур. В этом обзоре мы кратко проследим историю этой области, стараясь придерживаться хронологии в представлении основных результатов, опишем структурные особенности различных групп МЧ-каналов и проиллюстрируем некоторые общие физические принципы механизмов их функционирования.
ВВЕДЕНИЕ
Клетки сами генерируют напряжения и испытывают внешние механические воздействия разных масштабов. Они неизбежно генерируют силы по мере продвижения по клеточному циклу в результате сократительной активности, миграции в ходе дифференцировки и эмбрионального роста, а также в результате метаболической активности, которая создает осмотический дисбаланс. Клетки также воспринимают внешние силы, характерные для их конкретной среды, их локализации и функции в ткани. В то время как обычные соматические клетки, например, клетки хрящей или сосудистых стенок, испытывают значительное давление или растяжение, что является частью их нормальной среды, высокоспециализированные сенсорные клетки, такие как волосковые клетки внутреннего уха, настроены на гораздо меньшие механические стимулы.
Механочувствительные (МЧ) ионные каналы – не единственные клеточные сенсоры, реагирующие на механические напряжения. Другими такими структурами являются молекулы, которые соединяют цитоскелет с фокальными контактами (талин), а также связанные с фокальными контактами киназы. Они чувствительны к напряжениям в цитоскеклете и способны запускать перестройку и дифференцировку клеток [1]. Есть сообщения о рецепторах, связанных с G-белками, которые в отсутствие лигандов реагируют на растяжение мембран, запуская каскады вторичных мессенджеров [2]. В качестве еще одного примера может быть приведена бактериальная осмосенсорная киназа EnvZ, которая меняет активность в ответ на гидратационные стрессы, вызываемые изменениями ионной силы и концентрации макромолекул в цитоплазме [3].
МЧ-каналы отличаются от других рецепторов, потому что они находятся в мембранах, разделяющих различные компартменты, и непосредственно реагируют либо на силы в окружающем их липидном бислое, либо в ассоциированных элементах цитоскелета или внеклеточного матрикса. Они используют энергию уже существующих градиентов концентраций ионов или других растворенных веществ для преобразования механических напряжений в электрические или химические сигналы. МЧ-каналы открываются непосредственно механическими силами без каких-либо промежуточных химических стадий, поэтому являются самые быстрыми преобразователями механических стимулов. Например, время отклика слуховых каналов на смещение пучков волосковых клеток, вызванных давлением света, составляет 10 мкс [4]. Это позволяет нам слышать широкий диапазон частот и наслаждаться музыкой. Тактильные рецепторы в коже также характеризуются коротким латентным периодом и демонстрируют спектр адаптивных реакций, включающий кратковременные (фазовые) или продолжительные (тонические) сигналы [5], что позволяет нам детально определять наощупь жесткость и текстуру поверхности. Бактериальные механочувствительные каналы призваны компенсировать летальный эффект клеточного набухания при внезапном осмотическом шоке. Они работают как быстродействующие клапаны, которые снижают градиенты осмотически активных компонентов и гидростатическое давление в бактериях за ∼30 мс [6], тем самым предотвращая осмотическое повреждение.
В отличие от каналов, управляемых электрическим потенциалом, МЧ-каналы не являются монофилетическим семейством с характерной мембранной топологией и консервативными последовательностями, неизменно наблюдаемыми в сенсорах напряжения. МЧ-каналы, обнаруженные во всех доменах филогенетического древа организмов, принадлежат к нескольким структурно неродственным семействам и объединены только функционально. Говоря об общем физическом принципе функционирования МЧ-каналов, их процесс открытия под действием внешней силы базируется на том, что они имеют домены и сегменты, способные двигаться в направлении приложенной силы. С термодинамической точки зрения вклад работы внешней силы смещает вероятность нахождения в проводящем (открытом) по сравнению с покоящемся (закрытом) состоянием.
РАЗНООБРАЗИЕ МЧ-КАНАЛОВ И КРАТКИЙ ИСТОРИЧЕСКИЙ ОБЗОР
Возможность существования ионных каналов, управляемых механическими напряжениями, была высказана в конце 1970-х годов, когда Кори и Хадспет зарегистрировали быстрые токи в волосковых клетках лягушки-быка, появлющиеся в ответ на смещение пучка сенсорных волосков [7]. С тех пор эта область расширилась и включила другие объекты. Функциональные и структурные данные были получены на различных организмах, таких как Escherichia coli, Chlamydomonas reinhardtii, Caenorhabditis elegans, Drosophila melanogaster, Arabidopsis thaliana, Danio rerio, Xenopus laevis, Mus musculus, Homo sapiens и некоторых других. Многие МЧ-каналы оказались белковыми комплексами, собранными из одинаковых субъединиц (гомомультимерами), которые при гетерологичной экспрессии в удобных клеточных системах часто сохраняют ключевые электрофизиологические свойства. Некоторые стабильные каналы также могут быть выделены в чистом виде и функционально реконструированы в липосомные мембраны из раствора в детергенте. Такие системы иллюстрируют минимальный набор компонентов, необходимых для работы канала, а также позволяют исследовать роль специфических липидов в функционировании системы [8]. Некоторые механосенсорные комплексы, такие как слуховой канал, включают несколько различных белков, что практически исключает наблюдение функциональных каналов в системах, экспрессирующих отдельные компоненты.
Большое количество структурной информации, накопленное за последние несколько лет с помощью метода криоэлектронной микроскопии (крио-ЭМ), в настоящее время позволяет проводить точные структурные эксперименты и значительно повысило предсказательную силу моделирования методами молекулярной динамики. В последнее время были открыты несколько новых классов МЧ-каналов (Piezo, OSCA/TMEM, MSA, SWELL) в дополнение к недавно идентифицированным представителям уже существующих семейств (Flycatcher из семейства MscS). Эти новые структуры вызывают массу вопросов об их фундаментальных механизмах. Не менее важную часть этой научной области составляет исследование функциональной роли МЧ-каналов в нормальных физиологических и патологических процессах, дифференцировке клеток, развитии тканей и органов и даже в процессах канцерогенеза [9].
Механорецепторный (преобразующий) слуховой канал. Изучение механизмов слуха сосредоточено на волосковых слуховых клетках внутреннего уха (улитки), характерно оснащенных апикальными пучками отростков (стереоцилий), кончики которых связаны между собой. О ионном характере рецепторного потенциала волосковых клеток, индуцируемого отклонением волосков, впервые сообщили Кори и Хадспет (1979) [10], установив, что первичным слуховым преобразователем должен быть ионный канал. Канал располагается на кончиках стереоцилий вблизи мест прикрепления концевых связок (tip link – концевая связывающая нить) [11]. Его катионная проводимость варьирует между 100 и 200 пСм в зависимости от положения в улитке. Кинетика адаптации в этих каналах также меняется в зависимости от положения в улитке в соответствии с частотой, на которую они натроены [12]. Молекулярная идентификация механорецепторных каналов долго оставалась нерешенной проблемой, но прорыв был сделан в результате генетического анализа групп населения, где распространены семейные мутации, вызывающие глухоту. В результате, были клонированы белок TMHS, (четырежды пронизывающий мембрану стереоцилий волосковых клеток) и трансмембранные каналоподобные белки TMC1 и TMC2 [13, 14]. Были приведены убедительные данные, что TMC1 образует пору слуховых каналов, собираясь в комплекс с несколькими другими белками на кончиках стереоцилий [15]. Также было предсказано, что небольшой белок TMIE, ассоциированный с TMC, является частью поры [16]. Белки TMC1 и TMC2 гомологичны белкам семейства TMEM16/OSCA, которые формируют хлорные каналы, в то время как некоторые представители этого семейства также работают как скрамблазы, т.е. переносят фосфолипиды между монослоями мембраны [17]. Подобно ТМС, в функциональном состоянии эти белки представляют собой димеры субъединиц с десятью трансмембранными спиралями каждая (рис. 1а). Интересно, что в активном состоянии слуховой канал пропускает краситель FM1-43 (611 Да) в кончик стереоцилума, что может являться проявлением рудиментарной функции транспорта липидов. Недавнее исследование с помощью крио-ЭМ позволило визуализировать комплекс TMC1 C. elegans и идентифицировать два тесно связанных ним белка: TMIE, белок с одной трансмембранной спиралью, и связывающий Ca2+ и интегрин белок CALM-1, присоединенный к цитоплазматической стороне комплекса [18]. Считается, что ионы проходят в TMC1 по щели между спиралями 6, 7 и 8. Эта щель покрыта TMIE, но в нее частично проникают липиды. Концевые связывающие нити являются важными внеклеточными элементами; они соединяют соседние стереоцилии и передают механические усилия на канал. Нити образованы димерами протокадгерина 15 и кадгерина 23, соединенными между собой кальциевыми мостиками [19]. Смещение пучка создает напряжение в концевых связывающих нитях, что приводит к открытию каналов. Встраивание протокадгерина 15 в мембрану, по-видимому, опосредуется трансмембранным белком LHFPL5 [20]. Подробнее о функции механорецепторного слухового канала будет сказано ниже.
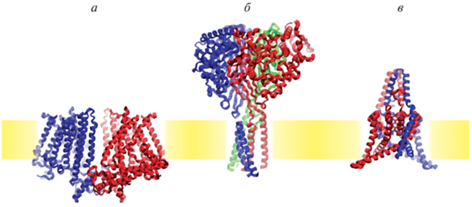
Рис. 1.
Структуры представителей трех семейств механочувствительных каналов. а – механочувствительный канал OSCA1.2 (идентификатор PDB 6MGW), представляющий семейство TMEM16/OSCA/TMC; б – кислоточувствительный ASIC-канал (PDB ID 6AVE), член семейства DEG/MEC/ENaC; в – механочувствительный канал TRAAK (PDB ID 4WFE), представляющий семейство двухпоровых калиевых (K2P) каналов.
Феноменологические исследования МЧ-каналов в несенсорных клетках. Первоначальное обнаружение катионных каналов, активируемых давлением, было сделано в куриных миобластах группой Сакса [21], после чего активность МЧ-каналов была обнаружена в бактериях [22], дрожжах [23], амфибиях [24] и высших растениях [25]. Последующие попытки применить фармакологию для характеристики механоактивируемых токов показали, что ионы гадолиния (Gd3+), амилорид, аминогликозидные антибиотики, рутениевый красный и пептид из яда паука Граммостола GsMTx4 блокируют различные типы МЧ-каналов [26, 27]. Не оправдались надежды найти универсальный блокирующий агент, который, подобно тетродотоксину, прочно связывающемуся с нейронными натриевыми каналами, мог бы послужить биохимической меткой для выделения загадочных МЧ-каналов. Молекулярная природа механочувствительных каналов в разных типа клеток долго осталась неизвестной.
Семейство DEG/ENaC/MEC. Первые молекулы – кандидаты на роль МЧ-каналов были выявлены в результате циклов мутагенеза и генетического скрининга нематод C. elegans [28]. Критерием отбора была неспособность мутантов реагировать на легкое прикосновение волоском к боковой части тела, где проходят механосенсорные нейроны. Комплементарное скрещивание выявило 18 генов mec (механосенсорные аномалии), необходимых для осязания, опосредованного шестью специализированными механосенсорными нейронами червя. Двенадцать генов mec кодируют компоненты, ответственные именно за механоперобразование, в том числе тубулины (mec-7, mec-12), элементы внеклеточного матрикса (mec-5, mec-9), параоксоназоподобные (mec-6), связывающие холестерин стоматиноподобные белки (mec-2), и mec-4 и mec-10, что по структуре напоминают каналы из семейства DEG/ENaC [29]. Белковые субъединицы mec-4 и mec-10 дважды пронизывают мембрану с цитоплазматическими N- и C-концами и большим внеклеточным доменом, который обеспечивает сборку субъединиц в тримеры (рис. 1б). Электрофизиологические измерения на миниатюрных нейронах червей были сложными, но они показали, что из этих двух генов mec-4 строго необходим для сенсорной функции [30]. Предполагается, что у C. elegans и Drosophila механопреобразующие каналы связаны со структурами микротрубочек внутри клетки и с кутикулой снаружи, по-видимому, для фокусировки напряжений собранных с целого “рецепторного поля”. Другие члены семейства, чувствительные к кислоте ионные каналы (ASIC-1) (рис. 1б) и, в частности, DEG-1, необходимы для механорецепции в других механочувствительных нейронах у C. elegans [31]. В Drosophila рецепторы щетинок и мультидендритные сенсорные нейроны используют ENaC-подобные каналы Pickpocket (Ppk) [32].
Бактериальные каналы. Разработка метода получения гигантских бактериальных сферопластов [33] сделало возможным прямое исследование бактерий с помощью электрофизиологического метода пэтч-кламп. Приложение отрицательного (всасывающего) давления к микропипетке, которое растягивает закрепленную на кончике мембрану, позволило обнаружить присутствие МЧ-каналов в бактериях [22]. Исследования цитоплазматической мембраны E. coli и реконструированных протеолипосом этим методом [34, 35] выявили три основных фенотипических класса МЧ-каналов, различающихся по проводимости и активирующему давлению: большие (MscL, 3 нСм), малые (MscS, 1 нСм) и мини (MscM, 100–300 пСм). Механочувствительный канал большой проводимости MscL был идентифицирован и клонирован путем биохимического фракционирования мембранных белков E. coli, реконструирования в липидных мембранах и определения методом пэтч-кламп [36]. Механочувствительный канал малой проводимости MscS был клонирован по гомологии с белком KefA, обеспечивающим выход калия из E. coli [37]. Позже было обнаружено, что сам KefA является K-зависимым МЧ-каналом; а затем переименован в MscK [38]. Последующий анализ генома E. coli выявил еще четыре паралога MscS: YnaI, YbdG, YbiO и YjeP. Активность мини-каналов была приписана продуктам экспрессии генов ynaI, yjeP и ybdG [39]. Вместе эти бактериальные каналы составляют адаптивную систему, которая регулирует тургорное давление в клетке, высвобождая небольшие метаболиты из цитоплазмы. MscS и MscL, два структурно неродственных канала из разных семейств, являются основными клапанами, спасающими бактерии от лизиса, и, таким образом, только делеция обоих генов приводит к “хрупкому” фенотипу E. coli, сильно восприимчивому к осмотическому стрессу [37].
MscL и MscS были очищены, функционально реконструированы в липидных мембранах, и было показано, что они открываются непосредственно натяжением липидного бислоя [8, 40]. Структуры гомологов MscL из M. tuberculosis и MscS из E. coli были получены кристаллографически [41]. В то время как семейство каналов MscL распространено в первую очередь в прокариотах (бактерии и археи), многие гомологи MscS были обнаружены у эукариот в клетках с клеточными стенками, включая делящиеся дрожжи, водоросли, жгутиконосцы и высшие растения [42]. Каналы, схожие с MscS, присутствуют не только в плазматических мембранах грибов, протистов и растений, но и во внутренних мембранах и мембранах органелл, где они стабилизируют пластиды, митохондрии и сократительные вакуоли [43]. Структуры и механизмы функционирования MscL и MscS будут описаны ниже.
Механочувствительные каналы растений. Первые исследования протопластов растений с помощью методики пэтч-кламп позволили зарегистрировать различные ионные токи, переносимые Cl–, K+ и Ca2+, возникающие при приложении давления [25, 44]. Каналы в клетках листового эпидермиса, проводящие Ca2+ и Mg2+, блокировались ионами Gd3+ в микромолярных концентрациях, что приводило к прекращению реакций на гравитацию в корнях растений [45]. Геномные данные показывают, что высшие растения Arabidopsis thaliana обладают десятью гомологами бактериального MscS (MSL1-10) [43]. Из них MSL9 и MSL10 расположены в плазматической мембране клеток корней, тогда как MSL8 специфически экспрессируется в пыльце, где он способствует нормальному прорастанию и росту пыльцевых трубок [43]. Каналы MSL2 и MSL3 специфически локализованы в пластидах, и делеция обоих этих генов приводит к морфологическим изменениям и набуханию пластид, которые, как предполагается, постоянно испытывают гиперосмотический стресс вследствие накопления сахаров. MSC1, гомолог MscS у одноклеточной водоросли Chlamydomonas reinhadtii [46], сходным образом регулирует форму и деление хлоропластов, подтверждая роль каналов из семейства MscS в поддержании эндосимбиотических органелл. Недавно в плотоядном растении венериной мухоловке был идентифицирован МЧ-канал Flychatcher (FLYC1) – близкий гомолог MscS. Каналы локализуются в специфических истонченных участках сенсорных волосков, вблизи их оснований. Волоски реагируют на шевелящуюся добычу и запускают потенциал действия, приводящий к закрытию ловушки [47].
Калиевые каналы, характеризуемые наличием двух порообразующих сегментов (K2P) были также обнаружены в растениях. A. thaliana обладает пятью двухпоровыми K+ каналами (TPK1-5), из которых механочувствительный канал TPK1 был локализован в устьичных клетках, реагирующих на осмотический стресс [48]. В геномах высших растений обнаружен единственный ген Piezo (PZO1). Кроме того, были идентифицированы два MCA канала, (MCA1 и MCA2) проводящие Са2+. MCA каналы пока не обнаружены в других организмах и характерны для высших растений. Генетически было показано, что каналы Piezo и MCA помогают корням реагировать на твердость почвы и способствуют более глубокому проникновению [43]. Семейство новых механочувствительных каналов OSCA (рис. 1а) также характерно для растений. Эти каналы участвуют в обеспечении притока Са2+ при гиперосмотическом стрессе [49]. Интересно, что в геномах A. thaliana и других наземных растений полностью отсутствуют TRP-подобные каналы. Однако, в отличие от наземных растений, зеленая одноклеточная водоросль Chlamydomonas reinhardtii обладает несколькими TRP-каналами; один из них, МЧ канал TRP11, расположен в основании жгутиков и обеспечивает обратное вращение жгутиков при столкновении клетки с твердым объектом [46].
Калиевые каналы с двумя порообразующими доменами (K2P, TPK). Первые завершенные геномные базы данных для эукариотических организмов привели к открытию нового класса калиевых каналов, в аминокислотной последовательности которых присутствуют два поробразующих сегмента (K2P). Эти сегменты не формируют отдельных ионных пор, они встречаются в димерном комплексе канала и формируют единую пору. K2P встречаются повсеместно и играют роль каналов утечки, регулирующих потенциал покоя во многих возбудимых и невозбудимых клетках. Среди них каналы TREK 1, TREK 2 и TRAAK активируются растяжением мембраны и в ответ на ступеньку натяжения отвечают кратковременным током с быстрой адаптацией [50]. Мультимодальный TREK1 уникален тем, что он реагирует на множество различных типов стимулов, включая pH, температуру, полиненасыщенные жирные кислоты, фосфоинозитидные липиды и общие анестетики [51].
Реконструкция TRAAK человека и TREK-1 рыб Danio rerio [52] показала, что открытие этих каналов управляется непосредственно натяжением липидного бислоя. Полученные кристаллические структуры TRAAK (рис. 1в) показали необычную связь внутренней части пор с алифатическим ядром мембраны через открытые “боковые отверстия” в стенке канала. Предполагается, что липиды, попадающие во внутреннюю полость через эти отверстия, действуют как механически активируемые “ворота”, они уходят в бислой при натяжении и закрывают пору в отсутствие натяжения [53].
K2P-каналы высокоселективно проводят K+ и, следовательно, являются гиперполяризующими и ингибирующими. Являясь частью популяции каналов “утечки”, K2P выполняет регуляцию возбудимости путем настройки потенциала покоя, установку порогов возбуждения и предоставляют защиту, подавляя гипервозбудимость в случаях ишемии и сотрясения мозга [51]. Неудивительно, что ингибирующие каналы TREK являются фармакологическими мишенями для нескольких общих анестетиков и антидепрессантов.
TRP-каналы. Исключительноe разнообразное каналов из семейства TRP (transient receptor potential), изначально идентифицированного в плодовой мушке Drosophila, выполняет множество функций, таких как прямое восприятие температуры, ноцицепция и боль, вкус и обоняние. TRP-каналы также участвуют в регуляции внутриклеточного Са2+, определении редокс-статуса клетки, осмо- и механочувствительности [54]. Дрожжевой вакуолярный канал TRPY1, признанный предковым преставителем всего семейства TRP (рис. 2а), открывается непосредственно натяжением мембраны и вдобавок регулируется фосфоинозитидными липидами и Са2+ [55, 56]. Осмочувствительный канал TRPV4, активируемый набуханием клеток, также активируется в участках с приложенным натяжением [57]. Многие TRPV-каналы активируются набором различных стимулов, что делает их “интеграторами” механических стимулов с температурой, осмолярностью и присутствием таких внешних компонентов, как анионные липиды, полиненасыщенные жирные кислоты или Ca2+.
Рис. 2.
Структуры представителей семейства механочувствительных каналов TRP. Дрожжевой канал TRPY1 (а), который считается родоначальным представителем семейства каналов TRP (PDB ID 6WHG), и механочувствительный канал NompC дрозофилы (б) (PDB ID 5VKQ), открывающийся посредством ассоциации с микротрубочками через удлиненные цитоплазматические анкириновые домены.
TRPN1 (NompC), первоначально идентифицированный в Drosophila, участвует в восприятии движения и вибраций щетинок. В его крио-ЭМ структуре выявлен протяженный N-концевой цитоплазматический домен, состоящий из анкириновых повторов [58] (рис. 2б). Эти анкириновые повторы в TRPN1 напрямую связаны со специальными микротрубочками в механочувствительных органах мушки [59]. Изначально предполагалось, что тянущая сила, приложенная к концу цитоплазматического домена, активирует канал, однако, согласно данным молекулярно-динамического моделирования, не тянущая сила, а сила, толкающая анкириновый пучок в мембранный домен, приводит к активации канала [60]. Было показано, что TRP-4, гомолог TRPN1 у нематоды C. elegans, является преобразующим каналом, генерирующим быстрые электрические ответы в реснитчатых механосенсорных нейронах [31].
В млекопитающих каналы TRPP1, проницаемые по Ca2+ (также известные как PC2, Pkd2 или polycystin 2), собираются с другим мембранным белком Pkd1 с образованием канала, чувствительного к потоку жидкости вдоль мембраны; канал располагается у основания первичной реснички на апикальной стороне почечного эпителия [61]. Канал отвечает на отклонение ресничек и таким образом вызывает приток Са2+ в клетку. Интересно что Pkd2 также играет роль на ранних стадиях развития позвоночных, устанавливая лево-правую симметрию тела [62].
Анионные каналы, регулируемые объемом клетки. Бестрофин-1 (BEST1) был идентифицирован у людей как локус мутации, связанный с вителлиформной макулярной дистрофией Беста. Функционально BEST1 оказался хлорным (Cl–) каналом, активируемым как повышенным внутриклеточным Ca2+, так и осмотическим набуханием клетки [63]. Структурные данные показали, что BEST1 является пентамером субъединиц, каждая из которых имеет 4 трансмембранных и 5 цитоплазматических спиралей. Последние образуют полый цитоплазматический вестибюль (рис. 3а). Гомологи BEST1 обнаружены во многих организмах и, предположительно, являются сенсорами, опосредующими изменение объема клетки в ответ на изменение концентрации внутриклеточного Ca2+.
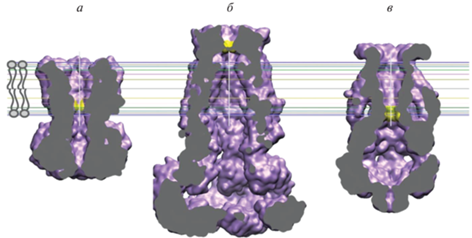
Рис. 3.
Каналы, активируемые осмотическим набуханием клетки, характеризуются полыми цитоплазматическими вестибюлями с относительно узкими порталами, непроницаемыми для крупных цитоплазматических компонентов. Все три структуры показаны в виде вертикальных сечений моделей с заполненным пространством, чтобы проиллюстрировать внутренние объемы цитоплазматических доменов. а – Бестрофин-1 (PDB ID 6N24); б – SWELL1 (PDB ID 6DJB); в – бактериальный MscS (PDB ID 6PWP). Желтые области обозначают гидрофобные ворота, горизонтальные линии очерчивают положение липидной мембраны.
Примером другого семейства анионных каналов, регулируемых объемом клетки (VRAC), являются белки LRRC8 (LRRC8A-E). У человека функциональные VRAC представляют собой гетерогенное семейство комплексов, образованных совместной сборкой пяти гомологичных субъединиц (LRRC8B-E) с главной субъединицей LRRC8A (SWELL1) [64]. Эти каналы опосредуют регуляторное уменьшение объема за счет выхода неорганических анионов и небольших органических осмолитов из клеток в случае гипоосмотического набухания. Структура SWELL1 была определена с помощью крио-ЭМ [65]. При ее анализе было обнаружено, что гексамерная сборка на самом деле представляет собой тример димеров. Трансмембранный домен SWELL1 образован шестью субъединицами с четырьмя трансмембранными спиралями, С-концевая часть каждой субъединицы несет 16 повторов, обогащенных лейцином (LRR), которые складываются в полую структуру (вестибюль) в цитоплазме (рис. 3б). SWELL1 активируется при снижении ионной силы в цитоплазме. Набухание клетки, с очевидностью, сопровождается снижением концентрации всех внутриклеточных компонентов и макромолекул. Для сравнения с BEST1 и LRRC8A на рис. 3в показан бактериальный MscS с его цитоплазматическим доменом. Все три белка имеют сходство в том, что все они имеют полые цитоплазматические вестибюли, структурно связанные с воротами. Представляется возможным, что снижение общей концентрации веществ и, как следствие, исключенного объема, занимаемого макромолекулами (crowding pressure), в цитоплазме является решающим активирующим фактором, тогда как увеличение концентрации должно вызывать дезактивацию вследствие дегидратации и увеличения давления.
Пьезоканалы. Семейство Piezo было открыто в 2010 г. группой Патапутьяна (Patapoutian) [66] с помощью технологии SiRNA нокдауна в сочетании с электрофизиологией. Они обнаружили прямую корреляцию между наличием быстро адаптируемых механоактивируемых токов в клетках нейробластомы с продуктом гена Fam 38A (теперь называемого Piezo1). Было обнаружено, что белок экспрессируется в мочевом пузыре, толстой кишке, почках, легких и коже. Гомологи Piezo1 обнаружены у большинства эукариот, включая простейших, растения и всех многоклеточных животных, но не найдены в дрожжах. В то время как большинство геномов содержат один гомолог Piezo1, у позвоночных есть второй, Piezo 2, который активно экспрессирован в нейронах сенсорного ганглия задних корешков спинного мозга (DRG). Piezo 1 и 2 представляют собой неселективные и проницаемые для кальция катионные каналы с проводимостью 20–45 пСм, которые генерируют устойчивые затухающие токи в ответ на надавливание на поверхность клетки закругленным стеклянным зондом. Такие же по характеру токи популяция каналов генерирует в ответ на ступенчатое давление, приложенное к участку мембраны на отверстии стеклянной пипетки (patch-clamp). В патч-кламп экспериментах показано, что натяжение мембраны, является основным физическим фактором, вызывающим открытие каналов. Для Piezo 1 средняя точка открывающего натяжения оценивалась между 2 и 6 мН/м [67, 68]. В дополнение к натяжению, Piezo 1 активируется сдвиговым напряжением, создаваемым потоком жидкости, параллельным поверхности клетки [69].
Гигантские белки Piezo1 и Piezo2 очень похожи, оба имеют длину ~2500 аминокислот, в зависимости от варианта сплайсинга. Структуры Piezo1 и Piezo2 были получены несколькими группами [65, 70, 71], которые обнаружили сходную тримерную архитектуру, напоминающую пропеллер. Предполагается, что каждый мономер имеет 38 трансмембранных спиралей, организованных в виде повторов по четыре спирали. Центральная пора образована С-концевыми областями каждой субъединицы, которая покрыта внеклеточным “колпачком” с одной стороны и внутриклеточной “пробкой” с ее центральными и латеральными сегментами – с другой. Более крупные N-концевые части каждого мономера образуют встроенные в мембрану “руки”, поэтому тример напоминает изогнутый 3-лопастной пропеллер (рис. 4). Было высказано предположение, что погруженный в мембрану тримерный комплекс придает мембране локальную кривизну, которая образует мембранный купол высотой ~10 нм относительно плоской части и имеет диаметр ~24 нм в плоскости мембраны. Предполагается, что натяжение мембраны уплощает купол и вызывает латеральное расширение изогнутого мембранно-белкового комплекса на площадь до 120 нм2 [70]. Если это латеральное расширение напрямую связано с открытием, этот механизм обеспечил бы исключительную чувствительность канала к натяжению (см. следующий раздел).
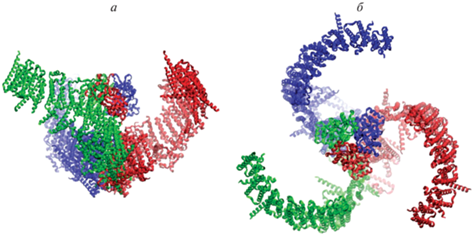
Рис. 4.
Структура канала Piezo1, (идентификатор PDB 6B3R), вид сбоку (а) и сверху (б). Тримерный канал (окрашена каждая субъединица) образует структуру в форме пропеллера с изогнутыми лопастями. Согласно сегодняшним представлениям, молекула придает кривизну мембране, формируя куполообразную структуру. Натяжение уплощает изогнутый белково-мембранный комплекс и временно открывает пору.
Несмотря на сильное сходство, Piezo1 и 2 экспрессируются в разных типах клеток. Piezo1 экспрессируются преимущественно в несенсорных тканях, тогда как Piezo2 функционируют в сенсорных нейронах и их окончаниях, в тактильных рецепторах (клетки Меркеля). Piezo 1 и 2 экспрессируются одновременно только в некоторых нейронах DRG, суставных хондроцитах [72] и в барорецепторных окончаниях дуги аорты и каротидных телец [73], где требуется скоординированное действие двух каналов. Тканеспецифические нокауты Piezo1 и 2 вызывают серьезные сенсорные аномалии, а также дефекты развития. Мутации в Piezo связаны по крайней мере с 18 наследственными болезнями, затрагивающими развитие, включая артрогрипоз, стоматоцитоз и лимфатическую дисплазию. По этой причине каналы стали важными объектами фармакологии. Каналы неспецифически блокируются ионами Gd3+ и рутениевым красным, тогда как пептид из яда паука Grammostola GsMTx4 действует как модулятор открытия, сдвигая направо кривые активации по шкале натяжения [74]. Индуцированные потоком токи Piezo1 не подвержены влиянию GsMTx4, но эффективно блокируются амфипатическими пептидами Aβ, высвобождение которых связано с травмой головного мозга [69]. Фармакологические скрининги идентифицировали два специфических активатора Piezo1 Yoda1 и Jedi 1,2, тогда как Dooku1 действует как специфический блокатор. Сайты связывания этих веществ в структуре канала были недавно идентифицированы методами крио-ЭМ [75].
СПОСОБЫ ПЕРЕДАЧИ ВНЕШНИХ СИЛ НА ВОРОТА КАНАЛА
Есть три основных механизма того, как сила может достичь канала, встроенного в мембрану, и как она может вызвать открытие (рис. 5). Сила может исходить от фибриллярных элементов, таких как цитоскелет или внеклеточный матрикс. Работа внешней силы в этом случае равна смещению ворот, приводящему к открытию, умноженному на линейную силу (f × ∆l). Этот вклад “работы внешних сил” должен смещать энергетический ландшафт системы в сторону открытого состояния. Такой режим “линейной силы” подразумевает направление конформационного переход вдоль вектора силы (1D), которая может либо толкать, либо тянуть (рис. 5а).
Рис. 5.
Пять основных способов, которыми механический стимул может достичь канал, вызывая его открывание. а – открывание линейной силой, приложенной к воротам канала за счет движения микротрубочки через воротную пружину; пространственный параметр Δl – линейное перемещение ворот канала в направлении действия силы, We – работа, производимая внешней силой (f). б – Открывание встроенного в мембрану канала двумерным натяжением (γ). Работа в этом случае равна произведению натяжения и изменения площади комплекса открывающихся каналов в плоскости мембраны (ΔA). в – Открывание канала Piezo, генерирующего кривизну. Изогнутые “лопасти” канала изгибают сегмент окружающей мембраны, формируя куполообразную структуру. Считается, что натяжение уплощает купол, открывающий центральные ворота. Латеральное расширение всей белок-мембранной конструкции из-за уплощения оказывается больше, чем можно было бы ожидать при простом растяжении канала, что обеспечивает более высокую чувствительность к натяжению. г – Закрытое состояние канала, стабилизированное осмотическим стрессом или высокой цитоплазматической концентрацией макромолекул. В этом случае открытие канала обусловлено увеличением гидратации и “разведением” цитоплазмы. Полая сенсорная область канала имеет отверстия, которые позволяют проходить растворителю и небольшим молекулам, но непроницаемы для больших молекул. Домен изменяет свой объем при открывании, обеспечивая чувствительность к осмотическому (или связанному с исключенным объемом макромолекул) давлению (Р) в цитоплазме, которое пропорционально Р и ΔV. д ‒ Модель “парусного” открывания канала за счет сдвиговых напряжений, создаваемых потоком жидкости, параллельным поверхности мембраны.
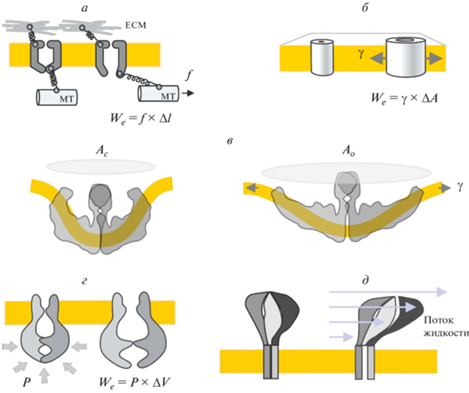
Внешняя сила также может передаваться через окружающий липидный бислой, подвергающийся двумерному натяжению (рис. 5б). Энергетический вклад “силы от липида” в этом двумерном случае представляет собой натяжение, умноженное на латеральное изменение площади при открытии канала (γ × ΔA). Структурный анализ пьезоканалов, изгибающих мембрану, позволил предложить дополнительный принцип открытия каналов натяжением, заключающийся в уплощении сферического сегмента мембраны, в котором находится канал (открытие, вызываемое кривизной, рис. 5в) [70, 76]. Во многих отношениях этот механизм подобен описанному выше двумерному расширению, но уплощение сегмента мембраны увеличивает эффективное изменение площади комплекса в плоскости (ΔA), тем самым повышая чувствительность перехода. Изогнутые лопасти пьезоканала, по-видимому, действуют как рычаги, передающие усилие от уплощающейся конструкции к центральным воротам.
Примеры трех активируемых объемом каналов с полыми цитоплазматическими доменами (рис. 3) предполагают, что такая конструкция может сделать их чувствительными к объемному давлению в цитоплазме. Внутренняя часть каждого домена связана с цитоплазмой относительно узкими порталами, проницаемыми для воды, ионов и, возможно, небольших осмолитов. Энтропийные силы, генерируемые в цитоплазме, могут быть результатом повышенной или пониженной концентрации более крупных (не проницаемых для порталов) цитоплазматических компонентов, действующих снаружи на полый внутриклеточный домен. В случае обезвоживания цитоплазмы осмотические силы в сочетании с уплотнением цитоплазмы будут увеличивать давление (crowding pressure), действующее на полый домен, тесно связанный с воротами (осмочувствительный воротный механизм, рис. 5г). Разбавление цитоплазмы снимет это давление. В этих случаях энергетическим фактором, нарушающим равновесие между состояниями, является произведение давления и изменения объема (P × ΔV), связанного с трехмерным переходом.
Сдвиговое напряжение, создаваемое потоком жидкости, является еще одним механическим фактором, который может воздействовать на заякоренный в мембране белковый комплекс. Любой канальный белок с выступающими внеклеточными доменами, прикрепленный к мембране через трансмембранные домены, будет испытывать воздействие вязкой сдвиговой силы (“парусная модель”, рис. 5д). Этот эффект может быть усилен элементами, связанными с внеклеточными доменами. Активация потоками жидкости была продемонстрирована для эпителиальных натриевых каналов (ENaCs) [77] и для пьезоканалов [69].
Изменение равновесия между функциональными состояниями является результатом податливости молекулы в направлении действия внешней силы. Этот основной механохимический принцип применим независимо от размерности системы [78, 79]. Диаграмма двух состояний (рис. 6а), иллюстрирующая энергию системы в зависимости от пространственного параметра (координаты реакции), показывает, что молекула-сенсор может быть в закрытом или открытом состоянии. Энергии этих двух состояний отличаются на величину G0, которая определяет вероятности состояний Pc и Po согласно уравнению Больцмана (ур. 1).
(1)
$\frac{{{{P}_{o}}}}{{{{P}_{c}}}} = {{e}^{{ - \frac{{{{G}_{0}}{\kern 1pt} - {\kern 1pt} {{W}_{e}}}}{{kT}}}}}.$Рис. 6.
а – Двухъямная энергетическая диаграмма, представляющая энергию канала, управляемого натяжением, с латеральным расширением (ΔA), выбранным в качестве координаты реакции. Разница энергий открытого и закрытого состояний в отсутствие натяжения составляет G0. Натяжение дает линейный вклад –γΔA, который изменяет энергетический профиль и снижает энергию открытого состояния. Подчиняясь распределению Больцмана, популяция каналов в открытом состоянии будет увеличиваться. б – Кривая доза–реакция для активируемого натяжением канала, построенная с использованием ур. 2 с экспериментально определенными для MscL параметрами G0 = 50 kT, ΔA = 20 нм2.
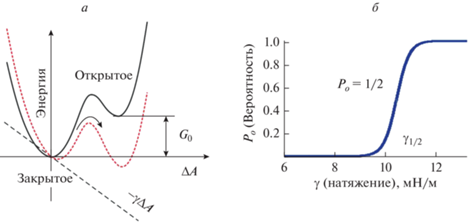
Энергетический профиль с двумя ямами (рис. 6а) схематически представляет энергию как функцию двумерного расширения молекулы (координата реакции), вызываемого внешним натяжением, записанным в виде линейного энергетического вклада γ × ΔA. Натяжение компенсирует разницу энергий состояний и сдвигает распределение в сторону открытого состояния. Натяжение также уменьшает высоту активационного барьера, тем самым увеличивая скорость открытия. Преобразование уравнения (1) с учетом наличия только двух состояний (Po = 1 – Pc) приводит к уравнению (2), которое дает S-образную кривую доза–реакция, показанную на рис. 6б. Наклон зависимости вероятности открытого состояния (Po) от силы определяется исключительно пространственным параметром перехода (ΔA). Чем больше пространственный параметр, тем круче кривая активации. Средняя точка кривой доза-реакция достигается при натяжении, которое точно компенсирует разницу энергий открытого и закрытого состояний (G0 – γΔA = 0). Фактическая форма кривой доза–реакция определяется как G0, так и пространственным параметром перехода (ур. 2):
Параметр kT представляет собой тепловую энергию окружающей среды. Он определяет порог, выше которого изменение энергии приводит к заметным эффектам. Для изменения отношения вероятностей в e раз (2.72 раза) требуется изменение разницы энергий состояний на 1 kT = 4.1 × × 10–21 Дж (k – постоянная Больцмана, T – абсолютная температура). Это равно работе, производимой силой 1 пН (пиконьютон) на расстоянии 4.1 нм; аналогично работа в 1 kT в двумерных и трехмерных системах эквивалента 4.1 мН/м × 1 нм2 или 4.1 атм × 10 нм3 соответственно.ВРЕМЕННАЯ АКТИВАЦИЯ: АДАПТАЦИЯ, ДЕСЕНСИТИЗАЦИЯ И ИНАКТИВАЦИЯ
Подобно нейронным потенциалозависимым каналам, которые формируют спайки, проходя циклы активации и инактивации [80], большинство МЧ-каналов генерирует переходные токи в ответ на ступенчатую механическую стимуляцию. Проходящий характер активации каналов может быть связан с различными механизмами. Самый простой из них предполагает вязкоупругую релаксацию напряжений в среде, при которой импульс, достигающий канала, затухает со временем из-за пассивной (вязкой) перестройки системы элементов, переносящих напряжение [81]. Это объясняет временную активацию МЧ-каналов в ооцитах Xenopus, где отсоединение подмембранного цитоскелета от участка мембраны устраняет адаптацию и продлевает течение тока до окончания действия стимула [24].
В то время как адаптация выражается в сдвиге кривой активации вправо при длительном воздействии стимула, инактивация обычно приписывается внутреннему процессу, который делает канал одновременно непроводящим и нечувствительным к стимулу. Это может быть следствием отсоединения активационных ворот от стимула с последующим закрытием ворот (что некоторые авторы называют “десенсибилизацией”, мы бы предпочли “десенситизацией”). Альтернативно, возврат в непроводящее состояние может быть вызван закрытием специальных ворот инактивации. По-видимому, это относится к Piezo1, где предполагалось, что активация расширяет узкий участок поры, образованный боковыми цепями M2493 внутренних спиралей [70], тогда как инактивация приписывается гидрофобному схлопыванию поры на четыре витка спирали выше основных ворот [82].
Вырывание участка мембраны из цитоплазмы (excised patch) или применение агентов, деполимеризующих цитоскелет, не влияют на десенсибилизацию TREK-1, происходящую приблизительно через 100 мс. Таким образом, по-видимому, десенсибилизация является внутренним свойством канального комплекса [50]. В согласии с этим наблюдением, очищенные и реконструированные в липосомы каналы TREK-1 и TRAAK также демонстрируют адаптивные токи [52]. Ниже будет обсуждаться механизм отсоединения ворот, вызывающего инактивацию бактериального канала MscS под натяжением.
Кинетика токов при адаптации слухового канала в волосковых клетках позвоночных имеет более чем один инактивационный компонент. Показано, что быстрая (~1 мс) фаза адаптации зависит как от мембранного потенциала, так и от притока Са2+ на апикальной стороне волосковой клетки. Более медленные компоненты адаптации волоскового пучка соответствуют критическому этапу сброса кривой активации в соответствии с новым положением покоя кончика стереоцилиарного пучка. Их связывают с регулировкой натяжения в концевой связывающей нити за счет проскальзывания и последующего движения миозина, подтягивающего верхний конец нити и восстанавливающего натяжение [83].
ЭКСПЕРИМЕНТАЛЬНЫЕ ПАРАМЕТРЫ ОТКРЫВАНИЯ МЧ КАНАЛОВ
Механорецепторный слуховой канал. Первоначальное описание открывания МЧ ионных каналов, которое рассматривает упругую пружину, тянущую подвижные ворота канала, было получено при измерении кинетики токов рецепторов волосковых клеток, вызванных смещением стереоцилиарного пучка [78] и одновременными изменениями его механической податливости [84]. На рис. 7а представлена конфигурация пучка стереоцилий в покое и при отклонении силой, приложенной к кончику. На рис. 7б показано, каким образом канал на кончике стереоцилии может чувствовать натяжение. Упругий элемент находится внутри клетки и связан непосредственно с каналом; альтернативно (или дополнительно) натяжение может передаваться через липидную мембрану. Когда пучок движется вправо, все стереоцилии поворачиваются вокруг точек, на которых они закреплены (шарниров), что создает напряжение в концевых связках. Отношение сдвига между соседними стереоцилиями к горизонтальному смещению кончика пучка (γ) составляет примерно 0.1–0.2. На рис. 7в представлена эквивалентная механическая схема одной взаимосвязанной пары, состоящей из модельных элементов, включающая затворную пружину (kg), прикрепленную к воротам канала, вероятность открытого состояния (Ро) которого зависит от натяжения и присутствия Са2+. Параметр d описывает “размах” ворот при открытии канала, а Δxg представляет собой индуцированную кальцием релаксацию гипотетического высвобождающего элемента (“спуск”), предложенного в качестве дополнительного фактора увеличения податливости при открытии. Мотор, присутствующий в системе, поддерживает натяжение в состоянии покоя в концевой связке. Параллельные упругие (ks) и вязкие (Ξs) элементы представляют поворотную жесткость стереоцилии и гидродинамическое сопротивление пучка. Панели г–е (рис. 7) иллюстрируют данные, полученные Cheung [85] с использованием оптического пинцета для одновременного приложения силы и измерения движения пучка. Ток рецептора (панель г) увеличивается при отклонении, достигая средней точки около 50 нм. Соотношение сила–смещение (панель д) является линейным на левом конце графика, где все каналы закрыты, и на правом конце, где они открыты, что указывает на примерно одинаковую жесткость пучка и концевой связующей нити. Однако в середине кривой, где канал открывается (панель д), имеется уплощение, а жесткость в этой области (панель е) имеет провал. Это указывает на удлинение и ослабление воротной пружины, связанное с открытием, подразумевающее поворот ворот канала в направлении действия силы. В волосковых клетках земноводных (лягушки-быка) эффективная жесткость запорной пружины kg составляла порядка 700 мкН/м, что описывает все упругие элементы, расположенные последовательно с преобразующим каналом. Чтобы достичь средней точки кривой активации (Ро = 0.5), пружину ворот необходимо растянуть примерно на 7 нм под усилием примерно 5 пН. Открытие канала связано с эффективным перемещением ворот на ~4 нм [85].
Рис. 7.
Открывание сенсорного канала внутреннего уха. а – Расположение стереоцилиарного пучка на апикальной стороне волосковой клетки. Пучок соединен между собой кадгериновыми нитями, называемыми концевыми связками (tip kinks). Отклонение кончика пучка вызывает напряжение концевых связок. б – Гипотетическая схема, в которой передающий канал, находящийся на кончике нижней стереоцилии, напрямую соединен с концевой связкой (состоящей из протокадгерина 15 и кадгерина 23), а эластический элемент прикреплен к актину ниже канала. Натяжение в концевой связке и эластичном элементе поддерживается миозиновыми моторами. в – Эквивалентная механическая схема, изображающая последовательное соединение канала с его воротами (Po); воротная пружина (kg), учитывающая механическую растяжимость концевой связки и всех связанных элементов внутри стереоцилии; и гипотетический элемент высвобождения, или “спуск”, который обеспечивает Са2+-зависимое удлинение системы последовательно связанной с каналом и мотором. Два параллельных элемента ks и Ξs учитывают поворотные жесткость и вязкое сопротивление соответственно. г – Кривая отклонения рецепторного тока для волосковой клетки лягушки-быка. д – Соотношение сила–прогиб, демонстрирующее линейные режимы на обоих концах и переходный режим в середине. е – Кривая жесткость–прогиб с минимумом, соответствующим точке наибольшего нарастания тока, вызванного открытием передающего канала. Панели в–е адаптированы из Cheung and Corey (2006) [85].
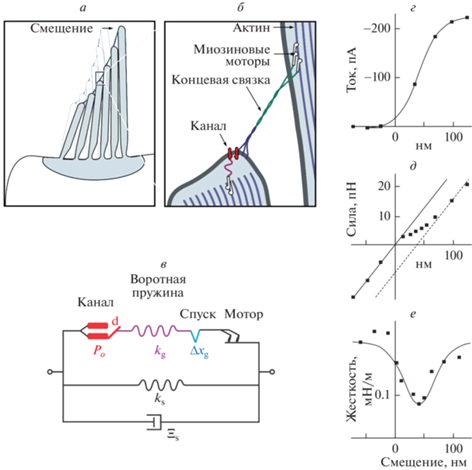
Если ворота канала действительно напрямую прикреплены к актиновым филаментам через эластичный белок пружины ворот (рис. 7б), то “перемещение” ворот можно понимать буквально. Однако пружина ворот не является концевой связкой. Молекулярно-динамическое моделирование кристаллических структур протокадгерина 15 и кадгерина 23, образующих концевую связку, показало, что эти филаментозные белки слишком жесткие, чтобы играть роль воротной пружины [19]. Другие компоненты, присутствующие в стереоцилиях, могут иметь необходимую жесткость и удлинение. В альтернативном варианте каналы могут не прикрепляться впрямую к концевой связке, но могут располагаться в мембране рядом с точкой прикрепления концевой связки и могут испытывать натяжение, передаваемое через липиды, когда усилие, приложенное к концевой связке, вызывает “натягивание” мембраны наподобие шатра (tenting) [86, 87].
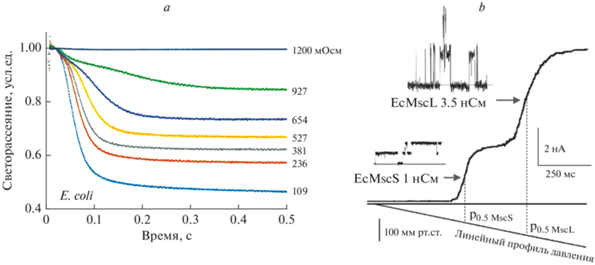
Бактериальные МЧ-каналы как модели открытия каналов натяжением мембраны. Механочувствительные каналы малой и большой проводимости, MscS и MscL, находятся в цитоплазматической мембране большинства бактерий. Они спасают бактерии в случае внезапного осмотического шока [37], действуя как управляемые натяжением спусковые клапаны для осмотически-активных компонентов цитоплазмы (метаболитов). Регулируя скорость высвобождения в соответствии со скоростью осмотического набухания [88], система снижает осмотический градиент и ограничивает натяжение мембраны ниже литического предела. Как определено измерениями светорассеяния в остановленном потоке [6], при сильном гипотоническом шоке бактерии могут высвобождать до 15% своего неводного внутреннего содержимого в течение 20 мс (рис. 8а). Низкопороговый канал MscS (проводимость 1 нСм) становится активным при натяжении 6–7 мН/м, а высокопороговый MscL (3 нСм) активируется при более высоком натяжении 11–14 мН/м. Эти каналы являются двумя основными составляющими системы высвобождения, и присутствие двух популяций легко наблюдается в пэтч-кламп экспериментах с мембранами гигантских сферопластов E. coli дикого типа (рис. 8б). В отличие от MscL, который открывается при почти литическом натяжении, MscS открывается значительно ниже литического предела и демонстрирует характерное адаптивное поведение [89]. Решенные структуры MscL [90] и MscS [41, 91, 92] дали информацию для компьютерного моделирования, симуляций и предсказания основных функциональных состояний для этих каналов на основе экспериментально измеренных параметров конформационных переходов [93–98].
Рис. 8.
Макроскопические реализации действия бактериальной системы высвобождения осмолитов, управляемой натяжением. а – Кинетика рассеяния света, зарегистрированная в экспериментах с остановленным потоком на суспензии клеток E. coli, подвергаемых осмотическому шоку от 1200 мОсм до различных конечных осмолярностей (показаны справа от кривых). Интенсивность рассеяния отражает соотношение показателей преломления внутри и вне клетки, которое падает в результате высвобождения осмолита (адаптировано из Cetiner et al., 2017 [6]). б – Записи тока, полученные с участка мембраны, вырезанного из гигантского бактериального сферопласта (штамм Frag1). Стимул представляет собой линейно растущее отрицательное давление (рампу), прикладываемое к пипетке, которая растягивает участок мембраны. Две волны тока принадлежат двум популяциям каналов: низкопороговому MscS, за которым следует активация высокопорогового канала MscL.
Канал большой проводимости MscL. Канал MscL первоначально был обнаружен в E. coli [36], и большинство параметров было определено экспериментально для этого вида [93, 97, 99]. Однако кристаллическая структура была получена для его гомолога из Mycobacterium tuberculosis (TbMscL) [90], который на 29% идентичен EcMscL. Недавно опубликованное моделирование кристаллической структуры TbMscL (2OAR) в липидном окружении иллюстрирует его механизм открытия, напоминающий открытие ирисовой диафрагмы. На рис. 9а (слева) показана структура канала и этапы открывания, полученные с использованием молекулярной динамики локально-распределенного натяжения (LDT-MD) [98]. Канал представляет собой комплекс из пяти 125-аминокислотных цепей, каждая из которых имеет две трансмембранные спирали (TM1,TM2); взаимное положение TM1 и TM2 указывает на обмен спиралей между соседними субъединицами. В этой конфигурации периплазматические петли физически соединяют все субъединицы, что делает канал чрезвычайно стабильным. И N-, и С-концы находятся в цитоплазме; С-концевые спирали образуют пучок с пятикратной симметрией. Пять внутренних спиралей TM1 образуют плотное сужение (гидрофобные ворота), выстланное алифатическими боковыми цепями I14 и V21. Во всех опубликованных моделях вода вытесняется из всей области сужения, поэтому внутри ворота имеют обезвоженный объем или, как иногда говорят, «заперты паром». Натяжение мембраны, передаваемое в основном через приграничные участки липидного бислоя, вызывает постепенный наклон спаренных TM1-TM2 спиралей с одновременным расширением поры. Проходя через низкопроводящее промежуточное расширенное состояние, канал переходит в полностью открытое состояние, характеризующееся наклоном спирали ~30° и латеральным расширением белкового комплекса на ~20 нм2. В слегка уплощенной открытой конформации имеется полностью сольватированная пора радиусом 1.5 нм с расчетной проводимостью 2.5 нСм (в 200 мМ KCl). С-концевой спиральный пучок со своими линкерами образует фильтр, контролирующий цитоплазматический вход в пору. Моделирование процесса открытия методом LDT-MD в сочетании с методом метадинамики позволило Rajeshwar и коллегам [98] рассчитать профиль свободной энергии канала при различных натяжениях, приложенных к белку (рис. 9б).
Рис. 9.
Механизм открывания MscL. а – Открывание TbMscL, смоделированное с использованием метода LDT-MD. Узкая конформация слева представляет собой кристаллическую структуру (PDB ID 1MSL). Структура была уравновешена в бислое PE/PG и растягивалась под действием радиальных сил, приложенных к граничным липидам. Проходя через расширенное промежуточное состояние, канал переходит в открытое состояние, характеризующееся большим наклоном спиральных пар TM2-TM2 (правая панель). б – Энергетические профили, рассчитанные при различных натяжениях вдоль координаты расширения. в – Примеры записей токов одиночных каналов для дикого типа и мутанта с усиленной функцией V23D MscL, их идеализация (красная запись). г – Энергетический профиль для EcMscL, реконструированный по кинетическим данным (Анишкин и др., 2005 [103]). ΔAcb – расстояние от дна ямы зарытого состояния до вершины барьера перехода, составляющее примерно 0.65 расстояния между дном ямы закрытого и дном ямы открытого состояний, ΔAco.
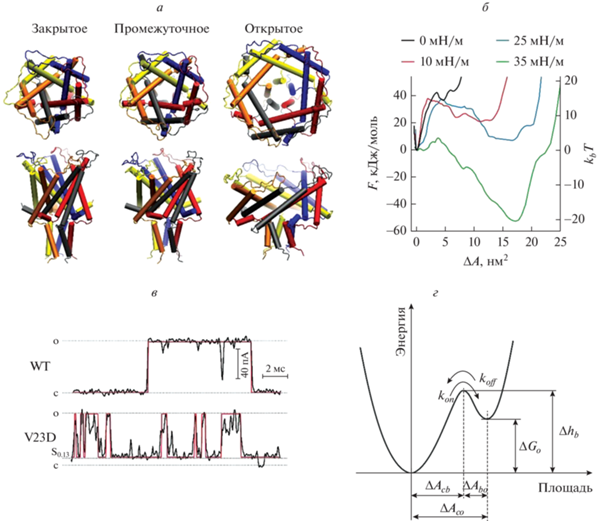
Экспериментальные параметры открывания E. coli MscL, такие как натяжение в средней точке активации, определяли путем реконструирования в гигантских однослойных липосомах и визуализации кривизны участка мембраны в ходе стимуляции [99]. В настоящее время общепризнано, что натяжение полуактивации (γ1/2) для MscL составляет около 12 мН/м [8, 99, 100]. С этим параметром кривые активации были аппроксимированы с использованием уравнения Больцамана (ур. 1), и было выяснено, что разность энергий открытого и закрытого состояний в отсутствие натяжения (G0) составляет ~ 50 kT (125 кДж/моль), а увеличение латеральной площади при переходе (ΔA) составляет около 20 нм2 [93]. Таким образом, изменение площади канала 17 нм2, рассчитанное для TbMscL, хорошо соответствует изменению площади, экспериментально определенному для гомологичного EcMscL. Подобный ирису характер смещений спиралей был подтвержден многочисленными экспериментами, в которых использовали сшивание доменов в открытом состоянии дисульфидными мостиками [101], определение липидной и водной доступности различных спиральных доменов с помощью электронного парамагнитного резонанса [102], а также мономолекулярную (single-molecule) флуоресценцию резонансного переноса энергии [97]. Важно отметить, что полностью десольватированные ворота в значительной степени определяют высокий барьер перехода в MscL, что также делает переходы практически мгновенными и сильно согласованными (рис. 9в). Введение в ворота зарядовой мутации с усилением функции (V23D, соответствует положению V21 ворот TbMscL) предрасполагает канал к спонтанному открытию и разбивает синхронные переходы на множество субпроводящих состояний [103].
Параметры латерального расширения площади для открытия MscL, определяемые из эксперимента [93] и из моделирования [98], оказываются близки. Дополнительный параметр, описывающий положение барьера, разделяющего закрытое и открытое состояния в EcMscL, был определен путем анализа индивидуальных зависимостей скоростей открытия (kon) и закрытия (koff) от натяжения [103, 104]. Наклоны этих зависимостей определяют положение переходного барьера при растяжении комплекса примерно до 0.65 от общего изменения площади (рис. 9г) между закрытым и открытым состояниями для MscL дикого типа. Расположение барьера ближе к открытому состоянию делает энергетическую яму, соответствующую закрытому состоянию, более широкой. Поэтому предполагается, что закрытая конформация будет “мягче”, чем открытая, и канал должен пройти существенное “скрытое” расширение, прежде чем он преодолеет переходный барьер и откроется.
Этот переход, сопровождаемый сильным наклоном спиралей, согласуется с рассчитанным профилем латерального давления липидного бислоя [105]. Предполагается, что натяжение, передаваемое через эти пограничные слои мембраны, действует на концы трансмембранных спиралей, вызывая их наклон. Асимметрично встроенные лизолипиды, увеличивающие спонтанную кривизну, могут изгибать мембрану и действовать как мощные активирующие агенты [106].
Канал MscS и его адаптивный функциональный цикл. В экспериментах пэтч-кламп на гигантских сферопластах E. coli MscS открывается при натяжении 5–7 мН/м с наклоном кривой Po(γ), соответствующим латеральному расширению белка (ΔA) на 15–18 нм2 [89]. Приложение к участку мембраны, содержащему популяцию из ~100 каналов, ступенчатого натяжения вызывает пик тока с последующим медленным затуханием, которое представляют собой комбинацию трех процессов: закрытие из-за адаптации стимула внутри участка мембраны [107], внутренняя адаптация и полная инактивация.
Это адаптивное поведение позволяет MscS по-разному реагировать в зависимости от скорости приложения натяжения. На рис. 10а показаны четыре записи, зарегистрированные для популяции MscS в участке мембраны, при стимуляции линейно растущим во времени давлением, прилагаемым с разной скоростью [108]. Конечное давление во всех записях одинаково. Полная популяция быстро реагирует на резкое увеличение давления, но только малая часть каналов реагирует на медленное возрастание давления. Такое поведение обусловлено наличием инактивированного состояния, которое не проводит ток и не чувствительно к натяжению.
Рис. 10.
Адаптивный функциональный цикл бактериального механочувствительного канала MscS. а – Реакции популяции MscS в участке мембраны, стимулированные линейными рампами давления, прилагаемыми с разной скоростью (из Boer et al, 2011 [108]). б — Вероятности переходов открытия и инактивации в зависимости от давления в учаcтке мембраны (из Akitake et al, 2005 [89]). Вероятность инактивации достигает максимума вблизи порога открытия. в–д – Гипотетические переходы MscS в открытое и инактивированное состояния из компактного закрытого (покоящегося) состояния (в) с оценкой изменений латеральной площади. Переход в открытое состояние (г) сопровождается латеральным расширением ~18 нм2 и образованием водной поры диаметром 16 Å, окруженной выпрямленными спиралями ТМ3. Модель открытого состояния воссоздана из структуры крио-ЭМ, полученной в липидах с короткими цепями (PDB ID 6VYL). Инактивированное состояние представлено полной крио-ЭМ структурой MscS, полученной в нанодисках (PDB ID 6PWP), оно характеризующейся периферийными (TM1-TM2) спиралями, отсоединенными от образующих пору и ворота спиралей TM3. Инактивированное состояние стабилизируется умеренным натяжением (γ) и давлением макромолекул (P) в цитоплазме. Переход в инактивированное состояние включает отсоединение пар TM1–TM2 от TM3 и сопутствующее образование кристаллографического излома в точке G113, связанное с расширением канала на ~8 нм2.
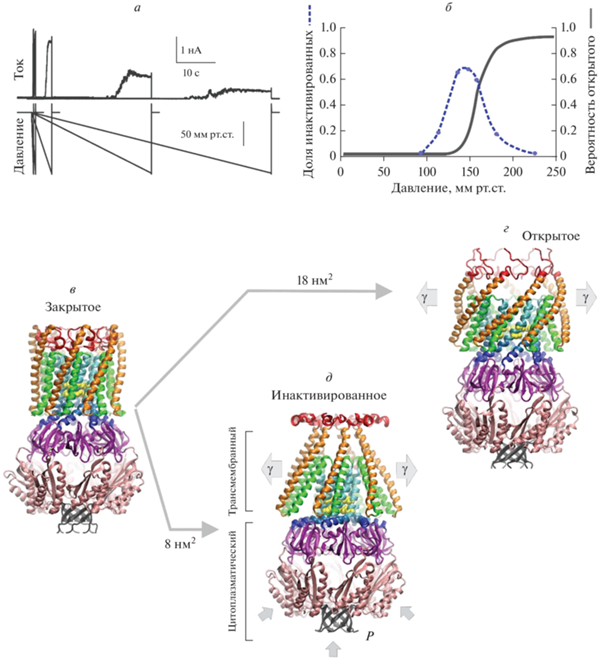
Как показывает анализ, инактивация и активация вызываются приложением натяжения, и оба процесса начинаются из закрытого состояния [109]. Эти два конформационных пути разделены частично перекрывающимся диапазонами натяжений, каждый из которых управляет отдельным процессом. MscS открывается без признаков инактивации при натяжении выше 8–9 мН/м, что заметно выше средней точки. Что касается зависимости инактивации от натяжения, то она достигает максимума у подножия кривой активации, между порогом и средней точкой (рис. 10б). После инактивации каналы остаются в непроводящем состоянии, пока приложено натяжение, но возвращаются в состояние покоя в течение 2 с после снятия натяжения.
Процесс инактивации критически зависит от натяжения мембраны, но его скорость резко возрастает в присутствии полимеров на цитоплазматической стороне участка мембраны (crowders) [110]. Таким образом, MscS учитывает два независимых механических стимула: латеральное натяжение мембраны (2D) и объемное давление, связанное с высокой плотностью непроницаемых веществ и макромолекул в цитоплазме (3D). Чтобы объяснить, как достигается этот синергизм, и проиллюстрировать полный функциональный цикл MscS, который включает как минимум три основных состояния, мы анализируем имеющиеся структуры и пытаемся с помощью моделирования и вычислений восстановить одно состояние, ранее не выявленное из анализа структур.
На рис. 10д показана структура MscS с его периплазматическим N-концевым доменом (6PWP), полученная в нанодисках [91]. В этой непроводящей конформации видны наклоненные периферические пары спиралей (TM1–TM2), образующие ребристую границу белка с липидом. Внутренние TM3 спирали выстилают центральную пору с гидрофобными воротами на цитоплазматическом конце, прямо над резким изломом. Горизонтальные части спиралей TM3, параллельные плоскости мембраны, продолжаются в длинные С-концевые домены от каждой субъединицы, которые объединяются, образуя большой полый цитоплазматический домен с семью боковыми порталами (“клетка”). Существенное расстояние от периферических спиралей TM1–TM2 до образующих ворота TM3 указывает на отсоединенное состояние ворот от доменов, воспринимающих натяжение. Это подразумевает, что структура 6PWP, вероятно, напоминает инактивированную конформацию, в которой прервана связь, передающая натяжение от липидного бислоя к воротам. Переупаковка уширенных TM1–TM2 пар ближе к TM3 позволила восстановить гипотетический физический контакт между воротами и внешними спиралями, обращенными к липиду [111]. Реконструированный гидрофобный контакт TM2–TM3, по-видимому, является “сцепляющим звеном” и путем передачи силы от липидного бислоя к воротам. Эта “компактная” модель закрытого состояния показана на рис. 10в.
Для моделирования открытого состояния мы рассмотрели кристаллическую структуру мутанта A106V (2VV5), в которой канал оказывается в полуоткрытом состоянии [112], и аналогичную структуру (6VYL), полученную методом крио-ЭМ в нанодисках, сформированных из липидов с короткими цепями [92]. Моделирование перехода открытия с экспериментально определенным расширением трансмембранного домена на 15–18 нм2 дает пору диаметром 16 Å, которая хорошо согласуется с проводимостью одиночного канала 1.1–1.2 нСм. При открывании выпрямляются спирали TM3, имеющие две консервативные шарнирные точки (глицины G113 и G121). ТМ3 спирали, таким образом, действуют как “складные распорки” [94]. Модель полностью открытого состояния, полученная из крио-ЭМ структур, представлена на рис. 10г.
Мутации, увеличивающие вероятность и скорость инактивации, представляют собой гидрофильные замены в реконструированной зоне контакта TM2–TM3. Они приводят к немедленной инактивации канала без открытия, что указывает на то, что контакт TM2-TM3 представляет собой лабильную “скользящую связь”, передающую натяжение на ворота [95]. Из зависимостей скорости инактивации и восстановления от натяжения [110] было определено, что отсоединение ворот связано с латеральным расширением примерно на 8 нм2, что согласуется с движением наружу пар TM1–TM2, как в конформациях, зафиксированных в кристалле 2OAU и крио-ЭМ структуре 6PWP.
MscS быстро инактивируется, когда на цитоплазматической стороне присутствуют макромолекулы или полимеры (5–10 об. %) [110]. Возникающее макромолекулярное давление, по-видимому, делает путь инактивации более предпочтительным. Моделирование методами МД закрытых и инактивированных моделей показало, что положение полого цитоплазматического домена таково, что цитоплазматическая часть белка более компактна в инактивированном состоянии по сравнению с закрытым состоянием [110]. Приложение радиально симметричного давления к области полого домена при моделировании МД для имитации эффекта повышения концентрации макромолекул приводит к большему расширению пар TM1–TM2, что увеличивает площадь проекции канала на мембране. Это аллостерическое взаимодействие между цитоплазматическим и трансмембранным доменами убедительно свидетельствует о том, что давление, связанное с высокой концентрацией макромолекул, будет помогать натяжению отделить периферические спирали от центральной поры и способствовать отсоединению ворот. Для объяснения биологического смысла наблюдаемого влияния высокой концентрации макромолекул на инактивацию MscS, следует предположить, что в ходе повышения проницаемости в ответ на осмотический стресс, канал получает обратную связь о состоянии цитоплазмы. Увеличенный исключенный объем макромолекул, воспринимаемый клеткообразным доменом как макромолекулярное давление, отсоединяет ворота. Этот механизм обратной связи предотвращает обезвоживание клеток при высвобождении избыточных цитоплазматических осмолитов во время адаптации тургора к гипотонической среде [110].
Такое сложное поведение MscS было отточено эволюцией для минимизации потерь метаболитов во время приспособления к широкому спектру осмотических шоков. Другая предполагаемая роль инактивации MscS, по-видимому, заключается в полной герметизации мембраны в конце периода высокой осмотической проницаемости тогда, когда клетка уже сбросила опасное давление и процесс выхода метаболитов необходимо прекратить. Важно отметить, что как у MscS, так и у MscL в непроводящем состоянии ворота полностью дегидратированы, что позволяет им оставаться полностью герметичными в закрытом состоянии во внутренней энергопреобразующей бактериальной мембране, обычно находящейся под напряжением до –180 мВ.
ЗАКЛЮЧЕНИЕ
Анализ встречаемости каналов в разных таксонах организмов показывает интересные случаи наследования молекулярной организации от менее развитых форм к более сложным, как показано на примере MscS, перешедшего с малыми изменениями к грибам и растениями от бактерий. Также имеются случаи четкого разграничения между таксонами, примером чего является MscL, который найден почти исключительно в прокариотическом мире (бактерии и археи). Некоторые типы каналов являются общими как для животных, так и для растений; к ним относятся Piezo, K2Ps, а также каналы из семейства TMEM16/OSCA. ENaC и TRP не обнаружены у высших растений. MCA каналы, специфичные для растений, никогда не встречаются у животных.
Это преобладание специфических типов механочувствительных каналов в разных таксонах, по-видимому, следует за древним разделением в зависимости от того, как организмы справляются с вездесущими осмотическими силами. Организмы, окруженные жесткой клеточной стенкой, используют гидростатическое (тургорное) давление для поддержания своей формы и объема. В этих клетках осмотически активная цитоплазматическая мембрана постоянно оказывает нормальное давление на клеточную стенку. Прокариоты, покрытые эластичным пептидогликановым слоем, обрели MscS для регуляции внутреннего тургора и гидратации цитоплазмы, а MscL – как аварийный клапан для предотвращения чрезмерного растяжения эластичного пептидогликанового слоя и мембраны. Сочетание тургора и давления, связанного с высокой концентрацией макромолекул, действующих на MscS в направлении, нормальном к плоскости мембраны, является доминирующей силой, действующей на полый цитоплазматический домен канала. Предположительно, по этой причине MscS и его гомологи обнаружены только в организмах с клеточной стенкой (бактерии, археи, водоросли, грибы и растения). Растения, окруженные особенно жесткой клеточной стенкой, унаследовали и разнообразили MscS, который теперь присутствует во всех растительных клетках и симбиотических органеллах, подверженных тургорному давлению.
Противоположная тенденция отмечается у животных, которые воспользовались сократительной способностью актомиозина и отказались от внешней стенки. Чтобы выдерживать осмотические силы, освободившиеся клетки развили мощный внутренний цитоскелет, который сдерживает осмотическое набухание за счет многочисленных точек крепления цитоскелета к сильно складчатой мембране. Большой избыток площади мембраны в типичной животной клетке обеспечивает свободу формы и регулировки объема. Предполагается, что в отсутствие сильных возмущений глобальное натяжение в мембране клеток животных близко к нулю, однако деформация клетки и прикрепление к субстрату могут вызывать локальное натяжение мембраны [113]. Предполагается, что локальные всплески натяжения будут скоротечными из-за способности мембраны течь. Каналы из семейств DEG/ENaC или TRP, для которых взаимодействие с цитоскелетом показано или предполагается, являются строго животными и не обнаружены у высших растений; однако в геномах растений присутствует единственный гомолог Piezo. Piezo, широко распространенные у животных, эволюционировали специально для функционирования в складчатой плазматической мембране, имеющей каркас, и, видимо, наиболее приспособлены для отслеживания локальных изменений натяжения. Каналы Piezo функционируют специфически в искривленных участках мембраны и регистрируют незначительное напряжение, которое не сильно растягивает, а скорее расправляет складчатую мембрану.
По-видимому, в самой ранней конструкции мембранных механопреобразователей использовался простейший принцип “сила от липида” для открывания, движимого непосредственно натяжением мембраны. TRP, K2P, Piezo унаследовали этот древний механизм, и только высокоспециализированные каналы, такие как NompC, MECs и слуховой канал, были помещены в определенные места и стали реагировать на силу в одном определенном направлении и, таким образом, оказались связаны с филаментами цитоскелета или внеклеточного матрикса. Относительно роли липидного бислоя, мы должны помнить, что Gd3+ и GsMTx4, два типичных блокатора/модификатора механочувствительных каналов, работают путем взаимодействия с липидами. Gd3+ конденсирует анионные липиды вокруг канала, индуцируя положительное давление, удерживающее канал закрытым [114]. Пептид GsMTx4 неглубоко встраивается в покоящуюся мембрану, но проникает глубже в натянутую мембрану. Привнося в мембрану свою молекулярную площадь, GsMTx4 компенсирует часть возмущающего натяжения и действует как подвижный амфипатический материал, фиксирующий латеральное давление во внешнем монослое мембраны, тем самым сдвигая кривые активации Piezo вправо [74].
Обычно методы генетического нокаута или нокдауна редко демонстрируют функциональный эффект по принципу “все или ничего”, относящийся к одному интересующему белку. Эксперименты часто выявляют несколько компонентов с перекрывающимися диапазонами чувствительности и некоторой избыточностью. Это говорит о том, что принципы эволюционируемости (evolvability) [115] полностью применимы к эволюции механосенсорных систем, которая выбрала несколько консервативных конструкций МЧ-каналов, диверсифицировала их и смешала в разных контекстах, где комбинация работает лучше, чем любой отдельный тип. Очевидное организационное сходство между липидными скрамблазами (TMEM16) и механочувствительными каналами (OSCA, TMC) подчеркивает исключительно оппортунистический ход эволюции. Комбинирование различных типов каналов с различными типами каркасов может дополнительно изменить порог и наклон активации, а также адаптивную способность.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Благодарности. Авторы благодарят Дэвида Кори и Элизабет Хасвелл за критические комментарии.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Wolfenson H., Yang B., Sheetz M.P. 2019. Steps in mechanotransduction pathways that control cell morphology. Ann. Rev. Physiol. 81, 585–605.
Yasuda N., Miura S., Akazawa H., Tanaka T., Qin Y., Kiya Y., Imaizumi S., Fujino M., Ito K., Zou Y., Fukuhara S, Kunimoto S, Fukuzaki K, Sato T, Ge J, Mochizuki N, Nakaya H, Saku K, Komuro I. 2008. Conformational switch of angiotensin II type 1 receptor underlying mechanical stress-induced activation. EMBO Rep. 9 (2), 179–186. https://doi.org/10.1038/sj.embor.7401157
Foo Y.H., Gao Y., Zhang H., Kenney L.J. 2015. Cytoplasmic sensing by the inner membrane histidine kinase EnvZ. Prog. Biophys. Mol. Biol. 118 (3), 119–129.
Abeytunge S., Gianoli F., Hudspeth A.J., Kozlov A.S. 2021. Rapid mechanical stimulation of inner-ear hair cells by photonic pressure. Elife. 10, e65930.
Handler A., Ginty D.D. 2021. The mechanosensory neurons of touch and their mechanisms of activation. Nat. Rev. Neurosci. 22 (9), 521–537.
Cetiner U., Rowe I., Schams A., Mayhew C., Rubin D., Anishkin A., Sukharev S. 2017. Tension-activated channels in the mechanism of osmotic fitness in Pseudomonas aeruginosa. J. Gen. Physiol. 149 (5), 595–609.
Corey D.P., Hudspeth A.J. 1979. Response latency of vertebrate hair cells. Biophys. J. 26 (3), 499–506.
Moe P., Blount P. 2005. Assessment of potential stimuli for mechano-dependent gating of MscL: effects of pressure, tension, and lipid headgroups. Biochemistry. 44 (36), 12239–12244.
Syeda R. 2021. Physiology and pathophysiology of mechanically activated PIEZO channels. Ann. Rev. Neurosci. 44, 383–402.
Corey D.P., Hudspeth A.J. 1979. Ionic basis of the receptor potential in a vertebrate hair cell. Nature. 281 (5733), 675–677.
Beurg M., Fettiplace R., Nam J.H., Ricci A.J. 2009. Localization of inner hair cell mechanotransducer channels using high-speed calcium imaging. Nature Neurosci. 12 (5), 553–558.
Ricci A.J., Crawford A.C., Fettiplace R. 2003. Tonotopic variation in the conductance of the hair cell mechanotransducer channel. Neuron. 40 (5), 983–990.
Longo-Guess C.M., Gagnon L.H., Cook S.A., Wu J., Zheng Q.Y., Johnson K.R. 2005. A missense mutation in the previously undescribed gene Tmhs underlies deafness in hurry-scurry (hscy) mice. Proc. Natl. Acad. Sci. USA. 102 (22), 7894–7899.
Kawashima Y., Geleoc G.S., Kurima K., Labay V., Lelli A., Asai Y., Makishima T., Wu D.K., Della Santina C.C., Holt J.R., Griffith A.J. 2011. Mechanotransduction in mouse inner ear hair cells requires transmembrane channel-like genes. J. Clin. Invest. 121 (12), 4796–4809.
Pan B., Akyuz N., Liu X.P., Asai Y., Nist-Lund C., Kurima K., Derfler B.H., Gyorgy B., Limapichat W., Walujkar S., Wimalasena L.N., Sotomayor M., Corey D.P., Holt J.R. 2018. TMC1 forms the pore of mechanosensory transduction channels in vertebrate inner ear hair cells. Neuron. 99 (4), 736–753.e6. https://doi.org/10.1016/j.neuron.2018.07.033
Cunningham C.L., Qiu X., Wu Z., Zhao B., Peng G., Kim Y.H., Lauer A., Muller U. 2020. TMIE defines pore and cating properties of the mechanotransduction channel of mmammalian cochlear hair cells. Neuron. 107 (1), 126–143. e128.
Gyobu S., Ishihara K., Suzuki J., Segawa K., Nagata S. 2017. Characterization of the scrambling domain of the TMEM16 family. Proc. Natl. Acad. Sci. USA. 114 (24), 6274–6279.
Jeong H., Clark S., Goehring A., Dehghani-Ghahnaviyeh S., Rasouli A., Tajkhorshid E., Gouaux E. 2022. Structure of C. elegans TMC-1 complex illuminates auditory mechanosensory transduction. Preprint. https://doi.org/10.21203/rs.3.rs-1623715/v1
Sotomayor M., Weihofen W.A., Gaudet R., Corey D.P. 2012. Structure of a force-conveying cadherin bond essential for inner-ear mechanotransduction. Nature. 492 (7427), 128–132.
Ge J., Elferich J., Goehring A., Zhao H., Schuck P., Gouaux E. 2018. Structure of mouse protocadherin 15 of the stereocilia tip link in complex with LHFPL5. Elife. 7.
Guharay F., Sachs F. 1984. Stretch-activated single ion channel currents in tissue-cultured embryonic chick skeletal muscle. J. Physiol. 352, 685–701.
Martinac B., Buechner M., Delcour A.H., Adler J., Kung C. 1987. Pressure-sensitive ion channel in Escherichia coli. Proc. Natl. Acad. Sci. USA. 84 (8), 2297–2301.
Gustin M.C., Zhou X.L., Martinac B., Kung C. 1988. A mechanosensitive ion channel in the yeast plasma membrane. Science. 242 (4879), 762–765.
Zhang Y., Gao F., Popov V.L., Wen J.W., Hamill O.P. 2000. Mechanically gated channel activity in cytoskeleton-deficient plasma membrane blebs and vesicles from Xenopus oocytes. J. Physiol. 523 Pt 1, 117–130.
Cosgrove D.J., Hedrich R. 1991. Stretch-activated chloride, potassium, and calcium channels coexisting in plasma membranes of guard cells of Vicia faba L. Planta. 186 (1), 143–153.
Hamill O.P., McBride D.W., Jr. 1996. The pharmacology of mechanogated membrane ion channels. Pharmacol. Rev. 48 (2), 231–252.
Bae C., Sachs F., Gottlieb P.A. 2011. The mechanosensitive ion channel Piezo1 is inhibited by the peptide GsMTx4. Biochemistry. 50 (29), 6295–6300.
Chalfie M., Sulston J. 1981. Developmental genetics of the mechanosensory neurons of Caenorhabditis elegans. Develop. Biol. 82 (2), 358–370.
Arnadottir J., Chalfie M. 2010. Eukaryotic mechanosensitive channels. Ann. Rev. Biophys. 39, 111–137.
Arnadottir J., O’Hagan R., Chen Y., Goodman M.B., Chalfie M. 2011. The DEG/ENaC protein MEC-10 regulates the transduction channel complex in Caenorhabditis elegans touch receptor neurons. J. Neurosci. 31 (35), 12695–12704.
Geffeney S.L., Goodman M.B. 2012. How we feel: Ion channel partnerships that detect mechanical inputs and give rise to touch and pain perception. Neuron. 74 (4), 609–619.
Adams C.M., Anderson M.G., Motto D.G., Price M.P., Johnson W.A., Welsh M.J. 1998. Ripped pocket and pickpocket, novel Drosophila DEG/ENaC subunits expressed in early development and in mechanosensory neurons. J. Cell Biol. 140 (1), 143–152.
Ruthe H.J., Adler J. 1985. Fusion of bacterial spheroplasts by electric fields. Biochim. Biophys. Acta. 819 (1), 105–113.
Sukharev S.I., Martinac B., Arshavsky V.Y., Kung C. 1993. Two types of mechanosensitive channels in the Escherichia coli cell envelope: Solubilization and functional reconstitution. Biophys. J. 65 (1), 177–183.
Berrier C., Besnard M., Ajouz B., Coulombe A., Ghazi A. 1996. Multiple mechanosensitive ion channels from Escherichia coli, activated at different thresholds of applied pressure. J. Membr. Biol. 151 (2), 175–187.
Sukharev S.I., Blount P., Martinac B., Blattner F.R., Kung C. 1994. A large-conductance mechanosensitive channel in E. coli encoded by mscL alone. Nature. 368 (6468), 265–268.
Levina N., Totemeyer S., Stokes N.R., Louis P., Jones M.A., Booth I.R. 1999. Protection of Escherichia coli cells against extreme turgor by activation of MscS and MscL mechanosensitive channels: Identification of genes required for MscS activity. EMBO J. 18 (7), 1730–1737.
Li Y., Moe P.C., Chandrasekaran S., Booth I.R., Blount P. 2002. Ionic regulation of MscK, a mechanosensitive channel from Escherichia coli. EMBO J. 21 (20), 5323–5330.
Edwards M.D., Black S., Rasmussen T., Rasmussen A., Stokes N.R., Stephen T.L., Miller S., Booth I.R. 2012. Characterization of three novel mechanosensitive channel activities in Escherichia coli. Channels. 6(4), 272–281.
Sukharev S. 2002. Purification of the small mechanosensitive channel of Escherichia coli (MscS): The subunit structure, conduction, and gating characteristics in liposomes. Biophys. J. 83 (1), 290–298.
Steinbacher S., Bass R., Strop P., Rees D.C. 2007. Structures of the prokaryotic mechanosensitive channels MscL and MscS. Mechanosensitive Ion Channels, Part A. 58, 1–24.
Balleza D., Gomez-Lagunas F. 2009. Conserved motifs in mechanosensitive channels MscL and MscS. Eur. Biophys. J. 38 (7), 1013–1027.
Hamilton E.S., Schlegel A.M., Haswell E.S. 2015. United in diversity: Mechanosensitive ion channels in plants. Ann. Rev. Plant Biol. 66, 113–137.
Qi Z., Kishigami A., Nakagawa Y., Iida H., Sokabe M. 2004. A mechanosensitive anion channel in Arabidopsis thaliana mesophyll cells. Plant Cell Physiol. 45 (11), 1704–1708.
Ding J.P., Pickard B.G. 1993. Mechanosensory calcium-selective cation channels in epidermal cells. Plant J. 3 (1), 83–110. https://doi.org/10.1111/j.1365-313x.1993.tb00013.x
Fujiu K., Nakayama Y., Iida H., Sokabe M., Yoshimura K. 2011. Mechanoreception in motile flagella of Chlamydomonas. Nature Cell Biol. 13 (5), 630–632.
Procko C., Murthy S., Keenan W.T., Mousavi S.A.R., Dabi T., Coombs A., Procko E., Baird L., Patapoutian A., Chory J. 2021. Stretch-activated ion channels identified in the touch-sensitive structures of carnivorous Droseraceae plants. Elife. 10.
Maathuis F.J.M. 2011. Vacuolar two-pore K+ channels act as vacuolar osmosensors. New Phytol. 191 (1), 84–91.
Murthy S.E., Dubin A.E., Whitwam T., Jojoa-Cruz S., Cahalan S.M., Mousavi S.A.R., Ward A.B., Patapoutian A. 2018. OSCA/TMEM63 are an evolutionarily conserved family of mechanically activated ion channels. Elife. 7.
Honore E., Patel A.J., Chemin J., Suchyna T., Sachs F. 2006. Desensitization of mechano-gated K2P channels. Proc. Natl. Acad. Sci. USA. 103 (18), 6859–6864.
Honore E. 2007. The neuronal background K2P channels: Focus on TREK1. Nat. Rev. Neurosci. 8 (4), 251–261.
Brohawn S.G., Su Z., MacKinnon R. 2014. Mechanosensitivity is mediated directly by the lipid membrane in TRAAK and TREK1 K+ channels. Proc. Natl. Acad. Sci. USA. 111 (9), 3614–3619.
Brohawn S.G., del Marmol J., MacKinnon R. 2012. Crystal structure of the human K2P TRAAK, a lipid- and mechano-sensitive K+ ion channel. Science. 335 (6067), 436–441.
Gees M., Owsianik G., Nilius B., Voets T. 2012. TRP channels. Comprehensive Physiol. 2 (1), 563–608.
Zhou X.L., Batiza A.F., Loukin S.H., Palmer C.P., Kung C., Saimi Y. 2003. The transient receptor potential channel on the yeast vacuole is mechanosensitive. Proc. Natl. Acad. Sci. USA. 100 (12), 7105–7110.
Ahmed T., Nisler C.R., Fluck E.C., 3rd, Walujkar S., Sotomayor M., Moiseenkova-Bell V.Y. 2022. Structure of the ancient TRPY1 channel from Saccharomyces cerevisiae reveals mechanisms of modulation by lipids and calcium. Structure. 30 (1), 139–155. e135.
Loukin S., Su Z., Zhou X., Kung C. 2010. Forward genetic analysis reveals multiple gating mechanisms of TRPV4. J. Biol. Chem. 285 (26), 19884–19890.
Jin P., Bulkley D., Guo Y., Zhang W., Guo Z., Huynh W., Wu S., Meltzer S., Cheng T., Jan L.Y. Jan Y.N., Cheng Y. 2017. Electron cryo-microscopy structure of the mechanotransduction channel NOMPC. Nature. 547 (7661), 118–122. https://doi.org/10.1038/nature22981
Liang X., Madrid J., Gartner R., Verbavatz J.M., Schiklenk C., Wilsch-Brauninger M., Bogdanova A., Stenger F., Voigt A., Howard J. 2013. A NOMPC-dependent membrane-microtubule connector is a candidate for the gating spring in fly mechanoreceptors. Curr. Biol. 23 (9), 755–763.
Wang Y., Guo Y., Li G., Liu C., Wang L., Zhang A., Yan Z., Song C. 2021. The push-to-open mechanism of the tethered mechanosensitive ion channel NompC. Elife. 10.
Nauli S.M., Alenghat F.J., Luo Y., Williams E., Vassilev P., Li X., Elia A.E., Lu W., Brown E.M., Quinn S.J., Ingber D.E., Zhou J. 2003. Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nature Genetics. 33 (2), 129–137. https://doi.org/10.1038/ng1076
Delmas P. 2004. The gating of polycystin signaling complex. Biol. Res. 37 (4), 681–691.
Kunzelmann K. 2015. TMEM16, LRRC8A, bestrophin: chloride channels controlled by Ca2+ and cell volume. Trends Biochem. Sci. 40 (9), 535–543.
Syeda R., Qiu Z., Dubin A.E., Murthy S.E., Florendo M.N., Mason D.E., Mathur J., Cahalan S.M., Peters E.C., Montal M., Patapoutian A. 2016. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499–511. https://doi.org/10.1016/j.cell.2015.12.031
Saotome K., Murthy S.E., Kefauver J.M., Whitwam T., Patapoutian A., Ward A.B. 2018. Structure of the mechanically activated ion channel Piezo1. Nature. 554 (7693), 481–486.
Coste B., Mathur J., Schmidt M., Earley T.J., Ranade S., Petrus M.J., Dubin A.E., Patapoutian A. 2010. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science. 330 (6000), 55–60.
Lewis A.H., Grandl J. 2015. Mechanical sensitivity of Piezo1 ion channels can be tuned by cellular membrane tension. Elife. 4.
Cox C.D., Bae C., Ziegler L., Hartley S., Nikolova-Krstevski V., Rohde P.R., Ng C.A., Sachs F., Gottlieb P.A., Martinac B. 2016. Removal of the mechanoprotective influence of the cytoskeleton reveals PIEZO1 is gated by bilayer tension. Nature Comm. 7, 10366.
Maneshi M.M., Ziegler L., Sachs F., Hua S.Z., Gottlieb P.A. 2018. Enantiomeric Abeta peptides inhibit the fluid shear stress response of PIEZO1. Sci. Rep. 8 (1), 14267.
Guo Y.R., MacKinnon R. 2017. Structure-based membrane dome mechanism for Piezo mechanosensitivity. Elife. 6.
Wang L., Zhou H., Zhang M., Liu W., Deng T., Zhao Q., Li Y., Lei J., Li X., Xiao B. 2019. Structure and mechanogating of the mammalian tactile channel PIEZO2. Nature. 573 (7773), 225–229.
Lee W., Leddy H.A., Chen Y., Lee S.H., Zelenski N.A., McNulty A.L., Wu J., Beicker K.N., Coles J., Zauscher S., Grandl J., Sachs F., Guilak F., Liedtke W.B. 2014. Synergy between Piezo1 and Piezo2 channels confers high-strain mechanosensitivity to articular cartilage. Proc. Natl. Acad. Sci. USA. 111 (47), E5114–E5122. https://doi.org/10.1073/pnas.1414298111
Zeng W.Z., Marshall K.L., Min S., Daou I., Chapleau M.W., Abboud F.M., Liberles S.D., Patapoutian A. 2018. PIEZOs mediate neuronal sensing of blood pressure and the baroreceptor reflex. Science. 362 (6413), 464–467.
Gnanasambandam R., Ghatak C., Yasmann A., Nishizawa K., Sachs F., Ladokhin A.S., Sukharev S.I., Suchyna T.M. 2017. GsMTx4: Mechanism of inhibiting mechanosensitive ion channels. Biophys. J. 112 (1), 31–45.
Xiao B. 2020. Levering mechanically activated piezo channels for potential pharmacological intervention. Ann. Rev. Pharmacol. Toxicol. 60, 195–218.
Young M., Lewis A.H., Grandl J. 2022. Physics of mechanotransduction by Piezo ion channels. J. Gen. Physiol. 154 (7).
Carattino M.D., Sheng S., Kleyman T.R. 2004. Epithelial Na+ channels are activated by laminar shear stress. J. Biol. Chem. 279(6), 4120–4126.
Corey D.P., Hudspeth A.J. 1983. Kinetics of the receptor current in bullfrog saccular hair cells. J. Neurosci. 3 (5), 962–976.
Markin V.S., Sachs F. 2004. Thermodynamics of mechanosensitivity. Phys. Biol. 1(1–2), 110–124.
Hille B. 2001. Ion channels of excitable membranes. 3rd edn. Sunderland. Mass.: Sinauer, 2001.
Sachs F. 2010. Stretch-activated ion channels: What are they? Physiol. 25(1), 50–56.
Zheng W., Gracheva E.O., Bagriantsev S.N. 2019. A hydrophobic gate in the inner pore helix is the major determinant of inactivation in mechanosensitive Piezo channels. Elife. 8.
Vollrath M.A., Kwan K.Y., Corey D.P. 2007. The micromachinery of mechanotransduction in hair cells. Ann. Rev. Neurosci. 30, 339–365.
Markin V.S., Hudspeth A.J. 1995. Gating-spring models of mechanoelectrical transduction by hair cells of the internal ear. Ann. Rev. Biophys. Biomol. Struct. 24, 59–83.
Cheung E.L., Corey D.P. 2006. Ca2+ changes the force sensitivity of the hair-cell transduction channel. Biophys. J. 90 (1), 124–139.
Kachar B., Parakkal M., Kurc M., Zhao Y., Gillespie P.G. 2000. High-resolution structure of hair-cell tip links. Proc. Natl. Acad. Sci. USA. 97 (24), 13 336–13 341.
Powers R.J., Kulason S., Atilgan E., Brownell W.E., Sun S.X., Barr-Gillespie P.G., Spector A.A. 2014. The local forces acting on the mechanotransduction channel in hair cell stereocilia. Biophys. J. 106(11), 2519–2528.
Bialecka-Fornal M., Lee H.J., Deberg H.A., Gandhi C.S., Phillips R. 2012. Single-cell census of mechanosensitive channels in living bacteria. PLoS One. 7(3), e33077.
Akitake B., Anishkin A., Sukharev S. 2005. The “dashpot” mechanism of stretch-dependent gating in MscS. J. Gen. Physiol. 125 (2), 143–154.
Chang G., Spencer R.H., Lee A.T., Barclay M.T., Rees D.C. 1998. Structure of the MscL homolog from Mycobacterium tuberculosis: A gated mechanosensitive ion channel. Science. 282 (5397), 2220–2226.
Reddy B., Bavi N., Lu A., Park Y., Perozo E. 2019. Molecular basis of force-from-lipids gating in the mechanosensitive channel MscS. Elife. 8.
Zhang Y., Daday C., Gu R.X., Cox C.D., Martinac B., de Groot B.L., Walz T. 2021. Visualization of the mechanosensitive ion channel MscS under membrane tension. Nature. 590 (7846), 509–514.
Chiang C.S., Anishkin A., Sukharev S. 2004. Gating of the large mechanosensitive channel in situ: estimation of the spatial scale of the transition from channel population responses. Biophys. J. 86 (5), 2846–2861.
Akitake B., Anishkin A., Liu N., Sukharev S. 2007. Straightening and sequential buckling of the pore-lining helices define the gating cycle of MscS. Nat. Struct. Mol. Biol. 14 (12), 1141–1149.
Belyy V., Anishkin A., Kamaraju K., Liu N., Sukharev S. 2010. The tension-transmitting 'clutch' in the mechanosensitive channel MscS. Nat. Struct. Mol. Biol. 17 (4), 451–458.
Vasquez V., Sotomayor M., Cordero-Morales J., Schulten K., Perozo E. 2008. A structural mechanism for MscS gating in lipid bilayers. Science. 321 (5893), 1210–1214.
Corry B., Hurst A.C., Pal P., Nomura T., Rigby P., Martinac B. 2010. An improved open-channel structure of MscL determined from FRET confocal microscopy and simulation. J. Gen. Physiol. 136 (4), 483–494.
Rajeshwar T.R., Anishkin A., Sukharev S., Vanegas J.M. 2021. Mechanical activation of MscL revealed by a locally distributed tension molecular dynamics approach. Biophys. J. 120 (2), 232–242.
Sukharev S.I., Sigurdson W.J., Kung C., Sachs F. 1999. Energetic and spatial parameters for gating of the bacterial large conductance mechanosensitive channel, MscL. J. Gen. Physiol. 113 (4), 525–540.
Nomura T., Cranfield C.G., Deplazes E., Owen D.M., Macmillan A., Battle A.R., Constantine M., Sokabe M., Martinac B. 2012. Differential effects of lipids and lyso-lipids on the mechanosensitivity of the mechanosensitive channels MscL and MscS. Proc. Natl. Acad. Sci. USA. 109 (22), 8770–8775.
Betanzos M., Chiang C.S., Guy H.R., Sukharev S. 2002. A large iris-like expansion of a mechanosensitive channel protein induced by membrane tension. Nat. Struct. Biol. 9 (9), 704–710.
Perozo E., Cortes D.M., Sompornpisut P., Kloda A., Martinac B. 2002. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418 (6901), 942–948.
Anishkin A., Chiang C.S., Sukharev S. 2005. Gain-of-function mutations reveal expanded intermediate states and a sequential action of two gates in MscL. J. Gen. Physiol. 125 (2), 155–170.
Sukharev S.I., Sigurdson W.J., Kung C., Sachs F. 1999. Energetic and spatial parameters for gating of the bacterial large conductance mechanosensitive channel, MscL. J. Gen. Physiol. 113 (4), 525–540.
Gullingsrud J., Schulten K. 2004. Lipid bilayer pressure profiles and mechanosensitive channel gating. Biophys. J. 86 (6), 3496–3509.
Perozo E., Kloda A., Cortes D.M., Martinac B. 2002. Physical principles underlying the transduction of bilayer deformation forces during mechanosensitive channel gating. Nat. Struct. Biol. 9 (9), 696–703.
Belyy V., Kamaraju K., Akitake B., Anishkin A., Sukharev S. 2010. Adaptive behavior of bacterial mechanosensitive channels is coupled to membrane mechanics. J. Gen. Physiol. 135 (6), 641–652.
Boer M., Anishkin A., Sukharev S. 2011. Adaptive MscS gating in the osmotic permeability response in E. coli: The question of time. Biochemistry. 50 (19), 4087–4096.
Kamaraju K., Belyy V., Rowe I., Anishkin A., Sukharev S. 2011. The pathway and spatial scale for MscS inactivation. J. Gen. Physiol. 138 (1), 49–57.
Rowe I., Anishkin A., Kamaraju K., Yoshimura K., Sukharev S. 2014. The cytoplasmic cage domain of the mechanosensitive channel MscS is a sensor of macromolecular crowding. J. Gen. Physiol. 143 (5), 543–557.
Anishkin A., Akitake B., Sukharev S. 2008. Characterization of the resting MscS: Modeling and analysis of the closed bacterial mechanosensitive channel of small conductance. Biophys. J. 94 (4), 1252–1266.
Wang W., Black S.S., Edwards M.D., Miller S., Morrison E.L., Bartlett W., Dong C., Naismith J.H., Booth I.R. 2008. The structure of an open form of an E. coli mechanosensitive channel at 3.45 A resolution. Science. 321 (5893), 1179–1183.
Shi Z., Graber Z.T., Baumgart T., Stone H.A., Cohen A.E. 2018. Cell membranes resist flow. Cell. 175 (7), 1769–1779 e1713.
Ermakov Y.A., Kamaraju K., Sengupta K., Sukharev S. 2010. Gadolinium ions block mechanosensitive channels by altering the packing and lateral pressure of anionic lipids. Biophys. J. 98 (6), 1018–1027.
Kirschner M., Gerhart J. 1998. Evolvability. Proc. Natl. Acad. Sci. USA. 95 (15), 8420–8427.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


