Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 2, стр. 142-146
Моноклональная линия клеток, коэкспрессирующих генетически кодируемые сенсоры cAMP и Ca2+
П. Д. Котова a, *, О. А. Рогачевская a, С. С. Колесников a
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Пущино, Московская обл., Россия
* E-mail: p.d.kotova@gmail.com
Поступила в редакцию 05.09.2022
После доработки 29.09.2022
Принята к публикации 01.10.2022
- EDN: CNTGDU
- DOI: 10.31857/S0233475523010048
Аннотация
Множественные поверхностные рецепторы и внутриклеточные сигнальные системы вовлечены в межклеточные коммуникации и паракринные/аутокринные регуляции клеточных функций. Семейство гептаспиральных рецепторов (G-protein coupled receptor, GPCR) является самым многочисленным и участвует в регуляции практически всех физиологических процессов за счет сопряжения со множеством внутриклеточных сигнальных каскадов. Среди них ключевыми являются аденилатциклазный каскад, контролирующий внутриклеточный уровень сАМР, и фосфоинозитидный каскад, определяющий многие аспекты внутриклеточной Са2+-сигнализации. Ряд фактов свидетельствует о том, что аденилатциклазный и фосфоинозитидный каскады могут взаимно регулировать друг друга. Поэтому агонисты GPCR-рецепторов, сопряженных с аденилатциклазой, могут также влиять на внутриклеточный Са2+, и наоборот, Са2+-мобилизующие лиганды могут инициировать изменения уровня cAMP. Представляется, что одновременный мониторинг сАМР и Са2+ в цитоплазме клеток может существенно детализировать представления о сигнальных процессах, инициируемых агонистами GPCR-рецепторов. Мониторинг внутриклеточного cAMP в режиме реального времени на сегодняшний день возможен только с помощью генетически кодируемых сенсоров, такие сенсоры разработаны и для анализа внутриклеточных Ca2+-сигналов. В данной работе нами была получена моноклональная линия клеток HEK-293, коэкспрессирующих флуоресцентные сенсоры cAMP (Pink Flamindo) и Ca2+ (GEM-GECO1). Как показали физиологические тесты, полученная клеточная линия обеспечивает возможность проведения одновременного мониторинга сАМР и Са2+ с достаточной чувствительностью. Такой инструмент существенно расширяет возможности исследования агонист-зависимых внутриклеточных процессов и, в частности, анализа интерференции cAMP- и Ca2+-сигнальных систем.
Для восприятия внешних стимулов клетки экспрессируют на плазматической мембране различные рецепторы, связывание которых с первичными медиаторами, такими как экстраклеточные гормоны, нейротрансмиттеры, цитокины или факторы роста, приводит к выработке внутри клетки вторичных посредников. Вторичные медиаторы представляют собой небольшие молекулы, которые передают сигналы к эффекторным молекулам, запуская многочисленные биохимические процессы, результатом которых являются специфические клеточные ответы на внеклеточные стимулы. Универсальными вторичными медиаторами являются молекулы циклического аденозинмонофосфата (cAMP) и ионы кальция (Ca2+).
Первой молекулой, идентифицированной как вторичный медиатор, был cAMP, который регулирует множественные внутриклеточные процессы. Активация гептаспиральных (G-protein coupled receptor, GPCR) рецепторов, сопряженных с Gs- или Gi/o-белком, приводит к стимуляции или ингибированию аденилатциклазы соответственно, в результате чего уровень внутриклеточного cAMP изменяется. Действие cAMP опосредовано работой первичных эффекторных молекул, а именно протеинкиназы А (PKA), фактора обмена гуанин-нуклеотидов (Epac) и циклонуклеотид-зависимых ионных каналов. Активация PKA приводит к фосфорилированию множества белков-мишеней, в том числе различных факторов, усиливающих транскрипцию определенных генов. Работа циклонуклеотид-зависимых каналов играет ключевую роль в фоторецепции, обонянии и сердечной сократимости. Epac стимулирует активность GTP-азы Rap1, что приводит к активации фосфолипазы Cε и стимуляции внутриклеточных и ядерных Ca2+-сигналов. Передача cAMP-сигналов завершается посредством действия фосфодиэстераз, деградирующих cAMP, и фосфатаз, противодействующих PKA-опосредованному фосфорилированию [1, 2].
Ионы Ca2+ являются универсальным вторичным медиатором, контролирующим множество важнейших физиологических процессов, от передачи нервного импульса и сокращения мышечных волокон до пролиферации, дифференцировки и программируемой клеточной гибели. В связи с этим уровень внутриклеточного Ca2+ жестко контролируется при участии соответствующих каналов, насосов и Са2+-связывающих белков. В ответ на различные внешние сигналы уровень цитоплазматического Ca2+ может значительно повышаться за счет входа Ca2+ снаружи или его высвобождения из внутриклеточных депо. Например, активация GPCR-рецепторов, сопряженных с Gq-белком, приводит к активации фосфолипазы Cβ и последующему расщеплению фосфатидилинозитол-4,5-бисфосфата (PIP2) и продукции инозитол-1,4,5-трисфосфата (IP3) и диацилглицерина (DAG). Связывание IP3-рецепторов с IP3 и Ca2+ приводит к высвобождению Ca2+ из эндоплазматического ретикулума и усилению этих Ca2+-сигналов преимущественно при помощи механизма Ca2+-индуцированного выброса Ca2+ из внутриклеточных депо (Сa2+-induced Ca2+ release). Частичное опустошение ретикулума приводит к взаимодействию белков его мембраны STIM с Сa2+-каналами плазматической мембраны Orai, входу наружного Ca2+ в цитозоль (store-operated calcium entry) и его загрузке в ретикулум посредством Ca2+-ATP-азы [1, 2].
Функционируя в ткани, клетки в норме могут подвергаться одновременному воздействию многих стимулов, активирующих различные сигнальные пути. В этих условиях Ca2+- и cAMP-сигнальные системы активны одновременно и могут оказывать влияние друг на друга. Так, Ca2+ модулирует активность аденилатциклаз, стимулируя AC1, AC8 и AC3, ингибируя AC5 и AC6, а также Ca2+-чувствительных фосфодиэстераз. При этом механизмы генерации Ca2+-сигналов регулируются при участии cAMP/PKA-пути на всех уровнях. Например, активация cAMP/PKA-пути приводит к фосфорилированию Gq-белков и фосфолипазы Cβ, что подавляет выработку IP3, контролируя таким образом начальные стадии трансдукции Ca2+-сигнала. На уровне высвобождения Ca2+ из внутриклеточных депо cAMP напрямую или посредством PKA может повышать вероятность открытия IP3-рецепторов, причем рианодиновые рецепторы также являются субстратом для PKA. Активация PKA также регулирует вход Ca2+ через STIM/Orai. В кардиомиоцитах активация PKA посредством воздействия на фосфоламбан потенцирует работу Ca2+-ATP-азы саркоплазматического ретикулума, способствуя выбросу депонированного Ca2+. Заключительная стадия Ca2+-сигнала контролируется PKA посредством активации IP3-киназы, преобразующей IP3 в IP4, а также с помощью активации Ca2+-ATP-азы плазматической мембраны [1, 2].
Методы исследования внутриклеточных сигнальных путей, в частности, основаны на мониторинге соответствующих вторичных медиаторов. Мониторинг внутриклеточного Ca2+ традиционно осуществляется методом микрофотометрии (Ca2+-imaging) с помощью синтетических флуоресцентных Са2+-зондов. Способность таких зондов проникать через плазматическую мембрану и аккумулироваться внутри живой клетки дает возможность изучать Ca2+-процессы в динамике и на уровне одиночных клеток. Синтетических флуоресцентных зондов для cAMP не разработано, в связи с этим мониторинг cAMP внутри живой клетки стал возможен только с появлением генетически кодируемых флуоресцентных сенсоров. Работа большинства таких сенсоров основана на Фёрстеровском переносе энергии (FRET), однако методика измерения FRET крайне сложна и требует специализированного оборудования для регистрации эмиссии флуоресценции на двух длинах волн. Недавно были разработаны одноволновые флуоресцентные генетически кодируемые сенсоры cAMP, что сделало мониторинг этой молекулы более доступным технически [3, 4]. Для мониторинга внутриклеточного Ca2+ также созданы генетически кодируемые флуоресцентные сенсоры, обладающие различными спектральными характеристиками [5]. Таким образом, последние разработки в области генетически кодируемых сенсоров делают возможным проведение мониторинга внутриклеточных cAMP и Ca2+ одновременно, что позволяет исследовать взаимодействие этих сигнальных путей. Данная работа была направлена на получение клеток, коэкспрессирующих генетически кодируемые флуоресцентные сенсоры cAMP и Са2+. Представляется, что для повышения эффективности работы такого инструмента необходимо, чтобы базовые клетки эндогенно экспрессировали множество рецепторных и сигнальных белков. Таким свойством обладают клетки HEK-293, в связи с чем именно эта линия была выбрана в качестве материнской [6].
Для проведения одновременного мониторинга флуоресценции нескольких сенсоров необходимо, чтобы не пересекались либо спектры возбуждения их флуоресценции (λex), либо спектры эмиссии флуоресценции (λem) всех используемых сенсоров. Для мониторинга внутриклеточного cAMP на сегодняшний день разработано несколько одноволновых флуоресцентных генетически кодируемых сенсоров, одними из лучших характеристик среди них обладает Pink Flamindo, флуоресцирующий в оранжевой области спектра (λex = 567 нм, λem = 590 нм) [4]. Имеющиеся в настоящий момент генетически кодируемые сенсоры Са2+ характеризуются разнообразными спектральными характеристиками, и для работы в комбинации с Pink Flamindo нами был выбран GEM-GECO1, флуоресцирующий в синей и зеленой областях спектра (λex = 390 нм, λem1 = 455 нм, λem2 = 511 нм) [5]. Ни спектры возбуждения, ни спектры эмиссии Pink Flamindo и GEM-GECO1 не пересекаются, что позволяет проводить одновременный и независимый мониторинг внутриклеточных cAMP и Са2+. Таким образом, для получения заявленной клеточной линии HEK-293 трансфицировали плазмидными векторами, обеспечивающими гетерологичную экспрессию сенсоров Pink Flamindo и GEM-GECO1.
Следует отметить, что в результате липофекции клеток HEK-293 плазмидным вектором доля клеток, экспрессирующих целевой белок, редко достигает половины даже после селекции в присутствии антибиотика, при этом уровень экспрессии белка интереса значительно варьируется от клетки к клетке и быстро падает с течением времени. Между тем, в качестве эффективного инструмента для исследования физиологических процессов желательно, чтобы большая доля модельных клеток экспрессировала генетически кодируемые сенсоры постоянно и на высоком уровне. Такого результата можно достичь, получив моноклональную клеточную линию.
В данной работе клетки HEK-293 культивировали в среде DMEM (Gibco), содержащей 4.5 г/л глюкозы, 10% эмбриональной бычьей сыворотки (HyClone), 100 мг/мл гентамицина (Sigma), 2 мМ глутамина (Sigma) во влажной атмосфере c 5% содержанием CO2 в воздухе при 37°C. С целью индукции экспрессии Pink Flamindo и GEM-GECO1 клетки трансфицировали плазмидными векторами Pink Flamindo (#102356 Addgene) и CMV-GEM-GECO1 (#32442 Addgene) одновременно. Для трансфекции использовали набор для липофекции Lipofectamine 3000 (Invitrogen) по оптимизированному согласно рекомендациям производителя протоколу. Затем клетки в течение 2 недель культивировали в присутствии 700 мкг/мл селективного антибиотика G418 (Invitrogen), устойчивость к которому несет плазмидный вектор Pink Flamindo. В результате селекции на чашке оставались колонии клеток, обладающие различным уровнем флуоресценции, обусловленным различиями в уровне экспрессии встроенных сенсоров. С помощью клеточного сортера FACSAria SORP (BD Biosciences) отбирали субпопуляцию клеток, обладающих наибольшей интенсивностью флуоресценции как GEM-GECO1 (λex = 407 нм, λem = = 525 ± 10 нм), так и Pink Flamindo (λex = 561 нм, λem = 582 ± 7.5 нм) (рис. 1а–1в). Затем отобранные клетки рассаживали по одной в лунку 96-луночного планшета, содержащую ростовую среду с повышенным до 15% содержанием сыворотки. Одиночные клетки порождали колонии клеток, которые наращивали до количества, достаточного для проведения физиологических тестов.
Рис. 1.
Характеристики клеток линии HEK-PF/GG. а, б – Конфокальные изображения клеток линии HEK-PF/GG при возбуждении флуоресценции Pink Flamindo (а) и GEM-GECO1 (б). в – Cуперпозиция флуоресцентных изображений, представленных в а и б. Изображения а – в были получены с помощью лазерного сканирующего конфокального микроскопа Leica TCS SPE (Leica), оборудованного объективом с масляной иммерсией Plan Apochromat HCX PL APO Lambda Blue 63× 1.4 Oil UV (Leica), и программы Leica Application Suite Advanced Fluorescence. Флуоресценцию возбуждали при 543 и 405 нм, эмиссию регистрировали в областях 580–640 и 440–530 нм для Pink Flamindo и GEM-GECO1 соответственно. г, д – Репрезентативные регистрации Са2+- и cAMP-ответов клеток линии HEK-PF/GG на стимуляцию активатором фосфолипазы С m-3M3FBS (100 мкМ) и активатором аденилатциклазы Forskolin (35 мкМ) (г) и норадреналином (1мкМ) (д). Моменты и продолжительность аппликаций веществ обозначены горизонтальными линиями выше экспериментальных кривых. Изменение внутриклеточного Ca2+ и сАМР характеризовали относительной флуоресценцией GEM-GECO1 и Pink Flamindo соответственно, используя параметр ΔF/F0. Для GEM-GECO1 ΔF = F0 – F, для Pink Flamindo ΔF = F – F0, где F и F0 – текущая интенсивность эмиссии индикатора и его эмиссии в начале регистрации соответственно.
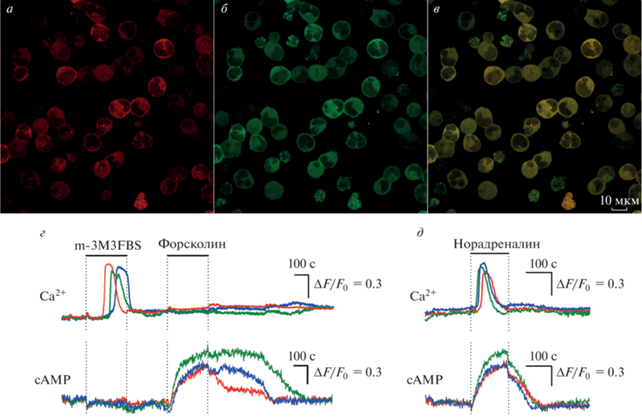
Клетки всех полученных моноклональных линий тестировали в физиологических экспериментах, а именно с помощью микрофотометрии оценивали характеристики сигналов, генерируемых клетками в ответ на стимуляцию активатором аденилатциклазы форсколином (10–50 мкМ) и активатором фосфолипазы С m-3M3FBS (100 мкМ). Для этого клетки прикрепляли ко дну фотометрической камеры с помощью адгезивного материала Cell Tak (Corning) и выдерживали при комнатной температуре 30 мин. Внеклеточный раствор содержал (мМ): NaCl – 110, KCl – 5.5, CaCl2 – 2, MgCl2 – 0.8, HEPES – 10, глюкозу – 10. Фотометрические эксперименты проводили с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss), оборудованного объективом Plan NeoFluar 20×/0.75 и цифровой EMCCD камерой LucaR (Andor Technology). Флуоресценцию клеток возбуждали при 572 ± ± 17.5 и 380 ± 5.5 нм, эмиссию регистрировали в областях 634 ± 34 и 523 ± 23 нм для Pink Flamindo и GEM-GECO1 соответственно. Количественный фотометрический анализ изображений осуществляли с использованием программы NIS Elements (Nikon). По результатам физиологического тестирования была отобрана моноклональная линия HEK-PF/GG, клетки которой демонстрировали обратимые и максимальные ответы на стимуляцию форсколином и m-3M3FBS (рис. 1г). Клетки полученной линии HEK-PF/GG также генерировали быстроразвивающиеся cAMP- и Са2+-ответы на стимуляцию норадреналином (1 мкМ) (рис. 1д). Известно, что этот агонист стимулирует аденилатциклазный и фосфолипазный сигнальные пути, взаимодействуя с адренергическими рецепторами разных типов [7]. Тот факт, что нам удалось детектировать cAMP- и Са2+-ответы клеток HEK-PF/GG на стимуляцию норадреналином в физиологических концентрациях, говорит о возможности их использования для исследования сигналов, вызываемых и другими природными агонистами GPCR-рецепторов.
Полученная в результате описанной работы моноклональная линия, клетки которой позволяют проводить одновременный мониторинг цитозольных cAMP и Са2+ в режиме реального времени, является без преувеличения долгожданным инструментом для исследования соответствующих внутриклеточных сигнальных систем и их взаимодействия.
Авторы благодарят Д.М. Поташникову за помощь в проведении работ на клеточном сортере FACSAria SORP в рамках Программы развития МГУ и А.Б. Никифорову за помощь в проведении работ на конфокальном микроскопе Leica TCS SPE.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при поддержке гранта РНФ № 19-75-10 068.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Arige V., Yule D.I. 2022. Spatial and temporal crosstalk between the cAMP and Ca2+ signaling systems. Biochim. Biophys. Acta, Mol. Cell Res. 1869 (9), 119293.
Hofer A.M. 2012. Interactions between calcium and cAMP signaling. Curr. Med. Chem. 19 (34), 5768–5773.
Massengill C.I., Day-Cooney J., Mao T., Zhong H. 2021. Genetically encoded sensors towards imaging cAMP and PKA activity in vivo. J. Neurosci. Methods. 362, 109298.
Harada K., Ito M., Wang X., Tanaka M., Wongso D., Konno A., Hirai H., Hirase H., Tsuboi T., Kitaguchi T. 2017. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Sci. Rep. 7 (1), 7351.
Zhao Y., Araki S., Wu J., Teramoto T., Chang Y.F., Nakano M., Abdelfattah A.S., Fujiwara M., Ishihara T., Nagai T., Campbell R.E. 2011. An expanded palette of genetically encoded Ca2+ indicators. Science. 333 (6051), 1888–1891.
Atwood B.K., Lopez J., Wager-Miller J., Mackie K., Straiker A. 2011. Expression of G protein-coupled receptors and related proteins in HEK293, AtT20, BV2, and N18 cell lines as revealed by microarray analysis. BMC Genomics. 12, 14.
Zink-Lorenz A., Komitowska J., Raue F. 1996. Norepinephrine induced calcitonin secretion in rat medullary thyroid carcinoma 6-23 cells: Interaction between intracellular calcium and cAMP. Exp. Clin. Endocrinol. Diabetes. 104 (1), 43–49.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


