Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 2, стр. 133-141
Катионные липоаминокислотные производные диэтаноламина как потенциально мембрано-активные антибактериальные агенты
М. К. Гусева a, З. Г. Дениева b, У. А. Буданова a, *, Ю. Л. Себякин a
a МИРЭА – Российский технологический университет,
Институт тонких химических технологий им. М.В. Ломоносова
119571 Москва, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: c-221@yandex.ru
Поступила в редакцию 23.09.2022
После доработки 21.11.2022
Принята к публикации 07.12.2022
- EDN: LANSBL
- DOI: 10.31857/S0233475523020032
Аннотация
Данная работа направлена на получение ряда катионных амфифилов на основе аминокислотных производных диэтаноламина как потенциально мембрано-активных антибактериальных агентов. Разработанные соединения содержат два остатка аминокислот в полярном блоке и различаются длиной алифатических цепей в гидрофобном домене. Амфифилы получены в препаративных количествах, достаточных для подтверждения их структур и проведения исследования антибактериальной активности. Синтезированные образцы на основе β-Ala (4c) и гамма-аминомасляной кислоты (ГАМК) (4d) с алифатической цепью С12 в гидрофобном домене проявили перспективный для дальнейших исследований уровень антимикробной активности (МИК, 1 мкг/мл) в отношении грамположительных (Bacillus subtilis) и грамотрицательных (Escherichia coli) бактерий. Амфифилы, содержащие ароматические аминокислоты L-Phe (6а) и L-Trp (6b) в полярной головной группе и углеводородную цепь С8, активны в отношении бактерий B. subtilis с МИК 1 мкг/мл. Полученные данные об антимикробной активности делают отобранные соединения привлекательными для дальнейшего детального изучения их механизма действия.
ВВЕДЕНИЕ
Быстрое распространение бактерий, устойчивых к существующим антибиотикам, ставит множество задач перед системой здравоохранения. Антибиотики, которые входят в состав стандартных протоколов лечения, со временем становятся неэффективными в отношении мультирезистентных бактерий, что провоцирует тяжелое течение инфекционных заболеваний. Поиском эффективных средств борьбы с патогенами, которые смогут пополнить антибактериальный терапевтический арсенал, занимается множество научных групп по всему миру.
Антимикробные пептиды (АМП) рассматриваются как возможно новый тип противомикробных агентов природного происхождения [1]. Они сочетают в себе противомикробную, ангиогенную и противовоспалительную активность с иммуномодулирующим действием [2]. Однако дороговизна расходных материалов, недостаточная изученность физико-химических и биологических свойств, нестабильность продукта или его токсичность для собственных клеток организма затрудняют широкое применение таких биологически активных структур [3].
Недостатки АМП стимулировали разработку новых мембрано-активных веществ – пептидомиметиков [4]. Это синтетические производные аминокислот и пептидов, предназначенные для имитации основных функций и свойств исходных фармакофоров. Выбор мембраны в качестве мишени обеспечивает преимущество пептидных агентов перед обычными антибиотиками, поскольку развитие устойчивости к ним происходит медленно или даже отсутствует. Такие молекулы сохраняют профиль активности и избирательность действия, при этом они обладают большей биодоступностью и стабильностью в физиологических условиях по сравнению с классическими АМП. За последнее десятилетие было синтезировано, выделено и изучено большое количество подобных агентов [4]. Некоторые из них уже используются в клинике [5], а некоторые проходят клинические испытания [6, 7].
Одним из наиболее перспективных направлений является использование пептидомиметиков – катионных амфифилов, которые имеют простую конструкцию и высокую стабильность, но при этом показывают перспективные результаты антимикробного действия [8]. Особый интерес к данным соединениям основан на эффективности стратегий синтеза, который не требует высоких экономических и временных затрат [9]. Основные способы получения амфифилов предполагают классические методы пептидной и липидной химии, что позволяет легко заменять или внедрять альтернативные фрагменты, представляющие собой различные аналоги аминокислот или алифатические звенья [8].
Биологическая активность амфифилов во многом зависит от архитектуры синтезируемых молекул. Она не однообразна, в отличие от прототипов, состоящих исключительно из α-аминокислотных остатков, а предполагает варьирование структуры основных фрагментов. Кроме того, возможен синтез малых молекул, центральное звено которых не представлено амидным остовом [10, 11]. В общем виде структура амфифильных молекул представлена одной или двумя алифатическими цепями, аминокислотными участками в качестве гидрофильной головной группы и спейсером, соединяющим два этих домена. Варьирование структурных элементов амфифила может влиять на биодоступность молекулы и ее токсический эффект [12]. Исследования показывают, что существует связь между длиной гидрофобного блока амфифильного соединения и минимальной ингибирующей концентрацией (МИК), которая необходима для подавления роста микроорганизмов [13].
Важнейшую роль в положительной динамике антибактериального действия играет “настройка” амфифильности данных соединений, в частности, соотношение гидрофильной части к гидрофобной – гидрофильно-липофильный баланс (ГЛБ) [14, 15]. Подбор оптимальной конструкции пептидомиметика способствует проявлению высокой антимикробной активности и снижению возможных токсических эффектов.
Целью данного исследования является разработка схемы получения и осуществление синтеза серии новых антимикробных пептидомиметиков, а также проведение предварительных биологических тестов антибактериальной активности. В качестве целевых соединений были выбраны катионные амфифилы на основе алифатических производных диэтаноламина, содержащие два остатка аминокислот в полярном блоке и различающиеся длиной алифатических цепей в гидрофобном домене. Структура синтезированных молекул предполагает их действие на мембраны бактериальных клеток, основываясь на литературных данных о подобных молекулах [8, 16, 17].
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. Реактивы для синтеза коммерчески доступны и были использованы без предварительной очистки. Спектры 1Н-ЯМР снимали в дейтерированном растворителе на импульсном ЯМР-спектрометре BrukerWM-300 (Германия) с рабочей частотой 300 МГц. Внутренний стандарт – гексаметилдисилоксан. ИК-спектры веществ регистрировали на ИК-Фурье спектрометре Bruker EQUINOX 55 (Германия). Масс-спектры регистрировали на времяпролетном масс-спектрометре VISION 2000 (Великобритания) методом MALDI, в качестве матрицы использовалась 2,4-дигидроксибензойная кислота (DHB). Тонкослойную хроматографию проводили на пластинках Сорбфил (Краснодар) и Silufol (Чехия), препаративную тонкослойную хроматографию – на силикагеле TLС standard grade (Sigma-Aldrich, Германия). Колоночную хроматографию проводили на силикагеле 0.040–0.063 мм (Merck, Германия). Обнаружение пятен веществ при тонкослойной хроматографии (ТСХ) осуществляли нагреванием над пламенем спиртовки или парах йода. Вещества, содержащие аминогруппы, обнаруживали в 5%-ном растворе нингидрина с последующим нагреванием до 50ºС. Ароматические соединения обнаруживали в ультрафиолете на пластинках Alugram Xtra SIL G/UV254.
Методы. Синтез катионных амфифилов проводили стандартными методами пептидной и липидной химии.
N-Октилдиэтаноламин (2а). Смесь 1 г (9.51 ммоль) диэтаноламина, 1.65 г (8.56 ммоль) 1-бромоктана и 6.58 г (47.6 ммоль) карбоната калия в 20 мл ацетонитрила перемешивали при 80°C в течение 24 ч. После завершения реакции избыток карбоната калия отфильтровывали, растворитель удаляли под вакуумом. Полученную массу растворяли в 25 мл этилацетата, промывали дистиллированной водой (3 × 20 мл) и сушили над сульфатом натрия. Продукт выделяли с помощью колоночной хроматографии в системе хлороформ:метанол 9 : 1. Получали 837 мг продукта 2а (45%).
1Н-ЯМР-спектр (DMSO-d6, δ, м.д.): 0.88 (т, 3Н, CH3), 1.27 (c, 10H, CH2CH2(CH2)5CH3), 1.38 (п, 2Н, CH2CH2(CH2)5CH3), 2.43 (т, 2Н, CH2CH2(CH2)5CH3), 2.51 (т, 4Н, CH2CH2NH), 3.40 (т, 4H, CH2CH2NH), 4.33 (с, 2Н, ОН).
N-Додецилдиэтаноламин (2b). N-Додецилдиэтаноламин получали аналогичным образом. Из 1 г (9.51 ммоль) диэтаноламина и 2.13 г (8.56 ммоль) 1-бромдодекана получали 1.7 г продукта 2b (74%).
1Н-ЯМР-спектр (DMSO-d6, δ, м.д.): 0.85 (т, 3Н, CH3), 1.24 (c, 18H, CH2CH2(CH2)9CH3), 1.36 (п, 2Н, CH2CH2(CH2)9CH3), 2.43 (т, 2Н, CH2CH2(CH2)9CH3), 2.51 (т, 4Н, CH2CH2NH), 3.40 (т, 4H, CH2CH2NH), 4.37 (с, 2Н, ОН).
O,O'-ди-(N-(трет-бутоксикарбонил-β-аланил) октил)диэтаноламин (3а). К раствору 220 мг (1.15 ммоль) Boc-(β-Ala)-OH в 5 мл безводного хлористого метилена при перемешивании добавляли 225 мг (1.84 ммоль) 4-диметиламинопиридина (DMAP) и раствор 380 мг (1.84 ммоль) дициклогексилкарбодиимида (DCC) в 5 мл хлористого метилена. Смесь перемешивали при 0°C в течение 15 мин. Добавляли раствор 100 мг (0.461 ммоль) продукта 2а в 5 мл хлористого метилена. Смесь выдерживали при интенсивном перемешивании в течение 24 ч. После завершения реакции отфильтровывали выпавший осадок дициклогексилмочевины, реакционную массу растворяли в 50 мл этилацетала и промывали дистиллированной водой (3 × 50 мл) и сушили над Na2SO4. После удаления растворителя на вакууме продукт выделяли колоночной хроматографией в системе толуол:этилацетат – 2 : 1. Выход продукта 3a составил 102 мг (40%).
1Н-ЯМР-спектр (CDCl3, δ, м.д.): 0.89 (т, 3Н, CH3), 1.28 (c, 10H, CH2CH2(CH2)5CH3), 1.46 (с, 18Н, CCH3), 1.94 (м, 2Н, CH2CH2(CH2)5CH3), 2.53 (т, 4Н, β-Ala: αCH2), 2.64 (т, 2Н, CH2CH2(CH2)5CH3), 2.78 (т, 4Н, CH2CH2NH), 3.41 (к, 4Н, β-Ala: βCH2), 4.18 (т, 4Н, CH2CH2NH), 5.25 (с, 2Н, NH).
ИК-спектр: (KBr), ν/см–1: 3415 (N–H); 2949, 2894 (C–H); 1743 (C=O эфир), 1720 (С=О, I амидная полоса); 1527 (N–C, II амидная полоса).
O,O'-ди-(N-(трет-бутоксикарбонил-ГАМК)октил) диэтаноламин (3b). Реакцию проводили аналогичным образом. Из 234 мг (1.15 ммоль) Boc-(ГАМК)-OH и 0.1 г (0.461 ммоль) соединения 2a получали 112 мг продукта 3b (41%).
1Н-ЯМР спектр (CDCl3, δ, м.д.): 0.89 (т, 3Н, CH3), 1.28 (c, 10H, CH2CH2(CH2)5CH3), 1.46 (с, 18Н, CCH3), 1.82 (п, 4Н, ГАМК: βCH2), 1.95 (м, 2Н, CH2CH2(CH2)5CH3), 2.37 (т, 4Н, ГАМК: αCH2), 2.52 (т, 2Н, CH2CH2(CH2)5CH3), 2.78 (т, 4Н, CH2CH2NH), 3.17 (м, 4Н, ГАМК: γCH2), 4.15 (т, 4Н, CH2CH2NH), 4.79 (с, 2Н, NH).
ИК-спектр: (KBr), ν/см–1: 3386 (N–H); 2927, 2856 см–1 (C–H); 1737 (C=O эфир); 1677 (С=О, I амидная полоса); 1521 (N–C, II амидная полоса).
O,O'-ди-(N-(трет-бутоксикарбонил-β-Ala)додецил)диэтаноламин (3c). Соединение 3c получали аналогичным образом. Из 0.34 г (1.8 ммоль) Boc-(β-Ala)-OH и 0.2 г (0.73 ммоль) соединения 2b получали 277 мг продукта 3c (62%).
1Н-ЯМР спектр (CDCl3, δ, м.д.): 0.86 (т, 3Н, CH3), 1.28 (c, 18H, CH2CH2(CH2)9CH3), 1.46 (с, 18Н, CCH3), 1.63 (п, 2Н, CH2CH2(CH2)9CH3), 2.53 (т, 4Н, β-Ala: αCH2), 2.59 (т, 2Н, CH2CH2(CH2)9CH3), 2.83 (т, 4Н, CH2CH2NH), 3.37 (м, 4Н, β-Ala: βCH2), 4.21 (т, 4Н, CH2CH2NH), 5.22 (с, 2Н, NH).
ИК-спектр: (KBr), ν/см–1: 3311 (N–H); 2958, 2902 (C-H); 1739 (C=O эфир); 1715 (С=О, I амидная полоса); 1519 (N–C, II амидная полоса).
O,O'-ди-(N-(трет-бутоксикарбонил-ГАМК) додецил)диэтаноламин (3d). Соединение 3d получали аналогичным образом. Из 0.37 г (1.8 ммоль) Boc-(ГАМК)-OH и 0.2 г (0.73 ммоль) соединения 2b получали 280 мг продукта 3d (60%).
1Н-ЯМР спектр (CDCl3, δ, м.д.): 0.87 (т, 3Н, CH3), 1.24 (c, 18H, CH2CH2(CH2)9CH3), 1.46 (с, 18Н, CCH3), 1.63 (п, 2Н, CH2CH2(CH2)9CH3), 1.80 (м, 4Н, ГАМК: βCH2), 2.36 (т, 4Н, ГАМК: αCH2), 2.49 (т, 2Н, CH2CH2(CH2)9CH3), 2.73 (т, 4Н, CH2CH2NH), 3.14 (м, 4Н, ГАМК: γCH2), 4.11 (т, 4Н, CH2CH2NH), 4.75 (с, 2Н, NH).
ИК-спектр: (KBr), ν/см–1: ИК-спектр: (KBr), ν/см–1: 3340 (N–H); 2914, 2855 см–1 (C–H); 1735 (C=O эфир); 1625 (С=О эфир, I амидная полоса); 1521 (N–C, II амидная полоса).
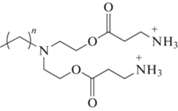
O,O'-ди-(β-аланилоктил)диэтаноламин бистрифторацетат (4а). К раствору 11 мг (0.02 ммоль) вещества 3a в 5 мл безводного хлористого метилена добавляли 33 мг (0.3 ммоль) трифторуксусной кислоты. Перемешивали 2 ч при 0°C. По завершению реакции растворитель и избыток трифторуксусной кислоты отгоняли на роторном испарителе. Конечный маслянистый продукт 4а получали с количественным выходом.
Масс-спектр, m/z: 382.18 [М + Na]+; 398.20 [М + К]+.
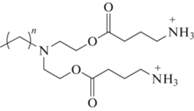
O,O'-ди-(ГАМК-октил)диэтаноламин бистрифторацетат (4b). Соединение 4b получали аналогичным образом. Из 14 мг (0.024 ммоль) соединения 3b и 41 мг (0.36 ммоль) трифторуксусной кислоты получали продукт 4b с количественным выходом.
Масс-спектр, m/z: 410.12 [М + Na]+; 426.18 [М + К]+.
O,O'-ди-(β-аланил-додецил)диэтаноламин бистрифторацетат (4c). Соединение 4c получали аналогичным образом. Из 12 мг (0.02 ммоль) соединения 3c и 41 мг (0.36 ммоль) трифторуксусной кислоты получали продукт 4c с количественным выходом.
Масс-спектр, m/z: 438.213 [М + Na]+; 454.209 [М + К]+.
O,O'-ди-(ГАМК-додецил)диэтаноламин бистрифторацетат (4d). Соединение 4d получали аналогичным образом. Из 10 мг (0.016 ммоль) соединения 3d и 27 мг (0.23 ммоль) трифторуксусной кислоты получали продукт 4d с количественным выходом.
Масс-спектр, m/z: 466.29 [М + Na]+; 485.31 [М + К]+.
O,O'-ди-(N-(трет-бутоксикарбонил-L-Phe)октил)диэтаноламин (5а). Реакцию получения 5а проводили аналогично соединению 3а. Из 0.1 г (0.46 ммоль) 2а и 0.427 г (1.6 ммоль) Boc-(Phe)-OH получали 0.24 г продукта 5a (72%).
1Н-ЯМР-спектр (CDCl3, δ, м.д.): 0.88 (т, 3Н, CH3), 1.27 (c, 10H, CH2CH2(CH2)5CH3), 1.41 (с, 18Н, CCH3), 1.54 (м, 2Н, CH2CH2(CH2)5CH3), 2.46 (т, 2Н, CH2CH2(CH2)5CH3), 2.67 (т, 4Н, CH2CH2NH), 3.10 (м, 4Н, NHCHCH2C6H5), 4.12 (т, 4Н, CH2CH2NH), 4.56 (м, 2H, NHCHCH2C6H5), 5.02 (с, 2Н, NH), 7.14–7.32 (м, 10Н, C6H5).
ИК-спектр: (KBr), ν/см–1: 3443 (N–H); 3070, 3057, 750, 709 (arC–H); 2982, 2851 см–1 (C–H); 1751 (C=O); 1678 (С=О эфир, I амидная полоса); 1516 (N–C, II амидная полоса).
O,O'-ди-(N-(трет-бутоксикарбонил-L-Trp)октил)диэтаноламин (5b). Реакцию получения 5b проводили аналогично соединению 3а. Из 0.1 г (0.4 ммоль) 2а и 0.490 г (1.6 ммоль) Boc-(Trp)-OH получали 0.2 г продукта 5b (56%).
1Н-ЯМР спектр (CDCl3, δ, м.д.): 0.90 (т, 3Н, CH3), 1.25 (c, 10H, CH2CH2(CH2)5CH3), 1.48 (с, 18Н, CCH3), 1.57 (м, 2Н, CH2CH2(CH2)5CH3), 2.24 (т, 2Н, CH2CH2(CH2)5CH3), 2.35 (т, 4Н, CH2CH2NH), 3.28 (м, 4Н, NHCHCH2C8H5NH), 3.94 (т, 4Н, CH2CH2NH), 4.62 (м, 2H, NHCHCH2C6H5NH), 5.21 (с, 2Н, NH), 7.00–7.58 (м, 12Н, C8H5NH), 8.68 (м, 2Н, C8H5NH).
ИК-спектр: (KBr), ν/см–1: 3361 (N–H); 3063, 3030, 749, 701 (arC–H); 2928, 2855 см–1 (C–H); 1721 (C=O эфир); 1715 (С=О эфир, I амидная полоса); 1500 (N–C, II амидная полоса).
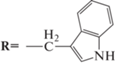
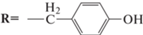
O,O'-ди-(N-(трет-бутоксикарбонил-L-Tyr)октил)диэтаноламин (5c). Реакцию получения 5c проводили аналогичным образом. Из 0.1 г (0.4 ммоль) 2а и 0.405 г (1.4 ммоль) Boc-(Tyr)-OH получали 96 мг продукта 5c (28%).
1Н-ЯМР-спектр (CDCl3, δ, м.д.): 0.88 (т, 3Н, CH3), 1.26 (c, 10H, CH2CH2(CH2)5CH3), 1.43 (с, 18Н, CCH3), 1.58 (м, 2Н, CH2CH2(CH2)5CH3), 2.34 (т, 2Н, CH2CH2(CH2)5CH3), 2.73 (т, 4Н, CH2CH2NH), 2.94 (м, 4Н, NHCHCH2C6H4), 3.65 (т, 4Н, CH2CH2NH), 4.53 (м, 2H, NHCHCH2C6H4), 4.99 (с, 2Н, NH), 6.75–7.04 (м, 10Н, C6H5), 7.25 (с, 2Н, ОН).
ИК-спектр: (KBr), ν/см–1: 3474 (N–H); 3072, 3061 (arC–H); 2934, 2854 см–1 (C–H); 1692 (C=O); 1643 (С=О эфир, I амидная полоса); 1514 (N–C, II амидная полоса).
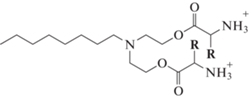
O,O'-ди-(L-Phe-октил)диэтаноламин бистрифторацетат (6а). К раствору 12 мг (0.017 ммоль) вещества 5a в 7 мл безводного CH2Cl2 добавляли 29 мг (0.25 ммоль) трифторуксусной кислоты. Перемешивали 3 ч при 0°C. По завершению реакции растворитель и избыток трифторуксусной кислоты отгоняли на роторном испарителе. Конечный маслянистый продукт 6а получали с количественным выходом.
Масс-спектр, m/z: 534.24 [М + Na]+; 550.22 [М + К]+.
O,O'-ди-(L-Trp-октил)диэтаноламин бистрифторацетат (6b). Соединение 6b получали аналогичным образом. Из 12 мг (0.013 ммоль) соединения 5b и 20 мг (0.20 ммоль) трифторуксусной кислоты получали продукт 6b с количественным выходом.
Масс-спектр, m/z: 612.16 [М + Na]+; 628.22 [М + К]+.
O,O'-ди-(L-Tyr-октил)диэтаноламин бистрифторацетат (6c). Соединение 6c получали аналогичным образом. Из 12 мг (0.016 ммоль) соединения 5b и 28 мг (0.24 ммоль) трифторуксусной кислоты получали продукт 6c с количественным выходом.
Масс-спектр, m/z: 566.40 [М + Na]+; 581.37 [М + К]+.
Определение минимальной ингибирующей концентрации (МИК) методом диффузии в агар. Исследование антибактериальной активности полученных амфифилов проводили совместно с сотрудниками базовой кафедры ФГБОУ “Научно-исследовательского института по изысканию новых антибиотиков им. Г.Ф. Гаузе”. В качестве тест-микроорганизмов использовали подготовленные суспензии Bacillus subtilis 534 и Escherichia coli M17 с концентрацией 1.5 × 108 КОЕ/мл и оптической плотностью 0.5 ед. по Мак-Фарланду. На чашки Петри наносили по 100 мкл суспензии и заливали 10 мл теплого питательного агара, перемешивали, оставляли до застывания. Потом на поверхность агара в чашках с культурами помещали стерильные диски из плотной фильтровальной бумаги (6 штук) равного размера и массы, с внутренним диаметром (6.0 ± 0.1 мм) на одинаковом расстоянии друг от друга. На диски наносили аликвоты исследуемых и контрольных образцов: по 1, 10 и 100 мкл, что соответствует 1, 10 и 100 мкг/мл вещества. После чего чашки выдерживали при комнатной температуре в течение 1–2 ч с последующим инкубированием при температуре 36 ± 1°C в течение 16–18 ч. По завершении эксперимента определяли диаметр зон подавления роста тест-микроорганизма с точностью до 1 мм. Эксперимент проводили 3 раза. В качестве препаратов сравнения использовались растворы ампициллина (Sigma-Aldrich) и ванкомицина (Acros Organics), к которым чувствительны используемые микроорганизмы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
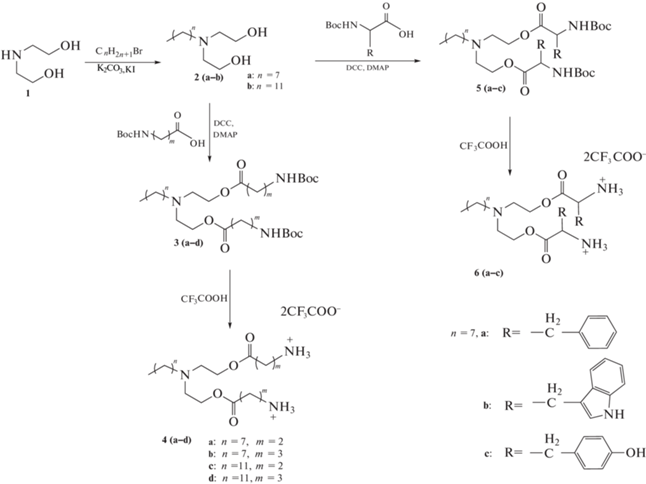
В настоящей работе была предложена и реализована схема синтеза новых катионных амфифилов на основе природных аминокислот и диэтаноламина (схема 1 ). Основным критерием выбора синтезируемых структур амфифилов стали результаты расчета гидрофильно-липофильного баланса (ГЛБ). Значения ГЛБ коррелируют с возможностью взаимодействий терапевтических молекул с компонентами клеточной стенки бактерий и проявлением антимикробной активности. Согласно литературным данным, оптимальный показатель ГЛБ соединений, проявляющих высокую антибактериальную активность, соответствует интервалу от 5 до 7 [17]. Теоретический расчет ГЛБ был проведен с использованием программы “ACD/Labs, Log P”. Была разработана библиотека химических структур на основе аминокислот и аминоспиртов и отобраны молекулы, значения ГЛБ которых лежат в диапазоне вероятной антибактериальной активности и варьируются от 3.14 до 6.49 (табл. 1). Для расчета ГЛБ в редакторе химических соединений “ChemDraw” создавали структуры получаемых соединений, которые затем загружались в программу “Log P” для автоматического расчета ГЛБ по заданным параметрам программы. Расчет значений для молекул из литературных источников [12, 17] со схожей структурой и с известным антибактериальным механизмом показал аналогичный результат. Полученные данные стали основой для разработки схем получения и синтеза соединений 4 (а–d) и 6 (a–c).
Все синтезируемые соединения имеют общий принцип строения и состоят из следующих структурных блоков: две полярные головные группы, спейсер, линкер и гидрофобный алкильный фрагмент. Гидрофильный блок представлен двумя остатками β-Ala, ГАМК, L-Phe, L-Tyr или L-Trp. В качестве спейсерного участка использовали диэтаноламин. Коммерчески доступный диэтаноламин часто входит в состав косметических и лекарственных средств из-за двух реакционноспособных функциональных групп, позволяющих синтезировать препараты с широким спектром действия [18].
Схема 1
Для формирования гидрофобного блока соединений 4 (a–d) и 6 (a–c) в данной работе предложено использовать 1-бромоктан и 1-бромдодекан. Липофильный компонент 2 (a, b) получали реакцией N-алкилирования диэтаноламина в присутствии K2CO3 в среде CH3CN. Выходы продуктов 2 (a, b) составили 45 и 74% соответственно.
Соединения 3 (a–d), содержащие Boc-защищенные алифатические аминокислоты, получали по карбодиимидному методу с использованием DCC и DMAP [19]. Выходы веществ 3 (a–d) составили 40, 41, 62 и 60% соответственно. Структуры полученных продуктов подтверждали данными 1Н-ЯМР- и ИК-спектроскопии.
Соединения 5 (a–c), содержащие Boc-защищенные ароматические аминокислоты, получали согласно вышеописанному методу. Выходы веществ 5 (a–c) составили 72, 56, 28% соответственно. Низкий выход соединения 5c, содержащего тирозин, объясняется тем, что присутствие реакционноспособной гидроксильной группы приводит к образованию трудноразделимой сложной смеси. Наличие большого количества побочных продуктов затрудняет выделение целевого соединения с незащищенной ОН-группой. Решением подобной проблемы может стать использование коммерческих общедоступных производных с защищенной гидроксильной группой, например, трет-бутильной защитой.
Конечные катионные амфифилы 4 (a–d) и 6 (a–c) получали удалением Boc-защитных групп действием трифторуксусной кислоты в среде безводного хлористого метилена (1 : 1 v/v). За ходом реакции следили по данным ТСХ. Структуры полученных солей подтверждали данными масс-спектрометрии.
Предварительную оценку антибактериального действия синтезированных соединений проводили на линии грамположительных B. subtilis 534 и грамотрицательных E. coli М17 бактерий методом диффузии бактерий в агар (табл. 2, 3). Соединения, которые в полярной группе содержат алифатические аминокислоты β-Ala (4c) и ГАМК (4d) с гидрофобной цепью С12, проявляют антибактериальную активность в отношении как грамположительных, так и грамотрицательных бактерий с МИК равной 1 мкг/мл. Амфифилы с ароматическими аминокислотами L-Phe (6а) и L-Trp (6b) в полярной головной группе и гидрофобной цепью С8 активны в отношении бактерий B. subtilis с МИК 1 мкг/мл. Таким образом, можно проследить следующую зависимость структуры и активности: для проявления высокой активности в отношении грамположительных бактерий B. subtillis необходимо проявление выраженной гидрофобности, что достигается или за счет увеличения длины углеводородной цепи до С12 при наличии алифатических аминокислот β-Ala и ГАМК, как в случае соединений 4с и 4d, или за счет введения гидрофобных ароматических кислот L-Phe и L‑Trp при сохранении длины углеводородного радикала С8, как в случае 6а и 6b. При этом, в отношении грамотрицательных бактерий E. coli данная зависимость соблюдается только для алифатических аминокислот с длинным гидрофобным фрагментом 4с и 4d, так как введение ароматических аминокислот не показало эффективности.
Таблица 2.
Размер зоны подавления роста бактерий, мм
| Вещество | Концентрация, мкг/мл |
E. coli (–) | B. subtilis (+) | ||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 1 | 2 | 3 | ||
| 4a | 1 | –* | – | – | – | – | – |
| 10 | – | – | – | – | – | – | |
| 100 | 13 × 12 | 14 × 12 | 13 × 11 | 14 × 10 | 14 × 13 | 13 × 14 | |
| 4b | 1 | – | – | – | – | – | – |
| 10 | – | – | – | – | – | – | |
| 100 | 15 | 16 | 21 | 20 | 18 × 21 | 20 | |
| 4с | 1 | 5 | 6 | 5 | 8 | 6 | 7 |
| 10 | 10 | 9 × 8 | 8 × 9 | 13 × 14 | 12 | 12 × 10 | |
| 100 | 15 × 14 | 16 × 18 | 15 | 20 × 11 | 21 × 13 | 16 × 12 | |
| 4d | 1 | 6 | 7 | 6 | 7 | 7 | 8 |
| 10 | 15 × 12 | 14 × 11 | 14 × 13 | 16 × 12 | 12 × 18 | 16 | |
| 100 | 27 × 25 | 23 × 29 | 26 × 22 | 27 × 25 | 24 × 33 | 30 × 22 | |
| 6a | 1 | – | – | – | 4 | 4 | 5 |
| 10 | – | – | – | 13 | 12 × 15 | 14 | |
| 100 | 18 | 16 | 15 | 20 × 18 | 22 | 16 × 19 | |
| 6b | 1 | – | – | – | 4 | 5 | 5 |
| 10 | – | – | – | 13 × 14 | 12 | 12 × 10 | |
| 100 | 27 × 25 | 23 | 22 × 25 | 22 × 25 | 15 | 20 | |
| 6c | 1 | – | – | – | – | – | – |
| 10 | – | – | – | 15 × 12 | 13 | 16 | |
| 100 | 20 | 25 | 21 × 24 | 28 × 22 | 26 | 19 × 23 | |
| Ванкомицин | 1 | Не изучалось | 6 | 7 | 7 | ||
| 10 | 12 × 9 | 15 × 12 | 13 | ||||
| 100 | 22 | 23 × 24 | 26 | ||||
| Ампициллин | 1 | – | – | – | Не изучалось | ||
| 10 | 12 | 13 × 11 | 14 | ||||
| 100 | 20 × 17 | 21 × 13 | 20 | ||||
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 20-04-00672). Работа выполнена с использованием оборудования ЦКП РТУ МИРЭА, получившего поддержку Минобрнауки РФ (соглашение от 01.09.2021 № 075-15-2021-689).
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Yount N.Y., Yeaman M.R. 2004. Multidimensional signatures in antimicrobial peptides. Proc. Natl. Acad. Sci. USA. 101 (19), 7363. https://doi.org/10.1073/pnas.0401567101
Мусин Х.Г. 2018. Антимикробные пептиды – потенциальная замена традиционным антибиотикам. Инфекция и иммунитет. 8 (3), 295.
Rima M., Rima M., Fajloun Z., Sabatier J.-M., Bechinger B., Naas T. 2021. Antimicrobial peptides: A potent alternative to antibiotics. Antibiotics. 10 (9), 1095. https://doi.org/10.3390/antibiotics10091095
Molchanova N., Hansen P.R., Franzyk H. 2017. Advances in development of antimicrobial peptidomimetics as hotential drugs. Molecules. 22 (9), 1430. https://doi.org/10.3390/molecules22091430
Pirri G., Giuliani A., Nicoletto S.F., Pizzuto L., Rinaldi A.C. 2009. Lipopeptides as anti-infectives: A practical perspective. Cent. Eur. J. Biol. 4(3), 258–273. https://doi.org/10.2478/s11535-009-0031-3
Fjell C.D., Hiss J.A., Hancock R.E. W., Schneider G. 2012. Designing antimicrobial peptides: Form follows function. Nat. Rev. Drug Discovery. 11, 37–51.
Faber C., Stallmann H., Lyaruu D., Joosten U., Von Eiff C., van Nieuw Amerongen A., Wuisman P.I. 2005. Comparable efficacies of the antimicrobial peptide human lactoferrin 1-11 and gentamicin in a chronic methicillin-resistant Staphylococcus aureus osteomyelitis model. Antimicrob. Agents Chemother. 49 (6), 2438–2444. https://doi.org/10.1128/AAC.49.6.2438-2444.2005
Lin L., Chi J., Yan Y., Luo R., Feng X., Zheng Y., Xian D., Li X., Quan G., Liu D, Wu C., Lu C., Pan X. 2021. Membrane-disruptive peptides/peptidomimetics-based therapeutics: Promising systems to combat bacteria and cancer in the drug-resistant era. Acta Pharm. Sin. B. 11 (9), 2609. https://doi.org/10.1016/j.apsb.2021.07.014
Tague A.J., Putsathit P., Hammer K.A., Wales S.M., Knight D.R., Riley T.V., Keller P.A., Pyne S.G. 2019. Cationic biaryl 1,2,3-triazolyl peptidomimetic amphiphiles: Synthesis, antibacterial evaluation and preliminary mechanism of action studies. Eur. J. Med. Chem. 168, 386. https://doi.org/10.1016/j.ejmech.2019.02.013
Mojsoska B., Jenssen H. 2015. Peptides and peptidomimetics for antimicrobial drug design. Pharmaceuticals (Basel). 8(3), 366–415. https://doi.org/10.3390/ph8030366
Zhang E., Bai P.-Y., Cui D.-Y., Chu W.-C., Hua Y.-G., Liu Q., Yin H.-Y., Zhang Y.-J., Qin S., Liu H.-M. 2018. Synthesis and bioactivities study of new antibacterial peptide mimics: The dialkyl cationic amphiphiles. Europ. J. Med. Chem. 143, 1489–1509. https://doi.org/10.1016/j.ejmech.2017.10.044
Su M., Xia D., Teng P., Nimmagadda A., Zhang C., Odom T., Cao A., Hu Y., Cai J. 2017. Membrane-active hydantoin derivatives as antibiotic agents. J. Med. Chem. 60 (20), 8456. https://doi.org/10.1021/acs.jmedchem.7b00847
Konai M.M., Ghosh C., Yarlagadda V. 2014. Membrane active phenylalanine conjugated lipophilic norspermidine derivatives with selective antibacterial activity. J. Med. Chem. 57, 9409–9423. https://doi.org/10.1021/jm5013566
Ghosh C., Sarkar P., Samaddar S., Uppua D., Haldar J. 2017. L-Lysine based lipidated biphenyls as agents with anti-biofilm and anti-inflammatory properties that also inhibit intracellular bacteria. Chem. Commun., 53, 8427–8430. https://doi.org/10.1039/C7CC04206J
Lohan S., Kalanta A., Sonkusre P., Cameotra S.S., Bisht G.S. 2014. Development of novel membrane active lipidated peptidomimetics active against drug resistant clinical isolates. Bioorg. & Med. Chem., 22, 4544–4552. https://doi.org/10.1016/j.bmc.2014.07.041
Schnaider L., Brahmachari S., Schmidt N.W., Mensa B., Shaham-Niv S., Bychenko D., Adler-Abramovich L., Shimon L.J.W., Kolusheva S., DeGrado W.F., Gazit E. 2017. Self-assembling dipeptide antibacterial nanostructures with membrane disrupting activity. Nat. Commun. 8 (1), 1365. https://doi.org/10.1038/s41467-017-01447-x
Shahane G., Ding W., Palaiokostas M., Azevedo H.S., Orsi M. 2019. Interaction of antimicrobial lipopeptides with bacterial lipid bilayers. J. Membr. Biol. 252 (4–5). 317. https://doi.org/10.1007/s00232-019-00068-3
Yar M., Mushtaq N., Afzal S. 2013. Synthesis, reactions, applications, and biological activity of diethanolamine and its derivatives. Russ. J. Org. Chem. 49 (7) 949–967. https://doi.org/10.1134/S1070428013070014
Denieva Z.G., Romanova N.A., Bodrova T.G., Budanova U.A., Sebyakin Yu.L. 2019. Synthesis of amphiphilic peptidomimetics based on the aliphatic derivatives of natural amino acids. Moscow Univ. Chem. Bull. 74 (6), 300–305. https://doi.org/10.3103/S0027131419060087
Makovitzki A., Baram J., Shai Y. 2008. Antimicrobial lipopolypeptides composed of palmitoyl di- and tricationic peptides: in vitro and in vivo activities, self-assembly to nanostructures, and a plausible mode of action. Biochemistry. 47 (40), 10630. https://doi.org/10.1021/bi8011675
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии