Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 2, стр. 105-111
Обратимое повышение устойчивости клеток карциномы A-431 к TRAIL-индуцированному апоптозу в конфлюэнтных культурах соответствует снижению представленности рецепторов DR4 и DR5
Р. С. Фадеев a, b, *, Н. В. Долгих a, А. В. Чеканов a, А. С. Сенотов a, К. С. Краснов a, b, М. И. Кобякова a, Я. В. Ломовская a, И. С. Фадеева a, b, В. С. Акатов a, b
a Институт теоретической и экспериментальной биофизики РАН
142290 Пущино, Московская обл., Россия
b Пущинский государственный естественно-научный институт
142290 Пущино, Московская обл., Россия
* E-mail: fadeevrs@gmail.com
Поступила в редакцию 07.10.2022
После доработки 03.11.2022
Принята к публикации 07.11.2022
- EDN: LALOSK
- DOI: 10.31857/S0233475523020020
Аннотация
Исследование механизмов действия цитокина TRAIL (TNF alpha Related Apoptosis Inducing Ligand) представляет большой интерес для разработки противоопухолевых препаратов направленного действия. Ранее нами было показано обратимое повышение устойчивости опухолевых клеток к TRAIL-индуцированному апоптозу в конфлюэнтных культурах. В клетках A-431 это происходит на фоне снижения экспрессии проапоптотических рецепторов DR4 и DR5 при отсутствии антиапоптотических рецепторов DсR1 и DсR2 на поверхности клеток, что сопровождается отсутствием активации проапоптотического белка Bid, эффекторной каспазы-3 при действии рекомбинантного белка izTRAIL, приводящее к повышению TRAIL-резистентности. Полученные результаты указывают на то, что обратимое повышение устойчивости клеток A-431 карциномы человека к TRAIL-индуцированному апоптозу в конфлюэнтных культурах обусловлено снижением экспрессии рецепторов DR4 и DR5 на клеточной поверхности.
ВВЕДЕНИЕ
Для разработки противоопухолевых препаратов направленного действия большой интерес представляет белок Apo2L/TRAIL (TNF alpha Related Apoptosis Inducing Ligand). Белок TRAIL представлен на поверхности таких иммунокомпетентных клеток, как NK-клетки, цитотоксические Т-лимфоциты, макрофаги, дендритные клетки, и является элементом иммунного надзора. Данный белок связывается с проапоптотическими рецепторами DR4 и DR5 на поверхности опухолевых клеток и вызывает их апоптотическую гибель, не повреждая нормальные клетки [1–4]. Некоторые опухолевые клетки обладают конститутивной устойчивостью к TRAIL, что ограничивает противоопухолевый потенциал этого белка [5]. Также известно, что в условиях in vitro резистентность опухолевых клеток к противоопухолевым средствам, в том числе к TRAIL-индуцированному апоптозу, может повышаться в многоклеточных структурах, таких как трехмерные клеточные сфероиды, имитирующие in vitro бессосудистые участки солидных опухолей [6]. Причины данного явления могут быть различны: от изменения внутриклеточных сигнальных путей до нарушения транспорта белка в центр сфероида [7]. Ранее нами было показано, что повышение устойчивости опухолевых клеток к TRAIL-индуцированному апоптозу происходит не только в трехмерных клеточных сфероидах, но и в двумерных конфлюэнтных культурах [8]. Такое повышение TRAIL-устойчивости опухолевых клеток является обратимым. После пересева клеток из высокоплотных культур в культуры с низкой плотностью TRAIL-чувствительность клеток восстанавливается [9]. Есть основания полагать, что причина повышения TRAIL-устойчивости опухолевых клеток в высокоплотных конфлюэнтных культурах определяется не межклеточными контактами, а изменением состава цитокинов в околоклеточном микроокружении, и это может моделировать подобные изменения in vivo [10, 11]. Ясного понимания механизмов этого феномена в настоящее время нет. Определение механизмов обратимой TRAIL-резистентности опухолевых клеток в высокоплотных культурах позволит выявить основные молекулярные мишени для повышения эффективности противоопухолевого действия белка TRAIL.
В представленной работе было выполнено исследование экспрессии TRAIL-рецепторов и протеолитической активации проапоптотического белка Bid, каспазы-3 и PARP (поли-ADP-рибоза полимераза) при повышении TRAIL-резистентности клеток эпидермоидной карциномы кожи человека A-431 в конфлюэнтных культурах.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. В работе использовали питательную среду DMEM (Sigma-Aldrich, США), эмбриональную телячью сыворотку (Gibco, США), сульфат гентамицина (Sigma-Aldrich), раствор трипсина-EDTA (Панэко, Россия), кристаллический фиолетовый (Sigma-Aldrich), фосфатно-солевой буфер (PBS, ЭкоСервис, Россия), додецилсульфат натрия (Applichem, США), параформальдегид (Applichem).
Получение рекомбинантного человеческого белка izTRAIL. Последовательность синтетического изолейцинового зиппеpа (IEKKIEA)4 (RMKQIEDKIEEILSKIYHIENEIARIKKLIGE) синтезирована de novo [12]. Ген izTRAIL cсинтезировали так, как описано ранее [13]. Синтезированный ген клонировали в плазмидный вектор pET101 (Novagen, CША). Бактериальный штамм E. coli BL21(DE3) был тpанcформирован полученным экспрессирующим вектором pET101/izTRAIL. Белок экспрессировали в cpеде TB в течение 12 ч пpи 18°C. Затем белок экстрагировали из клеточной биомаccы в буфеpе, содержащем 0.1 M тpиc, 0.2 M NaCl, 50 мM EDTA (pH 8.0). Полученный таким обpазом белок izTRAIL в основном находился в тельцаx включения. Ренатурацию белка осуществляли c иcпользованием 6 М раствор гуанидинхлорида, затем белок переводили в буфеp, содержащий 0.5 М аргинин, 0.5 М NaCl и 100 мМ тpиc-HCl (pH 8.0) и 2 мМ ДТТ, до конечной концентрации 500 мкг/мл. Полученный izTRAIL (тримерная форма около 80 кДа, мономеpная форма около 27 кДа) очищали методом металл-аффинной хроматографии на колонке c сорбентом Ni Sepharose High Performance. Чистоту полученного белка определяли c использованием SDS-PAGE и окрашиванием Coomassie blue G 250.
Культура клеток. В работе использовали клетки эпидермоидной карциномы кожи человека A-431, полученные из Всероссийской коллекции клеточных культур (Институт цитологии РАН, Санкт-Петербург). Клетки выращивали в среде DMEM с добавлением 10% эмбриональной телячьей сыворотки, 50 мкг/мл гентамицина сульфата при 37°С в атмосфере 5% СО2. Рост числа клеток начинался через 20 ч после посева. Время удвоения числа клеток в растущих культурах составляло 20 ± 2 ч.
Анализ цитотоксического действия белка izTRAIL. Клетки A-431 высевали в 96-луночные культуральные планшеты в количестве 5 × 103 клеток в 100 мкл ростовой среды на лунку и культивировали в течение 24 ч (пролиферирующая культура) или 96 ч (конфлюэнтная культура). Далее в опытные культуры добавляли izTRAIL и через 24 ч после добавления оценивали соотношение количества живых клеток в опытных и контрольных (без добавления izTRAIL) культурах. Для этого культуры клеток промывали PBS и окрашивали в течение 15 мин в 0.2% растворе кристаллического фиолетового в 20% этаноле, промывали PBS, добавляли 1% раствор додецилсульфата натрия и измеряли оптическую плотность при 550 нм, используя планшетный спектрофотометр Infinite F200 (Tecan, Австрия) [13].
Проточная цитометрия. Для проведения анализа экспрессии TRAIL-рецепторов на поверхности клеток A-431 через 24 ч (пролиферирующая культура) и 96 ч (конфлюэнтная культура) после посева клетки открепляли от поверхности культурального пластика с помощью смеси трипсина-EDTA, отмывали в Cell Staining Buffer (Biolegend, США) центрифугированием при 300g в течение 5 мин. Окрашивание проводили с использованием моноклональных антител PE anti-human CD261 (TRAIL-R1, BD Bioscience, США), PE anti-human CD262 (TRAIL-R2, Biolegend), Alexa Fluor 647 Mouse anti-human CD263 (TRAIL-R3, BD Bioscience), PE CD264/TRAIL-R4 Mouse anti-human (Molecular Probes, США). Для определения неспецифического связывания антител клетки окрашивали антителами соответствующего изотипического контроля. Окрашивание проводили при комнатной температуре в темноте в течение 30 мин. После окрашивания клетки фиксировали 2% раствором параформальдегида. Анализ экспрессии проводили при помощи проточного цитометра Accuri C6 (BD Bioscience) с программным обеспечением BD Accuri C6 Software.
Иммуноблотинг. Клетки отмывали в холодном PBS центрифугированием при 350g в течение 5 мин. Клеточный осадок лизировали в RIPA буфере (Santa Cruz, США) с добавленными ингибиторами протеаз (Santa Cruz) в течение 5 мин на льду. Клеточный осадок дополнительно разрушали с помощью ультразвукового дезинтегратора Sonicator Q500 (Misonix, США). Концентрацию белка измеряли методом Брэдфорд. Электрофорез в денатурирующих условиях проводили в камере Mini-protean tetra system (Bio-Rad, США) по методу Лэммли [14]. На каждую дорожку геля наносили по 20 мкг клеточного лизата. В качестве маркеров молекулярной массы использовали PageRuler Prestained Protein Ladder (Thermo Fisher Scientific, США). Перенос белков из геля на нитроцеллюлозную мембрану 0.2 мкм (Bio-Rad) осуществляли на Mini-protean transfer system (Bio-Rad). Для идентификации процессинга белков Bid, PARP и каспазы-3 использовали поликлональные кроличьи антитела BID Antibody (2002) (Cell Signaling Technology, США), поликлональные кроличьи антитела PARP Antibody (9542) (Cell Signaling Technology) и моноклональные мышиные антитела Anti-Human Caspase-3 (610 322) (BD Biosciences). В качестве вторичных антител использовали Goat Anti-Rabbit IgG (H + L)-HRP Conjugate (1706515) и Goat Anti-Mouse IgG (H + L)- HRP Conjugate (1 706 516) (Bio-Rad) в разведении 1 : 20 000. Детекцию производили с помощью ТМВ kit (Vector Laboratories, США) согласно инструкции производителя.
Статистический анализ. Результаты представляли в виде среднего ± стандартное отклонение (M ± SD). Опыты проводили не менее чем в 5 повторах (n ≥ 5). Статистическую значимость отличий определяли с использованием критерия Манна–Уитни.
РЕЗУЛЬТАТЫ
Снижение представленности TRAIL-рецепторов TRAILR1/DR4 и TRAILR2/DR5 на поверхности клеток A-431 при повышении их TRAIL-резистентности в конфлюэнтных культурах
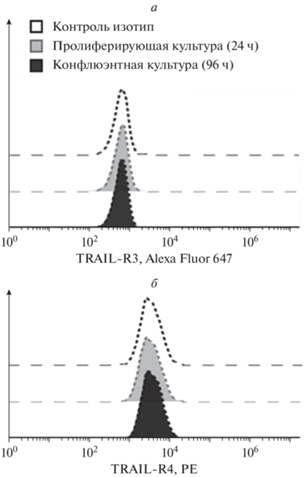
Ранее нами было показано, что рекомбинантный белок izTRAIL эффективно вызывает гибель клеток линии А-431, полученной из эпидермоидной карциномы кожи человека, в пролиферирующей культуре низкой плотности (24 ч после посева), но через 96 ч после посева клетки образуют конфлюэнтную культуру и становятся резистентными к действию данного белка [8]. В связи с тем, что падение экспрессии TRAIL-рецепторов на клеточной поверхности может быть причиной повышения устойчивость клеток к TRAIL-индуцированному апоптозу, было проведено исследование экспрессии про- и антиапоптотических TRAIL-рецепторов у клеток в пролиферирующих культурах низкой плотности (24 ч после посева) и в не пролиферирующих конфлюэнтных культурах (96 ч после посева). На рис. 1 представлена дозовая зависимость цитотоксического действия izTRAIL на клетки культур низкой плотности и конфлюэнтных культур, которые использовали в работе для анализа представленности TRAIL-рецепторов и TRAIL-сигнализации. Повышение TRAIL-резистентности в конфлюэнтных культурах и TRAIL-чувствительность клеток в культурах низкой плотности были такими же, как обнаружено ранее [8]. На клетках A-431 в культурах низкой плотности, как и в конфлюэнтных культурах, обнаружено отсутствие экспрессии антиапоптотических рецепторов TRAILR3/DcR1 и TRAILR4/DcR2 (рис. 2).
Рис. 1.
Увеличение резистентности клеток A-431 к TRAIL-индуцированной гибели в конфлюэнтной не пролиферирующей культуре через 96 ч после посева.
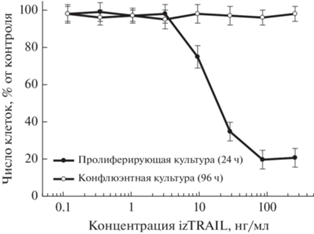
Рис. 2.
Отсутствие экспрессии антиапоптотических рецепторов TRAILR3/DcR1 (а) и TRAILR4/DcR2 (б) на поверхности клеток А 431 в культурах низкой плотности и в конфлюэнтных культурах.
Анализ экспрессии проапоптотических рецепторов TRAILR1/DR4 и TRAILR2/DR5 показал снижение числа клеток, несущих TRAILR1/DR4 с 98 ± 2% в пролиферирующей культуре низкой плотности до 25 ± 2% в конфлюэнтной культуре (рис. 3а). При исследовании экспрессии TRAILR2/ DR5 были получены сходные результаты. Число клеток, несущих TRAILR2/DR5, уменьшалось с 97 ± 3% в пролиферирующей низкоплотной культуре до 23 ± 5% в конфлюэнтной культуре (рис. 3б).
Рис. 3.
Уменьшение процента клеток A-431, несущих проапоптотические рецепторы TRAILR1/DR4 (а) и TRAILR2/DR5 (б), в конфлюэнтной культуре в сравнении с пролиферирующей. Отличие процента клеток, несущих DR4 (a) и DR5 (б), в конфлюэнтных культурах в сравнении с контрольными пролиферирующими культурами статистически значимо при * p < 0.05.
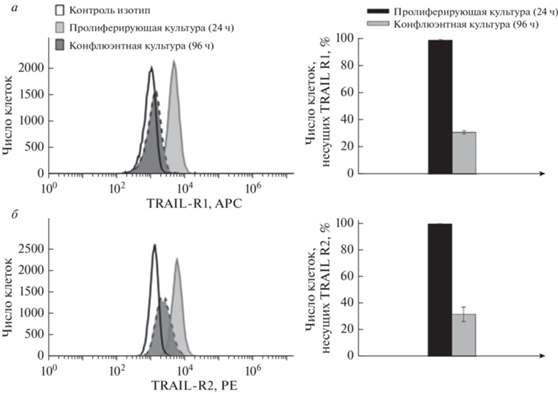
Таким образом, полученные данные показывают, что повышение устойчивости клеток A-431 к TRAIL-индуцированному апоптозу в конфлюэнтной культуре происходит на фоне снижения представленности проапоптотических рецепторов TRAILR1/DR4 и TRAILR2/DR5 на клеточной поверхности.
В конфлюэнтных культурах клеток A-431, в отличие от культур низкой плотности, белок izTRAIL не активирует процессинг проапоптотического белка Bid и каспазы-3
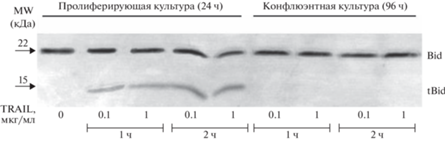
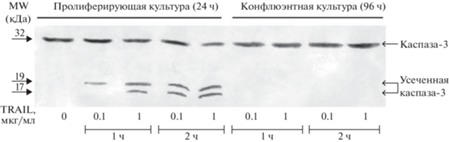
Нами было проведено исследование процессинга ключевых молекулярных участников TRAIL-индуцированного апоптоза, таких как Bid и каспаза-3, при добавлении izTRAIL до 1 мкг/мл в пролиферирующую и конфлюэнтную культуру клеток A-431.
На рис. 4 показано, что в пролиферирующей культуре клеток A-431 происходит процессирование (разрезание) Bid (22 кДа) с появлением усеченной формы данного белка – tBid (15 кДа), в то время как в конфлюэнтной культуре A-431 при добавлении белка izTRAIL образования tBid не происходило.
Рис. 4.
Отсутствие процессинга Bid в конфлюэнтной культуре клеток A-431 при их инкубации с izTRAIL (до 1 мкг/мл) в течение 2 ч в отличие от контрольных пролиферирующих культур.
Поскольку tBid не процессируется, то активация TRAIL-индуцированного апоптоза в конфлюэнтной культуре клеток A-431 может проходить другим возможным путем, через активацию эффекторной каспазы-3 непосредственным воздействием рецепторной каспазой-8 [6]. Для этого мы исследовали возможность протеолитической активации эффекторной каспазы-3 при воздействии до 1 мкг/мл белка izTRAIL на клетки A-431 в конфлюэнтной культуре. На рис. 5 показано, что при добавлении izTRAIL в конфлюэнтной культуре нет активации эффекторной каспазы-3, а в пролиферирующей культуре наблюдается образование активных малых форм каспазы-3 – p17. Эти данные указывают на то, что при действии izTRAIL на клетки A-431 в конфлюэнтной культуре не происходит активации рецепторной каспазы-8.
Рис. 5.
Отсутствие активации каспазы-3 в конфлюэнтной культуре клеток A-431 при инкубации с izTRAIL (до 1 мкг/мл) в течение 2 ч в отличие от контрольных пролиферирующих культур.
Дополнительно мы показали, что в клетках A‑431 в конфлюэнтной культуре, в отличии от пролиферирующих культур низкой плотности, при добавлении izTRAIL до 1 мкг/мл не происходит достоверного увеличения неактивной формы cPARP (p89), являющейся одним из основных маркеров апоптотической клеточной гибели (рис. 6). Это также указывает на отсутствие TRAIL-индуцированного апоптоза у клеток A‑431 в конфлюэнтной культуре.
Рис. 6.
Отсутствие увеличения неактивной формы cPARP в конфлюэнтной культуре клеток A-431 при инкубации с izTRAIL (до 1 мкг/мл) в отличие от контрольных пролиферирующих культур.

Таким образом, полученные результаты свидетельствуют, что в конфлюэнтной культуре клеток A-431 происходит ингибирование сигнального пути TRAIL-индуцированного апоптоза уже на начальных стадиях, в частности на этапе активации инициаторного белка Bid.
ОБСУЖДЕНИЕ
Механизм TRAIL-индуцированного апоптоза у опухолевых клеток начинается от связывания тримерного лиганда TRAIL с рецепторами клеточной гибели, в результате чего запускается каскад реакций, приводящий к протеолитическому разрушению внутриклеточных структур за счет активации эффекторных каспаз [6]. Известно, что связывание белка TRAIL со своими проапоптотическими рецепторами DR4 и/или DR5 приводит к тримеризации и кластеризации последних. Внутриклеточный DED-домен TRAIL-рецептора взаимодействует с адаптерным белком FADD, который в свою очередь взаимодействует с прокаспазами-8 и -10. Взаимодействие всех вышеперечисленных белков приводит к образованию мультибелкового комплекса известного как DISC, в котором происходит аутолитическая активация каспаз-8 и -10 [15]. Активные каспазы -8 и -10 в свою очередь активируют эффекторную каспазу-3, которая будучи активированной разрезает другие каспазы, и множество других регуляторных и структурных белков [6]. В конечном итоге это приводит к появлению признаков апоптоза, таких как фрагментация ДНК, формирование пузырей на клеточной поверхности (“блеббинг”) и так далее [16]. В качестве альтернативного пути, активированная инициаторная каспаза-8 также может процессировать белок Bid c образованием активной формы tBid, проапоптотического белка семейства Bcl-2. Белок tBid связывается с белками BAX и BAK, принадлежащими семейству Bcl-2, что приводит к их конформационной реорганизации с последующей олигомеризацией и образованием проницаемой поры в наружной мембране митохондрий (MOMP) [17]. MOMP обеспечивает выход в цитозоль проапоптотических белков таких как цитохром с, Smac/ DIABLO, которые обычно находятся в межмембранном пространстве. Цитохром с вместе с ATP и фактором APAF-1 образуют структуру, называемую апоптосомой, образование которой необходимо для активации каспазы-9. Активная каспаза-9 в свою очередь активирует эффекторные каспазы-3, -6 и -7 [18].
Возникновение резистентности к TRAIL-индуцированному апоптозу может осуществляется на любом из этих этапов передачи апоптотического сигнала. Для исследования механизма конфлюэнтной резистентности необходимо определить, на каком уровне происходит нарушение проведения апоптотического сигнала. Прежде всего, наиболее логичным подходом является разделение двух главных этапов передачи апоптотического сигнала, т.е. разделить возникновение резистентности на участке передачи сигнала с лиганд-рецепторного комплекса и резистентность на уровне митохондрии. Поскольку связующим звеном между двумя этими уровнями передачи сигнала является белок Bid, исследование активации именно этого белка можно считать наиболее определяющей в предполагаемых механизмах конфлюэнтной резистентности клеток A-431 к TRAIL-индуцированному апоптозу.
Мы показали, что в конфлюэнтной культуре клеток А-431 при добавлении TRAIL не происходило образование активной формы белка Bid – tBid. Параллельно с этим, у клеток A-431 в конфлюэнтной культуре отсутствовала непосредственная протеолитическая активация эффекторной каспазы-3 каспазой-8. То есть, мы можем предположить, что активация TRAIL-индуцированной каспаза-зависимой клеточной гибели не происходила. Это предположение подтверждается и тем, что у клеток А-431 в конфлюэнтной культуре при добавлении TRAIL не изменялось количество основного маркера апоптоза – неактивной формы cPARP (p89). Таким образом, в конфлюэнтной культуре клеток A-431 TRAIL-индуцированный апоптоз уже блокирован на участке до митохондриального триггера. В реализации такого рода устойчивости могут участвовать прежде всего повышение количества на поверхности клеток антиапоптотических мембранно-связанных «рецепторов-ловушек» для лиганда TRAIL, таких как TRAILR3/DcR1 и TRAILR4/DcR2 [19]. Однако нами было показано их полное отсутствие у клеток А-431 не только в конфлюэнтной TRAIL-резистентной культуре, но и даже в пролиферирующей неконфлюэнтной культуре, не обладающей резистентностью к TRAIL-индуцированному апоптозу. Таким образом, рецепторы TRAILR3/DcR1 и TRAILR4/DcR2 не принимают участие в повышении устойчивости клеток A‑431 к TRAIL-индуцированному апоптозу в конфлюэнтной культуре.
В свою очередь, при исследовании проапоптотических рецепторов к TRAIL у клеток А-431, таких как TRAILR1/DR4 и TRAILR2/DR5, нами было показано, что в конфлюэнтной культуре происходило выраженное снижение числа как DR4-позитивных, так и DR5-позитивных клеток, по сравнению с клетками в пролиферирующей неконфлюэнтной культуре, не обладающей устойчивостью к TRAIL-индуцированному апоптозу. То есть, в конфлюэнтной культуре снижено число клеток, у которых TRAIL потенциально способен индуцировать апоптоз путем связывания с проапоптотическими рецепторами.
Таким образом, полученные результаты указывают на то, что в основе повышения устойчивости клеток эпидермоидной карциномы кожи A-431 к TRAIL-индуцированному апоптозу в конфлюэнтной культуре лежит механизм, основанный на потере проапоптотических рецепторов TRAILR1/DR4 и TRAILR2/DR5, что, в свою очередь, предотвращает активацию проапоптотического белка Bid и эффекторной каспазы-3.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Финансовая и техническая поддержка. Работа выполнена при технической поддержке Центра коллективного пользования ИТЭБ РАН и при финансовой поддержке в рамках Госзадания № 075-01027-22-00.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Chamuleau M.E., Ossenkoppele G.J., van Rhenen A., van Dreunen L., Jirka S.M., Zevenbergen A., Schuurhuis G.J., van de Loosdrecht A.A. 2011. High TRAIL-R3 expression on leukemic blasts is associated with poor outcome and induces apoptosis-resistance which can be overcome by targeting TRAIL-R2. Leuk. Res. 35, 741–749.
Cheng J., Hylander B.L., Baer M.R., Chen X., Repasky E.A. 2006. Multiple mechanisms underlie resistance of leukemia cells to Apo2 Ligand/TRAIL. Mol. Cancer Ther. 5, 1844–1853.
Riccioni R., Pasquini L., Mariani G., Saulle E., Rossini A., Diverio D., Pelosi E., Vitale A., Chierichini A., Cedrone M., Foa R., Coco F., Peschle C., Testa U. 2005. TRAIL decoy receptors mediate resistance of acute myeloid leukemia cells to TRAIL. Haematologica. 90, 612–624.
Buchsbaum D.J., Zhou T., Lobuglio A.F. 2006.TRAIL receptor-targeted therapy. Future Oncol. 2, 493–508.
Zhang L., Fang B. 2005. Mechanisms of resistance to TRAIL-induced apoptosis in cancer. Cancer Gene Therapy. 12, 228–237.
Grayson K.A., Jyotsana N., Ortiz-Otero N., King M.R. 2011. Overcoming TRAIL-resistance by sensitizing prostate cancer 3D spheroids with taxanes. PLoS One. 16 (3), e0246733.
Chandrasekaran S., Marshall J.R., Messing J.A., Hsu J.W., King M.R. 2014. TRAIL-mediated apoptosis in breast cancer cells cultured as 3D spheroids. PLoS One. 9 (10), e111487.
Фадеев P.C., Чеканов А.В., Долгиx Н.В., Акатов В.С. 2012. Повышение резистентности опухолевых клеток линии А431 к TRAIL-индуцированному апоптозу в конфлюэнтных культурах. Биофизика. 57 (4), 649–654.
Долгих Н.В., Чеканов А.В., Фадеев Р.С., Акатов В.С. 2017. Различия в активации сигнальных путей опухолевых клеток А431 при конфлюэнт-зависимой и конфлюэнт-независимой TRAIL-резистентности. Биол. мембраны. 34 (6), 124–136.
Kobyakova M., Lomovskaya Y., Senotov A., Lomovsky A., Minaychev V., Fadeeva I., Shtatnova D., Krasnov K., Zvyagina A., Odinokova I., Akatov V., Fadeev R. 2022. The increase in the drug resistance of acute myeloid leukemia THP-1 cells in high-density cell culture is associated with inflammatory-like activation and anti-apoptotic Bcl-2 proteins. Int. J. Mol. Sci. 23, 7881.
Lomovskaya Y.V., Kobyakova M.I., Senotov A.S., Lomovsky A.I., Minaychev V.V., Fadeeva I.S., Shtatnova D.Y., Krasnov K.S., Zvyagina A.I., Akatov V.S., Fadeev R.S. 2022. Macrophage-like THP-1 cells derived from high-density cell culture are resistant to TRAIL-induced cell death via down-regulation of death-receptors DR4 and DR5. Biomolecules. 12, 150.
Suzuki K., Hiroaki H., Kohda D., Tanaka T. 1998. An isoleucine zipper peptide forms a native-like triple stranded coiled coil in solution. Protein Eng. 11, 1051–1055.
Fadeev R., Chekanov A., Solovieva M., Bezborodova O., Nemtsova E., Dolgikh N., Fadeeva I., Senotov A., Kobyakova M., Evstratova Y., Yakubovskaya R., Akatov V. 2019. Improved anticancer effect of recombinant protein izTRAIL combined with sorafenib and peptide iRGD. Int. J. Mol. Sci. 20, 525.
Lomovsky A., Baburina Y., Odinokova I., Kobyakova M., Evstratova Y., Sotnikova L., Krestinin R., Krestinina O. 2020. Melatonin can modulate the effect of navitoclax (ABT-737) in HL-60 cells. Antioxidants. 9, 1143.
Lavrik I.N., Krammer P.H. 2012. Regulation of CD95/Fas signaling at the DISC. Cell Death Differ. 19 (1), 36–41.
Galluzzi L., Maiuri M., Vitale I., Zischka H., Castedo M., Zitvogel L., Kroemer G. 2007. Cell death modalities: Classification and pathophysiological implications. Cell Death Differ. 14 (7), 1237–1243.
Waterhouse N., Sedelies K., Sutton V. Pinkoski M., Thia K., Johnstone R., Bird P., Green D., Trapani J. 2006. Functional dissociation of ΔΨm and cytochrome c release defines the contribution of mitochondria upstream of caspase activation during granzyme B-induced apoptosis. Cell Death Differ. 13, 607–618.
Zou H., Henzel W., Liu X., Lutschg A., Wang X. 1997. Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of caspase-3. Cell. 90 (3), 405–413.
Dida F., Li Y., Iwao A., Deguchi T., Azuma E., Komada Y. 2008. Resistance to TRAIL-induced apoptosis caused by constitutional phosphorylation of Akt and PTEN in acute lymphoblastic leukemia cells. Exp. Hematology. 36 (10), 1343–1353.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


