Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 2, стр. 122-132
Применение N,N,Nꞌ,Nꞌ-тетраметил-п-фенилендиамина и α,ω-гексадекандикарбоновой кислоты для определения коэффициентов Н+/О комплексов III и IV дыхательной цепи митохондрий печени в условиях свободного дыхания
В. Н. Самарцев a, А. А. Семенова a, К. Н. Белослудцев a, b, М. В. Дубинин a, *
a Марийский государственный университет
424000 Йошкар-Ола, пл. Ленина, 1, Республика Марий Эл, Россия
b Институт теоретической и экспериментальной биофизики РАН
142290 Пущино, Россия
* E-mail: dubinin1989@gmail.com
Поступила в редакцию 02.06.2022
После доработки 15.11.2022
Принята к публикации 20.11.2022
- EDN: KWTSVK
- DOI: 10.31857/S0233475523020068
Аннотация
Известно, что в отсутствие синтеза АТР и действия протонофорных разобщителей, то есть в состоянии 4, стимуляция дыхания митохондрий без изменения пассивной утечки протонов сопровождается снижением коэффициента Н+/О. В настоящей работе установлено, что при окислении сукцината митохондриями печени N,N,N',N'-тетраметил-п-фенилендиамин (ТМФД) и α,ω-гексадекандикарбоновая кислота (ГДК) эффективно стимулируют дыхание в состоянии 4, и такое их действие, в отличие от протонофорного разобщителя 2,4-динитрофенола (ДНФ), не вызвано усилением протонной проводимости внутренней мембраны. При этих условиях ТМФД и ГДК не оказывают существенного влияния на эффективность окислительного синтеза АТР и на трансформацию энергии комплексом IV (цитохром с-оксидазой). Полученные данные рассматриваются как свидетельство того, что при окислении сукцината митохондриями печени ТМФД и ГДК избирательно отключают комплекс III электрон транспортной цепи от трансформации энергии. Теоретически обосновано, что при этих условиях коэффициент Н+/О может быть определен исходя из отношения скоростей дыхания в отсутствие и в присутствии ТМФД и ГДК. Основываясь на этой модели, рассмотрено изменение коэффициента Н+/О в зависимости от стимуляции ТМФД и ГДК дыхания митохондрий в состоянии 4. Установлено, что под влиянием ТМФД или ГДК значение коэффициента Н+/О уменьшается при окислении сукцината с 6 до предельных значений 2. Сделано заключение, что в митохондриях печени при свободном дыхании, в отличие от окислительного синтеза АТР, значения коэффициента Н+/О составляют 4 и 2 для комплексов III и IV соответственно.
ВВЕДЕНИЕ
Согласно хемиосмотической теории Митчелла [1, 2] в митохондриях транспорт электронов комплексами электрон-транспортной цепи (ЭТЦ) сопряжен с векторным переносом Н+ из матрикса в межмембранное пространство. Это приводит к запасанию энергии в виде разности электрохимических потенциалов Н+ или выраженной в вольтах протон-движущей силы (Δр). Энергия Δр расходуется на синтез АТР Н+-АТР-синтазой, а также на связанный с этим транспорт в матрикс ADP и Pi в обмен на АТР [1, 3–7]. Часть энергии Δр рассеивается вследствие пассивной утечки протонов [3, 4, 6, 8, 9]. В отсутствие синтеза АТР в интактных митохондриях пассивная утечка протонов рассматривается как один из основных механизмов потребления кислорода [3, 4, 6, 8, 9]. Наряду с окислительным синтезом АТР, это так называемое свободное дыхание (окисление) имеет важное физиологическое значение. Так, в качестве основных функций свободного дыхания в митохондриях рассматриваются: продукция тепла для поддержания температуры тела у теплокровных животных и ингибирование продукции активных форм кислорода [3, 4, 6, 8, 9].
Для характеристики эффективности генерации Δр комплексами дыхательной цепи Митчеллом предложен стехиометрический коэффициент Н+/О, свидетельствующий о количестве протонов, перенесенных комплексами ЭТЦ через внутреннюю мембрану митохондрий при потреблении одного атома кислорода [2]. В том случае, если рассматривается перенос пары электронов каким-либо одним комплексом ЭТЦ, применяется также коэффициент Н+/2е– [3]. В последнее десятилетие достигнут консенсус в вопросе о значениях этих величин для различных комплексов ЭТЦ. Так, комплекс I (NADH-CoQ-редуктаза) при окислении NADH + Н+ транспортирует 2 электрона на кофермент Q (CoQ) сопряженно с векторным переносом 3–4 Н+ [3, 5, 10, 11]. Окисление CoQН2 комплексом III (bc1-комплекс, CoQH2-цитохром с-редуктаза) сопровождается транспортом 2 электронов на цитохром с, что сопряжено с векторным переносом 2 Н+, дополнительно к этому в межмембранное пространство освобождаются 2 Н+ [3, 5, 12–14]. В процессе переноса комплексом IV (цитохром c-оксидаза) 2 электронов от цитохрома с до молекулярного кислорода из матрикса захватывается 4 Н+ и в межмембранное пространство освобождается 2 Н+ с трансмембранным переносом 4 положительных зарядов [3, 5, 15]. Таким образом, при условии, что в расчет принимаются освобожденные в межмембранное пространство протоны, значения коэффициента Н+/О (Н+/2е–) составляют 4, 4 и 2 для комплексов I, III и IV соответственно. Если же в расчет принимаются захваченные из матрикса протоны, значения коэффициента Н+/О (Н+/2е–) составляют 4, 2 и 4 для комплексов I, III и IV соответственно. Эти значения коэффициентов соответствуют количеству перенесенных положительных зарядов из матрикса в межмембранное пространство [3, 5].
Методы определения коэффициента Н+/О (Н+/2е–) для ЭТЦ изолированных митохондрий основаны на регистрации количества перенесенных через мембрану протонов в обмен на проникающий катион (К+ в присутствии валиномицина или Са2+) [16–18]. В этом случае происходит падение мембранного потенциала (Δψ) и увеличение ΔрН. Очевидно, что такое действие проникающих катионов делает невозможным непосредственное определение значений коэффициента Н+/О (Н+/2е–) при различных функциональных состояниях митохондрий, в частности, при окислительном фосфорилировании и при вызванном пассивной утечкой протонов свободном дыхании.
Теоретически обосновано, что, исходя из молекулярной структуры и функции Н+-АТР-синтазы, для синтеза 1 молекулы АТР в митохондриях млекопитающих необходимо 2.7–3 протона [3, 19]. Еще 1 протон необходим для электрогенного обмена ADP и Рi на АТР [3, 7]. Экспериментально установлено, что значения коэффициента ADP/2е– для комплексов I, III и IV близки к 1, 0.5 и 1 соответственно [20–22]. Исходя из этих данных, значения коэффициента Н+/2е– при окислительном фосфорилировании определены как 4, 2, 4 для комплексов I, III и IV соответственно [3, 20]. Эти значения соответствуют количеству положительных зарядов, перенесенных комплексами дыхательной цепи, что свидетельствует об электрогенных процессах синтеза АТР Н+-АТР-синтазой, а также обмена ADP и Рi на АТР, связанных с совершением работы [3, 7, 19]. Выше уже отмечалось, что свободное дыхание митохондрий обусловлено пассивной утечкой протонов через внутреннюю мембрану [3, 4, 6, 8, 9]. Очевидно, что в этом случае, в отличие от окислительного фосфорилирования, протонами не совершается какой-либо работы. Недавно нами было предположено, что при свободном дыхании митохондрий значения коэффициента Н+/О составляют 4, 4 и 2 для комплексов I, III и IV соответственно [23]. Необходимы дальнейшие исследования для подтверждения этой гипотезы.
В митохондриях усиление пассивной утечки протонов с помощью протонофорных разобщителей, таких как 2,4-динитрофенол (ДНФ) и др., сопровождается стимуляцией дыхания и снижением Δр без изменения коэффициента Н+/О [24]. Вместе с тем, изначально сопряженная с трансформацией энергии дыхательная цепь может быть модифицирована таким образом, что электроны будут переноситься без формирования Δр [25–29]. В этом случае увеличение скорости дыхания митохондрий без изменения пассивной утечки протонов и Δр сопровождается уменьшением коэффициента Н+/О [25, 27]. Этот феномен определен как “декаплинг” (decoupling) или, говоря по-другому, “отключение” [25, 26, 28–30].
В качестве агентов, осуществляющих подобное отключение, наше внимание привлекли: N,N,N',N'-тетраметил-п-фенилендиамин (ТМФД), способный шунтировать комплекс III ЭТЦ путем передачи электронов от CoQН2 до цитохрома с [25, 31], и α,ω-гексадекандикарбоновая кислота (ГДК), переключающая комплекс III на холостой режим работы [29]. Представляет интерес методический подход, позволяющий вычислить значения коэффициента Н+/О (Н+/2е–) для комплексов III и IV в случае свободного дыхания митохондрий при полном отключении одного из них. При окислении митохондриями сукцината в условиях свободного дыхания избирательное полное отключение комплекса III ЭТЦ должно приводить к снижению коэффициента Н+/О до значения, характерного для комплекса IV.
В настоящей работе установлено, что ТМФД и ГДК, в используемых концентрациях, стимулируя дыхание митохондрий: а) не оказывают существенного влияния на эффективность окислительного синтеза АТР, б) не усиливают пассивную утечку протонов и в) не влияют на трансформацию энергии комплексом IV ЭТЦ. Принимая во внимание эти данные, на основе экспериментальных исследований в условиях свободного дыхания митохондрий теоретически определены значения коэффициента Н+/О для комплексов III и IV ЭТЦ. Установлено, что в митохондриях печени, окисляющих сукцинат при отключении ТМФД и ГДК комплекса III ЭТЦ значение коэффициента Н+/О уменьшается с 6 до предельных значений 2. Полученные результаты рассматриваются как свидетельство того, что при свободном дыхании митохондрий значения коэффициента Н+/О составляют 4 и 2 для комплексов III и IV соответственно.
МАТЕРИАЛЫ И МЕТОДЫ
Митохондрии из печени белых половозрелых крыс самцов (весом 210–250 г) выделяли общепринятым методом дифференциального центрифугирования с последующим освобождением от эндогенных жирных кислот с помощью бычьего сывороточного альбумина (БСА) фракции V в соответствии с описанной ранее методикой [28]. Среда выделения содержала 250 мМ сахарозу, 1 мМ EGTA, 5 мМ MOPS (рН до 7.4 доводили трис). Концентрацию белка митохондрий определяли биуретовым методом, в качестве стандарта использовали раствор БСА. Во время проведения эксперимента суспензию митохондрий (60–70 мг митохондриального белка в 1 мл) хранили на льду.
Дыхание митохондрий регистрировали полярографическим методом при 37°С в термостатируемой ячейке объемом 1 мл с помощью кислородного электрода типа Кларк и установки Oxygraph Plus (Hansatech Instruments, Великобритания). Концентрация в ячейке белка митохондрий – 1.0 мг/мл. Калибровку осуществляли общепринятым методом, при этом концентрация кислорода в указанной среде инкубации, насыщенной воздухом при нормальном атмосферном давлении при 37°С, была принята как 406 мкМ O (203 мкМ O2) [25]. Скорость дыхания митохондрий выражали как мкМ О/мин.
При исследовании сопряженного с синтезом АТР дыхания митохондрий (окислительного фосфорилирования) применяли метод пульса ADP, как подробно описано в работе [32]. Среда инкубации содержала 200 мМ сахарозу, 20 мМ KCl, 5 мМ янтарную кислоту, 5 мМ КН2РО4, 0.5 мМ EGTA, 2 мМ MgCl2, 10 мМ MOPS (рН до 7.4 доводили трис). Применяли следующий порядок работы. Сразу после митохондрий в кислородную ячейку добавляли 2 мкМ ротенон и, если это необходимо, ТМФД или ГДК, или ДНФ. В отсутствие указанных активаторов дыхания митохондрии потребляют кислород с низкой скоростью – нами рассматривается как состояние 4а (J4а). Через 2 мин после внесения ротенона, ТМФД или ГДК, или ДНФ к митохондриям добавляли 200 мкМ ADP, это приводило к многократной стимуляции сопряженного с синтезом АТР дыхания – состояние 3 (J3). После того как весь добавленный ADP был израсходован в процессе синтеза АТР, митохондрии вновь потребляют кислород с низкой скоростью – состояние 4б (J4б). Еще через 2 мин после выхода митохондрий в состояние 4б добавляли 50 мкМ ДНФ для определения максимальной скорости транспорта электронов по дыхательной цепи (состояние разобщенное, Ju). В качестве меры эффективности окислительного синтеза АТР применяли, как в работе [32]: скорость синтеза АТР (Jр), коэффициент дыхательного контроля (RC), стехиометрические коэффициенты ADP/О (P/O). Наряду с этим, для оценки эффективности окислительного фосфорилирования применяется также стехиометрический коэффициент ADP/ΔO (P/ΔO), где ΔO количество кислорода, потребляемого митохондриями в состоянии 3, за вычетом количества кислорода, потребленного в состоянии 4б за тот же промежуток времени [32]. Коэффициент RC определяли как отношение величин J3 и J4б. Коэффициент ADP/O (P/O) определяли с учетом всего количества кислорода потребляемого митохондриями в состоянии 3, как подробно описано в работах [22, 32]. Скорость синтеза АТР (Jр) определяли как произведение величин J3 и ADP/O. Коэффициент ADP/ΔO определяли как отношение величин скорости синтеза АТР и разности между скоростями дыхания в состояниях 3 и 4б по уравнению: ${{{\text{ADP}}} \mathord{\left/ {\vphantom {{{\text{ADP}}} {\Delta {\text{O}}}}} \right. \kern-0em} {\Delta {\text{O}}}} = {{{{J}_{p}}} \mathord{\left/ {\vphantom {{{{J}_{p}}} {\left( {{{J}_{3}} - {{J}_{{4{\text{б}}}}}} \right)}}} \right. \kern-0em} {\left( {{{J}_{3}} - {{J}_{{4{\text{б}}}}}} \right)}}$.
При исследовании несопряженного с синтезом АТР дыхания митохондрий (свободное дыхание, нами рассматривается как состояние 4) применяли среду инкубации следующего состава: 250 мМ сахароза, 5 мМ янтарная кислота, 0.5 мМ EGTA, 10 мМ MOPS (рН до 7.4 доводили трис). Концентрация в ячейке белка митохондрий – 1.0 мг/мл. При регистрации дыхания в полярографическую ячейку сразу после митохондрий добавляли ротенон (2 мкМ) и через 2 мин после этого ТМФД или ГДК в указанных в табл. 2 концентрациях.
Протонофорную активность исследуемых в работе соединений определяли двумя способами. Во-первых, путем индукции набухания деэнергизованных митохондрий печени крыс, инкубированных в изотоническом растворе ацетата калия в присутствии валиномицина, как в работах [33, 34]. Среда инкубации содержала 145 мМ ацетат калия, 0.2 мМ EGTA, 5 мМ цианид натрия, 5 мМ трис, pH 7.4. Во-вторых, путем индукции набухания также деэнергизованных митохондрий печени, инкубированных в изотоническом растворе нитрата аммония [35]. Среда инкубации содержала 135 мM NH4NO3, 0.1 мM EGTA, 5 мМ цианид натрия, 10 мM HEPES, pH 7.4. Набухание митохондрий определяли по уменьшению поглощения митохондриальной суспензии при 600 нм с помощью планшетного спектрофотометра Multiskan GO (Thermo Fisher Scientific, США).
В работе использовали MOPS, трис, ГДК, янтарную кислоту, ТМФД, FCCP, валиномицин, ацетат калия, NH4NO3, очищенный от жирных кислот БСА фракции V (Sigma); ротенон, EGTA (Serva); ДНФ, сахарозу, KCl (Fluka); КН2РО4, MgCl2 (Merck).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние ТМФД, ГДК и ДНФ на дыхание и окислительное фосфорилирование митохондрий печени. Эффекты ТМФД и ГДК целесообразно сравнить с действием одного из классических протонофорных разобщителей ДНФ. Как следует из данных табл. 1, в отсутствие синтеза АТР (состояние 4а) ДНФ, ТМФД и ГДК в указанных концентрациях стимулируют дыхание митохондрий в 1.96, 1.89 и 1.86 раза соответственно, т.е. в равной степени. В состоянии 3 ДНФ и ТМФД стимулируют, а ГДК ингибирует дыхание митохондрий (табл. 1). Обращает на себя внимание то, что скорости дыхания митохондрий в состояниях 4а (J4а) и 4б (J4б) равны как в отсутствие, так и в присутствии изучаемых соединений (табл. 1). Следовательно, в состоянии 4б ТМФД и ГДК не индуцируют гидролиз АТР, образованный в процессе окислительного фосфорилирования. ТМФД стимулирует, а ГДК ингибирует разобщенное 50 мкМ ДНФ до максимального уровня дыхание митохондрий (табл. 1).
Таблица 1.
Влияние ТМФД, ГДК и ДНФ на показатели дыхания и окислительного фосфорилирования митохондрий печени при окислении сукцината
| А. Скорость дыхания в различных состояниях | ||||
|---|---|---|---|---|
| условия опыта | J4а | J3 | J4б | Ju |
| Без добавок | 27.0 ± 1.58 | 116.6 ± 3.67 | 28.4 ± 0.89 | 157.9 ± 1.75 |
| ДНФ 5.5 мкМ | 52.9 ± 2.70* | 129.9 ± 2.60* | 54.3 ± 2.36* | 161.2 ± 6.57 |
| ТМФД 0.1 мМ | 51.1 ± 3.01* | 134.1 ± 5.01* | 52.9 ± 2.48* | 199.7 ± 5.52*/♦ |
| ГДК 0.1 мМ | 50.2 ± 3.56* | 103.3 ± 4.19*/♦ | 52.5 ± 3.33* | 112.6 ± 2.81*/♦ |
| Б. Эффективность синтеза АТР | ||||
| условия опыта | JP | RC | ADP/O | ADP/ΔO |
| Без добавок | 200.1 ± 3.60 | 4.11 ± 0.059 | 1.70 ± 0.028 | 2.28 ± 0.027 |
| ДНФ 5.5 мкМ | 175.8 ± 3.33* | 2.43 ± 0.053* | 1.35 ± 0.022* | 2.32 ± 0.019 |
| ТМФД 0.1 мМ | 215.7 ± 10.05♦ | 2.53 ± 0.096* | 1.61 ± 0.040♦ | 2.66 ± 0.054*/♦ |
| ГДК 0.1 мМ | 160.9 ± 6.31* | 1.99 ± 0.086*/♦ | 1.56 ± 0.049♦ | 3.18 ± 0.042*/♦ |
Примечание. Условия опыта, состав среды инкубации и символы описаны в разделе “Материалы и методы”. Размерность величин: J4а, J3, J4б и Ju – мкМ О/мин; JP – мкМ ADP/мин; RC, P/O и P/ΔO – относительные единицы. Приведены средние значения ± стандартная ошибка среднего (n = 6). * Различия между опытом (присутствие модулирующих агентов) и контролем (без добавок) статистически значимы, р < 0.05 (критерий Стьюдента). ♦ Различия между опытом (присутствие ТМФД или ГДК) и контролем (присутствие ДНФ) статистически значимы, р < 0.05 (критерий Стьюдента).
Таблица 2.
Влияние ТМФД в отсутствие и в присутствии ГДК (А), ГДК в отсутствие и в присутствии ТМФД (Б) на скорость дыхания митохондрий печени в состоянии 4 (JА и ΔJА, мкМ О/мин) и коэффициент (Н+/О)А при окислении сукцината
| А. Эффект ТМФД в отсутствие и в присутствии ГДК | ||||
|---|---|---|---|---|
| ТМФД, мМ | JА | (Н+/О)А | ||
| без ГДК | ГДК 0.07 мМ | Без ГДК | ГДК 0.07 мМ | |
| 0 | 27.2 ± 1.14 | 44.8 ± 2.11* | 6.00 | 3.64 ± 0.233* |
| 0.05 | 44.9 ± 2.78 | 57.4 ± 2.97* | 3.63 ± 0.275 | 2.84 ± 0.191* |
| 0.1 | 53.4 ± 2.64 | 63.6 ± 3.13* | 3.06 ± 0.200 | 2.57 ± 0.169 |
| 0.15 | 59.4 ± 2.73 | 67.8 ± 3.23 | 2.75 ± 0.174 | 2.41 ± 0.154 |
| 0.2 | 63.0 ± 2.54 | 70.0 ± 3.41 | 2.59 ± 0.154 | 2.33 ± 0.151 |
| 0.3 | 67.7 ± 3.62 | 73.4 ± 4.03 | 2.41 ± 0.166 | 2.22 ± 0.155 |
| + ДНФ 50 мкМ | 166.2 ± 11.06 | 124.4 ± 7.11* | – | – |
| Б. Эффект ГДК в отсутствие и в присутствии ТМФД | ||||
| ГДК, мМ | JА | (Н+/О)А | ||
| без ТМФД | ТМФД 0.1 мМ | Без ТМФД | ТМФД 0.1 мМ | |
| 0 | 28.8 ± 1.21 | 53.8 ± 1.82* | 6.00 | 3.21 ± 0.176* |
| 0.02 | 36.0 ± 1.23 | 57.9 ± 1.41* | 4.80 ± 0.256 | 2.98 ± 0.146* |
| 0.04 | 41.4 ± 2.13 | 61.3 ± 1.84* | 4.17 ± 0.280 | 2.82 ± 0.149* |
| 0.06 | 46.8 ± 1.19 | 64.0 ± 3.60* | 3.69 ± 0.185 | 2.70 ± 0.191* |
| 0.08 | 49.8 ± 2.11 | 65.8 ± 3.41* | 3.47 ± 0.208 | 2.58 ± 0.173* |
| 0.1 | 53.2 ± 2.66 | 67.7 ± 3.38* | 3.25 ± 0.213 | 2.46 ± 0.161* |
| + ДНФ 50 мкМ | 105.4 ± 5.21 | 117.6 ± 7.31 | – | – |
Известно, что стимуляция дыхания митохондрий протонофорными разобщителями, в частности ДНФ, сопровождается снижением показателей эффективности окислительного фосфорилирования: JP, RC и ADP/O [32, 36, 37], но без изменения коэффициента ADP/ΔO [32]. В наших условиях аналогичные эффекты ДНФ наблюдаются уже при концентрации этого разобщителя 5.5 мкМ (табл. 1). ТМФД, также как ДНФ, снижает RC, но в отличие от этого разобщителя не оказывает существенного влияния на скорость синтеза АТР (JP) и коэффициент ADP/O, но увеличивает коэффициент ADP/ΔO (табл. 1). ГДК, также как ТМФД, не оказывает существенного влияния на коэффициент ADP/O, увеличивает коэффициент ADP/ΔO, но снижает скорость синтеза АТР (табл. 1).
Таким образом, результаты проведенных исследований свидетельствуют о том, что ТМФД, стимулируя дыхание в состояниях 4а и 4б в равной степени, не оказывает существенного влияния на эффективность окислительного синтеза АТР. Как известно, дыхание митохондрий в состоянии 3 состоит из двух составляющих: сопряженного с синтезом АТР дыхания и свободного дыхания [22, 32]. Ранее нами было обосновано, что при каком-либо воздействии на митохондрии увеличение коэффициента ADP/ΔO без изменения коэффициента ADP/O свидетельствует о том, что при данных условиях скорость свободного дыхания как составляющая скорости дыхания в состоянии 3 меньше скорости дыхания в состоянии 4 [32]. Следовательно, в отличие от протонофорных разобщителей, ТМФД и ГДК в меньшей степени увеличивают скорость свободного дыхания как составляющую дыхания в состоянии 3, чем скорость дыхания в состоянии 4. Подробное выяснение молекулярных механизмов их действия – задача последующих исследований. ГДК отличается от ТМФД только тем, что снижает скорость окислительного синтеза АТР. Такое действие ГДК, по-видимому, обусловлено ингибированием транспорта электронов по дыхательной цепи. Во всех последующих экспериментах концентрация ГДК была не выше 0.1 мМ.
Влияние ТМФД, ГДК и ДНФ на пассивную утечку протонов через внутреннюю митохондриальную мембрану. При проведении исследований эффекты ТМФД и ГДК сравнивали с действием одного из классических протонофорных разобщителей ДНФ. Концентрации этих соединений, в которых они при окислении сукцината приблизительно в равной степени (в 2.0 раза) стимулируют свободное дыхание, приведены в табл. 1.
Одним из методов оценки способности различных соединений транспортировать протоны через внутреннюю митохондриальную мембрану является регистрация набухания органелл в изотоническом растворе ацетата калия в присутствии валиномицина [33, 34]. С помощью этого метода определяется транспорт протонов из матрикса в межмембранное пространство, т.е. в направлении противоположном пассивной утечке протонов через внутреннюю мембрану энергизованных митохондрий [33, 34].
Другим методом оценки способности различных соединений транспортировать протоны через внутреннюю митохондриальную мембрану является регистрация набухания органелл в изотоническом растворе нитрата аммония [35]. Индукция протонной проводимости при одновременном транспорте NH3 и ${\text{NO}}_{3}^{ - }$ приводит к накоплению в матриксе осмотически активных ионов ${\text{NH}}_{4}^{ + }$, ${\text{NO}}_{3}^{ - }$ и вследствие этого набуханию митохондрий. Этот метод позволяет определить наличие транспорта протонов из межмембранного пространства в матрикс, как это характерно для пассивной утечки протонов через внутреннюю мембрану энергизованных митохондрий. Вместе с тем известно, что транспорт таких анионов как ${\text{NO}}_{3}^{ - }$, SCN– и др. через внутреннюю мембрану митохондрий осуществляется при участии анионного канала, который может блокироваться гидрофобными соединениями [38]. Сказанное в полной мере относится и к методу оценки способности ТМФД транспортировать протоны через внутреннюю митохондриальную мембрану путем регистрации набухания органелл в изотоническом растворе роданида аммония [25]. В настоящей работе для оценки влияния ТМФД и ГДК на транспорт протонов были применены оба описанных выше метода.
Как видно из рис. 1а, ДНФ в концентрациях 5.5 мкМ эффективно индуцирует снижение оптической плотности суспензии деэнергизованных митохондрий, инкубируемых в изотонической среде ацетата калия, что свидетельствует об увеличении проницаемости внутренней митохондриальной мембраны для протонов. В отличие от этого разобщителя 0.1 мМ ГДК и ТМФД вплоть до концентрации 0.2 мМ не оказывают существенного влияния на снижение оптической плотности суспензии митохондрий (рис. 1а). Следовательно, ГДК и ТМФД не влияют на проницаемость внутренней мембраны митохондрий для протонов при условии их перемещения из матрикса в межмембранное пространство. Как показано на рис. 1б, ДНФ в той же концентрации также эффективно индуцирует снижение оптической плотности суспензии деэнергизованных митохондрий, инкубируемых в изотоническом растворе нитрата аммония. ГДК и ТМФД в указанных концентрациях не оказывают существенного влияния на снижение оптической плотности суспензии митохондрий (рис. 1б). Следовательно, ГДК и ТМФД также не усиливают проницаемость внутренней мембраны митохондрий для протонов при условии их перемещения из межмембранного пространства в матрикс.
Рис. 1.
Относительная скорость набухания деэнергизованных митохондрий печени в среде с ацетатом калия (а) и нитратом аммония (б) в отсутствие добавок (контроль) и в присутствии ДНФ, ГДК и ТМФД в указанных концентрациях. Условия опыта и состав сред инкубации описаны в разделе “Материалы и методы”. В отсутствие добавок (контроль) абсолютные значения скорости набухания митохондрий составляют: в ацетате калия – 0.051 ± 0.002 ΔA600/мин на 1 мг белка, в нитрате аммония – 0.022 ± 0.002 ΔA600/мин на 1 мг белка. Приведены средние значения ± стандартная ошибка среднего (n = 5). * Различия между скоростью дыхания в присутствии ДНФ и в отсутствие (контроль) статистически значимы, р < 0.05 (критерий Стьюдента).
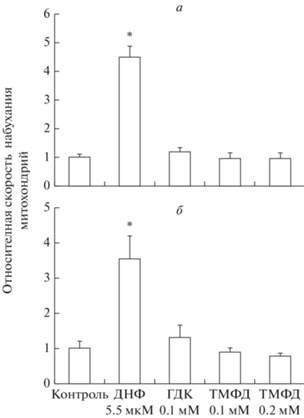
Таким образом, результаты исследований, полученные двумя независимыми методами, свидетельствуют о том, что ТМФД и ГДК, в отличие от протонофорных разобщителей, стимулируют дыхание митохондрий без усиления пассивной утечки протонов. Эти данные подтверждают известные ранее, полученные другими методами результаты [25, 29].
Исследовано влияние ТМФД и ГДК на трансформацию энергии цитохром с-оксидазой. В качестве доноров электронов, передающих электроны непосредственно на цитохром с, используются ферроцианид с аскорбатом [22, 29]. В наших экспериментах, как и в предыдущей работе [29], использовали ферроцианид и аскорбат в концентрации 10 и 5 мМ соответственно. Установлено, что в этих условиях ДНФ стимулирует дыхание до максимального уровня уже в концентрации 30 мкМ. Увеличение концентраций и ферроцианида, и аскорбата не влияет на скорость дыхания как в отсутствие, так и в присутствии ДНФ (данные не приведены). При окислении ферроцианида с аскорбатом скорость дыхания в отсутствие и в присутствии 0.2 мМ ТМФД составляет 76.2 ± 5.81 и 82.0 ± 6.12 мкМ О/мин (n = 4) соответственно. 30 мкМ ДНФ стимулирует скорость дыхания в отсутствие и в присутствии 0.2 мМ ТМФД до 193.0 ± ± 14.73 и 209.6 ± 15.11 мкМ О/мин (n = 4) соответственно. Как показано нами ранее [29] и подтверждено в настоящей работе (данные не приведены), при окислении ферроцианида с аскорбатом ГДК не влияет на дыхание митохондрий в состоянии 4, но частично ингибирует разобщенное 30 мкМ ДНФ дыхание. Следовательно, ТМФД и ГДК не оказывают существенного влияния на трансформацию энергии цитохром с-оксидазой. Эти данные свидетельствуют о том, что при окислении митохондриями сукцината десопрягающее действие этих соединений заключается в избирательном отключении комплекса III ЭТЦ от генерации Δр.
Теоретическое обоснование и экспериментальное исследование применения ТМФД и ГДК как инструмента для определения значений коэффициента Н+/О комплексов III и IV. Свободное дыхание митохондрий в отсутствие синтеза АТР или действия разобщителей (дыхание в состоянии 4) определяется пассивной утечкой протонов по эндогенным путям [36, 39]. Скорость пассивной утечки протонов (${{{v}}_{{{{{\text{H}}}^{ + }}}}}$) в стационарном состоянии может быть определена как произведение скорости дыхания и коэффициента Н+/О [8, 27]. Как уже отмечалось во введении, увеличение скорости дыхания митохондрий без изменения ${{{v}}_{{{{{\text{H}}}^{ + }}}}}$ сопровождается уменьшением коэффициента Н+/О [25, 27]. Очевидно, что при этих условиях справедливо уравнение:
(1)
${{{v}}_{{{{{\text{H}}}^{ + }}}}} = {{J}_{4}}{{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{4}} = {{J}_{{\text{A}}}}{{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}},$Исходя из уравнения (1), коэффициент ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$ может быть определен как:
(2)
${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}} = {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{4}}\frac{{{{J}_{4}}}}{{{{J}_{{\text{A}}}}}}.$(3)
${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{{\text{Аmin}}}}} = {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{4}}\frac{{{{J}_{4}}}}{{{{J}_{{{\text{Amax}}}}}}}.$В табл. 2А приведены значения скорости свободного дыхания митохондрий и рассчитанные по уравнению (2) значения коэффициента ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$ при последовательно повышающихся концентрациях ТМФД вплоть до 0.3 мМ в отсутствие и в присутствии ГДК. Как видно из таблицы, при окислении сукцината ТМФД эффективно стимулирует дыхание митохондрий. Последующее внесение 50 мкМ ДНФ приводит к дальнейшей стимуляции дыхания (табл. 2А). Стимулирующее действие ТМФД сопровождается снижением коэффициента ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$ (табл. 2А). ГДК в концентрации 0.07 мМ стимулирует дыхание митохондрий в отсутствие и в присутствии ТМФД в концентрациях 0.05 и 0.1 мМ и ингибирует в присутствии 50 мкМ ДНФ (табл. 2А). ГДК существенно снижает коэффициент ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$, но только при концентрации ТМФД не более 0.05 мМ (табл. 2А).
В табл. 2Б приведены значения скорости свободного дыхания митохондрий и рассчитанные по уравнению (2) значения коэффициента ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$ при последовательно повышающихся концентрациях ГДК в присутствии и в отсутствие ТМФД. Как видно из табл. 2, ГДК вплоть до концентрации 0.1 мМ стимулирует дыхание митохондрий, внесение ДНФ в указанной концентрации также приводит к дальнейшей стимуляции дыхания (табл. 2Б). Стимулирующее действие ГДК сопровождается снижением коэффициента ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$. ТМФД в концентрации 0.1 мМ стимулирует дыхание митохондрий в отсутствие и в присутствии ГДК (табл. 2Б). ТМФД, стимулируя дыхание в отсутствие и в присутствии ГДК, существенно снижает коэффициент ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$ (табл. 2Б).
Полученные результаты можно было бы формально рассматривать как свидетельство аддитивного действия ТМФД и ГДК при стимуляции дыхания и снижении коэффициента ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$. Однако по мере увеличения концентрации ТМФД действие ГДК ослабляется так же, как по мере увеличения концентрации ГДК ослабляется действие ТМФД. Следовательно, такое аддитивное действие могло быть обусловлено тем, что ТМФД и ГДК в указанных концентрациях не достигают своего максимального эффекта.
Эффективность действия ТМФД и ГДК может быть выражена количественно как величина снижения коэффициента Н+/О ($\Delta {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$) по уравнению:
(4)
$\Delta {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}} = {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{4}} - {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}.$(5)
$\Delta {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{{\text{Аmax}}}}} = {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{4}} - {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{{\text{Аmin}}}}}.$(6)
$\Delta {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}} = \frac{{\Delta {{{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}}_{{{\text{Аmax}}}}}\left[ A \right]}}{{{{K}_{{0.5}}} + \left[ A \right]}},$Используя уравнения (4) и (5), уравнение (6) можно преобразовать как:
(7)
${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}} = {{K}_{{0.5}}}\frac{{\Delta {{{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}}_{{\text{А}}}}}}{{\left[ A \right]}} + {{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{{\text{Аmin}}}}}.$Рис. 2.
Линейная зависимость коэффициента (Н+/О)А от удельной активности (Δ(Н+/О)А/[А]). а – ТМФД (1) и ГДК (2); б – ТМФД в присутствии 0.07 мМ ГДК (1) и ГДК в присутствии 0.1 мМ ТМФД (2). Значения коэффициента (Н+/О)А представлены в табл. 2.
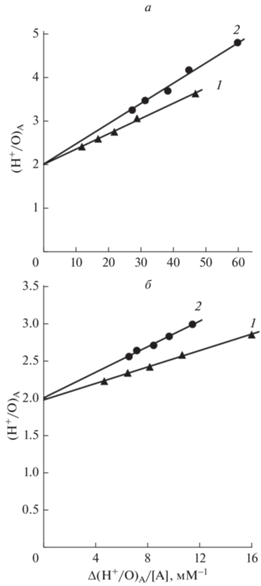
На рис. 2б зависимость коэффициента ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{\text{А}}}}$ от удельных активностей ТМФД в присутствии ГДК (1) и ГДК в присутствии ТМФД (2). В этом случае точка пересечения экспериментальной прямой с осью ординат также определяет величину ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{{\text{Аmin}}}}}$. Значение этой величины также составляет 2 как при максимальном эффекте ТМФД в присутствии ГДК, так и при максимальном эффекте ГДК в присутствии ТМФД (рис. 2б). При совместном действии ТМФД и ГДК коэффициент ${{({{{{{\text{Н}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{Н}}}^{ + }}} {\text{О}}}} \right. \kern-0em} {\text{О}}})}_{{{\text{Аmin}}}}}$ достигает такой же величины, как при действии этих агентов по отдельности. Следовательно, действие ТМФД и ГДК при достижении их максимальных эффектов неаддитивное. Как известно, ТМФД, будучи редокс-активным соединением, способен шунтировать комплекс III путем передачи электронов от CoQН2 до цитохрома с [25, 31]. В то время как ГДК, не обладая способностью транспортировать электроны, переключает комплекс III на холостой режим работы по другому механизму [29]. Вполне вероятно, что при совместном действии ТМФД и ГДК до максимального уровня происходит полное отключение комплекса III от генерации Δр. При этих условиях в генерации Δр будет принимать участие только комплекс IV, и характеризующий работу этого комплекса коэффициент Н+/О равен 2.
Таким образом, при свободном дыхании митохондрий в отличие от окислительного фосфорилирования значения коэффициента Н+/О составляют 4 и 2 для комплексов III и IV соответственно. Как уже отмечалось во введении, электрогенные процессы синтеза АТР Н+-АТР-синтазой, а также обмена ADP и Рi на АТР связаны с совершением работы [3, 7, 19]. Исходя из термодинамических расчетов, обосновано, что значения коэффициента Н+/2е– для комплексов I, III и IV составляют 4, 2 и 4 соответственно [3]. В отличие от окислительного синтеза АТР при свободном дыхании пассивная утечка протонов из межмембранного пространства в матрикс не сопровождается совершением работы. Как уже предполагалось нами ранее [41], в отсутствие синтеза АТР и разобщения (при свободном дыхании) возвращение протонов из межмембранного пространства в матрикс осуществляется путем простой диффузии протонов через какие-либо каналы внутренней мембраны митохондрий. Можно полагать, что скорость диффузии зависит от общего количества протонов, освобождаемых комплексами ЭТЦ в межмембранное пространство.
Суммируя полученные данные, можно сделать следующие выводы:
1. При окислении сукцината митохондриями печени ТМФД и ГДК эффективно стимулируют свободное дыхание (в состояниях 4а и 4б), и такое их действие, в отличие от протонофорного разобщителя ДНФ, не вызвано индукцией протонной проводимости внутренней мембраны. Эти соединения, стимулируя свободное дыхание и снижая коэффициент дыхательного контроля, в отличие от ДНФ не оказывают существенного влияния на коэффициент ADP/O, но увеличивают коэффициент ADP/ΔO. В отличие от протонофорных разобщителей ТМФД и ГДК в меньшей степени увеличивают скорость свободного дыхания как составляющей части скорости дыхания в состоянии 3, чем скорость дыхания в состоянии 4.
2. ТМФД и ГДК не оказывают влияния на трансформацию энергии цитохром с-оксидазой. Следовательно, десопрягающее действие этих соединений при окислении митохондриями сукцината заключается в избирательном отключении комплекса III ЭТЦ от генерации Δр.
3. Теоретически обосновано, что коэффициент Н+/О может быть определен исходя из отношения скоростей дыхания в отсутствие и в присутствии ТМФД и ГДК. Под влиянием ТМФД или ГДК значение коэффициента Н+/О уменьшается при окислении сукцината с 6 до предельных значений 2. Таким образом, в митохондриях печени при свободном дыхании в отличие от окислительного синтеза АТР значения коэффициента Н+/О составляют 4 и 2 для комплексов III и IV соответственно.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при финансовой поддержке РФФИ (№ 20-015-00124).
Соответствие принципам этики. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Mitchell P. 2011. Chemiosmotic coupling in oxidative and photosynthetic phosphorylation. Biochim. Biophys. Acta. 1807, 1507–1538.
Mitchell P., Moyle J. 1967. Respiration-driven proton translocation in rat liver mitochondria. Biochem. J. 105, 1147–1162.
Skulachev V.P., Bogachev A.V., Kasparinsky F.O. 2013. Principles of bioenergetics. Berlin: Springer-Verlag. 436 p.
Cadenas S. 2018. Mitochondrial uncoupling, ROS generation and cardioprotection. Biochim. Biophys. Acta. Bioenerg. 1859, 940–950.
Mazat J.P., Ransac S., Heiske M., Devin A., Rigoulet M. 2013. Mitochondrial energetic metabolism – some general principles. IUBMB Life. 65, 171–179.
Zorova L.D., Popkov V.A., Plotnikov E.Y., Silachev D.N., Pevzner I.B., Jankauskas S.S., Babenko V.A., Zorov S.D., Balakireva A.V., Juhaszova M., Sollott S.J., Zorov D.B. 2018. Mitochondrial membrane potential. Anal. Biochem. 552, 50–59.
Klingenberg M. 2008. The ADP and ATP transport in mitochondria and its carrier. Biochim. Biophys. Acta. 1778, 1978–2021.
Porter R.K., Brand M.D. 1993. Body mass dependens of H+ leak in mitochondria and its relevance to metabolic rate. Nature. 362, 628–630.
Nicholls D.G. 2021. Mitochondrial proton leaks and uncoupling proteins. Biochim. Biophys. Acta. Bioenerg. 1862, 148428.
Vinogradov A.D., Grivennikova V.G. 2016. Oxidation of NADH and ROS production by respiratory complex I. Biochim. Biophys. Acta. 1857, 863–871.
Hummer G., Wikström M. 2016. Molecular simulation and modeling of complex I. Biochim Biophys Acta. 1857, 915–921.
Sarewicz M., Osyczka A. 2015. Electronic connection between the quinone and cytochrome c redox pools and its role in regulation of mitochondrial electron transport and redox signaling. Physiol. Rev. 95, 219–243.
Fisher N., Meunier B., Biagini G.A. 2020. The cytochrome bc1 complex as an antipathogenic target. FEBS Lett. 594, 2935–2952.
Kao W.-C., Hunte C. 2022. Quinone binding sites of cyt bc complexes analysed by X-ray crystallography and cryogenic electron microscopy. Biochem. Soc. Trans. 50, 877–893.
Wikström M., Krab K., Sharma V. 2018. Oxygen activation and energy conservation by cytochrome c oxidase. Chem. Rev. 118, 2469–2490.
Brand M.D., Reynafarje B., Lehninger A.L. 1976. Re-evaluation of the H+/site ratio of mitochondrial electron transport with the oxygen pulse technique. J. Biol. Chem. 251, 5670–5679.
Reynafarje B., Brand M.D., Lehninger A.L. 1976. Evaluation of the H+/site ratio of mitochondrial electron transport from rate measurements. J. Biol. Chem. 251, 7442–7451.
Papa S., Guerrieri F., Lorusso M., Izzo G., Boffoli D., Capuano F., Capitanio N., Altamura N. 1980. The H+/e– stoicheiometry of respiration-linked proton translocation in the cytochrome system of mitochondria. Biochem. J. 192, 203–218.
Watt I.N., Montgomery M.G., Runswick M.J., Leslie A.G., Walker J.E. 2010. Bioenergetic cost of making an adenosine triphosphate molecule in animal mitochondria. Proc. Natl. Acad. Sci. USA. 107, 16 823–16 827.
Hinkle P.C. 2005. P/O ratios of mitochondrial oxidative phosphorylation. Biochim. Biophys. Acta. 1706, 1–11.
Stoner C.D. 1987 Determination of the P/2e– stoichiometries at the individual coupling sites in mitochondrial oxidative phosphorylation. Evidence for maximum values of 1.0, 0.5, and 1.0 at sites 1, 2, and 3. J. Biol. Chem. 262, 10445–10453.
Hinkle P.C., Kumar M.A., Resetar A., Harris D.L. 1991. Mechanistic stoichiometry of mitochondrial oxidative phosphorylation. Biochemistry. 30, 3576–3582.
Samartsev V.N., Semenova A.A., Ivanov A.N., Dubinin M.V. 2022. Comparative study of free respiration in liver mitochondria during oxidation of various electron donors and under conditions of shutdown of complex III of the respiratory chain. Biochem. Biophys. Res. Commun. 606, 163–167.
Brown G.C. 1989. The relative proton stoihiometries of the mitochondrial proton pumps are independent of the proton motive force. J. Biol. Chem. 264, 14 704–14 109.
Chien L.F., Brand M.D. 1996. The effect of chloroform on mitochondrial energy transduction. Biochem. J. 320, 837–845.
Skulachev V.P. 1998. Uncoupling: New approaches to an old problem of bioenergetics. Biochim. Biophys. Acta. 1363, 100–124.
Luvisetto S., Conti E., Buso M., Azzone G.F. 1991. Flux ratios and pump stoichiometries at sites II and III in liver mitochondria. Effect of slips and leaks. J. Biol. Chem. 266, 1034–1042.
Маркова О.В., Бондаренко Д.И., Самарцев В.Н. 1999. Опосредованное анионными переносчиками разобщающее действие дикарбоновых жирных кислот зависит от расположения второй карбоксильной группы. Биохимия. 64, 679–685.
Semenova A.A., Samartsev V.N., Dubinin M.V. 2021. The stimulation of succinate-fueled respiration of rat liver mitochondria in state 4 by α,ω-hexadecanedioic acid without induction of proton conductivity of the inner membrane. Intrinsic uncoupling of the bc1 complex. Biochimie. 181, 215–225.
Terada H., Shima O., Yoshida K., Shinohara Y. 1990. Effects of the local anesthetic bupivacaine on oxidative phosphorilation in mitochondria. Change from decoupling to uncoupling by formation of a leakage type ion pathway specific for H+ in cooperation with hydrophobic anions. J. Biol. Chem. 265, 7837–7842.
Alexandre A., Lehninger A.L. 1984. Bypasses of the antimycin a block of mitochondrial electron transport in relation to ubisemiquinone function. Biochim. Biophys. Acta. 767, 120–129.
Samartsev V.N., Semenova A.A., Dubinin M.V. 2020. A comparative study of the action of protonophore uncouplers and decoupling agents as inducers of free respiration in mitochondria in states 3 and 4: Theoretical and experimental approaches. Cell Biochem. Biophys. 78, 203–216.
Garlid K.D., Nakashima R.A. 1983. Studies on the mechanism of uncoupling by amine local anesthetics. Evidence for mitochondrial proton transport mediated by lipophilic ion pairs. J. Biol. Chem. 258, 7974–7980.
Popova L.B., Nosikova E.S., Kotova E.A., Tarasova E.O., Nazarov P.A., Khailova L.S., Balezina O.P., Antonenko Y.N. 2018. Protonophoric action of triclosan causes calcium efflux from mitochondria, plasma membrane depolarization and bursts of miniature end-plate potentials. Biochim. Biophys. Acta Biomembr. 1860, 1000–1007.
Brierley G.P., Jurkowitz M., Scott K.M., Merola A.J. 1970. Ion transport by heart mitochondria. XX. Factors affecting passive osmotic swelling of isolated mitochondria. J. Biol. Chem. 245, 5404–5411.
Самарцев В.Н., Кожина О.В., Полищук Л.С. 2005. Соотношение между дыханием и синтезом АТР в митохондриях при различной степени разобщения окислительного фосфорилирования. Биофизика. 50, 660–667.
Terada H. 1981. The interaction of highly active uncouplers with mitochondria. Biochim. Biophys. Acta. 639, 225–242.
Ponnalagu D., Singh H. 2017. Anion channels of mitochondria. Handb. Exp. Pharmacol. 240, 71–101.
Groen A.K., Wanders R.J.A., Westerhoff H.V., Van der Meer R., Tager J.M. 1982. Quantification of the contribution of various steps to the control of mitochondrial respiration. J. Biol. Chem. 257, 2754–2757.
Mookerjee S.A., Gerencser A.A., Watson M.A., Brand M.D. 2021. Controlled power: How biology manages succinate-driven energy release. Biochem. Soc. Trans. 49, 2929–2939.
Самарцев В.Н., Чезганова С.А., Полищук Л.С., Пайдыганов А.П., Видякина О.В., Зелди И.П. 2003. Температурная зависимость дыхания митохондрий печени крыс при разобщении окислительного фосфорилирования жирными кислотами. Влияние неорганического фосфата. Биохимия. 68, 1137–1143.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


