Биология моря, 2019, T. 45, № 1, стр. 35-43
Родственные связи каменного гольца Salvelinus malma kuznetzovi Taranetz, 1933 (Salmoniformes: Salmonidae) из бассейна реки Камчатка по данным генетического анализа
А. Г. Олейник 1, *, Л. А. Скурихина 1, А. Д. Кухлевский 1, 2
1 Институт биологии моря им. А.В. Жирмунского, Национальный научный центр морской биологии
(ННЦМБ) ДВО РАН
690041 Владивосток, Россия
2 Дальневосточный федеральный университет
690090 Владивосток, Россия
* E-mail: alla_oleinik@mail.ru
Поступила в редакцию 05.02.2018
После доработки 26.04.2018
Принята к публикации 31.05.2018
Аннотация
На основе анализа нуклеотидных последовательностей контрольного региона (CR), генов цитохрома b (Cytb), цитохромоксидазы-1 (COI) митохондриальной ДНК (мтДНК) и ядерного гена лактатдегидрогеназы LDH-C1 определены родственные связи каменного гольца Salvelinus malma kuznetzovi – эндемичного таксона из бассейна р. Камчатка. Результаты генеалогического анализа гаплотипов мтДНК подтверждают филогенетическую близость S. m. kuznetzovi, S. albus и S. m. malma и свидетельствуют о том, что все таксоны представляют Берингийскую филогенетическую группу гольцов. Величина дивергенции мтДНК S. m. kuznetzovi, S. albus и S. m. malma не превышает диапазона внутривидовой изменчивости в популяциях северной мальмы. Обосновывается существование плейстоценового криптического рефугиума в бассейне р. Камчатка, что позволяет говорить о необходимости более широких комплексных исследований гольцов Берингийской группы.
Территорию Северо-Восточной Азии можно рассматривать как область развития эндемизма гольцов рода Salvelinus, поскольку здесь обитает множество узкоареальных видов (Черешнев и др., 2002). Первоописание большинства таксонов основано исключительно на морфологических признаках, что представляет проблему для построения современной филогении рода. К таким гольцам относится каменный голец – малоизученный таксон, встречающийся только в бассейне р. Камчатка. Первое научное описание каменного гольца дал Таранец (1933), определивший его как подвид Salvelinus malma kuznetzovi Taranetz, 1933. Значительный вклад в изучение морфологии и экологии каменного гольца внесли К.А. Савваитова с соавторами, рассматривавшие его в качестве внутривидовой биологической формы мальмы в рамках Salvelinus alpinus complex (Савваитова, Максимов, 1970; Савваитова, 1989). В дальнейшем каменного гольца включили в состав белого гольца Salvelinus albus как редкую жилую форму (Глубоковский, 1977). Однако видовой статус каменного гольца Salvelinus kuznetzovi был позже использован (Богуцкая, Насека, 2004). К сожалению, современных работ по исследованию гольцов Камчатки, показывающих дифференциацию разных экологических форм и видов (Есин и др., 2017), недостаточно. И если морфологические различия S. m. malma и S. albus активно обсуждаются (Глубоковский, 1977, 1995; Савваитова, 1989; Черешнев и др., 2002), то отличия каменного гольца от симпатрической мальмы (характерная окраска и форма головы) выражены столь очевидно, что позволяют надежно идентифицировать даже молодь (Есин и др., 2017).
Имеющихся в настоящее время генетических данных также мало, чтобы обсуждать причины возникновения морфологического разнообразия гольцов в регионе и корректно анализировать родственные связи каменного гольца. Ограничения в скорости эволюции аллозимных локусов ядерного генома не позволили дифференцировать каменного гольца от симпатрической мальмы (Pavlov, Savvaitova, 1991; Осинов, Павлов, 1998; Osinov, 1999). При этом таксоны характеризуются сходным кариотипом (Васильев, 1985). Очевидно, что наиболее подходящим генетическим маркером в данной ситуации является быстро эволюционирующая митохондриальная ДНК (мтДНК), успешно используемая для дифференциации гольцов рода Salvelinus (Yamamoto et al., 2014; Moore et al., 2015; Олейник и др., 2015). Опираясь на результаты филогенетического анализа и оценки дивергенции мтДНК, было показано, что северная мальма S. m. malma Азии и Северной Америки, белый голец S. albus, эндемичные гольцы оз. Кроноцкое – длинноголовый S. kronocius и голец Шмидта S. schmidti – формируют самостоятельную Берингийскую филогенетическую группу (Олейник и др., 2015). По согласованным данным (Brunner et al., 2001; Alekseyev et al., 2009; Олейник и др., 2015) филогенетическая группа арктического гольца объединяет акадийскую (для S. alpinus oquassa) и евразийскую (для S. alpinus alpinus и S. alpinus salvelinus) филогруппы.
Анализ мтДНК показал, что каменный голец близок к S. m. malma (Brunner et al., 2001). Наибольшим успехом можно считать определение последовательностей полного митохондриального генома у двух представителей таксона (Balakirev et al., 2016). Однако в этих исследованиях не ставилась задача количественной оценки уровня генетических различий симпатрических гольцов. На сегодняшний день отсутствуют обобщающие работы, в которых показаны сходство и различие разных экологических форм и видов гольцов р. Камчатка. В то же время в связи с исследованием филогеографии S. m. malma на большей части ареала (Олейник и др., 2011; Oleinik et al., 2014; Yamamoto et al., 2014) появилась возможность получить уточненные данные о дифференциации каменного гольца от симпатрических и аллопатрических популяций S. m. malma, что и было целью нашей работы. Очевидна также необходимость проведения генеалогического анализа, предоставляющего возможность для выявления предковых гаплотипов мтДНК и для выяснения на этой основе родственных отношений эндемичных гольцов с другими представителями Берингийской филогенетической группы, симпатрично обитающими в бассейне р. Камчатка. Учитывая материнский способ наследования мтДНК, нами были определены нуклеотидные последовательности локуса ядерного гена лактатдегидрогеназы LDH-C1.
МАТЕРИАЛ И МЕТОДИКА
Работа основана на оригинальном материале из коллекции авторов. Сведения о географической локализации, распределении по ареалу и об объеме выборок приведены в табл. 1. Анализ выполнен на двух экземплярах каменного гольца, выловленных недалеко от места первоописания. Определены нуклеотидные последовательности трех участков мтДНК: контрольного региона (CR), генов цитохрома b (Cytb) и цитохромоксидазы-1 (COI), а также фрагмента ядерного гена лактатдегидрогеназы (LDH-C1). В анализ были включены и исследованные ранее 26 экз. гольцов; у 12 из них проанализирован локус LDH-C1 (табл. 1). В качестве внешней группы использовали Salvelinus alpinus.
Таблица 1.
Исследованные таксоны гольцов рода Salvelinus
| Таксон | Район сбора (обозначение) | Координаты | N1/N2 |
|---|---|---|---|
| Salvelinus m. kuznetzovi | Р. Радуга, п-в Камчатка (STAZ) | 53°13′ N, 162°01′ E | 2/2 |
| S. albus | Р. Радуга, п-в Камчатка (ALKA) | 53°13′ N, 162°01′ E | 3/1 |
| S. m. malma | Р. Паратунка, п-в Камчатка (MNPA) | 52°58′ N, 158°15′ E | 2/1 |
| S. m. malma | Р. Камчатка, п-в Камчатка (MNKA) | 56°13′ N, 162°01′ E | 2/– |
| S. m. malma | Оз. Аччен, п-в Чукотка (MNAC) | 64°50′ N, 174°36′ W | 2/– |
| S. m. malma | Оз. Пекульнейское, п-в Чукотка (MNMP) | 62°33′ N, 177°17′ E | 1/– |
| S. m. malma | Ручей Гришкин (бассейн оз. Начикинское) (MNNA) | 53°01′ N, 157°50′ E | 1/– |
| S. m. malma | Р. Фрости-Крик (Frosty Creek), Аляска (DFRO) | 57°38′ N, 155°46′ W | 2/– |
| S. m. malma | Р. Конгакут (Kongakut), Аляска (DKON) | 69°46ʹ N, 141°42′ W | 2/1 |
| S. a. alpinus | Р. Тессема, п-в Таймыр (ARGA) | 69°49′ N, 90°64′ E | 1/1 |
| S. a. alpinus | Оз. Ситасьяуре (Sitasjaure Lake), Скандинавский п-в, Швеция (ARLS) | 67°53′ N, 17°37ʹ E | 6/4 |
| S. a. oquassa | Пруд Фладс (Floods Pond), Северная Америка (ARCTFLO) | 44°73′ N, 68°49′ W | 2/2 |
Индивидуальные препараты тотальной ДНК получали из фиксированных тканей сердца или плавников по стандартной методике (Sambrook et al., 1989). Для амплификации и секвенирования мтДНК использовали наборы праймеров, которые ранее применялись для лососевых рыб: LRBT-25 (5'-AGA GCG CCG GTG TTG TAA TC-3') и LRBT-1195 (5'-GCT AGC GGG ACT TTC TAG GGT C-3') (Uiblein et al., 2001), Cytb – 5'-CAT AAT TCC TGC CCG GAC TCT AAC C-3' и 5'-TTT AAC CTC CGA TCT CCG GAT TAC A-3' (Ward et al., 2005), CO1 – 5'-TCA ACC AAC CAC AAA GAC ATT GGC AC-3' и 5'-AGT GTT TCA CAG TGT GTA GGC-3' (Ward et al., 2005). Для амплификации фрагмента гена LDH-C1 использовали праймеры Ldhxon3F и Ldhxon4R 5'-GGC AGC CTC TTC CTC AAA ACG CCC AA-3', 5'-CAA CCT GCT CTC TCC CTC CTG CTG ACG AA-3' (McMeel et al., 2001). Схема лабораторного протокола анализа LDH-C1 для лососевых рыб разработана ранее (Олейник и др., 2017). Очищенные нуклеотидные последовательности ядерных и митохондриальных генов секвенировали в прямом и обратном направлениях с использованием набора BigDye Terminator v3.1 (Applied Biosystems, США) в условиях, рекомендованных производителем. Последовательности нуклеотидов определяли в автоматическом анализаторе ABI Prism 3130 (Applied Biosystems, США) на 50-сантиметровой капиллярной колонке в полимере POP-7. Первичную обработку и множественное выравнивание нуклеотидных последовательностей проводили в программах SeqScape v2.5 (Applied Biosystems, США) и Geneious v8.1 (www.geneious.com/).
Для представления филогенетических отношений между гаплотипами мтДНК использовали метод медианных сетей (алгоритм MJ) (Bandelt et al., 1999), реализованный в пакете программ Network 4.5.02 (Fluxus Technology Ltd., www.fluxus-engineering.com). Дополнительно была построена NJ дендрограмма (Saitou, Nei, 1987) на основе p-дистанций (Nei, Kumar, 2000) с тестированием топологии с помощью бутстреп-анализа (1000 реплик) (Felsenstein, 1985). Статистический и филогенетический анализы проводили в программах DnaSP v6 (Rozas et al., 2017) и MEGA7 (Kumar et al., 2016). Для более полного представления об уровне дифференциации исследуемых гольцов были использованы представленные в GenBank данные по участку CR (Yamamoto et al., 2014; Moore et al., 2015; Сошнина и др., 2016; Esin et al., 2017) и полному митохондриальному геному (Doiron et al., 2002; Balakirev et al., 2016).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После выравнивания фрагмента гена LDH-C1 длина последовательностей у гольцов рода Salvelinus составила 274 пары нуклеотидов (пн). Все генотипы по локусу LDH-C1 являются гомозиготами, так как смешанный сигнал на хроматограммах не наблюдался. Последовательности депонированы в GenBank под номерами доступа MF101261–MF101263, MF101277, MF101280–MF101283, MF101295, MF101320 и MF101355–MF101356. На исследованном участке, содержавшем части экзонов 3 (43 пн) и 4 (77 пн) с промежуточным интроном переменной длины, выявлены семь вариабельных сайтов (все информативные). Последовательности S. m. malma, S. albus и S. m. kuznetzovi имеют общую делецию длиной 8 пн (нуклеотидные позиции: 227–234), которая отсутствует у S. a. oquassa. Арктические гольцы и S. m. malma характеризуются специфическими для таксонов последовательностями локуса LDH-C1, различающимися по семи сайтам (5 трансверсий и 2 транзиции). Дивергенция между данными генотипами в среднем составляет 0.027 ± 0.010, но все особи S. m. malma, S. albus и S. m. kuznetzovi имеют идентичные генотипы по локусу LDH-C1.
Общая длина нуклеотидных последовательностей митохондриальных генов составила 3339 пн. По объединенной последовательности (1–1021 пн CR, 1022–2221 пн COI и 2222–3362 пн Cytb) выявлены 73 вариабельных сайта (54 информативных) и 23 разных гаплотипа. Все секвенированные последовательности депонированы в GenBank под следующими номерами: KY122042–KY122044, KY122047–KY122049, KY122054–KY122059, KY122063–KY122066, KY122088–KY122095, KY122114 (COI); KY122139–KY122141, KY122144–KY122146, KY122151–KY122156, KY122160–KY122163, KY122185–KY122192, KY122211 (Cytb); KY122236–KY122238, KY122241–KY122243, KY122248–KY122253, KY122257–KY122260, KY122282–KY122289 и KY122308 (СR). В анализ также добавлены соответствующие участки из полногеномных последовательностей S. m. kuznetzovi (SK1: KU674351; SK2: KU674352), S. albus (SA1: KT266870; SA2: KT266871), S. m. malma (KJ746618) и S. alpinus (AF154851).
На исследованном участке генома у S. m. kuznetzovi обнаружено три гаплотипа, два из которых соответствуют выявленным ранее SK1 и SK2 (Balakirev et al., 2016), а один гаплотип (KY122308/KY122114/KY122211) является новым. Все последовательности имеют одинаковую длину и различаются лишь единичными нуклеотидными заменами. Общая дивергенция между последовательностями каменного гольца составила Dxy = 0.003 ± 0.001. Величина дивергенции между S. m. kuznetzovi и остальными таксонами в пределах Берингийской группы находится в диапазоне 0.002 ± 0.001–0.003 ± 0.001. В то же время уровень дивергенции аллопатрических S. m. kuznetzovi и S. alpinus статистически достоверно не отличается от соответствующих оценок для S. alpinus и S. m. malma и в среднем составляет 0.010 ± 0.002. Соотношение оценок дивергенции нуклеотидных последовательностей мтДНК во многом аналогично отмеченным ранее закономерностям, характерным для популяций S. m. malma и S. albus (Олейник и др., 2010, 2011).
На NJ-дереве (рис. 1) все представители Берингийской группы (S. m. malma, S. albus, S. m. kuznetzovi) образуют общий кластер с высокой степенью поддержки (100%). Последовательности S. m. kuznetzovi расположены в разных структурах дерева. На MJ-сети (рис. 2) также наблюдается несколько центров радиации, представляющих самостоятельные филогенетические группы гаплотипов. Гаплотипы S. m. kuznetzovi (SK1, SK2, SK3) входят в Берингийскую филогенетическую группу. Генеалогическое расстояние между этой группой и S. alpinus составило 19 нуклеотидных замен. Последовательности S. m. kuznetzovi с гаплотипами SK1 и SK2 наиболее близки к таковым S. albus (р. Камчатка) и S. m. malma (оз. Аччен), различия между ближайшими гаплотипами составили четыре замены. Последовательность S. m. kuznetzovi с гаплотипом SK3 на одну замену отличается от таковой S. m. malma (р. Камчатка, р. Конгакут). Генеалогическое расстояние между этими группами гаплотипов составило 10 нуклеотидных замен.
Рис. 1.
NJ – дендрограмма таксонов гольцов рода Salvelinus по данным анализа объединенных нуклеотидных последовательностей генов COI, Cytb и CR участка мтДНК. Цифрами обозначена бутстреп поддержка узлов ветвления (BS > 80%). Обозначение особей приводится согласно обозначению района сбора (табл. 1).
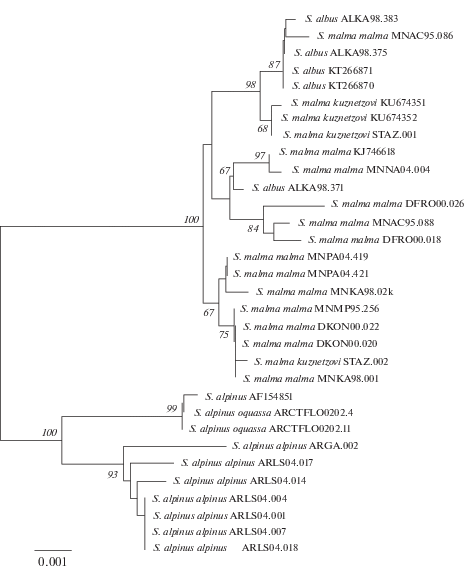
Рис. 2.
Генеалогическая сеть (MJ-анализ) гаплотипов объединенных нуклеотидных последовательностей генов COI, Cytb и CR участка мтДНК гольцов рода Salvelinus. На ветвях указаны мутационные различия между гаплотипами; размер окружностей пропорционален абсолютным частотам гаплотипов. Все мутации имеют равный вес; интервал поиска медианных векторов ε (черная точка) равен нулю. В прямоугольных областях – группы гаплотипов, соответствующие выделенным ранее у S. malma malma (Oleinik et al., 2014).
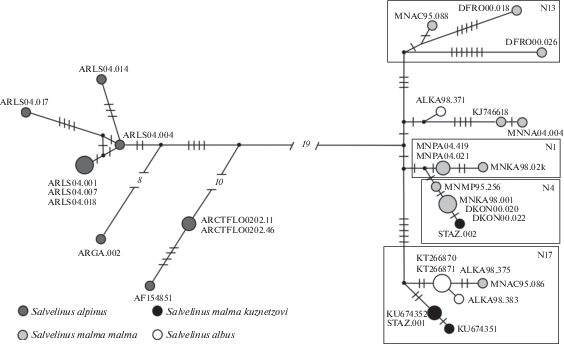
Для выяснения связей S. m. kuznetzovi с другими представителями Берингийской группы мы сравнили полученные нуклеотидные последовательности с данными, имеющимися в GenBank (Yamamoto et al., 2014; Moore et al., 2015; Сошнина и др., 2016; Esin et al., 2017). Поскольку отсутствуют работы, в которых филогенетический анализ мтДНК гольцов проводился бы по трем исследованным нами последовательностям генов, генеалогический анализ осуществляли по участку CR мтДНК. Выбор маркера обусловлен тем, что большинство исследований по филогеографии гольцов выполнено на основе фрагмента CR. Длина выравненного фрагмента составила 499 пн, что позволило использовать опубликованные частоты 28 гаплотипов (табл. 2), обнаруженных в 43 популяциях S. m. malma Северо-Восточной Азии и Северной Америки. Для данной генеалогии (рис. 3) характерно объединение слабо дивергировавших гаплотипов. Наблюдается два основных центра радиации с предковыми гаплотипами SM28 и SM36. Для короткого фрагмента CR гаплотип SK3 оказался идентичным гаплотипу SM28, а гаплотипы SK1, SK2, SA1, SA2 и ALKA98.375 были идентичны гаплотипу SM36 (табл. 2). Таким образом, сокращение длины последовательности уменьшило разрешение генеалогии, несмотря на увеличение объема выборок.
Таблица 2.
Последовательности CR (499 пн) гольцов Берингийской филогруппы, использованные при построении генеалогической сети (рис. 3): обозначение гаплотипов, общая частота встречаемости (N), соответствие гаплотипов из разных источников
| Гаплотип | GenBank | Идентичные последовательности CR (499 пн) | N | |
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| SM20 | AB684797 | – | KT962129 (SMAL-DL-4) | 13 |
| SM28 | AB684805 | KY122259–KY122260, KY122308, KY122284–KY122286, KY122288–KY122289 | KT962126 (SMAL-DL-1), KT962134 (SMAL-DL-9), dvH2, KX417788 (dvH7), EU310902 (BER12) | 333 |
| SM29 | AB684806 | KY122287 | KT962138 (SMAL-DL-13), KJ746618 (SMM208), dvH1, KR011250 (BER17), | 65 |
| SM33 | AB684810 | – | KT962131 (SMAL-DL-6), KR011246 (BER14) | 40 |
| SM36 | AB684813 | KY122237 | KT962127 (SMAL-DL-2), KR011254 (HaploC), KT266870 (SA1), KT266871 (SA2), KU674351(SK1), KU674352 (SK2), dvH4 | 137 |
| SM37 | AB684814 | KY122236 | KT962136 (SMAL-DL-11) | 5 |
| SM38 | AB684815 | KY122258 | KT962133 (SMAL-DL-8) | 3 |
| SM39 | AB684816 | – | – | 1 |
| SM40 | AB684817 | – | KT962128 (SMAL-DL-3), dvH6 | 47 |
| SM41 | AB684818 | – | – | 1 |
| SM42 | AB684819 | – | – | 1 |
| SM43 | AB684820 | – | KT962130 (SMAL-DL-5), KR011248 (BER16) | 32 |
| SM44 | AB684821 | – | – | 1 |
| SM45 | AB684822 | – | – | 1 |
| SM46 | AB684823 | – | – | 1 |
| SM47 | AB684824 | KY122283 | KR011252 (HaploZ) | 7 |
| SM48 | AB684825 | KY122282 | – | 3 |
| SM49 | AB684826 | – | – | 1 |
| SM51 | AB684828 | – | KT962132 (SMAL-DL-7), EU310903 (BER13) | 33 |
| SM52 | AB684829 | – | – | 10 |
| SM53 | AB684830 | – | – | 2 |
| SM54 | AB684831 | – | – | 3 |
| SM56 | AB684833 | – | – | 1 |
| SM57 | AB684834 | – | KT962135 (SMAL-DL-10), KX417787 (dvH5), KR011247 (BER15) | 20 |
| – | – | – | KT962137 (SMAL-DL-12) | 1 |
| – | – | – | KX417786 (dvH3) | 1 |
Рис. 3.
Генеалогическая сеть (MJ-анализ) гаплотипов CR участка мтДНК длиной 499 пн Берингийской филогенетической группы гольцов рода Salvelinus. Размер окружностей пропорционален абсолютным частотам гаплотипов. Все мутации имеют равный вес; интервал поиска медианных векторов ε (черные точки) равен нулю. Обозначение гаплотипов по: Yamamoto et al., 2014; Сошнина и др., 2016; Esin et al., 2017.
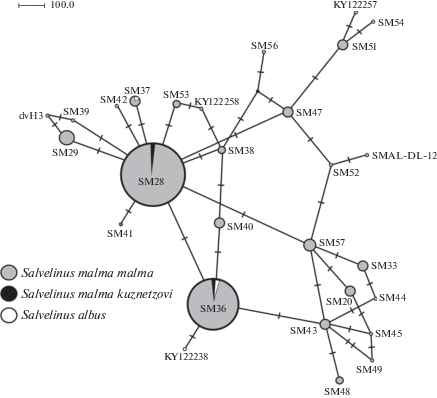
Ранее на основании PCR-RFLP анализа трех участков мтДНК (ND1/ND2, Cytb/D-loop, ND5/ND6) нами была исследована филогеография S. m. malma Азии и Северной Америки (Олейник и др., 2011; Oleinik et al., 2014). На ареале, включающем бассейны моря Бофорта, а также Чукотского, Берингова и Охотского морей, у S. m. malma выявлено три основных гаплотипа: N1, N4, N13 (обозначения по: Oleinik et al., 2014). Реконструированная генеалогия 75 гаплотипов мтДНК S. m. malma имеет следующие особенности: 1) радиальная структура кластеров, объединяющих слабо дивергировавшие гаплотипы; 2) широкое географическое распространение филогеографической группы с доминирующим гаплотипом N1, охватывающее большую часть ареала (82% популяций) и большинство исследованных гольцов. Кроме основного имеется еще несколько центров радиации (N4, N13, N17), объединяющих разное количество слабо дивергировавших гаплотипов (Oleinik et al., 2014).
Сопоставив три генеалогии, можно сделать вывод, что гаплотип SK3 S. m. kuznetzovi относится к филогруппе N4 (SM28) (рис. 2, 3; Oleinik et al., 2014). Ранее было показано, что N4 является основным гаплотипом в трех популяциях (Камчатка, Анадырь, Апука) азиатского побережья Берингова моря, но редко встречается в популяциях материкового побережья Охотского моря и североамериканского побережья Берингова моря (Oleinik et al., 2014). В то же время гаплотипы SK1 и SK2 S. m. kuznetzovi и четыре гаплотипа S. albus не входят ни в одну из основных филогрупп, а образуют кладу с гаплотипом N17 (SM36). Географическое распространение этой филогруппы охватывает оба побережья Берингова моря с южной границей по Олюторскому заливу на Камчатке и зал. Нортон (п-в Сьюард) на Аляске. Северная граница распространения клады достигает Чукотки и арктического побережья Аляски, ограничиваясь бассейном моря Бофорта.
Таким образом, полученные новые данные позволяют расширить присутствие филогруппы N17 на бассейн р. Камчатка, носителями которой являются S. m. kuznetzovi и S. albus. Отметим, что у S. m. malma р. Камчатка не обнаружено гаплотипов данной филогруппы (Oleinik et al., 2014). Наличие сильно дивергировавших гаплотипов (расстояние 10 нуклеотидных замен) характерно для филогенетических групп, длительное время существующих в стабильных условиях без резких колебаний численности или дивергировавших под действием дрейфа генов в разных рефугиумах (Slatkin, Hudson, 1991). Ранее нами было высказано предположение о существовании такого рефугиума у S. albus (Олейник и др., 2010), но небольшой объем исследованных выборок не позволил его обнаружить. По этой же причине не получено и статистическое подтверждение фрагментации ареала для филогруппы N17 как наиболее вероятного объяснения пространственного распределения гаплотипов S. m. malma (Oleinik et al., 2014). Поскольку ареал S. m. kuznetzovi ограничен бассейном р. Камчатка, можно более уверенно говорить о существовании плейстоценового рефугиума и связать появление современной зоны симпатрии с множественными эпизодами колонизации водоема ранее аллопатричными популяциями гольцов (Есин и др., 2017). В пользу подобного сценария свидетельствуют сложная историческая демография S. m. malma, отражающая периодичность оледенений в плейстоцене (Oleinik et al., 2014), а также современные представления о палеогеологии региона. Известно, что плейстоценовые оледенения на тихоокеанском побережье Берингова моря носили горный, а не покровный характер (Brigham-Grette, 2001; Barr, Solomina, 2014), как и масштабные оледенения среднего и позднего плейстоцена на п-ве Камчатка (Леонов, Кобренков, 2003), когда долина р. Камчатка не подвергалась ледниковым воздействиям и сохраняла постоянный сток (Черешнев, 1998). Одновременно разного рода геоморфологическая активность в регионе неоднократно создавала условия для изоляции гольцов (Певзнер и др., 2012).
Результаты популяционно-генетического и филогеографического исследования выявили вероятную историческую фрагментацию ареала S. m. malma, связанную с популяциями зал. Аляска Тихого океана (Олейник и др., 2011; Oleinik et al., 2014). Опираясь на палеогеографические реконструкции и анализ неслучайного пространственного распределения гаплотипов, было обосновано существование у S. m. malma наряду с основным Берингийским небольших криптических рефугиумов в северо-западной части Северной Америки (Oleinik et al., 2014). Генеалогия гаплотипов мтДНК (рис. 2) демонстрирует присутствие двух филогрупп N17 и N13, в равной степени (Dxy = 0.003 ± 0.001) дивергировавших от центрального кластера, включающего предковые гаплотипы S. m. malma (N1, N4). Такое соотношение оценок дивергенции и приведенные выше аргументы не только свидетельствуют об исторической фрагментации в зал. Аляска для филогруппы N13, но могут предполагать аналогичные процессы на противоположном побережье для филогруппы N17. Отметим, что предлагаемая гипотеза полностью соответствует разрабатываемому в последние годы новому взгляду на структуру рефугиумов Северной Америки (Shafer et al., 2010).
Результаты генеалогического анализа гаплотипов мтДНК подтверждают филогенетическую близость S. m. kuznetzovi и S. albus. Можно сделать вывод, что эндемичные гольцы возникли от общего с S. m. malma предка (Глубоковский, 1977, 1995). В настоящее время между S. m. kuznetzovi, S. albus и S. m. malma наблюдается неполное расхождение митохондриальных линий. Гаплотипы предковой популяции S. m. kuznetzovi, представляющие самостоятельный центр радиации, значительно дивергировали от S. m. malma р. Камчатка. При этом обнаружение у S. m. kuznetzovi гаплотипа, относящегося к филогруппе N4, которая доминирует в популяции S. m. malma р. Камчатка, может свидетельствовать как о сохранении предкового полиморфизма, так и о вторичном контакте популяций с вероятной гибридизацией. Идентичные результаты были получены и для S. albus (рис. 2) (Олейник и др., 2010). На данном этапе, опираясь только на исследования мтДНК, сложно определить, имеется ли в современных симпатричных популяциях поток генов или мы наблюдаем последствия исторической гибридизации. Данные по ядерному локусу LDH-C1 позволяют разделить представителей S. alpinus и S. m. malma, но, к сожалению, не дифференцируют S. m. malma, S. albus и S. m. kuznetzovi. В то же время анализ данных о генотипах девяти микросателлитных локусов показал, что между симпатричными популяциями S. albus и S. m. malma в бассейне р. Камчатка существует значительный уровень исторической и современной миграции (Салменкова, 2016).
Несмотря на невысокие оценки генетической дивергенции, S. m. kuznetzovi представляет особый интерес для изучения проблем эволюции и видообразования гольцов рода Salvelinus. Для более глубокого понимания причин образования области симпатрии в обсуждаемом районе ареала и для выяснения роли исторических событий в формировании современного географического распространения гаплотипов мтДНК представляется важным провести широкое исследование гольцов из разных локальностей на основе репрезентативного набора быстро эволюционирующих маркеров. Применение данного подхода позволило реконструировать эволюционную историю нескольких видов гольцов, ареалы которых в прошлом находились в Северном полушарии в регионах развития плейстоценовых оледенений (Gomez-Uchida et al., 2008; Moore et al., 2015; Taylor, May-McNally, 2015). Однако необходимо предостеречь исследователей от использования для внутривидовой дифференциации гольцов небольших участков мтДНК. Ранее было установлено, что генетическая дифференциация между популяциями гольцов имеет разные векторы направленности, не связана с изменениями в каком-либо одном гене, а затрагивает весь митохондриальный геном (Олейник и др., 2010). Поэтому анализ коротких нуклеотидных последовательностей одного гена малоэффективен при изучении данной группы.
Авторы посвящают эту статью памяти выдающегося ихтиолога Игоря Александровича Черешнева и выражают глубокую признательность В.А. Паренскому (ННЦМБ ДВО РАН) за предоставление двух экземпляров каменного гольца.
Исследование поддержано Российским фондом фундаментальных исследований (проект № 15-04-01000).
Список литературы
Богуцкая Н.Г., Насека А.М. Каталог бесчелюстных и рыб пресных и солоноватых вод России с номенклатурными и таксономическими комментариями. М.: Товарищество науч. изд. КМК. 2004. 389 с.
Васильев В.П. Эволюционная кариология рыб. М.: Наука. 1985. 300 с.
Глубоковский М.К. Таксономические отношения гольцов рода Salvelinus в бассейне реки Камчатка // Биол. моря. 1977. № 3. С. 24–35.
Глубоковский М.К. Эволюционная биология лососевых рыб. М.: Наука. 1995. 343 с.
Есин Е.В., Маркевич Г.Н., Мельник Н.О. Морфологическая специфика “каменного” гольца (Salvelinus, Salmonidae) бассейна реки Камчатка // Биоразнообразие уникальных экосистем: Тр. Кроноцк. гос. биосфер. запов. 2017. Вып. 5. С. 13–25.
Леонов В.Л., Кобренков Д.В. Основные закономерности распространения ледников последнего верхнеплейстоценового оледенения на юго-восточной Камчатке // Вестн. КРАУНЦ. Науки о земле. 2003. № 1. С. 74–85.
Олейник А.Г., Скурихина Л.А., Брыков Вл.А. Генетическая дивергенция митохондриальной ДНК белого гольца Salvelinus albus и северной мальмы Salvelinus malma malma // Генетика. 2010. Т. 46. № 3. С. 389–400.
Олейник А.Г., Скурихина Л.А., Брыков Вл.А. Популяционно-генетическая структура северной мальмы Salvelinus malma malma Азии и Северной Америки // Генетика. 2011. Т. 47. № 12. С. 1642–1654.
Олейник А.Г., Скурихина Л.А., Брыков Вл.А. Филогения гольцов рода Salvelinus по данным анализа митохондриальной ДНК // Генетика. 2015. Т. 51. № 1. С. 63–77.
Олейник А.Г., Скурихина Л.А., Кухлевский А.Д. Новый молекулярный маркер – ген лактатдегидрогеназы LDH-C1 для филогенетического анализа лососевых рыб (Salmoniformes: Salmonidae) // Биол. моря. 2017. Т. 43. № 6. С. 453–456.
Осинов А.Г., Павлов С.Д. Аллозимная изменчивость и генетическая дивергенция популяций арктического гольца и мальмы (Salvelinus alpinus – S. malma complex) // Вопр. ихтиологии. 1998. Т. 38. № 1. С. 47–61.
Певзнер М.М., Бабанский А.Д., Толстых М.Л., Кононкова Н.Н. Перестройка магматической системы вулканического массива Шивелуч как следствие крупномасштабных обрушений его постройки в позднем плейстоцене – раннем голоцене // Докл. РАН. 2012. Т. 447. № 3. С. 318–321.
Савваитова К.А. Арктические гольцы (структура популяционных систем, перспективы хозяйственного использования). М.: Агропромиздат. 1989. 224 с.
Савваитова К.А., Максимов В.А. Каменный голец из бассейна р. Камчатки // Науч. докл. высш. школы. Биол. науки. 1970. № 5. С. 7–20.
Салменкова Е.А. Генетическое взаимодействие между симпатричными популяциями близких видов гольцов – мальмы Salvelinus malma и белого гольца Salvelinus albus // Генетика. 2016. Т. 52. № 1. С. 84–89.
Сошнина В.А., Павлов С.Д., Зеленина Д.А. Генетическое разнообразие гольцов Командорских островов по результатам исследования митохондриальной ДНК // Генетика. 2016. Т. 52. № 11. С. 1336–1341.
Таранец А.Я. О некоторых новых пресноводных рыбах из Дальневосточного края // Докл. АН СССР. Сер. А. 1933. № 2. С. 83–85.
Черешнев И.А. Биогеография пресноводных рыб Дальнего Востока России. Владивосток: Дальнаука.1998. 130 с.
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. Лососевидные рыбы Северо-Востока России. Владивосток: Дальнаука. 2002. 496 с.
Alekseyev S.S., Bajno R., Gordeeva N.V. et al. Phylogeography and sympatric differentiation of the Arctic charr Salvelinus alpinus (L.) complex in Siberia as revealed by mtDNA sequence analysis // J. Fish Biol. 2009. V. 75. P. 368–392.
Balakirev E.S., Parensky V.A., Kovalev M.Yu., Ayala F.J. Complete mitochondrial genome of the stone char Salvelinus kuznetzovi (Salmoniformes, Salmonidae) // Mitochondrial DNA, Part B. 2016. V. 1. № 1. P. 287–288.
Bandelt H.J., Foster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. P. 37–48.
Barr I.D., Solomina O. Pleistocene and Holocene glacier fluctuations upon the Kamchatka Peninsula // Global Planet. Change. 2014. V. 113. P. 110–120.
Brigham-Grette J. New perspectives on Beringian Quaternary paleogeography, stratigraphy, and glacial history // Quat. Sci. Rev. 2001. V. 20. P. 15–24.
Brunner P.C., Douglas M.R., Osinov A. et al. Holarctic phylogeography of Arctic charr (Salvelinus alpinus L.) inferred from mitochondrial DNA sequences // Evolution. 2001. V. 55. № 3. P. 573–586.
Doiron S., Bernatchez L., Blier P.U. A comparative mitogenomics analysis of the potential adaptive value of Arctic charr mtDNA introgression in brook charr populations (Salvelinus fontinalis Mitchill) // Mol. Biol. Evol. 2002. V. 19. P. 1902–1909.
Esin E.V., Bocharova E.S., Mugue N.S., Markevich G.N. Occurrence of sympatric charr groups, Salvelinus, Salmonidae, in the lakes of Kamchatka: a legacy of the last glaciations // J. Fish Biol. 2017. V. 91. № 2. P. 628–644.
Felsenstein J. Confidence limits on phylogenies: An approach using the bootstrap // Evolution. 1985. V. 39. P. 783–791.
Gomez-Uchida D., Dunphy K.P., O’Connell M.F., Ruzzante D.E. Genetic divergence between sympatric Arctic charr Salvelinus alpinus morphs in Gander Lake, Newfoundland: roles of migration, mutation and unequal effective population sizes // J. Fish Biol. 2008. V. 73. P. 2040–2057.
Kumar S., Stecher G., Tamura K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets // Mol. Biol. Evol. 2016. V. 33. P. 1870–1874.
McMeel O.M., Hoey E.M., Ferguson A. Partial nucleotide sequences, and routine typing by polymerase chain reaction-restriction fragment length polymorphism, of the brown trout (Salmo trutta) lactate dehydrogenase, LDH-C1*90 and *100 alleles // Mol. Ecol. 2001. V. 10. P. 29–34.
Moore J.-S., Bajno R., Reist J.D., Taylor E.B. Post-glacial recolonization of the North American Arctic by Arctic char (Salvelinus alpinus): genetic evidence of multiple northern refugia and hybridization between glacial lineages // J. Biogeography. 2015. V. 42. P. 2089–2100.
Nei M., Kumar S. Molecular Evolution and Phylogenetics. Oxford: Oxford Univ. Press. 2000. 333 p.
Oleinik A.G., Skurikhina L.A., Bondar E.I., Brykov V.A. Phylogeography of northern Dolly Varden Salvelinus malma malma based on analysis of mitochondrial DNA // J. Zool. Syst. Evol. Res. 2014. V. 52. № 4. P. 293–304.
Osinov A.G. The Dolly Varden (Salvelinus malma) of Eurasia and the chars of the Kamchatka River basin: Data from allozyme analysis // ISACF Inf. Ser. 1999. № 7. P. 173–181.
Pavlov S.D., Savvaitova K.A. The stone char of the Kamchatka river // ISACF Inf. Ser. 1991. № 5. P. 131–134.
Rozas J., Ferrer-Mata A., Sánchez-DelBarrio J.C. et al. DnaSP 6: DNA sequence polymorphism analysis of large datasets // Mol. Biol. Evol. 2017. V. 34. P. 3299–3302.
Saitou N., Nei M. The neighbor-joining method: A new method for reconstructing phylogenetic trees // Mol. Biol. Evol. 1987. V. 4. P. 406–425.
Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: A laboratory manual. New York: Cold Spring Harbor Lab. Press. 1989. 1626 p.
Shafer A.B., Cullingham C.I., Côté S.D., Coltman D.W. Of glaciers and refugia: a decade of study sheds new light on the phylogeography of northwestern North America // Mol. Ecol. 2010. V. 19. P. 4589–4621.
Slatkin M., Hudson R.R. Pairwise comparisons of mitochondrial DNA sequences in stable and exponentially growing populations // Genetics. 1991. V. 129. P. 555–562.
Taylor E.B., May-McNally S.L. Genetic analysis of Dolly Varden (Salvelinus malma) across its North American range: evidence for a contact zone in southcentral Alaska // Can. J. Fish. Aquat. Sci. 2015. V. 72. № 7. P. 1048–1057.
Yamamoto S., Maekawa K., Morita K. et al. Phylogeography of the salmonid fish, Dolly Varden Salvelinus malma: multiple glacial refugia in the North Pacific Rim // Zool. Sci. 2014. V. 31. № 10. P. 660–670.
Uiblein F., Jagsch A., Honsig-Erlenburg W., Weiss S. Status, habitat use, and vulnerability of the European grayling in Austrian waters // J. Fish Biol. 2001. V. 59. Suppl A. P. 223–247.
Ward R.D., Zemlak T.S., Innes B.H. et al. DNA barcoding Australia’s fish species // Phil. Trans. Roy. Soc., B. 2005. V. 360. P. 1847–1857.
Дополнительные материалы отсутствуют.


