Биология моря, 2020, T. 46, № 5, стр. 323-328
Рост, размерная структура популяции, физиологические изменения и ультраструктура микроводоросли Picochlorum maculatum (Chlorophyta) при сублетальных концентрациях меди
1 Национальный научный центр морской биологии (ННЦМБ) им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
2 Дальневосточный федеральный университет
690950 Владивосток, Россия
* E-mail: zhannav@mail.ru
Поступила в редакцию 27.06.2019
После доработки 02.10.2019
Принята к публикации 03.10.2019
Аннотация
В течение семи суток исследовали влияние меди в концентрациях 100 и 200 мкг/л на динамику численности популяции, размер и ультраструктуру клеток, флуоресценцию хлорофилла а, мембранный потенциал митохондрий и содержание нейтральных липидов у микроводоросли Picochlorum maculatum (Chlorophyta). Показано, что в присутствии меди рост популяции ингибировался; размер и ультраструктура клеток не изменялись. Флуоресценция хлорофилла а была ниже контрольной в течение всего эксперимента; мембранный потенциал митохондрий снижался на третьи сутки, а на седьмые сутки восстанавливался. Содержание нейтральных липидов уменьшалось и к завершению опыта не достигало контрольного уровня.
Микроводоросли – это первичные продуценты, привлекающие внимание исследователей на протяжении длительного времени. Экологические аспекты пресноводных зеленых микроводорослей изучены довольно хорошо, а морским одноклеточным водорослям уделяется меньше внимания (Tragin, Vaulot, 2018). Актуальным является исследование влияния тяжелых металлов, в частности меди, на жизнедеятельность микроводорослей. Интерес к меди обусловлен тем, что в определенном количестве она необходима для нормального роста микроводорослей, входит в состав ряда ферментов, например, пластоцианина и цитохромоксидазы, участвующих в работе электрон-транспортных цепей хлоропластов и митохондрий (Adams et al., 2016). Опубликованы сведения о динамике численности популяции и фотосинтетическом аппарате микроводорослей – главном поставщике энергии растению. В то же время состоянию митохондрий уделяется меньше внимания (Cid et al., 1996). Известно, что основные задачи митохондрий (электронный транспорт и окислительное фосфорилирование) дублируются в хлоропластах, а их функционирование зависит от условий среды и энергетических потребностей клетки (Machado, Soares, 2014).
Одним из последствий стресса является интенсивное продуцирование микроводорослями нейтральных липидов, которые при благоприятных условиях в небольшом количестве присутствуют в мембранах клетки. Нейтральные липиды выполняют сигнальную функцию, участвуют в поддержании энергетического гомеостаза клеток и перестройках клеточных мембран. Метаболизм липидов тесно связан с фотосинтезом, дыханием и другими физиологическими процессами (Соловченко, 2012; Pyc et al., 2017).
В практике изучения влияния факторов среды на одноклеточные водоросли все чаще используется проточная цитометрия. Данный метод позволяет определить численность клеток, их размерную структуру и оценить физиологическое состояние микроводорослей (Hyka et al., 2013). Работ с результатами исследования ультраструктурных изменений водорослей при воздействии меди с помощью этого метода немного, что, возможно, связано с его трудоемкостью. Так, показано, что при токсических концентрациях тяжелых металлов у водорослей происходит уменьшение крист в митохондриях (El-Nagger, Sheikh, 2014), наблюдаются дезинтеграция тилакоидов и их разрушение (Gouveia et al., 2013; Martínez-Ruiz, Martínez-Jerónimo, 2015; Chen et al., 2016), а также утолщение клеточной стенки (Shanab et al., 2012).
Цели настоящей работы – изучить рост и размерную структуру популяции, функционирование фотосинтетического аппарата и митохондрий, а также определить содержание и ультраструктуру клеток у зеленой микроводоросли Picochlorum maculatum (Butcher) Henley, Hironaka, Guillou, M. Buchheim, J. Buchheim, M. Fawley & K. Fawley, 2004. Она применяется в биотехнологии как источник липидов и незаменимых жирных кислот (Klinthong et al., 2015; Augustine et al., 2017) и в марикультуре в качестве корма для животных (Kumar et al., 2017), в связи с этим изучение ее биологии и экологии является актуальным.
МАТЕРИАЛ И МЕТОДИКА
Объектом исследования служила культура одноклеточной водоросли Picochlorum maculatum, выделенная из вод зал. Восток (Японское море). Водоросль была выращена в 100 мл культуральной f среды, приготовленной в колбах Эрленмейера объемом 250 мл на основе фильтрованной и стерилизованной морской воды соленостью 32‰ при температуре 18°С и интенсивности освещения 70 мкмоль/м2/с в области видимого света с фотопериодом 14 ч свет : 10 ч темнота (Орлова и др., 2011). В качестве инокулята использовали культуру на экспоненциальной стадии роста. Начальная концентрация клеток микроводоросли во всех опытах составляла 10 × 104 кл/мл, продолжительность экспериментов – 7 сут. Пробы для проточно-цитометрического анализа отбирали через трое и семь суток опыта, для ультраструктурного – через семь суток. Медь добавляли в виде CuSO4 ⋅ 5H2O; концентрации (100 и 200 мкг/л) указаны в пересчете на ионы меди.
Все показатели измеряли на проточном цитометре CytoFLEX (Beckman Coulter, США). Для анализа записано 10 тыс. событий (частиц, регистрируемых в пробе) в течение каждого измерения. Клетки водоросли из общего числа событий, регистрируемых цитометром, выбирали по флуоресценции хлорофилла а (Hyka et al., 2013). Диаметр клеток определяли с помощью калибровочных бусин (Molecular Probes, США) по показателю прямого светорассеяния. Значения показателя бокового светорассеяния использовали для относительной оценки внутренней структуры клеток (Jamers et al., 2009; Hyka et al., 2013).
Интенсивность флуоресценции хлорофилла а регистрировали на длине волны 690 нм, длина волны возбуждения составляла 488 нм (Hyka et al., 2013). Для определения мембранного потенциала митохондрий использовали флуоресцентный краситель DiOC6(3) в течение 30 мин; длина волны возбуждения составляла 488 нм, испускания – 525 нм (Зурочка и др., 2014). Содержание нейтральных липидов определяли по флуоресценции флуорохрома Nile Red, окрашивание проводили в течение 15 мин при комнатной температуре в темноте; длина волны возбуждения составляла 488 нм, испускания – 580 нм (Aleman-Nava et al., 2016).
Для электронно-микроскопического анализа клетки P. maculatum фиксировали в течение 2 ч в 2.5% глютаральдегиде, приготовленном на фосфатном буфере (pH 7.4), а затем в течение 1 ч в 1% четырехокиси осмия на этом же буфере. Материал обезвоживали в серии спиртов возрастающей концентрации и ацетона, заливали в смесь эпона и аралдита (Fluka, Швейцария) по стандартной методике (Luft, 1961). Срезы толщиной 70 нм изготавливали на ультрамикротоме Ultracut R LEICA (Австрия), контрастировали 2% раствором уранилацетата и цитратом свинца по стандартной методике Рейнольдса (Reynolds, 1963). Срезы исследовали на трансмиссионном электронном микроскопе (ТЭМ) Libra 120 (Carl Zeiss, Германия).
Эксперименты проведены в трех повторностях, данные выражены в процентах к контролю (контроль − показатели, полученные без добавления меди). На графиках и в таблице представлены средние значения и стандартные отклонения.
РЕЗУЛЬТАТЫ
Концентрация меди 100 мкг/л не оказывала влияния на численность клеток Picochlorum maculatum через трое суток опыта, а на седьмые сутки снижалась до 52% от контрольной (рис. 1а). Флуоресценция хлорофилла а, мембранный потенциал митохондрий и содержание нейтральных липидов незначительно снижались на третьи сутки (рис. 1б–1г). К завершению эксперимента мембранный потенциал митохондрий значимо не отличался от контрольного, остальные физиологические показатели оставались на прежнем уровне. Размер клеток не изменялся в течение экспозиции (табл. 1).
Рис. 1.
Рост популяции и физиологическое состояние Picochlorum maculatum при воздействии меди. Данные выражены в процентах к контролю (показатели, полученные без добавления меди).
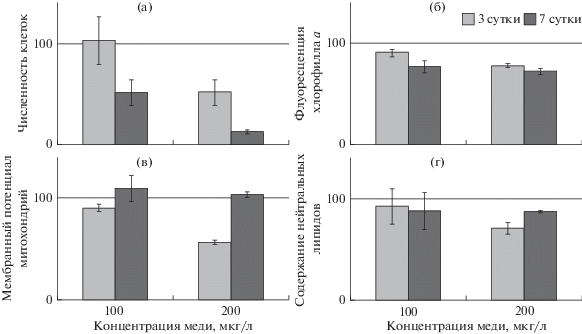
Таблица 1.
Размер клеток (% от общего числа) Picochlorum maculatum при воздействии меди разной концентрации
| Т, сут | Контроль | 100 мкг/л меди | 200 мкг/л меди | |||
|---|---|---|---|---|---|---|
| 2–4 мкм | >4 мкм | 2–4 мкм | >4 мкм | 2–4 мкм | >4 мкм | |
| 3 | 99.7 ± 0.4 | 0.3 ± 0.05 | 99.3 ± 0.7 | 0.1 ± 0.03 | 99.7 ± 1.6 | 0.3 ± 0.04 |
| 7 | 99.8 ± 0.6 | 0.2 ± 0.01 | 99.6 ± 1.3 | 0.4 ± 0.1 | 98.3 ± 1.5 | 1.2 ± 0.2 |
В контроле клетки P. maculatum имели овальную форму, типичную ультраструктуру, характерную для представителей зеленых водорослей (рис. 2а). Сравнительно крупный пристеночный хлоропласт содержал пластоглобулы. Ядро овальной формы диаметром 0.7–1.0 мкм располагалось на периферии, в апикальной части клетки находилась крупная вакуоль с электронно-светлым содержимым. Исследование ультраструктуры P. maculatum не выявило различий в строении протопласта и его элементов в контроле и при воздействии меди в концентрации 100 мкг/л (рис. 2б).
Рис. 2.
Ультраструктура клеток Picochlorum maculatum. а – в контроле, б – при концентрации меди 100 мкг/л, в – 200 мкг/л (ch – хлоропласт, nu – ядро; v – вакуоль; стрелками отмечены пластоглобулы). Масштаб – 500 нм.
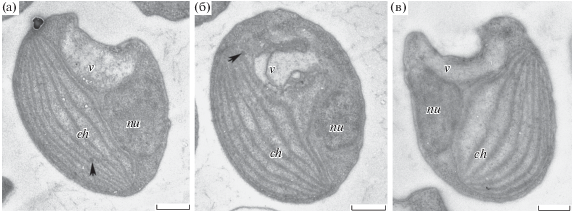
При концентрации меди 200 мкг/л численность клеток была в 2 раза ниже, чем в контроле; к окончанию эксперимента на третьи сутки опыта она составляла 13% от контроля (рис. 1а). Значения физиологических показателей снижались и, за исключением мембранного потенциала митохондрий, не восстанавливались в течение опыта. Размер клеток (табл. 1) и их ультраструктура (рис. 2в) не отличались от таковых в контроле.
ОБСУЖДЕНИЕ
Рост популяции Picochlorum maculatum ингибировался при концентрациях меди 100 и 200 мкг/л. Снижение роста до 30% от контроля отмечено у Tetraselmis sp. при концентрации меди 40 мкг/л (Adams et al., 2016). Показано, что при гибели клеток P. maculatum их размер не изменялся. В условиях стресса, как правило, наблюдалось укрупнение клеток. Это связано с тем, что энергии на процесс деления недостаточно, а необходимые для этого вещества продолжают накапливаться, что способствует снижению удельной концентрации токсиканта внутри клетки (Cid et al., 1996). Метаболизм микроводоросли, по-видимому, перестраивается для поддержания ростовых процессов, а клетки с изменившимися ультраструктурой и размером элиминируются из популяции. В неблагоприятных условиях, в том числе при сублетальных концентрациях меди, организм может использовать энергию, предназначенную для роста, на другие клеточные процессы, необходимые для контроля и поддержания гомеостаза клетки (Perales-Vela et al., 2007). Причиной ингибирования клеточного деления является также способность меди связываться с сульфгидрильными группами, играющими важную роль в регуляции данного процесса (Miazek et al., 2015; Wang et al., 2018). Кроме этого, медь оказывает негативное действие на морфологию хромосом и клеточный цикл (Jiang et al., 2001).
Рост растений зависит от эффективного поглощения солнечной энергии и ее трансформации в химическую в форме НАДФ-H+ и АТФ, а также от эффективной утилизации химической энергии в процессе фотосинтетической фиксации CO2 (Perales-Vela et al., 2007). Снижение интенсивности флуоресценции хлорофилла а у P. maculatum может быть связано как с его непосредственным уменьшением (в результате ингибирования синтеза, разрушения, выхода из фотосинтетических мембран), так и с ингибированием фотосинтеза в результате работы электрон-транспортной цепи фотосистем (Титов и др., 2011; Wang et al., 2018). В литературе имеются сведения, что пластоглобулы участвуют в детоксикации тяжелых металлов, в токсических условиях отмечено формирование данных включений (Титов и др., 2011; El Nagger, Sheikh, 2014). Возможно, наличие пластоглобул способствует адаптации P. maculatum к воздействию меди.
Митохондрии – органеллы, быстро перестраивающиеся при изменении условий среды: их размер, количество и субклеточное распределение зависят от физиологических потребностей клетки. Мембранный потенциал митохондрий P. maculatum снижался при воздействии меди (рис. 1в), что свидетельствует о деполяризации мембран. Данное явление зарегистрировано у зеленой водоросли Pseudokirchneriella subcapitata при концентрации меди 80 мкг/л через трое суток опыта (Machado, Soares, 2014). При подавлении фотосинтеза микроводорослей усиливается роль митохондрий в метаболических процессах. Например, активация дыхания является следствием потребления энергии для обеспечения детоксикации меди. В целом процессы, связанные с обеспечением дыхания растений, более устойчивы к меди, чем фотосинтез (Perales-Vela et al., 2007).
При стрессовых условиях любой природы у водорослей часто наблюдается накопление нейтральных липидов, однако в настоящей работе отмечено снижение их содержания. Это может быть связано с использованием нейтральных липидов при возрастающих энергозатратах клетки в токсических условиях. На примере другого тяжелого металла – кадмия показано, что его содержание в среде приводило к снижению количества нейтральных липидов и даже к разрушению липидных телец у микроводорослей (El-Nagger, Sheikh, 2014; Miazek et al., 2015).
Ультраструктура клеток P. maculatum при интоксикации медью оставалась сходной с таковой в контроле. Однако было неоднократно показано, что в присутствии в среде меди изменялось внутреннее строение клеток: увеличивались количество и размер вакуолей (Adams et al., 2016; Chen et al., 2016), происходило накопление крахмальных гранул и утолщение клеточной оболочки (El-Nagger, Sheikh, 2014). Известно, что вакуоли в условиях стресса способны накапливать ряд соединений, обладающих сильным антиоксидантным действием, что позволяет этим органеллам включаться в защиту клетки от окислительного стресса (Андреев, 2012). P. maculatum имеет крупную вакуоль, что обеспечивает водоросли поддержание физиологических процессов при воздействии меди. Так как в условиях эксперимента ее клеточная стенка оставалась неизменной и включений меди в органеллы клетки не обнаружено, можно предположить, что эта водоросль обладает механизмами экскрекции меди в среду, снижающими токсическое действие металла.
Таким образом, наибольшее влияние медь оказывала на динамику численности P. maculatum, а не на физиологические процессы данной микроводоросли. Такие же результаты получены на пресноводной Scenedesmus incrasatulus (см.: Perales-Vela et al., 2007): при замедлении роста популяции фотосинтетический аппарат и митохондрии функционировали без изменений.
Список литературы
Андреев И.М. Роль вакуоли в редокс-гомеостазе растительных клеток // Физиол. раст. 2012. Т. 59. С. 660–667.
Зурочка А.В., Хайдуков С.В., Кудрявцев И.В., Черешнев В.А. Проточная цитометрия в медицине и биологии. 2-е изд., доп. и расш. Екатеринбург: РИО УрО РАН. 2014. 576 с.
Орлова Т.Ю., Айздайчер Н.А., Стоник И.В. Лабораторное культивирование морских микроводорослей, включая продуцентов фитотоксинов: научно-метод. пособ. Владивосток: Дальнаука. 2011. 89 с.
Соловченко А.Е. Физиологическая роль накопления нейтральных липидов эукариотическими микроводорослями при стрессах // Физиол. раст. 2012. Т. 59. С. 192–202.
Титов А.Ф., Таланова В.В., Казнина Н.М. Физиологические основы устойчивости растений к тяжелым металлам: учеб. пособ. Институт биологии КарНЦ РАН. Петрозаводск: Карельский научный центр РАН. 2011. 77 с.
Adams M.S., Dillon C.T., Vogt S. et al. Copper uptake, intracellular localization and speciation in marine microalgae measured by synchrotron radiation X-ray fluorescence and absorption microspectroscopy // Environ. Sci. Technol. 2016. V. 20. P. 1–25.
Alemán-Nava G.S., Cuellar-Bermudez S.P., Cuaresma M. et al. How to use Nile Red, a selective fluorescent stain for microalgal neutral lipids // J. Microbiol. Methods. 2016. V. 128. P. 74–79.
Augustine A., Kumaran J., Puthumana J. et al. Multifactorial interactions and optimization in biomass harvesting of marine picoalga Picochlorum maculatum MACC3 with different flocculants // Aquaculture. 2017. V. 474. P. 18–25.
Chen Z., Song S., Wen Yu. et al. Toxicity of Cu (II) to the green alga Chlorella vulgaris: a perspective of photosynthesis and oxidant stress // Environ. Sci. Pollut. Res. Int. 2016. V. 18. https://doi.org/10.1007/s11356-016-6997-2
Cid A., Fidargo P., Herrero C., Abalde J. Toxic action of copper on the membrane system of a marine diatom measured by flow cytometry // Cytometry, Part A. 1996. V. 25. P. 32–36.
El-Naggar A.H., Sheikh H.M. Response of the green microalga Chlorella vulgaris to the oxidative stress caused by some heavy metals // Life Sci. J. 2014. V. 11. P. 1349–1357.
Gouveia C., Kreusch M., Schmidt É.C. et al. The effects of lead and copper on the cellular architecture and metabolism of the red alga Gracilaria domingensis // Microsc. Microanal. 2013. V. 19. P. 513–524.
Hyka P., Lickova S., Přibyl P. et al. Flow cytometry for the development of biotechnological processes with microalgae // Biotechnol. Adv. 2013. V. 31. P. 2–16.
Jamers A.N., Lenjou M., Deraedt P. et al. Flow cytometric analysis of the cadmium-exposed green alga Chlamydomonas reinhardtii (Chlorophyceae) // Eur. J. Phycol. 2009. V. 44. P. 541–550.
Jiang W., Liu D.H., Liu X. Effect of copper on root growth, cell division, and nucleolus of Zea mays // Biol. Plant. 2001. V. 44. P. 105–109.
Klinthong W., Yang Y.-H., Huang C.-H., Tan C.-S. A review: microalgae and their applications in CO2 capture and renewable energy // Aerosol Air Qual. Res. 2015. V. 15. P. 712–742.
Kumar S.D., Santhanam P., Ananth S. et al. Evaluation of suitability of wastewater-grown microalgae (Picochlorum maculatum) and copepod (Oithona rigida) as live feed for white leg shrimp Litopenaeus vannamei post-larvae // Aquacult. Int. 2017. V. 25. P. 393–411.
Luft J.H.J. Improvements in epoxy resin embedding methods // J. Biophys. Biochem. Cytol. 1961. V. 9. P. 409–414.
Machado M.D., Soares E.V. Modification of cell volume and proliferative capacity of Pseudokirchneriella subcapitata cells exposed to metal stress // Aquat. Toxicol. 2014. V. 147. P. 1–6.
Martínez-Ruiz E.B., Martínez-Jerónimo F. Nickel has biochemical, physiological, and structural effects on the green microalga Ankistrodesmus falcatus: An integrative study // Aquat. Toxicol. 2015. V. 169. P. 27–36.
Miazek K., Iwanek W., Remacle C. et al. Effect of metals, metalloids and metallic nanoparticles on microalgae growth and industrial products biosynthesis: a review // Int. J. Mol. Sci. 2015. V. 16. P. 23929–23969.
Perales-Vela H.V., González-Moreno S., Montes-Horcasitas C., Canizares-Villanueva R.O. Growth, photosynthetic and respiratory responses to sub-lethal copper concentrations in Scenedesmus incrassatulus (Chlorophyceae) // Chemosphere. 2007. V. 67. P. 2274–2281.
Pyc M., Cai Y., Greer M.S. et al. Turning over a new leaf in lipid droplet biology // Trends Plant Sci. 2017. V. 22. P. 596–609.
Reynolds E. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy // J. Cell Biol. 1963. V. 17. P. 208–212.
Shanab S., Essa A., Shalaby E. Bioremoval capacity of three heavy metals by some microalgae species (Egyptian isolates) // Plant Signal. Behav. 2012. V. 7. № 3. P. 1–8.
Tragin M., Vaulot P. Green microalgae in marine coastal waters: the ocean sampling day (OSD) dataset // Sci. Rep. 2018. V. 18. https://doi.org/10.1038/s41598-018-32338-w
Wang H., Ebenezer V., Ki J.-S. Photosynthetic and biochemical responses of the freshwater green algae Closterium ehrenbergii Meneghini (Conjugatophyceae) exposed to the metal coppers and its implication for toxicity testing // J. Microbiol. 2018. V. 56. P. 426–434.
Дополнительные материалы отсутствуют.


