Биология моря, 2020, T. 46, № 5, стр. 315-322
Характеристика нагульного скопления горбатого кита Megaptera novaeangliae (Borowski, 1781) в проливе Сенявина у восточного побережья Чукотки по результатам фотоидентификации
О. В. Титова 1, *, И. Д. Федутин 2, О. А. Филатова 2, 3, М. А. Антипин 3, А. М. Бурдин 4, Э. Хойт 5
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
2 Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
3 ФГБУ “Национальный парк “Берингия”
689251 Чукотский АО, пос. Провидения, Россия
4 Камчатский филиал Тихоокеанского института географии ДВО РАН
683000 Петропавловск-Камчатский, Россия
5 Общество охраны китов и дельфинов
DT65DD Дорсет, Бридпорт, Великобритания
* E-mail: arizona_sunset@mail.ru
Поступила в редакцию 25.05.2019
После доработки 21.10.2019
Принята к публикации 28.11.2019
Аннотация
В работе впервые описано нагульное скопление горбатых китов в прол. Сенявина на Чукотке. За два летне-осенних сезона 2017 и 2018 гг. было идентифицировано 143 особи. Более половины китов, обнаруженных в первый год, были встречены и на следующий год. Пространственное распределение кормящихся китов в разные годы существенно различалось, что может быть связано с использованием животными разных типов добычи. Состав нагульной группировки был относительно постоянным, с чуть более интенсивным притоком новых животных в течение сезона 2018 г. Расчетная численность скопления для 2017 г. составила 84(±1.5) – 90(±6.4) особей, для 2018 г. – 105(±3.7) – 109(±6.2) особей. При сравнении наших фотографий китов с фотокаталогами других нагульных скоплений были обнаружены совпадения с Чукотским морем, Анадырским заливом, Командорскими и восточными Алеутскими островами. Среди районов размножения для китов из прол. Сенявина обнаружены совпадения лишь с китами акватории Гавайских островов. Мы предполагаем, что нагульное скопление горбачей в прол. Сенявина относительно стабильно между сезонами и в течение сезона. Наблюдается обмен животными с некоторыми другими районами нагула. Изучаемое скопление образовано преимущественно китами гавайской субпопуляции.
Популяция горбатого кита Megaptera novaeangliae (Borowski, 1781) на Дальнем Востоке России была сильно подорвана коммерческим китобойным промыслом. В 1930-х гг. северное и восточное побережья Чукотки считались основными районами встреч этих китов в западной части Тихого океана (Томилин, 1937). В 1960-х гг. их численность здесь снизилась до критической (Berzin, Vladimirov, 1981).
В 1993–2011 гг. на Чукотке были организованы наблюдения за китообразными с привлечением местных промысловых бригад (Мельников, 2014). Автор отмечает резкое увеличение встреч горбачей во всех исследованных районах в 2010 г. Одним из мест наблюдений, обсуждаемых в работе В.В. Мельникова, был прол. Сенявина, где уже в октябре 2004 г. было зарегистрировано большое количество китов за одно наблюдение. Регулярно и в значительном количестве горбачей стали регистрировать в прол. Сенявина с 2010 г. (И.А. Загребин, личное сообщение).
В последние десятилетия одним из самых распространенных методов для исследования китообразных стала фотоидентификация (Katona, Whitehead, 1981). Возможность индивидуально различать животных позволяет точнее определять их численность, массово отслеживать перемещение животных между разными районами, а также, накапливая повторные наблюдения одних и тех же особей, определять некоторые популяционные и физиологические параметры (Gabriele et al., 2001; Calambokidis, Barlow, 2004).
Работы по фотоидентификации горбатых китов в водах Чукотки до настоящего времени проводились дважды. В 2005 г. в рамках крупного международного проекта по изучению популяционной структуры и численности горбатых китов в северной части Тихого океана SPLASH (Structure of Populations, Levels of Abundance and Status of humpback whales in the North Pacific) был организован судовой рейс, охвативший прибрежную зону Чукотки от мыса Наварин до мыса Дежнева. Результатом этого рейса стала идентификация 27 горбачей в Анадырском заливе. Летом 2017 г. при поддержке Русского географического общества в Анадырском заливе была проведена целенаправленная работа по идентификации горбатых китов. За 10 выходов в море удалось идентифицировать 83 кита (Бурдин и др., 2017).
Ареал горбача представляет собой ряд мест размножения в тропических и субтропических широтах, где киты проводят зиму, а также множество дискретных прибрежных участков в водах средних и высоких широт, куда киты ежегодно мигрируют в летнее время для нагула. Повсеместно наблюдается сложная структура миграционных путей, связывающих эти части ареала (Baker et al., 2013).
В северной части Тихого океана выделяют пять районов размножения горбатых китов, на основании привязанности к которым всех горбачей северной Пацифики подразделяют на пять субпопуляций (Bettridge et al., 2015). В российских водах отмечены горбачи, принадлежащие к четырем из них. На Камчатке, Командорских островах и Курилах встречаются киты преимущественно окинаво-филиппинской и в меньшей степени гавайской субпопуляций; в Анадырском заливе киты гавайской субпопуляции преобладают. Горбачи мексиканской субпопуляции встречаются единично в Анадырском заливе и на Командорах (Titova et al., 2018). Считают, что в водах Дальнего Востока России нагуливается и так называемая вторая западно-тихоокеанская субпопуляция (Second West Pacific DPS), точное место размножения которой не определено. О ее существовании предполагают лишь по косвенным данным (Calambokidis et al., 2008).
В настоящей работе впервые описано относительно недавно сформировавшееся нагульное скопление горбатых китов в прол. Сенявина. Проведено сравнение распределения китов в августе–сентябре 2017 и 2018 гг., проанализирована стабильность состава животных на протяжении периода наблюдений и оценена численность скопления. Сопоставляя фотокаталог горбачей прол. Сенявина с каталогами китов из других районов, мы получаем информацию о степени изолированности данного скопления и выясняем, животными какой субпопуляции оно образовано.
МАТЕРИАЛ И МЕТОДИКА
Материал был собран в августе–сентябре 2017 и 2018 гг. в прол. Сенявина, Провиденский район Чукотского АО (рис. 1). Акватория этого пролива представляет собой комплекс относительно глубоководных фьордов ледникового происхождения, в котором из-за специфической розы ветров, высоких скал по периметру и частых проявлений остаточного вулканизма формируется особый более мягкий микроклимат по сравнению с таковым на окружающем ландшафте (Купецкий, 1996).
Рис. 1.
Район работ и встречи китов в разные годы. Условные обозначения: “домики” – места расположения базового лагеря, линии – треки лодки, точки – встречи китов. а – расположение прол. Сенявина на общей карте региона, б – 2017 г.; в – 2018 г.
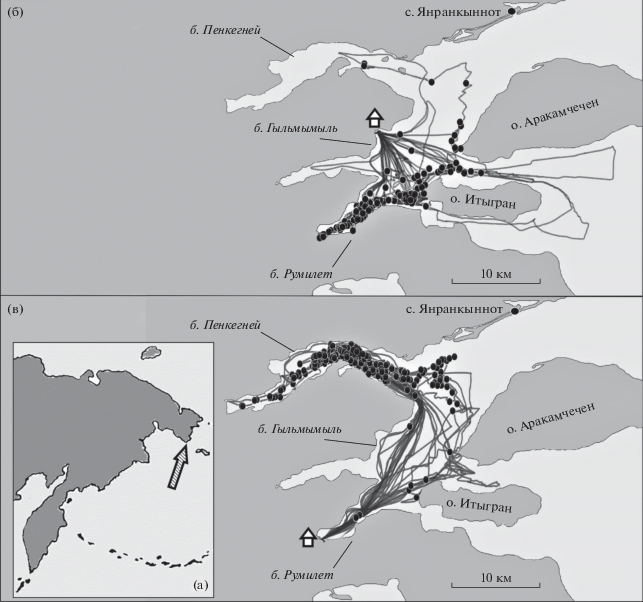
В 2017 г. базовый лагерь экспедиции располагался на кордоне национального парка “Берингия” в б. Гыльмымыль, в 2018 г. – в б. Румилет. Ежедневно при отсутствии осадков и силе ветра менее 4 баллов по шкале Бофорта к скоплению китов выходила исследовательская лодка “Zodiac Futura Mark III”. Осторожно приближаясь к животным, определяли координаты места встречи с помощью GPS и фотографировали по возможности всех китов, входящих в состав группы. Трек лодки записывался непрерывно на протяжении всего времени работы в море. Для фотосъемки использовали фотоаппараты Canon EOS-7D и Canon EOS-5D Mark III с телеобъективами 100–400 и 70–200 мм с экстендером 2×. Одновременно с фотосъемкой определяли тип активности животных (кормежка, отдых, перемещение, социальные взаимодействия). Одни и те же особи в течение дня могли быть зарегистрированы многократно. Среди встреченных китов по совокупности внешних признаков выделяли детенышей текущего года рождения и подростков, т.е. животных в возрасте более одного года, но еще не достигших зрелости. Признаками для выделения детенышей были заметно меньший размер тела и хвостовых лопастей, чем у соседних близко расположенных животных, а также постоянное или частое сопровождение одним конкретным взрослым животным, предположительно матерью. Признаком для выделения подростков служило наличие таких непостоянных элементов в окраске, как белизна на спинном плавнике и размытые или бледные очертания паттернов окраски на хвостовых лопастях (Blackmer et al., 2000). Для идентификации животных использовали нижнюю поверхность хвостовых лопастей, а также правую и левую сторону корпуса и спинного плавника. Информацию о встрече с каждой группой заносили в базу данных Microsoft Access 2010.
Для определения численности скопления в каждый из двух сезонов мы сформировали истории встреч конкретных особей, где отмечали их присутствие или отсутствие в выборке в течение каждого дня работы в море. На основании данных историй были составлены матрицы присутствия–отсутствия китов, по которым строили модели для расчета численности. При построении моделей для расчета численности китов на конкретной территории в определенный промежуток времени определяли дополнительные параметры. Прежде всего это вероятность повторной встречи животных (Hammond, 1986). Определение данного параметра возможно лишь при условии, что вероятность повторной встречи для всех животных равна. В нашем случае для выполнения этого условия из расчета были исключены все киты, идентифицированные как детеныши текущего года, так как они редко поднимают хвостовые плавники перед погружением и их иногда сложно определить при встрече без сопровождения матери (Calambokidis et al., 2008). Другими параметрами для построения моделей расчета численности являются факторы, связанные с демографическими изменениями скопления на протяжении периода наблюдения (Cormack, 1989). Мы определяли численность скопления по модели для открытых популяций, а также по модели для закрытых популяций, чтобы оценить верхний предел численности. Расчет производили с помощью пакета Rcapture для среды статистической обработки данных R 3.3.2. (R Development Core Team, 2011). В качестве статистической оценки средних значений использовали стандартную ошибку (SE).
Для выяснения связей нагульного скопления в прол. Сенявина с другими районами нагула горбачей в дальневосточных морях России мы сравнили всех идентифицированных за время работы китов с общим каталогом горбатых китов Дальнего Востока, собранным в 2004–2017 гг. на Командорских островах, у берегов Камчатки, на Курильских островах, в Анадырском заливе и в других районах. Чтобы проследить связи изучаемого нагульного скопления с местами размножения горбачей, а также с районами нагула в восточной части Тихого океана, каталог, собранный в результате фотоидентификации в прол. Сенявина, сопоставили с каталогом проекта SPLASH, размещенным на вебсайте Cascadia Research Collective. Авторизованный доступ к этому каталогу нам был любезно предоставлен руководителями проекта. Фотографии животных сравнивали вручную, предварительно ранжируя китов на группы, выделенные по типу окраски хвостовых лопастей. Это позволило искать совпадения между однотипными изображениями, что значительно ускорило процесс работы. Подробнее методика сравнения каталогов описана нами ранее (Titova et al., 2018)
РЕЗУЛЬТАТЫ
Общее количество идентификаций и возрастной состав
За два сезона работ было идентифицировано 143 особи горбатого кита (табл. 1). Около половины китов, идентифицированных в 2017 г. (53%), встречены повторно в 2018 г. Ежедневно отмечали от двух-трех до 50 особей и более. Это были преимущественно взрослые животные. Две пары мать–детеныш встретились в 2017 г. и пять пар – в 2018 г. Причем из пяти самок с детенышами, встреченных в 2018 г., три самки были встречены в 2017 г. беременными. По размеру тела и особенностям окраски всего несколько китов были определены как подростки. Метод определения возраста без проведения измерений является неточным, поэтому количество молодых животных следует считать приблизительным. Лишь один кит (17RUCO1888) в 2018 г. был точно определен как подросток, так как в 2017 г. он был встречен детенышем в сопровождении матери.
Пространственное распределение китов в разные годы
Места концентрации животных в 2017 и 2018 гг. существенно различались (рис. 1). В 2017 г. киты держались главным образом к юго-западу от о-ва Итыгран, а ближе к концу сезона постепенно переместились в б. Румилет. В 2018 г. они встречались в основном в б. Пенкегней в северной части пролива. Район концентрации китов в 2017 г. ежедневно обследовали по пути из лагеря к месту работ и в 2018 г., однако горбачи встречались там крайне редко.
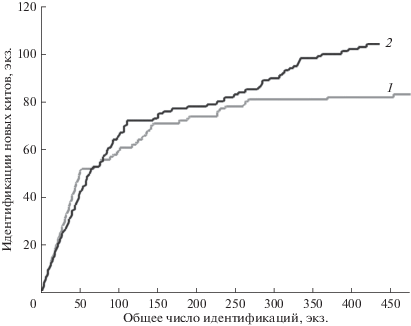
Динамика накопления идентификаций в течение сезона
Для оценки активности обновления состава скопления в течение сезона мы определили, насколько отличается скорость накопления идентификаций новых животных от скорости накопления всех идентификаций. За единицу прироста идентификаций взята одна идентификация каждого животного в один день. Новыми считались животные, впервые встреченные в данный сезон. Оказалось, что график скорости накопления новых особей в 2017 г. к концу сезона практически вышел на плато (рис. 2), т.е. встречались в основном уже знакомые киты. В 2018 г. накопление новых животных происходило в течение всего периода работы, но к концу сезона также наблюдали тенденцию к выходу графика на плато.
Численность
Расчет численности скопления китов с помощью модели CJS (Cormack-Jolly-Seber) для открытых популяций дал для каждого года исследований оценку, близкую к количеству идентифицированных животных. Верхний предел численности китов, определенный с помощью модели для закрытой популяции (Mh Chao), которая была выбрана на основании критерия Акаике (AIC), лишь немного отличается от этого значения. Для 2017 г. расчетная численность скопления составляла 84.0(±1.5) – 90(±6.4) особей, а для 2018 г. – 105(±3.7) – 109(±6.2) особей.
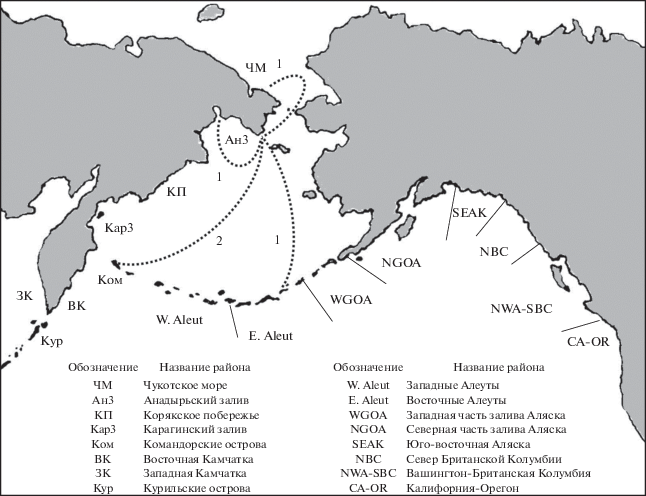
Повторные встречи китов в других нагульных районах и миграционные связи с местами размножения
Всего в сравнении участвовало 143 кита, идентифицированных в прол. Сенявина, и 10 808 особей, идентифицированных в других нагульных и репродуктивных районах северной части Тихого океана. Среди прочих нагульных районов повторные встречи были обнаружены в Чукотском море, Анадырском заливе, у Командорских и восточных Алеутских островов. В районе Командорских островов повторно были встречены две особи, во всех остальных районах – по одной (рис. 3). Среди четырех известных районов размножения горбатых китов мы обнаружили повторные встречи животных из прол. Сенявина только в водах Гавайских островов.
ОБСУЖДЕНИЕ
Прибрежная акватория Чукотского полуострова является труднодоступным и слабо изученным регионом. Из-за наблюдающегося в последние десятилетия изменения климата особый интерес представляет состояние динамично меняющихся арктических экосистем. Популяции горбатых китов, сильно пострадавшие от коммерческого китобойного промысла, в настоящее время активно восстанавливаются и постепенно занимают прежние районы обитания (Barlow et al., 2011). Однако, несмотря на общее восстановление численности животных, некоторые субпопуляции до сих пор остаются в статусе угрожаемых (Bettridge et al., 2015).
Особый гидрологический режим прол. Сенявина с относительно мягким микроклиматом и резкими перепадами глубин, по-видимому, создает благоприятные условия для формирования кормовой базы горбатых китов. Постоянное присутствие китов в прол. Сенявина из года в год и продолжительное в течение нагульного сезона может быть свидетельством обилия и доступности потенциальных кормовых объектов в этом районе. Около половины животных из встреченных в первый сезон были отмечены повторно в следующем году, в том числе несколько самок с детенышами. Это позволяет говорить о формировании устойчивой привязанности горбачей к данному району.
Примечательно резкое различие в распределении китов на изучаемой акватории в разные годы наблюдений. В 2017 г. большая часть встреч пришлась на участки с глубинами 50–80 м. В начале сентября животные активно кормились на мелководьях б. Румилет, где глубина не превышала 20 м. В 2018 г. все киты были встречены в расположенной к северу более глубоководной б. Пенкегней. Эти различия могут быть связаны с тем, что в разные годы киты использовали разные виды пищи. Поскольку детальное изучение объектов питания горбатых китов в прол. Сенявина не входило в задачи данного исследования, основанием для такого предположения послужили некоторые косвенные наблюдения. В 2017 г. мы нередко наблюдали, как группы кормящихся китов сопровождали скопления таких рыбоядных птиц, как моевка Rissa tridactyla и кайра Uria sp., а также видели, как птицы добывали рыбу из приповерхностного слоя воды в непосредственной близости от кормящихся горбачей. В 2018 г. сопровождения китов птицами практически не наблюдали, хотя именно в б. Пенкегней расположены крупные птичьи базары. В 2017 г. регулярно отмечали оживленную и массовую кормежку горбачей в течение дня, что характерно при питании активной в дневное время песчанкой Ammodytes hexapterus (см.: Hazen et al., 2009), а также может быть связано с дневным поднятием в толщу воды сайки Boreogadus saida (см.: Фадеев, 2005). В 2018 г. киты обычно отдыхали в светлое время суток и начинали кормиться с приближением сумерек, что может быть приурочено к вечерней вертикальной миграции планктонных ракообразных (Волков, Волвенко, 2016).
Накопление идентификаций, как правило, было наиболее активным в первые несколько дней работы, позже встречались преимущественно уже знакомые животные. В конце наблюдений 2017 г. новых китов практически не прибавилось. В 2018 г. интенсивность идентификации новых животных к концу сезона также снизилась. Эта динамика свидетельствует о том, что в акватории большинство особей уже зарегистрировано и активного подхода новых или транзитных китов не происходит, т.е. скопление в течение длительного периода наблюдений относительно стабильно.
Таблица 1.
Общее количество идентификаций и возрастной состав горбатых китов нагульного скопления в прол. Сенявина в 2017 и 2018 гг.
| Год | Продолжительность наблюдений | Дней с китами | Всего встреч, экз. | Повторные встречи между годами | Встречаемость, особь/сут | Ежедневные идентификации | Возрастные группы | |||
|---|---|---|---|---|---|---|---|---|---|---|
| макс. | ср. | дет. | подр. | взр. | ||||||
| 2017 | 16.08–06.09 | 19 | 83 | – | 4.37 | 52 | 25 | 2 | 4 | 77 |
| 2018 | 03.08–07.09 | 15 | 104 | 44 | 6.87 | 50 | 29 | 5 | 2 | 97 |
О стабильности состава скопления в период работы говорит и то, что расчетная численность оказалась близка к числу китов, идентифицированных в соответствующий год исследований. До настоящего момента численность горбачей в водах Дальнего Востока России была оценена лишь однажды более 10 лет назад в ходе работы по проекту SPLASH. Она составила приблизительно 100–200 особей во всех районах. В настоящее время получена численность около 100 животных только в одном из таких районов. Несколько более высокие значения при оценке численности в 2018 г. можно объяснить как естественным приростом популяции китов, так и приходом животных из других акваторий.
Несмотря на привязанность горбатых китов к конкретному нагульному району, отдельные животные могут ежегодно перемещаться в другие преимущественно соседние районы (Calambokidis et al., 2008). Как было показано в зал. Мэн, это тесно связано с изменением численности объектов питания (Weinrich et al., 1997). Однако существуют и условные границы для таких перемещений, отграничивающие нагульные районы разных субпопуляций (Calambokidis et al., 1996). Мы наблюдали повторные встречи китов, идентифицированных в прол. Сенявина, как в соседних (Чукотское море, Анадырский залив), так и в достаточно удаленных районах (Командорские и восточные Алеутские острова). В предыдущих исследованиях показано перемещение отдельных животных и среди других районов нагула (Титова и др., 2018). Следовательно, обмен в той или иной мере происходит между всеми нагульными районами дальневосточных морей России. Однако между горбачами, приходящими для нагула в Карагинский залив и на Командорские острова, существуют достоверные генетические различия (Richard et al., 2018), что говорит о сложном характере распределения этих китов.
Результаты нашего исследования подтверждают предположение о том, что на Чукотке нагуливается преимущественно гавайская субпопуляция горбатых китов, ранее известная как американское стадо. Интересно, что в этом районе, в отличие от Анадырского залива, не было обнаружено китов из мексиканской и окинаво-филиппинской субпопуляций, несмотря на сравнимые объемы изученных материалов.
Список литературы
Волков А.Ф., Волвенко И.В. Сетной зоопланктон западной части Берингова моря: таблицы встречаемости, численности и биомассы. 1986–2013. Владивосток: ТИНРО-центр. 2016. 1153 с.
Бурдин А.М., Кринова Л.С., Чукмасов П.В. Нагульные скопления горбатых китов в заливе Креста (Анадырский залив, Чукотка) в августе 2017 г. // Сохранение биоразнообразия Камчатки и прилегающих морей. Материалы ХVIII международ. науч. конф. Петропавловск-Камчатский, 15–16 ноября 2017 г. С. 402–404.
Купецкий В.Н. Ландшафты морей // Природа и ресурсы Чукотки. Вып. 5. Магадан: СВНЦ ДВО РАН. 1996. С. 41–47.
Мельников В.В. Китообразные (Cetacea) тихоокеанского сектора Арктики: история промысла, современное распределение, миграции, численность. Владивосток: Дальнаука. 2014. 396 с.
Титова О.В., Филатова О.А., Федутин И.Д. и др. Перемещения горбатых китов между нагульными скоплениями дальневосточных морей и их миграционные связи с местами размножения // Морские млекопитающие Голарктики: Тез. докл. 10-й международ. конф. 2018. Архангельск, Россия. 29 октября–02 ноября 2018 г. С. 99–100.
Томилин А.Г. Киты Дальнего Востока // Уч. зап. МГУ. 1937. Т. 18. С. 119–167.
Фадеев Н.С. Справочник по биологии и промыслу рыб северной части Тихого океана. Владивосток: ТИНРО-центр. 2005. 366 с.
Baker C.S., Steel D., Calambokidis J. et al. Strong maternal fidelity and natal philopatry shape genetic structure in North Pacific humpback whales // Mar. Ecol.: Prog. Ser. 2013. V. 494. P. 291–306.
Barlow J., Calambokidis J., Falcone E.A. et al. Humpback whale abundance in the North Pacific estimated by photographic capture-recapture with bias correction from simulation studies // Mar. Mammal Sci. 2011. V. 27. № 4. P. 793–818.
Berzin A.A., Vladimirov V.L. Changes in the abundance of whalebone whales in the Pacific and the Antarctic since the cessation of their exploitation // Rep. Int. Whaling Comm. 1981. V. 31. P. 495–499.
Bettridge S., Baker C., Barlow J. et al. Status review of the humpback whale (Megaptera novaeangliae) under the Endangered Species Act // NOAA Technical Memorandum NMFS, NOAA-TM-NMFS-SWFSC-540. Washington, DC: U.S. Dep. of Commerce. 2015. 240 p.
Blackmer A.L., Anderson S.K., Weinrich M.T. Temporal variability in features used to photo-identify humpback whales (Megaptera novaeangliae) // Mar. Mammal Sci. 2000. V. 16. № 2. P. 338–354
Calambokidis J., Steiger G.H., Evenson J.R. et al. Interchange and isolation of humpback whales off California and other North Pacific feeding grounds // Mar. Mammal Sci. 1996. V. 12. № 2. P. 215–226.
Calambokidis J., Barlow J. Abundance of blue and humpback whales in the eastern North Pacific estimated by capture-recapture and line-transect methods // Mar. Mammal Sci. 2004. V. 20. № 1. P. 63–85.
Calambokidis J., Falcone E.A., Quinn T.J. et al. SPLASH: Structure of Populations, Levels of Abundance and Status of Humpback Whales in the North Pacific // Final report for Contract AB133F-03-RP-00078 prepared by Cascadia Research for U.S. Dept of Commerce. Olympia, Wash.: Cascadia Research. 2008. 57 p.
Cormack R.M. Log-linear models for capture-recapture // Biometrics. 1989. V. 45. P. 395–413.
Gabriele C.M., Straley J.M., Mizroch S.A. et al. Estimating the mortality rate of humpback whale calves in the central North Pacific Ocean // Can. J. Zool. 2001. V. 79. № 4. P. 589–600.
Hammond P.S. Estimating the size of naturally marked whale populations using capture-recapture techniques // Rep. Int. Whaling Comm. 1986. V. 8 (Special Issue). P. 253–282.
Hazen E.L., Friedlaender A.S., Thompson M.A. et al. Fine-scale prey aggregations and foraging ecology of humpback whales (Megaptera novaeangliae) // Mar. Ecol.: Prog. Ser. 2009. V. 395. P. 75–89.
Katona S.K., Whitehead H.P. Identifying humpback whales using their natural markings // Polar Rec. 1981. V. 20. P. 439–444.
R Development Core Team. R: A Language and Environment for Statistical Computing. Vienna, Austria: R Found. for Statistical Computing. 2011. www.R-project.org:
Richard G., Titova O.V., Fedutin I.D. et al. Cultural transmission of fine-scale fidelity to feeding sites may shape humpback whale genetic diversity in Russian Pacific waters // J. Hered. 2018. V. 109. № 7. P. 724–734.
Titova O.V., Filatova O.A., Fedutin I.D. et al. Photo-identification matches of humpback whales (Megaptera novaeangliae) from feeding areas in Russian Far East seas and breeding grounds in the North Pacific // Mar. Mammal Sci. 2018. V. 34. № 1. P. 100–112.
Weinrich M., Martin M., Griffiths R. et al. A shift in distribution of humpback whales, Megaptera novaeangliae, in response to prey in the southern Gulf of Maine // Fish. Bull. 1997. V. 95. № 4. P. 826–836.
Дополнительные материалы отсутствуют.