Биология моря, 2021, T. 47, № 1, стр. 45-53
Пространственное распределение, рост и размножение двустворчатого моллюска Macoma calcarea (Gmelin, 1791) у берегов Новой Земли
А. Э. Носкович *
Мурманский морской биологический институт КНЦ РАН
183010 Мурманск, Россия
* E-mail: alyona.nosckovitch@yandex.ru
Поступила в редакцию 20.11.2019
После доработки 30.03.2020
Принята к публикации 06.06.2020
Аннотация
Рассмотрены популяционно-биологические характеристики двустворчатого моллюска Macoma calcarea (Gmelin, 1791) в восточной части Баренцева моря у берегов архипелага Новая Земля. В районе исследования биомасса макомы изменялась от 3.9 до 350.6 г/м2, плотность поселения варьировала от 13.3 до 196.6 экз/м2. Показано, что биомасса и плотность поселения моллюсков не зависели от глубины и придонной температуры воды, а размерный состав и темпы роста были сходны на разных глубинах. Отмечено существенное различие продолжительности жизни макомы на глубинах до 100 м (17 лет) и глубже (26 лет). На глубинах менее 100 м основу поселений этого вида составляли молодые особи (до 4 мм); на станциях с большими глубинами были многочисленны как молодь, так и моллюски с длиной раковины около 14.9 мм. Установлено, что половозрелыми особи M. calcarea становятся в возрасте 3–4 года при длине раковины более 7.5 мм. На глубоководных станциях половозрелых моллюсков было значительно больше, чем неполовозрелых, а самцов больше, чем самок. У исследованных самок выделены три стадии гаметогенеза. Размер готовых к вымету ооцитов составлял 175 мкм.
Двустворчатый моллюск Macoma calcarea (Gmelin, 1791) – бореально-арктический вид, широко распространенный во всех морях Арктики и Атлантического океана, а также в Тихом океане (Наумов, 2006). Моллюск обитает на разных глубинах и предпочитает илистые, алевритовые и песчаные грунты прибрежных мелководий (Rasmussen, 1973; Федяков, 1986). В некоторых донных биоценозах макома доминирует по биомассе (около 1000 г/м2) и на мягких грунтах образует поселения с высокой плотностью – более 500 экз/м2 (Дерюгин, 1928; Антипова, 1979; Бабков, Голиков, 1984; Федяков, 1986). Необычное обилие M. calcarea – более 6000 экз/м2 и до 4000 г/м2 – отмечено в Чукотском море (Сиренко, Гагаев, 2007). По типу питания макома является собирающим детритофагом, но способна переходить и к сестонофагии (Rasmussen, 1973). По отношению к температуре M. calcarea можно отнести к стенотермным умеренно тепловодным гидробионтам (Наумов, 2006). Известно, что этот вид относится к раздельнополым и расселяется при помощи пелагической планктотрофной личинки (Oertzen, 1972). Макома способна переносить сильные колебания солености воды и существенные, вплоть до отрицательных, колебания температуры. Отмечено, что при низкой солености размеры раковины особей M. calcarea небольшие (Цыганкова, Гусев, 2006).
В восточном прибрежье Новой Земли обнаружены обширные поселения M. calcarea (Броцкая, Зенкевич, 1939; Антипова, Нейман, 1983; Денисенко и др., 1995), но сведения о биологии и экологии данного моллюска в этом районе отсутствуют, за исключением информации о плотности поселения и биомассе.
Цели настоящего исследования – изучить особенности биологии двустворчатого моллюска M. calcarea в зоне влияния охлажденных новоземельских прибрежных вод у архипелага Новая Земля (Баренцево море), а также оценить влияние условий обитания на популяционные и биологические показатели вида.
МАТЕРИАЛ И МЕТОДИКА
Материал, использованный в работе, был собран сотрудниками Мурманского морского биологического института КНЦ РАН на 14 станциях в двух морских экспедициях НИС “Дальние Зеленцы” в августе–сентябре 2006 и 2007 гг. в восточную часть Баренцева моря к побережью архипелага Новая Земля (рис. 1). Особей Macoma calcarea вместе с другими представителями макрозообентоса собирали с помощью дночерпателя Ван-Вина с площадью захвата 0.1 м2 в трехкратной повторности. При отборе проб учитывали дрейф судна. Пробы промывали через сито с размером ячеи 0.7 мм и фиксировали 4% раствором формалина; после сортировки пробы переводили в 75% раствор этилового спирта. В 2017 г. из проб отобрали маком для дальнейшей обработки.
Рис. 1.
Карта-схема мест отбора проб и показатели обилия Macoma calcarea в прибрежных водах архипелага Новая Земля. а – биомасса, б – плотность поселения; 22–61 – номера станций.

Анализ факторов среды в районе работ включал результаты океанографического зондирования температуры и солености в придонном слое воды. О гранулометрическом составе донных отложений судили по схеме распределения донных осадков в Баренцевом море (Кленова, 1960; Павлидис, 1995). Популяционно-биологические характеристики M. calcarea (биомасса и плотность поселения) были определены для всех станций (табл. 1).
Таблица 1.
Характеристика станций, объем проанализированного материала и показатели обилия двустворчатого моллюска Macoma calcarea в районе архипелага Новая Земля
| № станции | Характеристика станций | n, экз. | В ± m, г/м2 | N ± m, экз/м2 | |||
|---|---|---|---|---|---|---|---|
| T, °C | S, ‰ | h, м | Грунт | ||||
| 2006 г. | |||||||
| 19* | −0.4 | 34.7 | 60.0 | Средний и крупный песок | 29 | 101.1 ± 0.7 | 103.3 ± 3.7 |
| 20 | 0.5 | 34.8 | 161.0 | Ил, глина, галька, щебень | 49 | 18.8 ± 0.2 | 163.3 ± 3.9 |
| 21 | 0.2 | 34.8 | 134.0 | То же | 16 | 14.0 ± 1.0 | 53.3 ± 2.9 |
| 22 | −1.8 | 35.2 | 197.0 | То же | 12 | 3.9 ± 0.6 | 40.0 ± 4.0 |
| 23* | −1.5 | 34.9 | 154.0 | Ил, глина, щебень | 24 | 350.6 ± 3.9 | 116.6 ± 2.3 |
| 24* | –0.7 | 34.8 | 149.0 | Ил, глина | 38 | 56.3 ± 0.7 | 130.0 ± 1.1 |
| 25 | −1.1 | 34.9 | 106.0 | Глина, щебень, песок, гравий | 4 | 59.7 ± 0.8 | 13.3 ± 0.1 |
| 26 | 0.05 | 34.9 | 80.0 | Галька, гравий, илистый песок | 7 | 111.5 ± 5.4 | 23.3 ± 1.3 |
| 2007 г. | |||||||
| 54* | 0.7 | 34.8 | 165.0 | Ил, мелкие камни, глина | 17 | 15.3 ± 0.17 | 63.3 ± 3.5 |
| 55* | 0.8 | 34.8 | 159.0 | Ил, мелкие камни, песок, глина, ракуша | 42 | 321.9 ± 5.22 | 140.0 ± 4.04 |
| 56* | −1.3 | 34.8 | 203.0 | Ил, мелкие камни, песок, ракуша | 59 | 71.1 ± 0.39 | 196.6 ± 4.04 |
| 57* | 1.2 | 34.9 | 130.0 | Песчано-илистый, камни, валуны, ракуша | 8 | 6.2 ± 0.31 | 26.6 ± 0.6 |
| 59* | 0.6 | 34.6 | 65.0 | Песчано-илистый, мелкие камни, ракуша | 31 | 17.1 ± 1.59 | 103.3 ± 1.2 |
| 61* | 1.3 | 34.8 | 79.0 | Песчано-илистый, ракуша | 8 | 4.0 ± 0.15 | 26.6 ± 0.1 |
На девяти станциях (табл. 1) проведен анализ размерно-возрастных характеристик и соотношения полов, определена степень зрелости гонад самок. Всего изучено 256 моллюсков. У всех особей измеряли длину раковины: у крупных экземпляров – штангенциркулем с точностью до 0.1 мм, у мелких – с помощью окулярной линейки бинокулярного микроскопа “Motic”. Возраст моллюсков оценивали, используя несколько взаимодополняющих методов. Наиболее часто подсчитывали кольца зимней остановки роста на наружной поверхности раковины. Этот подход широко распространен при изучении двустворчатых моллюсков, в том числе M. calcarea (см.: Золотарев, 1989; Методы… 1990; Лисицына и др., 2017; Gerasimova et al., 2019), хотя имеет замечания со стороны специалистов (Petersen, 1978). Поэтому у моллюсков крупнее 20 мм возраст оценивали еще и по внутренним меткам роста на радиальном спиле раковины, а для дополнительного контроля у 72 особей анализировали метки на спиле в области замка раковины.
Возрастные изменения длины тела оценивали по конечному размеру группы разновозрастных особей, а ежегодный прирост – по разнице смежных величин конечной длины раковины в последовательном ряду возрастов (Методы…, 1990).
Пол и стадии гаметогенеза моллюсков определяли под микроскопом “Микмед-1” по числу, строению и размерам половых клеток в гонадах. Диаметр ооцитов измеряли с помощью окулярной линейки. Если при вскрытии моллюска гонады отсутствовали, считали, что данный моллюск неполовозрелый. Стадии зрелости гонад анализировали только у самок. Основные этапы гаметогенеза оценивали по Чипперфильду (Chipperfield, 1953): I стадия – начало гаметогенеза (на препарате различимы мелкие ооциты); II стадия – активный гаметогенез (преобладают крупные прикрепленные ооциты); III стадия – преднерестовая (многочисленные крупные свободнолежащие ооциты, готовые к вымету); IV стадия – нерестовая (редкие невыметанные зрелые гаметы); 0 стадия – посленерестовая (половые клетки на препаратах гонад не видны).
Для сравнения выборок по показателям обилия, размерному составу и продолжительности жизни моллюсков использовали непараметрический критерий Манна–Уитни (уровень значимости p ≤ 0.05) (Ивантер, Коросов, 2003). Соответствие соотношения половозрелых и неполовозрелых особей, а также соотношения полов равномерному распределению 1 : 1 проверяли на основе критерия χ2 Пирсона (Закс, 1976; Ивантер, Коросов, 2003). Все станции отбора проб условно были разделены на две группы в зависимости от глубины; сравнивали выборки моллюсков, отобранные на глубине менее 100 м (мелководные) и более 100 м (глубоководные). Статистическая обработка данных выполнена с помощью программ MS Excel и Statistica 6.0; для картографического изображения участков сбора проб и распределения показателей обилия использовали программу Map Viewer 8.
РЕЗУЛЬТАТЫ
Пространственное распределение и обилие
В прибрежье архипелага Новая Земля биомасса и плотность поселения Macoma calcarea были распределены неравномерно (рис. 1). В целом биомасса макомы в пределах исследованного района варьировала от 3.9 до 350.6 г/м2. Максимальные значения отмечены на двух соседних станциях на глубинах 154 и 159 м, минимальные – на удаленных друг от друга станциях на глубинах 79 и 197 м. Плотность поселения макомы варьировала от 13.3 до 196.6 экз/м2. Максимальные значения (при низкой биомассе) отмечены на наибольшей глубине 203 м, а минимальные – на глубине 106 м. Различий между показателями обилия для двух групп моллюсков, отобранных на разной глубине, не выявлено: критерий Манна–Уитни для плотности поселения Uэмп = 8.5, для биомассы Uэмп = 10; p ≤ 0.05. Не выявлено связи между биомассой (плотностью поселения) и придонной температурой воды (коэффициент корреляции равен 0.051 и 0.035 соответственно) (рис. 2).
Размерный и возрастной состав
У берегов Новой Земли встречались особи M. calcarea с длиной раковины от 1 до 39.2 мм (рис. 3а). На глубинах менее 100 м поселения в основном были представлены моллюсками размером от 1 до 4 мм; отмечена особь с длиной раковины 32.9 мм. На глубинах более 100 м обнаружены мелкие (молодые) особи размером до 4 мм, моллюски с длиной раковины от 10.4 до 19.4 мм, а также несколько особей с максимальными размерами раковины 38.6–39.2 мм (рис. 3а). Различия в размерном составе моллюсков на разных глубинах статистически незначимы (критерий Манна–Уитни Uэмп = 58; Uэмп > Uкр; p ≤ 0.05).
Рис. 3.
Размерный (а) и возрастной (б) состав поселения Macoma calcarea на разных глубинах. Цифра над столбиками – количество моллюсков в размерном классе, экз.; вертикальные линии – ошибка среднего значения.
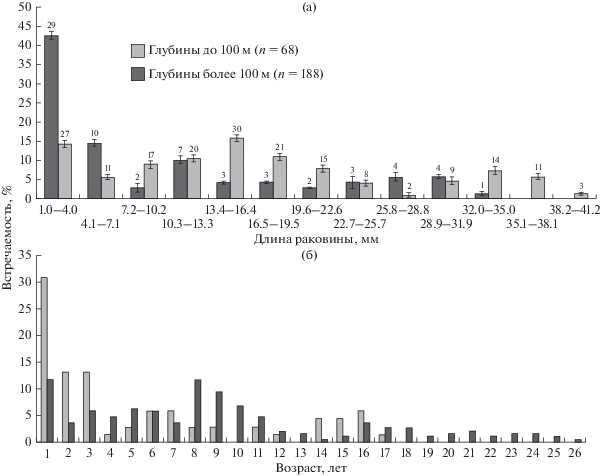
На глубинах менее 100 м максимальная продолжительность жизни M. calcarea составила 17 лет. Основная часть поселений (30%) была представлена годовиками (рис. 3б). Возраст моллюсков, обитавших глубже 100 м, достигал 26 лет. В поселении также преобладали годовики (11%) и моллюски в возрасте 8 (11%) – 9 лет (9%). Сравнение показало значимое различие возрастного состава (Uэмп = 128; Uэмп < Uкр; p ≤ 0.05).
Рост
В течение жизни моллюски росли неравномерно. Длина раковины моллюска в возрасте от 1 года до 4 лет (6.1 ± 1.3 мм) с глубины более 100 м в среднем была несколько больше, чем с глубины менее 100 м (5.8 ± 1.4 мм) (рис. 4а). Для моллюсков старше 5 лет характерна обратная картина (21.4 ± 1.6 и 20.5 ± 1.7 мм соответственно). Моллюски, собранные на станциях с глубинами до 100 м, наиболее интенсивно росли в течение довольно длительного периода – с первого года жизни и до 10 лет (средний прирост составлял 2.0 ± 0.2 мм/год). Затем темпы роста снижались и в среднем составляли 1.0 ± 0.3 мм/год (рис. 4б). У моллюсков, собранных на глубинах более 100 м, резкого сокращения темпов роста не отмечено. Наиболее интенсивно моллюски росли в течение первых трех лет жизни (2.0 ± 0.1 мм/год), затем темпы роста постепенно снижались, в среднем до 1.2 ± 0.3 мм/год. Небольшие колебания темпов роста отмечены в возрасте 9–12 лет (1.7 ± 0.05 мм/год) (рис. 4б).
Половой и репродуктивный состав
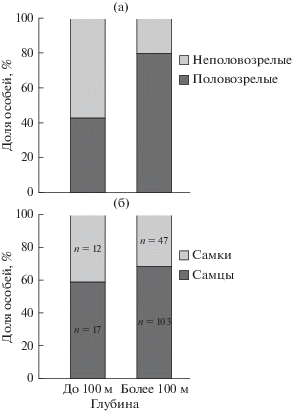
На глубинах менее 100 м большая часть поселения (57%) была представлена неполовозрелыми особями (средняя длина раковины 2.9 ± 0.2 мм) (рис. 5а), однако это преобладание не было значимым (критерий χ2 = 1.0; $\chi _{{0.05}}^{2}$ = 3.8; χ2 ≥ $\chi _{{0.05}}^{2}$). Среди половозрелых моллюсков на долю самцов приходилось 58% (длина раковины 18.8 ± 1.9 мм), на долю самок – 42% (длина раковины 21.2 ± 2.0 мм) (рис. 5б). Возраст самых мелких половозрелых моллюсков составлял 3–4 года; длина раковины составляла 7.5 мм (самцы) и 7.8 мм (самки). На глубоководных станциях значимо преобладали половозрелые особи (79%) (критерий χ2 = 23.7; $\chi _{{0.01}}^{2}$ = 6.6; χ2 ≥ $\chi _{{0.01}}^{2}$) (рис. 5а), среди которых самцов было больше (68%), чем самок (рис. 5б). Длина раковины самцов в среднем составляла 19.2 ± 0.8 мм, самок – 22.5 ± 1.2 мм.
Рис. 5.
Соотношение половозрелых и неполовозрелых особей (а), а также соотношение полов (б) у Macoma calcarea в поселениях на разной глубине.
Гонады были исследованы у 59 самок. У 15–20% самок (длина раковины 10.6 ± 0.6 мм) гонады находились в начале гаметогенеза; диаметр ооцитов в среднем составлял около 50 мкм. У большинства самок (длина раковины 20.7 ± 0.6 мм) в гонадах наблюдался активный гаметогенез, диаметр ооцитов в среднем составлял около 125 мкм. Доля самок (длина раковины 34.2 ± 0.7 мм) с гонадами в преднерестовой стадии, заполненными готовыми к вымету ооцитами диаметром около 175 мкм, достигала 20–25%.
ОБСУЖДЕНИЕ
У побережья архипелага Новая Земля гидрологические условия более стабильны, чем в южных районах Баренцева моря, температурные условия суровее, а диапазон сезонных колебаний факторов среды меньше. Самая низкая температура в августе составляла –1.8°С, а в сентябре –1.3°С. Относительно низкие значения температуры обусловлены поступлением вод из Карского моря. Холодные и опресненные воды Карского моря проходят вдоль юго-западного берега о-ва Южный архипелага Новая Земля и двигаются в северном направлении. Примерно на широте прол. Маточкин Шар они частично смешиваются с водами Новоземельского прибрежного течения, что приводит к повышению солености. В южных новоземельских проливах перенос вод осуществляется в обоих направлениях. Однако сток вод из Баренцева моря превышает их поступление из Карского моря (Ожигин и др., 2016). Придонная температура воды в течение года изменяется от 2 до –2°С, а показатели солености варьируют от 33.0 до 34.9‰ (Ожигин и др., 2016). На юге Баренцева моря в течение года диапазон изменения придонной температуры воды шире – от 2 до 10°С (Ожигин и др., 2016). Отмечено, что в августе температура воды у дна здесь варьировала от 7 до 13°С (Носкович, Павлова, 2017). В Белом море Macoma calcarea встречается на глубинах от 1 до 249 м при температуре от –1.5 до 14.4°С и солености от 22.0 до 29.3‰ (Наумов, 2006). В Карском море этот вид обнаружен на глубинах от 4 до 190 м при температуре от –1.6 до 6.4°C и при солености 30.6–33.8‰ (Лисицына, Герасимова, 2019).
У берегов Новой Земли M. calcarea формирует неоднородные по численности и биомассе поселения, при этом зависимости между показателями обилия моллюсков, глубиной их обитания и придонной температурой не обнаружено. По данным Полярного научно-исследовательского института морского рыбного хозяйства и океанографии, в 2003–2006 гг. в районе Новоземельского мелководья и в Южно-Новоземельском желобе существовали обширные поселения M. calcarea с плотностью поселения 105.3 ± 8.2 экз/м2 и биомассой 377.2 ± 63.3 г/м2 (Захаров и др., 2018). Известно, что в этом районе области с доминированием M. calcarea совпадают с местами обитания краба-стригуна Chionoecetes opilio, для которого молодь макомы служит основным пищевым объектом (Захаров и др., 2018). В более глубоководных районах обитания основу кормовой базы взрослых крабов составляют полихеты. По-видимому, выедание двустворчатого моллюска M. calcarea крабом-стригуном опилио привело к таким неравнозначным показателям обилия макомы у берегов Новой Земли. Не исключено, что локальные различия показателей обилия макомы отражают особенности многолетних колебаний донной фауны, характерных для северных морей (Petersen, 1978; Gerasimova et al., 2019).
Известно, что на размеры моллюска влияют соленость, глубина, температура воды и грунт (Rasmussen, 1973), а также содержание растворенного кислорода. Большое количество молоди M. calcarea в поселении на глубинах менее 100 м в прибрежье Новой Земли свидетельствует о благоприятных экологических условиях для размножения этого вида моллюска, а максимальные размеры раковины по сравнению с таковыми в других районах обитания позволяют предположить, что условия обитания здесь благоприятны и для последующего периода жизни M. calcarea. Наши данные соответствуют опубликованным данным (Petersen, 1978), полученным для вод Гренландии, где размеры макомы достигали почти 38 мм. В Карском море максимальная длина раковины макомы составляла 36–37 мм (Лисицына, Герасимова, 2019), в Печорском море – 30 мм (Gerasimova et al., 2019), в Белом море максимальные размеры раковины не превышали 24–29 мм (Лисицына и др., 2017). По-видимому, суровые, но относительно стабильные в течение года температурные и соленостные условия обитания, а также другие факторы позволяют M. calcarea в прибрежье архипелага Новая Земля достигать крупных размеров и значительной продолжительности жизни.
Сведений о линейном росте M. calcarea в других районах обитания мало. Следует отметить, что темпы роста этого вида в прибрежье Новой Земли в первые годы жизни не отличаются от таковых M. calcarea из вод западной Гренландии (ежегодный прирост 1.2–2.0 мм/год; см.: Petersen, 1978), но в 1.5 раза ниже, чем в южной части Баренцева моря (Носкович, 2018), и в 1.5–2 раза ниже, чем у беломорских маком (Лисицына и др., 2017). Моллюски из Печорского моря на ранних стадиях развития характеризуются низкой скоростью роста (Gerasimova et al., 2019).
У берегов Новой Земли продолжительность жизни M. calcarea сравнительно высокая. В более тепловодных районах обитания этот показатель ниже. Например, в юго-восточной части Балтийского моря встречались макомы в возрасте от 2 до 6 лет, а в южной части – до 14 лет (Юргенс, 2006). В Баренцевом и Карском морях отмечены моллюски в возрасте 15 лет (Антипова, Нейман, 1983; Золотарев, 1989), в южной части Баренцева моря и в Печорском море – до 10–13 лет (Носкович, 2018). По другим данным продолжительность жизни M. calcarea в Печорском море может достигать 15 лет (Gerasimova et al., 2019). В Карском море обнаружены макомы, возраст которых составлял 18–20 лет (Лисицына, Герасимова, 2019). В водах западной Гренландии продолжительность жизни M. calcarea оценена в 17 лет (Petersen, 1978).
Известно, что у побережья западной Гренландии M. calcarea достигает половой зрелости при длине раковины 9 мм (Petersen, 1978), а на юге Баренцева моря – 5 мм (Носкович, Павлова, 2017). Согласно нашим данным, у побережья Новой Земли макомы имели развитую гонаду при длине раковины около 7.5 мм.
На станциях с глубинами менее 100 м соотношение самцов и самок было одинаковым; в поселениях на глубинах более 100 м наблюдалось явное преобладание самцов. Такое соотношение полов может быть вызвано как генетическими, так и экологическими факторами, определяющими формирование пола или дифференцированную выживаемость самок и самцов (Одум, 1986). В водах западной Гренландии соотношение полов M. calcarea составляло 1 : 1 (Petersen, 1978). Известно, что у некоторых видов двустворчатых моллюсков наблюдается явление протандрии, когда у ювенильных особей сначала формируются мужские гонады (Coe, 1943). У исландского гребешка Chlamys islandica, обитающего у восточного Мурмана, в 3–5 лет доля самцов в популяции выше доли самок. По мере роста соотношение между полами выравнивается, но среди моллюсков старше восьми лет вновь наблюдается тенденция к преобладанию самцов (Ржавский и др., 2010). У черноморской мидии Mytilus galloprovincialis соотношение полов также может изменяться в сторону преобладания самцов; высказано предположение, что это связано с инверсией пола у самок, происходящей под воздействием загрязняющих веществ (Челядина и др., 2016). У беломорской мидии Mytilus edulis L. соотношение полов в поселении практически одинаковое (Касьянов, 1989).
Согласно нашим данным, в гонадах M. calcarea размеры ооцитов, готовых к вымету (175 мкм), заметно больше, чем размеры зрелых яйцеклеток (95 мкм), указанные для моллюсков этого же вида из прибрежья Гренландии и западной части Балтийского моря (Ockelmann, 1958; Oertzen, 1972), но гораздо мельче размеров яйцеклеток (200 мкм) особей из Белого моря (Наумов, 2006).
Несмотря на ограниченный период сбора материала, результаты наших исследований позволяют предположить, что нерест M. calcarea в районе Новой Земли может проходить в осенние месяцы при температуре воды около 1.5°С. Известно, что в Балтийском море личинки макомы оседают в зимние и весенние месяцы (Oertzen, 1972). В водах Гренландии в периоды с очень низкой температурой воды (–1.7°С) моллюски размножаются не каждый год, а личинки не оседают, однако при наступлении благоприятных температурных условий возможны две волны нереста: в марте–апреле и июле–августе (Ockelmann, 1958).
Таким образом, неоднородность условий среды обитания в районе архипелага Новая Земля сказывается на абсолютной величине популяционно-биологических характеристик M. calcarea. В частности, с увеличением глубины обитания увеличивается продолжительность жизни макомы, несколько изменяются характер линейного роста и соотношение полов. Однако биомасса и численность макомы не зависят от придонной температуры воды, а размерный состав населения и темпы роста моллюсков в исследованном диапазоне глубин значимо не различаются. В прибрежье архипелага возрастные и размерные классы M. calcarea представлены в широком диапазоне, без дискретности; для популяции этого вида в целом характерно высокое содержание молоди, что говорит о благоприятных экологических условиях для размножения, роста и жизнедеятельности моллюска.
Список литературы
Антипова Т.В. Распределение, экология, рост и продукция двустворчатых моллюсков Баренцева и Карского морей: Автореф. дис. … канд. биол. наук. Москва. 1979. 18 с.
Антипова Т.В., Нейман А.А. Распределение возрастных групп некоторых видов двустворчатых моллюсков в юго-восточной части Баренцева и в Карском море // Моллюски. Систематика, экология и закономерности распространения / Всесоюз. совещ. по изучению моллюсков: Автореф. докл. Л.: Наука. 1983. С. 168–171.
Бабков А.И., Голиков А.Н. Гидробиокомплексы Белого моря. Л.: Зоол. ин-т РАН. 1984. 104 с.
Броцкая В.А., Зенкевич Л.А. Количественный учет донной фауны Баренцева моря // Тр. ВНИРО. 1939. Т. 4. С. 5–126.
Денисенко С.Г., Луппова Е.Н., Денисенко Н.В. и др. Количественное распределение бентоса и структура донных сообществ на Приновоземельском шельфе Баренцева моря // Среда обитания и экосистемы Новой Земли. Архипелаг и шельф. Апатиты: Изд. КНЦ РАН. 1995. С. 66–79.
Дерюгин К.М. Фауна Белого моря и условия ее существования // Исслед. морей СССР. Л.: Гос. гидрол. ин-т. 1928. № 7–8. 510 с.
Закс Л. Статистическое оценивание. М.: Статистика. 1976. 600 с.
Захаров Д.В., Манушин И.Е., Стрелкова Н.А. и др. Характеристика кормовой базы и питание краба-стригуна опилио в Баренцевом море // Тр. ВНИРО. 2018. Т. 172. С. 70–90.
Золотарев В.Н. Склерохронология морских двустворчатых моллюсков. Киев: Наукова думка. 1989. 112 с.
Ивантер Э.В., Коросов А.В. Введение в количественную биологию: учеб. пособ. Петрозаводск: ПетрГУ. 2003. 304 с.
Касьянов В.Л. Репродуктивная стратегия морских двустворчатых моллюсков и иглокожих. Л.: Наука. 1989. 181 с.
Кленова М.В. Геология Баренцева моря. Л.: Изд. АН СССР. 1960. 376 с.
Лисицына К.Н., Герасимова А.В., Максимович Н.В. Демэкологические исследования Macoma calcarea (Gmelin) в Белом море // XIII Всерос. конф. с международным участием “Изучение, рациональное использование и охрана природных ресурсов Белого моря”. Сб. материалов. СПб. 2017. С. 123–126.
Лисицына К.Н., Герасимова А.В. Рост и распределение Macoma calcarea (Gmelin) в Карском море // Тр. VII Международ. науч.-практ. конф. “Морские исследования и образование (MARESEDU-2018)”: в 4-х т. Тверь: ООО “ПолиПРЕСС”. 2019. Т. III. С. 418–421.
Методы изучения двустворчатых моллюсков // Тр. Зоол. ин-та АН СССР / Под ред. Г.Л. Шкорбатова, Я.И. Старобогатова. Л.: АН СССР. 1990. Т. 219. 208 с.
Наумов А.Д. Двустворчатые моллюски Белого моря. Опыт эколого-фаунистического анализа. СПб.: Зоол. ин-т РАН. 2006. 367 с.
Носкович А.Э. Изменчивость скорости роста двустворчатого моллюска Macoma calcarea (Bivalvia, Tellinidae) в разных районах Баренцева моря // Современные эколого-биологические и химические исследования, техника и технология производств. Мурманск: Изд-во МГТУ. 2018. С. 372–378.
Носкович А.Э., Павлова Л.В. Репродуктивные особенности популяций двустворчатого моллюска Macoma calcarea (Bivalvia, Tellinidae) в Баренцевом и Печорском морях // Вестн. МГТУ. 2017. Т. 20. № 2. С. 463–471.
Одум Ю. Экология: В 2-х т. М.: Мир. 1986. Т. 2. 376 с.
Ожигин В.К., Ившин В.А., Трофимов А.Г. и др. Воды Баренцева моря: структура, циркуляция, изменчивость. Мурманск: ПИНРО. 2016. 260 с.
Павлидис М.А. Особенности распределения поверхностных осадков восточной части Баренцева моря // Океанология. 1995. Т. 34. № 4. С. 614–622.
Ржавский А.В., Буяновский А.И., Бритаев Т.А. Биология исландского гребешка Chlamys islandica (Bivalvia, Pectinidae) и пространственно-временная организация его поселений в губах восточного Мурмана // Успехи соврем. биол. 2010. Т. 130. № 1. С. 63–79.
Сиренко Б.И., Гагаев С.Ю. Необычное обилие макробентоса и тихоокеанские вселенцы в Чукотском море // Биол. моря. 2007. Т. 33. № 6. С. 399–407.
Федяков В.В. Закономерности распределения моллюсков Белого моря. Л.: Зоол. ин-т АН СССР. 1986. 127 с.
Цыганкова А.В., Гусев Е.А. Палеоэкологическая характеристика плейстоценовых двустворчатых моллюсков Енисейского залива. Современная палеонтология: классические и новейшие методы // Тез. докл. 3-й Всерос. науч. школы молодых ученых-палеонтологов. М. 2006. С. 72–75.
Челядина Н.С., Поспелова Н.В., Попов М.А. и др. Инверсия пола мидии Мytilus galloprovincialis Lam., культивируемой у берегов Крыма (Чёрное море) // Материалы Всерос. молодежной гидробиол. конф. “Перспективы и проблемы современной гидробиологии”, пос. Борок, 10–13 ноября 2016 г. Ярославль: Филигрань. 2016. С. 201–203.
Юргенс Е.М. Экологическая характеристика моллюска Macoma balthica (Linne, 1758) в южной части Балтийского моря: Автореф. дис. … канд. биол. наук. Калининград: Изд-во Рос. гос. ун-та им. И. Канта. 2006. 21 с.
Chipperfield P.W. Observation on the breeding and settlement of Mytilus edulis (L.) in the British waters // J. Mar. Biol. Assoc. U.K. 1953. V. 32. № 2. P. 449–476.
Coe W.R. Sexual differentiation in mollusks. I. Pelecypods // Q. Rev. Biol. 1943. V. 18. № 2. P. 154–164.
Gerasimova A.V., Filippova N.A., Lisitsyna K.N. et al. Distribution and growth of bivalve molluscs Serripes groenlandicus (Mohr) and Macoma calcarea (Gmelin) in the Pechora Sea // Polar Biol. 2019. V. 42. № 9. P. 1685–1702.
Ockelmann W.K. The zoology of East Greenland: Marine Lamellibranchiata // Medd. Groenl. 1958. V. 122. № 4. 256 p.
Oertzen J.-A. Cycles and rates of reproduction of six Baltic Sea bivalves of different zoogeographical origin // Mar. Biol. 1972. V. 14. P. 143–149.
Petersen G.H. Life cycles and population dynamics of marine benthic bivalves from the Disko Bugt area of West Greenland // Ophelia. 1978. V. 17. № 1. P. 95–120.
Rasmussen E. Systematics and ecology of the Isefjord marine fauna (Denmark) // Ophelia. 1973. V. 11. P. 5–495.
Дополнительные материалы отсутствуют.




