Биология моря, 2021, T. 47, № 2, стр. 108-114
Размножение и развитие солоноватоводных копепод при кормлении микроводорослями разных видов
Л. О. Аганесова *
Институт биологии южных морей им. А.О. Ковалевского РАН
299011 Севастополь, Россия
* E-mail: la7risa@gmail.com
Поступила в редакцию 30.07.2019
После доработки 28.01.2020
Принята к публикации 27.04.2020
Аннотация
В экспериментальных условиях определены продолжительность развития, выживаемость и репродуктивные характеристики копепод Calanipeda aquaedulcis (Krichagin, 1873) и Arctodiaptomus salinus (Daday, 1885) в зависимости от диеты из монокультур микроводорослей трех разных систематических групп. Наилучшие показатели выживаемости отмечены у копеподы C. aquaedulcis, питавшейся микроводорослью Prorocentrum cordatum (Ostenfeld) J.D. Dodge, 1975. У A. salinus выживаемость была максимальной при кормлении микроводорослью Isochrysis galbana Parke, 1949. Длительность онтогенеза C. aquaedulcis при любой из трех диет составила 14 сут. У A. salinus наименьшая продолжительность развития (18 сут) выявлена при кормлении Rhodomonas salina (Wislouch) Hill & Wetherbee, 1989. У самок C. aquaedulcis, питавшихся P. cordatum и I. galbana, отмечен 100% выклев науплиев, однако при питании Rh. salina выклев снижался до 86%. Установлено, что у самок C. aquaedulcis среднесуточная плодовитость за жизненный цикл в 2 раза выше, чем у A. salinus. Для самок A. salinus, получавших разное питание, установлены достоверные различия средней длины просомы и диаметра выметанных яиц; у C. aquaedulcis эти показатели не зависели от вида пищи.
Копеподы – основные кормовые организмы для личинок и планктоноядных взрослых рыб в естественных условиях (Poulet, Williams, 1991), а также перспективные объекты культивирования в качестве живого корма для личинок ценных морских рыб, выращиваемых в хозяйствах марикультуры (Støttrup et al., 1986; Семик, 1988; Marcus, 2005; Новоселова, Туркулова, 2008).
Распространенная в Европе, Азии и Северной Африке копепода Arctodiaptomus salinus (Daday, 1885) – галобионт, обитающий в солоноватоводных и соленых континентальных водоемах, населяющий в основном стоячие воды как малых горных бассейнов, так и больших соленых озер (Tolomeyev, 2002). Единственный вид рода Calanipeda aquaedulcis (Krichagin, 1873) относится к солоноватоводному комплексу, имеет морское происхождение и является промежуточной формой адаптации к пресным водам (Grindley, 1984). В минерализованных водах, например, Средиземноморского бассейна, он конкурирует с A. salinus (см.: Samchyshyna, 2008).
Широкий диапазон соленостной толерантности каляноидных копепод A. salinus и C. aquaedulcis (Губарева, Светличный, 2011) позволяет использовать их в качестве ценных живых кормов для личинок рыб, обитающих при разных оптимумах солености – от эстуарных до океанических. Еще одно преимущество этих видов копепод состоит в том, что в отличие от морских Calanoida у них отсутствует каннибализм: взрослые особи не выедают собственные яйца и ранние науплиальные стадии, поэтому науплиальные, копепоподитные и взрослые стадии можно выращивать совместно. Для кормления личинок разных видов кефалей и калкана оба вида копепод отлавливали в естественных водоемах (Семик, 1988) или культивировали экстенсивно в неконтролируемых условиях мезокосмов в смешанной с другими видами зоопланктона поликультуре (Khanaichenko et al., 1994; Новоселова, Туркулова, 2008). Однако методики массового интенсивного культивирования копепод в строго контролируемых температурных и трофических условиях еще дорабатываются. Поэтому цель настоящей работы заключалась в определении продукционных и репродуктивных характеристик A. salinus и C. aquaedulcis при оптимальных температурных условиях в зависимости от питания микроводорослями разных видов для разработки методики искусственного выращивания этих видов копепод.
МАТЕРИАЛ И МЕТОДИКА
Эксперименты проводили на лабораторных культурах копепод Arctodiaptomus salinus и Calanipeda aquaedulcis при оптимальной для выживаемости и развития обоих видов температуре 21 ± 1.5°С (Аганесова, 2013).
В качестве корма использовали широко распространенные в природе и легко культивируемые в искусственных условиях микроводоросли Isochrysis galbana Parke, 1949 (Prymnesiophyceae), Rhodomonas salina (Wislouch) Hill & Wetherbee, 1989 (Cryptophyceae) и Prorocentrum cordatum (Ostenfeld) J.D. Dodge, 1975 (Dinophyceae). По размерам эти микроводоросли подходят для питания копепод на разных стадиях развития. Источником моновидовых накопительных культур микроводорослей служили линии, полученные из музея-коллекции живых культур морских микроводорослей Института биологии южных морей им. А.О. Ковалевского РАН (Стельмах, Галатонова, 2003). Микроводоросли выращивали в накопительном режиме на основе стерилизованной черноморской воды, обогащенной средой Уолна (Coutteau, 1996), при температуре 24 ± 1.5°С и круглосуточном освещении 5 тыс. лк люминесцентными лампами LD-40. Для кормления копепод использовали микроводоросли из культур, находившихся в стадии экспоненциального роста, которые считаются наиболее качественным кормом и могут избирательно потребляться зоопланктоном (Петипа, Тен, 1971).
При создании культуральной среды для выращивания копепод (суспензия микроводорослей в стерилизованной морской воде) использовали черноморскую воду (17.8 ± 0.2‰), прошедшую грубую очистку, а затем отстоянную, механически очищенную последовательной фильтрацией через картриджные фильтры (размер пор 10, 5 и 1 мкм) и стерилизованную с помощью ультрафиолета с последующей двукратной пастеризацией. В лабораторных экспериментах использовали цилиндрические стеклянные сосуды объемом 50 мл, которые находились в условиях круглосуточного освещения 2000 лк. Культуральную среду в экспериментальных сосудах меняли каждые 2–3 сут.
Адаптацию копепод к питанию микроводорослями определенного вида проводили в течение 2–3 нед. Концентрация пищи составляла 0.02–0.08 мг сухой массы/мл. Таким образом были получены 6 лабораторных культур копепод A. salinus и C. aquaedulcis, адаптированных к питанию микроводорослями известного вида, которые использовали в экспериментах.
При изучении репродуктивных характеристик копепод A. salinus и C. aquaedulcis из лабораторных культур в экспериментальные сосуды отсаживали по одной самке с яйцами (по 25 повторов для каждой культуры). Определяли длину просомы самок и диаметр яиц, подсчитывали количество яиц в кладке (абсолютная плодовитость, яиц/самку) и выклюнувшихся жизнеспособных науплиев (% выклева).
Для определения плодовитости копепод A. salinus и C. aquaedulcis за жизненный цикл из лабораторных культур копепод в экспериментальные сосуды отсаживали по две половозрелых самки и одному самцу (по 25 повторов для каждой культуры). Определяли интервал вымета яиц самками, длительность эмбрионального развития яиц, продолжительность репродуктивного периода и среднесуточную продукцию яиц (EP) – среднее количество яиц, откладываемых самкой в сутки за репродуктивный период и за жизненный цикл. Все наблюдения за копеподами проводили прижизненно с периодичностью 1–3 сут под микроскопом МБС-12 при увеличении 2 × 8 и 4 × 8.
С целью определения продолжительности развития и выживаемости копепод A. salinus и C. aquaedulcis от первой науплиальной (N1) до шестой копеподитной (С6) стадии из лабораторных культур копепод в экспериментальные сосуды отсаживали по 15 науплиусов N1 (плотность 0.3 экз/мл). Эксперименты проводили в шести повторностях для каждого вида культуры.
Стадии развития копепод определяли прижизненно в камере Богорова под бинокуляром при увеличении 2 × 8 и 4 × 8. Выживаемость оценивали как процент особей, выживших при прохождении всех стадий от стадии N1 до С6. Продолжительность развития устанавливали как средний временной интервал развития особей от N1 до достижения половозрелости на стадии C6.
Для всех полученных данных рассчитаны средние арифметические величины (М), доверительный интервал (CI, 95%), стандартные отклонения и достоверность (p < 0.05) различий выборочных средних с помощью t-критерия Стьюдента.
РЕЗУЛЬТАТЫ
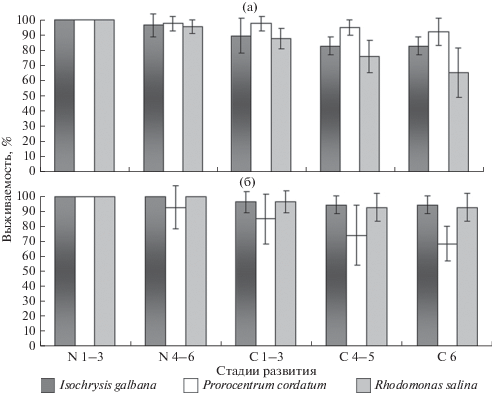
Выживаемость копеподы Calanipeda aquaedulcis на протяжении линек от стадии N1 до C6 зависела от вида микроводоросли и при кормлении Prorocentrum cordatum составила 92.5 ± 8.9%, Isochrysis galbana – 83 ± 5.9% и Rhodomonas salina – 65 ± 16.3% (рис. 1). Выживаемость копеподы Arctodiaptomus salinus также варьировала в зависимости от вида микроводоросли, которой она питалась. Минимальная (68.6 ± 11.5%) выживаемость A. salinus на протяжении всех линек от стадии N1 до стадии C6 отмечена при питании P. cordatum, максимальная (94.5 ± 6.1%) – при питании I. galbana.
Рис. 1.
Выживаемость копепод Calanipeda aquaedulcis (а) и Arctodiaptomus salinus (б) в эксперименте в зависимости от питания микроводорослями разных видов (М, CI, 95%; n = 15). Различия выживаемости значимы (р < 0.05) для стадий С4–5 и С6 (для C. aquaedulcis – диеты Prorocentrum cordatum и Rhodomonas salina) и С6 (для A. salinus – диеты Prorocentrum cordatum и Isochrysis galbana); для остальных стадий р > 0.05.
Длительность онтогенеза C. aquaedulcis при питании микроводорослями Rh. salina, I. galbana и P. cordatum составила 14 ± 0.1 сут (рис. 2), при этом продолжительность науплиального периода развития была наименьшей (6 ± 0.1 сут) у особей, питавшихся I. galbana и Rh. salina, а копеподитного (7 ± 0.2 сут) – у особей, потреблявших P. cordatum. Продолжительность развития от первого науплиуса до взрослой стадии у копеподы A. salinus оказалась значительно больше, чем у C. aquaedulcis. Наименьшая (18 ± 0.3 сут) продолжительность развития копеподы A. salinus выявлена при кормлении микроводорослью Rh. salina; продолжительность науплиального периода в этом случае составила 7 ± 0.1 сут, а копеподитного – 11 ± 0.3 сут.
Рис. 2.
Длительность развития копепод Calanipeda aquaedulcis (а) и Arctodiaptomus salinus (б) в эксперименте в зависимости от питания микроводорослями разных видов (М; n = 15); в прямоугольниках указана суммарная длительность стадий N1–3, N4–6, C1–3 и C4–5 (сут).

Соотношение полов у достигших взрослой стадии копепод обоих видов также варьировало в зависимости от питания (табл. 1), но различия не были достоверными (р > 0.05). У копеподы C. aquaedulcis доля самцов была наименьшей (20.8 ± 8.3%) в культуре, питавшейся I. galbana, и возрастала до 42.7 ± 6.3% при использовании в качестве корма P. cordatum. У особей C. aquaedulcis, питавшихся микроводорослью Rh. salina, соотношение полов было практически равным. Для копеподы A. salinus наиболее заметное преобладание самцов (56.1 ± 12.7%) отмечено при питании I. galbana; среди особей, питавшихся Rh. salina, доля самцов была наименьшей (19.7 ± 20.1%).
Таблица 1.
Соотношение полов (%) копепод Calanipeda aquaedulcis и Arctodiaptomus salinus при питании микроводорослями разных видов (М ± CI, 95%; n = 15)
| Диета из микроводорослей | C. aquaedulcis | A. salinus | ||
|---|---|---|---|---|
| самцы | самки | самцы | самки | |
| Isochrysis galbana | 20.8 ± 8.3 | 79.2 ± 8.3 | 56.1 ± 12.7 | 43.9 ± 12.7 |
| Prorocentrum cordatum | 42.7 ± 6.3 | 57.3 ± 6.3 | 47.7 ± 10.0 | 52.3 ± 10.0 |
| Rhodomonas salina | 53.0 ± 21.1 | 47.0 ± 21.1 | 19.7 ± 20.1 | 80.3 ± 20.1 |
Морфологические характеристки генераций копепод, питавшихся монокультурами микроводорослей, могут варьировать. Определены достоверные различия размеров яиц и средней длины просомы у самок копеподы A. salinus в зависимости от питания. У копепод, получавших в качестве корма Rh. salina, длина просомы составляла 0.99 ± ± 0.02 мм, а у копепод, питавшихся I. galbana, – 1.126 ± 0.013 мм. В зависимости от предложенного корма средний диаметр яиц составлял 92 ± 4 (P. cordatum), 103 ± 5 (Rh. salina) и 134 ± 5 мкм (I. galbana). Достоверных различий по влиянию вида микроводорослей на абсолютную плодовитость A. salinus, как и на процент выклева науплиев, не выявлено (табл. 2).
Таблица 2.
Репродуктивные характеристики копепод Calanipeda aquaedulcis и Arctodiaptomus salinus при питании микроводорослями разных видов (М ± CI, 95%; n = 25)
| Репродуктивные характеристики копепод | Диета из микроводорослей | ||
|---|---|---|---|
| Isochrysis galbana | Prorocentrum cordatum | Rhodomonas salina | |
| Calanipeda aquaedulcis | |||
| Средняя длина просомы самок, мм | 0.75 ± 0.01 | 0.76 ± 0.02 | 0.74 ± 0.01 |
| Средний диаметр яиц, мкм | 88 ± 8 | 84 ± 8 | 88 ± 10 |
| Абсолютная плодовитость | 24.2 ± 1.8 | 19.8 ± 3.6 | 9.12 ± 1.35 |
| Выклев, % | 100 | 100 | 86.3 ± 8 |
| EP за репродуктивный период | 10.97 ± 0.18 | 10.69 ± 1.19 | – |
| EP за жизненный цикл | 4.1 ± 0.64 | – | – |
| Arctodiaptomus salinus | |||
| Средняя длина просомы самок, мм | 1.126 ± 0.013 | 1.026 ± 0.026 | 0.99 ± 0.02 |
| Средний диаметр яиц, мкм | 134 ± 5 | 92 ± 4 | 103 ± 5 |
| Абсолютная плодовитость | 10.3 ± 1.3 | 16.4 ± 2.4 | 9.67 ± 2.14 |
| Выклев, % | 84.9 ± 7.3 | 62.6 ± 10.1 | 85.7 ± 19.8 |
| EP за репродуктивный период | 4.4 ± 0.59 | 3.31 ± 0.18 | – |
| EP за жизненный цикл | 1.76 ± 0.1 | – | – |
У копеподы C. aquaedulcis средние длина просомы самок и диаметр яиц не зависели от вида пищи, а абсолютная плодовитость значительно варьировала: от 9.12 ± 1.35 яиц при кормлении Rh. salina до 24.2 ± 1.8 яиц при кормлении I. galbana. Процент выклева изменялся от 100 (P. cordatum, I. galbana) до 86.3 ± 8% (Rh. salina) (табл. 2).
Длительность репродуктивного периода. При питании I. galbana самки C. aquaedulcis продуцировали яйца со времени достижения половозрелости (возраст 15 сут) до возраста 34 сут, самки A. salinus – с возраста 21 сут до 78 сут. Пик репродуктивного периода C. aquaedulcis приходился на 22–28-е сут, а A. salinus – на 28–46-е сут; после этого репродуктивная активность копепод постепенно снижалась. Интервал вымета яиц самками C. aquaedulcis составлял 3.2 ± 0.6 сут, A. salinus – 3.7 ± 0.5. Эмбриональное развитие яиц C. aquaedulcis при температуре 21°С длилось меньше 1 сут, A. salinus – около 3 сут.
Среднесуточная продукция яиц (EP) за репродуктивный цикл у C. aquaedulcis была наибольшей при питании I. galbana (10.97 ± 0.18 яиц) и P. cordatum (10.69 ± 1.19 яиц). У самок A. salinus наиболее высокие показатели EP также отмечены при питании I. galbana (4.4 ± 0.59 яиц) и P. cordatum (3.31 ± 0.18 яиц). Таким образом, при индивидуальном культивировании у самки C. aquaedulcis EP за весь жизненный цикл (4.10 ± 0.64 яйца) был более чем в 2 раза выше, чем у A. salinus (1.76 ± 0.10 яйца), хотя период размножения A. salinus в 2 раза длиннее за счет более продолжительного жизненного цикла.
ОБСУЖДЕНИЕ
Отмеченное у копепод Arctodiaptomus salinus и Calanipeda aquaedulcis постепенное увеличение продолжительности стадий постэмбрионального развития от младших науплиальных стадий к старшим копеподитным стадиям закономерно для каляноидных копепод. На протяжении всего периода развития исследованных видов копепод наиболее высокие значения выживаемости получены при кормлении их микроводорослью Isochrysis galbana, имеющей небольшие размеры. При этой диете, как и при питании мелкоразмерной Rhodomonas salina, продолжительность науплиального периода развития была минимальной у обоих видов копепод. Абсолютная выживаемость на ранних науплиальных стадиях и небольшая длительность этих стадий, вероятно, связаны с тем, что до перехода на экзогенное питание запасы желтка служат единственным источником энергии как на стадиях N1 и N2, так и на стадиях N2 и N3 (Jiménez-Melero et al., 2007). Стадии C4 и C5 – самые продолжительные. Показано, что самцы обоих видов копепод развивались быстрее самок; это можно объяснить половой дифференциацией и ростом гонад на 5-й критической стадии развития (Peterson, 2001). Известно, что соотношение полов у достигших половозрелости копепод может изменяться как под влиянием температуры, так и при воздействии трофических условий (Lang, 1948; Voordouw et al., 2005).
Установленная нами длительность науплиального периода C. aquaedulcis сопоставима с данными, полученными ранее (Гарбер, 1951). Однако длительность копеподитного периода C. aquaedulcis в предложенных нами оптимальных трофических условиях в 2 раза меньше приведенной в работе Б.И. Гарбера. Вероятно, это связано с субоптимальным питанием, которое не отвечало потребностям развития копеподитных стадий вида. Как и в наших экспериментах, максимальная выживаемость Bestiolina similis (Sewell, 1914) на копеподитных стадиях наблюдалась при питании I. galbana, минимальная – при питании диатомовыми и зелеными микроводорослями (Camus, Zeng, 2010).
Для A. salinus высокие показатели выживаемости получены при всех трех видах диеты: от 94.5% при питании I. galbana до 68.6% при употреблении P. cordatum; наименьшая средняя продолжительность развития этой копеподы отмечена при питании микроводорослью Rh. salina. Согласно литературным данным, выживаемость A. salinus (от N1 до C6) в условиях эксперимента (температура воды около 20°C) при питании фитопланктоном из естественной среды обитания с добавлением микроводорослей из культуры Chlamydomonas reinhardtii (P.A. Dangeard, 1888) составила 70%; первые половозрелые особи отмечены только на 24-е сут развития (Jiménez-Melero et al., 2007). В отсутствие пищевого лимитирования, но при кормлении суспензией хлореллы (концентрация 8 × 105 кл/мл) развитие A. salinus от яйца до взрослых особей длилось 26 сут при температуре 20°C (Толомеев, 2002). Полученные нами экспериментальные данные показали, что выживаемость этого вида может быть значительно выше (94%), а продолжительность развития меньше (18 сут). Различия выживаемости и длительности развития копепод при использовании в качестве корма Ch. reinhardtii (см.: Jiménez-Melero et al., 2007) и Chlorella sp. (см.: Толомеев, 2002), вероятно, обусловлены неадекватностью этих диет, связанной с дефицитом эссенциальных компонентов, необходимых для нормального развития разных стадий A. salinus.
По мнению исследователей (Herzig, 1983; Толомеев, 2002), продолжительность развития копепод от науплиальной до взрослой стадии в большей степени определяется температурными, чем трофическими, условиями. Наши данные показали, что при одинаковой температуре и обеспеченности кормом длительность развития и выживаемость копепод могут варьировать в зависимости от вида и класса микроводорослей, следовательно, от хемотаксономических характеристик микроводорослей, которыми питаются копеподы. Сведения о средней абсолютной плодовитости копеподы C. aquaedulcis (18–20 яиц) (Гиляров, 1987) в целом соответствуют нашим данным. Однако нами выявлена высокая вариабельность абсолютной плодовитости самок C. aquaedulcis в зависимости от вида микроводорослей, которыми они питались.
Значения абсолютной плодовитости A. salinus, полученные нами (16.4 ± 2.4 яйца), заметно выше литературных данных (от 3.97 ± 2.05 до 7.88 ± ± 4.88 яиц при низком и высоком уровне обеспеченности пищей соответственно) (Jiménez-Melero et al., 2012), что также может быть связано с хемотаксономическими характеристиками микроводорослей, которыми питались самки A. salinus.
Репродуктивные характеристики самок копепод при питании монокультурой микроводорослей могут служить показателями биохимического соответствия кормового объекта пищевым потребностям копепод (Lacoste et al., 2001). У каляноидных копепод синтез незаменимых жирных кислот ограничен, поэтому копеподы получают их из микроводорослей. Известно, что жирнокислотный состав у микроводорослей разных классов значительно варьирует (Zhukova, Aizdaicher, 1995). Микроводоросли I. galbana и P. cordatum характеризуются высоким содержанием полиненасыщенной жирной 22:6n-3-докозагексаеновой кислоты (ДГК) и низким содержанием 20:5n-3-эйкозапентаеновой кислоты (ЭПК) (Fidalgo et al., 1998; Makri et al., 2011), а для Rh. salina отмечено низкое содержание как ЭПК, так и ДГК (Guevara et al., 2011). Содержание и соотношение именно этих двух ненасыщенных жирных кислот в составе микроводорослей, предположительно, является одним из основных факторов, оказывающих влияние на репродукционные характеристики каляноидных копепод (Ханайченко, 1999). Наши данные по среднесуточной плодовитости A. salinus сходны с результатами, полученными в условиях оптимального проточного культивирования этого вида при температуре 20°С (в среднем 2.71 яйца) (Tolomeyev, 2002).
Солоноватоводные копеподы C. aquaedulcis и A. salinus вынашивают яйца в яйцевых мешках, в которых эмбрионы (в случае субитанных яиц) остаются до выклева науплиев (N1), в отличие, например, от представителей морских родов Calanus и Acartia, которые выметывают яйца в воду. Среднесуточная плодовитость у двух исследованных нами видов копепод, соответственно почти в 2 и 5 раз ниже, чем у близких по размерным характеристикам морских копепод, например, у копеподы Acartia tonsa (Dana, 1849), которая откладывает в сутки около 20 яиц (Ханайченко, 1999). У исследованных видов солоноватоводных копепод благодаря заботе о потомстве низкая плодовитость компенсируется высокой выживаемостью науплиусов, а отсутствие каннибализма увеличивает продолжительность жизненного цикла, в течение которого эти ракообразные могут размножаться.
Результаты наших исследований показали, что при выращивании копеподы C. aquaedulcis для улучшения выживаемости особей и быстрого развития в период онтогенеза, а также для достижения максимальной плодовитости самок оптимальными кормовыми объектами служат монокультуры микроводорослей P. cordatum и I. galbana. Монокультура микроводоросли Rh. salina на определенных стадиях развития копеподы C. aquaedulcis, по-видимому, не полностью удовлетворяет ее потребности в незаменимых компонентах пищи, необходимых для роста и развития. Следствием этого являются уменьшение процента выклева и низкая выживаемость C. aquaedulcis на всех стадиях онтогенеза, а также малая абсолютная плодовитость. Очевидно, микроводоросль Rh. salina – это менее подходящий пищевой объект при культивировании данного вида копепод.
Напротив, у копеподы A. salinus при питании монокультурой Rh. salina отмечены высокий процент выживаемости на всех стадиях развития от N1 до C6 (93%), короткая продолжительность развития (18 сут) и высокий процент выклева (86%). Следовательно, для этого вида копепод Rh. salina наряду с микроводорослями I. galbana и P. cordatum является оптимальным кормовым объектом.
Список литературы
Аганесова Л.О. Длительность развития копепод Calanipeda aquaedulcis и Arctodiaptomus salinus при разном температурном режиме культивирования // Мор. экол. журн. 2013. Т. 12. № 1. С. 19–25.
Гарбер Б.И. Наблюдения за развитием и размножением Calanipeda aquaedulcis Kritsch (Copepoda: Calanoida) // Тр. Карадаг. биол. ст. 1951. Т. 2. С. 3–55.
Гиляров А.М. Динамика численности планктонных ракообразных. М.: Наука. 1987. 192 с.
Губарева Е.С., Светличный Л.С. Солёностная толерантность копепод Calanipeda aquaedulcis и Arctodiaptomus salinus (Calanoida, Copepoda) // Мор. экол. журн. 2011. Т. 10. № 4. С. 32–39.
Новоселова Н.В., Туркулова В.Н. К методике массового культивирования живых кормов в условиях низкой температуры для молоди ценных морских видов рыб // Тр. ЮгНИРО. 2008. Т. 46. С. 41–47.
Петипа Т.С., Тен В.С. Исследование культур водорослей для изучения питания животных и выяснения взаимосвязи между процессами элиминации и продуцирования // Экологическая физиология морских планктонных водорослей (в условиях культур). Киев: Наукова думка. 1971. С. 168–177.
Семик A.M. Веслоногий рачок-диаптомус (Diaptomus salinus Е. Daday) – возможный объект массового культивирования // Живые корма для объектов марикультуры. М.: Изд-во ВНИРО. 1988. С. 98–102.
Стельмах Л.В., Галатонова О.А. Коллекция морских планктонных водорослей ФИЦ ИМБЮМ. Севастополь, 2003. 14 с.
Толомеев А.П. Экспериментальное определение кинетики роста и спектров питания некоторых видов зоопланктона: Автореф. дис. … канд. биол. наук. Красноярск. 2002. 20 с.
Ханайченко А.Н. Влияние микроводорослевой диеты на характеристики воспроизводства копепод // Экол. моря. 1999. Т. 49. С. 56–61.
Camus T., Zeng C. Roles of microalgae on total egg production over female lifespan and egg incubation time, naupliar and copepodite survival, sex ratio and female life expectancy of the copepod Bestiolina similis // Aquacult. Res. 2010. V. 41. № 11. P. 1717–1726.
Coutteau P. Micro-algae // Manual on the production and use of live food for aquaculture. FAO Fisheries Technical Paper. No. 361. Rome: FAO. 1996. P. 7–48.
Fidalgo J.P., Cid A., Torres E. et al. Effects of nitrogen source and growth phase on proximate biochemical composition, lipid classes and fatty acid profile of the marine microalga Isochrysis galbana // Aquaculture. 1998. V. 166. P. 105–116.
Grindley J.R. The zoogeography of the Pseudodiaptomidae // Crustaceana. 1984. Suppl. 7. P. 217–228.
Guevara M., Bastardo L., Cortez R. et al. Pastas de Rhodomonas salina (Cryptophyta) como alimento para Brachionus plicatilis (Rotifera) // Rev. Biol. Trop. 2011. V. 59. № 4. P. 1503–1515.
Herzig A. The ecological significance of the relationship between temperature and duration of embryonic development in planktonic freshwater copepods // Hydrobiologia. 1983. V. 100. P. 65–91.
Jiménez-Melero R., Parra G., Guerrero F. Effect of temperature, food and individual variability on the embryonic development time and fecundity of Arctodiaptomus salinus (Copepoda: Calanoida) from a shallow saline pond // Hydrobiologia. 2012. V. 686. P. 241–256.
Jiménez-Melero R., Parra G., Souissi S., Guerrero F. Post-embryonic developmental plasticity of Arctodiaptomus salinus (Copepoda: Calanoida) at different temperatures // J. Plankton Res. 2007. V. 29. № 6. P. 553–567.
Khanaichenko A.N., Bitukova Y.E., Tkachenko N.K. Experiences in rearing endemic Black Sea turbot larvae // P. Lavens, and R.A.M. Remmerswaal (Eds). Turbot Culture: Problems and Prospects. European Aquaculture Society, Special Pub. № 22, Gent, Belgium. 1994. P. 349−358.
Lacoste A., Poulet S.A., Cueff A. et al. New evidence of the copepod maternal food effects on reproduction // J. Exp. Mar. Biol. Ecol. 2001. V. 259. № 1. P. 85–107.
Lang K. Monographie der Harpacticiden I, II. Lund, Sweden: Hakan Ohlssons Boktryckeri. 1948. 1683 p.
Makri A., Bellou S., Birkou M. et al. Lipid synthesized by micro-algae grown in laboratory- and industrial-scale bioreactors // Eng. Life Sci. 2011. V. 11. № 1. P. 52–58.
Marcus N.H. Calanoid copepods, resting eggs, and aquaculture // Copepods in aquaculture. Oxford: Blackwell. 2005. Ch. 1. P. 3–10.
Peterson W.T. Patterns in stage duration and development among marine and freshwater calanoid and cyclopoid copepods: a review of rules, physiological constraints, and evolutionary significance // Hydrobiologia. 2001. V. 453. P. 91–105.
Poulet S.A., Williams R. Characteristics and properties of copepods affecting the recruitment of fish larvae // Bull. Plankton Soc. Jpn. 1991. Special vol. P. 271–290.
Samchyshyna L.V. Ecological characteristic of Calanoids (Copepoda, Calanoida) of the Inland Waters of Ukraine // Vestn. Zool. 2008. V. 42. N. 2. P. 32–37.
Støttrup J.G., Richardson K., Kirkegaard E., Pihl N.J. The cultivation of Acartia tonsa Dana for use as a live food source for marine fish larvae // Aquaculture. 1986. V. 52. № 2. P. 87–96.
Tolomeyev A.P. Phytoplankton diet of Arctodiaptomus salinus (Copepoda, Calanoida) in Lake Shira (Khakasia) // Aquat. Ecol. 2002. V. 36. № 2. P. 229–234.
Voordouw M.J., Robinson H.E., Anholt B.R. Paternal inheritance of the primary sex ratio in a copepod // J. Evol. Biol. 2005. V. 18. № 5. P. 1304–1314.
Zhukova N.V., Aizdaicher N.A. Fatty acid composition of 15 species of marine microalgae // Phytochemistry. 1995. V. 39. № 2. P. 351–356.
Дополнительные материалы отсутствуют.


