Биология моря, 2021, T. 47, № 2, стр. 115-120
Стронций- и иттрийсвязывающая активность пектина из морской травы Phyllospadix iwatensis Makino, 1931 и его модифицированного производного
В. В. Ковалев 1, Е. В. Хожаенко 2, Е. А. Подкорытова 1, 2, *
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
2 Дальневосточный федеральный университет
690091 Владивосток, Россия
* E-mail: eapodkorytova@mail.ru
Поступила в редакцию 22.01.2020
После доработки 22.04.2020
Принята к публикации 28.09.2020
Аннотация
Из морской травы Phyllospadix iwatensis Makino, 1931 был выделен низкоэтерифицированный пектин, который был модифицирован путем кислотного гидролиза в 0.5 М HCl. В исходном и гидролизованном пектинах определены содержание ангидрогалактуроновой кислоты, степень метоксилирования и молекулярно-массовое распределение. Оценена сорбционная способность данных пектинов в отношении ионов стронция и иттрия при рН 6.0. Установлено, что в ходе гидролиза молекулярная масса пектина уменьшилась в 2.9 раза, относительное содержание ангидрогалактуроновой кислоты увеличилось на 14%, а степень метоксилирования с 5.22% снизилась до нуля. Сорбционная способность гидролизованного пектина в отношении ионов стронция увеличилась на 40%, в отношении ионов иттрия – на 48%. При этом гидролизованный пектин в полной мере сохранил способность сорбировать ионы металлов из их растворов с низкой концентрацией.
Пектины – это широко распространенный в природе класс биополимеров, которые присутствуют во всех высших растениях, обнаружены в составе первичных клеточных стенок и межклеточного пространства. Пектины относятся к гетерополисахаридам, т.е. в их состав входят различные сахара. Структурной основой молекулы пектина является D-галактуроновая кислота, которая образует достаточно протяженные полимерные блоки, имеющие линейное строение. В этих галактуронановых блоках часть остатков D-галактуроновой кислоты находится в форме метиловых эфиров (Оводова и др., 2010; Mravec et al., 2017; Gawkowska et al., 2018).
Основной областью использования пектинов традиционно является пищевая промышленность. Однако в настоящее время внимание исследователей направлено на физиологическое действие пектинов. В ряде работ показано присутствие у пектинов таких фармакологических эффектов, как иммунорегуляторный, гиполипидемический, антибактериальный, противоопухолевый, гастропротекторный и др. (Correa-Ferreira et al., 2018; Lara-Espinoza et al., 2018; Minzanova et al., 2018; de Godoi et al., 2019). Одно из перспективных направлений использования пектинов в медицине обусловлено способностью некоторых пектинов прочно связывать в комплекс и выводить из организма тяжелые металлы и радионуклиды. Этой способностью обладают пектины с достаточным количеством остатков D-галактуроновой кислоты, имеющих свободные карбоксильные группы, благодаря которым образуется связь между пектином и металлом. Большинство природных пектинов, в том числе все коммерческие, относятся к высокоэтерифицированным пектинам, в которых основная часть карбоксильных групп в остатках D-галактуроновой кислоты этерифицирована метиловым спиртом, поэтому не может образовывать комплекс с ионами металлов (Зелепукин и др., 2016; Lara-Espinoza et al., 2018).
Перспективным источником низкоэтерифицированных пектинов являются морские травы семейства Zosteraceae, большие промысловые запасы которых обнаружены у берегов Дальнего Востока России (Боковня, Давидович, 2015). Ранее было показано, что пектины, полученные из морских трав зостеры и филлоспадикса, имеют степень этерификации менее 10% и способны образовывать прочные химические комплексы с некоторыми металлами, в том числе со стронцием (Коленченко и др., 2012; Khozhaenko et al., 2015, 2016). Это представляет большой практический интерес, так как радиоактивный изотоп стронция (90Sr) является одним из основных факторов радиационного загрязнения окружающей среды при ядерных взрывах и выбросах с АЭС. 90Sr обладает относительно длительным периодом существования и, будучи химическим аналогом кальция, способен откладываться в костной ткани, вызывая радиационное поражение организма. Дополнительную опасность представляет то, что при радиоактивном распаде 90Sr образуется его дочерний продукт иттрий (90Y), который является еще более мощным β-излучателем (Велешко и др., 2011; Koarai et al., 2016). Таким образом, возникает необходимость одновременного связывания и выведения из организма обоих указанных изотопов.
Цель настоящей работы – сравнительная количественная оценка сорбционной активности выделенного из филлоспадикса пектина и его модифицированного производного в отношении ионов стронция и иттрия.
МАТЕРИАЛ И МЕТОДИКА
Морскую траву Phyllospadix iwatensis собирали в районе о-ва Русский в б. Аякс в конце сентября 2018 г. Для выделения пектина использовали свежевыловленные растения, у которых удаляли корневища и отмершие части листьев. Затем морскую траву тщательно промывали в холодной водопроводной воде и измельчали до частиц размером не более 2 см. Выделение пектина из сырья проводили в соответствии с ранее описанной методикой, включающей кислотный гидролиз травы, экстракцию пектина оксалатом аммония и осаждение пектина этанолом (Khozhaenko et al., 2016). Полученный пектин дополнительно очищали переосаждением из 0.25% раствора трехкратным количеством этанола и сушили при температуре 80ºС.
Модификацию пектина проводили путем его кислотного гидролиза по следующей методике. Сначала 5 г пектина на стеклянном фильтре промывали 50 мл 0.5 М соляной кислоты для перевода его в кислотную форму. Промытый пектин помещали в стеклянную колбу, добавляли 0.5 М соляной кислоты до объема 150 мл, затем проводили гидролиз пектина при температуре 90°С и непрерывном перемешивании в течение 2 ч. По окончании гидролиза оставшийся твердый остаток пектина отделяли центрифугированием при 2.500 g в течение 30 мин, затем трижды промывали суспендированием в 100 мл 0.05 М соляной кислоты, каждый раз отделяя жидкую фазу центрифугированием. Отмытый осадок пектина растворяли в воде при добавлении 1 М натрия гидроксида до рН 6.0. Объем полученного раствора доводили до 400 мл и осаждали пектин добавлением трехкратного объема 95% этанола. Осадок пектина отделяли от жидкости с помощью фильтровальной ткани, промывали 10-кратным объемом 70% этанола, затем трехкратным объемом 95% этанола и сушили при температуре 80°С.
В качестве образца сравнения использовали коммерческий высокоэтерифицированный цитрусовый пектин марки Classic CS 401 (Herbstreith & Fox KG Pektin-Fabriken, Германия).
Содержание галактуроновой кислоты в образцах пектинов определяли колориметрическим методом по реакции с м-гидроксибифенилом (Blumenkrantz, Asboe-Hansen, 1973; Василенко, Седакова, 2005).
Степень метоксилирования определяли с помощью титриметрического метода (Позднякова, Бубенчиков, 2014).
Молекулярно-массовое распределение в образцах пектинов определяли методом эксклюзионной хроматографии на жидкостном хроматографе LC-20 Prominence с рефрактометрическим детектором (Shimadzu, Япония). Сбор и расчет данных производили с помощью стандартного сертифицированного программного обеспечения, предусматривающего статистическую обработку данных LC Solution Version 1.25 с функцией расчета молекулярно-массовых характеристик (GPC). Образцы анализировали на колонке OHpak SB-804HQ (8 × 300 мм, лимит эксклюзии 1 × 106 г/моль, размер частиц 10 мкм). Элюирование образцов проводили 37 мМ фосфатным буфером при рН 6.0, температуре 35°С и скорости 0.5 мл/мин. Определяемые образцы и стандарты готовили в концентрации 1–2 мг/мл. В качестве стандартов для калибровки колонки использовали набор пуллуланов с молекулярной массой от 11.8 до 788.0 кДа.
Сорбционную активность образцов пектинов оценивали в соответствии с ранее разработанной методикой (Коленченко и др., 2012). В емкость, снабженную магнитной мешалкой, вносили рассчитанное количество 0.1 М раствора солей иттрия или стронция, соответствующее концентрации металла в растворе от 40 до 1400 мг/л (в пересчете на 20 мл конечного объема), 1 мл 0.1 М ацетатного буфера с рН 6.0 и 10 мл 0.5% раствора пектинов. По показаниям рН-метра корректировали значение рН среды добавлением 0.1 М растворов гидроксида натрия или азотной кислоты. Затем объем реакционной смеси доводили до 20 мл, добавляя дистиллированную воду; смесь инкубировали при постоянном перемешивании в течение 60 мин при температуре 36–37°С. Раствор, содержавший свободные ионы иттрия или стронция, отделяли фильтрованием через гидрофильный фильтр Omnipore с размером пор 5 мкм. Остаточное содержание металла в жидкой фазе определяли на атомно-абсорбционном спектрофотометре AA-6800 (Shimadzu, Япония).
Количество связанного пектином металла вычисляли по формуле:
Количественные параметры сорбции оценивали с помощью математической модели Лэнгмюра. По результатам пяти экспериментов были рассчитаны константы Лэнгмюра. Для оценки релевантности использования модели был рассчитан коэффициент аппроксимации (R2).
РЕЗУЛЬТАТЫ
Физико-химические характеристики образцов пектинов, использованных в работе, приведены в табл. 1. По молекулярной массе пектин из филлоспадикса можно отнести к высокомолекулярным пектинам. Следует отметить, что характеристики молекулярно-массового распределения низкоэтерифицированного пектина из филлоспадикса и высокоэтерифицированного цитрусового пектина практически совпадают. В результате кислотного гидролиза молекулярная масса пектина из филлоспадикса значительно уменьшилась: средневесовая – в 2.9 раза, а среднечисловая – в 1.96 раза (табл. 1). При этом полидисперсность пектина снизилась в 1.5 раза, что свидетельствует о соответствующем повышении гомогенности образца. В ходе гидролиза пектина содержание в нем галактуроновой кислоты увеличилось в 1.14 раза. Это свидетельствует о том, что блоки галактуронана более устойчивы к воздействию кислоты, чем нейтральные сахара, которые в ходе кислотного гидролиза отщепляются от молекулы пектина в первую очередь. В результате гидролиза также произошло практически полное деметоксилирование пектина – степень метоксилирования снизилась до нуля. Это привело к дополнительному увеличению приблизительно на 4% содержания свободных карбоксильных групп в молекуле пектина.
Таблица 1.
Физико-химические характеристики использованных пектинов
| Показатель | Пектин из Phyllospadix iwatensis | Цитрусовый пектин | |
|---|---|---|---|
| нативный | гидролизованный | ||
| Степень метоксилирования, % | 5.22 ± 0.14 | 0 | 60.2 ± 0.45 |
| Содержание ангидрогалактуроновой кислоты, % | 70.5 ± 0.65 | 80.2 ± 0.97 | 79.4 ± 0.84 |
| Содержание свободных карбоксильных групп, % | 17.1 ± 0.16 | 20.5 ± 0.25 | 8.1 ± 0.09 |
| Средневесовая молекулярная масса, кДа | 325.45 | 119.93 | 319.36 |
| Среднечисловая молекулярная масса, кДа | 101.81 | 59.29 | 100.26 |
| Полидисперсность | 3.1969 | 2.023 | 3.1854 |
При сравнении сорбционных характеристик высокоэтерифицированного цитрусового пектина и низкоэтерифицированного пектина из филлоспадикса установлено, что по максимальной сорбционной емкости данные пектины в отношении ионов стронция различаются в 1.82 раза, а ионов иттрия – в 1.53 раза (табл. 2). Это подтверждает более высокую сорбционную способность низкоэтерифицированных пектинов по сравнению с таковой высокоэтерифицированных.
Таблица 2.
Экспериментальные константы Лэнгмюра для связывания ионов иттрия и стронция образцами пектина при рН 6.0
| Показатель | Нативный пектин из Phyllospadix iwatensis | Гидролизованный пектин из Phyllospadix iwatensis | Цитрусовый пектин |
|---|---|---|---|
| Стронций | |||
| Максимальная сорбционная емкость (qmax, мг/г) | 123.46 ± 0.35 | 172.41 ± 0.43 | 68.16 ± 0.49 |
| Коэффициент аффинитета (b, л/мг) | 0.0552 ± 0.0014 | 0.0897 ± 0.0021 | 0.0090 ± 0.0005 |
| Коэффициент аппроксимации (R2) | 0.990 | 0.991 | 0.990 |
| Иттрий | |||
| Максимальная сорбционная емкость (qmax, мг/г) | 108.7 ± 0.71 | 161.29 ± 0.13 | 71.42 ± 0.08 |
| Коэффициент аффинитета (b, л/мг) | 0.0393 ± 0.0013 | 0.0569 ± 0.0018 | 0.0156 ± 0.0011 |
| Коэффициент аппроксимации (R2) | 0.999 | 0.998 | 0.987 |
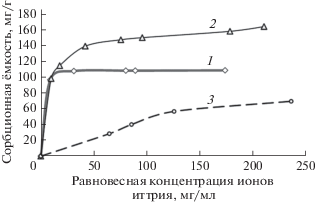
Сравнение изотерм сорбции ионов стронция и иттрия данными пектинами (рис. 1, 2) показало, что пектин из филлоспадикса активно сорбировал ионы металлов уже при их начальных низких концентрациях, в то время как цитрусовый пектин проявлял сорбционные свойства лишь при достаточно высоких концентрациях ионов металлов. Различие в действии этих пектинов имеет большое практическое значение, так как количество изотопов стронция и иттрия (и других токсических металлов), попадающих в организм человека, очень мало, но их необходимо максимально полно связать и вывести из организма. В связи с этим именно низкоэтерифицированные пектины могут считаться перспективными сорбентами.
Рис. 1.
Изотерма сорбции ионов стронция. 1 – пектин из Phyllospadix iwatensis, 2 – гидролизованный пектин, 3 – цитрусовый пектин.
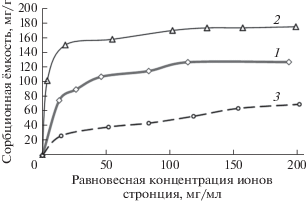
При сравнении сорбционных характеристик нативного и гидролизованного пектинов из филлоспадикса установлено, что по максимальной сорбционной емкости гидролизованный пектин превосходит нативный пектин в отношении ионов стронция в 1.4 раза, а ионов иттрия – в 1.48 раза. Эти результаты согласуются с данными, приведенными в табл. 1, которые свидетельствуют об увеличении содержания в гидролизованном пектине свободных карбоксильных групп, отвечающих за его сорбционную активность. Сравнение изотерм сорбции ионов иттрия нативным и гидролизованным пектинами из филлоспадикса (рис. 2) показало, что начальные участки изотерм, соответствующие области низких концентраций металла, практически совпадают. Это позволяет говорить о том, что в области низких концентраций иттрия данные пектины обладают одинаковой металлсвязывающей активностью. Изотермы сорбции стронция нативным и гидролизованным пектинами из филлоспадикса (рис. 1) заметно различаются на начальных участках: изотерма сорбции для гидролизованного пектина демонстрирует более крутой подъем. Таким образом, при одинаковой равновесной концентрации стронция в растворе гидролизованный пектин сорбировал больше металла, чем нативный пектин. Следовательно, несмотря на существенное уменьшение молекулярной массы, гидролизованный пектин в полной мере сохранял способность сорбировать ионы металлов из их растворов с низкой концентрацией.
ОБСУЖДЕНИЕ
По данным эксперимента из трех исследованных образцов пектинов наиболее эффективным сорбентом ионов стронция и иттрия оказался гидролизованный пектин из Phyllospadix iwatensis. В результате проведенного гидролиза сорбционная способность пектина из филлоспадикса в отношении ионов стронция и иттрия увеличилась на 40 и 48% соответственно. При этом заметно повысилась способность данного пектина сорбировать ионы стронция из растворов с низкой концентрацией металлов. Повышение сорбционных свойств пектина в результате гидролиза может быть связано со следующими причинами. В ходе гидролиза за счет отщепления нейтральных сахаров содержание ангидрогалактуроновой кислоты в пектине увеличилось на 14%. В то же время степень этерификации снизилась на 5.22%. В результате данных процессов относительное содержание свободных карбоксильных групп в пектине увеличилось на 20% (табл. 1). При этом соответствующим образом увеличилась и сорбционная способность пектина, которая, как отмечено ранее, зависит от содержания в нем свободных карбоксильных групп.
Механизм связывания ионов металлов пектинами предполагает, что отдельные участки галактуронана, входящие в состав разных молекул пектина, образуют межмолекулярную связь через ионы поливалентных металлов. Эта связь носит кооперативный характер, и для ее стабилизации необходимо плотное взаимодействие между достаточно протяженными участками галактуронана (Оводова и др., 2010; Gawkowska et al., 2018). Исходя из этого, повышение сорбционной способности пектина можно объяснить также тем, что в ходе кислотного гидролиза могло произойти разрушение участков молекулы пектина, тем или иным образом препятствовавших сближению блоков галактуронана, которое необходимо для образования прочной кооперативной связи. В результате гидролиза средняя молекулярная масса пектина снизилась в 2.9 раза. В образовавшихся фрагментах пектиновой молекулы содержание ангидрогалактуроновой кислоты достигло 80.2%, что в пересчете на ее натриевую соль (ангидрогалактуроновая кислота в пектине находится в форме натриевой соли) составляло около 90% массы молекулы. Таким образом, гидролизованный пектин фактически представляет собой блоки галактуронана разной величины, ранее входившие в состав молекулы пектина и высвободившиеся из нее в результате гидролиза. Эти блоки более подвижны и имеют больше возможностей для образования межмолекулярной связи, чем в случае их нахождения в исходной молекуле пектина.
Необходимо отметить, что помимо высокой сорбционной способности гидролизованный пектин имеет достаточно высокую степень однородности (полидисперсность составляет 2.15). Как известно, диапазон молекулярно-массового распределения лекарственного вещества является важным показателем качества в соответствии с требованиями большинства международных Государственных Фармакопей. Чем ýже диапазон молекулярно-массового распределения, тем легче субстанция поддается контролю качества и стандартизации. Таким образом, гидролизованный пектин из филлоспадикса может быть рекомендован в качестве основы при создании лекарственных препаратов для профилактики и терапии интоксикации радионуклидами.
Список литературы
Боковня И.Е., Давидович В.В. Оценка содержания биологически активных веществ в морской траве семейства Zosteraceae при различных способах ее заготовки // Международ. науч.-исслед. журн. 2015. № 8(39). Ч. 2. С. 6–7.
Василенко З.В., Седакова В.А. Методики количественного определения пектина // Вестн. фармации. 2005. № 3. С. 83–91.
Велешко И.Е., Розанов К.В., Велешко А.Н. и др. Сорбция радионуклидов 90Sr и 90Y биополимером микитон для радиологического мониторинга и пострадиационной реабилитации природных и техногенных сред // Изв. Самар. науч. центра РАН. 2011. Т. 13. № 5. С. 151–154.
Зелепукин Ю.И., Зелепукин С.Ю., Федорук В.А., Бушмин И.С. К вопросу производства пектина из свекловичного жома // Вестн. Воронеж. гос. ун-та инженер. технол. 2016. № 2. С. 238–242.
Коленченко Е.А., Хотимченко М.Ю., Хожаенко Е.В., Хотимченко Ю.С. Сорбция стронция пектинами, выделенными из морских трав Zostera marina и Phyllospadix iwatensis // Биол. моря. 2012. Т. 38. № 4. С. 325–329.
Оводова Р.Г., Головченко В.В., Попов С.В., Оводов Ю.С. Новейшие сведения о пектиновых полисахаридах // Изв. Коми науч. центра УрО РАН. 2010. № 3. С. 37–45.
Позднякова Т.А., Бубенчиков Р.А. Количественное определение функциональных групп пектиновых веществ травы герани сибирской (Geranium sibiricum L.) // Фундамент. исслед. 2014. № 11. Ч. 1. С. 110–113.
Blumenkrantz N., Asboe-Hansen G. New method for quantitative determination of uronic acids // Anal. Biochem. 1973. V. 54. P. 484–489.
Correa-Ferreira M.L., Ferreira D.M., Dallazen J.L. et al. Gastroprotective effects and structural characterization of a pectic fraction isolated from Artemisia campestris subsp maritima // Int. J. Biol. Macromol. 2018. V. 107. P. 2395–2403.
De Godoi A.M., Faccin-Galhardi L.C., Rechenchoski D.Z. et al. Structural characterization and antiviral activity of pectin isolated from Inga spp // Int. J. Biol. Macromol. 2019. V. 139. P. 925–931.
Gawkowska D., Cybulska J., Zdunek A. Structure-related gelling of pectins and linking with other natural compounds: a review // Polymers. 2018. V. 10. № 7. P. 762. https://doi.org/10.3390/polym10070762
Khozhaenko E.V., Khotimchenko R.Y., Kovalev V.V. et al. Metal binding activity of pectin isolated from seagrass Zostera marina and its derivatives // Russ. J. Mar. Biol. 2015. V. 41. № 6. P. 485–489.
Khozhaenko E., Kovalev V., Podkorytova E., Khotimchenko M. Removal of the metal ions from aqueous solutions by nanoscaled low molecular pectin isolated from seagrass Phyllospadix iwatensis // Sci. Total Environ. 2016. V. 565. P. 913–921.
Koarai K., Kino Y., Takahashi A. et al. 90Sr in teeth of cattle abandoned in evacuation zone: Record of pollution from the Fukushima-Daiichi Nuclear Power Plant accident // Sci. Rep. 2016. V. 6. P. 24077. https://doi.org/10.1038/srep24077
Lara-Espinoza C., Carvajal-Millán E., Balandrán-Quintana R. et al. Pectin and pectin-based composite materials: beyond food texture // Molecules. 2018. V. 23. P. 942. https://doi.org/10.3390/molecules23040942
Minzanova S.T., Mironov V.F., Arkhipova D.M. et al. Biological activity and pharmacological application of pectic polysaccharides: a review // Polymers (Basel). 2018. V. 10. № 12. P. 1407. https://doi.org/10.3390/polym10121407
Mravec J., Kracun S.K., Rydahl M.G. et al. An oligogalacturonide-derived molecular probe demonstrates the dynamics of calcium-mediated pectin complexation in cell walls of tip-growing structures // Plant J. 2017. V. 91. P. 534–546.
Дополнительные материалы отсутствуют.