Биология моря, 2021, T. 47, № 6, стр. 389-399
Морфология и некоторые данные по анатомии пикногонид семейства Colossendeidae (Arthropoda: Chelicerata)
Н. В. Алексеева *
Зоологический институт РАН
199034 Санкт-Петербург, Россия
* E-mail: nina.alexeyeva.spb@gmail.com
Поступила в редакцию 16.10.2020
После доработки 23.04.2021
Принята к публикации 30.06.2021
Аннотация
Пикногониды – небольшая группа архаичных первичноводных хелицеровых. У пикногонид необычный план строения и ряд особенностей, отличающих их от остальных хелицерат. Известно около десяти современных семейств пикногонид и более тысячи видов, однако наше представление об этой группе складывается из сведений об организации нескольких десятков видов, что не охватывает имеющегося разнообразия. Такую малоизученную группу составляют виды семейства Colossendeidae. С помощью методов световой микроскопии изучена морфология Colossendeis drakei Calman, 1915, C. fragilis Pushkin, 1993, C. scotti Calman, 1915 и Decolopoda australis Eights, 1835; получены некоторые сведения об анатомии этих животных. Описано внешнее строение каждого вида, приведены данные о наличии и специфике расположения основных систем органов. Проанализирован план строения животного, отмечены консолидация туловища и отсутствие функциональных межсегментарных сочленений. Выявленные особенности значительно расширяют наше понимание плана строения пикногонид. Так, отмечена тенденция к увеличению площади поверхности средней кишки, выражающаяся в удлинении дивертикулов и/или формировании складок. Обнаружена гипертрофия периферической части гонады у самок, у которых половой дивертикул простирается почти на всю длину ходильной ноги. Впервые описано наличие половых дивертикул у самцов пикногонид.
Морские пауки представляют собой обособленную группу архаичных морских хелицеровых (Wheeler, Hayashi, 1998; Dunlop, Arango, 2005; Masta et al., 2010). Пикногониды во многом отличаются от остальных хелицерат, оставаясь неизменными на протяжении длительного периода (Bergström et al., 1980). Туловище пикногонид состоит из цефалосомы, трех-пяти свободных сегментов и несегментированного лишенного придатков абдомена (Vilpoux, Waloszek, 2003). Цефалосома формирует непарный вырост (хоботок) и несет придатки – хелифоры, пальпы и яйценосные ножки, а также пару ходильных ног. Остальные ходильные ноги располагаются на свободных сегментах тела. Пищеварительная и половая системы образуют слепые выросты (дивертикулы), проникающие в конечности (Fahrenbach, Arango, 2007; Soler-Membrives et al., 2011). Обобщенные данные об анатомии пикногонид приведены в нескольких работах (Helfer, Schlottke, 1935; King, 1973; Arnaud, Bamber, 1987). Однако опубликованные сведения касаются преимущественно мелких представителей семейств Nymphonidae Wilson, 1878, Callipallenidae Hilton, 1942 и Phoxichilidiidae Sars, 1891. Информация об организации этих пикногонид и формирует наше представление о всей группе животных. Однако многие виды, а порой и семейства пикногонид до сих пор недостаточно изучены. Это касается, например, пикногонид семейств Ascorhynchidea Hoek, 1881, Rhynchothoracidae Thompson, 1909, Pallenopsidae Fry, 1978, Endeidae Norman, 1908 и Colossendeidae. Последние особо сложны для морфоанатомических исследований, так как имеют крупные размеры (Hedgpeth, 1947) и обладают массивной кутикулой (Fahrenbach, 1994), что затрудняет применение микроскопических методик. Лишь в немногих работах опубликованы данные об анатомии колоссендеид, в частности, об организации кровеносной (Firstman, 1973) и пищеварительной (Cano-Sánchez, López-González, 2017; Wagner et al., 2017) систем. В настоящей работе приведены и проанализированы сведения о морфологии и некоторые данные об анатомии видов Colossendeis drakei Calman, 1915, C. fragilis Pushkin, 1993, C. scotti Calman, 1915 и Decolopoda australis Eights, 1835.
МАТЕРИАЛ И МЕТОДИКА
Для исследования использован материал из спиртовой коллекции Зоологического института РАН. Не имеющих видимых повреждений животных извлекали из фиксатора (70% этанол) и переводили в дистиллированную воду через серию спиртов понижающейся концентрации (50, 30 и 10%). Всех особей изучали однотипно, манипуляции (табл. 1) выполняли вручную с помощью лезвия, срезы просматривали в стереомикроскопе Leica M205 C. Толщину срезов оценивали с помощью окуляр-микрометра.
Таблица 1.
Ориентация и характеристика срезов, выполненных в разных частях тела морских пауков семейства Colossendeidae
| Ориентация | Туловище | Хоботок | Ходильные ноги | Яйценосные ножки |
|---|---|---|---|---|
| Сагиттальная | Срединный разрез | Срединный разрез | Срединный разрез в районе каждого сустава | – |
| Поперечная | Серия срезов толщиной 0.5–1.0 мм | Серия срезов толщиной 0.8–1.0 мм | По 3–4 среза толщиной 1–2 мм в средней части каждого членика | По 2–3 среза толщиной 1.0–1.2 мм в базальной и средней частях |
В ходе исследования использовали следующие материалы: 1) Colossendeis drakei Calman, 1915, дата сбора 23.03.1987 г., сбор “Эврика”, Южные Оркнейские острова (60°43′6″ S, 47°00′00″ W), глубина 280–310 м, собрал И.С. Смирнов, определил А.Ф. Пушкин; 2) C. fragilis Pushkin, 1993, дата сбора 13.12.1988 г., сбор БМРТ “Пионер Латвии”, Южная Георгия и Южные Сандвичевы острова (53°50′4″ S, 36°10′5″ W), 182–185 м, собрал И.П. Турнов, определил А.Ф. Пушкин; 3) C. scotti Calman, 1915, дата сбора 21.04.1981 г., сбор БМРТ “Академик Книпович”, Южная Георгия (55°08′4″ S, 34°39′5″ W), глубина 116–135 м, собрал И.П. Турнов, определил А.Ф. Пушкин; 4) Decolopoda australis Eights, 1835, дата сбора 10.12.1988 г., сбор БМРТ “Пионер Латвии”, Южная Георгия и Южные Сандвичевы острова (54°55′6″ S, 35°08′5″ W), 135 м, собрал И.П. Турнов, определил А.Ф. Пушкин.
РЕЗУЛЬТАТЫ
Внешняя морфология
У всех изученных колоссендеид пальпы состоят из 9 члеников, а яйценосные ножки из 10; у представителей рода Colossendeis четыре пары ходильных ног, у вида Decolopoda australis – пять. Основные морфометрические показатели для каждого вида приведены в табл. 2.
Таблица 2.
Морфометрические данные четырех видов морских пауков семейства Colossendeidae
| Параметр | Colossendeis fragilis | C. drakei | C. scotti | Decolopoda australis |
|---|---|---|---|---|
| Длина хоботка, мм | 22.2 | 20.1 | 29.9 | 13.2 |
| Длина шеи, мм | 1.3 | 1.7 | 2 | 1.5 |
| Длина цефалосомы, мм | 3.5 | 4.9 | 4 | 4.2 |
| Длина первого свободного сегмента, мм | 4.0 | 4.1 | 3.8 | 1.3 |
| Длина туловища, мм | 11.3 | 18.4 | 15.3 | 9.4 |
| Длина абдомена, мм | 1.7 | 4.9 | 3.9 | 4.0 |
| Ширина латерального выроста, мм | 1.8 | 3.5 | 3.5 | 2.1 |
| Расстояние между латеральными выростами, мм | 1.9 | 2.8 | 0 | 0 |
| Длина хелифоры, мм | − | − | − | 13.0 |
| Длина пальпы, мм | 31.2 | 29.0 | 38.8 | 16.2 |
| Длина яйценосной ножки, мм | 42.9 | 67.8 | 62.2 | 37.6 |
| Длина ходильной ноги, мм | 97.0 | 131.7 | 104.5 | 75.0 |
| Отношение длины хоботка к длине туловища | 1.97 | 1.09 | 1.95 | 1.40 |
| Отношение длины абдомена к длине туловища | 0.15 | 0.27 | 0.26 | 0.43 |
| Отношение длины ходильной ноги к длине туловища | 8.58 | 7.16 | 6.83 | 6.52 |
| Отношение длины ходильной ноги к длине туловища (включая длину хоботка) | 2.91 | 3.41 | 2.29 | 3.30 |
| Отношение длины ротовой полости к длине глотки | 4.24 | 1.32 | 2.38 | 0.80 |
| Отношение длины ротовой полости к длине пищевода | 12.00 | 2.75 | 12.67 | 2.92 |
| Отношение длины средней кишки к длине передней кишки | 1.94 | 1.15 | 2.92 | 1.75 |
| Отношение длины туловища к длине брюшной нервной цепочки | 3.18 | 2.36 | 2.14 | 1.79 |
Туловище Colossendeis fragilis вытянутое, внешне несегментированное, гладкое (рис. 1а, 1б). Цефалосома имеет прямой выступающий передний край. Глазной бугорок высокий, конической формы, смещен к хоботку. Латеральные выросты отделены друг от друга, расширяются к дистальному концу (рис. 1а, 1б). Абдомен цилиндрической формы, подвижно соединен с туловищем. Хелифоры отсутствуют, основания пальп и яйценосных ножек сближены (рис. 1б). Эти придатки включают по 9 (рис. 1в) и 10 (рис. 1г) члеников соответственно.
Рис. 1.
Внешний вид, пальпа и яйценосная ножка Colossendeis fragilis (а–г), C. drakei (д–з), C. scotii (и–м). Обозначения: abd – абдомен, cs – цефалосома, et – глазной бугорок, fs – свободные сегменты тела, lp – латеральный вырост, m – рот, ov – яйценосная ножка, pp – пальпа, prb – хоботок. Наконечник стрелки маркирует сегментарные границы.
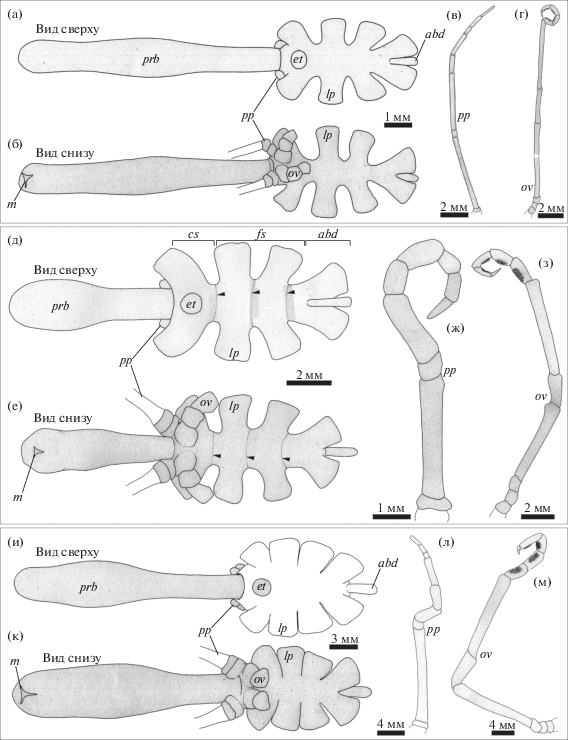
Туловище C. drakei вытянутое, со следами сегментации, гладкое (рис. 1д, е). Передний край цефалосомы вдавлен (рис. 1д). Глазной бугорок высокий, с округлой вершиной, смещен к хоботку. Латеральные выросты отделены друг от друга, расширяются к дистальному концу (рис. 1д, 1е). Абдомен удлиненный, цилиндрической формы (рис. 1д), подвижно соединен с туловищем. Хелифоры отсутствуют. Пальпы и яйценосные ножки располагаются на цефалосоме вентрально. Основания яйценосных ножек нависают над основаниями пальп (рис. 1е); сами конечности включают по 10 и 9 члеников соответственно (рис. 1ж–1з).
У C. scotii туловище гладкое, внешне несегментированное (рис. 1и, 1к). Передний край цефалосомы незначительно выступает, срединная часть вдавлена. Глазной бугорок высокий, конической формы, смещен от хоботка. Латеральные выросты соприкасаются друг с другом, расширяясь по направлению к придатку (рис. 1и, 1к). Абдомен удлинен, утолщается к дистальному концу, соединен с туловищем подвижно. Хелифоры отсутствуют. Основания пальп и яйценосных ножек сближены. Эти конечности состоят из девяти члеников (рис. 1л), а яйценосные ножки – из 10 (рис. 1м).
У Decolopoda australis дисковидное гладкое туловище. Следы сочленений в виде поперечных вдавлений сохраняются (рис. 2а, 2б). Хоботок и ходильные ноги покрыты небольшими коническими шипами. Передний край цефалосомы прямой (рис. 2а). Глазной бугорок невысокий и уплощенный, занимает срединное положение на цефалосоме. Латеральные выросты плотно прилегают друг к другу и расширяются к дистальному концу (рис. 2а, 2б). Абдомен вытянут и утолщен на свободном конце, подвижно соединен с туловищем. Хелифоры состоят из четырех члеников (рис. 2а, 2б). Клешня развита, пальцы гладкие, смыкаются дистальными концами. Основания пальп и яйценосных ножек сближены (рис. 2б). Пальпы состоят из девяти члеников (рис. 2в), яйценосные ножки – из 10 (рис. 2г).
Рис. 2.
Внешний вид (а–б), пальпа (в) и яйценосная ножка (г) Decolopoda australis. Обозначения: abd – абдомен, ch – хелифора, cs – цефалосома, et – глазной бугорок, fs – свободные сегменты тела, lp – латеральный вырост, m – рот, ov – яйценосная ножка, pp – пальпа, prb – хоботок. Наконечник стрелки маркирует сегментарные границы.

Пищеварительная система
Рот располагается на свободном конце подвижно соединенного с туловищем хоботка (рис. 1б, 1е, 1к; 2б) и окружен тремя гладкими губами. Он ведет в переднюю кишку, занимающую хоботок и часть цефалосомы (рис. 3). Этот отдел кишки выстлан кутикулой и включает ротовую полость, глотку и пищевод (относительные размеры отделов указаны в табл. 2). У C. fragilis ротовая полость гладкая, у остальных исследованных колоссендеид покровы формируют три продольных ряда складок (рис. 3б–3г). В глотке располагается цедильный аппарат – совокупность многочисленных кутикулярных шипов (рис. 3). Глотка сужается и переходит в пищевод. Его кутикула гладкая, без выростов.
Рис. 3.
Сагиттальный разрез через туловище Colossendeis fragilis (a), C. drakei (б), C. scotti (в) и Decolopoda аustralis (г). Обозначения: a – анус, b – надглоточный ганглий (мозг), bc – ротовая полость, cc – центральный канал средней кишки, ch – хелифора, dch – дивертикул хелифоры, dwl(4) – место отхождения дивертикулов средней кишки в ходильные ноги (4), e – глаза, es – пищевод, et – глазной бугорок, g – гонада, gwl – ганглии ходильных ног, hg – задняя кишка, lp – латеральный вырост, m – рот, ob – цедильный аппарат, ov – яйценосная ножка, pp – пальпа, sg – подглоточный ганглий. Наконечником стрелки отмечены продольные кутикулярные складки ротовой полости.

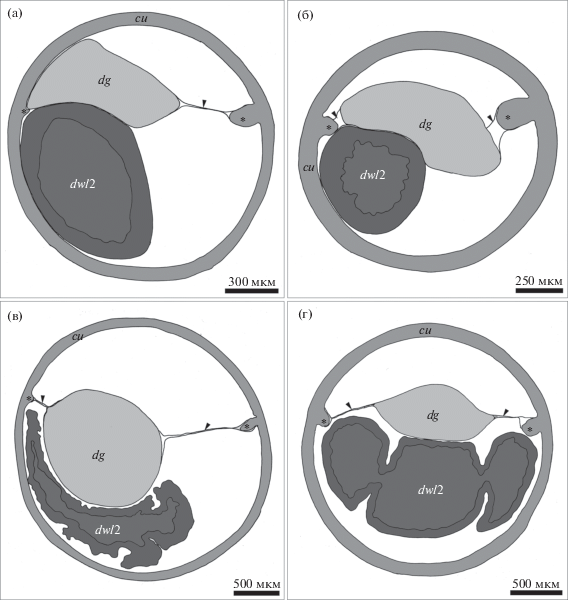
Средняя кишка включает центральный канал (рис. 4), который залегает срединно в туловище. От него берут начало слепые трубковидные выросты – дивертикулы. У всех пикногонид имеются дивертикулы ходильных ног: четыре пары у представителей рода Colossendeis и пять пар у D. australis. У последнего вида имеются дивертикулы хелифор (рис. 3г). У C. fragilis (рис. 3а) и C. scotti (рис. 3в) все выросты отходят попарно от центрального канала в пределах цефалосомы и первого свободного сегмента. У остальных изученных видов семейства дивертикулы отходят менее компактно (рис. 3б, 3г), в пределах всех сегментов, за исключением последнего. Дивертикулы C. fragilis и C. drakei гладкие (рис. 5а, 5б), у C. scotti они формируют многочисленные складочки (рис. 5в), а у D. australis – карманы (рис. 5г). Задняя кишка выстлана кутикулой. Она залегает в абдомене (рис. 3) и заканчивается анусом.
Рис. 4.
Организация полости тела на примере самки Decolopoda australis, схема поперечного среза через туловище. Обозначения: cc – центральный канал средней кишки, cu – кутикула, dg – половой дивертикул, dwl(2–3) – дивертикулы вторых и третьих ходильных ног, g – туловищная часть гонады, gwl3 – ганглий третьих ходильных ног, h – просвет сердца, hw – стенка сердца, per – перикард, vs – вертикальная септа. Двойная стрелка маркирует положение горизонтальной септы, в толще которой залегает гонада. Уровень среза показан пунктирной линией.

Рис. 5.
Срезы (схема) через середину бедренного членика ходильной ноги самок Colossendeis fragilis (а), C. drakei (б), C. scotti (в) и Decolopoda australis (г). Обозначения: cu – кутикула, dg – половая дивертикула, dwl2 – дивертикул второй ходильной ноги. Наконечник стрелки маркирует горизонтальную септу, звездочка – кутикулярный валик.
Полость тела представляет собой гемоцель и разделена на отдельные зоны. Над кишкой располагается трубковидное сердце (рис. 4), занимающее зону свободных сегментов тела. Дорсально просвет сердца ограничен стенкой тела, вентрально – центральным каналом средней кишки, а латерально – собственно стенками сердца (рис. 4). По бокам от него располагается перикардиальная полость, ограниченная снизу горизонтальной септой (рис. 4). Латеральные стенки сердца и горизонтальная септа уплощены. Вертикальная септа представлена отдельными диффузно расположенными клеточными тяжами, которые соединяют ганглии брюшной нервной цепочки со стенкой тела (рис. 4). Горизонтальная септа также продолжается во все придатки и тянется от дивертикула гонады до стенки тела. В месте соединения септы со стенкой тела формируется продольный валик (рис. 5).
Нервная система представлена мозгом и брюшной нервной цепочкой (БНЦ). Мозг залегает под глазным бугорком (рис. 3). Дорсолатерально от него отходят парные окологлоточные коннективы. У Colossendeis БНЦ располагается в пределах цефалосомы и первого свободного сегмента тела и включает 5 ганглиев (рис. 3а–3в). У D. australis БНЦ состоит из 6 ганглиев и располагается в цефалосоме, занимая первые три свободных сегмента тела (рис. 3г). Во всех случаях первый ганглий подглоточный, а все последующие – ганглии ходильных ног.
Половая система самцов и самок (рис. 6) состоит из туловищной и периферической частей. Туловищная часть имеет U-образную форму и располагается над центральным каналом средней кишки по бокам от сердца (рис. 4). У самок половой дивертикул простирается на всю длину ходильной ноги (рис. 6б, 6г) и только у C. fragilis оканчивается в предпоследнем членике (рис. 6а). У самцов D. australis и C. drakei периферическая часть представлена лишь протоками (рис. 6б, 6г). У самцов C. scotti и C. fragilis формируются половые дивертикулы, занимающие весь третий коксальный членик (рис. 6а, в). У обоих полов половые дивертикулы располагаются над дивертикулом кишки (рис. 4–5). Гонопоры и у самок, и у самцов открываются на втором коксальном членике каждой ходильной ноги (рис. 6).
Рис. 6.
Схемы организации женской (темно-серый цвет) и мужской (светло-серый) половой системы Colossendeis fragilis (а), C. drakei (б), C. scotti (в) и Decolopoda australis (г). Обозначения: dg – половой дивертикул, tp – туловищная часть гонады. Наконечник стрелки маркирует гонопоры. Ходильные ноги изображены не в масштабе.

ОБСУЖДЕНИЕ
1. Анализ внешнего вида пикногонид семейства Colossendeidae
Показано, что туловище колоссендеид внешне либо не сегментировано, либо со слабыми следами сегментации. В последнем случае без затруднения прослеживается тот же тип тагмозиса, что и у сегментированных форм пикногонид (Vilpoux, Waloszek, 2003). Туловище включает цефалосому, зону свободных сегментов тела и абдомен. Цефалосома у исследованных видов относительно короткая (табл. 2), у представителей рода Colossendeis на ней находятся хорошо развитые членистые и очень компактно расположенные пальпы, а также яйценосные ножки и первая пара ходильных ног; хелифоры отсутствуют.
Для большинства пикногонид характерны трехчлениковые хелифоры. У некоторых видов количество члеников вторично может уменьшаться до двух или одного, а иногда хелифоры и вовсе редуцируются (Arnaud, Bamber, 1987). Известно, что редукция хелифор происходит в онтогенезе (Пушкин, 1993; Vilpoux, Waloszek, 2003; Alexeeva, Tamberg, 2021). У Decolopoda australis хелифоры четырехчлениковые, что очень редко встречается у современных пикногонид и наблюдается только в семействах Pallenopsidae (Bamber, 1985) и Colossendeidae (Calman, Gordon, 1933), значительно удаленных друг от друга (Arango, Wheeler, 2007). Существует три возможных механизма формирования четырехчлениковой хелифоры.
Во-первых, выделение дополнительного членика из уже имеющихся элементов хелифоры, базального или среднего члеников. Подобное явление описано у пикногонид, но для других придатков: пальп, яйценосных ножек (Alexeeva et al., 2018) и ходильных ног (Okuda, 1940; Vilpoux, Waloszek, 2003; Alexeeva et al., 2018). В ходе развития внутри одного членика в толще новой кутикулы закладывается новая сочленовная граница, которая становится функциональной после очередной линьки.
Во-вторых, формирование членика из латерального выроста туловища. У вымерших форм Palaeopantopus maucheri и Palaeoisopus problematicus отмечена избыточная членистость проксимального участка ноги. Высказано предположение, что это дополнительные коксальные членики ходильных ног, отсутствующие у современных форм (Bergström et al., 1980).
В-третьих, сохранение исходной полимерной конечности. Известно, что у вымерших морских пауков хелифоры могли включать пять члеников, как у Palaeoisopus problematicus (см.: Bergström et al., 1980), или четыре членика, как у Haliestes dasos (см.: Siveter et al., 2004) и Pentapantopus vogteli (см.: Kühl et al., 2013). Первые два механизма подразумевают, что базовым является трехчлениковое строение, а четырехчлениковая хелифора вторична. В третьем механизме подобное строение хелифоры принимается как анцестральное.
Зона свободных сегментов тела морфологически выражена только у D. australis и C. drakei, она включает соответственно 4 и 3 сегмента. Пикногонида D. australis относится к вторично видоизмененным полимерным формам (Arango, Wheeler, 2007; Arabi et al., 2010). Подобные морские пауки встречаются также в семействах Pycnogonidae и Nymphonidae и сформировались независимо (Hedgpeth, 1947; Arabi et al., 2010). У подавляющего большинства современных (Arnaud, Bamber, 1987) и вымерших (Bergström et al., 1980; Siveter et al., 2004; Poschmann, Dunlop, 2006; Rudkin et al., 2013) пикногонид 3 свободных сегмента и только у Pentapantopus vogteli, филогенетическое положение которого спорно, их 4 (Kühl et al., 2013). По-видимому, это доказывает лабильность плана строения пикногонид, а не примитивность данного вида. Подобное явление характерно и для современной фауны пикногонид.
2.1. Организация пищеварительной системы
Особенности вооружения рта и организации передней кишки напрямую связаны со спецификой питания (Fahrenbach, Arango, 2007; Soler-Membrives et al., 2011, 2013; Wagner et al., 2017). Ротовое отверстие питающейся гидроидными полипами нимфониды Nymphon brevirostre снабжено кутикулярной бахромой (Alexeeva et al., 2018), которая располагается на внутреннем крае губ и позволяет повреждать тонкий эпителий добычи. У личинок и молоди Pycnogonum litorale края губ срастаются, формируя ротовую трубку, которая способна нарушить целостность жесткой гидроризы полипа Clava multicornis (Vilpoux, Waloszek, 2003; Alexeeva, Tamberg, 2021). У исследованных колоссендеид губы гладкие, поэтому можно предположить, что пищей для них служат животные, лишенные жестких покровов (см.: Wicksten, 2017).
Длина передней кишки значительно варьирует у разных групп пикногонид (Wagner et al., 2017). У колоссендеид она превышает длину центрального канала (табл. 2). Ротовая полость служит насосом, нагнетающим пищу в переднюю кишку. При этом D. australis отличается относительно длинной ротовой полостью. Вероятно, это связано с тем, что питается данный морской паук более грубой пищей, требующей лучшей фильтрации и более тщательного измельчения.
Средняя кишка состоит из центрального канала и системы выростов. Дивертикулы значительно увеличивают площадь средней кишки (ПСК), участвуют в распределении веществ и располагаются в хелифорах и ходильных ногах (Arnaud, Bamber, 1987). Предполагаемых причин увеличения ПСК несколько. Во-первых, отсутствие транспортной системы, что может быть связано с редукцией сердца и/или самой полости тела (Alexeeva, Tamberg, 2021). Во-вторых, несоразмерное увеличение размеров тела – пропорционально или в результате формирования дополнительных сегментов. При этом площадь кишки уже не может обеспечивать имеющийся объем (Schmidt-Nielsen, 1984). Вероятно, у колоссендеид данная причина является основной.
Механизмов, позволяющих достичь большей ПСК, также может быть несколько. Во-первых, это увеличение количества дивертикулов, которое может происходить как за счет формирования новых выростов (например, дивертикулы хоботка и личиночных ног), так и посредством бифуркации уже имеющихся (Fry, 1965; Arnaud, Bamber, 1987; Alexeeva, Tamberg, 2021). Второй возможный механизм – удлинение дивертикулов вследствие их более кучного отхождения (Helfer, Schlottke, 1935; King 1973; Arnaud, Bamber, 1988). И, наконец, формирование складок и карманов также приводит к увеличению ПСК. Последние два варианта обнаружены нами у исследованных колоссендеид.
2.2. Организация половой системы
Базовый план строения половой системы пикногонид описан для обоих полов и в целом единообразен (Arnaud, Bamber, 1987). Туловищная часть, расположенная над центральным каналом средней кишки, у большинства пикногонид, в том числе и у колоссендеид, имеет U-образную форму. Описана также пластинчатая форма (Alexeeva, Tamberg, 2021), кроме этого известны примеры резорбции данной области гонады у самок (Miyazaki, Makioka, 2010).
От туловищной части отходят выводные протоки, которые оканчиваются гонопорами на втором коксальном членике всех или некоторых ходильных ног. У самок пикногонид протоки формируют слепые выросты – половые дивертикулы, в которых происходит созревание яиц. Однако организация этой части половой системы у колоссендеид значительно отличается от имеющихся у нас представлений. У всех исследованных самок половые дивертикулы (вителлярии) гипертрофированы и располагаются вдоль дивертикулов средней кишки, простираясь на всю длину ходильной ноги. У небольших пикногонид дивертикул располагается только в феморальном членике (Arnaud, Bamber, 1987). Очевидно, что большие размеры колоссендеид наряду с гипертрофированными вителляриями позволяют значительно увеличить количество формирующихся яиц. Неудивительно, что у самцов колоссендеид, хотя и не у всех, мы также обнаружили формирование половых дивертикулов, ранее не описанных у других пикногонид.
Список литературы
Пушкин А.Ф. Фауна многоколенчатых (Pycnogonida) Южного океана // Исслед. фауны морей. XX (XXX). Результаты биологических исследований советских антарктических экспедиций. 1993. Т. 8. 397 с.
Alexeeva N., Tamberg Y. Anatomical changes in postembryonic development of Pycnogonum litorale // J. Morphol. 2021. V. 282. № 3. P. 329–354.
Alexeeva N., Tamberg Y., Shunatova N. Postembryonic development of pycnogonids: a deeper look inside // Arthropod Struct. Dev. 2018. V. 47. № 3. P. 299–317.
Arabi J., Cruaud C., Couloux A., Hassanin A. Studying sources of incongruence in arthropod molecular phylogenies: sea spiders (Pycnogonida) as a case study // C. R. Biol. 2010. V. 333. № 5. P. 438–453.
Arango C.P., Wheeler W.C. Phylogeny of the sea spiders (Arthropoda, Pycnogonida) based on direct optimization of six loci and morphology // Cladistics. 2007. V. 23. № 3. P. 255–293.
Arnaud F., Bamber R.N. The biology of Pycnogonida // Adv. Mar. Biol. 1987. V. 24. P. 1–96.
Bamber R.N. A second Pallenopsis mollissima (Hoek), with other deep water pycnogonids from the Glasgow Museum // Zool. J. Linn. Soc. 1985. V. 83. № 4. P. 301–306.
Bergström J., Stürmer W., Winter G. Palaeoisopus, Palaeopantopus and Palaeothea, pycnogonid arthropods from the lower Devonian Hunsrück slate, West Germany // Paläontol. Z. 1980. V. 54. № 1. P. 7–54.
Calman W.T., Gordon I. A dodecapodous pycnogonid // Proc. R. Soc. London. Ser. B. 1933. V. 113. № 781. P. 107–115.
Cano-Sánchez E., López-González P.J. Basal articulation of the palps and ovigers in Antarctic Colossendeis (Pycnogonida; Colossendeidae) // Helgol. Mar. Res. 2017. V. 70. № 1. P. 1–8.
Dunlop J.A., Arango C.P. Pycnogonid affinities: a review // J. Zool. Syst. Evol. Res. 2005. V. 43. № 1. P. 8–21.
Fahrenbach W.H. Microscopic anatomy of Pycnogonida: I. Cuticle, epidermis, and muscle // J. Morphol. 1994. V. 222. № 1. P. 33–48.
Fahrenbach W.H., Arango C.P. Microscopic anatomy of Pycnogonida: II. Digestive system. III. Excretory system // J. Morphol. 2007. V. 268. № 11. P. 917–935.
Firstman B. The relationship of the chelicerate arterial system to the evolution of the endosternite // J. Arachnol. 1973. P. 1–54.
Fry W.G. The feeding mechanisms and preferred foods of three species of Pycnogonida // Bull. Br. Mus. (Nat. Hist.). Zool. 1965. V. 12. P. 195–223.
Hedgpeth J.W. The Pycnogonida of the western North Atlantic and the Caribbean // Proc. U.S. Natl. Mus. 1947. V. 97. P. 157–342.
Helfer H., Schlottke E. Pantopoda // Bronns Klassen und Ordnungen des Tier-Reichs. 1935. Bd. 5, Abt. IV, Buch 2.
King P.E. Pycnogonids. London: Hutchinson. 1973. 140 p.
Kühl G., Poschmann M., Rust J. A ten-legged sea spider (Arthropoda: Pycnogonida) from the lower Devonian Hunsrück slate (Germany) // Geol. Mag. 2013. V. 150. № 3. P. 556–564.
Masta S.E., McCall A., Longhorn S.J. Rare genomic changes and mitochondrial sequences provide independent support for congruent relationships among the sea spiders (Arthropoda, Pycnogonida) // Mol. Phylogenet. Evol. 2010. V. 57. № 1. P. 59–70.
Miyazaki K., Makioka T. Structure of the adult female reproductive system in the sea spider, Propallene longiceps (Pycnogonida, Callipallenidae) and its functional and evolutionary significance // Invertebr. Reprod. Devel. 2010. V. 54. № 1. P. 35–39.
Okuda S. Metamorphosis of a Pycnogonid parasitic in a Hydromedusa (with 10 text-figures) //J. Fac. Sci. Hokkaido Imp. Univ. Zool. 1940. V. 7. № 2. P. 73–86.
Poschmann M., Dunlop J.A. A new sea spider (Arthropoda: Pycnogonida) with a flagelliform telson from the Lower Devonian Hunsrück Slate, Germany // Palaeontology. 2006. V. 49. № 5. P. 983–989.
Rudkin D.M., Cuggy M.B., Young G.A., Thompson D.P. An Ordovician pycnogonid (sea spider) with serially subdivided ‘headʼ region // J. Paleontol. 2013. V. 87. № 3. P. 395–405.
Soler-Membrives A., Rossi S., Munilla T. Feeding ecology of Ammothella longipes (Arthropoda: Pycnogonida) in the Mediterranean Sea: a fatty acid biomarker approach // Estuarine. Coastal. Shelf Sci. 2011. V. 92. № 4. P. 588–597.
Soler-Membrives A., Arango C.P., Cuadrado M., Munilla T. Feeding biology of carnivore and detritivore Mediterranean pycnogonids // J. Mar. Biol. Assoc. U.K. 2013. V. 93. № 3. P. 635–643.
Schmidt-Nielsen K. Scaling. Why is animal size so important? Cambridge: Cambridge Univ. Press. 1984. 241 p.
Siveter D.J., Sutton M.D., Briggs D.E., Siveter D.J. A Silurian sea spider // Nature. 2004. V. 431. № 7011. P. 978–980.
Vilpoux K., Waloszek D. Larval development and morphogenesis of the sea spider Pycnogonum litorale (Ström, 1762) and the tagmosis of the body of Pantopoda // Arthropod Struct. Dev. 2003. V. 32. № 4. P. 349–383.
Wagner P., Dömel J.S., Hofmann M. et al. Comparative study of bisected proboscides of Pycnogonida // Org. Diversity Evol. 2017. V. 17. № 1. P. 121–135.
Wheeler W.C., Hayashi C.Y. The phylogeny of the extant chelicerate orders // Cladistics. 1998. V. 14. № 2. P. 173–192.
Wicksten M.K. Feeding on cnidarians by giant pycnogonids (Pycnogonida: Colossendeidae Jarzinsky, 1870) in the north Central Pacific and North Atlantic oceans // J. Crustacean Biol. 2017. V. 37. № 3. P. 359–360.
Дополнительные материалы отсутствуют.


